Method Article
Imagerie en temps réel des jonctions endothéliales cellule-cellule Pendant neutrophiles Transmigration Sous physiologique débit
Dans cet article
Résumé
Les leucocytes traversent la monocouche endothéliale utilisant le paracellulaire ou la voie transcellulaire. Nous avons développé un test simple de suivre la distribution de jonction endogène VE-cadhérine et PECAM-1 au cours de la migration leucocytaire transendotheliale sous flux physiologique à une discrimination entre les deux voies de transmigration.
Résumé
Au cours de l'inflammation, les leucocytes quittent la circulation et traversent l'endothélium pour lutter contre les pathogènes envahisseurs dans les tissus sous-jacents. Ce processus est connu comme la migration des leucocytes transendotheliale. Deux voies de leucocytes à traverser la monocouche endothéliale ont été décrites: la voie paracellulaire, c'est-à travers les jonctions cellule-cellule et la voie transcellulaire, c'est à dire, à travers le corps de la cellule endothéliale. Cependant, il est techniquement difficile de discriminer entre le paragraphe et la voie transcellulaire. Nous avons développé un test in vitro simple pour étudier la distribution de la VE-cadhérine endogène et PECAM-1 au cours de la migration des neutrophiles transendotheliale dans des conditions d'écoulement physiologiques. Avant de neutrophiles perfusion, les cellules endothéliales ont été brièvement traités avec des anticorps marqués par fluorescence contre VE-cadhérine et PECAM-1. Ces anticorps ne gênent pas la fonction des deux protéines, comme cela a été déterminé par la cellule-électrique SUBSTRAte impédance de détection et PAF mesures. L'utilisation de ce test, nous avons pu suivre la répartition des endogène VE-cadhérine et PECAM-1 lors de la migration trans-endothéliale dans des conditions de débit et de discrimination entre les paramètres et de migration transcellulaire routes des leucocytes à travers l'endothélium.
Introduction
La migration des leucocytes transendothéliale efficace et étroitement contrôlé (TEM) est d'une importance capitale dans les processus physiologiques tels que la surveillance immunitaire et de l'inflammation aiguë. Toutefois, dans certaines conditions physiopathologiques, TEM incontrôlée et excessive est observée traduit dans les maladies inflammatoires chroniques (par exemple, la polyarthrite rhumatoïde, l'athérosclérose, l'asthme). Egalement au cours de la métastase des cellules tumorales, le processus de migration trans-endothéliale est instrumental pour les cellules tumorales quittent la circulation à métastaser 1-3. Dans le but d'interférer spécifiquement avec leucocytes excessive ou TEM des cellules tumorales, une compréhension détaillée de la régulation de ce processus est nécessaire.
On pense que le processus de TEM se produit à travers différentes étapes. Études séminales, revu il ya deux décennies par Butcher et Springer, ont conduit au modèle en plusieurs étapes décrivant le processus de TEM 4,5. Ce modèle est toujours valable, même si certains annonceétapes conditionnelles ont été inclus 6. Alon et al. Décrit la nécessité de la présence de chimiokines immobilisés sur la surface de l'endothélium 7. Récemment, ils ont montré que l'endothélium génère lui-même chimiokines qui sont présentés à la surface apicale endothéliale 8. En outre, le même groupe a mis en avant l'importance des conditions d'écoulement pendant TEM 7. Récemment, plusieurs publications ont porté sur les deux itinéraires différents leucocytes peuvent prendre à l'étape finale de la diapédèse de TEM. Ils peuvent soit aller à travers les jonctions cellule-cellule, c'est à dire, la voie de migration paracellulaire, ou traverser le corps de la cellule endothéliale, connue sous le nom migration voie transcellulaire 9. Carman et ses collègues ont étudié ces voies dans le détail et a conclu que les leucocytes choisissent préférentiellement la voie de migration paracellulaire (90%) sur la voie transcellulaire (10%) lors de la traversée d'une veine ombilicale endothéliale monocouche 10.Cependant, lorsque les cellules endotheliales provenant d'autres origines ont été utilisés, par exemple, le cerveau ou le système microvasculaire, les plus utilisés leucocytes voie transcellulaire (30%) 11. Le groupe Vestweber récemment montré que, lorsque les jonctions cellule-cellule étaient incapables de dissocier l'une de l'autre à l'aide d'une réaction en chaîne dans un modèle animal, en remplaçant endogène VE-cadhérine de VE-cadhérine, alpha-caténine chimère, leucocytes TEM a été complètement bloqué 12 . De manière surprenante, les auteurs ont remarqué que TEM a été bloqué en plusieurs, mais pas tous, les tissus. Dans l'ensemble, ces expériences élégantes ont indiqué que les leucocytes ont préféré la voie paracellulaire sur la voie transcellulaire, bien que les signaux de régulation qui déclenchent cette décision sont encore inconnues.
Même si la majorité des leucocytes préfèrent la voie de migration paracellulaire, il est encore difficile de distinguer entre les deux voies. En outre, en dépit de nombreuses études portant sur le rôle de la cellule Junct-cellule endothélialeions, la dynamique de ces jonctions, en particulier les protéines de jonction VE-cadhérine et PECAM-1, au cours de leucocytes passage est encore en débat. Nous avons développé un test relativement simple dans lequel les molécules de jonction peuvent être surveillés en temps réel pendant la diapédèse des leucocytes dans des conditions d'écoulement physiologiques en utilisant des anticorps marqués par fluorescence. Ces anticorps n'ont pas interféré avec ou bloquent l'intégrité de jonction ou de la mobilité des protéines ciblées. Ce test nous permet de suivre la dynamique des protéines de jonction au cours du processus de paracellulaire TEM. En outre, ce test permet aussi la discrimination entre les voies de migration paramètres et transcellulaires.
Protocole
Les neutrophiles ont été isolés chez des volontaires sains qui ont signé un consentement éclairé. La recherche a été effectuée en conformité avec les directives nationales et institutionnelles, pour le bien-être humain.
1. placage et l'entretien des cellules ombilicales humaines endothéliales de veine
- La culture de cellules endothéliales de veine ombilicale humaine (HUVEC) selon les instructions du fabricant. Cultivez HUVECs sur la fibronectine (FN) doté d'un revêtement plats (10 pg / ml, dissous dans l'eau déminéralisée) par des moyens (endothéliale Basal Medium (EBM-2) supplémenté avec de croissance endothélial moyen (EGM-2) SingleQuots). Utilisez culture cellulaire entre 4-8 passages pour les expériences.
- Jour 1: Coat-débit chambres avec 100 pi de la fibronectine (10 pg / ml dans PBS) pendant au moins 2 heures à 37 ° C et 5% de CO 2.
- Jour 2: Lorsque les cellules atteignent 80-90% de confluence, les cellules trypsiniser après un lavage soigneux avec RT tampon phosphate salin (PBS) pH 7,4, centrifuger à 800 xg et remettre en suspension à 800 000 cellules / ml en utilisant les médias. Plate 80.000 cellules dans chaque canal unique des flux-chambres FN-enduits et doucement pipeter la suspension de cellules de haut en bas. Culture O / N dans un incubateur à 37 ° C et 5% de CO 2.
- Jour 3: Actualiser les médias dans la diapositive débit chambre d'incliner lentement la lame à un angle de 45 °. (Voir la figure 1A).
NOTE: Il est recommandé de ne supprimer que les médias dans les réservoirs et pas dans le canal lui-même. Retrait des médias dans les canaux peut entraîner la perte de cellules endothéliales et de décès dus à la force d'entraînement des médias provoquée par pipetage. - Vérifiez par microscopie à contraste de phase si les cellules endothéliales ont formé une monocouche (soit 100% de confluence). Si les cellules ne sont pas 100% de confluence, changer les médias deux fois par jour jusqu'à ce qu'ils atteignent 100% de confluence.
- Une fois que les cellules ont atteint la confluence, stimuler les cellules avec des milieux (voir l'étape1.1) contenant du médiateur inflammatoire (TNF-α (10 ng / ml)). La stimulation des cellules HUVEC O / N (c'est-à-12 h) avec les résultats de TNF-α dans un phénotype inflammatoire de l'endothélium, ie., La régulation positive de molécules d'adhésion cellulaire telles que ICAM-1 et VCAM-1 13.
2. leucocytes polynucléaires isolement en utilisant des gradients de Percoll
- Préparer N-2 hydroxyéthylpiperazine-N'-2-éthanesulfonique (HEPES) -buffer (ci-après dénommé: flux tampon) avant d'isoler les leucocytes polynucléaires (PMN). Flow-tampon est utilisé pour laver les PMN isolées et en tant que tampon dans le dosage de l'écoulement. Pour préparer le tampon d'écoulement: diluer 7,72 g NaCl (132 mM), 4,76 g d'HEPES (20 mM), 0,45 g de KCl (6 mM), 0,25 g de MgSO 4 • 7H 2 O (1 mM), K 2 HPO 4 • 3H 2 O (1,2 mM) dans 1 litre d'eau déminéralisée et d'ajuster le pH à 7,4 (ce stock peut être conservé à 4 ° C pendant plusieurs semaines).
- Ajouter frais 100 pi 1 M CaCl 2 & #160; (1 mM), 2,5 ml d'albumine humaine à partir d'une concentration de 200 g / L de bouillon (0,5% v / v) et 0,1 g de glucose pour 100 ml (0,1% p / v) de tampon d'écoulement. Ensuite, filtrage du flux-tampon en utilisant un filtre de 0,45 um. NOTE: Ce tampon de flux doit être préparé frais pour chaque expérience.
- Avant d'isolement des PMN, préparer 10% de citrate trisodique (CNC) dans une solution PBS, pH 7,4.
- Recueillir 20 ml de sang total dans vacuettes de l'héparine de sodium à partir d'un volontaire sain. Diluer le sang total à 1: 1 avec 10% de PBS / TNC en tubes de 50 ml et 20 de pipette ml dilués sang avec précaution sur 12,5 ml de Percoll (23% (w / w) de solution colloïdale dans l'eau avec une densité de 1,130 g / ml) dans un nouveau tube de 50 ml. Placez délicatement les tubes dans la centrifugeuse et tourner pendant 20 min à 800 xg avec une faible accélération et pas de pause fixé à RT.
REMARQUE: Lors de l'ajout du sang dilué au Percoll, incliner le tube Percoll contenant dans un angle de 45 ° et une pipette doucement le sang dilué dans l'esprit du tubeh la vitesse la plus lente pipette de garçon. - Retirer tout le liquide et remplir ensuite le tube à la lyse des érythrocytes-tampon glacé (4,15 g NH 4 Cl [0,155 M], 0,5 g de KHCO3 [0,01 M] et 18,5 mg d'EDTA (triplex III) [0,1 mm] à 500 ml glacé de H 2 O) pour lyser les érythrocytes. Laisser le tube sur de la glace, de temps en temps renversant le tube, jusqu'à ce que la suspension vire au rouge foncé, suivie d'une centrifugation à 500 g pendant 5 min à 4 ° C avec des pauses activées.
REMARQUE: La fraction de culot contient les PMN (neutrophiles, éosinophiles, basophiles) avec des érythrocytes. - Retirer le surnageant et laver culot deux fois dans la lyse-tampon glacée à 500 g pendant 5 min à 4 ° C.
- Reprendre le culot avec flow-tampon à la température ambiante et déterminer la concentration PMN l'aide d'un hématimètre ou compteur de cellules automatisé. Suspendre les PMN du débit-tampon à 1 x 10 6 cellules / ml et conserver à la température ambiante.
3. étiquetage des endothéliale Junctional VE-cadhérine et PECAM-1
- Ajouter le PECAM Alexa Fluor 647 anticorps (clone WM59) à une dilution 1: 100 et l'anticorps VE-cadhérine-FITC calcium-indépendante (clone 55-7H1) à un milieu de culture à la dilution 1:50 HUVEC (voir étape 1.1), et incuber pendant 30 min avant de commencer l'expérience de flux de visualiser la dynamique de jonction des cellules endotheliales au cours de la transmigration des neutrophiles dans des conditions d'écoulement physiologiques.
REMARQUE: Avant d'ajouter les anticorps directement marqués à l'écoulement-chambres, veiller à ce que le volume de chaque canal ne dépasse pas 100 pi. Cela permet de garder les frais d'anticorps aussi bas que possible.
4. PMN TEM test sous flux
- Placer les PMN dans un bain-marie pendant 15 min à 37 ° C avant de les injecter dans le système d'écoulement.
- Connectez le tuyau à un débit chambre vide et remplir avec chaud (par exemple, 37 ° C) Flux-tampon (voir l'étape 4.3) pour éviter la formation de bulles d'air lors de la mise en place eSystème de flux de courrier.
- Se connecter un côté d'une chambre d'écoulement à vide du système de débit de la pompe de la seringue à l'aide de tubes en silicone contenant une seringue de 20 ml, et de mettre la chambre d'écoulement dans la platine du microscope.
- Branchez l'autre extrémité d'un flux chambre vide dans le ballon réservoir rempli de 37 ° C Débit-tampon (figure 1B) et démarrer la pompe de la seringue afin de combler tous les tubes avec flow-tampon. La pompe va tirer le tampon d'écoulement à partir du réservoir à travers la chambre d'écoulement dans la seringue. NOTE: Ce tube comprend également un port d'injection Luer en ligne, qui permet aux PMN à injecter avec une aiguille dans une expérience en cours d'exécution sans arrêter la circulation et la création de bulles d'air.
- Remplacer le flux chambre vide avec le flux compartiments contenant le TNF-α HUVEC traitées, raccorder le tuyau d'écoulement tampon contenant et le placer dans la platine du microscope (figure 1C). Pincez les tubes avant de débrancher et de rebrancher lem dans les chambres contenant les cellules HUVEC, comme pincement peut pas conduire à la formation de bulles d'air à l'intérieur de la tubulure et / ou débit-chambres.
- Réglez la vitesse d'écoulement de 1 dyn / cm 2, en fonction de la vitesse d'écoulement physiologique dans les veinules post-capillaires (1-5 dyn / cm 2).
- Fiche contraste interférentiel différentiel (DIC), FITC (488 nm) et l'Alexa Fluor 647 (647 nm) en utilisant simultanément un microscope confocal à balayage laser microscope.
- Injecter les PMN (étape 4.1) lentement dans le système d'écoulement via le in-line orifice d'injection Luer (figure 1D) en utilisant seringues de 1 ml.
- Après quelques minutes, les leucocytes apparaissent, adhèrent, et transmigrer. Arrêter l'expérience à tout moment désiré en débranchant le tube de l'écoulement chambre et pipetage fixateur (formaldéhyde 3,7% dans PBS) dans le flux chambre. Laisser fixation pendant 10 minutes, suivie d'un lavage avec du PBS. Les données sont analysées en utilisant un logiciel d'imagerie (voir tableau des matériaux et de l'équipement).
REMARQUE: Effectuer la il expérience utilisant un microscope confocal à balayage laser équipé d'une chambre climatique à une température constante à 37 ° C, 5% CO 2, et un objectif 63X d'huile.
Résultats
Nous avons d'abord testé si les anticorps n'ont pas interféré avec la fonction de barrière de l'endothélium. Nous avons mesuré la résistance des monocouches endothéliales en utilisant électrique cellule-substrat impédance de détection (ECIS). Pour plus de détails, voir Van Buul et al. Aucune 13 modification de la résistance a été observé lorsque l'anticorps anti-VE-cadhérine marqué par fluorescence a été ajouté aux cellules (figure 2A). Un anticorps anti-VE-cadhérine qui est bien reconnu pour bloquer la VE-cadhérine fonction réduit considérablement la résistance (Figure 2A). En outre, les anticorps utilisés pour l'imagerie ne pas modifier la dynamique de VE-cadhérine, comme cela a été évalué par mesure de la récupération de fluorescence après photo-blanchiment (FRAP) de la VE-cadhérine-GFP (figure 2B).
Après 1-2 min, les neutrophiles ont adhéré à la monocouche endothéliale pouvant être activé comme visualisé dans le canal DIC (figure 3A). Après l'exploration de soi 5-30c, la grande majorité des neutrophiles transmigré à travers la monocouche endothéliale travers les jonctions cellule-cellule qui ont été marquées avec les anticorps dirigés contre le PECAM-1 et VE-cadhérine. Au cours du processus de diapédèse, la distribution de la VE-cadhérine et PECAM-1 a été suivi en temps réel (figure 3B). Sur les sites de diapédèse des neutrophiles, la VE-cadhérine a été perturbé localement et PECAM-1 a montré une structure plus en forme d'anneau. Après l'achèvement de la diapédèse, les jonctions étroites et VE-cadhérine et PECAM-1 clairement déplacés sur les sites de la diapédèse (Figure 3C). Notez que les parties de l'anticorps anti-PECAM-1 ont été détectés sur la surface de la neutrophiles polynucléaires neutrophiles a atteint une fois que le côté baso-latéral de l'endothélium. Toutefois, cela n'a pas empêché les neutrophiles de traverser l'endothélium. Les dynamiques observées de VE-cadhérine en temps réel lors de la migration des neutrophiles transendotheliale étaient en accord avec les travaux de Shaw et ses collègues quiont montré, en utilisant la microscopie confocale et VE-cadhérine-GFP-transfecté les cellules endothéliales, que la VE-cadhérine-GFP diffuse latéralement lorsque les leucocytes ont traversé les jonctions cellule-cellule endotheliales 14. Travailler aussi par Su et ses collègues ont souligné nos observations de PECAM-1. Ils ont montré que la diffusion, à côté latéral VE-cadhérine au passage des leucocytes, PECAM-1 a été redistribué localement dans un anneau autour de la transmigration des neutrophiles à 15.

Figure 1: Dans la chambre d'écoulement vitro. (A) La flèche indique le réservoir à partir duquel le support a besoin d'être rafraîchi. (B) un tube de silicone qui relie la chambre d'écoulement avec la ligne dans l'orifice d'injection pour l'injection Luer PMN sans déconnecter le tube (tête de flèche). (C) Connection d'un écoulement de chambre de vide dans le ballon réservoir rempli de 37 ° C d'écoulement tampon (tête de flèche). (D) de la connexion d'écoulement avec la chambre de TNF-α HUVEC traitées à la tubulure d'écoulement contenant un tampon et placé dans la platine du microscope (tête de flèche).
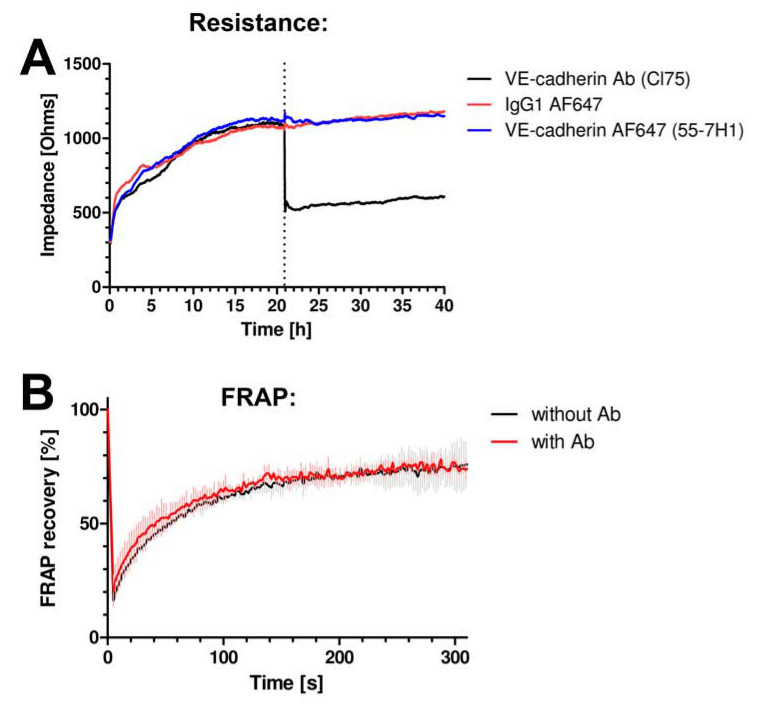
Figure 2: VE-cadhérine anticorps n'interfèrent pas avec la dynamique ou de la fonction de jonction. (A) impédance monocouche de cellules endothéliales est mesurée à l'aide de l'ECIS. Y-axe exprime impédance en ohms et l'axe des x représente le temps en heures. VE-cadhérine anticorps clone 55-7H1, marqué avec ALEXA647 (ligne bleue) ou isotype IgG témoin-ALEXA647 (ligne rouge) ne modifient pas endothéliale impédance monocouche cellulaire, alors que le VE-cadhérine blocage CL75 anticorps (ligne noire) ne réduire l'impédance . (B ) VE-cadhérine-GFP a été exprimée dans des cellules HUVEC et l'analyse de FRAP utilisant la microscopie confocale a révélé aucun changement dans la récupération de la fluorescence en présence ou en l'absence de la VE-cadhérine 55-7H1 anticorps.
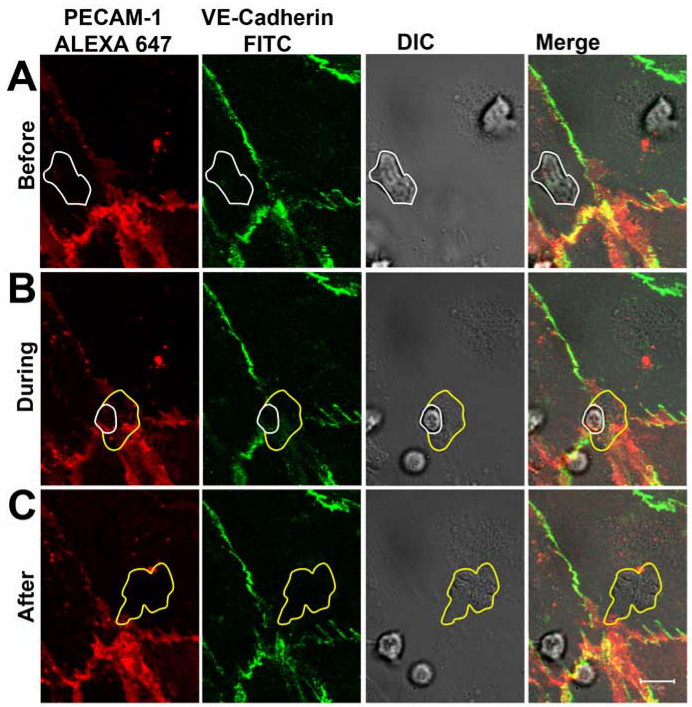
Figure 3 VE-cadhérine et PECAM-1 au cours de la distribution des neutrophiles TEM en temps réel. (A) des neutrophiles (marquée avec la ligne blanche) faire adhérer sur l'endothélium et traversant la jonction cellule-cellule sans affecter la distribution de la VE-cadhérine et PECAM -1. (B) des neutrophiles traversant la monocouche endothéliale à travers les jonctions cellule-cellule. Une dispersion locale de la VE-cadhérine et PECAM-1 peuvent être observées lorsqu'un neutrophiles saillie à travers les jonctions cellule-cellule. La ligne blanche illustre présence de neutrophiles encore au-dessus de l'endothélium. Ligne jaune montre tha membrane des neutrophilest est déjà sous endothélium. (C) des neutrophiles a entièrement franchi la monocouche endothéliale. VE-cadhérine et PECAM-1 sont déplacés sur les sites de diapédèse. Ligne jaune illustre frontières de l'neutrophiles transmigré. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
Pour ce protocole, il est essentiel d'éviter la formation de bulles d'air dans le débit-chambres, car cela se traduira par l'apoptose des cellules et une monocouche perturbé. Pour éviter cela, nous tenons à souligner à payer un intérêt particulier pour les étapes 4.2 et 4.5, où les tubes sont reliés à l'écoulement chambre. Une autre étape importante dans le protocole est le amorçage des PMN qui sont conservés à la température ambiante en les incubant pendant 15 à 30 min à 37 ° C avant de les injecter à l'écoulement de chambre (étape 4.1). Cela se traduit par l'amorçage des intégrines leucocytaires, en leur permettant d'adhérer à des molécules d'adhésion telles que ICAM-1, VCAM-1 ou à l'endothélium.
Ce protocole n'est pas limitée à étudier la transmigration des neutrophiles. Mais aussi d'autres types de leucocytes tels que les monocytes ou les lymphocytes peuvent être utilisés. Notez que l'étape 4.1, c'est à dire, l'amorçage des leucocytes peuvent différer entre les différents types de leucocytes. En outre, d'autres types de cellules endotheliales peuvent être utilisés. Pour cela, il reste critiquepour stimuler les cellules endotheliales à des stimuli inflammatoires appropriés, tels que le TNF-α ou IL-1β. Si les neutrophiles ne répondent pas de transmigration, on peut envisager de traiter les neutrophiles brièvement (5 min) avec de la N-formyl-L-méthionyl-L-leucyl-L-phénylalanine (fMLP) peptide 16. Cela stimulera les neutrophiles, en particulier leurs intégrines, encore plus loin, ce qui les rend plus enclins à adhérer à l'endothélium.
Typiquement / cm 2 vitesses d'écoulement 1 dyn est utilisé. Cette vitesse d'écoulement est mesurée dans les veinules post-capillaires, les sites où la plupart des migrations leucocytes transendotheliale se produit 17. En utilisant les débits-chambres décrites, il est possible d'augmenter la vitesse de circulation de 10 dyn / cm 2. Cependant, il n'est pas recommandé d'augmenter le cisaillement plus loin. Elle peut entraîner une fuite non désirée du tube et le détachement des cellules de la chambre d'écoulement.
Les résultats décrits dans la figure 3 indiquent que ceux-cianticorps peuvent être utilisés pour visualiser et étudier la dynamique des jonctions endothéliales cellule-cellule pendant la diapédèse des leucocytes. En particulier, en plus des dosages de transmigration existants ce protocole permet de discriminer de migration transcellulaire paracellulaire dans des conditions d'écoulement physiologiques en temps réel. Comme les anticorps se colorent les jonctions cellule-cellule, on peut marquer le nombre de leucocytes qui traversent la VE-cadhérine / jonctions PECAM-1-positifs par rapport non positive VE-cadhérine / PECAM-1 sites. De cette façon, la migration transcellulaire peut être discriminé de la migration paracellulaire.
Il est important de souligner que ces anticorps ne gênent pas la fonction des protéines, ils se lient à l'anticorps: PECAM-1 utilisé dans cette étude est dirigé contre le domaine extracellulaire secondes. Les cellules endotheliales qui ont été étalées en présence de l'anticorps n'ont pas montré de défauts dans la diffusion ou la formation d'une monocouche, ce qui suggère que l'anticorps n'a pas au moinsinterférer avec les interactions entre les cellules endothéliales homotypiques. en plus de cela, les deux anticorps ne nuisent pas à la capacité des neutrophiles à migrer à travers la monocouche endothéliale. En outre, le nombre de neutrophiles qui transmigrent à travers la monocouche endothéliale, en l'absence ou en présence de l'anticorps n'est pas modifié (données non présentées). Fait important, la microscopie confocale à balayage laser nous donne la possibilité d'enregistrer différents canaux de fluorescence et DIC simultanément.
Ainsi, ce test permet d'étudier la dynamique de la VE-cadhérine et PECAM-1 en même temps quand un neutrophiles traverse la jonction cellule-cellule endothéliale et aidera à comprendre pourquoi les leucocytes choisissent une voie sur l'autre, c'est-à-paracellulaire contre transcellulaire.
Déclarations de divulgation
The authors have no competing financial interests.
Remerciements
The authors thank Dr. P.L. Hordijk for critically reading the manuscript. AED is supported by a Landsteiner Foundation for Blood Transfusion Research (LSBR) fellowship (grant #1028). JK is supported by the Dutch Heart Foundation (2005T3901). JDvB is a NHS Dekker fellow (grant #2005T039).
matériels
| Name | Company | Catalog Number | Comments | |
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description | |
| μ-Slide VI | IBIDI | 80606 | Flow-chamber | |
| 0.45 μm filter | Whatman/GE Lifesciences | 10462100 | ||
| 1 mL syringe | BD Plastipak | 300013 | ||
| 20 mL syringe | BD Discardit II | 366296 | ||
| 21G needle | BD Microlance | 301155 | ||
| Albumin | Sanquin | 15522644 | ||
| Ammunium chloride (NH4Cl) | Merck | 1009245000 | ||
| Calcium chloride (CaCl2) | Sigma-Aldrich | 449709 | ||
| EBM-2 Basal medium + EGM-2 SingleQuot Kit Suppl. & Growth Factors | Lonza | CC-3156 + CC-4176 | media | |
| EDTA (Titriplex III) | Merck | 1370041000 | ||
| Falcon tubes | Corning Life Sciences | 352096 | ||
| Fibronectin | Sigma-Aldrich | F1141-2MG | FN | |
| Glucose | Sigma-Aldrich | G7528 | ||
| HEPES | Sigma-Aldrich | H3375 | ||
| In-line Luer Injection port | IBIDI | 10820 | ||
| Magnesium sulfate heptahydrate (MgSO4.7H2O) | Merck | 105886 | ||
| PECAM-1-ALEXA-647 | BD Pharmingen | 561654 | clone WM59 stock concentration 0.1mg/mL | |
| Percoll | GE Healthcare Life Sciences | 17-0891-09 | ||
| Phosphate Buffered Saline | Fresenius Kabi Nederland | M090001/01NL | PBS | |
| Potassium chloride (KCl) | Sigma-Aldrich | P9541 | ||
| Potassium hydrogen carbonate (KHCO3) | Merck | 1048540500 | ||
| Potassium phosphate dibasic trihydrate (K2HPO4) | Sigma-Aldrich | P5504 | ||
| Silicone Tygon 3350 tubing | VWR | 228-4331 | tubing | |
| Sodium chloride (NaCl) | Calbiochem (Millipore) | 567441 | ||
| Syringe pump | Harvard Apparatus | model number 55-5920 | ||
| TNFα | Peprotech | 300-01A | tumor necrosis factor | |
| trisodium citrate | Merck | 1.06447.5000 | TNC | |
| Vacuettes | Greiner, Germany | 980044 | ||
| VE-Cadherin-FITC | BD Pharmingen | 560411 | clone 55-7H1 | stock concentration 0.5mg/mL |
| Zeiss LSM510 META | Carl Zeiss MicroImaging, Jena, Germany | |||
| Zen Software 2008 | Carl Zeiss MicroImaging, Jena, Germany |
Références
- Ross, R. Atherosclerosis--an inflammatory disease. N. Engl. J. Med. 340, 115-126 (1999).
- Luster, A. D., Alon, R., von Andrian, U. H. Immune cell migration in inflammation: present and future therapeutic targets. Nat. Immunol. 6, 1182-1190 (2005).
- Szekanecz, Z., Koch, A. E. Vascular involvement in rheumatic diseases: ' vascular rheumatology. Arthritis Res. Ther. 10, 224 (2008).
- Butcher, E. C. Leukocyte-endothelial cell recognition: three (or more) steps to specificity and diversity. Cell. 67, 1033-1036 (1991).
- Springer, T. A. Traffic signals for lymphocyte recirculation and leukocyte emigration: the multistep paradigm. Cell. 76, 301-314 (1994).
- Ley, K., Laudanna, C., Cybulsky, M. I., Nourshargh, S. Getting to the site of inflammation: the leukocyte adhesion cascade updated. Nat. Rev. Immunol. 7, 678-689 (2007).
- Cinamon, G., Shinder, V., Shamri, R., Alon, R. Chemoattractant signals and beta 2 integrin occupancy at apical endothelial contacts combine with shear stress signals to promote transendothelial neutrophil migration. J. Immunol. 173, 7282-7291 (2004).
- Shulman, Z., Cohen, S. J., Roediger, B., et al. Transendothelial migration of lymphocytes mediated by intraendothelial vesicle stores rather than by extracellular chemokine depots. Nat. Immunol. 13, 67-76 (2012).
- Carman, C. V., Springer, T. A. Trans-cellular migration: cell-cell contacts get intimate. Curr. Opin. Cell Biol. 20, 533-540 (2008).
- Carman, C. V., Springer, T. A. A transmigratory cup in leukocyte diapedesis both through individual vascular endothelial cells and between them. J. Cell Biol. 167, 377-388 (2004).
- Millan, J., Hewlett, L., Glyn, M., et al. Lymphocyte transcellular migration occurs through recruitment of endothelial ICAM-1 to caveola- and F-actin-rich domains. Nat. Cell Biol. 8, 113-123 (2006).
- Schulte, D., Kuppers, V., Dartsch, N., et al. Stabilizing the VE-cadherin-catenin complex blocks leukocyte extravasation and vascular permeability. EMBO J. 30, 4157-4170 (2011).
- Buul, J. D., Mul, F. P., van der Schoot, C. E., Hordijk, P. L. ICAM-3 activation modulates cell-cell contacts of human bone marrow endothelial cells. J. Vasc. Res. 41, 28-37 (2004).
- Shaw, S. K., Bamba, P. S., Perkins, B. N., Luscinskas, F. W. Real-time imaging of vascular endothelial-cadherin during leukocyte transmigration across endothelium. J. Immunol. 167, 2323-2330 (2001).
- Su, W. H., Chen, H., Jen, C. J. Differential movements of VE-cadherin and PECAM-1 during transmigration of polymorphonuclear leukocytes through human umbilical vein endothelium. Blood. 100, 3597-3603 (2002).
- Paulsson, J. M., Jacobson, S. H., Lundahl, J. Neutrophil activation during transmigration in vivo and in vitro: A translational study using the skin chamber model. J. Immunol. Methods. 361, 82-88 (2010).
- Williams, M. R., Azcutia, V., Newton, G., Alcaide, P., Luscinskas, F. W. Emerging mechanisms of neutrophil recruitment across endothelium. Trends Immunol. 32, 461-469 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon