A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
דגם תא האנדותל מישורי הדמיה החיסוני סינפסה Dynamics
In This Article
Summary
Adaptive immunity is controlled by dynamic 'immunological synapses' formed between T cells and antigen presenting cells. This protocol describes methods for investigating endothelial cells both as understudied physiologic APCs and as a novel type of 'planar cellular APC model'.
Abstract
חסינות מסתגלת מוסדרת על ידי אינטראקציות דינמיות בין תאי T ותאי הצגת אנטיגן ('נגמ"שים') המכונה "סינפסות החיסונית". בתוך ממשקי תאי תאים האינטימיים אלה אשכולות בדידים משנה הסלולר של MHC / Ag-TCR, F- אקטין, הדבקה ויוצרים מולקולות איתות ולשפץ במהירות. דינמיקה אלה נחשבות לגורמים קריטיים של שתי היעילות והאיכות של התגובות חיסוני המתפתחות ולכן של מגן לעומת חסינות פתולוגיים. הבנה נוכחית של סינפסות החיסונית עם נגמ"שים פיסיולוגיים היא מוגבלת על ידי חוסר ההתאמה של הרזולוציה ההדמיה השגה. למרות שמודלים מלאכותיים מצע (למשל, bilayers שומנים מישוריים) מציעים רזולוציה מעולה והיו כלים יקרים מאוד, הם מטבעם אינו פיסיולוגיים ופשטניים. תאי האנדותל של כלי דם והלימפה צמחו כתא רקמה היקפית חשובה (או סטרומה) של 'חצי מקצועאל נגמ"שים ". נגמ"שים אלה (המבטאים ביותר של המכונות מולקולריות של נגמ"שים מקצועיים) יש התכונה הייחודית של יצירת תא שטח כמעט מישורי והם בקלות transfectable (למשל, עם כתבי חלבון פלואורסצנטי). במסמך גישה בסיסית ליישום תאי האנדותל כרומן ו'מודל APC הסלולרי מישוריים 'פיסיולוגי להדמיה וחקירה של תהליכי איתות אנטיגני הבסיסיים משופרות תתואר.
Introduction
לימפוציטים מסוג T הוא סניף של המערכת החיסונית אדפטיבית המאופיינת ביכולת לזהות ביעילות אנטיגן פפטיד (Ag) חייבת מורכב histocompatibility גדול (MHC) מולקולות באמצעות קולטנים של תאי T (TCRs) 1. לימפוציטים נאיביים constitutively להעביר ולסרוק תאים מקצועיים Ag הצגה '(נגמ"שים; למשל, תאים דנדריטים) בתוך בלוטות הלימפה, בעוד תאי הזיכרון / T מפעיל צריכים לסקור מגוון רחב מאוד של נגמ"שים ותאי יעד פוטנציאליים בתוך רקמות היקפי ביעילות.
בדקות הבאות הכרה ראשונית של Ag מקור על APC, ימפוציטים לעצור הגירתם ומתחיל להיווצר ממשק תאי תאים אינטימי מיוחד "סינפסה החיסונית 'כינתה (IS). ספג (כלומר, 30-60 דקות) היא קשר נדרש להגביר ולקיים איתות 2-7. מחקרים המתעוררים לזהות שבתוך הוא, זה הוא ההיווצרות רציפה ומהיר remodeling של מיקרו-אשכולות בדידים איתות תת-תאי (כלומר, מכילים MHC / Ag-TCR, F- אקטין, הדבקה ומולקולות איתות) הקובעים את החוזק והאיכות של תגובות חיסוני וכתוצאה מכך 2-7. עם זאת, פרטים דינמיים ומנגנון רגולציה של תהליך זה באופן חלקי הבינו 8,9. זה נובע במידה רבה מאתגרים טכניים הקשורים בטופולוגיות סדירות של משטחי APC ונטייה גרועים מבוקרת של מטוסי האינטראקציה תאי תאים, נושאים שעמוקים להגביל את ההדמיה spatiotemporal הנדרשת גישות 8-10 (Figure1A).
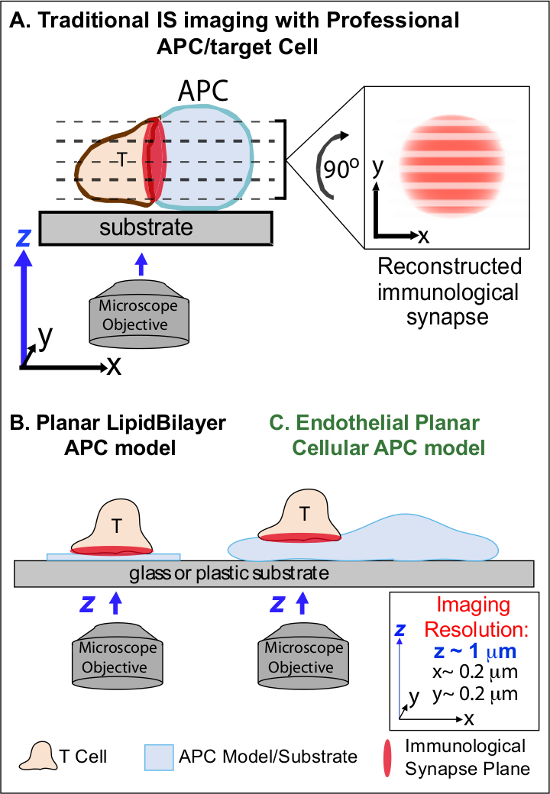
איור 1. דגם APC התא פיסיולוגי מישורי הדמיה החיסוני סינפסה Dynamics. סכמטי ממחיש הדמיה מסורתית של סינפסה החיסונית בין תאי T וprofessio תא סופי APC () ו- T ומודל מסורתי שומנים מישוריים APC bilayer (ב ') בהשוואה למודל זה רומן אנדותל APC מישוריים (C). נגמ"שים מקצועיים לספק סינפסות החיסונית פיזיולוגית אבל מציעים ממשק מונחה גרוע תא-תא (כלומר, ביחס למישור ההדמיה XY האופטימלי; רזולוציה ~ 0.2 מיקרומטר), אשר באופן דרמטי פוגע מרחבית (רזולוציה ~ מיקרומטר מטוס ההדמיה z 1) ובזמן (כלומר, בשל הצורך לסרוק שוב ושוב בכל מטוסי ההדמיה z) רזולוציה של הדמיה. יש דגמי bilayer טופולוגיה מישוריים המספקת רזולוציה ההדמיה spatiotemporal אופטימלית, אבל גם פשוטים ביותר, שאינם פיסיולוגי ונוקשה. מודל תא האנדותל זה משלב את הטופולוגיה מישוריים של bilayers שומנים עם המצע הפיזיולוגי של APC קלאסי כדי לספק רזולוציה הדמיה מרחב ובזמן אופטימלית בסביבה פיזיולוגית.מ '/ קבצים / ftp_upload / 53,288 53288fig1large.jpg "target =" / _ blank "> לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
העבודה קודמת עקפה באופן חלקי על המכשולים הללו על ידי פיתוח מודלים מצע מישוריים (כלומר, bilayers שומנים ומשטחים מצופים נוגדנים) המספקים רזולוציה spatiotemporal אופטימלית (כלומר, באמצעות תיקון משטח הפעלת תא T לתכנית אחת שמקבילה להדמית XY האופטימלית מטוס) 11-15 (1B איור). מודלים אלה הקלו תובנות חשובות דינמיקת subcellular / מולקולרית השולטות איתות אנטיגני בתאי T, כוללים גילוי אקטין דינמי / TCR מיקרו-אשכולות איתות 7,11-14. עם זאת, מודלים כאלה מטבעם פשטניים, כמו גם נוקשה (מניעת הפיתוח / המחקר של תכונות טופולוגי 3 ממדים) (איור 1). לכן, זה עדיין לא ברור איך להתייחס כגון ממצאים לPHYתאי תאים siologic מעקב חיסוני.
למרות שעדיין understudied, כלי דם ותאי האנדותל הלימפה הם מתעוררים כגדולים (כלומר, גדולים יותר במספרים מכל נגמ"שים המקצועיים, על ידי ~ 1000-פי) תא היקפי של נגמ"שים "חצי מקצועי" 16-18. תאים אלה מבטאים MHC-אני-, MHC-II- ושפע של מולקולות שיתוף ממריץ (למשל, CD40, LFA3, ICOSL, 4-1BB, OX40L, TL1A, PD-L1, אבל לא CD80 וCD86) ואסטרטגיים ממוקם בממשק שבין דם לרקמה שבו הם משרתים פונקציות זקיף מיוחדות 16-18. מחקרים קודמים הראו שתאי האנדותל יכולים למעשה מחדש לעורר מפעיל / זיכרון, אבל לא נאיבי, תאי T 19-25. כך, תאי האנדותל עשויים לשחק תפקידי APC ייחודיים בשלב מפעיל של תגובות חיסוניים אדפטיבית בתוך הרקמות ההיקפית, כגון השפעה מקומית על הפעלת תא T, בידול, זיכרון וסובלנות 16,17,26. CRItically, כאשר גדלו במבחנה, תאי האנדותל יוצרים משטחי תא כמעט מישורי והם בקלות transfectable (למשל, עם כתבי חלבון פלואורסצנטי). תכונות אלה הן אידיאליים עבור הדמיה גבוהה spatiotemporal רזולוציה של דינמיקה טופולוגית במהלך אינטראקציות תא-תא 19,27. כך תאי האנדותל עשויים לשמש כמודל 'מישוריים סלולארי APC' פיסיולוגי מובהק מתאים ללימוד מנגנוני שיפוץ subcellular / מולקולריים המניעה את הכרת אנטיגן ולווסת תגובות (איור 1 ג) 19,20.
בעבר הוקם טכניקות הדמיה משלימות (כולל transfection של תאי endothelia עם מקבלי חלבון פלואורסצנטי של קרום הפלזמה וcytosol) ללומד את הפרטים של אינטראקציה ליקוציט-האנדותל בהידבקות וההגירה Transendothelial 27, הראה כי לויקוציטים באופן פעיל לחקור את פני השטח של האנדותל ידי דינמי הכנסהההכחשה ד של תת-מיקרון בקנה מידה, בליטות גליליות אקטין עשיר (~ 200-1,000 ננומטר בקוטר ועומק) כינו בליטות כמו invadosome (כלומר, 'ILPs') 27,28. הדמיה גישות אלה הורחבו עוד יותר יחד עם יצירת הפרוטוקולים לנצל פונקצית APC אנדותל לפתח השיטות הראשונות להדמיה גבוהה spatiotemporal רזולוציה של סינפסה החיסונית תא אנדותל T כ19,20 דיווח ועוד לתאר זאת. ממצא מרכזי הנגזר ממודל APC סלולארי זה מישוריים רומן הוא שILPs תא T לתפקד גם בקידום זיהוי Ag ראשוני ובשמירת איתות שלאחר מכן. ואכן, מערכים של ILPs מרובה (שהתייצבו ונצבר בתגובה הראשונית שטף סידן) להעשרת תכנית בTCR ומולקולות רמיזות של PKC-Q איתות פעילה כגון, ZAP-70, phosphotyrosine וHS1. לכן, ILPs נראה לייצג מקביל פיסיולוגי תלת-ממדית למייקרו-TCR האיתותאשכולות ראו בדגמי bilayer מישוריים. גישה זו, ובכך, ברגישות מגלה / דינמיקה מולקולרית ואדריכלית (ומשתמע ביו-מכאנית) דיווחים לא אחרת לזיהוי.
השיטה המתוארת במסמך זה צריכה להיות שימושי לגישור על הפער בין APC המקצועי ודגמי מצע APC מלאכותיים כדי לשפר את היכולת שלנו לחקור את המנגנונים בסיסיים של תגובות חיסוניים אדפטיבית. ואילו כאן הדגש הוא על ההפעלה של מפעיל CD4 + סוג Th1 / תא זיכרון, גישה בסיסית זו ניתן לשנות בקלות ללמוד מגוון רחב של סוגי תאי T וAGS, כמפורט להלן.
Protocol
כל הניסויים שתוארו בפרוטוקול זה מתבצעים עם תאים ראשוניים אדם T ותאים זמינים מסחרי עיקריים אנושיים אנדותל פרוטוקול מחקר .Any (ECs עורי או כלי דם ריאה) מעורב בבני אדם חייב להיות מאושר על ידי דירקטוריון סקירה מוסדי ונכתב הסכמה מדעת חייבת להינתן מ כל תורם דם. ניסויים שנערכו תוך שימוש בפרוטוקול זה אושרו על ידי IRB של מרכז דיקונס ישראל בית רפואי.
1. תאי CD4 + האדם Th1 מפעיל / הזיכרון T הכנה
- החל חוסם עורקים לזרועו של תורם, לנגב וריד עם אלכוהול, והכנס את מחט. לאט לאט למשוך 15 מיליליטר של דם לתוך Vacutainer באמצעות EDTA כנוגד קרישה. כאשר הדם כבר נמשך, להתיר את חוסם עורקים לפני הסרת המחט. מייד להפעיל לחץ על פצע עם גזה סטרילית כאשר המחט מוסרת.
- העבר את הדם לצינור 50 מיליליטר. להוסיף RPMI-1640 ב RT בדילול 1: 1 (נפח סופי 30 מיליליטר). כיסוי לדלל בזהירותדם ד על שני צינורות 50 מיליליטר המכילים 15 מיליליטר של מסונן מראש לימפוציטים בינוניים בידוד כגון Ficoll-Paque ב RT.
- צנטריפוגה השיפוע ב RT למשך 30 דקות ב 1200 XG בהרוטור דלי מתנדנד. בעוד צנטריפוגה להכין מדיום סלולארי T (500 מיליליטר של RPMI-1640, 50 FCS מיליליטר, 5 מיליליטר פניצילין / סטרפטומיצין).
- לאחר ההסרה של צינור 50 מיליליטר מצנטריפוגות, להתבונן ארבע שכבות: גלולה של תאי דם אדומים בתחתית, Paque, שכבת תאים המכילה תאי דם לבנים (לימפוציטים כוללים) ופלזמה. מוציא בזהירות את שכבת תאי דם הלבנה עם פיפטה פסטר והעברה בצינור פלקון 50 מיליליטר.
- שטוף את שכבת תאי דם הלבנה על ידי הוספת RT RPMI-1460 (עד 20 מיליליטר) וצנטריפוגה ב RT במשך 5 דקות ב1,200 x גרם. Resuspend תאי הדם הלבנים ב 1 מיליליטר של מדיום סלולארי T. הוסף 5 μl של ההשעיה תא 1 מיליליטר למדיום סלולארי T 250 μl בצינור 1.5 מיליליטר צנטריפוגות ומערבבים בעדינות מעלה ומטה על ידי פיפטה.
- הוסף 25 μl לדללהשעיה תא ד 25 μl 0.4% Trypan כחולים. הוסף 10 μl של תערובת לכל צד של hemocytometer סטנדרטי.
- הנח hemocytometer על מיקרוסקופ כוח אור נמוך. באמצעות מטרת 10X לספור את מספר תאי חיים שנכללו הצבע הכחול Trypan ונמצאים בכיכר אמצע שני הצדדים של hemocytometer.
- כדי לחשב את ריכוז התאים, להכפיל את הממוצע של 2 ריבועים על ידי 100 (גורם לדילול) ולאחר מכן להכפיל ב -10 4 לתת את מספר תאים / מיליליטר.
- התאם את הריכוז הסופי 0.5 x 10 6 תאים / מיליליטר במדיום סלולארי T. הוסף ריכוז סופי של 1 מיקרוגרם / מיליליטר כל אחד מסופר-אנטיגנים חיידקים enterotoxin B staphylococcal (SEB) ורעלן תסמונת הלם רעיל 1 (TSST) לתאים. תרבות במשך 72 שעות (37 מעלות צלזיוס, 5% CO 2) כדי להרחיב את האוכלוסייה של תאי CD4 +.
- תאים גלולה T (1200 XG, 5 דק ') וגלול ברמה של 0.5 x 10 6 תאים / מיליליטר במדיום סלולארי T עםתוספת של IL-15 (מיליליטר / 20 ng) אנושי. העברה לימפוציטים לבקבוק T150. ימשיך להרחיב / תאי פיצול במדיום-IL-15 מלאים בכל שעות 24-48 במידת הצורך (המבוסס על צבע תקשורת; כלומר, בכל פעם שהתקשורת הופכת מורודה לצהוב מעט) לאחר מכן. לשמור על אוכלוסיית הלימפוציטים וכתוצאה מכך לתקופה של עד 15 ימים.
הערה: על ידי עיצוב, פרוטוקול זה יהיה להפעיל ולהרחיב באופן ספציפי תת קבוצה של תאי CD4 + T שהם תגובה לSEB וTSST ולאחר מכן להסיע אותם לכיוון פנוטיפ מפעיל / זיכרון כמו-Th1. תאי דם לבנים אחרים להיכשל כדי לשרוד ולגדול בתנאים אלה, כך שצעד 1.10 התאים יהיו לפחות 95% מסוג CD4 +, CD45RO + T תאי 19, באותה קלות יכולה להיות מוערך על ידי cytometry זרימה. אם תרצה, יכולה בקלות להיות מושגת טיהור נוספת באמצעות ערכות בחירת נוגדן זמין מסחרי / מגנטי-חרוז מבוססות חיוביות או שליליות.
2. החל תרבית תאי האנדותל האדם יסודי
- מעיל בקבוק T25 עם פיברונקטין (FN) 20 מיקרוגרם / מיליליטר PBS בתנאים סטריליים. השאר על RT במשך 30-60 דקות. הסר FN ולהוסיף 5 מיליליטר בינוני שלם (בינוני האנדותל בסל בינוני (EBM-2) בתוספת האנדותל צמיחה בינונית (EGM-2) singlequots). טרום דגירה ב -37 תרבית תאי חממת מעלות צלזיוס במשך לפחות 30 דקות.
- להפשיר בקבוקון של תאי כלי דם ריאה או עור אנושי קפוא אנדותל (HLMVECs או HDMVECs) באמבט מים 37 מעלות צלזיוס עם תסיסה עדינה מדי פעם ל~ 2-3 דקות. מייד להעביר תאים לבקבוק T25 המכיל תקשורת מחוממת מראש. מערבולת בעדינות ומניחים בחממה על 37 מעלות צלזיוס.
- לשנות את התקשורת אחרי שעה ~ 4-6. תמשיך להשתנות תקשורת בערך כל 48 שעות (או כאשר התקשורת הופכת מעט צהובה) עד הצלחת מגיעה ~ confluency 90-95%.
3. פיצול והרחבת תאי האנדותל כללי
- לגדל תאים ל~ confluency 90-95. פעולה זו עשויה להימשך 2-5 ימים. עבור פיצול,להסיר תקשורת ולשטוף עם PBS. הסר PBS ולהחליף עם נפח מינימאלי של טריפסין 1x הטרי (0.5 מיליליטר לT25 או 1.5 מיליליטר לT75). מערבולת בעדינות כדי לכסות את כל פני השטח עם טריפסין. לדגור על 37 ° C ל~ 5 דקות. צג הניתוק של התאים מהצלחת באמצעות מיקרוסקופ כוח אור נמוך.
- כאשר רוב התאים נראים מעוגל או מנותק, להוסיף 5 נפח (כלומר, בהשוואה לטריפסין הוסיף הנפח) של EGM-2 בינוניים מלאים מראש חימם בעדינות פיפטה על פני השטח של הבקבוק כדי לנתק את כל התאים.
- ספירת תאי אנדותל עם hemocytometer כפי שתואר ב1.6-1.7. גלולה התאים על ידי צנטריפוגה (5 דקות, 1,200 XG). הסר את supernatant. התאם ריכוז 0.5 מיליון תאים למ"ל על ידי תוספת של מדיה מלאה מראש חימם EGM-2 MV.
- העבר את aliquots של תאים לכלים או צלוחיות מצופים-FN המתאימים לתחזוקה. מערבולת בעדינות ומניח בחממה. לשנות את התקשורת בתוך 6-12 שעות של ציפוי. sho מדיהuld לשנות בערך כל שעה 48 ואילך.
4. Transfection תא האנדותל
הערה: תאי האנדותל ראשי הם עקשן לtransfection על ידי רוב השיטות הכימיות וelectroporation משותפים. השיטה מבוססת transfection הגרעיני המתוארת להלן מאפשרת יעילות גבוהה יחסית transfection (~ 50-70%). שיטה חלופית יעילה היא שימוש בזיהום על ידי וקטורים ויראליים מתאימים (ראה הערות בלוח חומרים).
- הכן צלוחיות T25 או T75 (לפי צורך) של HLMVECs או HDMVECs לצפיפות סופית של confluency.Coat 90-95% עם פיברונקטין (FN) 20ug / מיליליטר PBS בתנאים סטריליים או צלחות תרבות מיקרוסקופ כגון צלחות Delta-T (ל coverslips מ"מ שלב 5) או 12 עגול זכוכית ממוקם בתוך גם צלחת תרבית תאי 24 גם (לצעד 6) עם כמתואר לעיל (2.1).
- הוסף 1 מיליליטר של תקשורת בתרבות השלמה EGM-2 לתרבות מיקרוסקופ platesor 0.5 מיליליטר לכל 24 היטב ולאזן צלחות בCO% 37 מעלות צלזיוס / 5 2 באינקובטור humidified.
- קציר ולספור תאי האנדותל כבצעדים 3.1-3.3.Centrifuge הנפח הנדרש של תאים (0.5 מיליון תאים לכל מדגם) ב1,200 XG במשך 5 דקות על RT. Resuspend התא גלולה בזהירות ב100 μl פתרון transfection הגרעיני RT לדגימה.
- שלב של השעיה תא 100 μl עם 1-5 DNA מיקרוגרם. תא העברה / השעיה DNA לתוך קובט מוסמך; חייב מדגם לכסות את החלק התחתון של קובט ללא בועות אוויר.
הערה: בונה מיקוד YFP או DsRed לקרום התא (באמצעות חומצות אמינו N-20 של מסוף neuromodulin המכילה אות לpalmitoylation posttranslational) שימשה לבד (קרום-YFP לבד או קרום-DsRed לבד) או שיתוף transfected עם סמן נפח cytoplasmic (למשל, קרום-YFP וDsRed מסיסה). תמורות של סמני חלבון פלואורסצנטי רבים ניתן להשתמש. - סגור את קובט עם הכובע. הכנס את קובט עםהשעיה תא / דנ"א לתוך מחזיק קובט של electroporator וליישם תכנית electroporation S-005. קח את קובט מתוך המחזיק פעם התכנית נגמרה.
- להוסיף ~ 500 μl של התקשורת והתרבות מראש equilibrated לקובט ולהסיר בעדינות את ההשעיה התא מקובט באמצעות טפטפות העברת פלסטיק המסופקות בערכת transfection הגרעינית.
- לניסויים באמצעות צלחות תרבות מיקרוסקופ לחלק את ההשעיה התא מתגובה אחת באופן שווה בין שתי מנות המכילות תקשורת מחוממת מראש (שלבי 4.2-4.3). לניסויים באמצעות 24 היטב / צלחת, מחיצת תגובה אחת באופן שווה בין 3 בארות.
- דגירה התאים בCO% 37 מעלות צלזיוס / 5 2 באינקובטור humidified ולשנות תקשורת 4-6 שעות, ושוב שבלאחר transfection 12-16 שעות.
5. הדמיה תא חי וניתוח
- האנדותל הכנה
- יום 0: Co-transfect HLMVECs העיקרי עם הקרום-YFP וDsRed מסיסה באמצעות nucleofeטכנולוגית ction כמתואר בשלב 4 וצלחת צלחות תרבות Live- תא הדמיה.
- יום 1: החלף בינוני עם בינוני טרי המכיל IFN-γ (מיליליטר / 100 ng) כדי לגרום לביטוי MHC-II. ביום 2. לעורר תאי transfected על ידי תוספת של 20 TNF-α ng / ml לתקשורת הקיימת.
- ביום 3, דגירה האנדותל עם 1 מיקרוגרם / מיליליטר כל אחד מסופר-אנטיגנים חיידקי enterotoxin staphylococcal B (SEB) ורעלן תסמונת הלם רעיל 1 (TSST) בשעת 37 ° C במשך 30-60 דקות בסמוך לניסויים. להשמיט את הצעד הזה לתנאי השליטה '-Ag'.
- הכנה לימפוציטים
- במקביל לצעד 5.1.3, להכין מאגר (האדום-חופשי HBSS פנול) בתוספת 20 מ"מ Hepes, pH 7.4 ו 0.5% v / v אלבומין בסרום אדם מחומם מראש ל 37 מעלות צלזיוס. קח דוגמא של לימפוציטים מסוג תרבותי ולקבוע את הצפיפות על ידי ספירה עם hemocytometer (שלב 1.12-1.17).
- צנטריפוגה 2 מיליון תאים לדגימה בבית 1,XG 200 במשך 5 דקות ב RT בצינור חרוטי 15 מיליליטר. תקשורת לשאוב ותא גלולה בעדינות resuspend ב 2 מיליליטר של חיץ כזה שלא צבירי תאים להישאר.
- להסיר aliquot טרי של הפורע-2 צבע סידן וגלול בDMSO לעשות ריכוז המניה של 1 מ"מ.
- הוסף 2 μl של הפורע-2 מניות פתרון להשעית תא T (2 מיקרומטר ריכוז סופי), מכסה את הצינור ומערבבים מייד על ידי היפוך הצינור כדי להבטיח אפילו פיזור של צבע. לדגור על 37 ° C למשך 30 דקות.
- צנטריפוגה כמו בשלב 5.2.2. לשאוב מאגר-וימפוציטים בעדינות אך ביסודיות resuspend ב20-40 μl של הצפת-טרי.
- התקנת Live- תא הדמיה ורכישה
הערה: מגוון רחב של מערכות יכול להיות מועסק להדמיה הקרינה לחיות תאים במיקרוסקופי אור זקופים והפוכים. דרישות בסיסיות כוללות מקור הקרינה אור ומסננים, מצלמת CCD, מיתוג מסנן ממונע ותריסים, שלב מחומם (או microscתא אופ-mountable מחוממת) ותוכנה לרכישת תמונה אוטומטית. לפרוטוקול זה צמצם מספרי גבוה, הגדלה גבוהה (כלומר, 40X, 63X) עדשות טבילת שמן נדרשות כדי להשיג את הרזולוציה מרחבית ההכרחית. טיפול מיוחד יש לנקוט בבחירת המקור המתאים הקרינה ועדשות להדמיה סידן מבוסס-פורע-2 שלא כולם תואמים את 340/380 אורכי גל עירור ננומטר הנדרשים. גישה חלופית (תואמת עם מערכות סינון הקרינה ירוקות ואדום סטנדרטיים) ניתן להשתמש עם צבעי סידן רגיש שאינו ratiomentic (למשל, Fluo-4, רוד-3), אם כי אלה לא יכולים במדויק לכמת שטף סידן ורק לספק ביחס / קריאת נתונים הכמותיים.- הפעל מערכת מיקרוסקופ (מחשב לפעולה, מיקרוסקופ, מצלמת CCD, גלגל מסנן ומנורת קסנון).
- פתח את התוכנה הייעודית.
- מיקרוסקופ / תוכנה להגדיר עבור הזמן לשגות הדמיה רב-ערוצי אוטומטיים. כולל רכישה רציפה של מודעותלעומת זאת ifferential התערבות (DIC), הקרינה ירוקה סטנדרטית, לזרוח אדום סטנדרטי ועירור 340 ו -380 ננומטר סטנדרטיים פורע-2 תמונות. הגדר את המרווח לרכישה ל10-30 שניות ומשך זמן כולל של 20-60 דקות ~.
- קבע זמני חשיפה לפורע-2 הדמיה.
- להוסיף שמן אובייקטיבי טרי והר צלחת מיקרוסקופ המכילה רק 0.5 מיליליטר של חיץ-על מתאם שלב חימום ומייד להפעיל לאזן ל -37 מעלות צלזיוס (ייקח ~ 2-3 דקות).
- להוסיף נח לימפוציטים טעונים Fura2 לתא צלחת מיקרוסקופ רכוב בעזרת פיפטה 20 μl.
- הפעל הדמיה שדה בהירה. בחר את נתיב האור לעינית. השתמש בכפתור להתמקד הגס להביא אובייקטיבי במגע עם תחתית צלחת miscoscope. השתמש בעינית והידית להתמקד בסדר להתמקד בתאי T התיישבו בחלק התחתון של המנה.
- השתמש בפקדי שלב XY כדי לבחור שדה המכיל לפחות 10 תאים. לְהִמָנַעצפוף מעל שדות וגושי תאים כמו אלה ליצור חפצי הדמיה.
- מתג משדה בהיר למקור אור פלורסנט. לעבור מהדמית עינית למצלמת CCD. פרמטרים שנקבעו רכישה (לדוגמא, זמן חשיפה, רווח גלאי וbinning). שימוש בתוכנה לרכוש נחה Fura2-340 ותמונות Fura2-380 (החל עם זמן חשיפה זהה עבור כל, בדרך כלל בטווח של 200-1,000 ~ אלפיות שניים).
- השתמש בשיטות שתוארו בשלב 5.4.1 לחשב Fura2-340 / Fura2-380 עבור כל הלימפוציטים. לבצע חזרות חוזרות ונשנות של התאמת Fura2-340 וזמני חשיפת Fura2-380, רכישת תמונות וחישוב יחס עד הערכים הממוצע הם קרובים ל -1.
- קבע זמני חשיפה לממ-YFP וDsRed.
- החלף את צלחת מיקרוסקופ המשמשת בשלב 5.3.3.1 עם צלחת miscroscope מכיל transfected, מופעל ולשקוע טופלו (או שלא טופל; שליטה) HLMVECs או HDMVECs מתרבית תאי חממה (שלבי 4.5.1). השתמש פיפטה העברה חד פעמית כדי להסיר במהירות תקשורת, לשטוף פעם אחת על ידי תוספת של ~ 1 מיליליטר של חיץ-מראש חימם. לשאוב ולאחר מכן להוסיף 0.5 מיליליטר של חיץ-.
- לזהות תחומים שבהם תאי האנדותל transfectant חיוביים ניאון בהיר הם בהווה ובנראים בריא עם צמתים אינטר בנויים היטב.
- להתאים את הפרמטרים רכישה (לדוגמא, זמן חשיפה, רווח גלאי וbinning) לממ-YFP וDsRed. הקפד שעוצמת אות הקרינה ממוצעת בכל ערוץ נופלת בין 25% ו -75% מהטווח הדינמי של הגלאי.
- קבע זמני חשיפה לפורע-2 הדמיה.
- לנהל ניסוי Live- תא הדמיה.
- השתמש בתוכנה אוטומטית להתחיל רכישת תמונה וללכוד כמה מרווחים של תמונות להקים בסיס.
- במהלך הרכישה תחול ~ 5 μl של לימפוציטים המרוכז טעון-פורע-2 (משלב 5.2) למרכז שדה ההדמיה צלחת מיקרוסקופ על ידי החדרת הקצה של נפח קטן (P-5או P-20) פיפטה לתקשורת בסמוך למרכז היעד ולהוציא לאט.
- כימפוציטים להתיישב בשדה ההדמיה, לבצע התאמות עדינות בפוקוס כדי להבטיח שממשק תא התא-endothelia T (סינפסות החיסונית) נשמרים במישור המוקד. עם 40 ואובייקטיבי 63X, ~ 10-20 תאים לכל שדה הם אופטימליים. אם פחות תאים הם נצפו בחוזרים על שלב תחום ההדמיה 5.3.4.2.
- לאחר מרווח התצפית הרצויה של הניסוי התחרה, תמשיך הדמיה ומייד פיפטה ionomycin ישירות לתוך צלחת miscoscope (באמצעות טכניקה כמו ב5.3.4.2) לריכוז סופי של 2 מיקרומטר לגרום לשטף סידן מקסימאלי / אות איתות-פורעה 2 (כלומר , אמצעי הכיול, ראה ניתוח 5.4.).
- כחלופה ל5.3.4.4after מרווח התצפית הרצויה של הניסוי התחרתה, לשאוב מייד המאגר-ולהחליף אותו עם פתרון 0.5 מיליליטר מקבע (פורמלדהיד 3.7% ב PBS) במשך 5 דקות בRT, ואחריו שטיפת שלוש פעמים עם PBS. אז המשך לשלב 6.
- ניתוח של Live- תא הדמיה
הערה: לאחר שמירת קבצים שנרכשו, הם עשויים להיות מנותחים באופן ישיר או מיוצאים לניתוח על ידי מגוון רחב של יישומי תוכנת ניתוח תמונת off-line. ImageJ הוא חבילה יקרה במיוחד, תכליתית מאוד, כי הוא זמין באופן חופשי ותואם כמעט בכל חבילת תוכנת רכישה. העיצוב של ניסויי ההדמיה מתוארים בצעדים 5.1-5.3 יניב דינמיקת רזולוציה מרחב ובזמן גבוהה של אינטראקציות בין ימפוציטים וAPC אנדותל בהעדר נוכחות של SAG המקור. כמעט בלתי מוגבלים ניתוחים אפשריים כאשר פונים נתוני הדמיה של דינמיקת morphometric / איתות תאית. היעדים הספציפיים שתוארו בפרוטוקול ספציפי זה הם לכמת הגירת הלימפוציטים ואיתות (כלומר, קינטיקה ורמות שטף סידן תוך תאי) יחד עם דינמי מתואמתאל שינויים בארכיטקטורת סינפסה החיסונית עם דגש על תכונות ספציפיות (כלומר, ILPs / podo-הדפסים). דוגמאות לסטנדרטים של נפרדים ולא סטנדרטי הבאות (כלומר, שפותחו במיוחד עבור ניסויים / שאלות אלה) מנתח.- מדוד שטף סידן ימפוציטים
- בחר הראשוניים Fura2-340 (340 EX-510 EM ננומטר ננומטר) התמונות וFura2-380 (380 ננומטר ננומטר EM EX-510) שנרכשו לפני תוספת של לימפוציטים מסוג. השתמש אלה כתמונות רקע ודיגיטלי להחסיר אותם מכל התמונות בסדרת הזמן לכל ערוץ המתאים.
- עבור כל נקודת זמן ליצור תמונה דיגיטלית יחס של Fura2-340 מופחת רקע והתמונות מופחתי רקע Fura2-380 (כלומר, 340 ננומטר EX-510 ננומטר EM-רקע / 380 ננומטר EX-510 ננומטר EM-רקע).
- בחר בכלי ציור תוכנה המתאים. לחץ על המסך כדי לצייר אזור מעגלי שליnterest (ROI) סביב כל הלימפוציטים. אלה יפיקו ערך יחס-פיקסל בממוצע עבור כל מסגרת הלימפוציטים וזמן.
- עלילה היחס מחושב כפונקציה של זמן באמצעות יישום תוכנה מתאים (למשל, תוכנת גיליונות אלקטרוניים). חישוב שטף סידן בממוצע לניסוי על ידי סיכום ערכי היחס של כל הלימפוציטים לכל שדה וחלוקת ערך שבמספר הכולל של לימפוציטים לכל נקודת זמן
- לבצע ניתוח מעקב הגירת lympocyte.
- לנתח תא נדידת תאי T באמצעות יישום מתאים מעקב תא תוכנה (למשל, ImageJ) באמצעות ערוץ דסק"ש מכל וידאו. באמצעות Cell ImageJ מעקב התוסף, לזהות בכל מסגרת centroid של כל תא באופן ידני על ידי לחיצה על זה בכל מסגרת מתקדמת.
- השתמשו בקואורדינטות XY הסידורי וכתוצאה מכך (כלומר, עקבות של נתיבי הגירה) כדי לחשב את ממוצע המהירות (מרווח היגר מרחק סך הכל / כולל oהדמיה ו) וtortuosity (מרחק כולל היגרו / מרחק מקצה-לקצה ליניארי בין מיקום התא בתמונה הראשונה והאחרונה).
- צלב-לתאם פרמטרים אלה עם שטף סידן (5.4.1) דינמיקה על בסיס תא-ידי תאים.
- להעריך את צפיפות Podo-ההדפסה / ILP בתוך IS
- ספירת מספר כולל של ILP נוצר בכל תא T מרווחים מוגדר (למשל, לאחר 5 דקות של תוספת תאי T). ניתן לזהות אלו טבעות מיקרון בקנה מידה בדידה ניאון הקרום-YFP כי שיתוף למקם עם עיגולים כהים בDsRed cytoplasmic על APC אנדותל באתר של הידבקות הלימפוציטים.
- צלב-לתאם 'אינדקסי ILP' וכתוצאה מכך עם שטף סידן (5.4.1) דינמיקה על בסיס תא-ידי תאים.
- מדוד את podo-ההדפסה / החיים ILP.
- לכל podo-הדפסה / ILP בנתון לחשב גלגוליה כנקודת הזמן שעברה, כאשר ILP היה גלוי - נקודת הזמן שבו שpodo-הדפסה / אלחוטי ILPהראשון הופיע. ILP הממוצע תקופות חיים שני להוא.
- צלב-לתאם חיים אלה עם שטף סידן (5.4.1) דינמיקה על בסיס תא-ידי תאים.
- להעריך את הקשר בין זמן היווצרות ILP הראשוני ושטף סידן.
- לכל הלימפוציטים לזהות את נקודת הזמן (מסגרת) שבו סידן עולה ראשון מעל בסיס 19.
- לכל הלימפוציטים לזהות את נקודת הזמן שבי podo-ההדפסה הראשונה / ILP מופיעה.
- לכל הלימפוציטים לחשב "זמן לקזז" על ידי הפחתת נקודת זמן שטף סיד הראשונית מזה של podo-ההדפסה / ILP הראשוני. ממוצע הערכים לכל ימפוציטים בשדה. ערכים חיוביים מצביעים על היווצרות ILP מקדימה שטף סידן ואילו מספרים שליליים מצביעים על ההפך.
הערה: ניתן בקלות לבצע ניסויים אלה תחת זרימה למינרית גזירה רלוונטית מבחינה פיזיולוגית באמצעות תאי זרימת הדמיה מקביל קיר זמינים מסחרי כמתואר 19.
- מדוד שטף סידן ימפוציטים
הדמיה 6. קבועים תאים וניתוח
- נקודת סיום קבוע תא אנדותל T הוא היווצרות ומכתים
- הכן תאי T כמתואר ב1. הכינו תאי האנדותל (- / + SAG) כמו בשלב 5.1 (transfection, שלב 5.1.1 הוא אופציונאלי). קח דוגמא של לימפוציטים מסוג תרבותי ולקבוע את הצפיפות על ידי ספירה עם hemocytometer (סעיף 1).
- העבר את המקבילה נפח תרבות הלימפוציטים לפחות 3 x 10 5 ימפוציטים / מדגם לצינור חרוטי 15 מיליליטר ו צנטריפוגות ב XG 200 במשך 3 דקות. הסר את supernatant ו resuspend גלולה הלימפוציטים במאגר-(שלב 5.2.1) ריכוז של 6 x 10 5 מיליליטר / לימפוציטים.
- הסר את תאי האנדותל מתרבית תאי החממה ו( שתמשיך מדגם אחד בכל פעם) תקשורת ברציפות לשאוב ולהחליף עם 0.5 מיליליטר של השעיה הלימפוציטים (3 x 10 5 ימפוציטים / מדגם) ולהחליף עד 37 מעלות צלזיוס אניncubator.
- לאחר פעמים דגירה מתאימות, שצוין לעיל, בינוני לשאוב מבארות ולהוסיף פתרון מספק מקבע (פורמלדהיד 3.7% ב PBS) כדי לכסות את המדגם לחלוטין (למשל, בצלחת גם 24 ~ 300-500 μl). לדגור על RT למשך 5-10 דקות.
- לשטוף מדגם 3 פעמים עם PBS. כתם על ידי הוספת נוגדן ראשוני במשך 60 דקות ב RT (ראה רשימה). אם הנוגדן הראשוני מופנה לחלבון תאיים, צעד permeabilization נוסף צריכה להתבצע על ידי הוספת פתרון מספק permeabilization (0.01% TritonX-100 ב PBS) כדי לכסות את מדגם דקות 1 ב RT לחלוטין. לשטוף מדגם 3 פעמים עם PBS. להוסיף נוגדנים משני מתאימים (במקרים מסוימים במקביל phalloidin הניאון) במשך 60 דקות ב RT.
- הר coverslip הזכוכית העגול על שקופיות הדמיה. נקודת סיום קבוע תא אנדותל T הוא היווצרות והכתמה. כדי להתחיל מקום הדמיה שקופית ההדמיה המכיל דגימות על הבמה מיקרוסקופ ובחר את שמן 63Xמַטָרָה. החל שמן טבילה טרי.
- השתמש במצב ההדמיה הבהיר השדה ועדשות העין לאתר את מטוס המוקד. לעבור לepifluorescence ולבדוק מדגם באמצעות עדשות העין. בחר תחום העניין. עבור למצב לייזר סריקה.
- שימוש במצב מהיר הסריקה ועובד בתחום הרחב ביותר האפשרי להתאים אישית את כוח הלייזר ורווח של כל ערוץ ללייעל את האות כך ש, באופן אידיאלי, עוצמת אות מסוימת מגיעה לפחות ~ 25% ולא יותר מ -75% מהטווח הדינמי של הגלאים.
- שימוש בפקדי פוקוס ידניים, לסרוק במהירות באמצעות ציר ה- Z ולזהות את הגבולות העליונים ותחתונים של חתך (בדרך כלל כל המידע צריך להיות בתוך עובי של 15 ~ מיקרומטר). בחר את עובי סעיף Z-ציר בטווח של ~ .2-1.0 מיקרומטר.
- לבסוף, זום / לחתוך תחום ההדמיה לאזור הספציפי של עניין וסריקת התנהגות. בנוסף בעל si הקרינה בהיר מאוד וספציפיgnal במדגם, רכישת 3D הדמיה ברזולוציה גבוהה דורשת חזרות של סריקה וביצוע התאמות לפרמטרי רכישה. המטרה היא להשיג XY מקסימאלי ורזולוציה Z- ציר, בלי צילום הלבנת ניכרת.
- איכותי לנתח את הטופולוגיה של טופולוגיית 3D של הוא על ידי ביצוע שחזור 3D דיגיטלי של קטעים אופטיים וכתוצאה מכך דרך יישום תוכנה מתאים (למשל, J תמונה). באמצעות יישומים דומים כמותית להעריך הפצת אות הקרינה (למשל, הניתוח של פירסון שיתוף לוקליזציה ועוצמת הקרינה מתאם קו-סריקה וצפייה מאונך).
תוצאות
גישת הדמיה רומן באמצעות תאי האנדותל ושילוב יתרונות הרזולוציה של מודל bilayers שומנים מישוריים עם המורכבות וdeformability של נגמ"שים מקצועיים הפיזיולוגיים פותחה (איור 1). איור 2 מספק דוגמאות של הגירה טיפוסית, שטף סידן ודינמיקה טופולוגית נצ...
Discussion
בסך הכל, פרוטוקול זה מתאר שיטות לחקירת תאי האנדותל כט) נגמ"שים פיסיולוגיים understudied וii) כסוג חדש של 'מודל APC הסלולרי מישוריים'. עם כל כבוד ללשעבר, זה הפך להיות יותר ויותר מוערך שנגמ"שים שאינם hematopoietic ההיקפי (או 'סטרומה') ממלאים תפקידים קריטיים, שאינם מיותרים
Disclosures
The authors have nothing to disclose.
Acknowledgements
We thank Dr. Peter T. Sage for his assistance in generating some of the representative images. This work was supported by an NIH R01 grant to C.V.C. (HL104006).
Materials
| Name | Company | Catalog Number | Comments |
| BD Vacutainer stretch latex free tourniquet | BD Biosciences | 367203 | |
| BD alcohol swabs | BD Biosciences | 326895 | |
| BD Vacutainer Safety-Lok | BD Biosciences | 367861 | K2 EDTA |
| BD Vacutainer Push Button Blood Collection Set | BD Biosciences | 367335 | |
| RPMI-1640 | Sigma-Aldrich | R8758-1L | |
| Ficoll-Paque | Sigma-Aldrich | GE17-1440-02 | Bring to RT before use |
| FCS-Optima | Atlanta Biologics | s12450 | Heat inactivated |
| Penicillin-Streptomycin | Sigma-Aldrich | P4458-100ML | |
| Trypan blue | Sigma-Aldrich | T8154-20ML | |
| staphylococcal enterotoxin B | Toxin Technology | BT202RED | Stock solution 1mg/ml in PBS |
| toxic shock syndrome toxin 1 | Toxin Technology | TT606RED | Stock solution 1mg/ml in PBS |
| human IL-15 | R&D Systems | 247-IL-025 | Stock solution 50ug/ml in PBS |
| PBS | Life Technologies | 10010-049 | |
| Fibronectin | Life Technologies | 33016-015 | Stock solution 1mg/ml in H20 |
| HMVEC-d Ad-Dermal MV Endo Cells | Lonza | CC-2543 | Other Human Microvascular ECs can be used, i.e. HLMVECs |
| EGM-2 MV bullet kit | Lonza | CC-3202 | |
| Trypsin-EDTA | Sigma-Aldrich | T-4174 | Stock solution 10x, dilute in PBS |
| amaxa-HMVEC-L Nucleofector Kit | Lonza | vpb1003 | Required Kit for step 4 |
| IFN-g | Sigma-Aldrich | I3265 | Stock solution 1mg/ml in H20 |
| TNF-alpha 10ug, human | Life Technologies | PHC3015 | Stock solution 1mg/ml in H20 |
| phenol Red-free HBSS | Life Technologies | 14175-103 | |
| Hepes | Fisher Scientific | BP299-100 | |
| Calcium Chloride | Sigma-Aldrich | C1016-100G | Stock solution 1M in H20 |
| Magnesium chloride | Sigma-Aldrich | 208337 | Stock solution 1M in H20 |
| Human Serum albumin | Sigma-Aldrich | A6909-10ml | |
| Immersol 518 F fluorescence free Immersion oil | Fisher Scientific | 12-624-66A | |
| Fura-2 AM 20x50ug | Life Technologies | F1221 | Stock solution 1mM in DMSO |
| pEYFP-Mem (Mem-YFP) | Clontech | 6917-1 | |
| pDsRed-Monomer (Soluble Cytoplasmic DsRed) | Clontech | 632466 | |
| pDsRed-Monomer Membrane (Mem-DsRed) | Clontech | 632512 | |
| pEGFP-Actin | Clontech | 6116-1 | |
| Alexa Fluor 488 Phalloidin | Life Technologies | A12379 | |
| Formaldehyde solution 37% | Fisher Scientific | BP531-500 | Toxic, use fumehood |
| Triton X-100 | Sigma-Aldrich | X100-5ML | |
| Falcon 15mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-70C | |
| Falcon 50mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-49A | |
| Falcon Tissue Culture Treated Flasks T25 | Fisher Scientific | 10-126-9 | |
| Falcon Tissue Culture Treated Flasks T75 | Fisher Scientific | 13-680-65 | |
| Corning Cell Culture Treated T175 | Fisher Scientific | 10-126-61 | |
| Glass coverslips | Fisher Scientific | 12-545-85 | 12 mm diameter |
| Falcon Tissue Culture Plates 24-well | Fisher Scientific | 08-772-1 | |
| Delta-T plates | Bioptechs | 04200415B | |
| Wheaton Disposable Pasteur Pipets | Fisher Scientific | 13-678-8D | |
| 1.5 ml Eppendorf tube | Fisher Scientific | 05-402-25 | |
| ICAM1 mouse anti-human | BD Biosciences | 555509 | |
| HS1 mouse anti-human | BD Biosciences | 610541 | |
| Anti-Human CD11a (LFA-1alpha) Purified | ebioscience | BMS102 | |
| Anti-Human CD3 Alexa Fluor® 488 | ebioscience | 53-0037-41 | |
| Anti-MHC Class II antibody | Abcam | ab55152 | |
| Anti-Talin 1 antibody | Abcam | ab71333 | |
| Anti-PKC theta antibody | Abcam | ab109481 | |
| phosphotyrosine (4G10 Platinum) | Millipore | 50-171-463 | |
| Nucleofector II | Amaxa Biosystems | Required electroporator for step 4 | |
| Zeiss Axiovert | Carl Zeiss MicroImaging | ||
| Zeiss LSM510 | Carl Zeiss MicroImaging | ||
| Zeiss Axiovison Software | Carl Zeiss MicroImaging | ||
| NU-425 (Series 60) Biological Safety Cabinet | NuAIRE | Nu-425-600 | |
| Forma STRCYCLE 37 °C, 5% CO2 Cell culture Incubator | Fisher Scientific | 202370 | |
| Centrifuge 5810 | Eppendorf | EW-02570-02 | |
| Hemocytometer | Sigma-Aldrich | Z359629 | Bright-Line Hemocytometer |
| Isotemp Waterbath model 202 | Fisher Scientific | 15-462-2 |
References
- von Andrian, U. H., Mackay, C. R. T-cell function and migration. Two sides of the same coin. N. Engl. J. Med. 343 (14), 1020-1034 (2000).
- Springer, T. A. Adhesion receptors of the immune system. Nature. 346 (6283), 425-434 (1990).
- Shaw, A. S., Dustin, M. L. Making the T cell receptor go the distance: a topological view of T cell activation. Immunity. 6 (4), 361-369 (1997).
- Monks, C. R., Freiberg, B. A., Kupfer, H., Sciaky, N., Kupfer, A. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395 (6697), 82-86 (1998).
- Delon, J., Stoll, S., Germain, R. N. Imaging of T-cell interactions with antigen presenting cells in culture and in intact lymphoid tissue. Immunol Rev. 189, 51-63 (2002).
- Brossard, C., et al. Multifocal structure of the T cell - dendritic cell synapse. Eur J Immunol. 35 (6), 1741-1753 (2005).
- Dustin, M. L. The cellular context of T cell signaling. Immunity. 30 (4), 482-492 (2009).
- Balagopalan, L., Sherman, E., Barr, V. A., Samelson, L. E. Imaging techniques for assaying lymphocyte activation in action. Nat Rev Immunol. 11 (1), 21-33 (2011).
- Cebecauer, M., Spitaler, M., Serge, A., Magee, A. I. Signalling complexes and clusters: functional advantages and methodological hurdles. J Cell Sci. 123, 309-320 (2010).
- Oddos, S., et al. High-speed high-resolution imaging of intercellular immune synapses using optical tweezers. Biophys J. 95 (10), L66-L68 (2008).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285 (5425), 221-227 (1999).
- Bunnell, S. C., et al. T cell receptor ligation induces the formation of dynamically regulated signaling assemblies. J Cell Biol. 158 (7), 1263-1275 (2002).
- Yokosuka, T., et al. Newly generated T cell receptor microclusters initiate and sustain T cell activation by recruitment of Zap70 and SLP-76. Nat Immunol. 6 (12), 1253-1262 (2005).
- Seminario, M. C., Bunnell, S. C. Signal initiation in T-cell receptor microclusters. Immunol Rev. 221, 90-106 (2008).
- Dustin, M. L. Supported bilayers at the vanguard of immune cell activation studies. J Struct Biol. 168 (1), 152-160 (2009).
- Martinelli, R., Carman, C. V., Bradshaw, R. A., Stahl, P. Lymphocyte Endothelilal Interactions. Encyclopedia of Cell Biology. , (2015).
- Choi, J., Enis, D. R., Koh, K. P., Shiao, S. L., Pober, J. S. T lymphocyte-endothelial cell interactions. Annu Rev Immunol. 22, 683-709 (2004).
- Marelli-Berg, F. M., Jarmin, S. J. Antigen presentation by the endothelium: a green light for antigen-specific T cell trafficking?. Immunol Lett. 93 (2-3), 109-113 (2004).
- Sage, P. T., et al. Antigen recognition is facilitated by invadosome-like protrusions formed by memory/effector T cells. J Immunol. 188 (8), 3686-3699 (2012).
- Kumari, S., et al. Actin foci facilitate activation of the phospholipase C-gama in primary T lymphocytes via the WASP pathway . eLife. , (2015).
- Marelli-Berg, F. M., et al. Major histocompatibility complex class II-expressing endothelial cells induce allospecific nonresponsiveness in naive T cells. J Exp Med. 183 (4), 1603-1612 (1996).
- Ma, W., Pober, J. S. Human endothelial cells effectively costimulate cytokine production by, but not differentiation of, naive CD4+ T cells. J Immunol. 161 (5), 2158-2167 (1998).
- Perez, V. L., Henault, L., Lichtman, A. H. Endothelial antigen presentation: stimulation of previously activated but not naive TCR-transgenic mouse T cells. Cell Immunol. 189 (1), 31-40 (1998).
- Epperson, D. E., Pober, J. S. Antigen-presenting function of human endothelial cells. Direct activation of resting CD8 T cells. J Immunol. 153 (12), 5402-5412 (1994).
- Shiao, S. L., et al. Human effector memory CD4+ T cells directly recognize allogeneic endothelial cells in vitro and in vivo. J Immunol. 179 (7), 4397-4404 (2007).
- Marelli-Berg, F. M., Okkenhaug, K., Mirenda, V. A two-signal model for T cell trafficking. Trends Immunol. 28 (6), 267-273 (2007).
- Carman, C. V., et al. Transcellular diapedesis is initiated by invasive podosomes. Immunity. 26 (6), 784-797 (2007).
- Carman, C. V. Mechanisms for transcellular diapedesis: probing and pathfinding by 'invadosome-like protrusions'. J Cell Sci. 122 ((Pt 17)), 3025-3035 (2009).
- Dustin, M. L., Tseng, S. Y., Varma, R., Campi, G. T. T cell-dendritic cell immunological synapses. Curr Opin Immunol. 18 (4), 512-516 (2006).
- Saito, T., Yokosuka, T. Immunological synapse and microclusters: the site for recognition and activation of T cells. Curr Opin Immunol. 18 (3), 305-313 (2006).
- Gomez, T. S., et al. HS1 functions as an essential actin-regulatory adaptor protein at the immune synapse. Immunity. 24 (6), 741-752 (2006).
- Burbach, B. J., Medeiros, R. B., Mueller, K. L., Shimizu, Y. T-cell receptor signaling to integrins. Immunol Rev. 218, 65-81 (2007).
- Vicente-Manzanares, M., Sanchez-Madrid, F. Role of the cytoskeleton during leukocyte responses. Nat Rev Immunol. 4 (2), 110-122 (2004).
- Ma, Z., Janmey, P. A., Finkel, T. H. The receptor deformation model of TCR triggering. Faseb J. 22 (4), 1002-1008 (2008).
- Ma, Z., Sharp, K. A., Janmey, P. A., Finkel, T. H. Surface-anchored monomeric agonist pMHCs alone trigger TCR with high sensitivity. PLoS Biol. 6 (2), e43 (2008).
- Groves, J. T. Bending mechanics and molecular organization in biological membranes. Annu Rev Phys Chem. 58, 697-717 (2007).
- Xu, C., et al. Regulation of T cell receptor activation by dynamic membrane binding of the CD3epsilon cytoplasmic tyrosine-based motif. Cell. 135 (4), 702-713 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved