Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Görüntüleme İmmünoloji Synapse Dynamics için bir Endotel Hücre Modeli Düzlemsel
Bu Makalede
Özet
Adaptive immunity is controlled by dynamic 'immunological synapses' formed between T cells and antigen presenting cells. This protocol describes methods for investigating endothelial cells both as understudied physiologic APCs and as a novel type of 'planar cellular APC model'.
Özet
Adaptif bağışıklık, T hücreleri ve antijen sunan hücreler ("APC 'ler') arasındaki dinamik etkileşimler ile düzenlenir 'immünolojik sinaps" olarak adlandırılır. Bu samimi hücre-hücre arayüzleri içinde MHC / Ag-TCR, F-aktin, yapışma ayrık alt hücresel kümeleri ve sinyal molekülleri oluşturur ve hızla pişmanlık. Bu dinamikler, kritik verimlilik ve geliştirmek bağışıklık tepkilerinin kalitesi hem belirleyicileri ve dolayısıyla patolojik bağışıklık karşı koruyucu olması düşünülmektedir. Fizyolojik APC 'ile immünolojik sinaps mevcut anlayış elde görüntüleme çözünürlüğü yetersizliği ile sınırlıdır. Yapay alt tabaka modelleri (örneğin, düzlemsel lipid bilayers) mükemmel çözünürlük sunan ve son derece değerli araçlar olmuştur rağmen, doğal olmayan fizyolojik ve oversimplified bulunmaktadır. Vasküler ve lenfatik endotel hücreleri 'yarı mesleğinin önemli bir çevresel doku (veya stroma) bölmesi olarak ortaya çıkmıştırEl APC'ler '. (Profesyonel APC 'moleküler makinelerin çoğu ifade) Bu APC'Ier neredeyse düzlemsel hücre yüzeyini oluşturan benzersiz özelliğe sahiptir ve (floresan protein gazetecilere, gibi) kolayca transfectable vardır. Burada temel bir yaklaşım tarif edilecektir yeni ve geliştirilmiş bir görüntüleme ve temel antijenik sinyal süreçlerinin sorgulanmak üzere fizyolojik 'düzlemsel hücresel APC modeli' olarak endotel hücreleri uygulamak.
Giriş
T lenfositleri majör histokompatibilite kompleksi (MHC) bağlı verimli peptit antijeni (Ag) tanıma yeteneği ile karakterize adaptif bağışıklık sisteminin bir dalı vardır, T hücre reseptörlerinin (TCR'ler) 1 ile molekülleri. Naif lenfositler kurucu göç ve profesyonel Ag sunan hücreler '(ZPT; örneğin, dendritik hücreler) tarama bellek / efektör T hücreleri etkin bir periferik dokularda APC' ve potansiyel hedef hücrelerin son derece geniş bir yelpazede anket gerekir iken, lenf düğümleri içinde.
Bir APC üzerindeki soydaş Ag ilk muhasebeleştirilmesi aşağıdaki min, bunların göç tutuklama ve özel bir samimi hücre-hücre arayüzü olarak adlandırılan 'immünolojik sinaps' oluşmaya başlar lenfosit (IS). Sürekli (yani 30-60 dk) temas yükseltmek ve 2-7 sinyalizasyon sürdürmek için gerekli olan IS. Gelişmekte olan çalışmalar IS içinde, sürekli oluşumu ve hızlı r olduğunu tespitgücü ve immün yanıtları 2-7 sonuçlanan kalitesini belirlemek (örneğin, MHC / Ag-TCR, F-aktin, yapışma ve sinyal molekülleri içeren) ayrık alt hücresel sinyal mikro-kümelerin emodeling. Ancak, bu sürecin dinamik detaylar ve düzenleyici mekanizma tam olarak 8,9 anlaşılmaktadır. Bu son derece gerekli zamanmekansal görüntüleme sınırı APC yüzeylerin düzensiz topolojileri ve hücre-hücre etkileşimi uçakları kötü kontrollü yönlendirme, sorunları ile ilgili teknik zorlukları büyük ölçüde kaynaklanmaktadır 8-10 (Figure1A) yaklaşır.
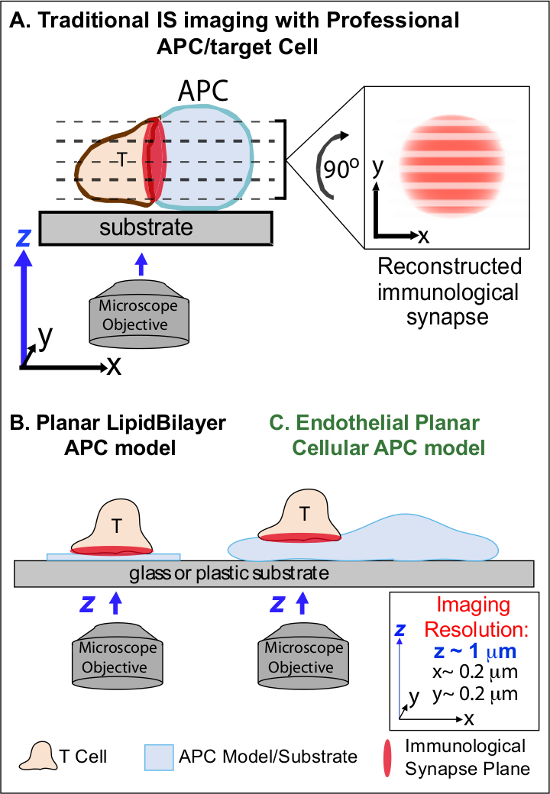
Görüntüleme İmmünoloji Synapse Dynamics Şekil 1. Fizyolojik Planar hücre APC Modeli. Şematik bir T hücresi ve professio arasındaki immünolojik sinaps geleneksel görüntüleme göstermektedir nal APC (A) ve T hücresi ve bu yeni endotel düzlemsel APC modelinde (C) ile karşılaştırıldığında, geleneksel bir düzlemsel lipid iki katmanlı APC modeli (B). , Dramatik, yani mekansal (z görüntüleme düzey çözünürlük ~ 1 mikron) ve temporal (ödün; Profesyonel ZPT fizyolojik immünolojik sinaps sağlar, ancak (çözünürlük ~ 0.2 mikron Optimum xy görüntüleme düzlemine göre yani) kötü amaçlı hücre-hücre arabirimi sunar ihtiyacı nedeniyle defalarca görüntüleme çözünürlüğü) tüm z görüntüleme uçakları ile tarayın. Iki tabakalı modelleri Optimal zamanmekansal görüntüleme çözünürlüğü sağlar düzlemsel topoloji var, ama aynı zamanda son derece, fizyolojik olmayan ve sert basitleştirilmiştir. Bu endotel hücre modeli fizyolojik bir ortamda optimum mekansal ve zamansal görüntüleme çözünürlüğü sağlamak için klasik bir APC fizyolojik substrat ile lipit bilayers düzlemsel topolojisini birleştirir.m / files / ftp_upload / 53288 / 53288fig1large.jpg "target =" _ blank "> bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Önceki çalışma kısmen uygun xy görüntüleme paralel olan tek bir planına T hücresi aktivasyonu aracılığı ile yüzey sabitleme örneğin, uygun uzaysal çözünürlük (sağlar geliştirmek düzlemsel alt-tabaka bir model (yani, lipid çift tabakaları ve antikor-kaplı yüzeyler), bu engeller etrafından olan düzlem) 11-15 (Şekil 1B). Bu modeller, dinamik aktin / TCR sinyalizasyon mikro kümelerin 7,11-14 keşif dahil olmak üzere T hücrelerinin antijenik sinyalizasyon, kontrol moleküler / hücre içi dinamikleri önemli bilgiler kolaylaştırmıştır. Bununla birlikte, bu modeller doğal basitleştirilmiş edilir, yanı sıra, katı (Şekil 1B) (3-boyutlu bir topolojik özelliklerin geliştirilmesi / çalışma engelleyen). Bu nedenle, phy böyle bulguları ilişkilendirmek nasıl belirsizdirsiologic hücre-hücre immün gözetim.
Hala understudied rağmen, damar ve lenfatik endotel hücreleri büyük olarak ortaya çıkmaktadır (yani ~ 1000 kat tüm profesyonel APC'lerce daha numaraları, daha fazla) 'yarı profesyonel' APC '16-18 periferik bölmesi. (Örneğin, CD40, LFA3, ICOSL, 4-1BB, OX40L, TL1A, PD-L1; fakat CD80 ve CD86) Bu hücreler, MHC-I-, MHC-II-ve ko-stimülatör moleküllerin çok sayıda dile ve stratejik olarak Onlar özel nöbetçi işlevleri 16-18 hizmet kan doku arayüzünde konumlandırılmış. Daha önceki çalışmalar, endotel hücrelerinin etkili bir efektör / bellek ama saf olmayan, T hücrelerini 19-25 yeniden stimüle edebilirler. Bu nedenle, endotelyal hücreler gibi T hücresi aktivasyonu, farklılaşması, hafıza ve tolerans 16,17,26 yerel etkisi gibi periferik dokular içinde adaptif bağışıklık tepkilerinin, efektör aşamasında özel APC rol oynaması olasıdır. Criin vitro yetiştirilen ola- rak, endotel hücreleri neredeyse düzlemsel hücre yüzeylerine formu (floresan protein muhabir olan, örneğin) kolayca transfekte bulunmaktadır. Bu özellikler, hücre-hücre etkileşimleri 19,27 sırasında topolojik dinamiklerin yüksek uzaysal çözünürlüklü görüntüleme için idealdir. Böylece endotel hücreleri tepkileri (Şekil 1C) 19,20 antijen tanıma sürücü ve düzenleyen moleküler / hücre içi biçimlenme mekanizmalarının çalışma için belirgin uygun bir fizyolojik 'düzlemsel hücresel APC' model olarak hizmet olabilir.
Daha önce yapışma ve transendoteliyal göç 27 sırasında lökosit-endotel etkileşimi detaylarını incelemek için (plazma zarı ve sitoplazmada floresan protein üreticileri ile endotelin hücrelerin transfeksiyonu dahil) tamamlayıcı görüntüleme tekniklerini kurulan lökositler aktif, dinamik tarafından endotel yüzeyine soruşturma olduğunu gösterdi Ekleme birmikronaltı ölçek d retraksiyonu, aktin-zengin silindirik çıkıntılar (~ çap ve derinlikte 200-1,000 nm) invadosome benzeri çıkıntılar (yani, 'ILPS') 27,28 olarak nitelendirdi. Bu görüntüleme yaklaşımları daha da bildirilen 19,20 olarak T hücre-endotelyal immünolojik sinaps yüksek uzaysal çözünürlüklü görüntüleme için ilk yöntemler geliştirmek endotel APC fonksiyonunun yararlanmak ve ayrıca burada açıklamak için protokollerin oluşturulması ile birlikte genişletilmiştir. Bu yeni düzlemsel hücresel APC modelinden elde edilen bir merkez bulgu T hücresi ILPS ilk Ag algılama teşvik ve sonraki sinyalizasyon sürdürülmesi hem işlev olmasıdır. Nitekim, (stabilize ve kalsiyum akı başlangıç yanıt tahakkuk eden) TCR ve aktif sinyal gibi PKC-Q, ZAP-70, fosfotirosinin ve HS1 düşündüren moleküllerde gösteri zenginleştirme birden ILPS'nin diziler. Bu nedenle, ILPS TCR-sinyal mikro üç boyutlu fizyolojik eşdeğer temsil etmek gibi görünüyordüzlemsel iki tabakalı modellerinde görülen kümeler. Bu yaklaşım, bu nedenle, hassas ortaya / raporlar, moleküler ve mimari (ve biyomekanik zımni) dinamikleri aksi saptanabilir değil.
Burada açıklanan yöntem adaptif bağışıklık tepkilerinin temel mekanizmaları sorgulamak için yeteneğimizi geliştirmek amacıyla profesyonel APC ve yapay APC substrat modelleri arasında köprü için yararlı olacaktır. Burada odaklama CD4 + efektör Th1-tipi / hafıza hücresinin aktivasyonuna iken, aşağıda ele alındığı gibi, bu temel yaklaşım, hali hazırda, T hücre türleri ve Ag'lerin geniş bir çalışma için modifiye edilebilir.
Protokol
Bu protokol açıklanan tüm deneyler birincil insan T hücreleri ve piyasada mevcut birincil insan endotel hücreleri, insan denekleri (dermal veya akciğer mikrovasküler EC) yapacağı her türlü araştırma protokolü kurumsal inceleme kurulu tarafından onaylanmış olması gerekir ve yazılı onam temin edilmelidir ile yürütülmektedir Her kan bağışı. Bu protokolü kullanarak yapılan deneyler Beth İsrail kadın papaz Tıp Merkezi IRB tarafından onaylanmıştır.
1. Hazırlanması İnsan CD4 + Th1 Efektör / Bellek T Hücreleri
- Alkol ile silin ven, vericinin koluna turnike uygulayın ve iğneyi. Yavaşça EDTA'lı vacutainer içine kanın 15 ml çizin. Kan çizilmiş edildiğinde, iğneyi çıkarmadan önce turnike çöz. Hemen iğne çıkarıldığında steril gazlı bez ile yara basınç uygulayın.
- 50 ml'lik bir tüp kan transferi. 1 seyreltisi (nihai hacim 30 mi) bir 1: at oda sıcaklığında RPMI-1640 ekleyin. Dikkatle seyreltik Bindirmebu, oda sıcaklığında Ficoll-Paque gibi lenfositlerin önceden süzüldü izolasyon ortamında 15 ml içeren, iki 50 ml'lik tüplere d, kan.
- Sallanan kepçeli rotor içinde 1.200 x g'de 30 dakika süre ile oda sıcaklığında gradyanı santrifüjleyin. (RPMI-1640 içinde 500 mi, 50 mi FCS, 5 ml penisilin / streptomisin), T hücresi ortamı hazırlar santrifüj bulunuyor.
- Santrifüj 50 ml tüp çıkarılması üzerine dört kat dikkat edilmelidir: kırmızı kan hücrelerinin bir pelet alt, Paque, beyaz kan (lenfositler dahil) hücreleri ve plazma içeren bir hücre tabakası. Dikkatli bir şekilde 50 ml Falcon tüpüne pastör pipet ve transfer akyuvar tabakayı kaldırmak.
- (20 ml kadar) RT RPMI-1460 eklenmesi ve 1200 x g'de 5 dakika boyunca oda sıcaklığında santrifüj edilerek beyaz kan hücre tabakasını yıkayın. T hücre ortamı, 1 ml beyaz kan hücrelerini yeniden süspanse edin. 1.5 ml'lik bir santrifüj tüpü içinde 250 ul T hücre ortamına 1 ml hücre süspansiyonu 5 ul ekleyin ve yavaşça yukarı ve aşağı pipet ile karıştırılır.
- 25 ul seyreltik ekleme25 ul% 0.4 Tripan mavisi d hücre süspansiyonu. Standart bir hemasitometre her iki tarafında karışımın 10 ul ekle.
- Düşük güç ışık mikroskobu hemasitometre yerleştirin. 10X objektif kullanılarak Tripan mavi boya dışlanan ve hemasitometre her iki tarafında orta meydanda mevcut olan yaşayan hücrelerin sayısını.
- Hücre konsantrasyonunu hesaplamak için, 100 (seyreltme faktörü) 2 kareler ortalamasını çarpın ve sonra çarpma tarafından 10 4 hücre / ml sayı vermek.
- T hücre ortamı içinde 0.5 x 10 6 hücre / ml nihai konsantrasyon ayarlayın. 1 ug bir son konsantrasyon ekleme / hücrelere bakteriyel süperantijenler stafilokok enterotoksin B (SEB) ve toksik şok sendromu toksini 1 (TSST) her biri ml. 72 saat (37 ° C ve% 5 CO2) Kültür CD4 + T hücre popülasyonu genişletmek.
- Pelet T hücreleri (1200 xg, 5 dk) ve T hücre ortamı içinde 0.5 x 10 6 hücre / ml'de tekrar süspansiyoninsan IL-15 (20 ng / ml) eklenmesi. Transfer T150 balonuna lenfosit. Gerektiği gibi tam orta IL-15 / 24-48 saat her bölünmüş hücreleri genişletmek için devam (medya renklerine göre, yani, ortam hafif sarı pembe döner zaman) sonra. 15 güne kadar için ortaya çıkan lenfosit nüfus koruyun.
NOT: Tasarım gereği, bu protokol etkinleştirmek ve özellikle genişletmek SEB ve TSST reaktif olan CD4 + T hücrelerinin alt kümesi ve daha sonra Th1-benzeri efektör / bellek fenotip doğru onları götürmek olacaktır. Diğer beyaz kan hücreleri hayatta ve hali hazırda akış sitometrisi ile tespit edilebilir şekilde adım 1,10, hücrelerin en az% 95 CD4 +, CD45RO + T hücreleri, 19 olacak şekilde, bu koşullar altında büyüyebilir başarısız. Arzu edildiği takdirde, daha fazla saflaştırma hali hazırda ticari olarak temin edilebilen bir antikor / manyetik boncuk esaslı pozitif ya da negatif seçim kitleri ile elde edilebilir.
2. İlköğretim İnsan Endotel Hücre Kültürü Başlangıç
- Kaplama, steril koşullar PBS içinde fibronektin (FN), 20 ug / ml olan bir T25 şişesi. 30-60 dakika boyunca oda sıcaklığında bekletin. FN çıkarın ve 5 ml tam orta ekleyin (Endotel Bazal Orta (EBM-2), orta Endotel Büyüme Ortamı (EGM-2) singlequots ile takviye edilmiş). 37 Pre-inkübe En az 30 dakika boyunca ° C hücre kültürü yetiştirme cihazı kullanılmaktadır.
- 2-3 dakika ~ ara sıra nazik bir çalkalama ile 37 ° C su banyosu içinde dondurulmuş insan akciğer veya dermal mikrovasküler endotelial hücreleri (HLMVECs ya HDMVECs) içindeki bir şişe çözülme. Hemen önceden ısıtılmış ortam içeren T25 şişesi hücreleri transferi. Yavaşça girdap ve 37 ° C'de inkübatör yer.
- ~ 4-6 saat sonra ortam değiştirin. Ortam yaklaşık her 48 saatte (ya da ortam hafif sarı hale geldiğinde) plakasının ulaşana kadar% 90-95 konfluent değiştirme devam edin.
3. Genel Yarma ve Endotel Hücreleri Genişleme
- ~ 90-95 confluency hücreleri büyütün. Bu 2-5 gün sürebilir. Bölme için,medya kaldırmak ve PBS ile durulayın. PBS çıkarın ve taze 1x tripsin minimum hacimde (T25 için 0.5 ml veya T75 için 1.5 ml) ile değiştirin. Yavaşça tripsin ile tüm yüzeyini kapsayacak şekilde girdap. 37 ° C'de inkübe edin ~ 5 dakika ° C. Düşük güç ışık mikroskobu kullanılarak plaka hücrelerin dekolmanı izleyin.
- Hücrelerin büyük çoğunluğu yuvarlak veya müstakil görünür olduğunda, önceden ısıtılmış tam EGM-2 orta (katma tripsin hacmine kıyasla, yani) 5 birimi ekleyin ve hafifçe tüm hücreleri ayırmak için balonun yüzeyi üzerine pipetle.
- 1.6-1.7 tarif edildiği gibi, bir hemositometre ile endotel hücreleri sayın. Santrifüj hücreleri (5 dk, 1200 xg) pelet. Süpernatantı. Önceden ısıtılmış tam bir EGM-2 MV maddesiyle ml başına 0.500.000 hücreleri konsantrasyonu ayarlayın.
- Bakım için uygun FN kaplı yemekleri veya şişelere hücrelerin hacimde aktarın. Yavaşça girdap ve inkübatör koyun. Kaplamanın 6-12 saat içinde ortam değiştirin. Medya shoHer 48 saat sonra yaklaşık olarak değiştirilebilir ULD.
4. Endotelyal HÜCRE NAKLİ
Not: Primer endotelyal hücreleri, en yaygın kimyasal ve elektroporasyon gibi yöntemler ile transfeksiyon dirençli bulunmaktadır. Aşağıda tarif edilen transfeksiyon Nükleer bazlı yöntem nispeten yüksek transfeksiyon verimi (~% 50-70) sağlar. Etkili bir alternatif bir yöntem, uygun viral vektörler (Malzeme Tablo yorumlara bakınız) neden olduğu enfeksiyona kullanımıdır.
- (Steril koşullar ya da örneğin Delta-T plakaları gibi bir mikroskop kültür plakaları içinde, PBS içinde fibronektin (FN) 20ug / ml,% 90-95 confluency.Coat bir nihai yoğunluk için HLMVECs ya HDMVECs bir T25 veya T75 şişeleri (gerektiğinde) hazırlayın (2.1) yukarıda tarif edildiği gibi) ile aşama 6, bir 24-yuvalı hücre kültürü plakasının (bir oyuk içine yerleştirilen bir adım 5) ya da 12 mm yuvarlak cam lameller.
- Her bir 24 çukuruna mikroskobu kültürü tam EGM-2 kültür ortamı 1 ml platesor 0,5 ml ilave edilir ve plakalar dengeyenemlendirilmiş bir 37 ° C /% 5 CO2 inkübatör.
- Hasat ve adım oda sıcaklığında 5 dakika boyunca 1200 x g'de hücrelerin gerekli hacmi (numune başına 0.500.000 hücre) 3.1-3.3.Centrifuge olarak endotel hücreleri sayın. Örnek başına 100 ul RT nükleer transfeksiyon solüsyonu dikkatle hücre pelletini.
- 1-5 mikrogram DNA ile hücre süspansiyonu 100 ul birleştirin. Sertifikalı küvetin içine hücre / DNA süspansiyonu aktarın; Numune hava kabarcığı olmadan küvetin alt kapağı gerekir.
Not: (translasyon sonrası palmitoilleme için bir sinyal içerir neuromodulin 20 N-terminal amino asit ile), hücre zarı YFP veya DsRed hedef yapılar (tek başına zar-YFP, tek başına ya da zar-DsRed), tek başına kullanılan ya da ile birlikte transfekte sitoplazmik hacimsel işaretleyici (örn zara-YFP ve çözünür DsRed). Floresan protein belirteçleri birçok permütasyon kullanılabilir. - Kapakla küvet kapatın. Ile küvet yerleştirinHücre / DNA Elektroporatör bir küvet tutucu içine süspansiyon ve elektroporasyon programı S-005 uygulanır. Program bittiğinde sahibinin dışarı küvet alın.
- Küvete ön dengelenmiş kültür ortamı ~ 500 ul ekleyin ve hafifçe nükleer transfeksiyon kitinde plastik transferi pipet kullanarak küvete hücre süspansiyonu çıkarın.
- Mikroskop kültür plakaları kullanılarak deneyler önceden ısıtılmış medya (Adımlar 4,2-4,3) içeren iki yemekler arasında eşit olarak tek reaksiyonu hücre süspansiyonu bölümlemek için. 24 kuyu / plaka, bölüm 3 kuyu arasında eşit tek reaksiyonu deneyler için.
- 12-16 saat sonrası transfeksiyon tekrar nemlendirilmiş bir 37 ° C /% 5 CO 2 inkübatör inkübe hücreleri ve Ortam 4-6 saat değiştirebilir, ve.
5. Canlı Hücre Görüntüleme ve Analiz
- Hazırlama Endotel
- Gün 0: Bir nucleofe yoluyla zara-YFP ve çözünür DsRed primer HLMVECs Co-transfekteolarak ction teknolojisi canlı hücre görüntüleme kültürü plakaları üzerine adım 4 ve levha tarif edilmiştir.
- Gün 1: MHC-II ekspresyonu indükte etmek için, IFN-y (100 ng / ml) ihtiva eden taze ortam ile orta değiştirin. 2. günde, mevcut ortama 20 ng / ml TNF-a ilave edilerek transfekte edilmiş hücreleri stimüle eder.
- Gün 3, 1 ug endotelyumu kuluçkaya / bakteriyel süperantijenlerin her 37 ° stafilokok enterotoksin B (SEB) ve toksik şok sendromu toksini 1 (TSST) ml Hemen deneylerden önce 30-60 dakika süreyle ° C. '-ag' Kontrol koşulları için bu adımı atlayın.
- Lenfositleri hazırlanması
- Aşama 5.1.3 paralel olarak, tampon A 20 mM Hepes ile takviye (fenol kırmızısı içermeyen HBSS), pH 7.4 ve% 0.5 v / v, insan serum albümini, 37 önceden ısıtılmış hazırlık ° C. Kültürlü lenfositlerin bir örneğini alın ve bir hemasitometre (Adım 1,12-1,17) ile sayılarak yoğunluğunu belirler.
- 1 ile numune başına Santrifüj 2000000 hücreleri15 ml konik bir tüp içinde oda sıcaklığında 5 dakika boyunca 200 x g. Aspire medya ve Tampon 2 ml yavaşça tekrar süspansiyon hücre pelet hiçbir hücre kümeleri kalır bir şekilde.
- 1 mM'lik bir stok konsantrasyonu yapmak için DMSO içinde Fura-2 kalsiyum boya ve tekrar süspansiyon taze bir kısım çıkarın.
- (2 uM son konsantrasyon), T hücresi süspansiyonuna Fura-2 stok çözeltisi 2 ul eklenir, tüpün kapağı ve boyanın eşit bir dağılım sağlamak için tersini tüp hemen karıştırın. 37 ° C'de inkübe edin 30 dakika boyunca ° C.
- Adım 5.2.2 deki gibi santrifüj. Aspire Tampon-A ve taze Tampon-A 20-40 ul yavaşça ama iyice tekrar süspansiyon lenfositler.
- Canlı hücre Görüntüleme Kurulum ve Devralma
Not: sistemleri çok çeşitli dik olarak ters ışık mikroskobu ile canlı hücre flüoresanı görüntüleme için kullanılabilir. Temel gereksinimler bir floresan ışık kaynağı ve filtreler, bir CCD kamera, motorlu filtre anahtarlama ve kepenkleri, ısıtmalı sahne (ya da Microsc dahilope monte ısıtmalı odacık) ve otomatik görüntü elde etmek için yazılım. Bu protokol, yüksek sayısal açıklık, yüksek büyütme (yani, 40X, 63X) immersiyon yağı lensler gerekli uzaysal çözünürlük elde etmek için gereklidir. Özel bakım tüm gerekli 340/380 nm uyarma dalga boyları ile uyumlu olarak Fura-2 tabanlı kalsiyum görüntüleme için uygun floresan kaynağı ve lens seçiminde dikkat edilmelidir. (Standart yeşil ve kırmızı floresans filtre setleri ile uyumlu) alternatif bir yaklaşım olmayan ratiomentic kalsiyum duyarlı boyalar ile birlikte kullanılabilir (örneğin, Fluo-4, Rhod-3), bu doğru, kalsiyum akışı miktarını belirlemek ve göreceli sağlayamaz se / kantitatif okuma.- Mikroskop sistemi açın (operasyon, mikroskop, CCD kamera, filtre tekerleği ve xenon lamba için PC).
- Belirlenen yazılımını açın.
- Otomatik çok kanallı time-lapse görüntüleme için kurmak mikroskop / yazılım. Reklamın sıralı satın Dahilifferential girişim kontrast (DIC), standart yeşil floresan, standart kırmızı floresan ve standart 340 ve 380 nm uyarma Fura-2 görüntüler. 10-30 sn ve 20-60 dk ~ bir toplam süresi edinimi için aralığını ayarlayın.
- Fura-2 görüntüleme için poz sürelerini ayarlayın.
- Taze objektif yağ ekleyin ve ısıtma sahne adaptör üzerine Tampon-A sadece 0.5 ml içeren bir mikroskop çanak montajı ve hemen 37 dengelenmeye açmak ° C (~ 2-3 dakika sürer).
- 20 ul pipet kullanarak monte mikroskop çanak odasına Fura2 yüklü lenfositleri ekleyin.
- Parlak bir alan görüntüleme açın. Eyepieces ışık yolu seçin. Miscoscope çanak alt ile temas hedefi getirmek için kaba odak düğmesini kullanın. Çanak alt kısmında yerleşmiş T hücreleri üzerinde odaklanmak için mercek ve ince odak düğmesini kullanınız.
- En az 10 hücre ihtiva eden bir alanı seçmek için xy sahne denetimlerini kullanın. Önlemekaşırı kalabalık olan bu görüntüleme eserler yaratacak şekilde alanlar ve hücre kümeleri.
- Parlak alandan Anahtarı ışık kaynağı floresan için. CCD kamera mercek görüntüleme geçin. Set satın alma parametreleri (örneğin, maruz kalma süresi, dedektör kazanç ve binning). Fura2-340 ve Fura2-380 görüntü dinlenme program tekniği kullanılarak (genellikle ~ 200-1,000 milisaniye aralığında, her biri için benzer poz süresi ile başlayan).
- Her lenfosit için Fura2-340 / Fura2-380 hesaplamak için Adım 5.4.1 açıklanan yöntemleri kullanın. , Fura2-340 ve Fura2-380 pozlama süreleri ayarlama görüntüleri elde ve ortalama değerler 1'e yakın dek oranları hesaplama tekrarlanan yineleme gerçekleştirin.
- Mem-YFP ve DsRed için poz sürelerini ayarlayın.
- Bir miscroscope çanak ile adım 5.3.3.1 kullanılan mikroskop çanak değiştirin transfekte aktif ve SAG tedavi (veya işlenmemiş; kontrol) içeren hücre kültürü inkübatör (Merdivenleri 4.5 den HLMVECs veya HDMVECs.1). Hızla ortamını çıkarın önceden ısıtılmış Tampon-A ~ 1 ml ilavesi ile bir kez durulama atılabilir bir transfer pipeti kullanarak. Aspire edin ve daha sonra tampon A-0.5 ilave edin.
- Parlak floresan pozitif transfektan endotel hücreleri mevcut ve iyi biçimlendirilmiş hücrelerarası kavşaklar ile sağlıklı göründükleri alanları belirleyin.
- Mem-YFP ve DsRed için satın alma parametreleri (örneğin, maruz kalma süresi, dedektör kazanç ve binning) ayarlayın. Her kanalda ortalama floresan sinyal yoğunluğu% 25 ve dedektörün dinamik aralık% 75 arasında düştüğünü emin olunuz.
- Fura-2 görüntüleme için poz sürelerini ayarlayın.
- Canlı hücre görüntüleme deney.
- Düzeninizle görüntülerin çeşitli aralıklarla görüntü elde etme başlayacak ve yakalamak için otomatik yazılımını kullanın.
- Satın alma sırasında küçük bir hacme (P-5 ucu sokarak mikroskop çanak görüntüleme alanının merkezine (adım 5.2 dan itibaren) konsantre Fura-2 yüklenmiş lenfositlerin ~ 5 ul uygulayınveya P-20) yakın yavaş yavaş objektif ve çıkartılması merkezine ortama pipet.
- Lenfositler görüntüleme alanına yerleşmek gibi, odak ince ayarlamalar T hücre endotelin hücre arayüzü (immünolojik sinaps) odak düzleminde korunur emin olun. 40 ve 63X amacı ile, ~ alan başına 10-20 hücre optimum bulunmaktadır. Daha az hücre görüntüleme alanı adımı yineleyin 5.3.4.2 görülmektedir edin.
- Deney istenen gözlem aralığı yarıştırılır sonra, maksimum kalsiyum akışı / Fura-2 sinyal sinyali uyardığı 2 uM'lik bir son konsantrasyona kadar (5.3.4.2 gibi tekniği kullanılarak) görüntüleme devam hemen miscoscope çanak içine, doğrudan iyonomisin pipetle (örn kalibrasyon aracı, analiz 5.4 bakınız.).
- Deney istenen gözlem aralığının 5.3.4.4after alternatif yarıştırılır olarak hemen Tampon-A aspire ve 0.5 ml sabitleme çözeltisinin (PBS içinde% 3.7 Formaldehit) 5 dakika için en ile değiştirinRT, PBS ile üç kez çalkalayın. Sonra 6. adıma geçin.
- Canlı hücre Görüntüleme Analizi
NOT: edinilen dosyaları kaydettikten sonra, doğrudan analiz edilebilir veya off-line görüntü analiz yazılımı geniş bir uygulama çeşitli analiz için ihraç etti. ImageJ hemen her kazanım yazılım paketi ile serbestçe kullanılabilir ve uyumlu bir özellikle değerli, çok yönlü bir pakettir. Adımlar 5,1-5,3 açıklanan görüntüleme deney tasarımı lenfositler ve endotel APC yokluğunda ve soydaş sarkmaya varlığı arasındaki etkileşimin yüksek uzaysal ve zamansal çözünürlük dinamiklerini verecektir. Hücresel morfometrik / sinyal dinamiklerinin görüntüleme verileri ele alırken neredeyse sınırsız analizler mümkündür. Bu özel protokol açıklanan özel amaçları koordineli lenfosit göçü ve dinamik birlikte (yani kinetik ve hücre içi kalsiyum akı seviyelerini) sinyal ölçmek için vardırarkadaşları özgü özellikleri (örneğin, ILPS / Podo-baskı) odaklanarak immünolojik sinaps mimarisinde değişir. Ayrı standart ve standart dışı olan aşağıdaki örnekler analiz (yani, bu deneyler / sorular için özel olarak geliştirilen).- Lenfosit Kalsiyum akı ölçün
- Lenfositlerin eklenmesinden önce iktisap edilmiş ilk Fura2-340 (340 nm EX-510 nm EM) ve Fura2-380 (380 nm EX-510 nm EM) görüntüleri seçin. Ilgili her kanal için zaman serilerinde tüm görüntüleri onları çıkarmak dijital arka plan resimleri olarak kullanın ve.
- Her zaman noktası için arka plan çıkarılır Fura2-340 ve arka plan çıkarılır Fura2-380 görüntüleri (yani 340 nm EX-510 nm EM-arka / 380 nm EX-510 nm EM-arka) bir dijital oranı görüntü oluşturun.
- Uygun yazılım çizim aracı seçin. I dairesel bölgesini çizmek için ekranda tıklayınHer lenfosit etrafında (YG) nterest. Bunlar her lenfosit ve zaman dilimi için bir piksel ortalama oran değerini üretecektir.
- Uygun bir yazılım uygulaması (örneğin, hesap tablosu programı) kullanılarak zamanın bir fonksiyonu olarak hesaplandı oranı çizilir. Alan başına lenfositlerinin bütün değerlerin oranım toplanmasıyla ve her bir zaman noktası için lenfositlerin sayısı ile bu değer bölünmesi ile deney için ortalama kalsiyum akısını hesaplayın
- Lenfosit göç izleme analiz yapmak.
- Her videodan DIC kanalını kullanarak uygun bir hücre izleme yazılımı uygulamasını (örneğin, ImageJ) kullanılarak hücre T hücre göçü analiz edin. ImageJ Hücre Takip Plugin kullanarak, el ile her ilerici çerçeve içinde üzerine tıklayarak her çerçeve içinde her hücrenin merkezini belirlemek.
- Ortaya çıkan seri xy koordinatları kullanın (örneğin, göç yolları izleri) ortalama hızı (toplam mesafe göç / toplam aralığını hesaplamak için of görüntüleme) ve eğrilik (toplam mesafe) / ilk ve son görüntüde hücre konumu arasındaki doğrusal uçtan uca mesafe göç etti.
- Bir hücre tarafından hücre bazında kalsiyum akı (5.4.1) dinamikleri ile bu parametreler Çapraz korelasyon.
- IS içinde Podo-print / TDP Yoğunluk değerlendirin
- Her T hücresi içerisinde oluşturulabilir İLP toplam sayısını tanımlandığı gibidir aralıklarla (örneğin, T hücreleri 5 dakika sonrası ekleme). Bunlar lenfosit yapışma bir yerinde endotelyal APC üzerinde sitoplazmik DsRed karanlık çevrelerin ile lokalize co ayrık mikron ölçekli floresan membran YFP halkaları tespit edilebilir.
- Bir hücre tarafından hücre bazında kalsiyum akı (5.4.1) dinamikleriyle ortaya çıkan 'ILP endeksleri' Çapraz korelasyon.
- Podo-print / ILP ömürleri ölçün.
- Verilen her Podo baskı / ILP için bir ILP görünür iken son kez noktası olarak ömürlerini hesaplamak IS - zaman noktasını o zaman Podo baskı / TDP fibirinci görünüyordu. Ortalama ILP IS hem başına yaşam süreleri.
- Bir hücre tarafından hücre bazında kalsiyum akı (5.4.1) dinamikleri ile bu yaşamlar Çapraz korelasyon.
- İlk TDP oluşumu ve kalsiyum akı arasındaki zamansal ilişkiyi değerlendirmek.
- Her lenfosit için kalsiyum ilk başlangıçta 19 üzerinde yükselir hangi zaman noktasını (çerçeve) belirlemek.
- Her lenfosit için ilk Podo baskı / ILP görünen hangi zaman noktasını belirlemek.
- Her lenfosit için başlangıç Podo baskı / İLP o gelen ilk kalsiyum akı zaman noktasını çıkarılarak bir 'offset zamanı' hesaplayın. Bir alandaki tüm lenfositlerin için değerlerinin ortalamasını alın. Pozitif değerler negatif sayılar tersini gösteriyor, oysa TDP formasyonu kalsiyum akışı öncesinde göstermektedir.
Not: 1 tarif edildiği gibi bu deneyler hali hazırda ticari olarak temin edilebilir, paralel duvar akış görüntüleme odaları kullanılarak fizyolojik olarak ilgili kesme laminer akışı altında gerçekleştirilebilir9.
- Lenfosit Kalsiyum akı ölçün
6. Sabit hücre Görüntüleme ve Analiz
- Sabit uç T hücre-endotelyal oluşumu ve boyanması IS
- 1'de tarif edildiği gibi endotel hücrelerinin T hücrelerini hazırlamak hazırlanması (- / + SAG) Aşama 5,1 olarak (transfeksiyon, Aşama 5.1.1 opsiyoneldir). Kültürlü lenfositlerin bir örneğini alın ve bir hemasitometre (Bölüm 1) ile sayılarak yoğunluğunu belirler.
- 3 dakika boyunca 200 x g'de 15 ml konik bir tüp ve santrifüj en az 3 x 10 5 lenfositler / örnek bir lenfosit kültür hacmi eşdeğer aktarın. Süpernatantı ve Tampon A-lenfosit pelet (Aşama 5.2.1) 6 x 10 5 lenfosit / ml konsantrasyonu tekrar süspansiyon.
- Hücre kültürü inkübatöründe endotel hücreleri çıkarın ve arka arkaya aspirat ortamı (her seferinde bir örnek işlem) ve lenfosit süspansiyonu (3 x 10 5 lenfositler / numune) içinde 0.5 ml ile değiştirin ve 37 yerine C ıncubator.
- Uygun kuluçka sürelerinden sonra, yukarıdaki kuyulardan aspire orta kaydetti ve (24 plaka ~ 300-500 ul, örneğin) numuneyi tamamen karşılamak için yeterli Sabitleme Çözüm (PBS içinde% 3,7 formaldehit) ekleyin. 5-10 dakika boyunca oda sıcaklığında inkübe edin.
- PBS numune 3 kez durulayın. Oda sıcaklığında 60 dakika boyunca birincil antikor eklenerek leke (listesine bakınız). Birincil antikor bir hücre içi protein yönlendirilir, ek permeabilization aşama tamamen oda sıcaklığında 1 dakika boyunca numune karşılamak için yeterli besleyici çözeltiyi (PBS içerisinde% 0.01 Triton X-100) eklenmesi ile yapılması gerekmektedir. PBS numune 3 kez durulayın. Oda sıcaklığında 60 dakika boyunca (ve bazı durumlarda eş zamanlı flüoresan falloidin olarak) uygun bir ikincil antikor ekleyin.
- Bir görüntüleme slayt yuvarlak cam lamel monte edin. Sabit uç T hücre-endotelyal oluşumu ve Boyama IS. Mikroskop sahnede örnekleri içeren görüntüleme slayt görüntüleme yeri başlayacak ve 63X yağ seçinamaç. Taze daldırma yağı sürün.
- Odak düzlemi bulmak için aydınlık alan görüntüleme modu ve göz mercekleri kullanın. Epifloresans geçin ve göz mercekleri vasıtasıyla numune kontrol edin. Ilgi alanı seçin. Lazer tarama moduna geçin.
- Hızlı tarama modunu kullanma ve mümkün olan en geniş alanın tek tek, ideal olarak, belirli bir sinyal yoğunluğu ulaştığı şekilde sinyal optimize etmek lazer gücü ve her kanalın kazancını ayarlamak çalışan ~% 25 ve dinamik aralık fazla% 75, en az dedektörlerin.
- Manuel odak kontrolleri kullanarak, hızlı bir şekilde Z ekseni üzerinden tarama ve kesit üst ve alt limitlerini (genellikle tüm bilgilerin ~ 15 mikron kalınlığında içinde bulunan olmalıdır) belirlemek. ~ 0.2-1.0 um aralığında Z ekseni kesit kalınlığı seçin.
- Son olarak, yakınlaştırma / ilgi ve davranış tarama belirli bir bölgeye görüntüleme alanını kırpar. Çok parlak ve spesifik floresan si olan ek olaraknumunede gnal, yüksek çözünürlüklü 3D görüntüleme edinme tarama ve satın alma parametreleri ayarlamalar yapma yineleme gerektirir. Amaç Kayda fotoğraf beyazlatma olmadan maksimum xy ve z-ekseni çözünürlüğü, elde etmektir.
- Niteliksel uygun bir yazılım uygulamasından (örn Resim J) üzerinden ortaya çıkan optik bölümlerin dijital 3 boyutlu rekonstrüksiyon yapılarak IS 3D topoloji topoloji analiz. Benzer uygulamalar sayesinde kantitatif floresan sinyal dağılımını değerlendirmek (örneğin, Pearson co-lokalizasyon ve bağlaşık floresan yoğunluğu hat-tarama analiz ve ortogonal inceleyen).
Sonuçlar
Endotel hücreleri kullanılarak ve fizyolojik karmaşıklığı ve profesyonel APC'lerin deformabilitesi ile düzlemsel lipid bilayers modelin çözünürlüğü avantajlarını birleştiren bir roman görüntüleme yaklaşımı (Şekil 1) geliştirilmiştir. 2 ile bu gözlenen tipik göç, kalsiyum akı ve topolojik dinamikleri örnekleri sağlar Şekil yaklaşım. Endotel üzerindeki sarkma yokluğunda, SAG-spesifik CD4 +
Tartışmalar
Genel olarak, bu protokol i) understudied fizyolojik APC'ler olarak endotel hücreleri soruşturma yöntemleri açıklar ve ii) 'düzlemsel hücresel APC modeli' yeni bir türü olarak. Eski ile ilgili olarak, giderek adaptif immün yanıtları 16-18 şekillenmesinde (hematopoetik APC'lerin karşılaştırıldığında, yani), periferal olmayan hematopoetik (ya da 'stromal') APC'Ier kritik olmayan gereksiz roller oynadığı takdir haline gelmiştir. Böyle 'yarı prof...
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
We thank Dr. Peter T. Sage for his assistance in generating some of the representative images. This work was supported by an NIH R01 grant to C.V.C. (HL104006).
Malzemeler
| Name | Company | Catalog Number | Comments |
| BD Vacutainer stretch latex free tourniquet | BD Biosciences | 367203 | |
| BD alcohol swabs | BD Biosciences | 326895 | |
| BD Vacutainer Safety-Lok | BD Biosciences | 367861 | K2 EDTA |
| BD Vacutainer Push Button Blood Collection Set | BD Biosciences | 367335 | |
| RPMI-1640 | Sigma-Aldrich | R8758-1L | |
| Ficoll-Paque | Sigma-Aldrich | GE17-1440-02 | Bring to RT before use |
| FCS-Optima | Atlanta Biologics | s12450 | Heat inactivated |
| Penicillin-Streptomycin | Sigma-Aldrich | P4458-100ML | |
| Trypan blue | Sigma-Aldrich | T8154-20ML | |
| staphylococcal enterotoxin B | Toxin Technology | BT202RED | Stock solution 1mg/ml in PBS |
| toxic shock syndrome toxin 1 | Toxin Technology | TT606RED | Stock solution 1mg/ml in PBS |
| human IL-15 | R&D Systems | 247-IL-025 | Stock solution 50ug/ml in PBS |
| PBS | Life Technologies | 10010-049 | |
| Fibronectin | Life Technologies | 33016-015 | Stock solution 1mg/ml in H20 |
| HMVEC-d Ad-Dermal MV Endo Cells | Lonza | CC-2543 | Other Human Microvascular ECs can be used, i.e. HLMVECs |
| EGM-2 MV bullet kit | Lonza | CC-3202 | |
| Trypsin-EDTA | Sigma-Aldrich | T-4174 | Stock solution 10x, dilute in PBS |
| amaxa-HMVEC-L Nucleofector Kit | Lonza | vpb1003 | Required Kit for step 4 |
| IFN-g | Sigma-Aldrich | I3265 | Stock solution 1mg/ml in H20 |
| TNF-alpha 10ug, human | Life Technologies | PHC3015 | Stock solution 1mg/ml in H20 |
| phenol Red-free HBSS | Life Technologies | 14175-103 | |
| Hepes | Fisher Scientific | BP299-100 | |
| Calcium Chloride | Sigma-Aldrich | C1016-100G | Stock solution 1M in H20 |
| Magnesium chloride | Sigma-Aldrich | 208337 | Stock solution 1M in H20 |
| Human Serum albumin | Sigma-Aldrich | A6909-10ml | |
| Immersol 518 F fluorescence free Immersion oil | Fisher Scientific | 12-624-66A | |
| Fura-2 AM 20x50ug | Life Technologies | F1221 | Stock solution 1mM in DMSO |
| pEYFP-Mem (Mem-YFP) | Clontech | 6917-1 | |
| pDsRed-Monomer (Soluble Cytoplasmic DsRed) | Clontech | 632466 | |
| pDsRed-Monomer Membrane (Mem-DsRed) | Clontech | 632512 | |
| pEGFP-Actin | Clontech | 6116-1 | |
| Alexa Fluor 488 Phalloidin | Life Technologies | A12379 | |
| Formaldehyde solution 37% | Fisher Scientific | BP531-500 | Toxic, use fumehood |
| Triton X-100 | Sigma-Aldrich | X100-5ML | |
| Falcon 15mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-70C | |
| Falcon 50mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-49A | |
| Falcon Tissue Culture Treated Flasks T25 | Fisher Scientific | 10-126-9 | |
| Falcon Tissue Culture Treated Flasks T75 | Fisher Scientific | 13-680-65 | |
| Corning Cell Culture Treated T175 | Fisher Scientific | 10-126-61 | |
| Glass coverslips | Fisher Scientific | 12-545-85 | 12 mm diameter |
| Falcon Tissue Culture Plates 24-well | Fisher Scientific | 08-772-1 | |
| Delta-T plates | Bioptechs | 04200415B | |
| Wheaton Disposable Pasteur Pipets | Fisher Scientific | 13-678-8D | |
| 1.5 ml Eppendorf tube | Fisher Scientific | 05-402-25 | |
| ICAM1 mouse anti-human | BD Biosciences | 555509 | |
| HS1 mouse anti-human | BD Biosciences | 610541 | |
| Anti-Human CD11a (LFA-1alpha) Purified | ebioscience | BMS102 | |
| Anti-Human CD3 Alexa Fluor® 488 | ebioscience | 53-0037-41 | |
| Anti-MHC Class II antibody | Abcam | ab55152 | |
| Anti-Talin 1 antibody | Abcam | ab71333 | |
| Anti-PKC theta antibody | Abcam | ab109481 | |
| phosphotyrosine (4G10 Platinum) | Millipore | 50-171-463 | |
| Nucleofector II | Amaxa Biosystems | Required electroporator for step 4 | |
| Zeiss Axiovert | Carl Zeiss MicroImaging | ||
| Zeiss LSM510 | Carl Zeiss MicroImaging | ||
| Zeiss Axiovison Software | Carl Zeiss MicroImaging | ||
| NU-425 (Series 60) Biological Safety Cabinet | NuAIRE | Nu-425-600 | |
| Forma STRCYCLE 37 °C, 5% CO2 Cell culture Incubator | Fisher Scientific | 202370 | |
| Centrifuge 5810 | Eppendorf | EW-02570-02 | |
| Hemocytometer | Sigma-Aldrich | Z359629 | Bright-Line Hemocytometer |
| Isotemp Waterbath model 202 | Fisher Scientific | 15-462-2 |
Referanslar
- von Andrian, U. H., Mackay, C. R. T-cell function and migration. Two sides of the same coin. N. Engl. J. Med. 343 (14), 1020-1034 (2000).
- Springer, T. A. Adhesion receptors of the immune system. Nature. 346 (6283), 425-434 (1990).
- Shaw, A. S., Dustin, M. L. Making the T cell receptor go the distance: a topological view of T cell activation. Immunity. 6 (4), 361-369 (1997).
- Monks, C. R., Freiberg, B. A., Kupfer, H., Sciaky, N., Kupfer, A. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395 (6697), 82-86 (1998).
- Delon, J., Stoll, S., Germain, R. N. Imaging of T-cell interactions with antigen presenting cells in culture and in intact lymphoid tissue. Immunol Rev. 189, 51-63 (2002).
- Brossard, C., et al. Multifocal structure of the T cell - dendritic cell synapse. Eur J Immunol. 35 (6), 1741-1753 (2005).
- Dustin, M. L. The cellular context of T cell signaling. Immunity. 30 (4), 482-492 (2009).
- Balagopalan, L., Sherman, E., Barr, V. A., Samelson, L. E. Imaging techniques for assaying lymphocyte activation in action. Nat Rev Immunol. 11 (1), 21-33 (2011).
- Cebecauer, M., Spitaler, M., Serge, A., Magee, A. I. Signalling complexes and clusters: functional advantages and methodological hurdles. J Cell Sci. 123, 309-320 (2010).
- Oddos, S., et al. High-speed high-resolution imaging of intercellular immune synapses using optical tweezers. Biophys J. 95 (10), L66-L68 (2008).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285 (5425), 221-227 (1999).
- Bunnell, S. C., et al. T cell receptor ligation induces the formation of dynamically regulated signaling assemblies. J Cell Biol. 158 (7), 1263-1275 (2002).
- Yokosuka, T., et al. Newly generated T cell receptor microclusters initiate and sustain T cell activation by recruitment of Zap70 and SLP-76. Nat Immunol. 6 (12), 1253-1262 (2005).
- Seminario, M. C., Bunnell, S. C. Signal initiation in T-cell receptor microclusters. Immunol Rev. 221, 90-106 (2008).
- Dustin, M. L. Supported bilayers at the vanguard of immune cell activation studies. J Struct Biol. 168 (1), 152-160 (2009).
- Martinelli, R., Carman, C. V., Bradshaw, R. A., Stahl, P. Lymphocyte Endothelilal Interactions. Encyclopedia of Cell Biology. , (2015).
- Choi, J., Enis, D. R., Koh, K. P., Shiao, S. L., Pober, J. S. T lymphocyte-endothelial cell interactions. Annu Rev Immunol. 22, 683-709 (2004).
- Marelli-Berg, F. M., Jarmin, S. J. Antigen presentation by the endothelium: a green light for antigen-specific T cell trafficking?. Immunol Lett. 93 (2-3), 109-113 (2004).
- Sage, P. T., et al. Antigen recognition is facilitated by invadosome-like protrusions formed by memory/effector T cells. J Immunol. 188 (8), 3686-3699 (2012).
- Kumari, S., et al. Actin foci facilitate activation of the phospholipase C-gama in primary T lymphocytes via the WASP pathway . eLife. , (2015).
- Marelli-Berg, F. M., et al. Major histocompatibility complex class II-expressing endothelial cells induce allospecific nonresponsiveness in naive T cells. J Exp Med. 183 (4), 1603-1612 (1996).
- Ma, W., Pober, J. S. Human endothelial cells effectively costimulate cytokine production by, but not differentiation of, naive CD4+ T cells. J Immunol. 161 (5), 2158-2167 (1998).
- Perez, V. L., Henault, L., Lichtman, A. H. Endothelial antigen presentation: stimulation of previously activated but not naive TCR-transgenic mouse T cells. Cell Immunol. 189 (1), 31-40 (1998).
- Epperson, D. E., Pober, J. S. Antigen-presenting function of human endothelial cells. Direct activation of resting CD8 T cells. J Immunol. 153 (12), 5402-5412 (1994).
- Shiao, S. L., et al. Human effector memory CD4+ T cells directly recognize allogeneic endothelial cells in vitro and in vivo. J Immunol. 179 (7), 4397-4404 (2007).
- Marelli-Berg, F. M., Okkenhaug, K., Mirenda, V. A two-signal model for T cell trafficking. Trends Immunol. 28 (6), 267-273 (2007).
- Carman, C. V., et al. Transcellular diapedesis is initiated by invasive podosomes. Immunity. 26 (6), 784-797 (2007).
- Carman, C. V. Mechanisms for transcellular diapedesis: probing and pathfinding by 'invadosome-like protrusions'. J Cell Sci. 122 ((Pt 17)), 3025-3035 (2009).
- Dustin, M. L., Tseng, S. Y., Varma, R., Campi, G. T. T cell-dendritic cell immunological synapses. Curr Opin Immunol. 18 (4), 512-516 (2006).
- Saito, T., Yokosuka, T. Immunological synapse and microclusters: the site for recognition and activation of T cells. Curr Opin Immunol. 18 (3), 305-313 (2006).
- Gomez, T. S., et al. HS1 functions as an essential actin-regulatory adaptor protein at the immune synapse. Immunity. 24 (6), 741-752 (2006).
- Burbach, B. J., Medeiros, R. B., Mueller, K. L., Shimizu, Y. T-cell receptor signaling to integrins. Immunol Rev. 218, 65-81 (2007).
- Vicente-Manzanares, M., Sanchez-Madrid, F. Role of the cytoskeleton during leukocyte responses. Nat Rev Immunol. 4 (2), 110-122 (2004).
- Ma, Z., Janmey, P. A., Finkel, T. H. The receptor deformation model of TCR triggering. Faseb J. 22 (4), 1002-1008 (2008).
- Ma, Z., Sharp, K. A., Janmey, P. A., Finkel, T. H. Surface-anchored monomeric agonist pMHCs alone trigger TCR with high sensitivity. PLoS Biol. 6 (2), e43 (2008).
- Groves, J. T. Bending mechanics and molecular organization in biological membranes. Annu Rev Phys Chem. 58, 697-717 (2007).
- Xu, C., et al. Regulation of T cell receptor activation by dynamic membrane binding of the CD3epsilon cytoplasmic tyrosine-based motif. Cell. 135 (4), 702-713 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır