JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
이미징 면역 시냅스 역학에 대한 내피 평면 셀 모델
요약
Adaptive immunity is controlled by dynamic 'immunological synapses' formed between T cells and antigen presenting cells. This protocol describes methods for investigating endothelial cells both as understudied physiologic APCs and as a novel type of 'planar cellular APC model'.
초록
적응성 면역 T 세포와 항원 제시 세포 ( '장갑차') 사이의 동적 인 상호 작용에 의해 조절 '면역 시냅스'라 칭한다. 이러한 친밀한 세포 - 세포 인터페이스 내에서 MHC / AG-TCR, F - 굴지, 접착의 개별 하위 세포 클러스터 및 신호 분자가 형성 빠르게 개조. 이러한 역학은 중요한 효율성과 개발 면역 반응의 품질 모두의 결정 때문에 병리학 적 면역 대 보호의 것으로 생각된다. 생리적 장갑차와 면역 시냅스의 현재 이해는 얻을 수있는 영상 해상도의 무능력에 의해 제한된다. 인공 기판 모델 (예를 들면, 평면 지질 이중층)이 우수한 해상도를 제공하며 매우 유용한 도구되었을지라도, 이들은 본래 비 생리적 및 과도하게 단순화된다. 혈관과 림프 내피 세포는 '반 직업의 중요한 말초 조직 (또는 기질) 구획으로 등장알 장갑차 '. (전문 장갑차의 분자 기계의 대부분을 표현할)이 거의 평탄한 장갑차 세포 표면을 형성하는 독특한 특징을 갖고 (형광성 단백질 리포터로, 예) 형질 용이하다. 여기서 기본 접근법을 설명한다 신규하고 개선 된 이미징 및 항원 기본적인 시그널링 프로세스 심문 생리적 '평면 셀룰러 APC 모델'내피 세포 등을 구현한다.
서문
T 림프구는 주요 조직 적합성 복합체 (MHC)에 효율적으로 결합 된 펩티드 항원은 (Ag)을 인식하는 능력을 특징으로 적응 면역계의 분기 아르는 T 세포 수용체 (TCR도 1)를 통해 분자. 나이브 림프구 구조적 마이그레이션 '전문의 Ag 제시 세포'(장갑차; 예 : 수지상 세포)을 주사 메모리 / 효과기 T 세포가 효과적으로 말초 조직 내의 장갑차 및 잠재 표적 세포의 매우 넓은 범위를 조사 할 필요가 있지만, 림프절 내.
APC에 동족의 Ag의 최초 인식 다음 분에서 자신의 마이그레이션을 체포하고 전문 친밀한 세포 - 세포 인터페이스라고 '면역 시냅스'를 형성하기 시작 림프구 (IS). 지속 (즉, 30 ~ 60 분) 접점이 증폭 2-7 신호를 유지해야한다. 새로운 연구는 IS 내에, 그것이 연속 형성하고 신속한 R이라고 파악강도와 면역 반응 2-7 결과의 품질을 결정 (즉, MHC / AG-TCR, F - 굴지, 접착 및 신호 분자를 포함) 이산 서브 셀룰러 신호 마이크로 클러스터의 emodeling. 그러나, 이러한 방법의 세부 사항 및 동적 규제기구는 불완전 8,9 이해된다. 이것은 근본적으로 필요한 시공간 촬상 제한 APC 표면의 불규칙한 토폴로지 및 세포 - 세포 상호 작용의 저조한 제어 평면 배향, 이슈와 관련된 기술적 인 과제는 크게 기인하는 80-10 (Figure1A)에 접근한다.
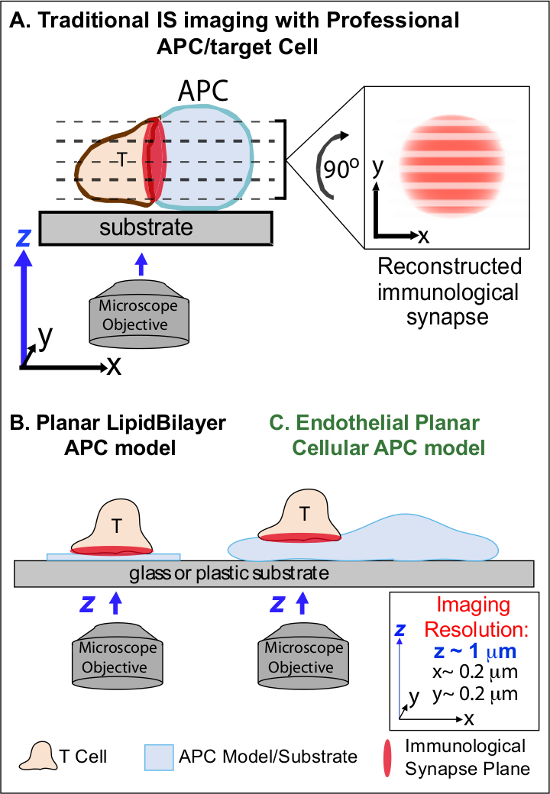
이미징 면역 시냅스 역학 그림 1. 생리적 평면 셀 APC 모델은. 회로도는 T 세포와 professio 사이의 면역 학적 시냅스의 전통적인 이미지를 보여 NAL APC (A)와 T 세포와이 신규 한 내피 평면 APC 모델 (C)에 비해 전통적인 평면 지질 이중층 APC 모델 (B). ,, 극적으로 즉, 공간 (Z 영상 플레인의 해상도 ~ 1 ㎛) 및 시간을 (타협, 전문 장갑차는 생리적 면역 시냅스를 제공하지만 (해상도 ~ 0.2 μm의 최적의 XY 영상 평면에 대한 즉,) 제대로 지향 세포 - 세포 인터페이스를 제공 필요에 의한 반복적으로 영상의 해상도) 모든 Z 영상면을 스캔합니다. 이중층 모델 시공간 최적 이미징 해상도를 제공 평면 위상을 가질뿐만 아니라, 고도의 비 - 생리 학적 및 강성 간략화된다. 이것은 내피 세포 모델 생리적 환경에서 최적의 공간 및 시간 해상도 이미징을 제공하는 APC의 고전 생리적 기판과 지질 이중층의 평면 위상을 결합한다.M / 파일 / ftp_upload / 53288 / 53288fig1large.jpg "대상 ="_ 빈 ">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
이전의 연구는 부분적으로 최적의 XY 촬상에 평행 한 평면으로 T 세포의 활성화 표면 고정을 통해, 즉, 최적의 시공간 해상도 (제공 현상 평면 기판 모델 (즉, 지질 이중층과 항체 - 코팅 된면)에 의해 이러한 장애물을 회피했다 평면) 11 ~ 15 (그림 1B). 이러한 모델은 동적 액틴 / TCR 신호 마이크로 클러스터 7,11-14의 발견을 포함하여 T 세포에 항원 신호를 제어하는 분자 / 세포 내 역학에 중요한 통찰력을 촉진하고있다. 그러나, 이러한 모델은 본질적으로 과도하게 단순화되고,뿐만 아니라 강성 (도 1b) (3 차원 기하학적 특징의 개발 / 연구를 배제). 따라서, PHY에 그러한 결과를 연관시키는 방법 불확실siologic 세포 - 세포 면역 감시.
여전히 파악 하였다 있지만, 혈관과 림프 내피 세포가 큰로서 등장하고있다 (즉, ~ 1,000 배의 모든 전문 장갑차보다 숫자에 큰) '세미 프로'장갑차 16-18의 주변 함. (예를 들어, CD40, LFA3, ICOSL, 4-1BB, OX40L, TL1A, PD-L1,하지만 CD80 및 CD86)이 세포는 MHC-I-, MHC-II-공동 자극 분자의 군중을 표현하고 전략적입니다 그들은 전문적인 감시 기능 16-18를 제공 혈액 조직 인터페이스에 위치. 이전의 연구에서는 내피 세포가 효율적으로 효과기 / 메모리 있지만 나이브 아니라 T 세포 19-25 다시 자극 할 수 있음을 입증 하였다. 따라서, 내피 세포는 T 세포 활성화, 분화, 메모리 및 공차 16,17,26 로컬 영향력 말초 조직 내의 적응성 면역 반응의 이펙터 단계에 고유 APC의 역할을하는 것으로 보인다. 크리시험 관내에서 배양 학적 때, 내피 세포는 사실상 평면 세포 표면을 형성하고 (형광 단백질 기자 예) 형질 용이하다. 이러한 기능은 세포 - 세포 상호 작용 19,27 동안 위상 역학의 높은 시공간 해상도 이미징에 이상적입니다. 따라서 내피 세포는 응답 (그림 1C) (19, 20)를 항원 인식을 운전하고 조절하는 분자 / 세포 내 리모델링 메커니즘 연구를위한 뚜렷하게 적합 생리적 '평면 세포 APC'모델이 될 수 있습니다.
이전 접착 및 transendothelial 마이그레이션 27시 백혈구 - 내피 상호 작용의 세부 사항을 공부 (세포막과 세포질의 형광 단백질 업체들과 내피 세포의 형질 전환 포함) 보완 이미징 기술을 설립, 백혈구가 적극적으로 동적으로 내피 세포의 표면을 검사 것으로 나타났다 삽입서브 마이크론 규모의 D 후퇴는 굴지 풍부한 원통형 돌기 (~ 직경과 깊이 200 ~ 나노 미터)는 invadosome 형 돌기 (즉, 'ILPs') 27, 28라고합니다. 이 촬상 방법은 상기보고 (19, 20)와 같은 T 세포 - 내피 면역 시냅스 높은 시공간 해상도의 영상화를위한 첫번째 방법을 개발하기 위해 내피 APC 기능을 활용 여기서는 더 설명하는 프로토콜들의 생성에 따라 확대되었다. 이 신규 한 평면 셀룰러 APC 모델로부터 유도 중앙 결과는 T 세포의 Ag ILPs 초기 탐지를 촉진 및 후속 시그널링을 모두 유지하는 기능을한다는 것이다. 실제로, (안정화 및 칼슘 플럭스 초기에 대응하여 발생한되었다), TCR 및 활성 신호 등 PKC-Q, ZAP-70, 포스 및 HS1의 암시 분자 쇼 농축 여러 ILPs의 배열. 따라서 ILPs는 TCR 시그널링에 마이크로 입체 생리적 등가를 나타내는 것평면 이중층 모델에서 본 클러스터. 이 방법은, 따라서 민감하게 밝혀 / 보고서 분자 및 건축 (및 생체 역학 묵시적) 역학 그렇지 않으면 감지되지.
본원에 기재된 방법은 적응성 면역 반응의 기본 메커니즘을 심문하는 능력을 향상시키기 위해 전문 APC 인공 APC 기판 모델 사이의 갭을 가교에 유용 할 것이다. 여기서 포커스는 CD4 +받은 Th1 형 이펙터 / 메모리 셀의 활성화에 있지만 후술하는 바와 같이,이 기본 방법은 용이하게, T 세포 유형 및 Ag로 광범위한 연구를 수정할 수있다.
프로토콜
이 프로토콜에 설명 된 모든 실험은 기본 인간 T 세포 및 시판 차 인간의 내피 세포 인체를 이용한 (피부 또는 폐 미세 혈관되는 EC) .ANY 연구 프로토콜은 기관 검토위원회의 승인을 받아야한다 서면 동의서가에서 제공해야합니다으로 실시하고 있습니다 각 혈액 기증자. 이 프로토콜을 사용하여 수행 실험 베스 이스라엘 집사 의료 센터의 IRB 승인했다.
1. 준비 인간의 CD4 +받은 Th1 이펙터 / 메모리 T 세포
- 알코올과 정맥을 닦아, 기증자의 팔에 지혈대를 적용하고 바늘을 삽입합니다. 천천히 항응고제로 EDTA를 사용하여 vacutainer에 혈액 15ml를 그립니다. 혈액 인출되었을 때, 바늘을 제거하기 전에 지혈대를 푼다. 즉시 바늘을 제거 할 때 멸균 거즈로 상처 압력을 적용합니다.
- 50 ML 튜브에 혈액을 전송합니다. 1 희석 (최종 부피 30 ㎖) : 1 실온에서 RPMI-1640을 추가합니다. 조심스럽게 희석 오버레이이러한 실온에서 피콜 - 페이크로 림프구 미리 필터링 된 절연 매체의 15 ml에 포함 된 두 개의 50 ㎖ 튜브 위에 D 혈액입니다.
- 스윙 버킷 로터에서 1,200 XG에 실온에서 30 분 동안 원심 분리하여 그라데이션. (RPMI-1640 500 ㎖, 50 ㎖의 FCS, 5 ml의 페니실린 / 스트렙토 마이신)을 T 세포 배지를 원심 분리하여 제조한다.
- 원심 분리기에서 50 ml의 튜브를 제거한 후, 4 층을 관찰 : 적혈구의 펠릿을 바닥에서 페이크, 백혈구 (림프구 포함) 세포 및 혈장을 포함 셀 층. 조심스럽게 50 ㎖ 팔콘 튜브에서 파스퇴르 피펫 및 전사와 백혈구 층을 제거한다.
- (20 ㎖까지) RT-RPMI 1460을 첨가하고, 1200 x g에서 5 분 동안 실온에서 원심 분리하여 백혈구 층을 세척한다. T 세포 배지 1 ㎖로 백혈구를 재현 탁. 1.5 ㎖의 원심 분리 관에 250 μL T 세포 매체에 1 ml의 세포 현탁액의 5 μl를 추가하고 부드럽게 위아래로 피펫으로 혼합한다.
- 25 μL를 희석 추가25 μL 0.4 % 트리 판 블루에 D 세포 현탁액. 표준 혈구의 각 측면에 혼합물의 10 μl를 추가합니다.
- 저전력 광학 현미경에 혈구를 놓습니다. 10X 목표를 사용하면 트리 판 블루 염료를 제외하고 혈구의 양쪽의 중앙 광장에 존재하는 한 살아있는 세포의 수를 계산합니다.
- 세포 농도를 계산하기 위해, 100 (희석 배수)에 의해 2 제곱의 평균을 곱하는 곱셈 후 10 4 세포 / ml의 수를 얻었다.
- T 세포 배지에서 0.5 × 106 세포 / ml에 최종 농도를 조정. 1 μg의 최종 농도를 추가 / 세포 superantigens 박테리아 포도상 구균 엔테로 톡신 B (SEB) 독성 쇼크 증후군 톡신 1 (TSST) 각각은 ML. 72 시간 (37 ℃, 5 % CO 2)를위한 배양은 CD4 + T 세포의 집단을 확대.
- 펠릿 T 세포 (1,200 XG, 5 분)와 T 세포 배지에서 0.5 × 106 세포 / ml로 재현 탁인간 IL-15 (20 NG / ㎖)의 첨가. 전송 T150 플라스크에 림프구. 필요에 따라 전체 매체 IL-15 / 매일 24 ~ 48 시간을 분할 세포를 확장 계속 (미디어 컬러를 기반으로, 즉, 미디어가 약간 노란색 분홍색에서 회전 할 때마다) 그 후. 최대 15 일 동안 결과 림프구 인구를 유지한다.
참고 : 디자인으로,이 프로토콜을 활성화하고 특히 확장 SEB와 TSST에 반응하는 CD4 + T 세포의 부분 집합 후받은 Th1과 같은 이펙터 / 메모리 표현형으로 그들을 몰 것이다. 다른 백혈구 생존 쉽게 유동 세포 계측법에 의해 평가 될 수있는 단계로 1.10 세포가 적어도 95 % CD4 +, CD45RO + T 세포 19 이도록, 이러한 조건에서 성장하지 못한다. 원하는 경우, 추가의 정제가 용이하게 상업적으로 입수 가능한 항체 / 마그네틱 비드 기반 양성 또는 음성 선별 키트를 통해 달성 될 수있다.
2. 기본 인간의 내피 세포 배양 시작
- 코트 무균 조건에서 PBS에 피브로넥틴 (FN) 20 μg의 / ㎖와 T25 플라스크. 30 ~ 60 분 동안 실온에서 둡니다. FN를 제거하고 5 ㎖를 완전 배지를 추가 (내피 기초 배지 (EBM-2) 매체 내피 세포 성장 매체 (EGM-2) singlequots 보충). (37)에 사전 품어 적어도 30 분 동안 ° C 세포 배양 인큐베이터.
- 2 ~ 3 분 ~에 대한 가끔 교반과 함께 37 ° C의 물을 욕조에 냉동 인간의 폐 또는 피부 미세 혈관 내피 세포 (HLMVECs 또는 HDMVECs)의 병을 해동. 즉시 미리 예열 미디어를 포함하는 T25 플라스크에 세포를 전송합니다. 부드럽게 소용돌이와 37 ° C에서 인큐베이터에있는 장소.
- ~ 4-6 시간 후 미디어를 변경합니다. 미디어를마다 약 48 시간 (또는 매체는 약간 노란색이되면) 판은 ~에 도달 할 때까지 90-95%의 포화 상태 변경을 계속합니다.
3. 일반 분할 및 내피 세포의 확장
- ~ 90 ~ 95 포화 상태에 세포를 성장. 이 2-5 일이 소요될 수 있습니다. 분할의 경우,미디어를 제거하고 PBS로 씻어. PBS를 제거하고 신선한 1X 트립신의 최소 볼륨 (T25 0.5 ml의 또는 T75 1.5 ml)로 교체합니다. 부드럽게 트립신 모든 표면을 커버하는 소용돌이 친다. 37 품어 ~ 5 분 동안 C를 °. 저전력 광 현미경을 사용하여 플레이트로부터 세포의 분리를 감시한다.
- 세포의 대부분은 반올림 또는 분리 나타날 때, 미리 가온 완전한 EGM-2 배지 (추가 트립신 볼륨에 비해, IE) 5 부피를 추가하고 부드럽게 세포를 분리 플라스크의 표면 위에 피펫.
- 1.6-1.7에 기재된 바와 같이 내피 세포 혈구 카운트. 원심 분리에 의해 세포 (5 분, 1,200 XG)를 펠렛. 상층 액을 제거합니다. 미리 예열 완료 EGM-2 MV 미디어 첨가하여 ml의 당 0,500,000 세포에 농도를 조정합니다.
- 유지 보수를 위해 해당 FN 코팅 접시 또는 플라스크에 세포의 분취 량을 전송합니다. 부드럽게 소용돌이와 인큐베이터에 배치합니다. 도금의 6 ~ 12 시간 내에서 미디어를 변경합니다. 미디어 소매일 48 시간 후에 약을 변경할 수 ULD.
4. 내피 세포 형질
참고 : 기본 내피 세포는 가장 일반적인 화학, 전기 방법으로 형질 전환에 불응 있습니다. 아래에서 설명하는 핵 형질 전환 기반의 방법은 상대적으로 높은 형질 전환 효율 (~ 50~70%) 수 있습니다. 효과적인 다른 방법은 적절한 바이러스 벡터 (자료 표에 주석을 참조)에 의한 감염의 사용이다.
- (멸균 조건 중 하나와 같은 델타 T 판으로 현미경 배양 플레이트에서 PBS에 피브로넥틴 (FN) 20ug / ㎖와 90-95%의 confluency.Coat의 최종 밀도 HLMVECs 또는 HDMVECs의 T25이나 T75 플라스크 (필요에 따라) 준비 (2.1)과 함께 전술 한 바와 같이) 단계 6 대 24 구멍 세포 배양 플레이트 (의 웰 내에 배치 단계 5) 또는 12mm 원형 유리 커버 슬립.
- 각 24도에 현미경 문화에 대한 완벽한 EGM-2 배지 1 ㎖ platesor 0.5 ML을 추가하고에 판 평형가습 된 37 ℃ / 5 % CO 2 인큐베이터.
- 수확 및 단계는 실온에서 5 분 동안 1,200 XG에서 세포의 필요한 볼륨 (샘플 당 50 만 셀) 3.1-3.3.Centrifuge과 내피 세포를 계산합니다. 샘플 당 100 μL RT 핵 형질 감염 용액에 조심스럽게 세포 펠렛을 재현 탁.
- 1-5 μg의 DNA를 가진 세포 현탁액 100 μl를 결합합니다. 인증 큐벳에 세포 / DNA 현탁액을 전송; 샘플을 기포없이 큐벳의 바닥을 커버해야합니다.
주 : (번역 후 팔미 토 일화에 대한 신호를 포함 neuromodulin의 20 N 말단 아미노산을 통해) 세포막에 YFP 또는을 DsRed 타겟팅 구축해은 (단독 막 YFP 단독으로 또는 멤브레인을 DsRed) 단독으로 사용 된 또는 함께 동시 - 형질 세포질 부피 마커 (예를 들어, 막 YFP 및 가용성을 DsRed). 형광 단백질 마커의 많은 치환이 사용될 수있다. - 캡 큐벳을 닫습니다. 와 큐벳을 삽입세포 / 유전자 electroporator의 큐벳 홀더에 서스펜션과 전기 프로그램 S-005을 적용합니다. 프로그램이 완료되면 홀더에서 큐벳을 가져 가라.
- 큐벳에 전 평형 문화 매체 ~ 500 μl를 추가하고 부드럽게 핵 형질 전환 키트에있는 플라스틱 전송 피펫을 사용하여 큐벳에서 세포 현탁액을 제거합니다.
- 현미경 배양 플레이트를 사용하여 실험을 예열 매체 (단계 4.2에서 4.3 사이)를 포함하는 두 식기간에 균등 한 반응에서 세포 현탁액을 파티션. 24도 / 플레이트, 파티션 3 우물 사이에 동등하게 하나의 반응을 이용하여 실험.
- 12 ~ 16 시간 포스트 형질 다시 가습 37 ° C / 5 % CO 2 배양기에서 세포를 품어 및 미디어에게 4-6 시간을 변경합니다.
5. 라이브 세포 이미징 및 분석
- 준비 내피
- 날 0 : nucleofe를 통해 막 YFP 및 가용성을 DsRed와 차 HLMVECs을 공동 - 형질같은 ction의 기술은 살아있는 세포 이미징 배양 플레이트에 4 단계와 플레이트에 기재된.
- 1 일 : MHC-II의 발현을 유도하기 위해 IFN-γ (100 NG / ㎖)를 포함하는 새로운 매체와 매체를 교체합니다. 주 2. 기존 미디어 20 NG / ㎖ TNF-α의 첨가에 의해 형질 전환 된 세포를 자극한다.
- 3 일에 1 μg의와 내피 세포를 배양 / 박테리아 superantigens 각각 37에서 포도상 구균 독소 B (SEB) 및 독성 쇼크 증후군 독소 1 (TSST)를 ML 직전에 실험에 30 ~ 60 분 동안 C를 °. '-Ag'제어 조건에 대해이 단계를 생략합니다.
- 림프구 준비
- 단계 5.1.3와 병행하여, 버퍼 20 mM의 헤 페스 보충 (페놀 레드 무료 HBSS)을, pH 7.4의 0.5 % V가 / V 인간 혈청 알부민 (37)에 미리 예열 준비 기음. 배양 림프구의 샘플을 가지고 혈구 (단계 1.12-1.17)로 계산하여 밀도를 결정한다.
- 1에서 샘플 당 원심 분리기는 2 백만 셀,15 ML 원뿔 튜브에 실온에서 5 분 200 XG. 대기음 미디어 및 완충액 2 ㎖에 재현 탁 부드럽게 세포 펠렛은 세포 클러스터는 남아 있지 않도록.
- 1 mm의 재고 농도를 만들기 위해 DMSO에의 Fura-2 칼슘 염료에 resuspend의 신선한 나누어지는을 제거합니다.
- (2 μM 최종 농도) T 세포 현탁액의 Fura-2 스톡 용액 2 μl를 추가, 튜브 및 캡 염료의 균일 분산을 보장하기 위해 관을 반전시킴으로써 즉시 혼합한다. 37 품어 30 분 동안 C를 °.
- 단계 5.2.2에서와 같이 원심 분리기. 기음 버퍼와 신선한 버퍼의 20 ~ 40 μL에 부드럽게하지만 철저하게 재현 탁 림프구.
- 라이브 셀 이미징 설정 및 취득
주 : 다양한 시스템이 똑바로 반전 광 현미경에 라이브 셀 형광 이미징을 위해 사용될 수있다. 기본적인 요구 사항은 형광 광원과 필터, CCD 카메라, 전동식 전환 필터 및 셔터 가열 스테이지 (또는 microsc 포함OPE 장착 가열 챔버) 및 자동화 된 이미지 수집을위한 소프트웨어. 이 프로토콜 높은 개구 높은 배율 (즉, 40X는 63X) 오일 침지 렌즈는 필요한 공간 해상도를 달성하기 위해 요구된다. 특별한주의가 모든 필요한 380분의 340 nm의 여기 파장과 호환로의 Fura-2 기반 칼슘 이미징에 적합한 형광 원 및 렌즈를 선택하는데주의해야한다. (표준 녹색 및 적색 형광 필터 세트와 호환) 대안적인 접근법은 비 ratiomentic 칼슘 성 염료로 사용될 수있다 (예를 들면, FLUO-4, 루비로드-3),이 정확하게 칼슘 플럭스를 정량 만 상대를 제공 할 수 있지만 / 양적 판독.- 현미경 시스템을 켭니다 (작업, 현미경, CCD 카메라, 필터 휠과 크세논 램프를위한 PC).
- 지정된 소프트웨어를 엽니 다.
- 자동화 된 멀티 채널 시간 경과 이미징을위한 설정 현미경 / 소프트웨어. 광고의 순차적 인 인수를 포함ifferential 간섭 대비 (DIC), 표준 녹색 형광, 표준 빨간색 형광 및 표준 340 및 380 nm의 여기의 Fura-2 이미지. 10 ~ 30 초와 20 ~ 60 분 ~ 총 기간 동안 획득을위한 간격을 설정합니다.
- 의 Fura-2 영상에 대한 노출 시간을 설정합니다.
- 신선한 목적 기름을 추가하고 가열 단계 어댑터에 버퍼의 0.5 ml의를 포함하는 현미경 접시를 탑재하고 즉시 37 평형을 켜 ° C (~ 2-3 분 소요됩니다).
- 20 μL 피펫을 사용하여 장착 된 현미경 접시 챔버에 Fura2로드 림프구 휴식 추가합니다.
- 시야의 영상을 켭니다. 접안 렌즈에 빛의 경로를 선택합니다. miscoscope 접시의 바닥과 접촉 목적을 가지고 거친 초점 손잡이를 사용합니다. 접시의 바닥에 정착 한 T 세포에 초점을 접안 렌즈와 미세 초점 노브를 사용합니다.
- 적어도 10 세포를 포함하는 필드를 선택하는 XY 스테이지 제어를 사용한다. 기피오버 북적이는 영상 아티팩트를 만듭니다으로 필드와 세포 덩어리.
- 시야 전환 광원을 형광등합니다. CCD 카메라에 접안 영상에서 전환합니다. 설정 파라미터 획득 (예를 들면, 노출 시간, 검출기 이득 및 비닝). Fura2-340 및 Fura2-380 이미지 쉬고 소프트웨어를 사용하여 획득 (보통 ~ 200 ~ 밀리의 범위에서, 각각에 대해 동일한 노출 시간에서 시작).
- 각각의 림프구에 대한 Fura2-340 / Fura2-380을 계산하는 단계 5.4.1에서 설명하는 방법을 사용합니다. , 및 Fura2-340 Fura2-380 노출 시간을 조절하는 화상을 취득하고, 평균 값이 1에 가까운 비율을 계산하는 단계까지의 반복을 반복 수행한다.
- MEM-YFP 및을 DsRed에 대한 노출 시간을 설정합니다.
- miscroscope 요리와 단계 5.3.3.1에서 사용되는 현미경 접시를 교체하는 것은, 형질 전환 활성화 및 SAG 치료 (또는 치료; 제어)를 포함하는 세포 배양 인큐베이터 (단계 4.5에서 HLMVECs 또는 HDMVECs.1). 빠르게, 미디어를 제거 미리 예열 버퍼의 ~ 1 ml를 첨가하여 한 번 씻어 일회용 전송 피펫을 사용합니다. 기음은 다음 버퍼의 0.5 ml를 추가합니다.
- 밝은 형광 긍정적 인 형질 내피 세포가 존재하고 잘 형성 세포 간 접합 건강한 표시되는 필드를 확인합니다.
- MEM-YFP 및을 DsRed에 대한 인수 매개 변수 (예를 들어, 노출 시간, 검출기 이득 및 비닝)를 조정합니다. 각 채널의 평균 형광 신호 강도가 25 % 검출기의 동적 범위의 75 % 사이에 떨어지는 있는지 확인하십시오.
- 의 Fura-2 영상에 대한 노출 시간을 설정합니다.
- 라이브 셀 이미징 실험을 실시한다.
- 기준을 설정하기 위해 이미지의 여러 간격을 이미지 수집을 시작하고 캡처하는 자동화 된 소프트웨어를 사용합니다.
- 획득 중에 소량 (P-5의 선단부를 삽입하여 현미경 접시 촬상 영역의 중심에 (단계 5.2), 농축의 Fura-2로드 된 림프구 ~ 5 μL를 적용또는 P-20) 가까이 천천히 목적과 배출의 중심 미디어로 피펫.
- 림프구는 이미지 필드에 정착으로, 초점 미세 조정이 T 세포 내피 세포 인터페이스 (면역 시냅스가) 초점면에서 유지되는 것을 보장 할 수 있습니다. (40)와 63X 목표와 함께, ~ 필드 당 10 ~ 20 세포가 최적입니다. 적은 수의 세포 이미징 분야의 단계를 반복 5.3.4.2에서 관찰하는 경우.
- 실험 목적 관측 간격 경쟁 후 최대 칼슘 플럭스 /의 Fura-2 시그널링 신호를 유도하기 위해 2 μM의 최종 농도로 (5.3.4.2 에서처럼 기술을 사용하여) 이미징을 계속하고 즉시 miscoscope 접시에 직접 이오 노마 이신 피펫 (즉 보정 수단은, 분석 5.4 참조.).
- 실험 목적 관측 간격을 5.3.4.4after 대안이 경쟁에 따라, 즉시 버퍼 대기음 0.5 ml의 정착액 용액 (PBS에 3.7 % 포름 알데히드)에 5 분으로 대체RT는, PBS로 3 회 세척 하였다. 그런 다음 6 단계로 진행합니다.
- 라이브 셀 이미징 분석
주 : 취득한 파일을 저장 한 후, 이들이 직접 분석 할 수 있거나, 오프라인 이미지 분석 소프트웨어 애플리케이션의 다양한 분석을 위해 반출. ImageJ에 거의 모든 수집 소프트웨어 패키지를 무료로 사용할 수와 호환이 특히 중요한, 매우 다양한 패키지입니다. 단계 5.1에서 5.3 사이에서 설명한 촬상 실험 디자인은 림프구 및 내피 APC 부재와 동족 처짐의 존재 사이의 상호 작용의 높은 공간 및 시간 해상도 역학을 수득한다. 세포 형태 학적 / 시그널링 역학의 촬상 데이터를 다루는 경우에 거의 무제한의 분석이 가능하다. 이 특정 프로토콜에 설명 된 특정 목적 배위 림프구 이동과 함께 동적 (즉, 반응 속도 및 세포 내 칼슘 플럭스의 레벨) 신호를 정량화한다알은 특정 기능 (예, ILPs / PODO-인쇄)에 초점을 맞춘 면역 시냅스 구조의 변화. 별도의 표준 및 비표준의 예 분석 (즉, 이들 실험 / 문의 전용으로 개발).- 림프구 칼슘 플럭스를 측정
- 림프구의 추가 이전에 취득한 초기 Fura2-340 (340 nm의 EX-510 나노 EM) 및 Fura2-380 (380 nm의 EX-510 나노 EM) 이미지를 선택합니다. 각각의 채널에 대한 시계열 화상 모두로부터 이들을 감산 디지털 배경 이미지로 사용하고이.
- 때마다 포인트 배경 - 감산 Fura2-340와 배경 - 감산 Fura2-380 이미지 (즉, 340 nm의 EX-510 nm의 EM-배경 / 380 nm의 EX-510 nm의 EM-배경)의 디지털 비의 이미지를 만들 수 있습니다.
- 해당 소프트웨어 그리기 도구를 선택합니다. 나는의 원형 영역을 그릴 화면을 클릭각 림프구의 주위에 (ROI)을 nterest. 다음은 각각의 림프구 및 시간 프레임의 픽셀 평균 비율 값을 생성합니다.
- 적절한 소프트웨어 애플리케이션 (예를 들어, 스프레드 시트 프로그램)를 이용하여 시간의 함수로서 계산 된 비율을 플롯. 당 분야의 모든 림프구의 비율 값을 합산하여 각 시점에 대한 림프구의 수에 의해 그 값을 나누어 실험의 평균 칼슘 플럭스를 계산
- lympocyte 마이그레이션 추적 분석을 실시한다.
- 각각의 영상에서 DIC 채널을 사용 적절한 셀 추적 소프트웨어 애플리케이션 (예 ImageJ에)를 사용하여 T 세포의 세포 이동을 분석. ImageJ에 셀 추적 플러그인을 사용하여 수동으로 각 프로그레시브 프레임에서 클릭하여 각 프레임에서 각 셀의 중심을 식별합니다.
- 그 결과 일련 XY 좌표를 사용하여 (즉, 마이그레이션 경로의 흔적은) 평균 속도 (총 거리 마이그레이션 / 총 간격 (을)를 계산촬상 F) 및 비틀림 (총 거리) / 최초 및 최종 이미지의 셀 위치 사이의 직선 종단 간 거리를 이주.
- 셀별로 칼슘 플럭스 (5.4.1)와 이러한 동역학 매개 변수를 교차 상관.
- IS 내 PODO 인쇄 / ILP 밀도를 평가
- 각각의 T 세포에 형성 ILP의 총 수를 계산 정의되는 간격 (예를 들면, T 세포의 5 분 후 첨가). 이러한 림프구 접착의 사이트에서 내피 APC에 세포질을 DsRed에 다크 서클과-지역화 공동 이산 미크론 크기의 형광 막 YFP 반지를 식별 할 수 있습니다.
- 셀별로 칼슘 플럭스 (5.4.1)와 역학 결과 'ILP 인덱스'교차 상관.
- PODO 인쇄 / ILP 수명을 측정합니다.
- 주어진 각 PODO 인쇄 / ILP를 들어 ILP를 볼 때 마지막 지점으로의 수명을 계산입니다 - 시점을 때 PODO 인쇄 / ILP Fi를첫 등장. 평균 ILP는 모두 당 수명.
- 셀별로 칼슘 플럭스 (5.4.1)와 이러한 역학 수명 교차 상관.
- 초기 ILP 형성 및 칼슘 플럭스 사이의 시간적 관계를 평가.
- 각 림프구 칼슘은 제 19 기준 이상으로 상승하는 시점 (프레임)을 식별한다.
- 각 림프구를 들어 제 PODO - 인쇄 / ILP가 나타나는 시점을 식별한다.
- 각 림프구의 초기 PODO 인쇄 / ILP와는 초기 칼슘 플럭스 시각을 감산하여 '시간 오프셋'을 계산한다. 필드의 모든 림프구에 대한 값을 평균. 양의 값은 음수가 반대를 나타내는 반면, ILP 형성 칼슘 플럭스 앞에 나타냅니다.
주 : (1) 한 바와 같이 이러한 실험 용이 시판 평행 벽 흐름 촬상 챔버를 사용하여 생리적으로 중요한 층류 전단 흐름 하에서 수행 될 수있다9.
- 림프구 칼슘 플럭스를 측정
6. 고정 셀 이미징 및 분석
- 고정 엔드 포인트 T 세포 - 내피는 형성과 염색입니다
- (1)에 설명 된대로 내피 세포를 준비 T 세포를 준비 (- / + SAG) 단계 5.1에서와 같이 (형질 단계 5.1.1는 선택 사항입니다). 배양 림프구의 샘플을 가지고 혈구 (1 절)로 계산하여 밀도를 결정한다.
- 3 분 동안 200 XG에 15 ML 원뿔 튜브와 원심 분리기에 적어도 3 × 10 5 림프구 / 샘플 림프구 배양 볼륨 상당을 전송합니다. 상층 액을 제거하고 버퍼에서 림프구 펠릿 (단계 5.2.1) 6 × 10 5 림프구 / ㎖의 농도를 재현 탁.
- 세포 배양 인큐베이터에서 내피 세포를 제거하고 연속적으로 흡인 미디어를 (한 번에 하나의 샘플을 진행) 및 림프구 서스펜션 (3 × 10 5 림프구 / 샘플) 0.5 ㎖로 교체하고 37에 교체 ° C 전ncubator.
- 적절한 배양 시간 후, 위의 우물에서 대기음 매체를 언급하고 (24 웰 플레이트 ~ 300-500 μL에서, 예를 들어) 완전히 샘플을 커버 할 수있는 충분한 정착액 솔루션 (PBS 3.7 % 포름 알데히드)를 추가합니다. 5 ~ 10 분 동안 실온에서 품어.
- PBS로 샘플을 3 회 씻어. RT에서 60 분간 일차 항체를 첨가하여 염색 (목록 참조). 일차 항체가 세포 내 단백질에 관한 경우, 부가적인 단계가 투과성으로 완전히 RT에서 1 분 동안 샘플을 커버하기에 충분한 투과성으로 용액 (PBS에 0.01 % 트리톤-100)를 첨가함으로써 수행 될 필요가있다. PBS로 샘플을 3 회 씻어. 실온에서 60 분 동안 (일부의 경우 병용 형광 팔로이 딘에) 적절한 이차 항체를 추가합니다.
- 이미지 슬라이드에 원형 유리 커버 슬립을 탑재합니다. 고정 엔드 포인트 T 세포 - 내피는 형성과 염색입니다. 현미경 스테이지에 샘플을 포함하는 이미지 슬라이드 영상 장소를 시작하고 63X 오일을 선택하려면목표. 신선한 침수 오일을 적용합니다.
- 초점면의 위치를 밝은 필드 이미징 모드와 안구 렌즈를 사용합니다. 표면 형광로 전환 안구 렌즈를 통해 샘플을 검사합니다. 관심의 필드를 선택합니다. 레이저 스캐닝 모드로 전환합니다.
- 고속 스캔 모드를 사용하여 가능한 넓은 분야 개별적으로, 이상적으로는, 특정 신호 강도에 도달하도록 신호를 최적화하기 위해, 레이저 파워와 각 채널의 게인을 조정에서 작동 ~ 25 % 및 동적 범위 이상 75 % 이상 감지기.
- 수동 초점 제어 기능을 사용하여, 신속하게 Z 축을 통해 스캔 절편의 상한 및 하한 (전형적으로 모든 정보 ~ 15 ㎛의 두께를 포함한다)를 식별. ~ 0.2 내지 1.0 ㎛ 인 범위에서 Z 축 방향 단면의 두께를 선택한다.
- 마지막으로, 줌 / 관심 및 행동 검사의 특정 영역에 촬상 영역을 자르기. 매우 밝고 특정 형광 SI를 갖는 이외에도샘플 gnal, 고해상도 3 차원 영상을 획득하는 검사 및 인수 매개 변수 조정을의 반복을 필요로한다. 목표는 상당한 광 표백없이 최대 XY 및 Z 축 해상도를 얻는 것이다.
- 질적으로 적절한 소프트웨어 애플리케이션 (예를 들어, 이미지 J)를 통해 생성 된 디지털 광학 부의 3 차원 재구성을 수행함으로써 3D IS의 토폴로지의 토폴로지를 분석한다. 유사한 응용 프로그램을 통해 정량적으로 형광 신호 분포를 평가 (예를 들어, 피어슨의 공동 현지화 및 상호 형광 강도 라인 스캔 분석과 직교보기).
결과
내피 세포를 사용하고 생리적 복잡성 및 전문 장갑차의 변형성을 가진 평면 지질 이중층 모델의 해상도의 이점을 조합 한 새로운 촬상 방식은 (도 1)을 개발 하였다. (2)이 관찰] 이주 칼슘 플럭스 및 위상 역학의 예를 제공 도표 접근. 내피에 처짐의 부재 하에서, SAG 특정 CD4 +받은 Th1 림프구 빠르게 편광 확산 칼슘 플럭 싱없이 ...
토론
전반적으로,이 프로토콜은 I) 파악 하였다 생리적 장갑차로 내피 세포를 조사하기위한 방법을 설명하고, II) '평면 세포 APC 모델'의 새로운 유형으로. 전자와 관련하여, 이는 점차 적응 면역 반응을 형성하는데 16-18 (조혈 장갑차에 비해, IE)를 둘레 비 조혈 (또는 '기질') 장갑차 중요한, 비 중복 역할을하는 것으로 인식되고있다. 이러한 '세미 프로'장갑차, 혈...
공개
The authors have nothing to disclose.
감사의 말
We thank Dr. Peter T. Sage for his assistance in generating some of the representative images. This work was supported by an NIH R01 grant to C.V.C. (HL104006).
자료
| Name | Company | Catalog Number | Comments |
| BD Vacutainer stretch latex free tourniquet | BD Biosciences | 367203 | |
| BD alcohol swabs | BD Biosciences | 326895 | |
| BD Vacutainer Safety-Lok | BD Biosciences | 367861 | K2 EDTA |
| BD Vacutainer Push Button Blood Collection Set | BD Biosciences | 367335 | |
| RPMI-1640 | Sigma-Aldrich | R8758-1L | |
| Ficoll-Paque | Sigma-Aldrich | GE17-1440-02 | Bring to RT before use |
| FCS-Optima | Atlanta Biologics | s12450 | Heat inactivated |
| Penicillin-Streptomycin | Sigma-Aldrich | P4458-100ML | |
| Trypan blue | Sigma-Aldrich | T8154-20ML | |
| staphylococcal enterotoxin B | Toxin Technology | BT202RED | Stock solution 1mg/ml in PBS |
| toxic shock syndrome toxin 1 | Toxin Technology | TT606RED | Stock solution 1mg/ml in PBS |
| human IL-15 | R&D Systems | 247-IL-025 | Stock solution 50ug/ml in PBS |
| PBS | Life Technologies | 10010-049 | |
| Fibronectin | Life Technologies | 33016-015 | Stock solution 1mg/ml in H20 |
| HMVEC-d Ad-Dermal MV Endo Cells | Lonza | CC-2543 | Other Human Microvascular ECs can be used, i.e. HLMVECs |
| EGM-2 MV bullet kit | Lonza | CC-3202 | |
| Trypsin-EDTA | Sigma-Aldrich | T-4174 | Stock solution 10x, dilute in PBS |
| amaxa-HMVEC-L Nucleofector Kit | Lonza | vpb1003 | Required Kit for step 4 |
| IFN-g | Sigma-Aldrich | I3265 | Stock solution 1mg/ml in H20 |
| TNF-alpha 10ug, human | Life Technologies | PHC3015 | Stock solution 1mg/ml in H20 |
| phenol Red-free HBSS | Life Technologies | 14175-103 | |
| Hepes | Fisher Scientific | BP299-100 | |
| Calcium Chloride | Sigma-Aldrich | C1016-100G | Stock solution 1M in H20 |
| Magnesium chloride | Sigma-Aldrich | 208337 | Stock solution 1M in H20 |
| Human Serum albumin | Sigma-Aldrich | A6909-10ml | |
| Immersol 518 F fluorescence free Immersion oil | Fisher Scientific | 12-624-66A | |
| Fura-2 AM 20x50ug | Life Technologies | F1221 | Stock solution 1mM in DMSO |
| pEYFP-Mem (Mem-YFP) | Clontech | 6917-1 | |
| pDsRed-Monomer (Soluble Cytoplasmic DsRed) | Clontech | 632466 | |
| pDsRed-Monomer Membrane (Mem-DsRed) | Clontech | 632512 | |
| pEGFP-Actin | Clontech | 6116-1 | |
| Alexa Fluor 488 Phalloidin | Life Technologies | A12379 | |
| Formaldehyde solution 37% | Fisher Scientific | BP531-500 | Toxic, use fumehood |
| Triton X-100 | Sigma-Aldrich | X100-5ML | |
| Falcon 15mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-70C | |
| Falcon 50mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-49A | |
| Falcon Tissue Culture Treated Flasks T25 | Fisher Scientific | 10-126-9 | |
| Falcon Tissue Culture Treated Flasks T75 | Fisher Scientific | 13-680-65 | |
| Corning Cell Culture Treated T175 | Fisher Scientific | 10-126-61 | |
| Glass coverslips | Fisher Scientific | 12-545-85 | 12 mm diameter |
| Falcon Tissue Culture Plates 24-well | Fisher Scientific | 08-772-1 | |
| Delta-T plates | Bioptechs | 04200415B | |
| Wheaton Disposable Pasteur Pipets | Fisher Scientific | 13-678-8D | |
| 1.5 ml Eppendorf tube | Fisher Scientific | 05-402-25 | |
| ICAM1 mouse anti-human | BD Biosciences | 555509 | |
| HS1 mouse anti-human | BD Biosciences | 610541 | |
| Anti-Human CD11a (LFA-1alpha) Purified | ebioscience | BMS102 | |
| Anti-Human CD3 Alexa Fluor® 488 | ebioscience | 53-0037-41 | |
| Anti-MHC Class II antibody | Abcam | ab55152 | |
| Anti-Talin 1 antibody | Abcam | ab71333 | |
| Anti-PKC theta antibody | Abcam | ab109481 | |
| phosphotyrosine (4G10 Platinum) | Millipore | 50-171-463 | |
| Nucleofector II | Amaxa Biosystems | Required electroporator for step 4 | |
| Zeiss Axiovert | Carl Zeiss MicroImaging | ||
| Zeiss LSM510 | Carl Zeiss MicroImaging | ||
| Zeiss Axiovison Software | Carl Zeiss MicroImaging | ||
| NU-425 (Series 60) Biological Safety Cabinet | NuAIRE | Nu-425-600 | |
| Forma STRCYCLE 37 °C, 5% CO2 Cell culture Incubator | Fisher Scientific | 202370 | |
| Centrifuge 5810 | Eppendorf | EW-02570-02 | |
| Hemocytometer | Sigma-Aldrich | Z359629 | Bright-Line Hemocytometer |
| Isotemp Waterbath model 202 | Fisher Scientific | 15-462-2 |
참고문헌
- von Andrian, U. H., Mackay, C. R. T-cell function and migration. Two sides of the same coin. N. Engl. J. Med. 343 (14), 1020-1034 (2000).
- Springer, T. A. Adhesion receptors of the immune system. Nature. 346 (6283), 425-434 (1990).
- Shaw, A. S., Dustin, M. L. Making the T cell receptor go the distance: a topological view of T cell activation. Immunity. 6 (4), 361-369 (1997).
- Monks, C. R., Freiberg, B. A., Kupfer, H., Sciaky, N., Kupfer, A. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395 (6697), 82-86 (1998).
- Delon, J., Stoll, S., Germain, R. N. Imaging of T-cell interactions with antigen presenting cells in culture and in intact lymphoid tissue. Immunol Rev. 189, 51-63 (2002).
- Brossard, C., et al. Multifocal structure of the T cell - dendritic cell synapse. Eur J Immunol. 35 (6), 1741-1753 (2005).
- Dustin, M. L. The cellular context of T cell signaling. Immunity. 30 (4), 482-492 (2009).
- Balagopalan, L., Sherman, E., Barr, V. A., Samelson, L. E. Imaging techniques for assaying lymphocyte activation in action. Nat Rev Immunol. 11 (1), 21-33 (2011).
- Cebecauer, M., Spitaler, M., Serge, A., Magee, A. I. Signalling complexes and clusters: functional advantages and methodological hurdles. J Cell Sci. 123, 309-320 (2010).
- Oddos, S., et al. High-speed high-resolution imaging of intercellular immune synapses using optical tweezers. Biophys J. 95 (10), L66-L68 (2008).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285 (5425), 221-227 (1999).
- Bunnell, S. C., et al. T cell receptor ligation induces the formation of dynamically regulated signaling assemblies. J Cell Biol. 158 (7), 1263-1275 (2002).
- Yokosuka, T., et al. Newly generated T cell receptor microclusters initiate and sustain T cell activation by recruitment of Zap70 and SLP-76. Nat Immunol. 6 (12), 1253-1262 (2005).
- Seminario, M. C., Bunnell, S. C. Signal initiation in T-cell receptor microclusters. Immunol Rev. 221, 90-106 (2008).
- Dustin, M. L. Supported bilayers at the vanguard of immune cell activation studies. J Struct Biol. 168 (1), 152-160 (2009).
- Martinelli, R., Carman, C. V., Bradshaw, R. A., Stahl, P. Lymphocyte Endothelilal Interactions. Encyclopedia of Cell Biology. , (2015).
- Choi, J., Enis, D. R., Koh, K. P., Shiao, S. L., Pober, J. S. T lymphocyte-endothelial cell interactions. Annu Rev Immunol. 22, 683-709 (2004).
- Marelli-Berg, F. M., Jarmin, S. J. Antigen presentation by the endothelium: a green light for antigen-specific T cell trafficking?. Immunol Lett. 93 (2-3), 109-113 (2004).
- Sage, P. T., et al. Antigen recognition is facilitated by invadosome-like protrusions formed by memory/effector T cells. J Immunol. 188 (8), 3686-3699 (2012).
- Kumari, S., et al. Actin foci facilitate activation of the phospholipase C-gama in primary T lymphocytes via the WASP pathway . eLife. , (2015).
- Marelli-Berg, F. M., et al. Major histocompatibility complex class II-expressing endothelial cells induce allospecific nonresponsiveness in naive T cells. J Exp Med. 183 (4), 1603-1612 (1996).
- Ma, W., Pober, J. S. Human endothelial cells effectively costimulate cytokine production by, but not differentiation of, naive CD4+ T cells. J Immunol. 161 (5), 2158-2167 (1998).
- Perez, V. L., Henault, L., Lichtman, A. H. Endothelial antigen presentation: stimulation of previously activated but not naive TCR-transgenic mouse T cells. Cell Immunol. 189 (1), 31-40 (1998).
- Epperson, D. E., Pober, J. S. Antigen-presenting function of human endothelial cells. Direct activation of resting CD8 T cells. J Immunol. 153 (12), 5402-5412 (1994).
- Shiao, S. L., et al. Human effector memory CD4+ T cells directly recognize allogeneic endothelial cells in vitro and in vivo. J Immunol. 179 (7), 4397-4404 (2007).
- Marelli-Berg, F. M., Okkenhaug, K., Mirenda, V. A two-signal model for T cell trafficking. Trends Immunol. 28 (6), 267-273 (2007).
- Carman, C. V., et al. Transcellular diapedesis is initiated by invasive podosomes. Immunity. 26 (6), 784-797 (2007).
- Carman, C. V. Mechanisms for transcellular diapedesis: probing and pathfinding by 'invadosome-like protrusions'. J Cell Sci. 122 ((Pt 17)), 3025-3035 (2009).
- Dustin, M. L., Tseng, S. Y., Varma, R., Campi, G. T. T cell-dendritic cell immunological synapses. Curr Opin Immunol. 18 (4), 512-516 (2006).
- Saito, T., Yokosuka, T. Immunological synapse and microclusters: the site for recognition and activation of T cells. Curr Opin Immunol. 18 (3), 305-313 (2006).
- Gomez, T. S., et al. HS1 functions as an essential actin-regulatory adaptor protein at the immune synapse. Immunity. 24 (6), 741-752 (2006).
- Burbach, B. J., Medeiros, R. B., Mueller, K. L., Shimizu, Y. T-cell receptor signaling to integrins. Immunol Rev. 218, 65-81 (2007).
- Vicente-Manzanares, M., Sanchez-Madrid, F. Role of the cytoskeleton during leukocyte responses. Nat Rev Immunol. 4 (2), 110-122 (2004).
- Ma, Z., Janmey, P. A., Finkel, T. H. The receptor deformation model of TCR triggering. Faseb J. 22 (4), 1002-1008 (2008).
- Ma, Z., Sharp, K. A., Janmey, P. A., Finkel, T. H. Surface-anchored monomeric agonist pMHCs alone trigger TCR with high sensitivity. PLoS Biol. 6 (2), e43 (2008).
- Groves, J. T. Bending mechanics and molecular organization in biological membranes. Annu Rev Phys Chem. 58, 697-717 (2007).
- Xu, C., et al. Regulation of T cell receptor activation by dynamic membrane binding of the CD3epsilon cytoplasmic tyrosine-based motif. Cell. 135 (4), 702-713 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유