A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הדמיה בזמן אמת, כימות של פיתוח Biofilm פטרייתי באמצעות מערכת זרימת Recirculating דו-שלבית
In This Article
Summary
אנו מתארים את מכלול, המבצע, ועוצב ניקוי של מנגנון זרימה כדי התמונה פטרייתי ביופילמים בזמן אמת בזמן תחת זרימה. אנחנו גם מספקים ולדון אלגוריתמים כמותיים כדי לשמש על תמונות נרכשות.
Abstract
ב קנדידה הלוע התחתון, חברי קנדידה חייב לדבוק ולגדול על פני השטח הרירית אוראלי בעוד תחת השפעת זרימת הרוק. בעוד פותחו מודלים עבור הגידול תחת זרימה, רבות ממערכות אלה יקרים, או אל תאפשר הדמיה בזמן התאים נמצאים תחת זרימה. פיתחנו מנגנון הרומן זה מאפשר לנו תמונה את הצמיחה וההתפתחות של תאי קנדידה אלביקנס תחת זרימה בזמן אמת. כאן, אנו מפרטים הפרוטוקול על הרכבה ועל השימוש והתותח זרימה, כמו גם כימות של נתונים שנוצרו. אנחנו יכולים לכמת את קצבי התאים לצרף ולנתק מהשקופית, כמו גם לקבוע מדד של ביומסה בשקופית לאורך זמן. מערכת זו הוא חסכוני ורב -גונית לעבוד עם סוגים רבים של מיקרוסקופ אור, כולל מיקרוסקופ benchtop זול, מסוגל מורחב הדמיה פעמים בהשוואה למערכות אחרות זרימה. בסך הכל, זה מערכת תפוקה נמוכה יכול לספק מידע בזמן אמת מאוד מפורט על הגידול biofilm של מינים פטרייתי תחת זרימה.
Introduction
קנדידה אלביקנס (אלביקנס ג) הוא פתוגן פטרייתי הזדמנותית של בני אדם שיכולים להדביק סוגי רקמות רבים, כולל אוראלי משטחים הרירית, גורם קנדידה הלוע התחתון, וכתוצאה מכך איכות חיים נמוכה יותר עבור אנשים מושפעים1. ביופילמים היא מאפיין חשוב בפתוגנזה של ג אלביקנס, מחקרים רבים נעשו על היווצרות ועל תפקוד אלביקנס ג biofilms2,3,4, 5, שרבים מהם נערכו באמצעות חשמל סטטי (אין זרימת) במבחנה מודלים. עם זאת, אלביקנס ג חייב לדבוק ולגדול בנוכחות זרימת הרוק בחלל הפה. מערכות זרימה רבים פותחו כדי לאפשר לחיות תאים הדמיה6,7,8,9,10. מערכות זרימה שונים אלה עוצבו למטרות שונות, לכן לכל מערכת יש והחולשות שונים. מצאנו כי רבים מן הזרם מערכות מתאים אלביקנס ג היו יקרים, נדרש מתחם מפוברק חלקים, או יכול לא להיות עם תמונה במהלך הזרימה, היה צריך לעצור לפני הדמיה. לכן, פיתחנו מנגנון זרימת הרומן ללמוד אלביקנס ג ביופילמים תחת זרימה11. במהלך העיצוב של מנגנון הזרימה שלנו, עקבנו אלה השיקולים המרכזיים. ראשית, רצינו להיות היכולת לכמת את מספר היבטים biofilm הצמיחה וההתפתחות ב בזמן אמת ללא צורך את השימוש פלואורסצנט תאים (המאפשר לנו זנים מוטציה המחקר, מבודד קליניים יאומתו בקלות). שנית, רצינו כל החלקים יהיו זמינים מסחרית עם מעט שינויים לא (כלומר., אין ייצור מותאם אישית), ומאפשר לאחרים יותר בקלות לשחזר את המערכת שלנו, המאפשרות תיקונים קלים. שלישית, גם רצינו לאפשר עבור המורחבת הדמיה פעמים במחירים זרימה גבוהה יחסית. לבסוף, רצינו, לאחר תקופה של תאים לצרף המצע תחת זרימה, להיות מסוגל לפקח על צמיחה biofilm לאורך זמן ממושך ללא החדרת תאים חדשים.
שיקולים אלו הובילו אותנו לפתח את הבקבוק-שני recirculating מערכת הזרימה מאויר באיור1. שתי המבחנות מאפשרים לנו לפצל את הניסוי לתוך בשני שלבים, שלב מצורף שמושך מן הבקבוק מצורף נזרע תא ושלב הצמיחה המשתמשת מדיה ללא תא כדי להמשיך את הצמיחה biofilm ללא התוספת של תאים חדשים. מערכת זו מיועדת לעבודה עם חדר דגירה על המיקרוסקופ, עם השקופית, הצנרת לתו זה (2-5, איור 1) להצבה בתוך החממה, והניח כל שאר הרכיבים במיכל המשני גדול בחוץ מיקרוסקופ. בנוסף, קדירות פלטה עם רגש טמפרטורה המצורפת משמש כדי לשמור על תאים פטרייתי הבקבוקון קובץ מצורף ב- 37 מעלות צלזיוס. כמו זה הוא צואה, מערכת זו הוא מסוגל הדמיה רציפה במהלך הזרימה (יכול להיות מעל 36 h בהתאם לתנאים), ניתן להשתמש מיקרוסקופים סטנדרטי ביותר, כולל מיקרוסקופ benchtop ישר או הפוך. כאן, נדון ההרכבה, המבצע, ומספקים ניקוי על מנגנוני זרימה, כמו גם כמו כמה אלגוריתמים בסיסיים ImageJ כמותיים כדי לנתח קטעי וידאו לאחר ניסוי.
Protocol
1. להרכיב את המנגנון זרימה
- הגדר את החלקים המופיעים בטבלה של חומרים לפי התוכניות באיור 1 עם השיקולים בהמשך.
הערה: לנוחיותכם, הזרם המנגנון מחולק שני צדדים, הצד הירוק (הכל במעלה הזרם של השקופית כדי המבחנות מדיה), הכתום בצד (הכל במורד הזרם של השקופית כדי המבחנות מדיה).- ודא כי כל מנגנון זרימת אוויר חזק כדי למנוע דליפות, למעט הבלעדי של המבחנות מדיה (איור 1, 1). כדי לעשות זאת, חלות שרברבים הקלטת כל זכר השחלה לפני הרכבה חוץ את pulsation dampener (PD), בקבוק מסנן 2 מיקרומטר (פנסיון מלא), שאינן דורשות שרברבים הקלטת כמו gaskets גומי לשמור אותם אטום.
- החלת האוזן מלחציים-כל התאמה טקסוס זה בלחץ חיובי במהלך פעולה רגילה (קרי, במורד הזרם של המשאבה).
- להשתמש בצבע מקודד מעבדה קלטות לתייג את מיקומי שסתום עם A או G (עבור הקובץ המצורף וצמיחה, בהתאמה), המיקום משאבת המיקומים חיבור שקופיות, הקשר המסנן 0.2 µm.
- לקבוע אורך צינורות כדי לשמש מבוסס על המרחק בין מערכת זרימת מיקרוסקופ, לזכור כל זרימה המנגנון במורד הזרם של המשאבה על המבחנות (רוב הצד כתום) צריך להיות הכלילה משני. להוסיף כ- 1 מ' של צינורות נוספת נגד הזרם של השקופית (וגם רצוי המלכודת בועה) כדי למקם בתוך תא הדגירה מיקרוסקופ, זה מבטיח כי כל המדיה להגיע השקופית יהיה בטמפרטורה הנכונה.
- המקום מלכודת בועות קרוב ככל האפשר באופן סביר לשקופית, רצוי בתוך החדר הדגירה במהלך ניסוי (בועות לעיתים קרובות טופס לאורך הקיר אבובים;) עם זאת, זכור כי זה חייב להיות מחובר ואקום לפעול.
- ודא הצנרת בין את פנסיון מלא של 0.2 מסנן חד פעמיות מיקרומטר הוא בערך 0.5 מ'.
- הוספה כ 2 ס מ בר מגנטי מערבבים את כל הבקבוק מדיה.
- לקבל צורה כלשהי של תופסנים לצנרת לפעול כמו שסתומי סגירה (ועוצרי דימום יכול לשמש).
- קלות שימוש, שמור את המנגנון זרימה סלסלת autoclavable. זה יכול להיות מועיל שיהיה סל קטן השני ב אחד גדול יותר כדי לאפשר הפרדה קלה של הצד הירוק ואת הצד של תפוזים.
- עבור הבקבוק המצורף, באמצעות מקדחה 4 מ מ, נקדח חור נוסף ב פקק הגומי כדי להכיל את החללית תרמי (היזהרו לא כדי לעבור עוד חור). כדי לקבל את הצנרור דרך היציאות, יקדם את הצנרור עם פינצטה; פעם דרך, מהדק את הצנרור שיצמיד אותו המקום, ולאחר מכן משוך הפינצטה לסגת.
הערה: אם זה לא ניתן להוסיף את החור נוספת פקק הגומי, בקבוק רחב-הפה בורג עם כובע בורג ארבע יציאות יפעלו במקום פקק הבקבוק וגומי.
- ברגע מערכת הזרימה הורכב באופן מלא, לסגור את השסתומים של שתי מבחנות צמיחה צד כתום וירוק. להשתמש במים עם הצנרת הבקבוק המצורף, משורה של לכייל את משאבת מינון לפי הוראות היצרן.
2. ביצוע ניסוי
- יום לפני הניסוי, מתחילים לחמם מראש תא הדגירה מיקרוסקופ עד 37 ° C, ולהכין את תרבות לילה של זן פטרייתיים (קרינה פלואורסצנטית זה לא נדרש).
- לאסוף שימוש אחד הרכיבים של המשאבה, ולמקם אבטחה סטרילי ארון.
- הסר את מלכודת בועות, הטמפרטורה בדיקה של מנגנון זרימת ולמקם אותם בארון אבטחה.
- Detangle ולארגן הצנרת, במידת הצורך.
- אוטוקלב המנגנון זרימה, כולל פסי stir, למשך 30 דקות להבטיח עקרות; בסיום, להעביר אבטחה בארון.
- לצרף את מלכודת בועות רגש טמפרטורה, כל שימוש אחד הרכיבים (למעט השקופית) כפי שהיא מתוארת באיור 1.
- עבור מסנן 0.2 µm (איור 1, 11), הסר את הבוכנה של המזרק 1 מ"ל, עד"מתאם". לכפות את הצנרור מ FB לתוך קצה זה, לצרף את המסנן 0.2 µm לאורך צינור שמוביל הבקבוקון צמיחה.
- למרוח משחה ואקום סיליקון מסביב בארב של מתאם שקופיות (היזהרו לא כדי לקבל את כל השומן מבפנים) לפני חיבורו, כמו זה מסייע למנוע דליפות אוויר לתוך המערכת.
- למלא את הבקבוק מצורף עם 100 מ של 1% (w/v) תמצית שמרים, peptone 2% (w/v) ו- 2% (w/v) גלוקוז (YPD), ולמלא את הבקבוקון צמיחה עם 200 מ של YPD. לוודא לאורך צינור ירוק בצד יגיע המדיה כל הבקבוק.
- ודא כי שסתומים פתוחות. לצרף את מלכודת בועות ואקום, והתחבר המשאבה הצנרת בצד הירוק במורד הזרם של המלכודת בועה.
- לשאוב את הנוזלים בספיקה של 3.3 mL/min כדי לחלוטין למלא את הצד הירוק, אז לוותר על ולמחוק כ 1-2 מ של התקשורת כי הזוג הראשון של מיליליטר לעתים קרובות מכילים תאים מתים או פסולת אקראי. ודא כי הצד הירוק של הצנרת מתמלא מדיה, יש אין בועות במורד הזרם של המלכודת בועה לפני שתמשיך.
- למלא את השקופית ערוץ ואת המאגר YPD, מטפל לא להכיר בועות.
- לחבר השקופית מנגנון זרימת ומשאבת יותר נוזלים כדי ליצור מאגר כ- 0.5 מ' בצד כתום. זה כדי למנוע בטעות השמנה אוויר בשקופית במקרה של זרם אחורי.
- להכין את המנגנון זרימה, התעבורה למיקרוסקופ: מהדק סגור את כניסת ו עודפים של מלכודת בועות, וכן קלאמפ ירוק וכתום בצד מצורף הבקבוק שסתומים סגורים. ודא מזרקי PD ו FB חזק כפי שהם יכולים לשחרר במהלך autoclaving.
- נתק את המשאבה הצנרת כדי להקל על תחבורה. לאחר מכן להזיז כל הרכיבים, כולל את קדירות פלטה, לתוך מיכל משני ליד המיקרוסקופ.
- הכינו את המנגנון זרימה עבור הדמיה.
- לצרף את החללית טמפרטורה בחישה פלטה ולהתחיל חימום את הבקבוקון המצורף ל- 37 מעלות צלזיוס. מערבבים את המדיה-300 סל ד ולשמור על זה עבור הניסוי כולו.
- טעינת השקופית על המיקרוסקופ, והשתמש הקלטת במידת הצורך לאבטח אותו בחוזקה.
- לצרף את מלכודת בועות ואקום (מבטל את המלחציים עדיין).
- לחבר את המשאבה מנגנון זרימת במיקום המצוין על איור 1.
- . הפעל את המשאבה בספיקה של 3.3 mL/min, לאפשר את הפעלת עבור 5-10 s ולאחר מכן הסר את המלחציים כניסה/יציאה של מלכודת בועות.
- לאפשר את המשאבה להמשיך להפעיל בזמן הבקבוקון מצורף מתחמם. ברגע מדיה יש שהופץ ברחבי מערכת הזרימה, בדוק פעולה רגילה.
- בדיקת צנרת אוויר דולף ב upstream של המשאבה (היווצרות בועה כמה הם תופעה רגילה) או נוזל ידלוף במורד הזרם.
- בדוק כי הבקבוקון מדיה צמיחה, PD ו FB הם כל המדיה מטפטף מהצינור כניסה (אם לא, זה עשוי להצביע על סינון סתומים, או של קלאמפ האוזן overtightened).
- באמצעות המיקרוסקופ, בדוק אם יש תאים המצורפת או מתגלגל על השקופית בערוץ. מספר מופרז של תאים עשוי להצביע על זיהום במהלך הגדרת, או קרום טפלון (PTFE) של בועת השמנה, צריך להחליף.
- לאחר תא הבקבוקון ואת הדגירה מצורף שניהם ב 37 מעלות צלזיוס, להוסיף הבקבוקון המצורף כדי להגיע עונה 1 פרק 106 תאים למ"ל מספיק תרבות לילה של התאים פטרייתי.
הערה: עוצמת הקול שנוסיף µL ניתן לחשב באמצעות הנוסחא הזו: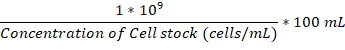
- לחכות 15 דקות כדי לאפשר את התאים להסתגלות.
- פתח שני השסתומים הבקבוקון של צד כתום וירוק המצורף בעת סגירת שני השסתומים הבקבוק הצמיחה כדי להתחיל את הזרימה של תאים.
- להמתין כ- 5 דקות לאפשר תאים להגיע אל השקופית, ולאפשר למיקוד הראשונית של המיקרוסקופ (הפעם אולי צריכים להיות מותאמים בהתאם לאורך הצנרת בצד הירוק). במהלך תקופה זו, להתאים את המיקרוסקופ כדי באותם פרמטרים הדמיה בשימוש במחקרים קודמים. אם זה הראשון, בצע את הפעולות הבאות:
- לעבור יעד אוויר הגדלה נמוכה.
- למצוא ולהתמקד על התא מצורף או ניצני קטן התא.
- קביעת תצורה של הקבל לתאורת קוהלר, ולאחר מכן לעבור שדה אפל.
- הגדר את זמן החשיפה 300 ms.
- התאם את עוצמת זרחני עד תא קטן הוא עמום עדיין נראה בבירור רקע (אות על רקע יחס של 7-8 עבור תא הבת ניצני הוא ערך סביר). הערה/מארק עוצמת זרחני לניסויים עתידיים.
- להגדיר את התוכנה כדי לקבל תמונה כל 2 דקות מעל 2 h.
- התחל ייבוא תמונות לשלב קובץ מצורף. בדוק שוב לאחר כ 5, 10 דקות כדי להבטיח המוקד נשמרה. אם לא, תנסה לכוון את התמקדות מיד לאחר התמונה הבאה היא רכשה.
- מיד לאחר סיום שלב מצורף, שמור את הקובץ ולאחר מכן פתח שני השסתומים הבקבוקון של צמיחה צד כתום וירוק בעת סגירת שני השסתומים הבקבוקון של קובץ מצורף. לטפל לא כדי להקפיץ את הבמה אם יש שסתומים נמצאים בתוך תא הדגירה.
- נתק החללית מד מן קדירות פלטה.
- להסיר את הבקבוקון מצורף בחישה פלטה ולמקם את הבקבוקון צמיחה במקומו.
- להגדיר את התוכנה כדי לקבל תמונה כל 15 דקות מעל 22 h ולהתחיל ייבוא תמונות בשלב הצמיחה. מחדש תוך התמקדות צריך שלא יהיה צורך, אך מומלץ מאוד לבדוק את המנגנון זרימה אחרי כמה שעות.
- בדיקת צנרת אוויר דולף ב upstream של המשאבה (שוב כמה היווצרות בועה הם תופעה רגילה) או נוזל ידלוף במורד הנהר
- סימון כי הבקבוקון מדיה צמיחה, PD ו FB הם כל טפטוף מדיה (אם לא, זה יכול להצביע על מסנן סתומות, מהדק overtightened האוזן או להדביק על התאמת טקסוס אם התאים בשימוש flocculate).
- בדוק את רמת הנוזלים ב פנסיון מלא. אם התקשורת מתקרב לפסגה של הבקבוק (מעל 1.5 ס מ מעל החלק העליון של המסנן), להדק שני screwcaps (לא לצופף אותם, כמו את הבקבוקון. הוא תחת לחץ). אם הם לא אחזק עוד יותר, המשך הניסוי (אם כי זה עלול לגרום לדליפה), ולהחליף את gaskets גומי על PD ו FB לאחר הניקוי הבא.
- לאחר סיום הרכישה שלב הצמיחה, שמור את הקובץ ולאחר מכן פתח את השסתומים הבקבוק של צד כתום וירוק מצורף אשר עלול לגרום רעש כמו הלחץ משחרר בצד כתום. משוך הצנרת בצד הירוק מגיע בשתי מבחנות מדיה עד שהם לפחות כמה סנטימטרים מעל התקשורת. להפעיל את המשאבה במהירות גבוהה (כ 100 מ לדקה או החזק לחצן הרצה קדימה על המשאבה) כדי להסיר את כל המדיה הצנרת, מה שהופך את ניקוי קל יותר. בעת ריקון, נתק את המנגנון זרימה של המשאבה, ומסירים אותו המיקרוסקופ.
3. יש לנקות את המנגנון זרימה
- להסיר את כל הרכיבים הלא-autoclavable (שימוש אחד רכיבי מלכודת בועות, רגש טמפרטורה), ואת אוטוקלב המנגנון זרימה במשך 30 דקות להשליך בשימוש רכיבים חד-פעמיים, בדיקה נקי עם 70% אתנול, להפריש מלכודת בועות.
- לאחר סיום autoclaving, למחוק מדיה, לשטוף, להפריש מדיה מבחנות. ואז להתחבר מחדש את מלכודת בועות, חבר של שקופיות ערוץ ibidi כדי לשמש לניקוי (הניתן לשימוש חוזר), וחבר מערכת הזרימה המשאבה במיקום המוצג באיור1.
- קלאמפ סגור השסתום הבקבוק צד כתום צמיחה.
- במקום כ- 200 מ של אקונומיקה מדולל לתוך גביע. למקם את stoppers גומי האקונומיקה ולאחר מכן התחל את המשאבה במהירות גבוהה לזרום אקונומיקה לאורך כל המנגנון זרימה (למעט כל המסננים). ברגע מלא עם אקונומיקה, להפסיק את המשאבה כי עוזב את המשאבה במהירות גבוהה יכול ללבוש ולשבור את הצנרור.
- לאחר ניקוי הפנים למשך 15 דקות, תחזיקי את stoppers גומי מעל כשהספל ולהתחיל המשאבה שוב כדי להסיר המלבין את המנגנון זרימה.
- חזור על שלבים 3.4 ו- 3.5 פעמיים עם עודף מים במקום אקונומיקה לשטוף מערכת הזרימה. במהלך תקופה זו, לנקות את מסנני רק עם מים כי בחומרי ניקוי אחרים יהיה לאכל או לסתום את המסננים.
- במקום הצנרת בדרך כלל שתתחבר למסנן מדיה 0.2 µm (שמקורו 2 מיקרומטר FB) לתוך המים הספל עם stoppers גומי מהשלב 3.6.
- נתק את הצנרור צמוד לים של המסנן בתוך שורה 20 מיקרומטר, אשר ניתן בדרך כלל את הנוצה בקלות למרות הצבת האוזן.
- השתמש בקבוקון מסנן ואקום קטע ארוך של צינורות דרך פקק 3 חורים חילוף ליצירת מערכת ואקום אשר יכול להתחבר מנגנוני זרימה.
- חיבור מערכת ואקום זו לים של הים מסנן 20 מיקרומטר, ולהתחיל את הואקום; זה ימשוך מים באמצעות המסננים בכיוון ההפוך, הסרת תאים מתים.
- למשוך לפחות 200 מ ל מים דרך מסננים ולאחר מכן הסר הצנרור מן המים כדי לרוקן את הקווים מסנן מים.
- נתק את מערכת ואקום של המסנן 20 מיקרומטר, וחבר מחדש את המסנן אבובים הרגיל שלה.
4. לכימות קטעי וידאו
הערה: כל הקבצים צריך להמיר פורמט קובץ (. TIF) תג התמונה לעבודה. בנוסף, כדי להשוות בין ניסויים, חיוני כי כל התמונות נלקחים עם מיקרוסקופ אותו ואת ההדמיה פרמטרים, כפי שפורט לעיל.
- הורד והתקן ImageJ אם לא כבר מותקן.
- הורד את קובץ מאקרו משלימה, למקם אותו בתיקיית ImageJ\macros.
- התאם את המאקרו שסופקו:
- פתח אוסף תמונות מתוך ניסוי הקודם ב- ImageJ, בחר נקודת זמן עם כדוריות.
- בחר מתוך התפריט באמצעות "תמונה | סוג | 8-bit".
- בחר מתוך התפריט באמצעות "תמונה | התאם | הסף". סמן את התיבה "רקע כהה" . הגדר את התפריט הנפתח של צד ימין אדום.
- התאם את ערך נמוך עד כל התאים מכוסים בצבע אדום עם רעש עודף מינימלי (כמה כתמים התא הלא בסדר, תטופל החוצה על ידי המאקרו). שים לב הערך התחתון.
- סגור את החלון הסף והן את התמונה פתוח.
- בחר מתוך התפריט באמצעות "תוספים | פקודות מאקרו | ערוך". כאשר תתבקש לפתוח קובץ: תעלו רמה בתיקיה אחת", ואז בחר את התיקיה פקודות מאקרו ופתח את הקובץ מאקרו כימות biofilm זרימה.
- שנה את הערך 15 בכל המקרים של "setThreshold (15, 255);" לערך שנקבע בשלב 4.3.4. שמור את הקובץ, לסגור את החלון.
- בחר מתוך התפריט באמצעות "תוספים | פקודות מאקרו | התקן", בחר את הקובץ כימות biofilm זרימה.
- . כעת, תחת "תוספים | פקודות מאקרו" תפריט, יופיעו אפשרויות חדשות שש quantifications וידאו שונים. הפעל את הניתוח המלא ובחר את הקובץ המצורף וצמיחה קבצי הווידאו כאשר תתבקש לבצע ניתוחים זמינים כל הנתונים שהושגו וליצור באופן אוטומטי קבצי פלט.
תוצאות
להחליפן בתמונות של מצב רגיל בין לילה זמן לשגות הניסוי באמצעות פראי-סוג אלביקנס ג תאים ב 37 ° C ניתן לראות באיור 2א ו- 1 וידאו משלימה. התמונות היו חדות משופרת כדי לשפר את הראות. בוצע כימות הנתונים המקוריים, גרפים נציג ניתן לראות
Discussion
באמצעות מערכת הזרימה כמתואר לעיל מאפשר לדור של קטעי וידאו זמן לשגות כמותית של biofilm פטרייתי צמיחה והתפתחות. כדי לאפשר השוואות בין ניסויים זה חשיבות חיונית על מנת להבטיח כי הפרמטרים הדמיה נשמרים זהה. זה כולל הבטחת כי המיקרוסקופ מוגדרת לתאורת קוהלר עבור ניסוי (מדריכים רבים זמינים באינטרנט עב...
Disclosures
המחברים אין לחשוף.
Acknowledgements
המחברים רוצה להכיר ד ר ווייד עורכת הדין למתן ערך קלט בעיצוב של המנגנון זרימה.
Materials
| Name | Company | Catalog Number | Comments |
| Pump | Cole Parmer | 07522-20 | 6 |
| Pump head | Cole Parmer | 77200-60 | 6 |
| Tubing | Cole Parmer | 96410-14 | N/A |
| Bubble trap adapter | Cole Parmer | 30704-84 | 3 |
| Bubble trap vacuum adapter for 1/4” ID vacuum line | Cole Parmer | 31500-55 | 3 |
| In-line filter adapter (4 needed) | Cole Parmer | 31209-40 | 8,9 |
| Orange-side Y | Cole Parmer | 31209-55 | 7 |
| Green-side Y | ibidi | 10827 | 2 |
| * Slides | ibidi | 80196 | 4 |
| * Slide luers | ibidi | 10802 | 4 |
| Vacuum assisted Bubble trap | Elveflow/Darwin microfluidics | KBTLarge - Microfluidic Bubble Trap Kit | 3 |
| Media flasks | Corning | 4980-500 | 1 |
| 0.2 µm air filter | Corning | 431229 | 1 |
| Threaded glass bottle for PD and filter flask (2 needed) | Corning | 1395-100 | 5,10 |
| Ported Screw cap for PD and filter flask (2 needed) | Wheaton | 1129750 | 5,10 |
| Screwcap tubing connector | Wheaton | 1129814 | 5,10 |
| Tubing connector beveled washer | Danco | 88579 | 5,10 |
| Tubing connector flat washer | Danco | 88569 | 5,10 |
| Clamps for in-line filters and downstream Y (7 needed) | Oetiker/MSC Industrial Supply Company | 15100002-100 | 7,8,9 |
| Clamp tool | Oetiker/MSC Industrial Supply Company | 14100386 | N/A |
| 20 μm in-line media filter | Analytical Scientific Instruments | 850-1331 | 8 |
| 10 μm in-line media filter | Analytical Scientific Instruments | 850-1333 | 9 |
| 2 μm inlet media filter | Supelco/Sigma-Aldrich | 58267 | 10 |
| * 0.22 µm media filter | Millipore | SVGV010RS | 11 |
| * 0.22 µm media filter “adapter” | BD Biosciences | 329654 | 11 |
| Rubber stopper | Fisher Scientific | 14-131E | 1 |
| Hotplate stirrer with external probe port | ThermoFisher Scientific | 88880006 | N/A |
| Temperature probe | ThermoFisher Scientific | 88880147 | N/A |
References
- Pankhurst, C. L. Candidiasis (oropharyngeal). BMJ clinical evidence. 2012, 1304 (2012).
- Ramage, G., Vandewalle, K., Wickes, B. L., López-Ribot, J. L. Characteristics of biofilm formation by Candida albicans. Revista iberoamericana de micología. 18 (4), 163-170 (2001).
- Nobile, C. J., Mitchell, A. P. Regulation of cell-surface genes and biofilm formation by the C. albicans transcription factor Bcr1p. Current biology: CB. 15 (12), 1150-1155 (2005).
- Blankenship, J. R., Mitchell, A. P. How to build a biofilm: a fungal perspective. Current opinion in microbiology. 9 (6), 588-594 (2006).
- Araújo, D., Henriques, M., Silva, S. Portrait of Candida Species Biofilm Regulatory Network Genes. Trends in microbiology. 25 (1), 62-75 (2017).
- Lane, W. O., et al. Parallel-plate flow chamber and continuous flow circuit to evaluate endothelial progenitor cells under laminar flow shear stress. Journal of visualized experiments. (59), e3349 (2012).
- Bakker, D. P., van der Plaats, A., Verkerke, G. J., Busscher, H. J., van der Mei, H. C. Comparison of velocity profiles for different flow chamber designs used in studies of microbial adhesion to surfaces. Applied and environmental microbiology. 69 (10), 6280-6287 (2003).
- Zhang, W., Sileika, T. S., Chen, C., Liu, Y., Lee, J., Packman, A. I. A novel planar flow cell for studies of biofilm heterogeneity and flow-biofilm interactions. Biotechnology and bioengineering. 108 (11), 2571-2582 (2011).
- Uppuluri, P., Lopez-Ribot, J. L. An easy and economical in vitro method for the formation of Candida albicans biofilms under continuous conditions of flow. Virulence. 1 (6), 483-487 (2010).
- Diaz, P. I., et al. Synergistic interaction between Candida albicans and commensal oral streptococci in a novel in vitro mucosal model. Infection and immunity. 80 (2), 620-632 (2012).
- McCall, A., Edgerton, M. Real-Time Approach to Flow Cell Imaging of Candida albicans Biofilm Development. Journal of fungi. 3 (1), 13 (2017).
- Zhang, B., Zerubia, J., Olivo-Marin, J. -. C. Gaussian approximations of fluorescence microscope point-spread function models. Applied optics. 46 (10), 1819-1829 (2007).
- Tati, S., et al. Candida glabrata Binding to Candida albicans Hyphae Enables Its Development in Oropharyngeal Candidiasis. PLoS pathogens. 12 (3), 1005522 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved