È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Imaging in tempo reale e quantificazione dello sviluppo di Biofilm fungine utilizza un sistema bifase di flusso a ricircolo
In questo articolo
Riepilogo
Descriviamo l'assembly, operazione, e la pulizia di un apparato di flusso progettato per formazione di biofilm fungine di immagine in tempo reale mentre sotto flusso. Inoltre forniamo e discutere algoritmi quantitativi da utilizzare sulle immagini acquisite.
Abstract
Nella candidosi orofaringea, membri del genere Candida devono rispettare e crescere sulla superficie mucosa orale mentre sotto gli effetti del flusso salivare. Mentre sono stati sviluppati modelli per la crescita sotto flusso, molti di questi sistemi sono costosi, o non consentire mentre le cellule sono sotto flusso di imaging. Abbiamo sviluppato un apparato romanzo che ci permette di immagine la crescita e lo sviluppo delle cellule di Candida albicans in flusso e in tempo reale. Qui, abbiamo dettaglio il protocollo per il montaggio e l'uso di questo apparato di flusso, così come la quantificazione dei dati generati. Siamo in grado di quantificare le tariffe che le cellule collegare e staccano dalla diapositiva, come pure di determinare una misura della biomassa sulla diapositiva nel corso del tempo. Questo sistema sia economico e versatile, lavorando con molti tipi di microscopi ottici, compresi microscopi benchtop poco costoso, ed è in grado di estesa volte rispetto ad altri sistemi di flusso di imaging. Nel complesso, questo è un sistema di bassa produttività che può fornire informazioni in tempo reale altamente dettagliate sulla crescita di biofilm delle specie fungine sotto flusso.
Introduzione
Candida albicans (C. albicans) è un agente patogeno fungoso opportunistico degli esseri umani che possono infettare molti tipi di tessuto, comprese le superfici mucose orale, causando la candidosi orofaringea e conseguente a una minore qualità della vita per individui affetti1. Formazione di biofilm è una caratteristica importante per la patogenesi di albicans del c., e numerosi studi sono stati fatti sulla formazione e sulla funzione di c. albicans biofilms2,3,4, 5, molti dei quali sono stati eseguiti utilizzando statico (nessun flusso) in vitro modelli. Tuttavia, c. albicans deve aderire e crescere in presenza di flusso salivare nella cavità orale. Numerosi sistemi di flusso sono stati sviluppati per consentire per vivere-cella imaging6,7,8,9,10. Questi sistemi di flusso differenti sono stati progettati per scopi diversi, e quindi ogni sistema ha diversi punti di forza e debolezze. Abbiamo trovato che molti del flusso sistemi appropriati per albicans del c. erano costose, richiesto complesso fabbricato parti, o non potrebbe essere imaged durante flusso e doveva essere fermato prima di formazione immagine. Di conseguenza, abbiamo sviluppato un apparato di flusso romanzo per studiare la formazione di biofilm di albicans del c. sotto flusso11. Durante la progettazione del nostro apparato di flusso, abbiamo seguito queste considerazioni principali. In primo luogo, abbiamo voluto essere in grado di quantificare gli aspetti multipli della crescita di biofilm e sviluppo in tempo reale senza richiedere l'uso di cellule fluorescenti (permettendoci di ceppi mutanti di studio e gli isolati clinici non modificati facilmente). In secondo luogo, volevamo tutte le parti per essere commercialmente disponibile con poca o nessuna modifica (cioè., nessun montaggio su ordinazione), consentendo ad altri di più facilmente ricreare il nostro sistema e per riparazioni semplici. In terzo luogo, abbiamo anche voluto consentire per esteso volte al prezzo ragionevolmente elevato flusso di imaging. Infine, abbiamo voluto, dopo un periodo di cellule allegare al substrato sotto flusso, essere in grado di monitorare la crescita di biofilm nel corso di un periodo prolungato senza introdurre nuove cellule.
Queste considerazioni hanno portato a sviluppare il sistema di flusso a ricircolo due-boccetta illustrato nella Figura 1. Due boccette ci permettono di dividere l'esperimento in due fasi, una fase di attaccamento che attinge il matraccio di cella-seminato allegato e una fase di crescita che utilizza mezzi senza cellula per continuare la crescita di biofilm senza l'aggiunta di nuove cellule. Questo sistema è progettato per funzionare con una camera di incubazione per il microscopio, con lo scivolo e il tubo che lo precede (2 a 5, Figura 1) essere collocato all'interno dell'incubatore, e tutti gli altri componenti collocati in un grande contenitore secondario di fuori del microscopio. Inoltre, un agitatore di piastra riscaldante con una sonda di temperatura collegata viene utilizzato per mantenere le cellule fungine nella beuta di attaccamento a 37 ° C. Come esso è a ricircolo, questo sistema è in grado di imaging continuo durante il flusso (può essere oltre 36 h a seconda di condizioni) e può essere utilizzato sulla maggior parte dei microscopi, tra cui microscopi da banco verticale o invertito. Qui, discutiamo l'assembly, operazione, e pulizia dell'apparato di flusso, oltre a fornire alcuni algoritmi quantitativi di base ImageJ per analizzare i video dopo un esperimento.
Protocollo
1. Montare l'apparecchiatura di flusso
- Configurare le parti elencate nella Tabella materiali seguendo lo schema in Figura 1 con le considerazioni discussione di seguito.
Nota: Per comodità, il flusso apparato è diviso in due lati, il lato verde (tutto a Monte della diapositiva per le beute di media) e l'arancio lato (tutto a valle della diapositiva per le beute di media).- Garantire che tutto l'apparato di flusso è aria stretta per evitare perdite, con la sola eccezione delle beute media (Figura 1, 1). A tale scopo, applicare il nastro idraulici per qualsiasi filettatura maschio prima del montaggio ad eccezione di smorzatori di pulsazioni (PD) e 2 µm filtro bottiglia (FB), che non richiedono nastro idraulici come le guarnizioni di gomma tenerli chiusi ermeticamente.
- Applicare morsetti orecchio a ogni raccordo spinato che si trova sotto pressione positiva durante il funzionamento normale (cioè, a valle della pompa).
- Usa colore codificato nastri di laboratorio per etichettare le posizioni della valvola con un A o G (per allegato e crescita, rispettivamente), la posizione della pompa, i percorsi di collegamento di diapositiva e il collegamento del filtro di 0,2 µm.
- Determinare la distanza tra il sistema di flusso ed il microscopio, tenendo presente che tutto l'apparato di flusso a valle della pompa per le beute (maggioranza del lato arancio) dovrebbe essere nel contenimento secondario in base alla lunghezza del tubo da utilizzare. Aggiungere circa 1 m di tubazione supplementare a Monte della slitta (e preferibilmente il gorgogliatore) da collocare all'interno della camera di incubazione del microscopio, come questo assicura che tutti i media raggiungendo la diapositiva sarà alla giusta temperatura.
- Posto il gorgogliatore più ragionevolmente possibile alla diapositiva, preferibilmente all'interno della camera di incubazione durante un esperimento (bolle spesso si formano lungo la parete della tubazione); Tuttavia, tenere presente che deve essere collegato ad un vuoto di operare.
- Assicurarsi che il tubo tra il FB e il 0,2 µm filtro monouso è circa 0,5 m di lunghezza.
- Aggiungere un circa 2cm ancoretta magnetica per ogni beuta di media.
- Ottenere qualche forma di tubi morsetti per fungere da valvole di intercettazione (possono essere utilizzati emostatiche).
- Per facilità d'uso, è necessario mantenere l'apparato di flusso in un cestino di autoclavabile. Può essere utile avere un secondo cestello più piccolo in uno più grande per consentire la facile separazione del lato verde e l'arancione.
- Per la staffa di fissaggio, con una punta di 4 mm, un foro supplementare del tappo di gomma per ospitare la sonda termica (attenzione a non passare attraverso un altro foro). Per ottenere il tubo attraverso le porte, spingere il tubo attraverso con le pinzette; una volta attraverso, assicurare il tubo flessibile per tenerlo sul posto e poi tirare indietro le pinzette.
Nota: Se non è possibile aggiungere il foro supplementare per il tappo di gomma, una bottiglia di vite bocca larga con tappo a vite di quattro porte funzionino al posto il tappo di gomma e pallone.
- Una volta che il sistema di flusso è stato completamente assemblato, chiudere le valvole di boccette di crescita sia lato verde e arancione. Utilizzare acqua con il tubo di boccetta di attaccamento e un cilindro graduato per tarare la pompa peristaltica secondo le istruzioni del produttore.
2. eseguire un esperimento
- Il giorno prima dell'esperimento, iniziare il pre-riscaldamento della camera di incubazione di microscopio a 37 ° C e preparare una coltura durante la notte di un ceppo fungina (fluorescenza non è necessario).
- Raccogliere i componenti monouso e pompa e collocare in una sterile biosicurezza armadio.
- Rimuovere il ferma-bolle e la temperatura della sonda dall'apparato di flusso e inserire questi nell'armadietto di biosicurezza.
- Detangle e organizzare il tubo, se necessario.
- Autoclave l'apparato di flusso, tra cui le barre di mescolare, per 30 min garantire la sterilità; al termine, trasferimento alla cappa di biosicurezza.
- Fissare il gorgogliatore, sonda di temperatura e tutti i componenti monouso (tranne la diapositiva) come raffigurato nella Figura 1.
- Per il filtro da 0,2 µm (Figura 1, 11), togliere lo stantuffo della siringa da 1 mL per renderlo come un "adattatore". Forzare il tubo da FB in questo fine e fissare il filtro da 0,2 µm per il tubo che porta il pallone di crescita.
- Applicare grasso al silicone vuoto intorno barb della scheda diapositiva (attenzione a non ottenere qualsiasi grasso all'interno) prima della connessione, come questo aiuta a previene perdite d'aria nel sistema.
- Riempire il pallone di attaccamento con 100 mL di Estratto di lievito 1% (p/v), 2% (p/v) di peptone e 2% (p/v) di glucosio (YPD) e riempire il pallone di crescita con 200 mL di YPD. Assicurarsi che la tubazione lato verde raggiunge i media in ciascuna beuta.
- Garantire che tutte le valvole siano aperte. Allegare il gorgogliatore ad un vuoto e collegare la pompa alla tubazione di verde sul lato a valle della trappola della bolla.
- Pompare il fluido ad un flusso di 3,3 mL/min a completamente riempire il lato verde, quindi dispensare e scartare circa 1 – 2 mL dei media, perché il primo paio di millilitri contenga spesso le cellule morte o detriti casuale. Assicurarsi che il lato verde del tubo è riempito con i media e nessun bolle a valle della trappola bolla prima di procedere.
- Riempire la diapositiva di canale e il serbatoio con YPD, facendo attenzione a non introdurre bolle.
- Collegare la diapositiva all'apparato di flusso e pompa più fluido per creare un buffer di circa 0,5 m sul lato arancio. Si tratta di impedire accidentalmente inglobare aria nella diapositiva in caso di riflusso.
- Preparare l'apparato di flusso per il trasporto al microscopio: morsetto chiuso ingresso ed uscita del gorgogliatore e morsetto il verde e l'arancio lato valvole di boccetta allegato chiusi. Assicurarsi che i tappi a vite per il PD e FB sono stretti come essi possono allentare durante la sterilizzazione in autoclave.
- Scollegare la pompa dal tubo per agevolarne il trasporto. Quindi spostare tutti i componenti, tra cui l'agitatore di piastra, in un contenitore secondario vicino al microscopio.
- Preparare l'apparato di flusso per l'imaging.
- Collegare la sonda di temperatura all'agitatore di piastra e iniziare il riscaldamento della muffola allegato a 37 ° C. Mescolare i media a 300 giri/min e mantenere questo per l'intero esperimento.
- Montare il vetrino sul microscopio e utilizzare il nastro se necessario per fissarlo saldamente.
- Allegare il gorgogliatore ad un vuoto (non ancora annullare il morsetto).
- Collegare la pompa all'apparato di flusso nella posizione indicata nella Figura 1.
- Avviare la pompa con una portata di 3,3 mL/min, farlo girare per circa 5 – 10 s e quindi rimuovere il morsetto di ingresso/uscita di bubble trappola.
- Avviare la pompa continuare l'esecuzione mentre il matraccio di attaccamento si riscalda. Una volta media ha diffuso in tutto il sistema di flusso, verificare per il normale funzionamento.
- Controllare raccordi per aria che perdeva in a Monte della pompa (qualche formazione di bolle è normale), o liquido fuoriuscita a valle.
- Controllare che la crescita media beuta, PD e FB sono tutti i mezzi di gocciolamento dal tubo di aspirazione (se non, questo potrebbe indicare un filtro intasato o un morsetto all'orecchio serrati eccessivamente).
- Uso del microscopio, verifica per allegata o rotolamento celle nella diapositiva di canale. Un numero eccessivo di cellule può indicare la contaminazione durante il set-up, o che la membrana di politetrafluoroetilene (PTFE) della bolla trappola deve essere sostituito.
- Una volta che la camera di boccetta e incubazione di attaccamento sono entrambi a 37 ° C, aggiungere abbastanza durante la notte cultura delle cellule fungine nel matraccio allegato per raggiungere 1 x 106 cellule/mL.
Nota: Il volume da aggiungere in µ l può essere calcolato con la formula: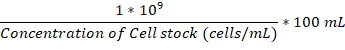
- Attendere 15 minuti per consentire alle cellule di acclimatare.
- Aprire entrambi valvole di boccetta allegato lato verde e arancione durante la chiusura di due valvole di boccetta di crescita per avviare il flusso delle cellule.
- Attendere circa 5 minuti consentire alle cellule di raggiungere la diapositiva e consentire la messa a fuoco iniziale del microscopio (questa volta potrebbe essere necessario essere regolato a seconda della lunghezza della tubazione lato verde). Durante questo tempo, regolare il microscopio per gli stessi parametri di imaging utilizzata negli esperimenti precedenti. Se questa è la prima esecuzione, attenersi alla seguente procedura:
- Passare a un obiettivo di aria basso ingrandimento.
- Trovare e concentrarsi su una cella associata o piccola in erba.
- Configurare il condensatore per l'illuminazione di Köhler, quindi passare a campo scuro.
- Impostare il tempo di esposizione a 300 ms.
- Regolare l'intensità illuminante fino ad una piccola cella è scarsa ancora chiaramente visibile sullo sfondo (sfondo rapporto di circa 7 – 8 un segnale per una cellula figlia in erba è un valore ragionevole). Segno/nota l'intensità illuminante per gli esperimenti futuri.
- Configurare il software per acquisire un'immagine ogni 2 min oltre 2 h.
- Iniziare l'acquisizione di immagini per la fase di attacco. Controllare nuovamente dopo circa 5 e 10 min per garantire che lo stato attivo è stato mantenuto. In caso contrario, tenta di regolare la messa a fuoco subito dopo l'immagine successiva viene acquisito.
- Immediatamente dopo la fase di attaccamento ha finito, salvare il file e quindi aprire entrambe le valvole boccetta di crescita lato verde e arancione durante la chiusura di entrambe le valvole boccetta allegato. Fare attenzione a non per urtare la fase se tutte le valvole sono all'interno della camera di incubazione.
- Scollegare la sonda del termometro dall'agitatore di piastra riscaldante.
- Togliere il matraccio allegato dall'agitatore piastra riscaldante e posizionare il pallone di crescita al suo posto.
- Configurare il software per acquisire un'immagine ogni 15 min oltre 22 h e iniziare l'acquisizione di immagini per la fase di crescita. Ri-messa a fuoco non dovrebbe essere necessario, ma si consiglia vivamente di verificare l'apparecchiatura di flusso dopo poche ore.
- Controllare raccordi per aria che perdeva in a Monte della pompa (di nuovo qualche formazione di bolle è normale), o liquido fuoriuscita a valle
- Controllare che la crescita media beuta, PD e FB sono tutto grondante media (se non, questo potrebbe indicare un filtro intasato, un morsetto all'orecchio serrati eccessivamente o uno zoccolo a un raccordo spinato se le cellule utilizzate flocculare).
- Controllare il livello del liquido in FB. Se i media si sta avvicinando la parte superiore della bottiglia (oltre 1,5 cm sopra la parte superiore del filtro), serrare entrambi coperchi a vite (non separarli, come questo matraccio è sotto pressione). Se non stringeranno ulteriormente, continuare l'esperimento (anche se questo potrebbe causare una perdita) e sostituire le guarnizioni di gomma sul PD e FB dopo la pulizia successiva.
- Una volta terminata l'acquisizione di fase di crescita, salvare il file e quindi aprire le valvole di boccetta di attaccamento lato verde e arancione che possono fare un rumore come rilascia la pressione sul lato arancio. Tirare verso l'alto il tubo lato verde provenienti da due boccette di media fino a quando essi sono almeno parecchi centimetri sopra il media. Il funzionamento ad alta velocità (circa 100 mL/min oppure tenere premuto il tasto di avanzamento veloce sulla pompa) per rimuovere tutti i media i tubi, che rende la pulizia più facile. Quando svuotato, scollegare l'apparecchio di flusso dalla pompa e rimuoverla dal microscopio.
3. pulire l'apparato di flusso
- Rimuovere tutti i componenti non-autoclavabile (componenti monouso, gorgogliatore e sonda di temperatura), e autoclave l'apparato di flusso per 30 min. Discard utilizzato componenti monouso, pulito sonda con etanolo al 70% e mettere da parte il gorgogliatore.
- Al termine della sterilizzazione in autoclave, gettare il terreno e sciacquare e mettere da parte le boccette di media. Quindi ricollegare il gorgogliatore, collegare una diapositiva di canale ibidi da utilizzarsi per la pulizia (riutilizzabile) e collegare il sistema di flusso della pompa nella posizione mostrata nella Figura 1.
- Morsetto chiuso la valvola di boccetta di crescita laterale arancione.
- Posto circa 200 mL di candeggina non diluita in un bicchiere. Inserire i tappi di gomma la candeggina e poi avviare la pompa ad alta velocità a circolare candeggina in tutto l'apparato di flusso (ad eccezione di tutti i filtri). Una volta riempito con candeggina, fermare la pompa perché lasciando la pompa ad alta velocità può indossare e rompere i tubi.
- Dopo lo sbiancamento per 15 min, tenere i tappi di gomma sopra il becher e avviare la pompa nuovamente per rimuovere la candeggina dall'apparato di flusso.
- Ripetere i passaggi da 3.4 e 3.5 due volte con l'acqua in eccesso invece di candeggina per lavare il sistema di flusso. Durante questo periodo, è necessario pulire i filtri solo con acqua perché altri detergenti si corrodono o intasare i filtri.
- Posizionare il tubo che collegherebbe normalmente per il filtro di media 0,2 µm (provenienza del µm 2 FB) in acqua becher con i tappi di gomma dal punto 3.6.
- Scollegare il tubo attaccato all'ingresso del filtro inline 20 µm, che di solito può essere tirato a parte con facilità nonostante il morsetto all'orecchio.
- Consente di creare un sistema di vuoto che possa connettersi all'apparato di flusso una beuta per filtrazione sotto vuoto e un lungo tratto di tubazione attraverso un ricambio tappo 3 fori.
- Questo sistema di vuoto di collegare alla presa dell'ingresso filtro µm 20 e avviare il vuoto; Questo tirerà acqua attraverso i filtri nella direzione inversa, rimuovendo le cellule morte.
- Tirare almeno 200 mL di acqua attraverso i filtri, quindi rimuovere il tubo dall'acqua per svuotare le linee di filtro dell'acqua.
- Scollegare il sistema di aspirazione dal filtro µm 20, e ricollegare il filtro alla sua normale tubazione.
4. quantificare i video
Nota: Tutti i file devono essere convertiti per il formato TIFF (TIF) a lavorare. Inoltre, per confrontare tra esperimenti, è fondamentale che tutte le immagini sono prese con il microscopio stesso e parametri di imaging, come discusso in precedenza.
- Scaricare e installare ImageJ se non è già installato.
- Scaricare il file di macro supplementare e posizionarlo nella cartella ImageJ\macros.
- Regolare la macro fornita:
- Aprire una serie di immagini da un esperimento precedente in ImageJ e selezionare un punto di tempo con cellule presenti.
- Selezionare dal menu tramite "immagine | Tipo | 8-bit".
- Selezionare dal menu tramite "immagine | Regolare | Soglia". Selezionare la casella di "Dark Background" . Impostare il menu a discesa di destra al rosso.
- Regolare il valore più basso fino a quando tutte le celle sono coperti in rosso con il minimo rumore in eccesso (alcuni non-cellula pezzatura è discreta e sarà trattato fuori dalla macro). Prendere nota di questo valore inferiore.
- Chiudere la finestra di soglia e dell'immagine aperta.
- Selezionare dal menu tramite "plugin | Le macro | Modificare". Quando viene richiesto di aprire un file: "spostare in una cartella di livello", quindi selezionare la cartella di macro e aprire il file di macro flusso quantificazione di biofilm.
- Modificare il valore 15 in tutte le istanze di "setThreshold (15, 255);" per il valore determinato al punto 4.3.4. Salvare il file e chiudere questa finestra.
- Selezionare dal menu tramite "plugin | Le macro | Installa"e selezionare il file di quantificazione del biofilm flusso.
- Ora, sotto la "plugin | Macro" menu, sei nuove opzioni per varie quantificazioni dei video visualizzato. Eseguire l' analisi completa e selezionare i file video allegato e crescita quando viene richiesto di eseguire tutte le analisi disponibili sui dati acquisiti e generare automaticamente i file di output.
Risultati
Immagini rappresentative di un normale pernottamento time-lapse esperimento utilizzando selvaggio-tipo albicans del c. le cellule a 37 ° C possono essere visto in Figura 2A e supplementare Video 1. Le immagini sono state contrasto aumentato per migliorare la visibilità. Quantificazione dei dati originali è stato effettuato, e grafici rappresentativi possono essere visto in Figura 2
Discussione
Utilizzando il sistema di flusso come indicato in precedenza consente la generazione di video time-lapse quantitativi della crescita di biofilm fungine e dello sviluppo. Per consentire il confronto tra esperimenti è di importanza critica per garantire che i parametri di imaging vengono mantenuti lo stesso. Ciò include garantire che il microscopio è impostato per l'illuminazione di Köhler per ogni esperimento (molte guide sono disponibili online per questo processo). Oltre a parametri di imaging, ci sono alcuni passi ...
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Gli autori desidera ringraziare Dr. Wade Sigurdson per fornire un input prezioso nella progettazione dell'apparato di flusso.
Materiali
| Name | Company | Catalog Number | Comments |
| Pump | Cole Parmer | 07522-20 | 6 |
| Pump head | Cole Parmer | 77200-60 | 6 |
| Tubing | Cole Parmer | 96410-14 | N/A |
| Bubble trap adapter | Cole Parmer | 30704-84 | 3 |
| Bubble trap vacuum adapter for 1/4” ID vacuum line | Cole Parmer | 31500-55 | 3 |
| In-line filter adapter (4 needed) | Cole Parmer | 31209-40 | 8,9 |
| Orange-side Y | Cole Parmer | 31209-55 | 7 |
| Green-side Y | ibidi | 10827 | 2 |
| * Slides | ibidi | 80196 | 4 |
| * Slide luers | ibidi | 10802 | 4 |
| Vacuum assisted Bubble trap | Elveflow/Darwin microfluidics | KBTLarge - Microfluidic Bubble Trap Kit | 3 |
| Media flasks | Corning | 4980-500 | 1 |
| 0.2 µm air filter | Corning | 431229 | 1 |
| Threaded glass bottle for PD and filter flask (2 needed) | Corning | 1395-100 | 5,10 |
| Ported Screw cap for PD and filter flask (2 needed) | Wheaton | 1129750 | 5,10 |
| Screwcap tubing connector | Wheaton | 1129814 | 5,10 |
| Tubing connector beveled washer | Danco | 88579 | 5,10 |
| Tubing connector flat washer | Danco | 88569 | 5,10 |
| Clamps for in-line filters and downstream Y (7 needed) | Oetiker/MSC Industrial Supply Company | 15100002-100 | 7,8,9 |
| Clamp tool | Oetiker/MSC Industrial Supply Company | 14100386 | N/A |
| 20 micron in-line media filter | Analytical Scientific Instruments | 850-1331 | 8 |
| 10 micron in-line media filter | Analytical Scientific Instruments | 850-1333 | 9 |
| 2 micron inlet media filter | Supelco/Sigma-Aldrich | 58267 | 10 |
| * 0.22 µm media filter | Millipore | SVGV010RS | 11 |
| * 0.22 µm media filter “adapter” | BD Biosciences | 329654 | 11 |
| Rubber stopper | Fisher Scientific | 14-131E | 1 |
| Hotplate stirrer with external probe port | ThermoFisher Scientific | 88880006 | N/A |
| Temperature probe | ThermoFisher Scientific | 88880147 | N/A |
Riferimenti
- Pankhurst, C. L. Candidiasis (oropharyngeal). BMJ clinical evidence. 2012, 1304 (2012).
- Ramage, G., Vandewalle, K., Wickes, B. L., López-Ribot, J. L. Characteristics of biofilm formation by Candida albicans. Revista iberoamericana de micología. 18 (4), 163-170 (2001).
- Nobile, C. J., Mitchell, A. P. Regulation of cell-surface genes and biofilm formation by the C. albicans transcription factor Bcr1p. Current biology: CB. 15 (12), 1150-1155 (2005).
- Blankenship, J. R., Mitchell, A. P. How to build a biofilm: a fungal perspective. Current opinion in microbiology. 9 (6), 588-594 (2006).
- Araújo, D., Henriques, M., Silva, S. Portrait of Candida Species Biofilm Regulatory Network Genes. Trends in microbiology. 25 (1), 62-75 (2017).
- Lane, W. O., et al. Parallel-plate flow chamber and continuous flow circuit to evaluate endothelial progenitor cells under laminar flow shear stress. Journal of visualized experiments. (59), e3349 (2012).
- Bakker, D. P., van der Plaats, A., Verkerke, G. J., Busscher, H. J., van der Mei, H. C. Comparison of velocity profiles for different flow chamber designs used in studies of microbial adhesion to surfaces. Applied and environmental microbiology. 69 (10), 6280-6287 (2003).
- Zhang, W., Sileika, T. S., Chen, C., Liu, Y., Lee, J., Packman, A. I. A novel planar flow cell for studies of biofilm heterogeneity and flow-biofilm interactions. Biotechnology and bioengineering. 108 (11), 2571-2582 (2011).
- Uppuluri, P., Lopez-Ribot, J. L. An easy and economical in vitro method for the formation of Candida albicans biofilms under continuous conditions of flow. Virulence. 1 (6), 483-487 (2010).
- Diaz, P. I., et al. Synergistic interaction between Candida albicans and commensal oral streptococci in a novel in vitro mucosal model. Infection and immunity. 80 (2), 620-632 (2012).
- McCall, A., Edgerton, M. Real-Time Approach to Flow Cell Imaging of Candida albicans Biofilm Development. Journal of fungi. 3 (1), 13 (2017).
- Zhang, B., Zerubia, J., Olivo-Marin, J. -. C. Gaussian approximations of fluorescence microscope point-spread function models. Applied optics. 46 (10), 1819-1829 (2007).
- Tati, S., et al. Candida glabrata Binding to Candida albicans Hyphae Enables Its Development in Oropharyngeal Candidiasis. PLoS pathogens. 12 (3), 1005522 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon