Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Imagerie en temps réel et la Quantification du développement de biofilms fongiques en utilisant un système de flux de recirculation en deux phases
Dans cet article
Résumé
Nous décrivons le montage, exploitation, et le nettoyage d’un appareil à débit conçu pour la formation de biofilms fongiques d’image en temps réel sous flux. Nous également fournissons et discuter des algorithmes quantitatifs pour être utilisé sur les images acquises.
Résumé
Dans la candidose oropharyngée, les membres du genre Candida doivent respecter et se développent sur la surface de la muqueuse buccale, sous l’effet du flux salivaire. Tandis que les modèles de croissance sous flux ont été développés, beaucoup de ces systèmes sont chers, ou ne permettent pas d’imagerie tandis que les cellules sont sous flux. Nous avons développé un appareil novateur qui permet à l’image de la croissance et le développement des cellules de Candida albicans sous flux et en temps réel. Ici, nous détaillons le protocole pour le montage et l’utilisation de cet appareil de flux, ainsi que la quantification des données qui sont générées. Nous sommes en mesure de quantifier les taux que les cellules attachent à et se détachent de la diapositive, ainsi que pour déterminer une mesure de la biomasse sur la diapositive au fil du temps. Ce système est économique et polyvalent, travaillant avec nombreux types de microscopes légers, y compris les microscopes portatifs peu coûteux, et est capable d’étendue d’imagerie fois par rapport aux autres systèmes de flux. Dans l’ensemble, il s’agit d’un système de faible débit qui peut fournir des informations en temps réel très détaillées sur la croissance de biofilm des espèces fongiques sous flux.
Introduction
Candida albicans (C. albicans) est un champignon pathogène opportuniste des humains qui peuvent infecter de nombreux types de tissus, y compris les muqueuses orales, causant la candidose oropharyngée et résultant en une plus faible qualité de vie pour les personnes concernées1. La formation de biofilm est une caractéristique importante de la pathogenèse de c. albicanset de nombreuses études ont été faites sur la formation et la fonction de c. albicans biofilms2,3,4, 5, dont beaucoup ont été réalisées à l’aide de statique (pas de débit) in vitro des modèles. Cependant, c. albicans doivent adhérer et se développer en présence de flux salivaire dans la cavité buccale. Nombreux systèmes d’écoulement ont été développées pour permettre de vivre-cellule d’imagerie6,7,8,9,10. Ces systèmes de flux différents ont été conçus à des fins différentes, et donc chaque système possède différentes forces et faiblesses. Nous avons constaté que beaucoup de l’écoulement des systèmes appropriés pour c. albicans étaient coûteux, complexe requis fabriqué des pièces, ou pourrait être pas photographié au cours de l’écoulement et a dû être arrêté avant l’imagerie. Par conséquent, nous avons développé un appareil de nouveaux flux pour étudier la formation de biofilm de c. albicans sous flux11. Lors de la conception de nos appareils de débit, nous avons suivi ces considérations principales. Tout d’abord, nous voulions être en mesure de quantifier les multiples aspects de la croissance de biofilm et le développement en temps réel sans nécessiter l’utilisation de cellules fluorescentes (nous permettant d’étude souches mutantes et isolats cliniques non modifiées facilement). Deuxièmement, nous voulions que toutes les parties à être commercialisé avec peu ou aucune modification (i.e., aucune fabrication sur mesure), permettant à d’autres plus facilement recréer notre système et la possibilité pour des réparations faciles. En troisième lieu, nous voulions également permettre prolongée d’imagerie fois à raisonnablement des débits élevés. Enfin, nous avons voulu, après une période de cellules fixation au substrat sous flux, pour pouvoir surveiller la croissance de biofilm après un certain temps sans introduire de nouvelles cellules.
Ces considérations nous conduisent à développer le système d’écoulement recirculation deux-flacon illustré à la Figure 1. Les deux ballons nous permettent de partager l’expérience en deux phases, une phase d’attachement qui puise dans la fiole d’attachement cellulaire graines et une phase de croissance qui utilise les médias acellulaire pour poursuivre la croissance de biofilm sans l’ajout de nouvelles cellules. Ce système est conçu pour fonctionner avec une chambre d’incubation pour le microscope, avec le toboggan et le tube qui le précède (de 2 à 5, Figure 1) étant placé à l’intérieur de l’incubateur, et tous les autres composants placés dans un grand récipient secondaire à l’extérieur de la microscope. En outre, un agitateur de plaque chauffante avec une sonde de température ci-jointe est utilisé pour maintenir les cellules fongiques dans la fiole de pièce jointe à 37 ° C. Comme c’est le recyclage, ce système est capable de l’imagerie continue au cours de l’écoulement (peut être plus de 36 h selon les conditions) et peut être utilisé sur la plupart des microscopes, y compris les microscopes de benchtop inversé ou dressées. Ici, nous discutons de la montage, exploitation, et nettoyage de l’appareil à flux, tout en fournissant certains algorithmes quantitatives de base ImageJ pour analyser les vidéos après une expérience.
Protocole
1. monter l’appareil à flux
- Configurer les éléments énumérés dans la Table des matières selon le schéma de la Figure 1 avec les considérations discutées ci-dessous.
Remarque : Pour plus de commodité, le flux appareil est divisé en deux parties, le côté vert (tout en amont de la diapositive pour les fioles de médias) et l’orange côté (tout en aval de la diapositive pour les fioles de médias).- S’assurer que tous les appareils de débit est hermétique pour éviter les fuites, à la seule exception des fioles médias (Figure 1, 1). Pour ce faire, appliquer plombiers ruban sur n’importe quel filetage mâle avant de monter à l’exception de l’amortisseur de pulsations (pp) et de 2 µm filtre bouteille (FB), qui ne nécessitent pas de bureaucratie plombiers comme les joints de caoutchouc Gardez-les hermétique.
- Appliquer des pinces oreille à chaque raccord cannelé qui est sous pression positive durant le fonctionnement normal (c'est-à-dire, en aval de la pompe).
- Utiliser la couleur codée bandes lab d’étiqueter les emplacements de soupapes par un A ou G (pour la fixation et la croissance, respectivement), l’emplacement de la pompe, les lieux de connexion de diapositive et la connexion de filtre de 0,2 µm.
- Déterminer la longueur de tube à utiliser en fonction de la distance entre le système d’écoulement et le microscope, gardant à l’esprit que tout l’appareil d’écoulement en aval de la pompe pour les fioles (majorité du côté orange) soit dans l’enceinte de confinement secondaire. Ajouter environ 1 m de tuyau supplémentaire en amont de la diapositive (et de préférence le barboteur) à placer dans la chambre d’incubation de microscope, comme cela s’assurera que tous les médias pour atteindre la diapositive soient à la bonne température.
- Place le barboteur aussi près que possible à la diapositive, de préférence à l’intérieur de la chambre d’incubation pendant une expérience (bulles souvent forme le long de la paroi du tube) ; Cependant, gardez à l’esprit qu’il doit être relié à un aspirateur à exploiter.
- S’assurer que le tuyau entre le FB et le 0,2 µm filtre jetable est environ 0,5 m de long.
- Ajouter un environ barre d’agitation magnétique de 2 cm dans chaque fiole de médias.
- Obtenir une certaine forme de tubes pinces pour servir de robinets d’arrêt (une pince hémostatique peut être utilisée).
- Pour la facilité d’utilisation, garder l’appareil à flux dans un panier autoclavable. Il peut être utile d’avoir un deuxième panier plus petit dans un plus grand pour permettre une séparation facile du côté vert et l’orange.
- Pour le ballon de la pièce jointe, à l’aide d’un foret de 4 mm, percer un trou supplémentaire dans le bouchon en caoutchouc pour accueillir la sonde thermique (attention de ne pas passer par un autre trou). Pour obtenir la tuyauterie via les ports, pousser le tube à travers avec des pincettes ; une fois, serrer le tube pour le maintenir en place, puis tirez la pince à épiler Régularisez.
Remarque : S’il n’est pas possible d’ajouter le trou supplémentaire pour le bouchon en caoutchouc, une bouteille de large-bouche vis avec un bouchon à vis quatre ports peut fonctionner à la place le bouchon du flacon et en caoutchouc.
- Une fois que le système d’écoulement a été entièrement assemblé, fermer les vannes de deux fioles de croissance du côté vert et orange. Utiliser l’eau avec le tuyau de fiole de pièce jointe et un cylindre gradué pour calibrer la pompe péristaltique selon les instructions du fabricant.
2. réaliser une expérience
- Le jour avant l’expérience, commencer le préchauffage de la chambre d’incubation microscope à 37 ° C et préparer une nuit culture d’une souche fongique (fluorescence n’est pas nécessaire).
- Rassembler pompe et composants à usage unique et placer dans une stérile sur la biosécurité du cabinet.
- Enlever le collecteur de bulle et la température de sonde de l’appareil à flux et placez-les dans le cabinet de prévention des risques biotechnologiques.
- Démêler et organiser le tube, si nécessaire.
- Stériliser l’appareil à flux, y compris les barres de remuer, pendant 30 min assurer la stérilité ; Lorsque vous avez terminé, transfert à la biosécurité du cabinet.
- Fixez le barboteur, sonde de température et tous les composants réutilisables (sauf la diapositive) comme illustré à la Figure 1.
- Pour le filtre de 0,2 µm (Figure 1, 11), retirer le piston de la seringue de 1 mL pour le rendre comme un « adaptateur ». Forcer la tubulure de la FB dans cette extrémité et fixer le filtre de 0,2 µm à la tuyauterie menant à la fiole de croissance.
- Appliquez de la graisse sous vide silicone autour de l’ardillon de la diapo (attention de ne pas obtenir de graisse à l’intérieur) avant de se connecter, comme ce permet d’éviter les fuites d’air dans le système.
- Remplissez la fiole de fixation avec 100 mL d’extrait de levure 1 % (p/v), 2 % (p/v) de peptone et 2 % (p/v) de glucose (DPJ) et remplir la fiole de croissance avec 200 mL de la DPJ. Veiller à ce que la tubulure latérale verte atteint les médias dans chaque fiole.
- Veiller à ce que toutes les vannes sont ouvertes. Fixez le barboteur à une dépression et raccorder la pompe au tuyau vert côté en aval du piège à bulle.
- Pomper le liquide à un débit de 3,3 mL/min à complètement remplir le côté vert, puis extruder et jeter environ 1 à 2 mL des médias, parce que les deux premiers millilitres contiennent souvent des cellules mortes ou des débris au hasard. Faire en sorte que le côté vert du tube est rempli avec les médias et qu’il n’a aucuns bulles en aval du piège à bulle avant de continuer.
- Remplir la diapositive de canal et le réservoir avec la DPJ, prenant soin de ne pas pour introduire des bulles.
- Connectez la diapositive à l’appareil de flux et pompe plus fluide pour créer une mémoire tampon d’environ 0,5 m sur le côté orange. Il s’agit d’empêcher accidentellement air de piégeage dans la diapositive en cas de reflux.
- Préparer l’appareil à flux pour le transport au microscope : pince fermée amont et aval du barboteur et pince le vert et l’orange robinets attachement fiole fermée. Veiller à ce que les cache-vis pour le PD et FB sont serrés car ils peuvent desserrer durant l’autoclavage.
- Débrancher la pompe du circuit respiratoire pour faciliter le transport. Puis déplacez tous les composants, y compris l’agitateur de la plaque de cuisson, dans un conteneur secondaire près du microscope.
- Préparer l’appareil à flux pour l’imagerie.
- Fixer la sonde de température à l’agitateur de la plaque chauffante et commencer à chauffer le ballon de l’attachement à 37 ° C. Remuer les médias à 300 tr/min et tenez ceci pour l’expérience entière.
- Monter la culasse sur le microscope et utilisez du ruban si nécessaire pour bien le fixer.
- Fixez le barboteur à vide (pas défaire le collier sans pourtant).
- Raccorder la pompe à l’appareil de flux à l’emplacement indiqué sur la Figure 1.
- Démarrer la pompe à un débit de 3,3 mL/min et laissez-le tourner pendant environ 5 à 10 s puis débrancher la pince d’entrée/sortie du piège à bulle.
- Laissez la pompe fonctionner alors que le ballon de la pièce jointe s’échauffe. Une fois que les médias a distribué dans tout le système d’écoulement, vérifier le fonctionnement normal.
- Vérifier les raccords pour une fuite dans l’air en amont de la pompe (une formation de bulles est normale), ou liquide qui s’écoule en aval.
- Vérifiez que la fiole de croissance médias, PD et FB sont tous médias dégoulinant du tube d’aspiration (si pas, cela peut indiquer un filtre obstrué, ou une pince à oreilles trop serrée).
- À l’aide du microscope, recherchez les cellules attachées ou roulement sur la diapositive de canal. Un nombre excessif de cellules peut indiquer la contamination lors de l’installation, ou que la membrane de polytétrafluoroéthylène (PTFE) de la bulle piège doit être remplacée.
- Une fois que la chambre de fiole et incubation de fixation sont tous deux à 37 ° C, ajouter assez durant la nuit de la culture des cellules fongiques dans le ballon de la pièce jointe pour atteindre 1 x 106 cellules/mL.
Remarque : Le volume d’ajouter en µL peut être calculé à l’aide de cette formule :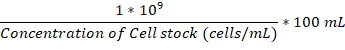
- Attendre 15 min pour permettre les cellules s’acclimater.
- Ouvrir les deux robinets de fiole de fixation côté vert et orange tout en fermant les deux vannes de fiole de croissance pour démarrer le flux de cellules.
- Attendre environ 5 min permettre des cellules atteindre la diapositive et permettent la mise au point initiale du microscope (ce temps peut devoir être ajustée selon la longueur de la tubulure latérale verte). Pendant ce temps, ajuster le microscope pour les mêmes paramètres d’imagerie utilisés dans des expériences antérieures. Si il s’agit de la première manche, procédez comme suit :
- Placez-vous dans un objectif d’air de faible grossissement.
- Trouver et se concentrer sur une cellule attachée ou petits bourgeonnement.
- Configurer le condensateur pour l’éclairage de Koehler, puis passez à fond noir.
- Définir la durée d’exposition à 300 ms.
- Réglez l’intensité de l’éclairage jusqu'à ce qu’une petite cellule est dim encore clairement visible sur l’arrière-plan (un rapport signal sur fond d’environ 7 à 8 pour une cellule de fille en herbe est une valeur raisonnable). Marque/note l’intensité d’éclairage pour de futures expériences.
- Configurer le logiciel afin d’acquérir une image de plus de 2 h toutes les 2 min.
- Commencer l’acquisition d’images pour la phase d’attachement. Vérifiez après environ 5 et 10 min pour faire en sorte qui mettent l’accent a été maintenue. Si ce n’est pas le cas, essayez d’ajuster la mise au point immédiatement après que l’image suivante est acquis.
- Immédiatement après que la phase d’attachement terminée, enregistrez le fichier et ouvrez les deux valves de fiole de croissance côté vert et orange tout en fermant les deux vannes de fiole de pièce jointe. Prendre soin de ne pas pour cogner la scène si les vannes sont à l’intérieur de la chambre d’incubation.
- Débrancher la sonde du thermomètre de l’agitateur de la plaque chauffante.
- Enlever le ballon de l’attachement de l’agitateur de la plaque chauffante et placer le ballon de la croissance à sa place.
- Configurer le logiciel afin d’acquérir une image toutes les 15 minutes sur une période de 22 h et commencer l’acquisition d’images pour la phase de croissance. Re-mise au point n’est pas nécessaire, mais il est fortement recommandé de vérifier l’appareil à flux après quelques heures.
- Vérifier les raccords pour une fuite dans l’air en amont de la pompe (encore une fois une formation de bulles est normale), ou le liquide qui s’écoule en aval
- Vérifier que la fiole de croissance médias, PD et FB sont tout dégoulinant de médias (si pas, cela pourrait indiquer un filtre obstrué, une pince à oreilles trop serrée ou une obstruction à un raccord cannelé, si les cellules utilisées floculent).
- Vérifier le niveau du liquide dans le FB. Si les médias se rapproche de la partie supérieure de la bouteille (plus de 1,5 cm au-dessus du haut du filtre), serrer les deux vis (ne pas desserrer, ce flacon est sous pression). Si ils ne serrera pas plus loin, poursuivre l’expérience (bien que cela peut entraîner une fuite) et remplacez les joints de caoutchouc sur le PD et le FB après le prochain nettoyage.
- Lorsque l’acquisition de phase de croissance est terminée, enregistrez le fichier et puis ouvrez les vannes de fiole de fixation côté vert et orange qui peuvent faire un bruit comme la pression libère le côté orange. Tirez sur le tube de côté vert provenant de deux flacons de médias jusqu'à ce qu’ils soient au moins plusieurs centimètres au-dessus de la presse. Faire fonctionner la pompe à vitesse élevée (environ 100 mL/min ou maintenez enfoncée la touche avance rapide sur la pompe) pour supprimer tous les médias de la tuyauterie, ce qui rend le nettoyage plus facile. Lorsque vide, déconnecter l’appareil de débit de la pompe et retirez-le du microscope.
3. Nettoyez l’appareil à flux
- Supprimez tous les composants non autoclavable (composants réutilisables, barboteur et sonde de température), et stériliser l’appareil à flux pour 30 min. jetez utilisé des composants réutilisables, nettoyer la sonde avec l’éthanol à 70 % et mettre de côté barboteur.
- Après que autoclavage est terminée, jeter des médias et rincer et mis de côté des flacons de médias. Puis rebrancher le barboteur, connectez une diapositive ibidi de canal à utiliser pour le nettoyage (réutilisable) et relier le système de débit de la pompe à l’endroit indiqué sur la Figure 1.
- Pince fermée orange croissance ballon robinet d’arrêt.
- Placer environ 200 mL d’eau de Javel non diluée dans un bécher. Placez les bouchons de caoutchouc dans l’eau de Javel et puis démarrez la pompe à une vitesse élevée pour circuler l’eau de Javel tout au long de l’appareil de flux (sauf tous les filtres). Une fois rempli d’eau de Javel, arrêter la pompe parce que les partis de la pompe à une vitesse élevée peuvent porter et casser le tube.
- Après le blanchiment pendant 15 min, tenir les bouchons en caoutchouc au-dessus le bécher et démarrer la pompe à nouveau pour retirer l’appareil de flux de l’eau de Javel.
- Répétez les étapes 3.4 et 3.5 deux fois avec l’excès d’eau au lieu de rincer le système d’écoulement d’eau de Javel. Pendant ce temps, nettoyez les filtres d’eau parce que les autres agents de nettoyage vont se corroder ou obstruer les filtres.
- Déposer le tube qui relierait normalement pour le filtre de 0,2 µm (venant de la FB de 2 µm) dans l’eau du bécher avec les bouchons de caoutchouc à l’étape 3.6.
- Débrancher le tuyau attaché à l’entrée du filtre inline 20 µm, qui peut habituellement être tiré apart avec aisance malgré la pince à oreilles.
- Utilisez une fiole de filtre à vide et une longue section de tuyau au travers d’un bouchon de 3 trous rechange pour créer un système d’aspiration qui peut se connecter à l’appareil de flux.
- Raccorder ce système d’aspiration à l’entrée de l’entrée du filtre 20 µm et commencer le vide ; Cela va tirer l’eau au travers des filtres dans le sens inverse, en enlevant les cellules mortes.
- Tirer au moins 200 mL d’eau à travers les filtres, puis enlevez le tuyau de l’eau pour vider les lignes de filtre d’eau.
- Débrancher le système d’aspiration du filtre 20 µm, et rebrancher le filtre pour son tube normal.
4. quantifier les vidéos
Remarque : Tous les fichiers doivent être convertis au format de fichier (TIF) balise image à travailler. En outre, pour comparer entre les expériences, il est essentiel que toutes les images sont prises avec le même microscope et paramètres d’imagerie, comme indiqué plus haut.
- Téléchargez et installez ImageJ si pas déjà installé.
- Téléchargez le fichier de macro complémentaire et placez-le dans le dossier ImageJ\macros.
- Ajuster la macro fournie :
- Ouvrir une pile d’image d’une expérience précédente dans ImageJ, puis sélectionnez un point de temps avec des cellules présentes.
- Choisissez parmi le menu via « Image | Type | 8-bit ».
- Choisissez parmi le menu via « Image | Ajuster | Seuil ». Cochez la case « fond sombre » . Le menu déroulant de droite la valeur rouge.
- Régler la valeur inférieure jusqu'à ce que toutes les cellules sont couverts en rouge avec un minimum de bruit excessif (certaines cellules non mouchetures est OK et sera traitée sur la macro). Prenez note de cette valeur inférieure.
- Fermez la fenêtre de seuil et l’image ouverte.
- Choisissez parmi le menu via « Plugins | Les macros | Edit ». Lorsque vous êtes invité à ouvrir un fichier : « déplacer vers le haut niveau d’un seul dossier », puis sélectionnez le dossier macros et ouvrez le fichier de macro de quantification de biofilm flux.
- Modifiez la valeur 15 dans toutes les instances de « setThreshold (15, 255) ; » à la valeur déterminée à l’étape 4.3.4. Enregistrez le fichier et fermer cette fenêtre.
- Sélectionnez via le menu « Plugins | Les macros | Installer » et sélectionnez le fichier de quantification de biofilm de flux.
- Maintenant, en vertu de la « Plugins | Macros » menu, six nouvelles options pour les quantifications vidéo divers apparaissent. Exécuter l' analyse complète , puis sélectionnez les fichiers vidéo, pièce jointe et de croissance, lorsque vous êtes invité à effectuer toutes les analyses disponibles sur les données acquises et de générer automatiquement des fichiers de sortie.
Résultats
Time-lapse expérience la nuit images représentatives d’une vie normale à l’aide de type sauvage c. albicans cellules à 37 ° C peuvent être vu dans la Figure 2A et la vidéo 1. Les images ont été conçue pour améliorer la visibilité de contraste. Quantification des données originales a été réalisée, et des graphiques représentant peuvent être vu dans la Figure 2
Discussion
En utilisant le système d’écoulement décrites ci-dessus permet la génération de vidéos time-lapse quantitatives des biofilms fongiques croissance et le développement. Pour permettre la comparaison entre les expériences, c’est d’une importance cruciale pour s’assurer que les paramètres d’imagerie restent les mêmes. Cela inclut de veiller à ce que le microscope est mis en place pour l’éclairage de Köhler pour chacune des expériences (de nombreux guides sont disponibles en ligne pour ce processus)....
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs aimerait Dr Wade Sigurdson pour apporter une contribution précieuse dans la conception de l’appareil à flux.
matériels
| Name | Company | Catalog Number | Comments |
| Pump | Cole Parmer | 07522-20 | 6 |
| Pump head | Cole Parmer | 77200-60 | 6 |
| Tubing | Cole Parmer | 96410-14 | N/A |
| Bubble trap adapter | Cole Parmer | 30704-84 | 3 |
| Bubble trap vacuum adapter for 1/4” ID vacuum line | Cole Parmer | 31500-55 | 3 |
| In-line filter adapter (4 needed) | Cole Parmer | 31209-40 | 8,9 |
| Orange-side Y | Cole Parmer | 31209-55 | 7 |
| Green-side Y | ibidi | 10827 | 2 |
| * Slides | ibidi | 80196 | 4 |
| * Slide luers | ibidi | 10802 | 4 |
| Vacuum assisted Bubble trap | Elveflow/Darwin microfluidics | KBTLarge - Microfluidic Bubble Trap Kit | 3 |
| Media flasks | Corning | 4980-500 | 1 |
| 0.2 µm air filter | Corning | 431229 | 1 |
| Threaded glass bottle for PD and filter flask (2 needed) | Corning | 1395-100 | 5,10 |
| Ported Screw cap for PD and filter flask (2 needed) | Wheaton | 1129750 | 5,10 |
| Screwcap tubing connector | Wheaton | 1129814 | 5,10 |
| Tubing connector beveled washer | Danco | 88579 | 5,10 |
| Tubing connector flat washer | Danco | 88569 | 5,10 |
| Clamps for in-line filters and downstream Y (7 needed) | Oetiker/MSC Industrial Supply Company | 15100002-100 | 7,8,9 |
| Clamp tool | Oetiker/MSC Industrial Supply Company | 14100386 | N/A |
| 20 μm in-line media filter | Analytical Scientific Instruments | 850-1331 | 8 |
| 10 μm in-line media filter | Analytical Scientific Instruments | 850-1333 | 9 |
| 2 μm inlet media filter | Supelco/Sigma-Aldrich | 58267 | 10 |
| * 0.22 µm media filter | Millipore | SVGV010RS | 11 |
| * 0.22 µm media filter “adapter” | BD Biosciences | 329654 | 11 |
| Rubber stopper | Fisher Scientific | 14-131E | 1 |
| Hotplate stirrer with external probe port | ThermoFisher Scientific | 88880006 | N/A |
| Temperature probe | ThermoFisher Scientific | 88880147 | N/A |
Références
- Pankhurst, C. L. Candidiasis (oropharyngeal). BMJ clinical evidence. 2012, 1304 (2012).
- Ramage, G., Vandewalle, K., Wickes, B. L., López-Ribot, J. L. Characteristics of biofilm formation by Candida albicans. Revista iberoamericana de micología. 18 (4), 163-170 (2001).
- Nobile, C. J., Mitchell, A. P. Regulation of cell-surface genes and biofilm formation by the C. albicans transcription factor Bcr1p. Current biology: CB. 15 (12), 1150-1155 (2005).
- Blankenship, J. R., Mitchell, A. P. How to build a biofilm: a fungal perspective. Current opinion in microbiology. 9 (6), 588-594 (2006).
- Araújo, D., Henriques, M., Silva, S. Portrait of Candida Species Biofilm Regulatory Network Genes. Trends in microbiology. 25 (1), 62-75 (2017).
- Lane, W. O., et al. Parallel-plate flow chamber and continuous flow circuit to evaluate endothelial progenitor cells under laminar flow shear stress. Journal of visualized experiments. (59), e3349 (2012).
- Bakker, D. P., van der Plaats, A., Verkerke, G. J., Busscher, H. J., van der Mei, H. C. Comparison of velocity profiles for different flow chamber designs used in studies of microbial adhesion to surfaces. Applied and environmental microbiology. 69 (10), 6280-6287 (2003).
- Zhang, W., Sileika, T. S., Chen, C., Liu, Y., Lee, J., Packman, A. I. A novel planar flow cell for studies of biofilm heterogeneity and flow-biofilm interactions. Biotechnology and bioengineering. 108 (11), 2571-2582 (2011).
- Uppuluri, P., Lopez-Ribot, J. L. An easy and economical in vitro method for the formation of Candida albicans biofilms under continuous conditions of flow. Virulence. 1 (6), 483-487 (2010).
- Diaz, P. I., et al. Synergistic interaction between Candida albicans and commensal oral streptococci in a novel in vitro mucosal model. Infection and immunity. 80 (2), 620-632 (2012).
- McCall, A., Edgerton, M. Real-Time Approach to Flow Cell Imaging of Candida albicans Biofilm Development. Journal of fungi. 3 (1), 13 (2017).
- Zhang, B., Zerubia, J., Olivo-Marin, J. -. C. Gaussian approximations of fluorescence microscope point-spread function models. Applied optics. 46 (10), 1819-1829 (2007).
- Tati, S., et al. Candida glabrata Binding to Candida albicans Hyphae Enables Its Development in Oropharyngeal Candidiasis. PLoS pathogens. 12 (3), 1005522 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon