Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
В реальном времени обработки изображений и количественная оценка развития грибковых биопленки, с использованием двухфазной системы рециркуляции потока
В этой статье
Резюме
Мы описываем Ассамблея, операции, и очистки потока аппарата предназначена для грибковых биопленки изображения в режиме реального времени под потока. Мы также представить и обсудить количественных алгоритмы для использования на приобретенные изображения.
Аннотация
В Ротоглоточный кандидоз члены рода Candida должны придерживаться и растут на устные слизистой поверхности находясь под воздействием слюны. Хотя были разработаны модели для роста под потока, многие из этих систем являются дорогими, или не позволяют изображений в то время как клетки находятся под потока. Мы разработали новый аппарат, который позволяет нам изображения рост и развитие клеток Candida albicans под потока и в режиме реального времени. Здесь мы подробно протокол для Ассамблеи и использование этого аппарата потока, а также количественная оценка данных, которые создаются. Мы в состоянии дать количественную оценку ставок, которые клетки придают и отсоединить от слайдов, а также определить меру биомассы на слайде с течением времени. Эта система является экономичным и универсальный, работают со многими типами света Микроскопы, включая недорогие benchtop Микроскопы, и способный распространяется изображений раза по сравнению с другими системами потока. В целом это низкая пропускная система, которая может обеспечить весьма подробную информацию в реальном времени о росте биопленки плесневые под потока.
Введение
Кандидоз (C. albicans) это оппортунистическая грибкового патогена людей, которые могут заразить многих типов тканей, включая устные слизистой поверхности, вызывая Ротоглоточный кандидоз и приводит к нижней качества жизни для пострадавших лиц1. Биопленки является важной характеристикой для патогенеза C. albicans, и многочисленные исследования проводились на формирование и функции C. albicans биопленки,2,3,,4, 5, многие из которых были проведены с использованием статических (отсутствие потока) в vitro модели. Однако C. albicans необходимо придерживаться и расти в присутствии слюны в ротовой полости. Были разработаны многочисленные потока системы для клеток изображений6,,78,9,10. Эти различные системы были разработаны для различных целей, и поэтому каждая система имеет свои сильные и слабые стороны. Мы обнаружили, что многие из потока, который систем подходит для C. albicans были дорогостоящими, требуется комплекс готовых частей, или не удалось образы во время потока и пришлось прекратить до изображений. Поэтому мы разработали Роман потока аппарат для изучения C. albicans биопленки под поток11. При разработке нашего потока аппарата мы следовали этих основных соображений. Во-первых, мы хотели иметь возможность определить несколько аспектов биопленки роста и развития в режиме реального времени без необходимости использования флуоресцентных клеток (позволяет нам легко исследование мутантных штаммов и неизмененной клинических изолятов). Во-вторых, мы хотели, чтобы все части будут коммерчески доступны с практически никаких изменений (т.е., не изготовление на заказ), позволяя другим пользователям более легко воссоздать нашей системы и позволяет легко ремонт. В-третьих, мы также хотели бы позволить для расширенных изображений раз на достаточно высокий дебит. И наконец мы хотели, после периода клеток, придавая субстрат под поток, чтобы иметь возможность контролировать рост биопленки в течение продолжительного времени без введения новых клеток.
Эти соображения привели нас к разработке двух колбу рециркуляционный потока системы показан на рисунке 1. Две фляги позволяют нам разделить эксперимент в два этапа, вложение фазы, который черпает из клеток семенами вложение колбу и фазы роста, который использует ячейки свободных средств массовой информации для продолжения роста биопленки без добавления новых клеток. Эта система предназначена для работы с камерой инкубации для микроскопа, с слайд и труб, предшествующих его (2-5, рис. 1) размещены внутри инкубатора, и все другие компоненты помещены в большой вторичный контейнер снаружи Микроскоп. Кроме того плитой мешалкой с прилагаемой Термощуп используется для поддержания грибковых клеток в колбу вложение в 37 ° C. Как это рециркуляции, эта система способна непрерывной съемки во время потока (может быть более чем 36 часов, в зависимости от условий) и может быть использован на большинстве стандартных Микроскопы, включая прямыми или инвертированными benchtop микроскопы. Здесь мы обсуждаем Ассамблея, операции, и очистки потока аппарата, а также как обеспечить некоторые основные ImageJ количественных алгоритмы анализа видео после эксперимента.
протокол
1. сборка аппарата потока
- Настройка частей, которые перечислены в Таблице материалов согласно схеме на рисунке 1 с учетом соображений, обсуждаются ниже.
Примечание: Для удобства, поток, аппарат делится на две стороны, зеленой стороне (все вверх по течению слайда для фляги СМИ) и оранжевый сторону (все по течению слайда для фляги СМИ).- Убедитесь, что все аппарата потока воздуха, плотно затянуты для предотвращения утечки, с единственным исключением СМИ колбы (рис. 1, 1). Для этого применяются ленты сантехников для любого мужчины потоков перед монтажом Кроме Гаситель (PD) и 2 мкм фильтром бутылку (FB), которые не требуют сантехники ленты резиновые прокладки держать их герметичной.
- Применить уха зажимы на каждый колючая установку, которая находится под положительным давлением во время нормальной работы (то есть, ниже по течению от насоса).
- Использовать цвет кодированная лаборатории лент для обозначения места клапана с A или G (для крепления и роста, соответственно), расположение насоса, в местах соединения слайд и подключение фильтра 0,2 мкм.
- Определите, что длина труб для использования на основе расстояния между системой потока и Микроскоп, имея в виду, что весь аппарат потока вниз по течению насоса для фляги (большинство оранжевый стороны) должно быть вторичной сдерживания. Добавление дополнительных труб приблизительно 1 м выше по течению от слайда (и, желательно, Пузырь ловушки) в место внутри камеры микроскопа инкубации, поскольку это гарантирует, что все средства массовой информации, достигнув слайд будет при правильной температуре.
- Место Пузырь ловушки максимально близко вполне на слайд, предпочтительно в камере инкубации во время эксперимента (пузыри часто формы вдоль стены трубы); Однако, имейте в виду, что он должен быть подключен к вакуума для работы.
- Убедитесь, что трубка между FB и 0,2 мкм одноразовые фильтр находится около 0,5 м длиной.
- Добавить примерно 2 см магнитные перемешать бар для каждого СМИ колбу.
- Получите некоторые формы трубы зажимы в качестве запорных клапанов (hemostats могут быть использованы).
- Для удобства использования Держите аппарат поток в автоклавируемый корзину. Это может быть полезно иметь второй меньшего корзину в один большой, чтобы позволить легко разделение стороне зеленый и оранжевый.
- Для вложения колбу, используя 4 мм сверло сверлить дополнительные отверстия в резиновую пробку для размещения тепловой зонд (заботиться не пройти через еще один отверстие). Чтобы получить трубы через порты, протолкнуть трубку с помощью пинцета; Однажды, зажим трубы, чтобы удерживать его на месте, а затем тянуть обратно пинцетом.
Примечание: Если это не возможно добавить дополнительные отверстия для резиновой пробкой, винт широкий рот бутылку с четырех портовый колпачок может работать вместо колбу и резиновой пробкой.
- После того, как поток системы полностью собран, закройте клапаны как зеленый и оранжевый сторона роста колбы. Используйте воду с трубки колбу вложений и мерный цилиндр для калибровки Перистальтический насос согласно инструкциям производителя.
2. выполнить эксперимент
- За день до эксперимента, начать предварительного нагрева камеры микроскопа инкубации до 37 ° C и подготовить ночь культуры грибковых напряжения (флуоресценции не требуется).
- Соберите одноразовые компоненты и насос и место в стерильных биобезопасности кабинета.
- Удалять Пузырь ловушки и температуры зонда от потока аппарат и поместить их в кабинет биобезопасности.
- Detangle и организовать трубы, в случае необходимости.
- Автоклав аппарат потока, включая перемешать баров, за 30 мин для обеспечения стерильности; После завершения передачи биобезопасности кабинета.
- Прикрепите Пузырь ловушки, датчик температуры и все одноразовые компоненты (за исключением слайда), как показано на рисунке 1.
- Для фильтра 0,2 мкм (рис. 1, 11) удалите поршень от 1 мл шприц, чтобы сделать его как «адаптер». Силу труб от FB в этом направлении и прикрепить 0.2 мкм фильтром для трубы, ведущие к колбе роста.
- Применить вакуумной силиконовой смазки вокруг колючей слайда адаптера (заботиться, чтобы не получить любой жир на внутренней стороне) до подключения его, как это помогает предотвратить утечки воздуха в систему.
- Заполните колбу вложение с 100 мл 1% (w/v) экстракт дрожжей, Пептон 2% (w/v), и 2% (w/v) глюкозы (YPD) и залейте 200 мл YPD роста колбу. Гарантировать, что зеленой стороне трубы достигает СМИ в каждом колбу.
- Убедитесь, что все клапаны открыты. Прикрепите Пузырь ловушки в вакууме и Подключите насос к зеленой стороне трубы вниз по течению от Пузырь ловушки.
- Перекачивать жидкости со скоростью потока 3,3 мл/мин полностью заполнить зеленой стороне, затем распределить и отбросить примерно 1 – 2 мл средства массовой информации, потому что первые несколько миллилитров часто содержат отмершие клетки или случайного мусора. Убедитесь, что зеленой стороне трубы заполняется с СМИ и имеет не пузыри вниз по течению, Пузырь ловушки перед продолжением.
- Заполните канал слайд и водохранилище YPD, стараясь не ввести пузыри.
- Подключите слайд потока аппарат, и насос больше жидкости для создания буфера около 0,5 м на стороне оранжевый. Это необходимо для предотвращения случайного захвата воздуха в слайд в случае обратного потока.
- Подготовьте аппарат поток для транспортировки в микроскоп: зажим закрыт на входе и выходе Пузырь ловушки, и зажим, зеленый и оранжевый боковые крепления колбу Клапаны закрыты. Убедитесь, что колпачки для PD и FB туго, поскольку они могут ослабить во время автоклавированием.
- Отключите насос от трубки для облегчения перевозок. Затем переместите все компоненты, включая плитой мешалки, в вторичный контейнер у Микроскоп.
- Подготовьте аппарат поток для обработки изображений.
- Прикрепите датчик температуры к мешалкой плитой и начинают Отопление вложение колбу до 37 ° C. Движение средств массовой информации на 300 об/мин и поддерживать это для всего эксперимента.
- Смонтировать слайд на микроскопе и использовать ленту, если необходимо плотно зафиксируйте его.
- Прикрепить Пузырь ловушки в вакууме (не отменить зажим еще).
- Подключите насос к аппарату потока в месте, указанном на рисунке 1.
- Запустить насос со скоростью потока 3,3 мл/мин, позволяют ему баллотироваться на примерно 5 – 10 s, а затем удалить Пузырь ловушки входе/выходе зажим.
- Позволяет насос, чтобы продолжить выполнение в то время как вложение колбу нагрюет вверх. После того, как средства массовой информации был распространен во всей системе потока, проверьте для нормальной работы.
- Проверка арматуры для воздуха, утечка в вверх по течению от насоса (некоторые пузырь формирование нормальных), или вниз по течению вытекания жидкости.
- Убедитесь, что рост СМИ колбу, PD и FB все капает СМИ от в трубку (если не, это может указывать фильтр засорен или overtightened ушковый зажим).
- С помощью микроскопа, проверьте прилагаемый или прокатки клетки на слайде канала. Чрезмерное количество клеток может указывать загрязнения во время установки, или что политетрафторэтилена (ПТФЭ) мембраны Пузырь ловушки нуждается в замене.
- После того как вложение колбу и инкубации камеры оба при 37 ° C, добавьте достаточно ночи культуру грибковых клеток вложение колбу до 1 x 106 клеток/мл.
Примечание: Объем для добавления в мкл может рассчитываться с помощью этой формулы: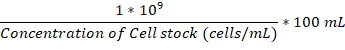
- Подождите 15 минут, чтобы позволить клетки, чтобы акклиматизироваться.
- Откройте оба зеленый и оранжевый стороне вложение колбу клапаны при закрытии оба клапана колбу роста для запуска потока клеток.
- Подождите приблизительно 5 минут позволить клеток достичь слайд и позволяют для первоначального фокусировки микроскопа (на этот раз может потребоваться скорректировать в зависимости от длины труб зеленой стороне). В это время настройте Микроскоп же изображений параметры, используемые в предыдущих экспериментах. Если это первый запуск, выполните следующие действия:
- Переключитесь на малое увеличение воздушные цели.
- Найти и сосредоточиться на прилагаемый ячейку или небольших начинающих.
- Настройка конденсатора для освещения Кёлер, а затем перейти к darkfield.
- Установите время экспозиции до 300 мс.
- Отрегулируйте интенсивность освещения до маленькой камере тусклым, еще хорошо видны на фоне (фон соотношение примерно 7 – 8 сигнал для многообещающий дочь ячейки является разумное значение). Примечание/Марк интенсивность освещения для дальнейших экспериментов.
- Настройка программного обеспечения, чтобы получить изображение каждые 2 мин более 2 ч.
- Начало захвата изображений для этапа вложение. Проверить обратно после примерно 5 и 10 мин для обеспечения что фокус был сохранен. Если нет, то попытка настроить фокусировку сразу же после приобретения следующее изображение.
- Сразу же после завершения этапа вложение, сохраните файл, а затем откройте оба клапана колбу зеленый и оранжевый сторона роста при закрытии оба клапана колбу крепления. Заботиться не ударить стадии, если все клапаны внутри камеры инкубации.
- Выключайте термометр зонд с мешалкой плитой.
- Удалить вложение настой из мешалки плитой и место роста колбу на своем месте.
- Настройка программного обеспечения для получения изображения каждые 15 мин в более чем 22 h и начать получение изображения для фазы роста. Переориентации не должно быть необходимо, но настоятельно рекомендуется проверить аппарат поток через несколько часов.
- Проверка арматуры для воздуха, утечка в вверх по течению от насоса (опять же некоторые пузырь формирование нормальных), или вниз по течению вытекания жидкости
- Убедитесь, что рост СМИ колбу, PD и FB все капает средств массовой информации (если не, это может указывать фильтр засорен, overtightened ушковый зажим или забивают в колючей установку, если клетки flocculate).
- Проверка уровня жидкости в FB. Если средства массовой информации приближается в верхней части бутылки (свыше 1,5 см выше верхней части фильтра), затяните оба screwcaps (не ослабить их, как этот настой находится под давлением). Если они не будут затянуть далее, продолжить эксперимент (хотя это может привести к утечки) и заменить резиновые прокладки на PD и FB после следующей чистки.
- После завершения приобретения фазы роста, сохраните файл, а затем откройте зеленый и оранжевый стороне вложение колбу клапаны, которые могут сделать шум, как давление выпускает на стороне оранжевый. Потяните вверх на зеленой стороне трубки, исходя из обоих СМИ колбы до тех пор, пока они находятся по крайней мере несколько сантиметров выше средств массовой информации. Запустите насос на высокой скорости (около 100 мл/мин или удерживайте кнопку перемотки вперед на насос), чтобы удалить все СМИ от трубки, которая делает уборку гораздо легче. Когда опустели, отключите аппарат поток от насоса и удалить его от Микроскоп.
3. Очистите аппарат поток
- Удалите все компоненты не автоклавируемый (одноразовые компоненты, Пузырь ловушки и датчик температуры), и Автоклав аппарат поток для 30 min. отменить используются одноразовые компоненты, чистый зонд с 70% этиловом спирте и отложите в сторону Пузырь ловушки.
- После завершения автоклавирования, отказаться от средств массовой информации и промыть и отложите в сторону СМИ колбы. Затем повторно подключите Пузырь ловушки, подключите канал слайд ibidi использоваться для очистки (многоразовые), а система потока к насосу на месте, показанный на рисунке 1.
- Зажим закрыт клапан колбу оранжевый сторона роста.
- Место примерно 200 мл неразбавленный отбеливатель в стакан. Поместите резиновые пробки в отбеливателя и затем запустите насос с высокой скоростью распространить отбеливателя на протяжении всего потока аппарат (за исключением все фильтры). После того, как заполнены с хлоркой, остановите насос, потому что оставляя насос с высокой скоростью может носить и разорвать трубы.
- После отбеливания за 15 мин, удерживайте резиновые пробки выше стакан и запустите насос снова, чтобы удалить отбеливатель из потока аппарата.
- Повторите шаги 3.4 и 3.5, дважды с избыток воды вместо отбеливатель для промывания системы потока. В это время очистите фильтры только с водой, потому что другие чистящие вещества будут ржаветь или засорить фильтры.
- Место труб, что обычно будет подключаться к фильтр СМИ 0.2 мкм (исходя из 2 мкм FB) в стакан воды с резиновой пробки из шага 3.6.
- Отключение при входе 20 мкм встроенный фильтр, который может обычно быть растаскивают с легкостью несмотря на ушковый зажим трубы.
- Используйте длинные секции труб через запасные 3-отверстие пробкой и колбы вакуумного фильтра для создания вакуумной системы, которая может подключаться к аппарату потока.
- Подключите этот вакуумной системы к входу 20 мкм фильтр на входе и начать вакуума; Это будет тянуть воду через фильтры в обратном направлении, удаление омертвевших клеток.
- Тянуть по меньшей мере 200 мл воды через фильтры, а затем удалить труб от воды, чтобы очистить фильтр линии воды.
- Вакуумная система отключения от 20 мкм фильтром, и подключите фильтр для его нормального труб.
4. Количественная оценка видео
Примечание: Все файлы должны быть преобразованы в тег изображения (TIF) формат для работы. Кроме того для сравнения между эксперименты, важно, что все изображения взяты с же микроскоп и параметры визуализации, как обсуждалось выше.
- Скачать и установить ImageJ, если еще не установлен.
- Загрузите файл дополнительных макросов и поместите его в папку ImageJ\macros.
- Отрегулируйте указанный макрос:
- Откройте стек изображений от предыдущих эксперимента в ImageJ и выберите точку времени с клетки присутствуют.
- Выберите в меню через «изображение | Тип | 8-битный».
- Выберите в меню через «изображение | Отрегулируйте | Порог». Установите флажок «темный фон» . Установите в раскрывающемся меню справа на красный.
- Отрегулируйте меньшее значение до тех пор, пока все клетки покрыты в красном с минимальными избыточного шума (некоторые не клеточный speckling нормально и будут обрабатываться из макроса). Запишите это меньшее значение.
- Закройте окно порог и открыть изображение.
- Выберите в меню через «плагины | Макросы | Правка». Когда будет предложено открыть файл: «поднять уровень одной папки», затем выберите папку макросы и откройте файл макроса количественной оценки потока биопленки.
- Измените значение 15 во всех случаях «setThreshold (15, 255);» на значение, определенное на шаге 4.3.4. Сохраните файл и закройте это окно.
- Выберите в меню через «плагины | Макросы | Установки» и выберите файл количественной оценки потока биопленки.
- Теперь, согласно «плагины | Макрос» меню, шесть новых вариантов для различных видео количественной появляются. Выполнить полный анализ и выберите видео файлы вложений и роста при появлении запроса для всех имеющихся анализов на полученных данных и автоматически генерировать выходных файлов.
Результаты
Представитель изображения обычного ночь промежуток времени эксперимент с использованием одичал тип C. albicans клеток при 37 ° C можно увидеть в Рисунок 2A и 1 дополнительного видео. Изображения были контраст, расширение для улучшения ?...
Обсуждение
Использование системы потока изложенные выше позволяет поколения количественных покадровой видео биопленки грибковые роста и развития. Для проведения сравнений между эксперименты это исключительно важное значение для обеспечения визуализации параметры то же самое. Это включает в с...
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Авторы хотели бы признать доктор Wade Sigurdson для предоставления ценный вклад в дизайн аппарата потока.
Материалы
| Name | Company | Catalog Number | Comments |
| Pump | Cole Parmer | 07522-20 | 6 |
| Pump head | Cole Parmer | 77200-60 | 6 |
| Tubing | Cole Parmer | 96410-14 | N/A |
| Bubble trap adapter | Cole Parmer | 30704-84 | 3 |
| Bubble trap vacuum adapter for 1/4” ID vacuum line | Cole Parmer | 31500-55 | 3 |
| In-line filter adapter (4 needed) | Cole Parmer | 31209-40 | 8,9 |
| Orange-side Y | Cole Parmer | 31209-55 | 7 |
| Green-side Y | ibidi | 10827 | 2 |
| * Slides | ibidi | 80196 | 4 |
| * Slide luers | ibidi | 10802 | 4 |
| Vacuum assisted Bubble trap | Elveflow/Darwin microfluidics | KBTLarge - Microfluidic Bubble Trap Kit | 3 |
| Media flasks | Corning | 4980-500 | 1 |
| 0.2 µm air filter | Corning | 431229 | 1 |
| Threaded glass bottle for PD and filter flask (2 needed) | Corning | 1395-100 | 5,10 |
| Ported Screw cap for PD and filter flask (2 needed) | Wheaton | 1129750 | 5,10 |
| Screwcap tubing connector | Wheaton | 1129814 | 5,10 |
| Tubing connector beveled washer | Danco | 88579 | 5,10 |
| Tubing connector flat washer | Danco | 88569 | 5,10 |
| Clamps for in-line filters and downstream Y (7 needed) | Oetiker/MSC Industrial Supply Company | 15100002-100 | 7,8,9 |
| Clamp tool | Oetiker/MSC Industrial Supply Company | 14100386 | N/A |
| 20 μm in-line media filter | Analytical Scientific Instruments | 850-1331 | 8 |
| 10 μm in-line media filter | Analytical Scientific Instruments | 850-1333 | 9 |
| 2 μm inlet media filter | Supelco/Sigma-Aldrich | 58267 | 10 |
| * 0.22 µm media filter | Millipore | SVGV010RS | 11 |
| * 0.22 µm media filter “adapter” | BD Biosciences | 329654 | 11 |
| Rubber stopper | Fisher Scientific | 14-131E | 1 |
| Hotplate stirrer with external probe port | ThermoFisher Scientific | 88880006 | N/A |
| Temperature probe | ThermoFisher Scientific | 88880147 | N/A |
Ссылки
- Pankhurst, C. L. Candidiasis (oropharyngeal). BMJ clinical evidence. 2012, 1304 (2012).
- Ramage, G., Vandewalle, K., Wickes, B. L., López-Ribot, J. L. Characteristics of biofilm formation by Candida albicans. Revista iberoamericana de micología. 18 (4), 163-170 (2001).
- Nobile, C. J., Mitchell, A. P. Regulation of cell-surface genes and biofilm formation by the C. albicans transcription factor Bcr1p. Current biology: CB. 15 (12), 1150-1155 (2005).
- Blankenship, J. R., Mitchell, A. P. How to build a biofilm: a fungal perspective. Current opinion in microbiology. 9 (6), 588-594 (2006).
- Araújo, D., Henriques, M., Silva, S. Portrait of Candida Species Biofilm Regulatory Network Genes. Trends in microbiology. 25 (1), 62-75 (2017).
- Lane, W. O., et al. Parallel-plate flow chamber and continuous flow circuit to evaluate endothelial progenitor cells under laminar flow shear stress. Journal of visualized experiments. (59), e3349 (2012).
- Bakker, D. P., van der Plaats, A., Verkerke, G. J., Busscher, H. J., van der Mei, H. C. Comparison of velocity profiles for different flow chamber designs used in studies of microbial adhesion to surfaces. Applied and environmental microbiology. 69 (10), 6280-6287 (2003).
- Zhang, W., Sileika, T. S., Chen, C., Liu, Y., Lee, J., Packman, A. I. A novel planar flow cell for studies of biofilm heterogeneity and flow-biofilm interactions. Biotechnology and bioengineering. 108 (11), 2571-2582 (2011).
- Uppuluri, P., Lopez-Ribot, J. L. An easy and economical in vitro method for the formation of Candida albicans biofilms under continuous conditions of flow. Virulence. 1 (6), 483-487 (2010).
- Diaz, P. I., et al. Synergistic interaction between Candida albicans and commensal oral streptococci in a novel in vitro mucosal model. Infection and immunity. 80 (2), 620-632 (2012).
- McCall, A., Edgerton, M. Real-Time Approach to Flow Cell Imaging of Candida albicans Biofilm Development. Journal of fungi. 3 (1), 13 (2017).
- Zhang, B., Zerubia, J., Olivo-Marin, J. -. C. Gaussian approximations of fluorescence microscope point-spread function models. Applied optics. 46 (10), 1819-1829 (2007).
- Tati, S., et al. Candida glabrata Binding to Candida albicans Hyphae Enables Its Development in Oropharyngeal Candidiasis. PLoS pathogens. 12 (3), 1005522 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены