A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מולטי-סיב פונסה להקליט פעילות עצבית בבעלי חיים הנעים באופן חופשי
In This Article
Summary
פרוטוקול זה מפרט כיצד ליישם ולבצע הקלטות מרובות סיבים, כיצד לתקן את הפריטים שאינם תלויים בסידן, ושיקולים חשובים עבור הדמיה צבעונית כפולה.
Abstract
הקלטת הפעילות של קבוצת נוירונים בחיה הנעה בחופשיות היא משימה מאתגרת. יתר על כן, כמו המוח הוא גזור קבוצות קטנות יותר תפקודית פונקציונלי, הוא הופך להיות הראשון להקליט מן התחזיות ו/או המוגדרים גנטית תת אוכלוסיות של נוירונים. בדרך-אגב, מדובר בגישה הנגישה ורבת עוצמה היכולה להתגבר על האתגרים הללו. על-ידי שילוב מתודולוגיות אופטיות וגנטיות, ניתן למדוד את הפעילות העצבית במבני מוח עמוקים על-ידי הבעת הבעת מחווני סידן מקודדים גנטית, אשר מתרגמים את הפעילות העצבית לאות אופטי שניתן למדוד בקלות. הפרוטוקול הנוכחי מפרט את הרכיבים של מערכת מרובת סיבים מולטי-סיב, כיצד לגשת למבני מוח עמוקים כדי לספק ולאסוף אור, שיטה לחשבון ממצאים התנועה, וכיצד לעבד ולנתח אותות פלורסנט. הפרוטוקול מפרט שיקולים ניסיוניים בעת ביצוע דימות צבע יחיד וכפול, מסיבים אופטיים בודדים או מרובים.
Introduction
היכולת להתאים תגובות עצביות עם היבטים ספציפיים של התנהגות בעל חיים הוא קריטי כדי להבין את התפקיד קבוצה מסוימת של נוירונים משחק בבימוי או להגיב לפעולה או גירוי. בהתחשב במורכבות של התנהגות בעלי חיים, עם מספר רב של מדינות פנימיות וגירויים חיצוניים שיכולים להשפיע אפילו על הפשוטה ביותר של הפעולות, הקלטת אות עם החלטה חד משפט החוקרים עם הכלים הדרושים כדי להתגבר על אלה גבלות.
סיבים פואביל הפך להיות טכניקה של בחירה עבור חוקרים רבים בתחום של מערכות מדעי המוח בגלל הפשטות היחסית שלה לעומת אחרים בטכניקות הקלטה vivo, היחס הגבוה שלה האות לרעש, ואת היכולת להקליט במגוון של , תבניות התנהגותיות1,2,3.4,5,6,7,8 שלא כמו שיטות אלקטרופיזיולוגיות מסורתיות, פוגינסה היא הגישה האופטית הנפוצה ביותר בשילוב עם אינדיקטורים הסידן מקודד גנטית (הסמארה, סדרת GCaMP)9. הסמתים משנים את יכולתם לעבור בהתבסס על השאלה אם הם קשורים לסידן. בגלל הריכוז הפנימי של הסידן בנוירונים הוא מוסדר מאוד בחוזקה וערוצי סידן מגודרת לפתוח כאשר תא העצב יורה פוטנציאל פעולה, עליות חולף בריכוז הסידן הפנימי, אשר התוצאה עליות ארעי ב יכולת של הסמא לקרינה פלואורסצנטית, יכול להיות פרוקסי טוב לירי עצבי9.
עם מילוי סיבים אופטיים, אור העירור מכוון למטה, סיב אופטי רב-מצבי במצב למוח, ואות פליטה נאסף בחזרה דרך אותו סיבים. בגלל סיבים אופטיים אלה הם קלים משקל, בעלי חיים יכולים לנוע במידה רבה ללא הפריע, מה שהופך את הטכניקה הזאת תואם עם מגוון רחב של בדיקות התנהגותיות ותנאים. תנאים מסוימים, כגון תנועות מהירות או כיפוף של כבל טלאי סיבים אופטיים מעבר לרדיוס שבו הוא יכול לשמור על השתקפות פנימית מוחלטת, יכול להציג ממצאים האות. כדי לאותת מתוך רעש, נוכל לנצל את הרכוש של GCaMP המכונה "נקודת isosbestic". בקצרה, עם GCaMP, כמו אורך הגל של האור עירור הוא העביר שמאלה, הפליטה שלה במצב הסידן מאוגד פוחתת ואת הפליטה במצב הסידן מאוגד מגדיל במעט. הנקודה שבה האינטנסיביות היחסית של שתי הפליטות הללו שוות הוא כינה את נקודת isosbestic. כאשר GCaMP הוא נרגש בשלב זה, הפליטה שלה אינו מושפע על ידי שינויים בריכוזי סידן פנימיים, ושונות באות הוא בדרך כלל בשל הנחתה של האות מפני כיפוף יתר של כבל טלאי סיבים אופטיים או תנועה של רקמות עצביות ביחס לסיבים המושתל.
אלקטרופיזיולוגיה של יחידה בודדת היא עדיין תקן זהב עבור בחופשיות-נע הקלטות vivo בשל התא היחיד שלה ברמת ספייק רזולוציה. עם זאת, זה יכול להיות קשה לאתר את הזהות המולקולרית של התאים המוקלטת, וניתוח שלאחר-הוק יכול להיות מפרך למדי. בעוד הסיבים האופטיים אין ברזולוציה של תא יחיד, זה מאפשר לחוקרים לשאול שאלות בלתי אפשרי לטפל בטכניקות מסורתיות. שילוב של אסטרטגיות ויראליות עם בעלי חיים טרנסגניים, הביטוי של הסמפור יכול להיות מופנה לטיפוסים עצביים מוגדרים גנטית להקליט פעילות עצבית או הגדרת הקרנה, אשר ניתן לבצע על ידי ניטור אותות סידן ישירות באקסון טרמינל10,11. יתר על כן, על ידי שתילת הצינורית סיבים אופטיים מרובים, ניתן לנטר בו את הפעילות העצבית ממספר אזורי המוח ומסלולים באותה חיה12,13.
בכתב יד זה, אנו מתארים טכניקה עבור ליחיד ורב סיבים מרובה, כיצד לתקן את הפריטים עצמאיים סידן, ופרטים כיצד לבצע הקלטות מונו וצבע כפול. כמו כן, אנו מספקים דוגמאות לסוגי השאלות שהוא מאפשר לאדם לשאול ולרמות הגדלות של מורכבות (ראה איור 1). ההתקנה סיבים photometry עבור הקלטות multi-סיבים המפורטים בפרוטוקול זה ניתן לבנות באמצעות רשימה של חומרים שנמצאו ב https://sites.google.com/view/multifp/hardware (איור 2).
זה חיוני כי המערכת יהיה מצויד הן 410 ננומטר ו 470 אורכי גל הריגוש ננומטר עבור סידן עצמאית ו סידן התלות של הקרינה מGCaMP6 או המשתנים שלה. עבור הגדרות מותאמות אישית או אם אין תוכנה זמינה להפעלת המערכת, ניתן להשתמש בתוכנת קוד פתוח בונסאי (http://www.open-ephys.org/bonsai/) בחינם. לחילופין, ניתן להפעיל את הסיבים האופטיים באמצעות MATLAB (למשל, https://github.com/deisseroth-lab/multifiber)12 או שפת תכנות אחרת14. התוכנה והחומרה של המערכת צריך לאפשר מניפולציה הן 410 nm ו 470 נוריות ננומטר והמצלמה, הפקת תמונות (איור 2), וחישוב של עוצמת פלורסנט מתכוון באזורי העניין (rois) שצויר סביב הסיבים על התמונות. הפלט צריך להיות טבלה של ערכי עוצמה ממוצע שנרשמו עם 470 ננומטר ו 410 Led ננומטר מכל סיבים בכבל התיקון. בעת ביצוע ניסויים רב סיבים, 400 יקרומטר סיבים כרוכות עשוי להגביל את התנועה של עכברים. במקרים כאלה, מומלץ להשתמש במיתרי התיקון של 200 יקרומטר, המספקים גמישות רבה יותר. ייתכן גם שניתן יהיה להשתמש בכבלי דמה קטנים יותר במהלך אימון של עכברים.
זה חיוני כדי להיות מסוגל לחלץ נקודות זמן לאירועים של עניין במהלך רכישת סיבים photometry. אם המערכת אינה מספקת בקלות מערכת מובנית לשילוב TTLs עבור אירועים ספציפיים, אסטרטגיה חלופית היא להקצות חותמת זמן לנקודות זמן בודדות שנרשמו כדי להתיישר עם זמנים ואירועים ספציפיים במהלך הניסוי. ניתן לבצע הטבעה בזמן באמצעות שעון המחשב.
Protocol
כל הניסויים נעשו בהתאם לטיפול בבעלי חיים מוסדיים ובוועדות השימוש של אוניברסיטת קליפורניה, סן דייגו, והמדריך הקנדי לטיפול ולשימוש בבעלי חיים מעבדתיים ואושרו על ידי הגנת אוניברסיטת לאוול בעלי חיים וועדה.
1. יישור הנתיב האופטי בין מצלמת ה-CMOS (מוליך למחצה משלים מתכתי) לבין כבל התיקון הבודד או המסתעף
- שחרר את כל הברגים על מתרגם 5 הצירים (11, איור 2ב).
- בורג בכבל התיקון (12, איור 2B) למתאם [SMA (תת-מיניאטורי A) או FC (מחבר סיב אופטי)] המוצמדת למתרגם בן 5 הצירים.
- הפעל את האור 470 ננומטר (1, איור 2B) בצריכת חשמל נמוכה (100 μw), ומניחים את קצה הpatchcord מצביע על שקופית מפלסטיק אוטופלורנטית. אין לזה שום השפעה על הקלטות עתידיות אלא רק להמחיש את תהליך היישור.
- הקלטה ממצלמת ה-CMOS (13, איור 2B) במצב חי. הגדל את הרווח או התאם את טבלת בדיקת החיפוש (LUT) עד שהתמונה אינה שחורה לחלוטין. הנקודה היא להיות מסוגל לראות תמונה בנקודת המוקד של המטרה (10, איור 2B).
- מראש את מתרגם 5 צירים לכיוון המטרה, להבטיח כי אור ננומטר 470 ממורכז על הסיבים ב-SMA או קצה FC של כבל התיקון, עד שניתן יהיה לפתור תמונה במצלמה.
- התאימו את צירי X ו-Y עד שהתמונה תהיה ממורכזת ותיפתר היטב.
- דמיין את האור הנפלט מהקצה הפרכלל של כבל התיקון. הוא אמור להופיע כמעגל איזוטרופי. אם נעשה שימוש בכבל תיקון הסתעפות, כמות האור הנפלטת בקצות הקצה של כל כבל התיקון צריכה להיות דומה. אם העיגול אינו איזוטרופי או שהאור הנפלט אינו שוויוני, התאם את מתרגם 5 הצירים בציר X-Y.
2. ההתקנה של ROIs סביב סיבים למדידה של עוצמת פלורסנט מתכוון
- הפעל את כל האורות עירור כדי להמחיש טוב יותר את הסיבים. כוונן את מרווח המצלמה כך שאין פיקסלים רוויים ותמונה ברורה של הסיבים נמצאים.
- הקלטה בשידור חי או. שתיקחי תמונה ראשונית
- צייר ROIs סביב הסיבים ולשמור אותם למדידה של ערכי העוצמה ממוצע במהלך ההקלטות (איור 2א).
- עבור הקלטות סיבים מרובים, בדוק את העצמאות באותות.
- . שיא חי מכל הסיבים
- הצבע סיב אחד כלפי מקור אור והקש באצבע. תנודות גדולות מאוד צריך להתרחש אך ורק באותו ערוץ (דליפה מקובלת 1:1000).
- אם האותות אינם עצמאיים, לצייר מיותר ROIs שמרני ולחזור על בדיקת העצמאות.
- כדי לתייג ולעקוב אחר אילו ROI מתאים לאילו סיבים, סרט צבעוני או לק ציפורניים ניתן להחיל על סוף הסיבים. צלם תמונה לפני תחילת כל ניסוי כתזכורת משנית.
3. הכיוונון של זירת ההקלטה
- תלו את חוט התיקון מעל הזירה באמצעות דוכנים, מלחציים, או מחזיקי.
- ודא כי בעל החיים יכול לנוע בחופשיות ברחבי הזירה כולה, ללא עכבות על ידי אורך הסיבים.
- אם נעשה שימוש בתיבת אופרנט או בשדה פתוח, ודא שכבל התיקון יוכל להגיע לבעל החיים עם כיפוף מינימלי. אם זה דורש אף לתקוע, לוודא שיש מספיק תקורה החדר כדי למנוע כיפוף של סיבים. הימנע כיפוף מוגזם או פיתול של כבל התיקון.
4. בהקלטות vivo
הערה: הליך השתלת סיבי סיבים אופטיים לניסויים באופטיקה אופטית זהה לנוהל אלקטרואופטיקה כמתואר בספרטה et al15. אנו ממליצים להשתמש במלט שיניים (ראה טבלת חומרים), אשר מספק עיגון חזקה של כובע הראש אל עצם הגולגולת. מלט שיניים יהיה שימושי במיוחד במקרים שבהם עיגון ברגים לא ניתן להשתמש.
- לבדוק חזותית את הקצה המרוחק של סיבי חוט התיקון על ידי עין עם מיקרוסקופ minifiber. אם פני השטח של הסיבים שרוט, להבריק את הסיבים באמצעות ליטוש סיבים/השכלת הסרט עם חצץ בסדר (1 יקרומטר ו 0.3 יקרומטר).
- לנקות את הקצוות המרוחק של כבל התיקון עם 70% אתנול והמוליך קצה כותנה.
- נקו את הצינורית סיבים אופטיים תוך שימוש ב-70% אתנול והמוליך לעצת כותנה.
- חבר את קצה חזיות של חוט התיקון לסיבים מושתל באמצעות קרמיקה מפוצל שרוול מכוסה שפופרת פסיכיאטרית שחורה. במהלך החיבור, לוודא כי השרוול הוא הדוק, אחרת להשתמש בשרוול חדש.
הערה: תהיה כמות גדולה של אובדן האות אם יש מרווח בין כלל כבל התיקון לבין השתל, וההקלטות לא יפעלו. - הניחו לבעל החיים להתאושש מספר דקות לפני תחילת בדיקות ההתנהגות.
- תתחיל להקליט את האות האופטי. ולהריץ את הניסוי
- במהלך ההקלטה, שים עין על מעקב החיים כדי להבטיח הקלטות איכותיות. האות צפוי להצטמצם במהירות כפונקציה של זמן ב-2 הדקות הראשונות של ההקלטה. השפעה זו נגרמת על ידי החום בתיווך LED ריקבון, לפיה הגידול בחום מגביר את ההתנגדות של האלמנט האופטי.
- אם קפיצה באות העולה/ביטול קינטיקה של GCaMP מתרחשת, זה לעתים קרובות אינדיקציה כי השרוול הוא לא הדוק מספיק את החלל בין כבל התיקון לבין השתל משתנה. במקרה זה, לעצור את הניסוי ולחבר מחדש את החיה באמצעות שרוול חדש.
5. בדיקות מידע לאופטיקה
הערה: זוהי שיטה לניתוח נתונים הפועל היטב עבור רוב ההקלטות. עם זאת, ניתן ליישם גישות חלופיות. ניתן למצוא כאן קוד לדוגמה לניתוח נתונים: https://github.com/katemartian/Photometry_data_processing.
- תמצית המשמעות של העוצמה הפלואורסצנטית ערכים שנרשמו מ 470 nm (int470) ו 410 Nm (Int410) נוריות, המתאימות לכל סיב בודד.
- חלק כל אות באמצעות אלגוריתם ממוצע נע (איור 3א).
- ביצוע תיקון בסיסי של כל אות (איור 3A ו -3b) באמצעות באופן מסתגל משוקלל מחדש ריבועים לפחות נענש (airpls) אלגוריתם (https://github.com/zmzhang/airPLS) כדי להסיר את המדרון ואת התדר הנמוך תנודות באותות.
- תקנן כל אות באמצעות הערך הממוצע וסטיית התקן (איור 3ג):
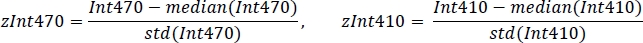
- שימוש ברגרסיה ליניארית חזקה שאינה שלילית, התאמה סטנדרטית של zint410 ל-zint470 אותות (איור 3ד) לפונקציית הרגרסיה:
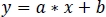
- השתמש בפרמטרים של רגרסיה ליניארית (a, b) כדי למצוא ערכים חדשים של Zint410 מצויד zint470 (fitint410, איור 3D, E):
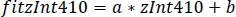
- השתמש בפרמטרים של רגרסיה ליניארית (a, b) כדי למצוא ערכים חדשים של Zint410 מצויד zint470 (fitint410, איור 3D, E):
- חישוב dFמנורמל/f (z DF/F) (איור 3f):
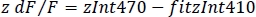
6. הקלטות בצבע כפול בו
- הוסף למערכת הפוטופונסה 560 ננומטר LED כדי להלהיב את חיישן הסידן פלורסנט אדום ומראות דיקרואיק מתאים ומסננים (ראה קים et al., 2016 לתיאור מפורט)12.
- הוסיפו מפצל תמונה בין המטרה למצלמת ה-CMOS כדי להפריד בין אורכי גל הפליטה הירוק והאדום (ראה איור 5). מפצל התמונה יהיה ליצור שתי תמונות משוקף על חיישן המצלמה, המתאים אותות אדום וירוק (למשל, כבל טלאי עם 3 ענפים תיצור תמונה עם 6 סיבים).
- צייר ROIs סביב כל הסיבים בשני הצבעים כמפורט לעיל. הקפד לזהות בבירור כל ROI עם סיבים וערוצים המתאימים (ירוק ואדום) (איור 4א).
- ההדק עירור סימולטני עם 470 ננומטר ו 560 Led ננומטר ולסירוגין אותם עם 410 ננומטר LED (איור 5א).
7. ניתוח נתונים בצבע כפול
- בצע את השלבים בסעיף 5 כדי למצוא Fitint410 עבור האות Int470 ולחשב z dF/F.
- מכיוון שהנקודה האיזוסיסטית לאדום-השתנה היא בדרך כלל לא ידועה, האות שנרשם עם 410 ננומטר LED בערוץ הירוק יכול לשמש לתיקון תנועה בשני הערוצים. בצע את השלבים בסעיף 5 כדי למצוא Fitint410 עבור האות Int560 ולחשב z dF/F.
תוצאות
ההתנהגות העצבית של תגובות התנהגותיות יכולה להשתנות בהתאם למגוון גורמים. בדוגמה זו, השתמשנו vivo סיבים למדוד את הפעילות של מסופי אקסון מן האזור ההיפותלמי לרוחב (lha) כי לסיים habenula לרוחב (lha). עכברים סוג פראי הוזרקו עם וירוס הקשורים adeno (AAV) קידוד GCaMP6s (AAV-hSyn-GCaMP6s) ב LHA ו סיבים אופטיים הושתל עם הטיפ מיד...
Discussion
הסיבים האופטיים היא גישה נגישה המאפשרת לחוקרים להקליט בכמויות גדולות-סידן דינמיקה מתוך אוכלוסיות נוירואליות מוגדרות בעלי חיים הנעים בחופשיות. שיטה זו יכולה להיות משולבת עם מגוון רחב של בדיקות התנהגותיות, כולל משימות "תנועה כבד" כגון בדיקות לשחות כפויה2, פחד מיזוג18
Disclosures
סייג ' אהרונסון הינו המנכ ל ומייסד נוירופומטריקה בע מ, המוכרת מערכות מולטי-סיבים לפוטופייבר.
Acknowledgements
עבודה זו נתמכת על ידי מענק ממדעי הטבע ומועצת המחקר ההנדסה של קנדה (NSERC: RGPIN-2017-06131) כדי סי C. P הוא משמש FRSQ שבצ בורסייר. אנו מודים גם Plateforme d'Outils Moléculaires (https://www.neurophotonics.ca/fr/pom) לייצור וקטורים ויראליים המשמשים במחקר זה.
Materials
| Name | Company | Catalog Number | Comments |
| 1/4"-20 Stainless Steel Cap Screw, 1" Long | Thorlabs | SH25S100 | |
| 1/4"-20 Stainless Steel Cap Screw, 1/2" Long | Thorlabs | SH25S050 | |
| 1/4"-20 Stainless Steel Cap Screw, 3/8" Long | Thorlabs | SH25S038 | |
| 1000 µm, 0.50 NA, SMA-SMA Fiber Patch Cable | Thorlabs | M59L01 | |
| 12.7 mm Optical Post | Thorlabs | TR30/M | |
| 12.7 mm Pedestal Post Holder | Thorlabs | PH20EM | |
| 15 V, 2.4 A Power Supply Unit with 3.5 mm Jack Connector for T-Cube | Thorlabs | KPS101 | |
| 20x objective | Thorlabs | RMS20X | #10 in Figure 2, #11 in Figure 5 |
| 30 mm Cage Cube with Dichroic Filter Mount | Thorlabs | CM1-DCH/M | #8-9 in Figure 2, #8-10 in Figure 5 |
| 405 nm LED | Doric Lenses | CLED_405 | #2 in Figure 2 |
| 410 nm bandpass filter | Thorlabs | FB410-10 | #5 in Figure 2; #7 in Figure 5 |
| 465 nm. LED | Doric Lenses | CLED_465 | #1 in Figure 2 |
| 470 nm bandpass filter | Thorlabs | FB470-10 | #4 in Figure 2; #6 in Figure 5 |
| 560 nm bandpass filter | Semrock | FF01-560/14-25 | #5 in Figure 5 |
| 560 nm LED | Doric Lenses | CLED_560 | #1 in Figure 3 |
| 5-axis kinematic Mount | Thorlabs | K5X1 | #11 in Figure 2, #12 in Figure 5 |
| Achromatic Doublet | Thorlabs | AC254-035-A-ML | #7 in Figure 2 |
| Adaptor for 405 collimator | Thorlabs | AD11F | #3 in Figure 2; #4 in Figure 5 |
| Adaptor for ajustable collimator | Thorlabs | AD127-F | #3 in Figure 2; #4 in Figure 5 |
| Aluminum Breadboard | Thorlabs | MB1824 | |
| Clamping Fork | Thorlabs | CF125 | |
| Cube connector | Thorlabs | CM1-CC | |
| Dual 493/574 dichroic | Semrock | FF493/574-Di01-25x36 | #10 in Figure 5 |
| Emission filter for GCaMP6 | Semrock | FF01-535/22-25 | #6 in Figure 2 |
| Enclosure with Black Hardboard Panels | Thorlabs | XE25C9 | |
| Externally SM1-Threaded End Cap for Machining | Thorlabs | SM1CP2M | |
| Fast-change SM1 Lens Tube Filter Holder | Thorlabs | SM1QP | #4-6 in Figure 2, #5-7 in Figure 5 |
| Fixed Collimator for 405 nm light | Thorlabs | F671SMA-405 | #3 in Figure 2; #4 in Figure 5 |
| Fixed collimator for 470 and 560 nm light | Thorlabs | F240SMA-532 | #3 in Figure 2; #4 in Figure 5 |
| Green emission filter | Semrock | FF01-520/35-25 | In light beam splitter |
| High-Resolution USB 3.0 CMOS Camera | Thorlabs | DCC3260M | #13 in Figure 2, #15 in Figure 5 |
| Light beam splitter | Neurophotometrics | SPLIT | #14 in Figure 5 |
| Longpass Dichroic Mirror, 425 nm Cutoff | Thorlabs | DMLP425R | #8 in Figure 2, #9 in Figure 5 |
| Longpass Dichroic Mirror, 495 nm Cutoff | Semrock | FF495-Di03 | #9 in Figure 2, #8 in Figure 5 |
| Metabond dental cement | C&B | ||
| M8 - M8 cable | Doric Lenses | Cable_M8-M8 | |
| Optic fiber cannulas | Doric Lenses | Need to specify that these will be used to photometry experiments requiring low autofluorescence | |
| Optic fiber Patchcords | Doric Lenses | Need to specify that these will be used to photometry experiments requiring low autofluorescence | |
| Red emission filter | Semrock | FF01-600/37-25 | In light beam splitter |
| T7 LabJack | LabJack | ||
| T-cube LED Driver | Thorlabs | LEDD1B | |
| USB 3.0 I/O Cable, Hirose 25, for DCC3240 | Thorlabs | CAB-DCU-T3 |
References
- Gunaydin, L. A., et al. Natural Neural Projection Dynamics Underlying Social Behavior. Cell. 157 (7), 1535-1551 (2014).
- Proulx, C. D., et al. A neural pathway controlling motivation to exert effort. Proceedings of the National Academy of Sciences of the United States of America. 115 (22), 5792-5797 (2018).
- Muir, J., et al. In Vivo Fiber Photometry Reveals Signature of Future Stress Susceptibility in Nucleus Accumbens. Neuropsychopharmacology. 43 (2), 255-263 (2017).
- Wang, D., et al. Learning shapes the aversion and reward responses of lateral habenula neurons. eLife. 6, (2017).
- de Jong, J. W., et al. A Neural Circuit Mechanism for Encoding Aversive Stimuli in the Mesolimbic Dopamine System. Neuron. 101 (1), 133-151 (2018).
- Lerner, T. N., et al. Intact-Brain Analyses Reveal Distinct Information Carried by SNc Dopamine Subcircuits. Cell. 162 (3), 635-647 (2015).
- Calipari, E. S., et al. In vivo imaging identifies temporal signature of D1 and D2 medium spiny neurons in cocaine reward. Proceedings of the National Academy of Sciences of the United States of America. 113 (10), 2726-2731 (2016).
- González, A. J., et al. Inhibitory Interplay between Orexin Neurons and Eating. Current Biology. 26 (18), 2486-2491 (2016).
- Chen, T. -. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Barker, D. J., et al. Lateral Preoptic Control of the Lateral Habenula through Convergent Glutamate and GABA Transmission. Cell Reports. 21 (7), 1757-1769 (2017).
- Siciliano, C. A., Tye, K. M. Leveraging calcium imaging to illuminate circuit dysfunction in addiction. Alcohol. 74, 47-63 (2018).
- Kim, C. K., et al. Simultaneous fast measurement of circuit dynamics at multiple sites across the mammalian brain. Nature Methods. 13 (4), 325-328 (2016).
- Sych, Y., Chernysheva, M., Sumanovski, L. T., Helmchen, F. High-density multi-fiber photometry for studying large-scale brain circuit dynamics. Nature Methods. 16 (6), 553-560 (2019).
- Akam, T., Walton, M. E. pyPhotometry: Open source Python based hardware and software for fiber photometry data acquisition. Scientific Reports. 9 (1), 3521 (2019).
- Sparta, D. R., et al. Construction of implantable optical fibers for long-term optogenetic manipulation of neural circuits. Nature Protocol. 7 (1), 12-23 (2011).
- Stamatakis, A. M., et al. Lateral Hypothalamic Area Glutamatergic Neurons and Their Projections to the Lateral Habenula Regulate Feeding and Reward. The Journal of Neuroscience. 36 (2), 302-311 (2016).
- Tervo, G. D., et al. A Designer AAV Variant Permits Efficient Retrograde Access to Projection Neurons. Neuron. 92 (2), 372-382 (2016).
- Yu, K., da Silva, P., Albeanu, D. F., Li, B. Central Amygdala Somatostatin Neurons Gate Passive and Active Defensive Behaviors. The Journal of Neuroscience. 36 (24), 6488-6496 (2016).
- Falkner, A. L., Grosenick, L., Davidson, T. J., Deisseroth, K., Lin, D. Hypothalamic control of male aggression-seeking behavior. Nature Neuroscience. 19 (4), 596-604 (2016).
- Ren, J., et al. Anatomically Defined and Functionally Distinct Dorsal Raphe Serotonin Sub-systems. Cell. 175 (2), 472-487 (2018).
- Barnett, L. M., Hughes, T. E., Drobizhev, M. Deciphering the molecular mechanism responsible for GCaMP6m’s Ca2+-dependent change in fluorescence. PLOS ONE. 12 (2), 0170934 (2017).
- Sun, F., et al. A Genetically Encoded Fluorescent Sensor Enables Rapid and Specific Detection of Dopamine in Flies, Fish, and Mice. Cell. 174 (2), 481-496 (2018).
- Patriarchi, T., et al. Ultrafast neuronal imaging of dopamine dynamics with designed genetically encoded sensors. Science. 360 (6396), (2018).
- Feng, J., et al. A Genetically Encoded Fluorescent Sensor for Rapid and Specific In Detection of Norepinephrine. Neuron. 102 (4), 745-761 (2019).
- Akerboom, J., et al. Genetically encoded calcium indicators for multi-color neural activity imaging and combination with optogenetics. Frontiers in Molecular Neuroscience. 6, 1-29 (2013).
- Dana, H., et al. Sensitive red protein calcium indicators for imaging neural activity. eLife. 5, (2016).
- Wang, H., Jing, M., Li, Y. Lighting up the brain: genetically encoded fluorescent sensors for imaging neurotransmitters and neuromodulators. Current Opinion in Neurobiology. 50, 171-178 (2018).
- Lu, L., et al. Wireless optoelectronic photometers for monitoring neuronal dynamics in the deep brain. Proceedings of the National Academy of Sciences. 115 (7), 1374-1383 (2018).
- Jennings, J. H., et al. Visualizing Hypothalamic Network Dynamics for Appetitive and Consummatory Behaviors. Cell. 160 (3), 516-527 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved