Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Photométrie multifibres pour enregistrer l'activité neuronale chez les animaux en mouvement libre
Dans cet article
Résumé
Ce protocole détaille comment mettre en œuvre et exécuter des enregistrements de photométrie multifibres, comment corriger les artefacts indépendants du calcium et des considérations importantes pour l'imagerie photométrie bicolore.
Résumé
Enregistrer l'activité d'un groupe de neurones chez un animal en mouvement libre est une entreprise difficile. En outre, comme le cerveau est disséqué en sous-groupes fonctionnels de plus en plus petits, il devient primordial d'enregistrer à partir de projections et/ ou de sous-populations génétiquement définies de neurones. La photométrie en fibre est une approche accessible et puissante qui peut surmonter ces défis. En combinant des méthodologies optiques et génétiques, l'activité neuronale peut être mesurée dans des structures cérébrales profondes en exprimant des indicateurs de calcium génétiquement codés, qui traduisent l'activité neuronale en un signal optique qui peut être facilement mesuré. Le protocole actuel détaille les composants d'un système de photométrie multifibres, comment accéder aux structures profondes du cerveau pour délivrer et recueillir la lumière, une méthode pour rendre compte des artefacts de mouvement, et comment traiter et analyser les signaux fluorescents. Le protocole détaille les considérations expérimentales lors de l'exécution de l'imagerie mono et double couleur, à partir de fibres optiques implantées simples ou multiples.
Introduction
La capacité de corréler les réponses neuronales avec des aspects spécifiques du comportement d'un animal est essentielle pour comprendre le rôle qu'un groupe particulier de neurones joue dans la direction ou la réponse à une action ou un stimulus. Compte tenu de la complexité du comportement animal, avec la myriade d'états internes et de stimuli externes qui peuvent affecter même les actions les plus simples, l'enregistrement d'un signal avec une résolution d'essai unique équipe les chercheurs avec les outils nécessaires pour surmonter ces Limitations.
La photométrie de fibre est devenue la technique de choix pour beaucoup de chercheurs dans le domaine des neurosciences de systèmes en raison de sa simplicité relative comparée à d'autres techniques d'enregistrement in vivo, de son rapport signal-bruit élevé, et de la capacité d'enregistrer dans une série de paradigmes comportementaux1,2,3,4,5,6,7,8. Contrairement aux méthodes électrophysiologiques traditionnelles, la photométrie est l'approche optique la plus couramment utilisée en conjonction avec des indicateurs de calcium génétiquement codés (GECIs, la série GCaMP)9. Les GECI modifient leur capacité à fluorer en fonction du fait qu'ils sont ou non liés au calcium. Parce que la concentration interne de calcium dans les neurones est très étroitement réglementée et les canaux de calcium à rayons de tension s'ouvrent lorsqu'un neurone déclenche un potentiel d'action, les augmentations transitoires de la concentration interne de calcium, qui se traduisent par des augmentations transitoires de la capacité d'un GECI à la fluorescence, peut être un bon proxy pour le tir neuronal9.
Avec la photométrie de fibre, la lumière d'excitation est dirigée vers le bas une fibre optique mince et multimode dans le cerveau, et un signal d'émission est rassemblé vers le haut par la même fibre. Parce que ces fibres optiques sont légères et pliables, un animal peut se déplacer en grande partie sans entrave, ce qui rend cette technique compatible avec un large éventail de tests et de conditions comportementales. Certaines conditions, telles que les mouvements rapides ou la flexion du cordon de patch de fibre optique au-delà du rayon auquel il peut maintenir la réflexion interne totale, peuvent introduire des artefacts de signal. Pour désambiguer le signal du bruit, nous pouvons exploiter une propriété de GCaMP connue sous le nom de « point isosbestique ». En bref, avec GCaMP, comme la longueur d'onde de la lumière d'excitation est décalée vers la gauche, son émission dans l'état de calcium-lié diminue et l'émission dans l'état de calcium-unbound augmente légèrement. Le point auquel l'intensité relative de ces deux émissions est égale est appelé le point isosbestic. Lorsque GCaMP est excité à ce stade, son émission n'est pas affectée par les changements dans les concentrations internes de calcium, et la variance dans le signal est le plus souvent due à l'atténuation du signal de la surflexion du cordon de patch de fibre optique ou le mouvement du tissu neural par rapport à la fibre implantée.
L'électrophysiologie d'une seule unité demeure l'étalon-or pour les enregistrements in vivo en mouvement libre en raison de sa résolution de niveau à cellule unique et à un seul pic. Cependant, il peut être difficile d'identifier l'identité moléculaire des cellules enregistrées, et l'analyse post-hoc peut être assez laborieuse. Bien que la photométrie en fibre n'ait pas de résolution unicellulaire, elle permet aux chercheurs de poser des questions impossibles à aborder avec les techniques traditionnelles. Combinant des stratégies virales avec des animaux transgéniques, l'expression des IGE peut être dirigée vers des types neuronaux génétiquement définis pour enregistrer l'activité neuronale définie par la population ou la projection, qui peut être effectuée en surveillant le signal calcique directement à l'axone terminaux10,11. En outre, en implantant de multiples canules à fibres optiques, il est possible de surveiller simultanément l'activité neuronale de plusieurs régions et voies du cerveau chez le même animal12,13.
Dans ce manuscrit, nous décrivons une technique pour la photométrie simple et multi-fibre, comment corriger pour les artefacts calcium-indépendants, et détailler comment exécuter des enregistrements mono- et dual-color. Nous fournissons également des exemples des types de questions qu'il permet de poser et de leur niveau croissant de complexité (voir la figure 1). La configuration de la photométrie en fibre pour les enregistrements multifibres détaillés dans ce protocole peut être construite à l'aide d'une liste de matériaux trouvés à https://sites.google.com/view/multifp/hardware (Figure 2).
Il est essentiel que le système soit équipé pour les longueurs d'onde d'excitation de 410 nm et 470 nm pour les émissions de fluorescence dépendantes du calcium et du calcium de GCaMP6 ou de ses variantes. Pour les configurations personnalisées ou s'il n'y a pas de logiciel disponible pour exécuter le système, le programme libre et open source Bonsai (http://www.open-ephys.org/bonsai/) peut être utilisé. Alternativement, la photométrie en fibre peut être exécuté par MATLAB (par exemple, https://github.com/deisseroth-lab/multifiber)12 ou tout autre langage de programmation14. Le logiciel et le matériel du système devraient permettre la manipulation des LED de 410 nm et 470 nm et de la caméra, l'extraction d'images (figure 2), et le calcul de l'intensité fluorescente moyenne dans les régions d'intérêt (ROI) dessinées autour des fibres sur les images. La sortie devrait être un tableau des valeurs d'intensité moyennes enregistrées avec les LED de 470 nm et 410 nm de chaque fibre dans le cordon de correction. Lors de l'exécution d'expériences multifibres, les fibres groupées de 400 m peuvent limiter le mouvement des souris. Dans de tels cas, nous vous recommandons d'utiliser des cordons patch de 200 m, qui offrent plus de flexibilité. Il peut également être possible d'utiliser de plus petits câbles factices pendant la formation des souris.
Il est crucial d'être en mesure d'extraire des points de temps pour les événements d'intérêt lors de l'acquisition de la photométrie fibre. Si le système ne fournit pas facilement un système intégré pour intégrer les TTL pour des événements spécifiques, une autre stratégie consiste à attribuer un horodatage aux points de temps individuels enregistrés pour s'aligner sur des moments et des événements spécifiques au cours de l'expérience. L'estampage peut être fait à l'aide de l'horloge de l'ordinateur.
Access restricted. Please log in or start a trial to view this content.
Protocole
Toutes les expériences ont été faites conformément aux comités institutionnels de soins et d'utilisation des animaux de l'Université de Californie à San Diego et au Guide canadien pour le soin et l'utilisation des animaux de laboratoire et ont été approuvées par l'Université Laval Protection des animaux. comité.
1. Alignement de la trajectoire optique entre la caméra CMOS (semi-conducteur d'oxyde métallique complémentaire) et le cordon de patch individuel ou ramifié
- Relâchez toutes les vis sur le traducteur à 5 axes (11, figure 2B).
- Visdans le cordon de patch (12, Figure 2B) à l'adaptateur [SMA (sous-miniature A) ou FC (connecteur à fibre optique)] qui est apposé sur le traducteur à 5 axes.
- Allumez la lumière d'excitation de 470 nm (1, figure 2B) à basse puissance (100 W), et placez la pointe du patchcord pointant vers une glissière en plastique autofluorescent. Cela n'a aucune incidence sur les enregistrements futurs, mais uniquement pour visualiser le processus d'alignement.
- Enregistrement de la caméra CMOS (13, Figure 2B) en mode live. Augmentez le gain ou ajustez la table de recherche (LUT) jusqu'à ce que l'image ne soit pas entièrement noire. Le point est de pouvoir voir une image au point focal de l'objectif (10, Figure 2B).
- Avancez le traducteur à 5 axes vers l'objectif, en veillant à ce que la lumière de 470 nm soit centrée sur la fibre à l'extrémité SMA ou FC du cordon patch, jusqu'à ce qu'une image puisse être résolue sur la caméra.
- Ajustez les axes X et Y jusqu'à ce que l'image soit centrée et bien résolue.
- Visualisez la lumière émise par l'extrémité de ferrule du cordon de correction. Il doit apparaître comme un cercle isotropique. Si un cordon de correction de ramification est utilisé, la quantité de lumière émise aux extrémités de ferrule de chaque cordon de correction devrait être semblable. Si le cercle n'est pas isotropique ou si la lumière émise est inégale, ajustez le traducteur à 5 axes dans l'axe X-Y.
2. Configuration des ROIs autour des fibres pour la mesure de l'intensité fluorescente moyenne
- Allumez toutes les lumières d'excitation pour mieux visualiser les fibres. Ajuster le gain de la caméra de telle sorte qu'aucun pixel n'est saturé et une image claire des fibres sont présentes.
- Enregistrez en direct ou prenez une image préliminaire.
- Dessiner des ROIs autour des fibres et les garder pour la mesure des valeurs moyennes d'intensité pendant les enregistrements (Figure 2A).
- Pour les enregistrements de fibres multiples, testez l'indépendance dans les signaux.
- Enregistrement en direct de toutes les fibres.
- Pointez une fibre vers une source lumineuse et appuyez sur un doigt. De très grandes fluctuations devraient se produire uniquement dans ce canal (fuite acceptable 1:1000).
- Si les signaux ne sont pas indépendants, redessiner des ROI plus conservateurs et répéter le test d'indépendance.
- Pour étiqueter et garder une trace de ce retour sur investissement correspond à laquelle la fibre, le ruban adhésif coloré ou le vernis à ongles peuvent être appliqués à l'extrémité des fibres. Prenez une photo avant le début de toute expérience comme un rappel secondaire.
3. Configuration de l'arène d'enregistrement
- Accrochez le cordon de correction au-dessus de l'arène à l'aide de gradins, de pinces ou de supports.
- Assurez-vous que l'animal peut se déplacer librement dans toute l'arène, décomplexé par la longueur de la fibre.
- Qu'il s'agisse d'une boîte d'opéra ou d'un champ ouvert, assurez-vous que le cordon de correction sera en mesure d'atteindre l'animal avec une flexion minimale. Si cela nécessite un nez poke, assurez-vous qu'il ya assez d'espace au-dessus pour empêcher la flexion de la fibre. Évitez toute flexion ou torsion excessive du cordon de correction.
4. Enregistrements in vivo
REMARQUE: La procédure d'implantation de canule de fibre optique pour des expériences de photométrie de fibre est identique à la procédure pour l'optogénétique comme décrit dans Sparta et autres15. Nous vous recommandons d'utiliser du ciment dentaire (voir Table of Materials), qui fournit un ancrage robuste de la tête de l'os du crâne. Le ciment dentaire sera particulièrement utile dans les cas où les vis d'ancrage ne peuvent pas être utilisées.
- Inspecter visuellement l'extrémité distale des fibres du cordon patch à l'œil et avec un microscope minifibre. Si la surface des fibres est rayée, repolish les fibres en utilisant le fildeur de fibre / film de clapotis avec du grain fin (1 m et 0,3 m).
- Nettoyez les extrémités distales du cordon de correction avec 70% d'éthanol et un applicateur de pointe de coton.
- Nettoyez les canules à fibres optiques à l'aide de 70 % d'éthanol et d'un applicateur de pointe de coton.
- Connectez l'extrémité de ferrule du cordon de correction à la fibre implantée utilisant une manche fendue en céramique couverte d'un tube de rétrécissement noir. Pendant la connexion, assurez-vous que la manche est serrée, sinon utilisez un nouveau manchon.
REMARQUE : Il y aura une grande quantité de perte de signal s'il y a n'importe quel espace entre la ferrule de corde de correction et l'implant, et les enregistrements ne fonctionneront pas. - Permettre à l'animal de récupérer quelques minutes avant le début des tests comportementaux.
- Commencez à enregistrer le signal optique et exécutez l'expérience.
- Tout en enregistrant, gardez un œil attentif sur le live-trace pour assurer des enregistrements de qualité. On s'attend à ce que le signal diminue rapidement en fonction du temps dans les 2 premières min de l'enregistrement. Cet effet est causé par la désintégration LED à médiation thermique, par laquelle l'augmentation de la chaleur augmente la résistance de l'élément optique.
- Si un saut dans le signal qui dépasse la cinétique on/off de GCaMP se produit, c'est souvent une indication que la manche n'est pas assez serrée et l'espace entre le cordon de correction et l'implant change. Dans ce cas, arrêtez l'expérience et reconnectez l'animal à l'aide d'un nouveau manchon.
5. Analyse des données de photométrie en fibre
REMARQUE : Il s'agit d'une méthode d'analyse de données qui fonctionne bien pour la plupart des enregistrements. Cependant, d'autres approches peuvent être mises en œuvre. Exemple de code pour l'analyse des données peut être trouvé ici: https://github.com/katemartian/Photometry_data_processing.
- Extrait des valeurs moyennes d'intensité de fluorescence enregistrées à partir de 470 nm(Int470) et 410 nm(Int410) LED, correspondant à chaque fibre individuelle.
- Lisser chaque signal à l'aide d'un algorithme de moyenne mobile (Figure 3A).
- Effectuer la correction de base de chaque signal(figure 3A et 3B) à l'aide de l'algorithme de moindre souper pénalisé (https://github.com/zmzhang/airPLS) réévalué par itérativement (airPLS) pour enlever la pente et la basse fréquence fluctuations des signaux.
- Normaliser chaque signal en utilisant la valeur moyenne et l'écart type (Figure 3C):
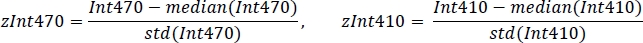
- En utilisant la régression linéaire robuste non négative, adapter zInt410 standardisé à zInt470 signaux (Figure 3D) à la fonction de régression:
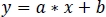
- Utilisez les paramètres de la régression linéaire (a, b) pour trouver de nouvelles valeurs de zInt410 monté s'adapter à zInt470(fitInt410, Figure 3D,E):
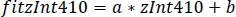
- Utilisez les paramètres de la régression linéaire (a, b) pour trouver de nouvelles valeurs de zInt410 monté s'adapter à zInt470(fitInt410, Figure 3D,E):
- Calculer le dFnormalisé /F (z dF/F) (Figure 3F):
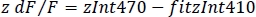
6. Enregistrements bicolores simultanés
- Ajoutez au système de photométrie une LED de 560 nm pour exciter le capteur de calcium fluorescent rouge et les miroirs et filtres dichroiques appropriés (voir Kim et al., 2016 pour une description détaillée)12.
- Ajouter un séparateur d'images entre l'objectif et la caméra CMOS pour séparer les longueurs d'onde d'émission vertes et rouges (voir la figure 5). Le séparateur d'image formera deux images miroirs sur le capteur de la caméra, correspondant aux signaux rouges et verts (par exemple, un cordon patch avec 3 branches créera une image avec 6 fibres).
- Dessinez des ROIs autour de toutes les fibres dans les deux couleurs comme détaillé ci-dessus. Assurez-vous d'identifier clairement chaque retour sur investissement avec la fibre et le canal correspondants (vert et rouge) (Figure 4A).
- Déclencher l'excitation simultanée avec 470 nm et 560 nm LED et les alterner avec 410 nm LED (Figure 5A).
7. Analyse de données double couleur
- Suivez les étapes de la section 5 pour trouver fitInt410 pour le signal Int470 et calculer z dF/F.
- Étant donné que le point isosbestic pour les GECI rouges décalés est généralement inconnu, le signal enregistré avec 410 nm LED dans le canal vert peut être utilisé pour la correction du mouvement à travers les deux canaux. Suivez les étapes de la section 5 pour trouver fitInt410 pour le signal Int560 et calculer z dF/F.
Access restricted. Please log in or start a trial to view this content.
Résultats
Les corrélations neuronales des réponses comportementales peuvent varier en fonction d'une variété de facteurs. Dans cet exemple, nous avons utilisé la photométrie in vivo de fibre pour mesurer l'activité des terminaux d'axone de la zone hypothalamic latérale (LHA) qui se terminent dans le habenula latéral (LHb). Des souris de type sauvage ont été injectées avec un virus adéno-associé (AAV) codant gCaMP6s (AAV-hSyn-GCaMP6s) dans le LHA et une fibre optique a été implantée avec la pointe immédiatement au...
Access restricted. Please log in or start a trial to view this content.
Discussion
La photométrie par fibre est une approche accessible qui permet aux chercheurs d'enregistrer la dynamique du calcium en vrac à partir de populations neuronales définies chez les animaux en mouvement libre. Cette méthode peut être combinée avec un large éventail de tests comportementaux, y compris "mouvement lourd" tâches telles que les tests de natation forcée2, la peur conditionnement18, interactions sociales1,4...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Sage Aronson est le PDG et fondateur de Neurophotometrics Ltd., qui vend des systèmes de photométrie multifibres.
Remerciements
Ces travaux ont été appuyés par une subvention du Conseil de recherches en sciences naturelles et en génie du Canada (CRSNG : RGPIN-2017-06131) à C.P. C. P. est un chercheur-boursier frSQ. Nous remercions également la Plateforme d'Outils Moléculaires (https://www.neurophotonics.ca/fr/pom) pour la production des vecteurs viraux utilisés dans cette étude.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 1/4"-20 Stainless Steel Cap Screw, 1" Long | Thorlabs | SH25S100 | |
| 1/4"-20 Stainless Steel Cap Screw, 1/2" Long | Thorlabs | SH25S050 | |
| 1/4"-20 Stainless Steel Cap Screw, 3/8" Long | Thorlabs | SH25S038 | |
| 1000 µm, 0.50 NA, SMA-SMA Fiber Patch Cable | Thorlabs | M59L01 | |
| 12.7 mm Optical Post | Thorlabs | TR30/M | |
| 12.7 mm Pedestal Post Holder | Thorlabs | PH20EM | |
| 15 V, 2.4 A Power Supply Unit with 3.5 mm Jack Connector for T-Cube | Thorlabs | KPS101 | |
| 20x objective | Thorlabs | RMS20X | #10 in Figure 2, #11 in Figure 5 |
| 30 mm Cage Cube with Dichroic Filter Mount | Thorlabs | CM1-DCH/M | #8-9 in Figure 2, #8-10 in Figure 5 |
| 405 nm LED | Doric Lenses | CLED_405 | #2 in Figure 2 |
| 410 nm bandpass filter | Thorlabs | FB410-10 | #5 in Figure 2; #7 in Figure 5 |
| 465 nm. LED | Doric Lenses | CLED_465 | #1 in Figure 2 |
| 470 nm bandpass filter | Thorlabs | FB470-10 | #4 in Figure 2; #6 in Figure 5 |
| 560 nm bandpass filter | Semrock | FF01-560/14-25 | #5 in Figure 5 |
| 560 nm LED | Doric Lenses | CLED_560 | #1 in Figure 3 |
| 5-axis kinematic Mount | Thorlabs | K5X1 | #11 in Figure 2, #12 in Figure 5 |
| Achromatic Doublet | Thorlabs | AC254-035-A-ML | #7 in Figure 2 |
| Adaptor for 405 collimator | Thorlabs | AD11F | #3 in Figure 2; #4 in Figure 5 |
| Adaptor for ajustable collimator | Thorlabs | AD127-F | #3 in Figure 2; #4 in Figure 5 |
| Aluminum Breadboard | Thorlabs | MB1824 | |
| Clamping Fork | Thorlabs | CF125 | |
| Cube connector | Thorlabs | CM1-CC | |
| Dual 493/574 dichroic | Semrock | FF493/574-Di01-25x36 | #10 in Figure 5 |
| Emission filter for GCaMP6 | Semrock | FF01-535/22-25 | #6 in Figure 2 |
| Enclosure with Black Hardboard Panels | Thorlabs | XE25C9 | |
| Externally SM1-Threaded End Cap for Machining | Thorlabs | SM1CP2M | |
| Fast-change SM1 Lens Tube Filter Holder | Thorlabs | SM1QP | #4-6 in Figure 2, #5-7 in Figure 5 |
| Fixed Collimator for 405 nm light | Thorlabs | F671SMA-405 | #3 in Figure 2; #4 in Figure 5 |
| Fixed collimator for 470 and 560 nm light | Thorlabs | F240SMA-532 | #3 in Figure 2; #4 in Figure 5 |
| Green emission filter | Semrock | FF01-520/35-25 | In light beam splitter |
| High-Resolution USB 3.0 CMOS Camera | Thorlabs | DCC3260M | #13 in Figure 2, #15 in Figure 5 |
| Light beam splitter | Neurophotometrics | SPLIT | #14 in Figure 5 |
| Longpass Dichroic Mirror, 425 nm Cutoff | Thorlabs | DMLP425R | #8 in Figure 2, #9 in Figure 5 |
| Longpass Dichroic Mirror, 495 nm Cutoff | Semrock | FF495-Di03 | #9 in Figure 2, #8 in Figure 5 |
| Metabond dental cement | C&B | ||
| M8 - M8 cable | Doric Lenses | Cable_M8-M8 | |
| Optic fiber cannulas | Doric Lenses | Need to specify that these will be used to photometry experiments requiring low autofluorescence | |
| Optic fiber Patchcords | Doric Lenses | Need to specify that these will be used to photometry experiments requiring low autofluorescence | |
| Red emission filter | Semrock | FF01-600/37-25 | In light beam splitter |
| T7 LabJack | LabJack | ||
| T-cube LED Driver | Thorlabs | LEDD1B | |
| USB 3.0 I/O Cable, Hirose 25, for DCC3240 | Thorlabs | CAB-DCU-T3 |
Références
- Gunaydin, L. A., et al. Natural Neural Projection Dynamics Underlying Social Behavior. Cell. 157 (7), 1535-1551 (2014).
- Proulx, C. D., et al. A neural pathway controlling motivation to exert effort. Proceedings of the National Academy of Sciences of the United States of America. 115 (22), 5792-5797 (2018).
- Muir, J., et al. In Vivo Fiber Photometry Reveals Signature of Future Stress Susceptibility in Nucleus Accumbens. Neuropsychopharmacology. 43 (2), 255-263 (2017).
- Wang, D., et al. Learning shapes the aversion and reward responses of lateral habenula neurons. eLife. 6, (2017).
- de Jong, J. W., et al. A Neural Circuit Mechanism for Encoding Aversive Stimuli in the Mesolimbic Dopamine System. Neuron. 101 (1), 133-151 (2018).
- Lerner, T. N., et al. Intact-Brain Analyses Reveal Distinct Information Carried by SNc Dopamine Subcircuits. Cell. 162 (3), 635-647 (2015).
- Calipari, E. S., et al. In vivo imaging identifies temporal signature of D1 and D2 medium spiny neurons in cocaine reward. Proceedings of the National Academy of Sciences of the United States of America. 113 (10), 2726-2731 (2016).
- González, A. J., et al. Inhibitory Interplay between Orexin Neurons and Eating. Current Biology. 26 (18), 2486-2491 (2016).
- Chen, T. -W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Barker, D. J., et al. Lateral Preoptic Control of the Lateral Habenula through Convergent Glutamate and GABA Transmission. Cell Reports. 21 (7), 1757-1769 (2017).
- Siciliano, C. A., Tye, K. M. Leveraging calcium imaging to illuminate circuit dysfunction in addiction. Alcohol. 74, 47-63 (2018).
- Kim, C. K., et al. Simultaneous fast measurement of circuit dynamics at multiple sites across the mammalian brain. Nature Methods. 13 (4), 325-328 (2016).
- Sych, Y., Chernysheva, M., Sumanovski, L. T., Helmchen, F. High-density multi-fiber photometry for studying large-scale brain circuit dynamics. Nature Methods. 16 (6), 553-560 (2019).
- Akam, T., Walton, M. E. pyPhotometry: Open source Python based hardware and software for fiber photometry data acquisition. Scientific Reports. 9 (1), 3521(2019).
- Sparta, D. R., et al. Construction of implantable optical fibers for long-term optogenetic manipulation of neural circuits. Nature Protocol. 7 (1), 12-23 (2011).
- Stamatakis, A. M., et al. Lateral Hypothalamic Area Glutamatergic Neurons and Their Projections to the Lateral Habenula Regulate Feeding and Reward. The Journal of Neuroscience. 36 (2), 302-311 (2016).
- Tervo, G. D., et al. A Designer AAV Variant Permits Efficient Retrograde Access to Projection Neurons. Neuron. 92 (2), 372-382 (2016).
- Yu, K., da Silva, P., Albeanu, D. F., Li, B. Central Amygdala Somatostatin Neurons Gate Passive and Active Defensive Behaviors. The Journal of Neuroscience. 36 (24), 6488-6496 (2016).
- Falkner, A. L., Grosenick, L., Davidson, T. J., Deisseroth, K., Lin, D. Hypothalamic control of male aggression-seeking behavior. Nature Neuroscience. 19 (4), 596-604 (2016).
- Ren, J., et al. Anatomically Defined and Functionally Distinct Dorsal Raphe Serotonin Sub-systems. Cell. 175 (2), 472-487 (2018).
- Barnett, L. M., Hughes, T. E., Drobizhev, M. Deciphering the molecular mechanism responsible for GCaMP6m’s Ca2+-dependent change in fluorescence. PLOS ONE. 12 (2), 0170934(2017).
- Sun, F., et al. A Genetically Encoded Fluorescent Sensor Enables Rapid and Specific Detection of Dopamine in Flies, Fish, and Mice. Cell. 174 (2), 481-496 (2018).
- Patriarchi, T., et al. Ultrafast neuronal imaging of dopamine dynamics with designed genetically encoded sensors. Science. 360 (6396), (2018).
- Feng, J., et al. A Genetically Encoded Fluorescent Sensor for Rapid and Specific In Detection of Norepinephrine. Neuron. 102 (4), 745-761 (2019).
- Akerboom, J., et al. Genetically encoded calcium indicators for multi-color neural activity imaging and combination with optogenetics. Frontiers in Molecular Neuroscience. 6, 1-29 (2013).
- Dana, H., et al. Sensitive red protein calcium indicators for imaging neural activity. eLife. 5, (2016).
- Wang, H., Jing, M., Li, Y. Lighting up the brain: genetically encoded fluorescent sensors for imaging neurotransmitters and neuromodulators. Current Opinion in Neurobiology. 50, 171-178 (2018).
- Lu, L., et al. Wireless optoelectronic photometers for monitoring neuronal dynamics in the deep brain. Proceedings of the National Academy of Sciences. 115 (7), 1374-1383 (2018).
- Jennings, J. H., et al. Visualizing Hypothalamic Network Dynamics for Appetitive and Consummatory Behaviors. Cell. 160 (3), 516-527 (2014).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon