Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Мульти-Волокно Фотометрия для записи нейронной активности в свободно движущихся животных
В этой статье
Резюме
В этом протоколе подробно описано, как осуществлять и выполнять многоволоконные фотометрические записи, как исправить для независях от кальция артефактов, а также важные соображения для двухцветной фотометрической визуализации.
Аннотация
Запись активности группы нейронов в свободно движущемся животном является сложной задачей. Кроме того, по мере того, как мозг расчленяется на все более мелкие и малые функциональные подгруппы, запись по проекциям и/или генетически определенным субпопуляциям нейронов становится первостепенной. Волоконная фотометрия является доступным и мощным подходом, который может преодолеть эти проблемы. Объединив оптические и генетические методологии, нейронная активность может быть измерена в глубоких структурах мозга путем выражения генетически закодированных индикаторов кальция, которые преобразуют нейронную активность в оптический сигнал, который можно легко измерить. Текущий протокол детализирует компоненты многоволоконной системы фотометрии, как получить доступ к глубоким структурам мозга для доставки и сбора света, метод учета артефактов движения, и как обрабатывать и анализировать флуоресцентные сигналы. Протокол детализирует экспериментальные соображения при выполнении одно- и двойной цветизображения, от одного или нескольких имплантированных оптических волокон.
Введение
Способность соотносить нейронные реакции с определенными аспектами поведения животного имеет решающее значение для понимания роли конкретной группы нейронов играет в режиссуре или реагировании на действие или стимул. Учитывая сложность поведения животных, с множеством внутренних состояний и внешних стимулов, которые могут повлиять даже на простейшие действия, запись сигнала с односудебным разрешением оснащает исследователей необходимыми инструментами для преодоления этих Ограничения.
Волоконная фотометрия стала методом выбора для многих исследователей в области системной нейронауки из-за его относительной простоты по сравнению с другими методами записи in vivo, его высоким соотношением сигнала к шуму, а также способностью записываться в различных поведенческие парадигмы1,2,3,4,5,6,7,8. В отличие от традиционных электрофизиологических методов, фотометрия является оптическим подходом, наиболее часто используемым в сочетании с генетически закодированными индикаторами кальция (GECIs, серия GCaMP)9. ГИКи меняют свою способность к флуоресцизму в зависимости от того, связаны ли они с кальцием. Потому что внутренняя концентрация кальция в нейронах очень жестко регулируется и напряжения-gated кальциевых каналов открыты, когда нейрон пожаров потенциал действия, переходное увеличение внутренней концентрации кальция, что приводит к переходным увеличениям в способность GECI к флуоресценции, может быть хорошим прокси для нейронов стрельбы9.
С помощью волоконной фотометрии, возбуждая свет направлен вниз тонкой, многопользовательской оптической волокна в мозг, и сигнал выбросов собирается обратно через то же волокно. Поскольку эти оптические волокна легкие и сгибаемые, животное может двигаться в основном беспрепятственно, что делает этот метод совместимым с широким спектром поведенческих тестов и условий. Некоторые условия, такие как быстрые движения или изгиб волоконно-оптического патча шнур за радиус, в котором он может поддерживать общее внутреннее отражение, может ввести сигнал артефактов. Чтобы дизабигват сигнал от шума, мы можем использовать свойство GCaMP известный как "изосбестной точки". Кратко, с GCaMP, по мере того как длина волны света возбуждения перенесена к левой стороне, своя излучение в кальцием-связанном положении уменьшает и излучение в кальцием-unbound положении незначительно увеличивает. Точка, в которой относительная интенсивность этих двух выбросов равна, называется изосбестной точкой. Когда GCaMP возбужденных в этот момент, его выброс не влияет на изменения во внутренних концентрациях кальция, и дисперсия в сигнале чаще всего из-за затмения сигнала от overbending волоконно-оптического патча шнура или движения нервной ткани по отношению к имплантированному волокну.
Одноединая единица электрофизиологии по-прежнему является золотым стандартом для свободно движущихся записей in vivo из-за его одноклеточного и однопикового разрешения уровня. Тем не менее, это может быть трудно определить молекулярной идентичности клеток, регистрируются, и после специального анализа может быть довольно трудоемким. Хотя волоконная фотометрия не имеет одноклеточного разрешения, она позволяет исследователям задавать вопросы, которые невозможно решить с помощью традиционных методов. Сочетание вирусных стратегий с трансгенными животными, экспрессия ГГИС может быть направлена на генетически определенные типы нейронов для записи популяционно-или проекционно-определенной нейронной активности, которая может быть выполнена путем мониторинга сигнала кальция непосредственно на аксон терминалы10,11. Кроме того, имплантируя несколько волоконно-оптических канюли, можно одновременно контролировать нейронную активность из нескольких областей мозга и путей в одном животном12,13.
В этой рукописи мы описываем технику одно- и многоволоконной фотометрии, как исправить для независях от кальция артефактов, и подробно, как выполнять моно- и двухцветные записи. Мы также приведив примеры типов вопросов, которые он позволяет задать и их возрастающие уровни сложности (см. рисунок 1). Установка фотометрии волокна для многоволоконных записей, описанных в этом протоколе, может быть построена с помощью списка материалов, найденных на https://sites.google.com/view/multifp/hardware(рисунок 2).
Важно, чтобы система была оборудована как для 410 нм и 470 нм возбуждающие длины волн для кальция-независимых и кальциевых зависимых флуоресценции выбросов от GCaMP6 или его вариантов. Для пользовательских настроек или если нет доступного программного обеспечения для запуска системы, можно использовать бесплатную программу bonsai (http://www.open-ephys.org/bonsai/) с открытым исходным кодом. Кроме того, волоконная фотометрия может проходить через MATLAB (например, https://github.com/deisseroth-lab/multifiber)12 или другой язык программирования14. Программное и аппаратное обеспечение системы должно позволить манипулировать как 410 нм и 470 нм светодиодов и камеры, извлечение изображений (Рисунок 2), и расчет средней интенсивности флуоресцентных в регионах интереса (ROIs) обращается вокруг волокон на изображения. Выход должен быть таблицей значений средней интенсивности, записанных с 470 нм и 410 нм светодиодов от каждого волокна в патч шнур. При выполнении многоволоконных экспериментов, 400 мкм в комплекте волокон может ограничить движение мышей. В таких случаях мы рекомендуем использовать 200 мкм патч шнуры, которые обеспечивают большую гибкость. Это также может быть возможным использовать меньшие манекен кабели во время тренировки мышей.
Очень важно, чтобы иметь возможность извлечь очки времени для событий, представляющих интерес во время приобретения волоконной фотометрии. Если система не обеспечивает встроенную систему для интеграции TTL для конкретных событий, альтернативная стратегия заключается в присвоении отметки времени отдельным точкам времени, записанным в соответствие с конкретнымвременем и событиями в ходе эксперимента. Штамповка времени может быть выполнена с помощью компьютерных часов.
протокол
Все эксперименты проводились в соответствии с институциональными комитетами по уходу и использованию животных Калифорнийского университета в Сан-Диего и Канадским руководством по уходу и использованию лабораторных животных и были одобрены Университетом Лавал по защите животных Комитет.
1. Выравнивание оптического пути между камерой CMOS (дополнительный полупроводник оксида металла) и индивидуальным или разветвляющим сярприговым шнуром
- Потерять все винты на 5-осевой переводчик (11, Рисунок 2B).
- Винт в патч шнур (12, Рисунок 2B) к адаптеру «SMA (суб-миниатюра A) или FC (волоконно-оптический разъем)», который прикреплен к 5-осевой переводчика.
- Включите 470 нм возбуждательный свет (1, Рисунок 2B) при низкой мощности (100 зВт), и поместите кончик патчкорда, указывающий на автофлуоресцентный пластиковый слайд. Это не имеет никакого отношения к будущим записям, но предназначено исключительно для визуализации процесса выравнивания.
- Запись с камеры CMOS (13, Рисунок 2B) в режиме live. Увеличьте прибыль или отрегулируйте таблицу поиска (LUT) до тех пор, пока изображение не будет полностью черным. Смысл заключается в том, чтобы иметь возможность видеть изображение в координационном центре цели (10, рисунок 2B).
- Предварительный 5-осевой переводчик к цели, гарантируя, что 470 нм свет сосредоточен на волокно на SMA или FC конце патч шнур, пока изображение может быть решена на камеру.
- Отрегулируйте осей X и Y до тех пор, пока изображение не будет по центру и хорошо решено.
- Визуализируйте свет, излучаемый феррул-концом патч-провода. Он должен выглядеть как изотропный круг. Если используется ветвящий патч шнур, количество света, излучаемого на ферруле-концы каждого шнура патч должен быть одинаковым. Если круг не изотропный или излучаемый свет неравен, отрегулируйте 5-осевый переводчик в оси X-Y.
2. Установка ROIs вокруг волокон для измерения средней интенсивности флуоресцентных
- Включите все возбуждающие огни, чтобы лучше визуализировать волокна. Отрегулируйте прирост камеры таким образом, чтобы пиксели не насыщались и четкое изображение волокон присутствуют.
- Запись в прямом эфире или возьмите предварительное изображение.
- Нарисуйте ROIs вокруг волокон и держать их для измерения значений средней интенсивности во время записи(Рисунок 2A).
- Для нескольких волоконных записей, тест на независимость в сигналах.
- Запись в реальном маштабе времени от всех волокон.
- Укажите одно волокно к источнику света и коснитесь пальцем. Очень большие колебания должны происходить исключительно в этом канале (приемлемая утечка 1:1000).
- Если сигналы не являются независимыми, перерисовывайте более консервативные ROIs и повторите тест на независимость.
- Для маркировки и отслеживания которых рентабельность инвестиций соответствует тому, какое волокно, цветная лента или лак для ногтей могут быть применены к концу волокон. Сфотографируйте перед началом любого эксперимента в качестве вторичного напоминания.
3. Настройка арены звукозаписи
- Повесьте шнур патча над ареной, используя трибуны, зажимы или держатели.
- Убедитесь, что животное может свободно перемещаться по всей арене, раскованно по длине волокна.
- Используется ли оператная коробка или открытое поле, убедитесь, что патч шнур сможет достичь животного с минимальным изгибом. Если это требует нос тыкать, убедитесь, что есть достаточно места накладных расходов для предотвращения изгиба волокна. Избегайте чрезмерного изгиба или скручивания патч шнура.
4. Записи In vivo
ПРИМЕЧАНИЕ: Процедура имплантации волокон волокон волокон для экспериментов на фотометрии волокон идентична процедуре оптогенетики, описанной в Sparta et al15. Мы рекомендуем использовать зубной цемент (см. Таблица материалов),который обеспечивает надежное закрепление головной колпак к кости черепа. Зубной цемент будет особенно полезен в тех случаях, когда не могут быть использованы якорные винты.
- Визуально осматривайте дистальный конец волокон патч-провода на глаз и с помощью микроскопа minifiber. Если поверхность волокон поцарапан, repolish волокон с помощью волокна полировки / плеск пленки с тонкой крупы (1 мкм и 0,3 мкм).
- Очистите дистальные концы патч шнура с 70% этанола и хлопка наконечник аппликатор.
- Очистите волоконно-оптические канюли с помощью 70% этанола и аппликатора кончика хлопка.
- Соедините феррульский конец патч-провода с имплантированным волокном с помощью керамического сплит-рукава, покрытого черной термоусадкой. Во время соединения убедитесь, что рукав тугой, в противном случае используйте новый рукав.
ПРИМЕЧАНИЕ: Там будет большое количество потери сигнала, если есть какое-либо пространство между патч шнур ferrule и имплантат, и записи не будут работать. - Разрешить животному восстановиться в течение нескольких минут до начала поведенческого тестирования.
- Начните запись оптического сигнала и запустите эксперимент.
- Во время записи, внимательно следите за живой след, чтобы обеспечить качество записей. Сигнал, как ожидается, быстро уменьшится как функция времени в первые 2 минуты записи. Этот эффект вызван теплоо-опосредованным led распадом, при котором увеличение тепла увеличивает сопротивление оптического элемента.
- Если происходит скачок сигнала, превышающий кинетизацию GCaMP, это часто свидетельствует о том, что рукав недостаточно плотно и пространство между патч-проводом и имплантатом меняется. В этом случае, остановить эксперимент и восстановить животное с помощью нового рукава.
5. Анализ данных фотометрии клетчатки
ПРИМЕЧАНИЕ: Это метод для анализа данных, который хорошо работает для большинства записей. Однако можно внедрить альтернативные подходы. Пример кода для анализа данных можно найти здесь: https://github.com/katemartian/Photometry_data_processing.
- Извлекайте средние значения интенсивности флуоресценции, зарегистрированные от 470 нм(Int470) и 410 нм(Int410) светодиодов, соответствующих каждому отдельному волокну.
- Гладкая каждый сигнал с помощью алгоритма движущегося среднего(рисунок 3A).
- Выполните базовую коррекцию каждого сигнала(рисунок 3A и 3B)с использованием адаптивного итеративного алгоритма наименьших квадратов (airPLS) (https://github.com/zmzhang/airPLS) для удаления наклона и низкой частоты колебания сигналов.
- Стандартизировать каждый сигнал, используя среднее значение и стандартное отклонение(рисунок 3C):
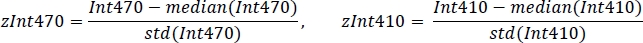
- Использование неотрицательной надежной линейной регрессии, подходят стандартизированные сигналы zInt410 к zInt470(Рисунок 3D)к функции регрессии:
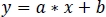
- Используйте параметры линейной регрессии(a, b)для поиска новых значений zInt410, установленных на zInt470(fitInt410, Рисунок 3D,E).
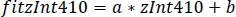
- Используйте параметры линейной регрессии(a, b)для поиска новых значений zInt410, установленных на zInt470(fitInt410, Рисунок 3D,E).
- Рассчитайте нормализованный dF/F (z dF/F)(рисунок 3F):
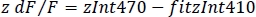
6. Одновременные двухцветные записи
- Добавьте к системе фотометрии светодиод 560 нм, чтобы возбудить красный флуоресцентный датчик кальция и соответствующие дихроические зеркала и фильтры (см. Kim et al., 2016 для подробного описания)12.
- Добавьте сплиттер изображения между целью и камерой CMOS, чтобы отделить зеленые и красные длины волн эмиссии (см. рисунок 5). Сплиттер изображения образует два зеркальных изображения на датчике камеры, соответствующие красным и зеленым сигналам (например, патч-провод с 3 ветвями создаст изображение с 6 волокнами).
- Нарисуйте ROIs вокруг всех волокон в обоих цветах, как описано выше. Убедитесь в том, чтобы четко определить каждую рентабельность инвестиций с соответствующим и каналом (зеленый и красный)(рисунок 4A).
- Триггер одновременное возбуждение с 470 нм и 560 нм светодиодов и чередовать их с 410 нм светодиод(рисунок 5A).
7. Анализ данных двойного цвета
- Следуйте шагам в разделе 5, чтобы найти fitInt410 для сигнала Int470 и рассчитать z dF/F.
- Поскольку изосбестная точка для гЕКИ с красными сдвигами, как правило, неизвестна, сигнал, записанный со светодиодом 410 нм в зеленом канале, может быть использован для коррекции движения по обоим каналам. Следуйте шагам в разделе 5, чтобы найти fitInt410 для сигнала Int560 и рассчитать z dF/F.
Результаты
Нейронные корреляты поведенческих реакций могут варьироваться в зависимости от различных факторов. В этом примере мы использовали фотометрию волокна in vivo для измерения активности аксонных терминалов из боковой гипоталамической области (LHA), которые заканчиваются в боковой хабенуле (L...
Обсуждение
Фотометрия клетчатки является доступным подходом, который позволяет исследователям записывать динамику навалом кальция из определенных нейронных популяций у свободно движущихся животных. Этот метод может быть объединен с широким спектром поведенческих тестов, в том числе "движение ...
Раскрытие информации
Sage Aronson является генеральным директором и основателем Neurophotometrics Ltd., которая продает многоволоконные фотометрические системы.
Благодарности
Эта работа была поддержана грантом Совета по естественным наукам и инженерным исследованиям Канады (NSERC: RGPIN-2017-06131) к К.П. К.П. является ФСК Чрчер-Бурсье. Мы также благодарим Plateforme d'Outils Mol'culaires (https://www.neurophotonics.ca/fr/pom) за производство вирусных векторов, используемых в данном исследовании.
Материалы
| Name | Company | Catalog Number | Comments |
| 1/4"-20 Stainless Steel Cap Screw, 1" Long | Thorlabs | SH25S100 | |
| 1/4"-20 Stainless Steel Cap Screw, 1/2" Long | Thorlabs | SH25S050 | |
| 1/4"-20 Stainless Steel Cap Screw, 3/8" Long | Thorlabs | SH25S038 | |
| 1000 µm, 0.50 NA, SMA-SMA Fiber Patch Cable | Thorlabs | M59L01 | |
| 12.7 mm Optical Post | Thorlabs | TR30/M | |
| 12.7 mm Pedestal Post Holder | Thorlabs | PH20EM | |
| 15 V, 2.4 A Power Supply Unit with 3.5 mm Jack Connector for T-Cube | Thorlabs | KPS101 | |
| 20x objective | Thorlabs | RMS20X | #10 in Figure 2, #11 in Figure 5 |
| 30 mm Cage Cube with Dichroic Filter Mount | Thorlabs | CM1-DCH/M | #8-9 in Figure 2, #8-10 in Figure 5 |
| 405 nm LED | Doric Lenses | CLED_405 | #2 in Figure 2 |
| 410 nm bandpass filter | Thorlabs | FB410-10 | #5 in Figure 2; #7 in Figure 5 |
| 465 nm. LED | Doric Lenses | CLED_465 | #1 in Figure 2 |
| 470 nm bandpass filter | Thorlabs | FB470-10 | #4 in Figure 2; #6 in Figure 5 |
| 560 nm bandpass filter | Semrock | FF01-560/14-25 | #5 in Figure 5 |
| 560 nm LED | Doric Lenses | CLED_560 | #1 in Figure 3 |
| 5-axis kinematic Mount | Thorlabs | K5X1 | #11 in Figure 2, #12 in Figure 5 |
| Achromatic Doublet | Thorlabs | AC254-035-A-ML | #7 in Figure 2 |
| Adaptor for 405 collimator | Thorlabs | AD11F | #3 in Figure 2; #4 in Figure 5 |
| Adaptor for ajustable collimator | Thorlabs | AD127-F | #3 in Figure 2; #4 in Figure 5 |
| Aluminum Breadboard | Thorlabs | MB1824 | |
| Clamping Fork | Thorlabs | CF125 | |
| Cube connector | Thorlabs | CM1-CC | |
| Dual 493/574 dichroic | Semrock | FF493/574-Di01-25x36 | #10 in Figure 5 |
| Emission filter for GCaMP6 | Semrock | FF01-535/22-25 | #6 in Figure 2 |
| Enclosure with Black Hardboard Panels | Thorlabs | XE25C9 | |
| Externally SM1-Threaded End Cap for Machining | Thorlabs | SM1CP2M | |
| Fast-change SM1 Lens Tube Filter Holder | Thorlabs | SM1QP | #4-6 in Figure 2, #5-7 in Figure 5 |
| Fixed Collimator for 405 nm light | Thorlabs | F671SMA-405 | #3 in Figure 2; #4 in Figure 5 |
| Fixed collimator for 470 and 560 nm light | Thorlabs | F240SMA-532 | #3 in Figure 2; #4 in Figure 5 |
| Green emission filter | Semrock | FF01-520/35-25 | In light beam splitter |
| High-Resolution USB 3.0 CMOS Camera | Thorlabs | DCC3260M | #13 in Figure 2, #15 in Figure 5 |
| Light beam splitter | Neurophotometrics | SPLIT | #14 in Figure 5 |
| Longpass Dichroic Mirror, 425 nm Cutoff | Thorlabs | DMLP425R | #8 in Figure 2, #9 in Figure 5 |
| Longpass Dichroic Mirror, 495 nm Cutoff | Semrock | FF495-Di03 | #9 in Figure 2, #8 in Figure 5 |
| Metabond dental cement | C&B | ||
| M8 - M8 cable | Doric Lenses | Cable_M8-M8 | |
| Optic fiber cannulas | Doric Lenses | Need to specify that these will be used to photometry experiments requiring low autofluorescence | |
| Optic fiber Patchcords | Doric Lenses | Need to specify that these will be used to photometry experiments requiring low autofluorescence | |
| Red emission filter | Semrock | FF01-600/37-25 | In light beam splitter |
| T7 LabJack | LabJack | ||
| T-cube LED Driver | Thorlabs | LEDD1B | |
| USB 3.0 I/O Cable, Hirose 25, for DCC3240 | Thorlabs | CAB-DCU-T3 |
Ссылки
- Gunaydin, L. A., et al. Natural Neural Projection Dynamics Underlying Social Behavior. Cell. 157 (7), 1535-1551 (2014).
- Proulx, C. D., et al. A neural pathway controlling motivation to exert effort. Proceedings of the National Academy of Sciences of the United States of America. 115 (22), 5792-5797 (2018).
- Muir, J., et al. In Vivo Fiber Photometry Reveals Signature of Future Stress Susceptibility in Nucleus Accumbens. Neuropsychopharmacology. 43 (2), 255-263 (2017).
- Wang, D., et al. Learning shapes the aversion and reward responses of lateral habenula neurons. eLife. 6, (2017).
- de Jong, J. W., et al. A Neural Circuit Mechanism for Encoding Aversive Stimuli in the Mesolimbic Dopamine System. Neuron. 101 (1), 133-151 (2018).
- Lerner, T. N., et al. Intact-Brain Analyses Reveal Distinct Information Carried by SNc Dopamine Subcircuits. Cell. 162 (3), 635-647 (2015).
- Calipari, E. S., et al. In vivo imaging identifies temporal signature of D1 and D2 medium spiny neurons in cocaine reward. Proceedings of the National Academy of Sciences of the United States of America. 113 (10), 2726-2731 (2016).
- González, A. J., et al. Inhibitory Interplay between Orexin Neurons and Eating. Current Biology. 26 (18), 2486-2491 (2016).
- Chen, T. -. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Barker, D. J., et al. Lateral Preoptic Control of the Lateral Habenula through Convergent Glutamate and GABA Transmission. Cell Reports. 21 (7), 1757-1769 (2017).
- Siciliano, C. A., Tye, K. M. Leveraging calcium imaging to illuminate circuit dysfunction in addiction. Alcohol. 74, 47-63 (2018).
- Kim, C. K., et al. Simultaneous fast measurement of circuit dynamics at multiple sites across the mammalian brain. Nature Methods. 13 (4), 325-328 (2016).
- Sych, Y., Chernysheva, M., Sumanovski, L. T., Helmchen, F. High-density multi-fiber photometry for studying large-scale brain circuit dynamics. Nature Methods. 16 (6), 553-560 (2019).
- Akam, T., Walton, M. E. pyPhotometry: Open source Python based hardware and software for fiber photometry data acquisition. Scientific Reports. 9 (1), 3521 (2019).
- Sparta, D. R., et al. Construction of implantable optical fibers for long-term optogenetic manipulation of neural circuits. Nature Protocol. 7 (1), 12-23 (2011).
- Stamatakis, A. M., et al. Lateral Hypothalamic Area Glutamatergic Neurons and Their Projections to the Lateral Habenula Regulate Feeding and Reward. The Journal of Neuroscience. 36 (2), 302-311 (2016).
- Tervo, G. D., et al. A Designer AAV Variant Permits Efficient Retrograde Access to Projection Neurons. Neuron. 92 (2), 372-382 (2016).
- Yu, K., da Silva, P., Albeanu, D. F., Li, B. Central Amygdala Somatostatin Neurons Gate Passive and Active Defensive Behaviors. The Journal of Neuroscience. 36 (24), 6488-6496 (2016).
- Falkner, A. L., Grosenick, L., Davidson, T. J., Deisseroth, K., Lin, D. Hypothalamic control of male aggression-seeking behavior. Nature Neuroscience. 19 (4), 596-604 (2016).
- Ren, J., et al. Anatomically Defined and Functionally Distinct Dorsal Raphe Serotonin Sub-systems. Cell. 175 (2), 472-487 (2018).
- Barnett, L. M., Hughes, T. E., Drobizhev, M. Deciphering the molecular mechanism responsible for GCaMP6m’s Ca2+-dependent change in fluorescence. PLOS ONE. 12 (2), 0170934 (2017).
- Sun, F., et al. A Genetically Encoded Fluorescent Sensor Enables Rapid and Specific Detection of Dopamine in Flies, Fish, and Mice. Cell. 174 (2), 481-496 (2018).
- Patriarchi, T., et al. Ultrafast neuronal imaging of dopamine dynamics with designed genetically encoded sensors. Science. 360 (6396), (2018).
- Feng, J., et al. A Genetically Encoded Fluorescent Sensor for Rapid and Specific In Detection of Norepinephrine. Neuron. 102 (4), 745-761 (2019).
- Akerboom, J., et al. Genetically encoded calcium indicators for multi-color neural activity imaging and combination with optogenetics. Frontiers in Molecular Neuroscience. 6, 1-29 (2013).
- Dana, H., et al. Sensitive red protein calcium indicators for imaging neural activity. eLife. 5, (2016).
- Wang, H., Jing, M., Li, Y. Lighting up the brain: genetically encoded fluorescent sensors for imaging neurotransmitters and neuromodulators. Current Opinion in Neurobiology. 50, 171-178 (2018).
- Lu, L., et al. Wireless optoelectronic photometers for monitoring neuronal dynamics in the deep brain. Proceedings of the National Academy of Sciences. 115 (7), 1374-1383 (2018).
- Jennings, J. H., et al. Visualizing Hypothalamic Network Dynamics for Appetitive and Consummatory Behaviors. Cell. 160 (3), 516-527 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены