É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Fotometria de múltiplas fibras para gravar atividade neural em animais em movimento livre
Neste Artigo
Resumo
Este protocolo detalha como aplicar e executar gravações da fotometria da multi-fibra, como corrigir para artefatos cálcio-independentes, e considerações importantes para a imagem latente da fotometria da duplo-cor.
Resumo
Registrar a atividade de um grupo de neurônios em um animal em movimento livre é uma empresa desafiadora. Além disso, como o cérebro é dissecado em subgrupos funcionais menores e menores, torna-se primordial para gravar a partir de projeções e/ou subpopulações geneticamente definidas de neurônios. A fotometria de fibras é uma abordagem acessível e poderosa que pode superar esses desafios. Combinando metodologias ópticas e genéticas, a atividade neural pode ser medida em estruturas cerebrais profundas, expressando indicadores de cálcio geneticamente codificados, que traduzem a atividade neural em um sinal óptico que pode ser facilmente medido. O protocolo atual detalha os componentes de um sistema da fotometria da multi-fibra, como alcançar estruturas profundas do cérebro para entregar e recolher a luz, um método para dar conta dos artefatos do movimento, e como processar e analisar sinais fluorescentes. O protocolo detalha considerações experimentais ao executar a imagem latente única e dupla da cor, de único ou de fibras óticas implantadas múltiplas.
Introdução
A capacidade de correlacionar respostas neurais com aspectos específicos do comportamento de um animal é fundamental para entender o papel que um determinado grupo de neurônios desempenha em dirigir ou responder a uma ação ou estímulo. Dada a complexidade do comportamento animal, com a miríade de Estados internos e estímulos externos que podem afetar até mesmo as ações mais simples, o registro de um sinal com resolução de julgamento único equipa pesquisadores com as ferramentas necessárias para superar esses Limitações.
A fotometria da fibra transformou-se a técnica da escolha para muitos investigadores no campo da neurociência dos sistemas por causa de sua simplicidade relativa comparada a outras técnicas in vivo da gravação, sua relação sinal-à-ruído elevada, e a habilidade de gravar em uma variedade de paradigmas comportamentais1,2,3,4,5,6,7,8. Diferentemente dos métodos eletrofisiológicos tradicionais, a fotometria é a abordagem óptica mais comumente utilizada em conjunto com indicadores de cálcio geneticamente codificados (GECIs, a série GCaMP)9. GECIS mudar a sua capacidade de fluorescência com base em se eles estão ou não ligados ao cálcio. Porque a concentração interna de cálcio nos neurônios é muito firmemente regulada e tensão-gated canais de cálcio aberto quando um neurônio dispara um potencial de ação, aumentos transitórios na concentração interna de cálcio, que resultam em aumentos transitórios no capacidade de um GECI para fluorescência, pode ser um bom proxy para o disparo neuronal9.
Com a fotometria da fibra, a luz da excitação é dirigida abaixo de uma fibra ótica fina, multimodo no cérebro, e um sinal de emissão é coletado para trás acima através da mesma fibra. Porque estas fibras ópticas são leves e bendable, um animal pode mover-se pela maior parte Unhindered, fazendo esta técnica compatível com uma disposição larga de testes e de circunstâncias comportáveis. Algumas condições, tais como movimentos rápidos ou flexão do cabo de remendo de fibra óptica além do raio em que pode manter a reflexão interna total, podem introduzir artefatos de sinal. Para ambiguar sinal de ruído, podemos explorar uma propriedade do GCaMP conhecido como o "ponto isosbestic." Momentaneamente, com GCaMP, porque o comprimento de onda da luz da excitação é deslocado à esquerda, sua emissão no estado cálcio-ligado diminui e a emissão no estado cálcio-unbound aumenta marginalmente. O ponto em que a intensidade relativa destas duas emissões são iguais é denominado o ponto espécies. Quando GCaMP é excitado neste momento, sua emissão é afetada por mudanças em concentrações internas do cálcio, e a variação no sinal é o mais frequentemente devido à atenuação do sinal do overdobra do cabo de remendo Fiber-Optic ou do movimento do tecido neural em relação à fibra implantada.
A electrofisiologia da única unidade é ainda o padrão do ouro para livremente-mover-se em gravações in vivo devido a sua única-pilha e única-espiga resolução nivelada. No entanto, pode ser difícil identificar a identidade molecular das células que estão sendo gravadas, e a análise post-hoc pode ser bastante trabalhosa. Quando a fotometria da fibra não tiver a definição da único-pilha, permite investigadores de fazer perguntas impossíveis endereçar com técnicas tradicionais. Combinando estratégias virais com animais transgênicos, a expressão de GECIs pode ser direcionada para tipos neuronais geneticamente definidos para registrar a atividade neural definida pela população ou projeção, que pode ser realizada pelo monitoramento do sinal de cálcio diretamente no AXON terminais10,11. Além disso, através da implantação de múltiplas cânulas de fibra óptica, é possível monitorar simultaneamente a atividade neural de várias regiões cerebrais e caminhos no mesmo animal12,13.
Neste manuscrito, nós descrevemos uma técnica para a fotometria single e multi-Fiber, como corrigir para artefatos cálcio-independentes, e detalhar como executar gravações mono e Dual-Color. Nós também fornecemos exemplos dos tipos de perguntas que ele permite que alguém pergunte e seus níveis crescentes de complexidade (veja a Figura 1). A configuração de fotometria de fibra para gravações de várias fibras detalhadas neste protocolo pode ser construída usando uma lista de materiais encontrados em https://sites.google.com/view/multifp/hardware (Figura 2).
É essencial que o sistema esteja equipado para comprimentos de onda da excitação de 410 nanômetro e de 470 nanômetro para a emissão cálcio-independente e cálcio-dependente da fluorescência de GCaMP6 ou de suas variações. Para configurações personalizadas ou se não houver nenhum software disponível para executar o sistema, o livre, programa de código aberto bonsai (http://www.open-ephys.org/bonsai/) pode ser usado. Alternativamente, a fotometria da fibra pode ser executada através de MATLAB (por exemplo, https://github.com/deisseroth-lab/multifiber)12 ou a outra língua de programação14. O software e hardware do sistema deve permitir a manipulação de ambos os 410 nm e 470 nm LEDs e a câmera, extração de imagens (Figura 2), e cálculo da intensidade média fluorescente nas regiões de interesse (Rois) desenhado em torno das fibras em as imagens. A saída deve ser uma tabela de valores médios de intensidade registradas com os LEDs 470 nm e 410 nm de cada fibra no cabo de remendo. Ao realizar experimentos Multifibras, 400 μm de fibras podem limitar o movimento de camundongos. Nesses casos, recomendamos o uso de cabos de remendo de 200 μm, que proporcionam mais flexibilidade. Também pode ser possível usar cabos fictícios menores durante o treinamento de camundongos.
É crucial poder extrair pontos do tempo para eventos do interesse durante a aquisição da fotometria da fibra. Se o sistema não fornecer prontamente um sistema interno para integrar TTLs para eventos específicos, uma estratégia alternativa é atribuir um carimbo de data/hora a pontos de tempo individuais gravados para alinhar com horários e eventos específicos durante o experimento. O carimbo de tempo pode ser feito usando o relógio do computador.
Protocolo
Todos os experimentos foram feitos de acordo com os comitês institucionais de cuidados e uso de animais da Universidade da Califórnia, San Diego, e o guia canadense para o cuidado e uso de animais de laboratório e foram aprovados pela Université Laval proteção animal Comité.
1. alinhamento do trajeto ótico entre a câmera do CMOS (semicondutor complementar do óxido de metal) e o cabo de remendo individual ou ramificando
- Afrouxe todos os parafusos no Tradutor de 5 eixos (11, Figura 2B).
- Aparafuse o cabo de remendo (12, Figura 2B) ao adaptador [sma (sub-miniatura a) ou FC (conector de fibra óptica)] que é afixada ao Tradutor de 5 eixos.
- Gire sobre a luz da excitação de 470 nanômetro (1, Figura 2b) na baixa potência (100 μW), e coloc a ponta do chicote que aponta a uma corrediça plástica autofluorescent. Isto não tem nenhum rolamento em gravações futuras mas é unicamente para visualizar o processo do alinhamento.
- Gravar a partir da câmera CMOS (13, Figura 2b) no modo ao vivo. Aumente o ganho ou ajuste a tabela de pesquisa (LUT) até que a imagem não seja totalmente preta. O ponto é ser capaz de ver uma imagem no ponto focal do objetivo (10, Figura 2b).
- Avance o tradutor de 5 eixos em direção ao objetivo, assegurando que a luz 470 nm esteja centrada na fibra na extremidade SMA ou FC do cabo de remendo, até que uma imagem possa ser resolvida na câmera.
- Ajuste os eixos X e Y até que a imagem seja centralizada e bem resolvida.
- Visualize a luz emitida da ponteira-extremidade do cabo de remendo. Deve aparecer como um círculo isotrópico. Se um cabo de remendo de ramificação é usado, a quantidade de luz emitida nas ponteira-extremidades de cada cabo de remendo deve ser similar. Se o círculo não for isotrópico ou se a luz emitida for desigual, ajuste o tradutor de 5 eixos no eixo X-Y.
2. configuração de ROIs em torno das fibras para a medida da intensidade fluorescente média
- Ligue todas as luzes de excitação para visualizar melhor as fibras. Ajuste o ganho da câmera de forma que nenhum pixel esteja saturado e uma imagem clara das fibras esteja presente.
- Registro ao vivo ou ter uma imagem preliminar.
- Desenhar ROIs em torno das fibras e mantê-los para a medição dos valores médios de intensidade durante as gravações (Figura 2a).
- Para gravações múltiplas da fibra, teste para a independência nos sinais.
- Registro ao vivo de todas as fibras.
- Aponte uma fibra para uma fonte de luz e bata com um dedo. Flutuações muito grandes devem ocorrer unicamente nesse canal (vazamento aceitável 1:1000).
- Se os sinais não forem independentes, redesenhe ROIs mais conservadores e repita o teste de independência.
- Para etiquetar e manter-se a par de que ROI corresponde a que a fibra, a fita colorida ou o lustrador de prego podem ser aplicados à extremidade das fibras. Tire uma foto antes do início de qualquer experimento como um lembrete secundário.
3. configuração da arena de gravação
- Pendure o cabo de remendo acima da arena usando carrinhos, grampos, ou suportes.
- Certifique-se de que o animal pode mover-se livremente ao longo de toda a arena, desinibida pelo comprimento da fibra.
- Se uma caixa operante ou campo aberto é usado, assegure-se de que o cabo de remendo possa alcangar o animal com dobra mínima. Se isto exige um puxão do nariz, assegure-se de que haja bastante sobrecarga do quarto para impedir a dobra da fibra. Evite qualquer dobra ou torção excessiva do cabo de remendo.
4. gravações in vivo
Nota: o procedimento de implante de cânula de fibra óptica para experimentos de fotometria de fibra é idêntico ao procedimento para optogenética, conforme descrito em Sparta et al.15. Recomendamos o uso de cimento dentário (ver tabela de materiais), que fornece ancoragem robusta do cinza para o osso do crânio. O cimento dentário será particularmente útil nos casos em que os parafusos de ancoragem não possam ser utilizados.
- Inspecione visualmente a extremidade longe do ponto de origem das fibras do cabo de remendo pelo olho e com um microscópio do minifiber. Se a superfície das fibras for arranhada, relustrar as fibras usando a película de lustro/lapping da fibra com grão fino (1 μm e 0,3 μm).
- Limpe as extremidades distais do cabo de remendo com 70% de etanol e um aplicador de ponta de algodão.
- Limpe as cânulas de fibra óptica usando 70% de etanol e um aplicador de ponta de algodão.
- Conecte a extremidade da ponteira do cabo de remendo à fibra implantada usando uma separação-luva cerâmica coberta com um tubo preto do psiquiatra. Durante a ligação, certifique-se de que a manga está apertada, caso contrário utilize uma manga nova.
Nota: haverá uma grande quantidade de perda de sinal se houver algum espaço entre a ponteira do cabo de remendo e o implante, e as gravações não funcionarão. - Permitir que o animal se recupere por alguns minutos antes do início do teste comportamental.
- Comece a gravar o sinal óptico e execute o experimento.
- Durante a gravação, mantenha um olho atento no rastreio ao vivo para garantir gravações de qualidade. Espera-se que o sinal diminua rapidamente em função do tempo nos primeiros 2 min de gravação. Este efeito é causado pela deterioração Heat-mediada do diodo emissor de luz, por meio de que o aumento no calor aumenta a resistência do elemento ótico.
- Se um salto no sinal que excede a cinética de ligar/desligar do GCaMP ocorre, isto é frequentemente uma indicação que a luva não é apertada bastante e o espaço entre o cabo de remendo e o implante está mudando. Neste caso, pare o experimento e reconecte o animal usando uma luva nova.
5. análise de dados da fotometria da fibra
Nota: Este é um método para análise de dados que funciona bem para a maioria das gravações. No entanto, abordagens alternativas podem ser implementadas. Código de exemplo para análise de dados pode ser encontrado aqui: https://github.com/katemartian/Photometry_data_processing.
- Extraia os valores médios de intensidade de fluorescência registados a partir de 470 nm (int470) e 410 nm (int410) LEDs, correspondendo a cada fibra individual.
- Suavizar cada sinal usando um algoritmo de média móvel (Figura 3a).
- Execute a correção de linha de base de cada sinal (Figura 3a e 3B) usando o algoritmo adaptável iterativamente reponderado penalizado de mínimos quadrados (airpls) (https://github.com/zmzhang/airPLS) para remover a inclinação e a baixa frequência flutuações nos sinais.
- Padronize cada sinal usando o valor médio e o desvio padrão (Figura 3C):
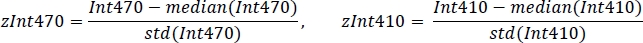
- Usando regressão linear robusta não negativa, ajuste os sinais padronizados zint410 a zint470 (Figura 3D) para a função de regressão:
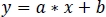
- Use os parâmetros da regressão linear (a, b) para encontrar novos valores de zint410 cabido a zint470 (fitint410, Figura 3D, E):
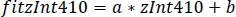
- Use os parâmetros da regressão linear (a, b) para encontrar novos valores de zint410 cabido a zint470 (fitint410, Figura 3D, E):
- Calcule o DF/f normalizado (z DF/f) (Figura 3f):
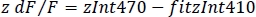
6. simultânea Dual-cor gravações
- Adicione ao sistema da fotometria um diodo emissor de luz de 560 nanômetro para excitar o sensor fluorescente vermelho do cálcio e os espelhos e os filtros dichroic apropriados (veja Kim et al., 2016 para a descrição detalhada)12.
- Adicione um divisor de imagem entre o objetivo e a câmera CMOS para separar os comprimentos de onda de emissão verde e vermelho (veja a Figura 5). O divisor de imagem irá formar duas imagens espelhadas no sensor da câmera, correspondendo aos sinais vermelhos e verdes (por exemplo, um cabo de remendo com 3 ramos criará uma imagem com 6 fibras).
- Desenhe ROIs em torno de todas as fibras em ambas as cores como detalhado acima. Certifique-se de identificar claramente cada ROI com a fibra correspondente e canal (verde e vermelho) (Figura 4A).
- Acionar A excitação simultânea com 470 nm e 560 nm LEDs e alterná-los com 410 nm LED (Figura 5A).
7. análise de dados de cor dupla
- Siga as etapas na seção 5 para encontrar Fitint410 para o sinal 470 inte calcule z DF/F.
- Porque o ponto espécies para GECIS vermelho-deslocado é geralmente desconhecido, o sinal gravado com o diodo emissor de luz de 410 nanômetro no canal verde pode ser usado para a correção do movimento através de ambos os canais. Siga as etapas na seção 5 para encontrar Fitint410 para o sinal 560 inte calcule z DF/F.
Resultados
Correlações neurais de respostas comportamentais podem variar dependendo de uma variedade de fatores. Neste exemplo, utilizou-se a fotometria de fibra in vivo para medir a atividade dos terminais AXON da área hipotálamo lateral (LHA) que terminam no habenula lateral (LHb). Camundongos tipo Wild foram injetados com um vírus adeno-associado (AAV) codificando GCaMP6s (AAV-hSyn-GCaMP6s) na LHA e uma fibra óptica foi implantada com a ponta imediatamente acima do LHb (Figura 4a
Discussão
A fotometria da fibra é uma aproximação acessível que permita que os investigadores gravem a dinâmica do volume-cálcio das populações neuronal definidas em animais livre-moventes. Este método pode ser combinado com uma ampla gama de testes comportamentais, incluindo tarefas de "movimento pesado", como testes de natação forçada2, Fear-condicionamento18, interações sociais1,4e outros7
Divulgações
Sage Aronson é o CEO e fundador da Neurophotometrics Ltd., que vende sistemas de fotometria de múltiplas fibras.
Agradecimentos
Este trabalho foi apoiado por uma subvenção do Conselho de pesquisa de ciências naturais e engenharia do Canadá (NSERC: RGPIN-2017-06131) para C.P. C. P. é um FRSQ chercheur-Boursier. Agradecemos também ao Plateforme d' Outils Moléculaires (https://www.neurophotonics.ca/fr/pom) pela produção dos vetores virais utilizados neste estudo.
Materiais
| Name | Company | Catalog Number | Comments |
| 1/4"-20 Stainless Steel Cap Screw, 1" Long | Thorlabs | SH25S100 | |
| 1/4"-20 Stainless Steel Cap Screw, 1/2" Long | Thorlabs | SH25S050 | |
| 1/4"-20 Stainless Steel Cap Screw, 3/8" Long | Thorlabs | SH25S038 | |
| 1000 µm, 0.50 NA, SMA-SMA Fiber Patch Cable | Thorlabs | M59L01 | |
| 12.7 mm Optical Post | Thorlabs | TR30/M | |
| 12.7 mm Pedestal Post Holder | Thorlabs | PH20EM | |
| 15 V, 2.4 A Power Supply Unit with 3.5 mm Jack Connector for T-Cube | Thorlabs | KPS101 | |
| 20x objective | Thorlabs | RMS20X | #10 in Figure 2, #11 in Figure 5 |
| 30 mm Cage Cube with Dichroic Filter Mount | Thorlabs | CM1-DCH/M | #8-9 in Figure 2, #8-10 in Figure 5 |
| 405 nm LED | Doric Lenses | CLED_405 | #2 in Figure 2 |
| 410 nm bandpass filter | Thorlabs | FB410-10 | #5 in Figure 2; #7 in Figure 5 |
| 465 nm. LED | Doric Lenses | CLED_465 | #1 in Figure 2 |
| 470 nm bandpass filter | Thorlabs | FB470-10 | #4 in Figure 2; #6 in Figure 5 |
| 560 nm bandpass filter | Semrock | FF01-560/14-25 | #5 in Figure 5 |
| 560 nm LED | Doric Lenses | CLED_560 | #1 in Figure 3 |
| 5-axis kinematic Mount | Thorlabs | K5X1 | #11 in Figure 2, #12 in Figure 5 |
| Achromatic Doublet | Thorlabs | AC254-035-A-ML | #7 in Figure 2 |
| Adaptor for 405 collimator | Thorlabs | AD11F | #3 in Figure 2; #4 in Figure 5 |
| Adaptor for ajustable collimator | Thorlabs | AD127-F | #3 in Figure 2; #4 in Figure 5 |
| Aluminum Breadboard | Thorlabs | MB1824 | |
| Clamping Fork | Thorlabs | CF125 | |
| Cube connector | Thorlabs | CM1-CC | |
| Dual 493/574 dichroic | Semrock | FF493/574-Di01-25x36 | #10 in Figure 5 |
| Emission filter for GCaMP6 | Semrock | FF01-535/22-25 | #6 in Figure 2 |
| Enclosure with Black Hardboard Panels | Thorlabs | XE25C9 | |
| Externally SM1-Threaded End Cap for Machining | Thorlabs | SM1CP2M | |
| Fast-change SM1 Lens Tube Filter Holder | Thorlabs | SM1QP | #4-6 in Figure 2, #5-7 in Figure 5 |
| Fixed Collimator for 405 nm light | Thorlabs | F671SMA-405 | #3 in Figure 2; #4 in Figure 5 |
| Fixed collimator for 470 and 560 nm light | Thorlabs | F240SMA-532 | #3 in Figure 2; #4 in Figure 5 |
| Green emission filter | Semrock | FF01-520/35-25 | In light beam splitter |
| High-Resolution USB 3.0 CMOS Camera | Thorlabs | DCC3260M | #13 in Figure 2, #15 in Figure 5 |
| Light beam splitter | Neurophotometrics | SPLIT | #14 in Figure 5 |
| Longpass Dichroic Mirror, 425 nm Cutoff | Thorlabs | DMLP425R | #8 in Figure 2, #9 in Figure 5 |
| Longpass Dichroic Mirror, 495 nm Cutoff | Semrock | FF495-Di03 | #9 in Figure 2, #8 in Figure 5 |
| Metabond dental cement | C&B | ||
| M8 - M8 cable | Doric Lenses | Cable_M8-M8 | |
| Optic fiber cannulas | Doric Lenses | Need to specify that these will be used to photometry experiments requiring low autofluorescence | |
| Optic fiber Patchcords | Doric Lenses | Need to specify that these will be used to photometry experiments requiring low autofluorescence | |
| Red emission filter | Semrock | FF01-600/37-25 | In light beam splitter |
| T7 LabJack | LabJack | ||
| T-cube LED Driver | Thorlabs | LEDD1B | |
| USB 3.0 I/O Cable, Hirose 25, for DCC3240 | Thorlabs | CAB-DCU-T3 |
Referências
- Gunaydin, L. A., et al. Natural Neural Projection Dynamics Underlying Social Behavior. Cell. 157 (7), 1535-1551 (2014).
- Proulx, C. D., et al. A neural pathway controlling motivation to exert effort. Proceedings of the National Academy of Sciences of the United States of America. 115 (22), 5792-5797 (2018).
- Muir, J., et al. In Vivo Fiber Photometry Reveals Signature of Future Stress Susceptibility in Nucleus Accumbens. Neuropsychopharmacology. 43 (2), 255-263 (2017).
- Wang, D., et al. Learning shapes the aversion and reward responses of lateral habenula neurons. eLife. 6, (2017).
- de Jong, J. W., et al. A Neural Circuit Mechanism for Encoding Aversive Stimuli in the Mesolimbic Dopamine System. Neuron. 101 (1), 133-151 (2018).
- Lerner, T. N., et al. Intact-Brain Analyses Reveal Distinct Information Carried by SNc Dopamine Subcircuits. Cell. 162 (3), 635-647 (2015).
- Calipari, E. S., et al. In vivo imaging identifies temporal signature of D1 and D2 medium spiny neurons in cocaine reward. Proceedings of the National Academy of Sciences of the United States of America. 113 (10), 2726-2731 (2016).
- González, A. J., et al. Inhibitory Interplay between Orexin Neurons and Eating. Current Biology. 26 (18), 2486-2491 (2016).
- Chen, T. -. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Barker, D. J., et al. Lateral Preoptic Control of the Lateral Habenula through Convergent Glutamate and GABA Transmission. Cell Reports. 21 (7), 1757-1769 (2017).
- Siciliano, C. A., Tye, K. M. Leveraging calcium imaging to illuminate circuit dysfunction in addiction. Alcohol. 74, 47-63 (2018).
- Kim, C. K., et al. Simultaneous fast measurement of circuit dynamics at multiple sites across the mammalian brain. Nature Methods. 13 (4), 325-328 (2016).
- Sych, Y., Chernysheva, M., Sumanovski, L. T., Helmchen, F. High-density multi-fiber photometry for studying large-scale brain circuit dynamics. Nature Methods. 16 (6), 553-560 (2019).
- Akam, T., Walton, M. E. pyPhotometry: Open source Python based hardware and software for fiber photometry data acquisition. Scientific Reports. 9 (1), 3521 (2019).
- Sparta, D. R., et al. Construction of implantable optical fibers for long-term optogenetic manipulation of neural circuits. Nature Protocol. 7 (1), 12-23 (2011).
- Stamatakis, A. M., et al. Lateral Hypothalamic Area Glutamatergic Neurons and Their Projections to the Lateral Habenula Regulate Feeding and Reward. The Journal of Neuroscience. 36 (2), 302-311 (2016).
- Tervo, G. D., et al. A Designer AAV Variant Permits Efficient Retrograde Access to Projection Neurons. Neuron. 92 (2), 372-382 (2016).
- Yu, K., da Silva, P., Albeanu, D. F., Li, B. Central Amygdala Somatostatin Neurons Gate Passive and Active Defensive Behaviors. The Journal of Neuroscience. 36 (24), 6488-6496 (2016).
- Falkner, A. L., Grosenick, L., Davidson, T. J., Deisseroth, K., Lin, D. Hypothalamic control of male aggression-seeking behavior. Nature Neuroscience. 19 (4), 596-604 (2016).
- Ren, J., et al. Anatomically Defined and Functionally Distinct Dorsal Raphe Serotonin Sub-systems. Cell. 175 (2), 472-487 (2018).
- Barnett, L. M., Hughes, T. E., Drobizhev, M. Deciphering the molecular mechanism responsible for GCaMP6m’s Ca2+-dependent change in fluorescence. PLOS ONE. 12 (2), 0170934 (2017).
- Sun, F., et al. A Genetically Encoded Fluorescent Sensor Enables Rapid and Specific Detection of Dopamine in Flies, Fish, and Mice. Cell. 174 (2), 481-496 (2018).
- Patriarchi, T., et al. Ultrafast neuronal imaging of dopamine dynamics with designed genetically encoded sensors. Science. 360 (6396), (2018).
- Feng, J., et al. A Genetically Encoded Fluorescent Sensor for Rapid and Specific In Detection of Norepinephrine. Neuron. 102 (4), 745-761 (2019).
- Akerboom, J., et al. Genetically encoded calcium indicators for multi-color neural activity imaging and combination with optogenetics. Frontiers in Molecular Neuroscience. 6, 1-29 (2013).
- Dana, H., et al. Sensitive red protein calcium indicators for imaging neural activity. eLife. 5, (2016).
- Wang, H., Jing, M., Li, Y. Lighting up the brain: genetically encoded fluorescent sensors for imaging neurotransmitters and neuromodulators. Current Opinion in Neurobiology. 50, 171-178 (2018).
- Lu, L., et al. Wireless optoelectronic photometers for monitoring neuronal dynamics in the deep brain. Proceedings of the National Academy of Sciences. 115 (7), 1374-1383 (2018).
- Jennings, J. H., et al. Visualizing Hypothalamic Network Dynamics for Appetitive and Consummatory Behaviors. Cell. 160 (3), 516-527 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados