Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
SerbestÇe Hareket Eden Hayvanlarda Nöral AktiviteYi Kaydetmek Için Çoklu Fiber Fotometri
Bu Makalede
Özet
Bu protokol, çok fiberli fotometri kayıtlarının nasıl uygulanacağını ve gerçekleştirildirilebildiğini, kalsiyumdan bağımsız eserlerin nasıl düzeltilebildiğini ve çift renkli fotometri görüntüleme için önemli hususları ayrıntılarıyla anlatır.
Özet
Serbestçe hareket eden bir hayvanda bir grup nöronların aktivitesini kaydetmek zorlu bir girişimdir. Ayrıca, beyin daha küçük ve daha küçük fonksiyonel alt gruplara bölündükçe, projeksiyonlardan ve/veya genetik olarak tanımlanmış nöronların alt popülasyonlarından kaydetmek çok önemli hale gelir. Fiber fotometri bu zorlukların üstesinden gelebilir erişilebilir ve güçlü bir yaklaşımdır. Optik ve genetik metodolojileri birleştirerek, nöral aktivite, genetik olarak kodlanmış kalsiyum göstergeleri ifade edilerek derin beyin yapılarında ölçülebilir, bu da nöral aktiviteyi kolayca ölçülebilen bir optik sinyale dönüştürür. Mevcut protokol, çok fiberli fotometri sisteminin bileşenlerini, ışık teslim etmek ve toplamak için derin beyin yapılarına nasıl erişilmeyi, hareket yapılarını hesaba katmak için bir yöntem ve floresan sinyalleri nasıl işleyip analiz edileteceklerini ayrıntılarıyla anlatıyor. Protokol, tek veya birden fazla implante optik liflerden tek veya çift renkli görüntüleme yaparken deneysel hususları ayrıntılarıyla anlatır.
Giriş
Nöral tepkileri bir hayvanın davranışının belirli yönleriyle ilişkilendirme yeteneği, belirli bir nöron grubunun bir eylemi veya uyarıcıyı yönlendirmede veya yanıtlamada oynadığı rolü anlamak için önemlidir. Hayvan davranışının karmaşıklığı göz önüne alındığında, en basit eylemleri bile etkileyebilecek sayısız iç durum ve dış uyaran göz önüne alındığında, tek deneme çözünürlüğü ile bir sinyal kaydetmek araştırmacıları bu eylemlerin üstesinden gelmek için gerekli araçlarla donatır. Sınırlama.
Fiber fotometri, diğer in vivo kayıt teknikleri, yüksek sinyal-gürültü oranı ve çeşitli kayıt yeteneği ile karşılaştırıldığında göreceli basitliği nedeniyle sistem nörobilim alanında birçok araştırmacı için tercih edilen teknik haline gelmiştir davranış salk›r›mlar›1,2,3,4,5,6,7,8. Geleneksel elektrofizyolojik yöntemlerin aksine, fotometri en sık genetik kodlanmış kalsiyum göstergeleri ile birlikte kullanılan optik yaklaşımdır (GECIs, GCaMP serisi)9. GECIs kalsiyum bağlı olup olmadığını dayalı floresan yeteneklerini değiştirmek. Nöronlardaki kalsiyumun iç konsantrasyonu çok sıkı bir şekilde düzenlendiğinden ve bir nöron bir eylem potansiyeli ateşlediğinde voltaj kapılı kalsiyum kanalları açıldığından, iç kalsiyum konsantrasyonunda geçici artışlar meydana gelir ve bu da floresan bir GECI yeteneği, nöronal ateş için iyi bir proxy olabilir9.
Fiber fotometri ile uyarma ışığı beyne ince, çok modlu optik fiberden aşağı doğru yönlendirilir ve aynı lif aracılığıyla bir emisyon sinyali toplanır. Bu optik lifler hafif ve bükülebilir olduğundan, bir hayvan büyük ölçüde engelsiz hareket edebilir, davranış testleri ve koşulları geniş bir dizi ile uyumlu bu tekniği yapma. Hızlı hareketler veya fiber optik yama kablosunun toplam iç yansımayı koruyabileceği yarıçapın ötesinde bükülme gibi bazı koşullar, sinyal yapıtlarına neden olabilir. Sinyalin gürültüden uzakdur, "izosbestik nokta" olarak bilinen GCaMP özelliğinden yararlanabiliriz. Kısaca, GCaMP ile, uyarma ışığının dalga boyu sola kaydırıldıkça, kalsiyuma bağlı durumdaki salınımı azalır ve kalsiyum-bağlı olmayan durumdaki emisyon marjinal olarak artar. Bu iki emisyonun göreceli yoğunluğunun eşit olduğu nokta sisosbestik nokta olarak adlandırılmaktadır. GCaMP bu noktada heyecanlı olduğunda, emisyon iç kalsiyum konsantrasyonlarında değişiklikler etkilenmez, ve sinyal varyans en sık fiber optik yama kablosu veya nöral doku hareketi aşırı bükme gelen sinyalin zayıflaması nedeniyle implante fiber göreli.
Tek birimelektrofizyoloji, tek hücreli ve tek başak seviyesindeçözünürlüğü sayesinde in vivo kayıtları serbestçe hareket eden altın standarttır. Ancak, kaydedilen hücrelerin moleküler kimliğini saptamak zor olabilir ve post-hoc analizi oldukça zahmetli olabilir. Fiber fotometri tek hücreçözünürlüğü yok iken, araştırmacılar geleneksel teknikler ile ele almak imkansız sorular sormak için izin verir. Viral stratejilerin transgenik hayvanlarla birleştirilmesiyle, GECIs'in ekspresyonu, kalsiyum sinyalinin doğrudan aksonda izlenmesi yle yapilebilen popülasyon veya projeksiyon tanımlı nöral aktiviteyi kaydetmek için genetik olarak tanımlanmış nöronal tiplere yönlendirilebilir. terminalleri10,11. Ayrıca, birden fazla fiber optik kanüller implante ederek, aynı anda aynı hayvan12,13çeşitli beyin bölgeleri ve yolları nöral aktivite izlemek mümkündür.
Bu el yazmasında, tek ve çok fiberli fotometri için bir teknik, kalsiyumdan bağımsız eserler için nasıl düzeltilme ve mono-ve çift renkli kayıtların nasıl yapılacağını ayrıntılı olarak anlatacağız. Ayrıca, kişinin sormasını sağladığı soru türlerine ve artan karmaşıklık düzeylerine örnekler salıyoruz (bkz. Şekil 1). Bu protokolde ayrıntılı olarak yer alan çok fiberli kayıtlar için fiber fotometri kurulumu, https://sites.google.com/view/multifp/hardware bulunan malzemelerin bir listesi kullanılarak oluşturulabilir (Şekil 2).
Sistemin GCaMP6 veya varyantlarından kalsiyumbağımsız ve kalsiyuma bağımlı floresan emisyonu için hem 410 nm hem de 470 nm uyarma dalga boyları için donatılması esastır. Özel olarak oluşturulmuş kurulumlar için veya sistemi çalıştıracak kullanılabilir bir yazılım yoksa, ücretsiz, açık kaynak programı Bonsai (http://www.open-ephys.org/bonsai/) kullanılabilir. Alternatif olarak, fiber fotometri MATLAB (örneğin, https://github.com/deisseroth-lab/multifiber)12 veya diğer programlama dili14üzerinden çalıştırılabilir. Sistemin yazılım ve donanım ı 410 nm ve 470 nm LED'lerin ve kameranın manipülasyonuna, görüntülerin çıkarılmasına(Şekil 2)ve liflerin etrafına çizilen ilgi bölgelerindeki ortalama floresan yoğunluğunun hesaplanmasına izin vermelidir. görüntüler. Çıkış, yama kablosundaki her bir elyaftan 470 nm ve 410 nm LED ile kaydedilen ortalama yoğunluk değerlerinin bir tablosu olmalıdır. Çok fiber deneyler yaparken, 400 μm paketlenmiş lifler farelerin hareketini sınırlayabilir. Bu gibi durumlarda, daha fazla esneklik sağlayan 200 μm yama kablosu kullanmanızı öneririz. Farelerin eğitimi sırasında daha küçük kukla kablolar kullanmak da mümkün olabilir.
Bu fiber fotometri edinimi sırasında ilgi olayları için zaman noktaları ayıklamak mümkün olmak çok önemlidir. Sistem belirli olaylar için TTL'leri tümleştirmek için yerleşik bir sistem sağlamazsa, alternatif bir strateji deneme sırasında belirli zaman ve olaylarla hizalamak için kaydedilen tek tek zaman noktalarına bir zaman damgası atamaktır. Zaman damgalama bilgisayar saati kullanılarak yapılabilir.
Access restricted. Please log in or start a trial to view this content.
Protokol
Tüm deneyler Kaliforniya Üniversitesi, San Diego Kurumsal Hayvan Bakım ve Kullanım Komiteleri ve Laboratuvar Hayvanlarının Bakımı ve Kullanımı için Kanada Rehberi uyarınca yapıldı ve Université Laval Hayvan Koruma tarafından onaylandı Komitesi.
1. CMOS (tamamlayıcı metal oksit yarı iletken) kamera ile bireysel veya dallanma yama kablosu arasındaki optik yolun hizalanması
- 5 eksenli çevirmendeki tüm vidaları gevşetin (11, Şekil 2B).
- 5 eksenli çevirmene yapıştırılmış olan adaptöre [SMA (alt minyatür A) veya FC (fiber optik konektör)] yama kablosunu (12, Şekil 2B)vidalayın.
- 470 nm uyarma ışığını (1, Şekil 2B)düşük güçte (100 μW) açın ve otofloresan plastik kaydırağa işaret eden yama kablosunun ucunu yerleştirin. Bu gelecekteki kayıtları herhangi bir etkisi yoktur ama sadece hizalama işlemi görselleştirmek içindir.
- Canlı modda CMOS kameradan (13, Şekil 2B)kayıt yapın. Görüntü tamamen siyah olmayana kadar kazancı artırın veya arama tablosunu (LUT) ayarlayın. Amaç odak noktasında bir görüntü görebilmektir (10, Şekil 2B).
- 5 eksenli çevirmeni hedefe doğru ilerleterek, 470 nm'lik ışığın yama kablosunun SMA veya FC ucundaki lif üzerinde ortalanmasını sağlayarak, kamerada bir görüntü çözülene kadar ilerleyin.
- Görüntü ortalanana ve iyi çözülene kadar X ve Y eksenlerini ayarlayın.
- Yama kablosunun ferrule ucundan yayılan ışığı görselleştirin. Bir iotropik daire olarak görünmelidir. Dallanma yama kablosu kullanılırsa, her yama kablosunun ferrule uçlarında yayılan ışık miktarı benzer olmalıdır. Daire isotropik değilse veya yayılan ışık eşit değilse, X-Y eksenindeki 5 eksenli çevirmeni ayarlayın.
2. Ortalama floresan yoğunluğunun ölçülmesi için lifler in etrafında ROI kurulumu
- Lifleri daha iyi görselleştirmek için tüm uyarma ışıklarını açın. Kamerayı, hiçbir pikselin doygun luk tasnİf edilebis olması ve liflerin net bir görüntüsünün mevcut olacak şekilde kazanisini ayarlayın.
- Canlı kayıt veya bir ön görüntü almak.
- Liflerin etrafına ROI'lar çizin ve kayıtlar sırasında ortalama yoğunluk değerlerinin ölçümü için saklayın (Şekil 2A).
- Birden fazla fiber kayıt için, sinyalleri bağımsızlık için test edin.
- Tüm liflerden canlı kayıt.
- Bir lifi ışık kaynağına doğru işaretle ve parmağınızla dokunun. Çok büyük dalgalanmalar sadece bu kanalda meydana gelmelidir (kabul edilebilir sızıntı 1:1000).
- Sinyaller bağımsız değilse, daha muhafazakar ROI'ları yeniden çizin ve bağımsızlık testini tekrarlayın.
- Hangi YG'nin hangi elyaf, renkli bant veya ojeye karşılık gelir etiketlemek ve takip etmek için liflerin sonuna uygulanabilir. İkincil bir anımsatıcı olarak herhangi bir denemebaşlamadan önce bir resim alın.
3. Kayıt alanının kurulumu
- Standları, kelepçeleri veya tutucuları kullanarak yama kablosunu arenanın üzerine asın.
- Hayvan serbestçe tüm arena boyunca hareket edebilirsiniz emin olun, lif uzunluğu ile sınır tanımayan.
- Operant kutusu veya açık alan kullanılsın, yama kablosunun hayvana en az bükme ile ulaşmasını sağlayın. Bu bir burun dürtme gerektiriyorsa, lif bükme önlemek için yeterli oda yükü olduğundan emin olun. Yama kablosunun aşırı bükülmesinden veya bükülmesinden kaçının.
4. In vivo kayıtları
NOT: Fiber fotometri deneyleri için optik fiber kanül implantasyonu prosedürü Sparta ve ark15'teaçıklandığı gibi optogenetik prosedürü ile aynıdır. Kafa kapağının kafatası kemiğine sağlam bir şekilde sabitlenir etmesini sağlayan diş çimentosu (Bkz. Malzeme Tablosu)kullanmanızı öneririz. Diş çimentosu özellikle demirleme vidalarının kullanılamadığı durumlarda yararlı olacaktır.
- Yama kablosunun liflerinin distal ucunu göz ve minifiber mikroskopla görsel olarak inceleyin. Liflerin yüzeyi çizilirse, liflerince kum (1 μm ve 0,3 m) ile lif parlatma/lapping film kullanarak yeniden parlatılır.
- Yama kablosunun distal uçlarını %70 etanol ve pamuk uçlu aplikatör ile temizleyin.
- %70 etanol ve pamuk uçlu aplikatör kullanarak fiber optik kanülleri temizleyin.
- Yama kablosunun ferrule ucunu, siyah bir shrink tüpüyle kaplı seramik split kollu kullanarak implante edilen elyafa bağlayın. Bağlantı sırasında, kılıfın sıkı olduğundan emin olun, aksi takdirde yeni bir kılıf kullanın.
NOT: Yama kordonu ferrule ve implant arasında herhangi bir boşluk varsa büyük miktarda sinyal kaybı olacaktır ve kayıtlar çalışmaz. - Davranışsal testlerbaşlamadan önce hayvanın birkaç dakika lığına iyileşmesine izin verin.
- Optik sinyali kaydetmeye başla ve deneyi çalıştır.
- Kayıt sırasında, kaliteli kayıtları sağlamak için canlı izleme dikkatli bir göz tutmak. Sinyalin, ilk 2 dakika kayıtta zamanın bir fonksiyonu olarak hızla azalması beklenmektedir. Bu etki ısı aracılı LED bozunma neden olur, Böylece ısı artışı optik elemanın direncini artırır.
- GCaMP'nin açık/kapalı kinetiklerini aşan sinyalde bir sıçrama meydana gelirse, bu genellikle kılıfın yeterince sıkı olmadığının ve yama kablosu ile implant arasındaki boşluğun değiştiğini gösterir. Bu durumda, deneyi durdurun ve hayvanı yeni bir kılıf kullanarak yeniden bağlayın.
5. Fiber fotometri veri analizi
NOT: Bu, çoğu kayıt için iyi çalışan bir veri analizi yöntemidir. Ancak, alternatif yaklaşımlar uygulanabilir. Veri analizi için örnek kodu burada bulabilirsiniz: https://github.com/katemartian/Photometry_data_processing.
- Ekstrakt ortalama floresan yoğunluğu değerleri 470 nm(Int470) ve 410 nm(Int410) LED'lerden, her bir lif için karşılık gelen kaydedildi.
- Hareketli ortalama algoritma kullanarak her sinyali düzleştirin (Şekil 3A).
- Eğimi ve düşük frekansı kaldırmak için uyarlanabilir yinelemeli olarak yeniden ağırlıklandırılan Penalized En Az Kareler (airPLS) algoritmasını (https://github.com/zmzhang/airPLS) kullanarak her sinyalin temel düzeltmesini(Şekil 3A ve 3B)gerçekleştirin sinyallerdeki dalgalanmalar.
- Her sinyali ortalama değer ve standart sapmayı kullanarak standartlaştırın (Şekil 3C):
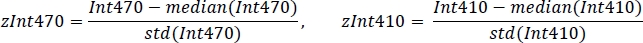
- Negatif olmayan sağlam doğrusal regresyon kullanarak, standartlaştırılmış zInt410 -zInt470 sinyallerini(Şekil 3D)regresyon fonksiyonuna sığdırın:
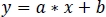
- ZInt 470 'e uygun zInt410(fitInt410, Şekil 3D,E)yeni değerleri bulmak için doğrusal regresyon parametrelerini kullanın (a, b)
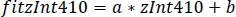
- ZInt 470 'e uygun zInt410(fitInt410, Şekil 3D,E)yeni değerleri bulmak için doğrusal regresyon parametrelerini kullanın (a, b)
- Normalleştirilmiş dF/F (z dF/F)(Şekil 3F) hesaplayın:
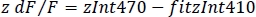
6. Eşzamanlı çift renkli kayıtlar
- Kırmızı floresan kalsiyum sensörü ve uygun dikroik aynalar ve filtreler heyecanlandırmak için fotometri sistemine 560 nm LED ekleyin (ayrıntılı açıklama için Kim ve ark., 2016 bakınız)12.
- Yeşil ve kırmızı emisyon dalga boylarını ayırmak için hedef ve CMOS kamera arasında bir görüntü ayırıcı ekleyin (Bkz. Şekil 5). Görüntü ayırıcı, kamera sensöründe kırmızı ve yeşil sinyallere karşılık gelen iki aynalı görüntü oluşturacaktır (örn. 3 dallı bir yama kablosu 6 fiberden bir görüntü oluşturur).
- Yukarıda ayrıntılı olarak her iki renkte tüm lifler etrafında ROIs çizin. Her yatırım getirisini ilgili lif ve kanal (yeşil ve kırmızı) ile net bir şekilde tanımladığından emin olun (Şekil 4A).
- 470 nm ve 560 nm LED ile eşzamanlı uyarma tetikleyin ve 410 nm LED ile değiştirin(Şekil 5A).
7. Çift renkli veri analizi
- Int470 sinyali için fitint410'u bulmak ve z dF/F'yihesaplamak için Bölüm 5'teki adımları izleyin.
- Kırmızı yalıtılı GECIs'lerin izosbestik noktası genellikle bilinmemekle birlikte, yeşil kanalda 410 nm LED ile kaydedilen sinyal her iki kanalda da hareket düzeltmesi için kullanılabilir. Int560 sinyali için fitint410'u bulmak ve z dF/F'yihesaplamak için Bölüm 5'teki adımları izleyin.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Davranışsal yanıtların nöral korelasyonları çeşitli faktörlere bağlı olarak değişebilir. Bu örnekte, lateral habenulada (LHb) sonlandırılabilen lateral hipotalamik bölgeden (LHA) akson terminallerinin aktivitesini ölçmek için in vivo fiber fotometri kullandık. Yabani tip farelere LHA'da GCaMP6 (AAV-hSyn-GCaMP6s) kodlayan bir adeno ilişkili virüs (AAV) enjekte edildi ve lhb'nin hemen üzerinde bir optik lif ucu ile implante edildi(Şekil 4A). GCaMP6s ek...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Fiber fotometri, araştırmacıların serbestçe hareket eden hayvanlarda tanımlanmış nöronal popülasyonlardan toplu kalsiyum dinamiği kaydetmelerine olanak tanıyan erişilebilir bir yaklaşımdır. Bu yöntem, zorunlu yüzme testleri 2 , korku-klima18, sosyaletkileşimler1,4, ve diğerleri7 gibi "hareket ağır" görevleri de dahil olmak üzere davranış testleri geniş bi...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Sage Aronson, çok fiber litometri sistemleri satan Neurophotometrics Ltd.'nin CEO'su ve kurucusudur.
Teşekkürler
Bu çalışma, Kanada Doğa Bilimleri ve Mühendislik Araştırma Konseyi'nin (RGPIN-2017-06131) C.P. C.P.'ye verdiği bir hibe ile desteklenmiştir. Ayrıca plateforme d'Outils Moléculaires (https://www.neurophotonics.ca/fr/pom) bu çalışmada kullanılan viral vektörlerin üretimi için teşekkür ederiz.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1/4"-20 Stainless Steel Cap Screw, 1" Long | Thorlabs | SH25S100 | |
| 1/4"-20 Stainless Steel Cap Screw, 1/2" Long | Thorlabs | SH25S050 | |
| 1/4"-20 Stainless Steel Cap Screw, 3/8" Long | Thorlabs | SH25S038 | |
| 1000 µm, 0.50 NA, SMA-SMA Fiber Patch Cable | Thorlabs | M59L01 | |
| 12.7 mm Optical Post | Thorlabs | TR30/M | |
| 12.7 mm Pedestal Post Holder | Thorlabs | PH20EM | |
| 15 V, 2.4 A Power Supply Unit with 3.5 mm Jack Connector for T-Cube | Thorlabs | KPS101 | |
| 20x objective | Thorlabs | RMS20X | #10 in Figure 2, #11 in Figure 5 |
| 30 mm Cage Cube with Dichroic Filter Mount | Thorlabs | CM1-DCH/M | #8-9 in Figure 2, #8-10 in Figure 5 |
| 405 nm LED | Doric Lenses | CLED_405 | #2 in Figure 2 |
| 410 nm bandpass filter | Thorlabs | FB410-10 | #5 in Figure 2; #7 in Figure 5 |
| 465 nm. LED | Doric Lenses | CLED_465 | #1 in Figure 2 |
| 470 nm bandpass filter | Thorlabs | FB470-10 | #4 in Figure 2; #6 in Figure 5 |
| 560 nm bandpass filter | Semrock | FF01-560/14-25 | #5 in Figure 5 |
| 560 nm LED | Doric Lenses | CLED_560 | #1 in Figure 3 |
| 5-axis kinematic Mount | Thorlabs | K5X1 | #11 in Figure 2, #12 in Figure 5 |
| Achromatic Doublet | Thorlabs | AC254-035-A-ML | #7 in Figure 2 |
| Adaptor for 405 collimator | Thorlabs | AD11F | #3 in Figure 2; #4 in Figure 5 |
| Adaptor for ajustable collimator | Thorlabs | AD127-F | #3 in Figure 2; #4 in Figure 5 |
| Aluminum Breadboard | Thorlabs | MB1824 | |
| Clamping Fork | Thorlabs | CF125 | |
| Cube connector | Thorlabs | CM1-CC | |
| Dual 493/574 dichroic | Semrock | FF493/574-Di01-25x36 | #10 in Figure 5 |
| Emission filter for GCaMP6 | Semrock | FF01-535/22-25 | #6 in Figure 2 |
| Enclosure with Black Hardboard Panels | Thorlabs | XE25C9 | |
| Externally SM1-Threaded End Cap for Machining | Thorlabs | SM1CP2M | |
| Fast-change SM1 Lens Tube Filter Holder | Thorlabs | SM1QP | #4-6 in Figure 2, #5-7 in Figure 5 |
| Fixed Collimator for 405 nm light | Thorlabs | F671SMA-405 | #3 in Figure 2; #4 in Figure 5 |
| Fixed collimator for 470 and 560 nm light | Thorlabs | F240SMA-532 | #3 in Figure 2; #4 in Figure 5 |
| Green emission filter | Semrock | FF01-520/35-25 | In light beam splitter |
| High-Resolution USB 3.0 CMOS Camera | Thorlabs | DCC3260M | #13 in Figure 2, #15 in Figure 5 |
| Light beam splitter | Neurophotometrics | SPLIT | #14 in Figure 5 |
| Longpass Dichroic Mirror, 425 nm Cutoff | Thorlabs | DMLP425R | #8 in Figure 2, #9 in Figure 5 |
| Longpass Dichroic Mirror, 495 nm Cutoff | Semrock | FF495-Di03 | #9 in Figure 2, #8 in Figure 5 |
| Metabond dental cement | C&B | ||
| M8 - M8 cable | Doric Lenses | Cable_M8-M8 | |
| Optic fiber cannulas | Doric Lenses | Need to specify that these will be used to photometry experiments requiring low autofluorescence | |
| Optic fiber Patchcords | Doric Lenses | Need to specify that these will be used to photometry experiments requiring low autofluorescence | |
| Red emission filter | Semrock | FF01-600/37-25 | In light beam splitter |
| T7 LabJack | LabJack | ||
| T-cube LED Driver | Thorlabs | LEDD1B | |
| USB 3.0 I/O Cable, Hirose 25, for DCC3240 | Thorlabs | CAB-DCU-T3 |
Referanslar
- Gunaydin, L. A., et al. Natural Neural Projection Dynamics Underlying Social Behavior. Cell. 157 (7), 1535-1551 (2014).
- Proulx, C. D., et al. A neural pathway controlling motivation to exert effort. Proceedings of the National Academy of Sciences of the United States of America. 115 (22), 5792-5797 (2018).
- Muir, J., et al. In Vivo Fiber Photometry Reveals Signature of Future Stress Susceptibility in Nucleus Accumbens. Neuropsychopharmacology. 43 (2), 255-263 (2017).
- Wang, D., et al. Learning shapes the aversion and reward responses of lateral habenula neurons. eLife. 6, (2017).
- de Jong, J. W., et al. A Neural Circuit Mechanism for Encoding Aversive Stimuli in the Mesolimbic Dopamine System. Neuron. 101 (1), 133-151 (2018).
- Lerner, T. N., et al. Intact-Brain Analyses Reveal Distinct Information Carried by SNc Dopamine Subcircuits. Cell. 162 (3), 635-647 (2015).
- Calipari, E. S., et al. In vivo imaging identifies temporal signature of D1 and D2 medium spiny neurons in cocaine reward. Proceedings of the National Academy of Sciences of the United States of America. 113 (10), 2726-2731 (2016).
- González, A. J., et al. Inhibitory Interplay between Orexin Neurons and Eating. Current Biology. 26 (18), 2486-2491 (2016).
- Chen, T. -W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Barker, D. J., et al. Lateral Preoptic Control of the Lateral Habenula through Convergent Glutamate and GABA Transmission. Cell Reports. 21 (7), 1757-1769 (2017).
- Siciliano, C. A., Tye, K. M. Leveraging calcium imaging to illuminate circuit dysfunction in addiction. Alcohol. 74, 47-63 (2018).
- Kim, C. K., et al. Simultaneous fast measurement of circuit dynamics at multiple sites across the mammalian brain. Nature Methods. 13 (4), 325-328 (2016).
- Sych, Y., Chernysheva, M., Sumanovski, L. T., Helmchen, F. High-density multi-fiber photometry for studying large-scale brain circuit dynamics. Nature Methods. 16 (6), 553-560 (2019).
- Akam, T., Walton, M. E. pyPhotometry: Open source Python based hardware and software for fiber photometry data acquisition. Scientific Reports. 9 (1), 3521(2019).
- Sparta, D. R., et al. Construction of implantable optical fibers for long-term optogenetic manipulation of neural circuits. Nature Protocol. 7 (1), 12-23 (2011).
- Stamatakis, A. M., et al. Lateral Hypothalamic Area Glutamatergic Neurons and Their Projections to the Lateral Habenula Regulate Feeding and Reward. The Journal of Neuroscience. 36 (2), 302-311 (2016).
- Tervo, G. D., et al. A Designer AAV Variant Permits Efficient Retrograde Access to Projection Neurons. Neuron. 92 (2), 372-382 (2016).
- Yu, K., da Silva, P., Albeanu, D. F., Li, B. Central Amygdala Somatostatin Neurons Gate Passive and Active Defensive Behaviors. The Journal of Neuroscience. 36 (24), 6488-6496 (2016).
- Falkner, A. L., Grosenick, L., Davidson, T. J., Deisseroth, K., Lin, D. Hypothalamic control of male aggression-seeking behavior. Nature Neuroscience. 19 (4), 596-604 (2016).
- Ren, J., et al. Anatomically Defined and Functionally Distinct Dorsal Raphe Serotonin Sub-systems. Cell. 175 (2), 472-487 (2018).
- Barnett, L. M., Hughes, T. E., Drobizhev, M. Deciphering the molecular mechanism responsible for GCaMP6m’s Ca2+-dependent change in fluorescence. PLOS ONE. 12 (2), 0170934(2017).
- Sun, F., et al. A Genetically Encoded Fluorescent Sensor Enables Rapid and Specific Detection of Dopamine in Flies, Fish, and Mice. Cell. 174 (2), 481-496 (2018).
- Patriarchi, T., et al. Ultrafast neuronal imaging of dopamine dynamics with designed genetically encoded sensors. Science. 360 (6396), (2018).
- Feng, J., et al. A Genetically Encoded Fluorescent Sensor for Rapid and Specific In Detection of Norepinephrine. Neuron. 102 (4), 745-761 (2019).
- Akerboom, J., et al. Genetically encoded calcium indicators for multi-color neural activity imaging and combination with optogenetics. Frontiers in Molecular Neuroscience. 6, 1-29 (2013).
- Dana, H., et al. Sensitive red protein calcium indicators for imaging neural activity. eLife. 5, (2016).
- Wang, H., Jing, M., Li, Y. Lighting up the brain: genetically encoded fluorescent sensors for imaging neurotransmitters and neuromodulators. Current Opinion in Neurobiology. 50, 171-178 (2018).
- Lu, L., et al. Wireless optoelectronic photometers for monitoring neuronal dynamics in the deep brain. Proceedings of the National Academy of Sciences. 115 (7), 1374-1383 (2018).
- Jennings, J. H., et al. Visualizing Hypothalamic Network Dynamics for Appetitive and Consummatory Behaviors. Cell. 160 (3), 516-527 (2014).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır