このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
自由に動く動物の神経活動を記録するマルチファイバー光メトリー
要約
このプロトコルでは、マルチファイバーフォトメトリー記録の実装と実行方法、カルシウムに依存しないアーティファクトの修正方法、およびデュアルカラーフォトメトリイメージングに関する重要な考慮事項について詳しく説明します。
要約
自由に動く動物のニューロンのグループの活動を記録することは挑戦的な仕事です。さらに、脳がより小さく、より小さい機能サブグループに解剖されると、ニューロンの突起および/または遺伝的に定義された亜集団から記録することが最も重要になります。ファイバーフォトメトリーは、これらの課題を克服できるアクセス可能で強力なアプローチです。光学法と遺伝的方法論を組み合わせることで、遺伝子コード化されたカルシウム指標を発現させることで、脳の深部構造で神経活動を測定することができ、神経活動を簡単に測定できる光学信号に変換します。現在のプロトコルでは、マルチファイバーフォトメトリーシステムの構成要素、光を送受信する深層脳構造にアクセスする方法、モーションアーティファクトを考慮する方法、蛍光信号を処理および解析する方法について詳しく説明しています。このプロトコルは、単一または複数の埋め込み光ファイバから単一およびデュアルカラーイメージングを実行する際の実験的な考慮事項を詳述します。
概要
神経反応を動物の行動の特定の側面と相関させる能力は、特定のニューロングループが行動や刺激を指示または応答する際に果たす役割を理解するために重要です。動物の行動の複雑さを考えると、最も単純な行動にも影響を与える可能性のある無数の内部状態と外部刺激により、単一試用解像度で信号を記録すると、これらを克服するために必要なツールを研究者に提供します。制限。
ファイバーフォトメトリーは、生体内記録技術の他に比べて相対的なシンプルさ、高い信号対雑音比、および様々なシステム神経科学の分野で多くの研究者にとって選択の技術となっています。行動パラダイム1,2,3,4,5,6,7,8.従来の電気生理学的方法とは異なり、フォトメトリーは、遺伝的にコードされたカルシウム指標(GECI、GCaMPシリーズ)9と組み合わせて最も一般的に使用される光学的アプローチです。GECIsは、カルシウムに結合しているかどうかに基づいて蛍発性を変化させます。ニューロン中のカルシウムの内部濃度は非常に厳しく調節され、ニューロンが作用電位を発射すると電圧ゲートカルシウムチャネルが開くため、一過性の内部カルシウム濃度が増加し、蛍光に対するGECIの能力は、ニューロン発射9の良好なプロキシでありうる。
光ファイヤを使用すると、励起光は薄いマルチモードの光ファイバを脳に送り込み、発光信号を同じ繊維を通して回収します。これらの光ファイバは軽量で曲げ可能であるため、動物はほとんど妨げられずに移動することができ、この技術は、行動テストや条件の広い配列と互換性があります。光ファイバ パッチ コードの急速な動きや曲げなど、内部反射全体を維持できる半径を超える一部の条件では、信号アーティファクトが発生する可能性があります。ノイズからの信号を曖昧にするために、我々は「アイソスベストポイント」として知られているGCaMPのプロパティを利用することができます。簡単に言えば、GCaMPでは、励起光の波長が左にシフトするにつれて、カルシウム結合状態での発光が減少し、カルシウム非結合状態での放出がわずかに増加する。これら2つの放出の相対的強度が等しい点は、イソスベスティックポイントと呼べられている。GCaMPがこの時点で興奮すると、その発光は内部カルシウム濃度の変化の影響を受けず、信号の分散は、光ファイバパッチコードのオーバーベンディングまたは神経組織の動きによる信号の減衰が最も頻繁に起こる。埋め込まれた繊維に対して相対的である。
単一単位の電気生理学は単一細胞および単一スパイクのレベルの決断による生体内の記録で自由に動かすための金の標準である。しかし、記録されている細胞の分子的アイデンティティを特定することは困難であり、ポストホック分析は非常に面倒な場合があります。繊維フォトメトリーは単一細胞分解能を持たないが、研究者は従来の技術では対応できない質問をすることができます。ウイルス戦略とトランスジェニック動物を組み合わせることで、GECの発現は遺伝的に定義されたニューロン型に向けられ、集団または投影定義の神経活動を記録することができ、これは軸でカルシウムシグナルを直接モニタリングすることによって行うことができる。ターミナル10,11.さらに、複数の光ファイバーカニューレを埋め込むことにより、同じ動物12、13内の複数の脳領域および経路からの神経活動を同時に監視することができる。
本原稿では、単繊維およびマルチファイバーフォトメトリーの技術、カルシウムに依存しないアーティファクトの補正方法、モノカラーとデュアルカラーの記録の実行方法について説明する。また、質問の種類とその複雑さの増加レベルの例も示します (図 1参照)。このプロトコルで詳述されているマルチファイバー記録用の光メトリーセットアップは、https://sites.google.com/view/multifp/hardwareで見つかった材料のリストを使用して構築できます(図2)。
GCaMP6またはその変異体からのカルシウム依存性およびカルシウム依存性蛍光放出に対して、410 nmおよび470 nmの励起波長の両方にシステムを装備することが不可欠です。カスタムビルドのセットアップや、システムを実行するための利用可能なソフトウェアがない場合は、無料のオープンソースプログラムBonsai(http://www.open-ephys.org/bonsai/)を使用することができます。あるいは、ファイバーフォトメトリーは、MATLAB(例えば、https://github.com/deisseroth-lab/multifiber)12または他のプログラミング言語14を介して実行することができる。システムのソフトウェアとハードウェアは、410 nmと470 nmのLEDとカメラの両方の操作、画像の抽出(図2)、および繊維の周りに描かれた対象領域(ROI)の平均蛍光強度の計算を可能にする必要があります。画像。出力は、パッチ コード内の各ファイバから 470 nm および 410 nm LED で記録された平均強度値のテーブルである必要があります。マルチファイバー実験を行う場合、400μmの束化繊維はマウスの動きを制限してもよい。このような場合は、柔軟性を高める 200 μm パッチ コードを使用することをお勧めします。また、マウスの訓練中に小さなダミーケーブルを使用することも可能です。
ファイバーフォトメトリーの獲得時に、対象となる事象のタイムポイントを抽出できることが重要です。システムが特定のイベントに TTLL を統合するための組み込みシステムを容易に提供しない場合、別の方法として、テスト中に特定の時間とイベントに合わせて記録された個々のタイム ポイントにタイム スタンプを割り当てることを別の方法として使用します。タイムスタンプは、コンピュータクロックを使用して行うことができます。
Access restricted. Please log in or start a trial to view this content.
プロトコル
すべての実験は、カリフォルニア大学サンディエゴ校の施設動物ケアおよび使用委員会、および実験動物のケアと使用に関するカナダガイドに従って行われ、ラバル動物保護大学によって承認されました。委員 会。
1. CMOS(相補金属酸化物半導体)カメラと個々または分岐パッチコードとの間の光路の位置合わせ
- 5 軸トランスレータのすべてのネジを緩めます (11,図 2B)。
- パッチコード(図2B)のネジは、5軸トランスレータに貼付されたアダプタ[SMA(サブミニチュアA)またはFC(光ファイバコネクタ))]に取り付け済み。
- 470 nm励起光(図2B)を低出力(100μW)でオンにし、パッチコードの先端を自己蛍光プラスチックスライドを指します。これは、将来の記録には関係ありませんが、アライメントプロセスを視覚化するためのものです。
- CMOSカメラ(13、図2B)からライブモードで記録します。イメージが完全に黒でないまで、ゲインを増やすか、ルックアップ テーブル (LUT) を調整します。ポイントは、目的の焦点で画像を見ることができる(10、図2B)。
- 5 軸のトランスレータを目的に進み、470 nm の光がパッチ コードの SMA または FC 端のファイバの中央に配置されていることを確認し、カメラで画像を解決します。
- イメージが中央に配置され、適切に解決されるまで、X 軸と Y 軸を調整します。
- パッチ コードのフェルール端から放出されるライトを視覚化します。等方性円として表示されます。分岐パッチコードを使用する場合、各パッチコードのフェルール端部で放出される光の量は同様である必要があります。円が等方性でない場合、または放出された光が等しくない場合は、X-Y 軸の 5 軸トランスレータを調整します。
2. 平均蛍光強度測定用繊維周辺のROIの設定
- すべての励起ライトをオンにして、繊維をより良く視覚化します。ピクセルが飽和し、繊維の鮮明な画像が存在しないようなカメラゲインを調整します。
- ライブレコードや予備画像を撮ります。
- 繊維の周りにROIを描画し、記録中の平均強度値の測定のためにそれらを維持します(図2A)。
- 複数のファイバ記録の場合は、信号の独立性をテストします。
- すべての繊維からのライブレコード。
- 1 本のファイバを光源に向け、指でタップします。非常に大きな変動は、そのチャネルでのみ発生する必要があります(許容漏れ1:1000)。
- 信号が独立していない場合は、より保守的なROIを再描画し、独立テストを繰り返します。
- どのROIがどの繊維、着色テープまたはマニキュアに対応しているかをラベル付けし、追跡するために、繊維の端部に適用することができます。実験を開始する前に、セカンダリリマインダーとして写真を撮ります。
3. レコーディングアリーナの設定
- スタンド、クランプ、またはホルダーを使用して、パッチコードをアリーナの上に掛けます。
- 動物が繊維の長さによって抑制されずに、アリーナ全体を自由に動くことができることを確認してください。
- オペラボックスまたはオープンフィールドを使用するかどうかにかかわらず、パッチコードが最小限の曲げで動物に到達できることを確認してください。鼻突きが必要な場合は、繊維の曲げを防ぐのに十分なスペースオーバーヘッドがあることを確認します。パッチコードの曲がりやねじれは避けてください。
4. インビボ録音
注:繊維光メトリー実験のための光ファイバーカニューレ移植の手順は、スパルタら15に記載されている光遺伝学の手順と同一である。頭蓋骨にヘッドキャップの強い固定を提供する歯科用セメント(材料の表を参照)を使用することをお勧めします。歯科用セメントは、固定ネジが使用できない場合に特に有用です。
- パッチコードの繊維の遠位端を目とミニファイバー顕微鏡で目で目で検査します。繊維の表面に傷が付いている場合は、細かいグリット(1 μmおよび0.3 μm)で繊維研磨/ラッピングフィルムを使用して繊維を再研磨します。
- 70%のエタノールと綿の先端アプリケーターでパッチコードの遠位端をきれいにします。
- 70%エタノールと綿の先端アプリケーターを使用して光ファイバーカニューレをきれいにします。
- 黒い収縮管で覆われたセラミックスプリットスリーブを使用して、パッチコードのフェルール端を埋め込んだ繊維に接続します。接続中に、スリーブがタイトであることを確認し、それ以外の場合は新しいスリーブを使用してください。
注:パッチコードフェルールとインプラントの間にスペースがあり、録音が機能しない場合、大量の信号損失が生じるでしょう。 - 行動テストを開始する前に、動物が数分間回復できるようにします。
- 光信号の記録を開始し、実験を実行します。
- 録音中は、ライブトレースに注意して、品質の高い録音を確保してください。信号は、記録の最初の2分の時間の関数として急速に減少することが予想されます。この効果は、熱媒介LED崩壊によって引き起こされ、それによって熱の増加は、光学素子の抵抗を増加させる。
- GCaMPのオン/オフ運動を超える信号のジャンプが発生した場合、これは多くの場合、スリーブが十分にタイトではなく、パッチコードとインプラントの間のスペースが変化していることを示しています。この場合、実験を中止し、新しいスリーブを使用して動物を再接続します。
5. ファイバーフォトメトリーデータ分析
注: これは、ほとんどの録画に適したデータ分析の方法です。ただし、別の方法を実装できます。データ分析の例コードは、https://github.com/katemartian/Photometry_data_processingここに見つけることができます。
- 抽出は、470nm(Int 470)および410nm(Int 410)LEDから記録された蛍光強度値を平均し、個々の繊維に対応する。
- 移動平均アルゴリズムを使用して各信号を滑らかにします(図3A)。
- アダプティブ繰り返し再重み付けされたペナルティ最小二乗(airPLS)アルゴリズム(https://github.com/zmzhang/airPLS)を使用して各信号のベースライン補正を実行し、傾きと低周波を除去します。信号の変動。
- 平均値と標準偏差を使用して各信号を標準化します (図 3C):
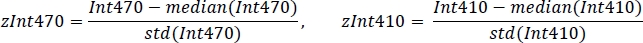
- 非負の強い線形回帰を使用して、標準化された zInt410 から zInt470 シグナル (図 3D)を回帰関数に適合します。
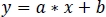
- 線形回帰(a, b)のパラメータを使用して、zInt 470(fitInt410,図 3D,E)に適合したzInt410 の新しい値を見つけます。
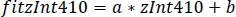
- 線形回帰(a, b)のパラメータを使用して、zInt 470(fitInt410,図 3D,E)に適合したzInt410 の新しい値を見つけます。
- 正規化されたdF/F (z dF/F) (図 3F) を計算します。
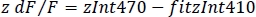
6. 同時デュアルカラー録音
- フォトメトリーシステムに560nm LEDを追加して、赤色蛍光カルシウムセンサと適切なダイクロイックミラーおよびフィルタを励起する(詳細についてはKim et al., 2016を参照)12。
- 目的とCMOSカメラの間に画像分割機を追加して、緑と赤の発光波長を分離します(図5参照)。画像スプリッタは、赤と緑の信号に対応するカメラセンサー上の2つのミラー画像を形成します(例えば、3つの枝を持つパッチコードは、6繊維を持つ画像を作成します)。
- 上記のように、両方の色ですべてのファイバの周りにROIを描画します。対応するファイバとチャネル(緑と赤)で各ROIを明確に識別してください(図4A)。
- 470 nm および 560 nm LED で同時励起をトリガーし、410 nm LED (図 5A)で交互に使用します。
7. デュアルカラーデータ解析
- セクション 5 の手順に従って、Int470 信号のfitInt410 を見つけ、z dF/Fを計算します。
- 赤シフト GEC のアイソスベスト ポイントは一般に不明であるため、緑色チャネルに 410 nm LED で記録された信号は、両方のチャネルでの移動補正に使用できます。セクション 5 の手順に従って、Int560 信号のfitInt410 を見つけ、z dF/Fを計算します。
Access restricted. Please log in or start a trial to view this content.
結果
行動応答の神経相関は、様々な要因によって異なる場合があります。この例では、生体内繊維光測定で、横ハベヌラ(LHb)で終わる横視床下部(LHA)からの軸索末子の活性を測定した。野生型マウスは、LHAにGCaMP6s(AAV-hSyn-GCaMP6s)をコードするアデノ関連ウイルス(AAV)を注入し、光ファイバをLHbのすぐ上の先端に移植した(図4A)。GCaMP6s発現は、カルシウム信号を記録?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
ファイバーフォトメトリーは、研究者が自由に動く動物の定義されたニューロン集団からバルクカルシウムダイナミクスを記録することを可能にするアクセス可能なアプローチです。この方法は、強制水泳テスト2、恐怖コンディショニング18、社会的相互作用1、4、および他7などの「運動重い」タスクを含む行動テストの...
Access restricted. Please log in or start a trial to view this content.
開示事項
セージ・アロンソンは、マルチファイバーフォトメトリーシステムを販売するニューロフォトメトリクス社のCEO兼創設者です。
謝辞
この研究は、カナダ自然科学工学研究評議会(NSERC:RGPIN-2017-06131)からC.P.C.P.への助成金によって支援されました。我々はまた、この研究で使用されるウイルスベクターの生産のためのプレートフォルム・ドゥティルス・モレキュアレス(https://www.neurophotonics.ca/fr/pom)に感謝する。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 1/4"-20 Stainless Steel Cap Screw, 1" Long | Thorlabs | SH25S100 | |
| 1/4"-20 Stainless Steel Cap Screw, 1/2" Long | Thorlabs | SH25S050 | |
| 1/4"-20 Stainless Steel Cap Screw, 3/8" Long | Thorlabs | SH25S038 | |
| 1000 µm, 0.50 NA, SMA-SMA Fiber Patch Cable | Thorlabs | M59L01 | |
| 12.7 mm Optical Post | Thorlabs | TR30/M | |
| 12.7 mm Pedestal Post Holder | Thorlabs | PH20EM | |
| 15 V, 2.4 A Power Supply Unit with 3.5 mm Jack Connector for T-Cube | Thorlabs | KPS101 | |
| 20x objective | Thorlabs | RMS20X | #10 in Figure 2, #11 in Figure 5 |
| 30 mm Cage Cube with Dichroic Filter Mount | Thorlabs | CM1-DCH/M | #8-9 in Figure 2, #8-10 in Figure 5 |
| 405 nm LED | Doric Lenses | CLED_405 | #2 in Figure 2 |
| 410 nm bandpass filter | Thorlabs | FB410-10 | #5 in Figure 2; #7 in Figure 5 |
| 465 nm. LED | Doric Lenses | CLED_465 | #1 in Figure 2 |
| 470 nm bandpass filter | Thorlabs | FB470-10 | #4 in Figure 2; #6 in Figure 5 |
| 560 nm bandpass filter | Semrock | FF01-560/14-25 | #5 in Figure 5 |
| 560 nm LED | Doric Lenses | CLED_560 | #1 in Figure 3 |
| 5-axis kinematic Mount | Thorlabs | K5X1 | #11 in Figure 2, #12 in Figure 5 |
| Achromatic Doublet | Thorlabs | AC254-035-A-ML | #7 in Figure 2 |
| Adaptor for 405 collimator | Thorlabs | AD11F | #3 in Figure 2; #4 in Figure 5 |
| Adaptor for ajustable collimator | Thorlabs | AD127-F | #3 in Figure 2; #4 in Figure 5 |
| Aluminum Breadboard | Thorlabs | MB1824 | |
| Clamping Fork | Thorlabs | CF125 | |
| Cube connector | Thorlabs | CM1-CC | |
| Dual 493/574 dichroic | Semrock | FF493/574-Di01-25x36 | #10 in Figure 5 |
| Emission filter for GCaMP6 | Semrock | FF01-535/22-25 | #6 in Figure 2 |
| Enclosure with Black Hardboard Panels | Thorlabs | XE25C9 | |
| Externally SM1-Threaded End Cap for Machining | Thorlabs | SM1CP2M | |
| Fast-change SM1 Lens Tube Filter Holder | Thorlabs | SM1QP | #4-6 in Figure 2, #5-7 in Figure 5 |
| Fixed Collimator for 405 nm light | Thorlabs | F671SMA-405 | #3 in Figure 2; #4 in Figure 5 |
| Fixed collimator for 470 and 560 nm light | Thorlabs | F240SMA-532 | #3 in Figure 2; #4 in Figure 5 |
| Green emission filter | Semrock | FF01-520/35-25 | In light beam splitter |
| High-Resolution USB 3.0 CMOS Camera | Thorlabs | DCC3260M | #13 in Figure 2, #15 in Figure 5 |
| Light beam splitter | Neurophotometrics | SPLIT | #14 in Figure 5 |
| Longpass Dichroic Mirror, 425 nm Cutoff | Thorlabs | DMLP425R | #8 in Figure 2, #9 in Figure 5 |
| Longpass Dichroic Mirror, 495 nm Cutoff | Semrock | FF495-Di03 | #9 in Figure 2, #8 in Figure 5 |
| Metabond dental cement | C&B | ||
| M8 - M8 cable | Doric Lenses | Cable_M8-M8 | |
| Optic fiber cannulas | Doric Lenses | Need to specify that these will be used to photometry experiments requiring low autofluorescence | |
| Optic fiber Patchcords | Doric Lenses | Need to specify that these will be used to photometry experiments requiring low autofluorescence | |
| Red emission filter | Semrock | FF01-600/37-25 | In light beam splitter |
| T7 LabJack | LabJack | ||
| T-cube LED Driver | Thorlabs | LEDD1B | |
| USB 3.0 I/O Cable, Hirose 25, for DCC3240 | Thorlabs | CAB-DCU-T3 |
参考文献
- Gunaydin, L. A., et al. Natural Neural Projection Dynamics Underlying Social Behavior. Cell. 157 (7), 1535-1551 (2014).
- Proulx, C. D., et al. A neural pathway controlling motivation to exert effort. Proceedings of the National Academy of Sciences of the United States of America. 115 (22), 5792-5797 (2018).
- Muir, J., et al. In Vivo Fiber Photometry Reveals Signature of Future Stress Susceptibility in Nucleus Accumbens. Neuropsychopharmacology. 43 (2), 255-263 (2017).
- Wang, D., et al. Learning shapes the aversion and reward responses of lateral habenula neurons. eLife. 6, (2017).
- de Jong, J. W., et al. A Neural Circuit Mechanism for Encoding Aversive Stimuli in the Mesolimbic Dopamine System. Neuron. 101 (1), 133-151 (2018).
- Lerner, T. N., et al. Intact-Brain Analyses Reveal Distinct Information Carried by SNc Dopamine Subcircuits. Cell. 162 (3), 635-647 (2015).
- Calipari, E. S., et al. In vivo imaging identifies temporal signature of D1 and D2 medium spiny neurons in cocaine reward. Proceedings of the National Academy of Sciences of the United States of America. 113 (10), 2726-2731 (2016).
- González, A. J., et al. Inhibitory Interplay between Orexin Neurons and Eating. Current Biology. 26 (18), 2486-2491 (2016).
- Chen, T. -W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Barker, D. J., et al. Lateral Preoptic Control of the Lateral Habenula through Convergent Glutamate and GABA Transmission. Cell Reports. 21 (7), 1757-1769 (2017).
- Siciliano, C. A., Tye, K. M. Leveraging calcium imaging to illuminate circuit dysfunction in addiction. Alcohol. 74, 47-63 (2018).
- Kim, C. K., et al. Simultaneous fast measurement of circuit dynamics at multiple sites across the mammalian brain. Nature Methods. 13 (4), 325-328 (2016).
- Sych, Y., Chernysheva, M., Sumanovski, L. T., Helmchen, F. High-density multi-fiber photometry for studying large-scale brain circuit dynamics. Nature Methods. 16 (6), 553-560 (2019).
- Akam, T., Walton, M. E. pyPhotometry: Open source Python based hardware and software for fiber photometry data acquisition. Scientific Reports. 9 (1), 3521(2019).
- Sparta, D. R., et al. Construction of implantable optical fibers for long-term optogenetic manipulation of neural circuits. Nature Protocol. 7 (1), 12-23 (2011).
- Stamatakis, A. M., et al. Lateral Hypothalamic Area Glutamatergic Neurons and Their Projections to the Lateral Habenula Regulate Feeding and Reward. The Journal of Neuroscience. 36 (2), 302-311 (2016).
- Tervo, G. D., et al. A Designer AAV Variant Permits Efficient Retrograde Access to Projection Neurons. Neuron. 92 (2), 372-382 (2016).
- Yu, K., da Silva, P., Albeanu, D. F., Li, B. Central Amygdala Somatostatin Neurons Gate Passive and Active Defensive Behaviors. The Journal of Neuroscience. 36 (24), 6488-6496 (2016).
- Falkner, A. L., Grosenick, L., Davidson, T. J., Deisseroth, K., Lin, D. Hypothalamic control of male aggression-seeking behavior. Nature Neuroscience. 19 (4), 596-604 (2016).
- Ren, J., et al. Anatomically Defined and Functionally Distinct Dorsal Raphe Serotonin Sub-systems. Cell. 175 (2), 472-487 (2018).
- Barnett, L. M., Hughes, T. E., Drobizhev, M. Deciphering the molecular mechanism responsible for GCaMP6m’s Ca2+-dependent change in fluorescence. PLOS ONE. 12 (2), 0170934(2017).
- Sun, F., et al. A Genetically Encoded Fluorescent Sensor Enables Rapid and Specific Detection of Dopamine in Flies, Fish, and Mice. Cell. 174 (2), 481-496 (2018).
- Patriarchi, T., et al. Ultrafast neuronal imaging of dopamine dynamics with designed genetically encoded sensors. Science. 360 (6396), (2018).
- Feng, J., et al. A Genetically Encoded Fluorescent Sensor for Rapid and Specific In Detection of Norepinephrine. Neuron. 102 (4), 745-761 (2019).
- Akerboom, J., et al. Genetically encoded calcium indicators for multi-color neural activity imaging and combination with optogenetics. Frontiers in Molecular Neuroscience. 6, 1-29 (2013).
- Dana, H., et al. Sensitive red protein calcium indicators for imaging neural activity. eLife. 5, (2016).
- Wang, H., Jing, M., Li, Y. Lighting up the brain: genetically encoded fluorescent sensors for imaging neurotransmitters and neuromodulators. Current Opinion in Neurobiology. 50, 171-178 (2018).
- Lu, L., et al. Wireless optoelectronic photometers for monitoring neuronal dynamics in the deep brain. Proceedings of the National Academy of Sciences. 115 (7), 1374-1383 (2018).
- Jennings, J. H., et al. Visualizing Hypothalamic Network Dynamics for Appetitive and Consummatory Behaviors. Cell. 160 (3), 516-527 (2014).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved