JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
자유롭게 움직이는 동물의 신경 활동을 기록하는 다중 섬유 광도 측정법
요약
이 프로토콜은 다중 섬유 광도 측정 기록을 구현하고 수행하는 방법, 칼슘 독립적 인 아티팩트를 수정하는 방법 및 이중 색상 광도계 이미징에 대한 중요한 고려 사항을 자세히 설명합니다.
초록
자유롭게 움직이는 동물에서 뉴런 그룹의 활동을 기록하는 것은 어려운 일입니다. 더욱이, 두뇌는 더 작고 더 작은 기능 적인 하위 그룹으로 해부되기 때문에, 뉴런의 투영 및/또는 유전적으로 정의된 하위 집단에서 기록하는 것이 가장 중요하게 됩니다. 섬유 광도 측정은 이러한 문제를 극복할 수 있는 접근가능하고 강력한 접근 방식입니다. 광학 및 유전 적 방법론을 결합하여, 신경 활동은 쉽게 측정 할 수있는 광학 신호로 신경 활동을 변환 유전자 부호 칼슘 지표를 표현하여 깊은 뇌 구조에서 측정 할 수 있습니다. 현재 프로토콜은 다중 섬유 광도 계열 시스템의 구성 요소, 빛을 전달하고 수집하는 깊은 뇌 구조에 액세스하는 방법, 모션 아티팩트를 설명하는 방법, 형광 신호를 처리하고 분석하는 방법을 자세히 설명합니다. 이 프로토콜은 단일 또는 다중 이식된 광섬유에서 단일 및 이중 컬러 이미징을 수행할 때 실험적 고려 사항을 자세히 설명합니다.
서문
동물의 행동의 특정 측면과 신경 반응을 상관 시키는 능력은 특정 신경 세포 의 특정 그룹 지시 또는 행동 또는 자극에 응답에 재생 하는 역할을 이해 하는 데 중요 하다. 동물 행동의 복잡성을 감안할 때, 가장 간단한 행동에도 영향을 미칠 수있는 수많은 내부 상태와 외부 자극을 감안할 때, 단일 시험 해상도로 신호를 기록하면 연구원이 이를 극복하는 데 필요한 도구를 갖추게됩니다. 제한.
섬유 광도계는 다른 생체 내 기록 기술과 비교하여 상대적으로 단순성, 높은 신호 대 잡음 비율 및 다양한 기록 능력 으로 인해 시스템 신경 과학 분야의 많은 연구자들이 선택하는 기술이 되었습니다. 행동 패러다임1,2,3,4,5,6,7,8. 기존의 전기 생리학적 방법과 는 달리, 광도측정은 유전자 부호가 코딩된 칼슘 지표(GECIs, GCaMP 계열)와 함께 가장 일반적으로 사용되는 광학접근법9. GECIs는 칼슘에 결합되어 있는지 여부에 따라 형광 능력을 변경합니다. 뉴런의 칼슘 의 내부 농도는 매우 엄격하게 조절되고 전압 게이트 칼슘 채널이 열리기 때문에 뉴런이 작용 전위를 발사할 때, 내부 칼슘 농도가 일시적으로 증가하여 일시적인 증가를 초래합니다. 형광에 GECI의 능력, 신경발사에대한 좋은 프록시가 될 수 있습니다 9 .
광섬유 광도 측정을 사용하면 여기 광이 얇고 다중 모드 광섬유를 뇌로 향하며 방출 신호가 동일한 섬유를 통해 다시 수집됩니다. 이러한 광섬유는 가볍고 구부릴 수 있기 때문에 동물이 크게 방해받지 않고 움직일 수 있으므로 이 기술은 다양한 행동 테스트 및 조건과 호환됩니다. 전체 내부 반사를 유지할 수 있는 반경을 초과하는 광섬유 패치 코드의 빠른 움직임이나 굽힘과 같은 일부 조건은 신호 아티팩트를 유발할 수 있습니다. 소음의 신호를 모호하게 하기 위해 "isosbestic 지점"으로 알려진 GCaMP의 속성을 악용할 수 있습니다. 간단히 말해서, GCaMP를 사용하면 여기 빛의 파장이 왼쪽으로 이동함에 따라 칼슘 결합 상태에서의 방출이 감소하고 칼슘 언바운드 상태에서의 방출이 소폭 증가합니다. 이 두 방출의 상대강도가 동일한 지점을 isosbestic 점이라고 합니다. 이 시점에서 GCaMP가 흥분되면 방출은 내부 칼슘 농도의 변화에 의해 영향을받지 않으며 신호의 차이는 광섬유 패치 코드의 과감 또는 신경 조직의 움직임으로 인한 신호감 쇠약으로 인해 가장 빈번합니다. 이식된 섬유에 상대적입니다.
단일 단위 전기 생리학은 단일 셀 및 단일 스파이크 레벨 해상도로 인해 생체 내에서 자유롭게 움직이는 기록의 금 본위제입니다. 그러나, 기록되는 세포의 분자 동일을 찾아내기 어려울 수 있고, 사후 분석은 아주 힘들 수 있습니다. 섬유 광도측정은 단세포 분해능이 없지만, 연구자들은 전통적인 기술로는 해결할 수 없는 질문을 할 수 있습니다. 바이러스 성 전략을 형질전환 동물과 결합하여 GECIs의 발현은 축축한에서 직접 칼슘 신호를 모니터링하여 수행 할 수있는 인구 또는 투영 정의 신경 활동을 기록하기 위해 유전적으로 정의 된 신경 유형으로 지시 될 수 있습니다. 터미널10,11. 더욱이, 다중 광섬유 캐뉼라를 이식함으로써, 동일한 동물12,13에서여러 뇌 영역 및 경로로부터의 신경 활동을 동시에 모니터링할 수 있다.
이 원고에서는 단일 및 다중 섬유 광도 측정기, 칼슘 독립적 인 아티팩트를 수정하는 방법 및 모노 및 이중 색상 기록을 수행하는 방법을 자세히 설명합니다. 또한 질문할 수 있는 질문 유형과 증가하는 복잡성 수준에 대한 예제도 제공합니다(그림 1참조). 이 프로토콜에 자세히 설명된 다중 섬유 기록을 위한 광섬유 광도계 설정은 https://sites.google.com/view/multifp/hardware 있는 재료 목록을 사용하여 구축할 수있습니다(그림 2).
GCaMP6 또는 그 변이체에서 칼슘 독립적 및 칼슘 의존형 형광 방출을 위해 410 nm 및 470 nm 여기 파장 모두에 시스템을 장착하는 것이 필수적입니다. 사용자 정의 구축 설정또는 시스템을 실행할 수있는 소프트웨어가없는 경우, 무료 오픈 소스 프로그램 Bonsai (http://www.open-ephys.org/bonsai/)를 사용할 수 있습니다. 대안적으로, 광섬유 광도측정은 MATLAB(예를 들어, https://github.com/deisseroth-lab/multifiber)12 또는 다른 프로그래밍 언어14를통해 실행될 수 있다. 시스템의 소프트웨어 및 하드웨어는 410 nm 및 470 nm LED와 카메라, 이미지 추출(그림 2)및 관심 영역 (ROI)의 평균 형광 강도를 모두 조작 할 수 있어야합니다. 이미지를 볼 수 있습니다. 출력은 패치 코드의 각 섬유에서 470 nm 및 410 nm LED로 기록된 평균 강도 값의 테이블이어야 합니다. 다중 섬유 실험을 수행할 때, 400 μm 번들 섬유는 마우스의 움직임을 제한할 수 있다. 이러한 경우 유연성을 제공하는 200 μm 패치 코드를 사용하는 것이 좋습니다. 또한 마우스의 훈련 중에 더 작은 더미 케이블을 사용할 수도 있습니다.
광섬유 광도 측정을 획득하는 동안 관심 있는 이벤트에 대한 시간 포인트를 추출하는 것이 중요합니다. 시스템이 특정 이벤트에 대해 TTL을 통합하는 기본 제공 시스템을 쉽게 제공하지 않는 경우, 다른 전략은 실험 중에 특정 시간 및 이벤트에 맞게 기록된 개별 타임포인트에 타임스탬프를 할당하는 것입니다. 타임 스탬프는 컴퓨터 시계를 사용하여 수행 할 수 있습니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
모든 실험은 캘리포니아 대학, 샌디에고, 실험실 동물의 관리 및 사용에 대한 캐나다 가이드의 기관 동물 관리 및 사용위원회에 따라 수행되었으며 라발 대학 동물 보호대학의 승인을 받았습니다. 위원회.
1. CMOS (보완 금속 산화물 반도체) 카메라와 개별 또는 분기 패치 코드 사이의 광학 경로 정렬
- 5축 변환기의 모든 나사를 느슨하게 합니다(11, 그림 2B).
- 5축 변환기에 부착된 어댑터[SMA(서브 미니어처 A) 또는 FC(광섬유 커넥터)]에 패치 코드(12, 도 2B)의나사.
- 저전력(100 μW)에서 470 nm 여기 등(1, 그림 2B)을켜고 패치코드 끝을 오토형광 플라스틱 슬라이드를 가리킵니다. 이것은 향후 레코딩에 아무런 영향을 미치지 않지만 정렬 프로세스를 시각화하기 위한 것입니다.
- 라이브 모드에서 CMOS 카메라(13, 그림 2B)에서녹화합니다. 이미지가 완전히 검은색이 아닐 때까지 게인을 늘리거나 조회 테이블(LUT)을 조정합니다. 포인트는 목표의 초점에서 이미지를 볼 수 있게 하는 것이다(도 10, 도 2B).
- 5축 변환기를 목표쪽으로 전진시켜 470nm 라이트가 패치 코드의 SMA 또는 FC 끝의 섬유를 중심으로 카메라에서 이미지가 해결될 때까지 합니다.
- 이미지가 중앙에 있고 잘 해결될 때까지 X 축과 Y 축을 조정합니다.
- 패치 코드의 페룰 끝에서 방출되는 빛을 시각화합니다. 등방성 원으로 표시되어야 합니다. 분기 패치 코드를 사용하는 경우 각 패치 코드의 ferrule 끝에서 방출되는 빛의 양은 비슷해야 합니다. 원이 등방성있지 않거나 방출된 라이트가 같지 않은 경우 X-Y축에서 5축 변환기를 조정합니다.
2. 평균 형광 강도 측정을 위한 섬유 주변 ROI 설정
- 모든 여기 조명을 켜면 섬유를 더 잘 시각화할 수 있습니다. 화소가 포화되지 않고 섬유의 선명한 이미지가 나타나지 않고 카메라 게인을 조정합니다.
- 라이브 녹화 또는 예비 이미지를 찍습니다.
- 파이버 주위에 ROI를 그리고 기록 하는 동안 평균 강도 값의 측정을 위해 그들을 유지(그림 2A).
- 여러 파이버 레코딩의 경우 신호의 독립성 테스트를 거라 합니다.
- 모든 섬유에서 라이브 기록.
- 광원쪽으로 섬유 1개를 가리키고 손가락으로 탭합니다. 매우 큰 변동은 해당 채널에서만 발생해야 합니다(허용 가능한 누설 1:1000).
- 신호가 독립적이지 않은 경우 보다 보수적인 ROI를 다시 그리고 독립 테스트를 반복합니다.
- 어떤 ROI가 섬유, 컬러 테이프 또는 매니큐어를 섬유의 끝에 적용할 수 있는지에 대한 레이블을 지정하고 추적합니다. 실험을 시작하기 전에 사진을 보조 알림으로 촬영합니다.
3. 녹음 장 설치
- 스탠드, 클램프 또는 홀더를 사용하여 경기장 위에 패치 코드를 걸어 놓습니다.
- 동물이 섬유의 길이에 의해 억제되지 않고, 전체 경기장을 통해 자유롭게 이동할 수 있는지 확인하십시오.
- 작동 식 상자 또는 열린 필드를 사용 하든, 패치 코드가 최소한의 굽힘으로 동물에 도달 할 수 있는지 확인하십시오. 코 찌르기가 필요한 경우 섬유가 구부러지는 것을 방지하기에 충분한 공간 오버헤드가 있는지 확인하십시오. 패치 코드가 과도하게 구부러지거나 비틀지 않도록 하십시오.
4. 생체 내 녹음
참고 : 섬유 광측량 실험에 대한 광섬유 캐뉼라 이식의 절차는 스파르타 외15에설명 된 바와 같이 광유전학에 대한 절차와 동일합니다. 두개골 뼈에 헤드 캡의 견고한 고정을 제공하는 치과 시멘트 (재료 표참조)를 사용하는 것이 좋습니다. 치과 용 시멘트는 고정 나사를 사용할 수없는 경우에 특히 유용합니다.
- 눈으로 및 미니 화이버 현미경으로 패치 코드의 섬유의 말단을 육안으로 검사합니다. 섬유의 표면이 긁힌 경우, 섬유 연마/랩핑 필름을 미세한 모래(1 μm 및 0.3 μm)로 사용하여 섬유를 다시 연마합니다.
- 70% 에탄올과 면 팁 어플리케이터로 패치 코드의 말단을 청소합니다.
- 70% 에탄올과 면 팁 어플리케이터를 사용하여 광섬유 캐뉼라를 청소합니다.
- 검은 수축 튜브로 덮인 세라믹 분할 슬리브를 사용하여 패치 코드의 ferrule 끝을 이식된 섬유에 연결합니다. 연결 하는 동안, 그렇지 않으면 새 소매를 사용 하 여 소매꽉 있는지 확인 합니다.
참고: 패치 코드 페룰과 임플란트 사이에 공간이 있으면 많은 양의 신호 손실이 발생하며 기록이 작동하지 않습니다. - 동물에게 행동 테스트가 시작되기 전에 몇 분 동안 회복되도록 하십시오.
- 광 신호 기록을 시작하고 실험을 실행합니다.
- 녹음하는 동안 라이브 트레이스를 주의 깊게 주시하여 고품질 레코딩을 보장합니다. 신호는 기록의 처음 2 분에서 시간의 함수로 급격히 감소 할 것으로 예상된다. 이 효과는 열 매개 LED 붕괴에 의해 발생, 열의 증가는 광학 요소의 저항을 증가시킨다.
- GCaMP의 온/오프 역학을 초과하는 신호의 점프가 발생하는 경우, 이것은 종종 슬리브가 충분히 꽉 조이지 않고 패치 코드와 임플란트 사이의 공간이 변경되고 있음을 나타냅니다. 이 경우 실험을 중지하고 새 슬리브를 사용하여 동물을 다시 연결합니다.
5. 섬유 광도 측정 데이터 분석
참고: 대부분의 레코딩에서 잘 작동하는 데이터 분석을 위한 방법입니다. 그러나 대체 방법을 구현할 수 있습니다. 데이터 분석을 위한 예제 코드는 여기에서 찾을 수 있습니다: https://github.com/katemartian/Photometry_data_processing.
- 추출물은 각각의 섬유에 대응하는 470nm(Int470) 및 410 nm(Int 410) LED로부터 기록된 형광 강도 값을 의미한다.
- 움직이는 평균 알고리즘을 사용하여 각 신호를 부드럽게합니다(그림 3A).
- 각 신호의 기준선 보정을수행(그림 3A 및 3B)경사 및 저주파를 제거하기 위해 적응반복적으로 재조정된 최소 제곱(airPLS) 알고리즘(https://github.com/zmzhang/airPLS)을 사용하여 신호의 변동.
- 평균 값 및 표준 편차를 사용하여 각 신호를 표준화합니다(그림3C):
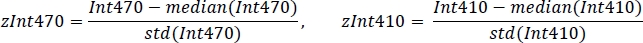
- 비음수 강력한 선형 회귀를 사용하여 표준화된 zInt410에서 zInt470 신호(그림3D)를회귀 함수에 맞춥니다.
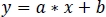
- 선형 회귀의 매개 변수를 사용하여(a, b) zInt470에 장착 된 zInt410의 새 값을 찾으십시오(fitInt410, 그림 3D,E):
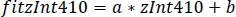
- 선형 회귀의 매개 변수를 사용하여(a, b) zInt470에 장착 된 zInt410의 새 값을 찾으십시오(fitInt410, 그림 3D,E):
- 정규화된 dF/F(z dF/F)(그림 3F)계산:
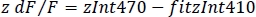
6. 동시 듀얼 컬러 레코딩
- 광도측정 시스템에 560 nm LED를 추가하여 적색 형광 칼슘 센서 및 적절한 이색 거울 및 필터를 자극한다(자세한 설명은 김 등, 2016참조)12.
- 목표와 CMOS 카메라 사이에 이미지 스플리터를 추가하여 녹색 및 적색 방출 파장을 분리합니다(그림 5참조). 이미지 스플리터는 적색 및 녹색 신호에 해당하는 카메라 센서에 두 개의 미러 이미지를 형성합니다(예: 3개의 가지가 있는 패치 코드는 6개의 섬유로 이미지를 생성합니다).
- 위에서 설명한 대로 두 색상의 모든 섬유 주위에 ROI를 그립니다. 해당 섬유 및 채널(녹색 및 빨간색)(그림4A)을사용하여 각 ROI를 명확하게 식별해야 합니다.
- 470 nm 및 560 nm LED로 동시 여기를 트리거하고 410 nm LED(그림 5A)로번갈아 가며.
7. 듀얼 컬러 데이터 분석
- 섹션 5의 단계를 따라 Int470 신호에 대한 fitInt410을 찾고 z dF/F를계산합니다.
- 적색 이동 GEC에 대한 isosbestic 지점은 일반적으로 알 수 없기 때문에, 녹색 채널에 410 nm LED로 기록 된 신호는 두 채널에 걸쳐 이동 보정에 사용할 수 있습니다. 섹션 5의 단계를 따라 Int560 신호에 대한 fitInt410을 찾고 z dF/F를계산합니다.
Access restricted. Please log in or start a trial to view this content.
결과
행동 반응의 신경 상관 관계는 다양한 요인에 따라 달라질 수 있습니다. 이 예에서는, 우리는 외측 하베눌라(LHb)에서 종결되는 측면 시상하부 영역(LHA)으로부터 축삭 말단의 활성을 측정하기 위해 생체 내 섬유 광측측정을 사용했다. 야생형 마우스는 LHA에서 GCaMP6s(AAV-hSyn-GCaMP6s)를 인코딩하는 아데노 관련 바이러스(AAV)를 주입하고 광섬유를 LHb 바로 위에 팁으로 이식하였다(도4
Access restricted. Please log in or start a trial to view this content.
토론
섬유 광도계는 연구원이 자유롭게 움직이는 동물에 있는 정의된 신경 인구에서 벌크 칼슘 역학을 기록할 수 있는 접근접근접근입니다. 이 방법은 강제 수영 테스트2,공포 조절18,사회적 상호 작용1,4및 기타7과같은 "운동 무거운"작업을 포함하여 다양한 행동 테스트와 결합 될 수있습니다.
Access restricted. Please log in or start a trial to view this content.
공개
세이지 아론슨은 멀티 파이버 광도 계량 시스템을 판매하는 Neurophotometrics Ltd.의 CEO 겸 설립자입니다.
감사의 말
이 작품은 캐나다의 자연 과학 및 공학 연구위원회 (NSERC : RGPIN-2017-06131)에서 C.P. C. C. P.에 대한 보조금에 의해 지원되었다 FRSQ 체르쉐르 부르시에입니다. 우리는 또한 이 연구 결과에 사용된 바이러스 성 벡터의 생산을 위한 Plateforme d'Outils Moléculaires (https://www.neurophotonics.ca/fr/pom)에게 감사합니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 1/4"-20 Stainless Steel Cap Screw, 1" Long | Thorlabs | SH25S100 | |
| 1/4"-20 Stainless Steel Cap Screw, 1/2" Long | Thorlabs | SH25S050 | |
| 1/4"-20 Stainless Steel Cap Screw, 3/8" Long | Thorlabs | SH25S038 | |
| 1000 µm, 0.50 NA, SMA-SMA Fiber Patch Cable | Thorlabs | M59L01 | |
| 12.7 mm Optical Post | Thorlabs | TR30/M | |
| 12.7 mm Pedestal Post Holder | Thorlabs | PH20EM | |
| 15 V, 2.4 A Power Supply Unit with 3.5 mm Jack Connector for T-Cube | Thorlabs | KPS101 | |
| 20x objective | Thorlabs | RMS20X | #10 in Figure 2, #11 in Figure 5 |
| 30 mm Cage Cube with Dichroic Filter Mount | Thorlabs | CM1-DCH/M | #8-9 in Figure 2, #8-10 in Figure 5 |
| 405 nm LED | Doric Lenses | CLED_405 | #2 in Figure 2 |
| 410 nm bandpass filter | Thorlabs | FB410-10 | #5 in Figure 2; #7 in Figure 5 |
| 465 nm. LED | Doric Lenses | CLED_465 | #1 in Figure 2 |
| 470 nm bandpass filter | Thorlabs | FB470-10 | #4 in Figure 2; #6 in Figure 5 |
| 560 nm bandpass filter | Semrock | FF01-560/14-25 | #5 in Figure 5 |
| 560 nm LED | Doric Lenses | CLED_560 | #1 in Figure 3 |
| 5-axis kinematic Mount | Thorlabs | K5X1 | #11 in Figure 2, #12 in Figure 5 |
| Achromatic Doublet | Thorlabs | AC254-035-A-ML | #7 in Figure 2 |
| Adaptor for 405 collimator | Thorlabs | AD11F | #3 in Figure 2; #4 in Figure 5 |
| Adaptor for ajustable collimator | Thorlabs | AD127-F | #3 in Figure 2; #4 in Figure 5 |
| Aluminum Breadboard | Thorlabs | MB1824 | |
| Clamping Fork | Thorlabs | CF125 | |
| Cube connector | Thorlabs | CM1-CC | |
| Dual 493/574 dichroic | Semrock | FF493/574-Di01-25x36 | #10 in Figure 5 |
| Emission filter for GCaMP6 | Semrock | FF01-535/22-25 | #6 in Figure 2 |
| Enclosure with Black Hardboard Panels | Thorlabs | XE25C9 | |
| Externally SM1-Threaded End Cap for Machining | Thorlabs | SM1CP2M | |
| Fast-change SM1 Lens Tube Filter Holder | Thorlabs | SM1QP | #4-6 in Figure 2, #5-7 in Figure 5 |
| Fixed Collimator for 405 nm light | Thorlabs | F671SMA-405 | #3 in Figure 2; #4 in Figure 5 |
| Fixed collimator for 470 and 560 nm light | Thorlabs | F240SMA-532 | #3 in Figure 2; #4 in Figure 5 |
| Green emission filter | Semrock | FF01-520/35-25 | In light beam splitter |
| High-Resolution USB 3.0 CMOS Camera | Thorlabs | DCC3260M | #13 in Figure 2, #15 in Figure 5 |
| Light beam splitter | Neurophotometrics | SPLIT | #14 in Figure 5 |
| Longpass Dichroic Mirror, 425 nm Cutoff | Thorlabs | DMLP425R | #8 in Figure 2, #9 in Figure 5 |
| Longpass Dichroic Mirror, 495 nm Cutoff | Semrock | FF495-Di03 | #9 in Figure 2, #8 in Figure 5 |
| Metabond dental cement | C&B | ||
| M8 - M8 cable | Doric Lenses | Cable_M8-M8 | |
| Optic fiber cannulas | Doric Lenses | Need to specify that these will be used to photometry experiments requiring low autofluorescence | |
| Optic fiber Patchcords | Doric Lenses | Need to specify that these will be used to photometry experiments requiring low autofluorescence | |
| Red emission filter | Semrock | FF01-600/37-25 | In light beam splitter |
| T7 LabJack | LabJack | ||
| T-cube LED Driver | Thorlabs | LEDD1B | |
| USB 3.0 I/O Cable, Hirose 25, for DCC3240 | Thorlabs | CAB-DCU-T3 |
참고문헌
- Gunaydin, L. A., et al. Natural Neural Projection Dynamics Underlying Social Behavior. Cell. 157 (7), 1535-1551 (2014).
- Proulx, C. D., et al. A neural pathway controlling motivation to exert effort. Proceedings of the National Academy of Sciences of the United States of America. 115 (22), 5792-5797 (2018).
- Muir, J., et al. In Vivo Fiber Photometry Reveals Signature of Future Stress Susceptibility in Nucleus Accumbens. Neuropsychopharmacology. 43 (2), 255-263 (2017).
- Wang, D., et al. Learning shapes the aversion and reward responses of lateral habenula neurons. eLife. 6, (2017).
- de Jong, J. W., et al. A Neural Circuit Mechanism for Encoding Aversive Stimuli in the Mesolimbic Dopamine System. Neuron. 101 (1), 133-151 (2018).
- Lerner, T. N., et al. Intact-Brain Analyses Reveal Distinct Information Carried by SNc Dopamine Subcircuits. Cell. 162 (3), 635-647 (2015).
- Calipari, E. S., et al. In vivo imaging identifies temporal signature of D1 and D2 medium spiny neurons in cocaine reward. Proceedings of the National Academy of Sciences of the United States of America. 113 (10), 2726-2731 (2016).
- González, A. J., et al. Inhibitory Interplay between Orexin Neurons and Eating. Current Biology. 26 (18), 2486-2491 (2016).
- Chen, T. -W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Barker, D. J., et al. Lateral Preoptic Control of the Lateral Habenula through Convergent Glutamate and GABA Transmission. Cell Reports. 21 (7), 1757-1769 (2017).
- Siciliano, C. A., Tye, K. M. Leveraging calcium imaging to illuminate circuit dysfunction in addiction. Alcohol. 74, 47-63 (2018).
- Kim, C. K., et al. Simultaneous fast measurement of circuit dynamics at multiple sites across the mammalian brain. Nature Methods. 13 (4), 325-328 (2016).
- Sych, Y., Chernysheva, M., Sumanovski, L. T., Helmchen, F. High-density multi-fiber photometry for studying large-scale brain circuit dynamics. Nature Methods. 16 (6), 553-560 (2019).
- Akam, T., Walton, M. E. pyPhotometry: Open source Python based hardware and software for fiber photometry data acquisition. Scientific Reports. 9 (1), 3521(2019).
- Sparta, D. R., et al. Construction of implantable optical fibers for long-term optogenetic manipulation of neural circuits. Nature Protocol. 7 (1), 12-23 (2011).
- Stamatakis, A. M., et al. Lateral Hypothalamic Area Glutamatergic Neurons and Their Projections to the Lateral Habenula Regulate Feeding and Reward. The Journal of Neuroscience. 36 (2), 302-311 (2016).
- Tervo, G. D., et al. A Designer AAV Variant Permits Efficient Retrograde Access to Projection Neurons. Neuron. 92 (2), 372-382 (2016).
- Yu, K., da Silva, P., Albeanu, D. F., Li, B. Central Amygdala Somatostatin Neurons Gate Passive and Active Defensive Behaviors. The Journal of Neuroscience. 36 (24), 6488-6496 (2016).
- Falkner, A. L., Grosenick, L., Davidson, T. J., Deisseroth, K., Lin, D. Hypothalamic control of male aggression-seeking behavior. Nature Neuroscience. 19 (4), 596-604 (2016).
- Ren, J., et al. Anatomically Defined and Functionally Distinct Dorsal Raphe Serotonin Sub-systems. Cell. 175 (2), 472-487 (2018).
- Barnett, L. M., Hughes, T. E., Drobizhev, M. Deciphering the molecular mechanism responsible for GCaMP6m’s Ca2+-dependent change in fluorescence. PLOS ONE. 12 (2), 0170934(2017).
- Sun, F., et al. A Genetically Encoded Fluorescent Sensor Enables Rapid and Specific Detection of Dopamine in Flies, Fish, and Mice. Cell. 174 (2), 481-496 (2018).
- Patriarchi, T., et al. Ultrafast neuronal imaging of dopamine dynamics with designed genetically encoded sensors. Science. 360 (6396), (2018).
- Feng, J., et al. A Genetically Encoded Fluorescent Sensor for Rapid and Specific In Detection of Norepinephrine. Neuron. 102 (4), 745-761 (2019).
- Akerboom, J., et al. Genetically encoded calcium indicators for multi-color neural activity imaging and combination with optogenetics. Frontiers in Molecular Neuroscience. 6, 1-29 (2013).
- Dana, H., et al. Sensitive red protein calcium indicators for imaging neural activity. eLife. 5, (2016).
- Wang, H., Jing, M., Li, Y. Lighting up the brain: genetically encoded fluorescent sensors for imaging neurotransmitters and neuromodulators. Current Opinion in Neurobiology. 50, 171-178 (2018).
- Lu, L., et al. Wireless optoelectronic photometers for monitoring neuronal dynamics in the deep brain. Proceedings of the National Academy of Sciences. 115 (7), 1374-1383 (2018).
- Jennings, J. H., et al. Visualizing Hypothalamic Network Dynamics for Appetitive and Consummatory Behaviors. Cell. 160 (3), 516-527 (2014).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유