A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ייצור רשתות ננו-צינוריות ליפידים מרובות רכיבים באמצעות בדיקת תנועתיות Kinesin Gliding
In This Article
Summary
פרוטוקול זה מתאר תהליך לייצור רשתות ננו-צינוריות ליפידים באמצעות תנועתיות קינזין גולשת בשילוב עם שלפוחיות ליפידים חד-שכבתיות ענקיות.
Abstract
רשתות ננו-צינוריות ליפידים (LNT) מייצגות מערכת מודלים חוץ גופית לחקר הובלה מולקולרית וביופיסיקה של שומנים עם רלוונטיות לצינוריות השומנים הנמצאות בכל מקום בתאים אאוקריוטים. עם זאת, LNTs in vivo הם מבנים מאוד לא שיווי משקל הדורשים אנרגיה כימית ומנועים מולקולריים כדי להרכיב, לתחזק ולארגן מחדש. יתר על כן, ההרכב של LNTs in vivo הוא מורכב, ומורכב ממספר מיני שומנים שונים. שיטות אופייניות להבלטת LNTs הן עתירות זמן ועבודה, והן דורשות פינצטה אופטית, מיקרובים ומיקרופיפטים כדי למשוך בכוח ננו-צינוריות מבועיות ליפידים ענקיות. מוצג כאן פרוטוקול לבדיקת תנועתיות הגלישה (GMA), שבה רשתות LNT בקנה מידה גדול נוצרות במהירות מבועיות ענק חד-שכבתיות (GUVs) באמצעות תנועתיות מיקרוטובולים המופעלות על ידי קינזין. באמצעות שיטה זו, רשתות LNT נוצרות ממגוון רחב של פורמולציות שומנים המחקות את המורכבות של LNTs ביולוגיים, מה שהופך אותן לשימושיות יותר ויותר למחקרים חוץ גופיים של ביופיסיקה של שומנים ותחבורה הקשורה לממברנה. בנוסף, שיטה זו מסוגלת לייצר באופן אמין רשתות LNT בזמן קצר (<30 דקות) באמצעות ציוד מעבדה נפוץ. מאפייני רשת LNT כגון אורך, רוחב ומחיצות שומנים ניתנים גם לכוונון על ידי שינוי הרכב השומנים של ה- GUVs המשמשים לייצור הרשתות.
Introduction
ייצור רשתות ננו-צינוריות שומנים (LNT) מעורר עניין גובר בבדיקה חוץ גופית של מבנים שומניים ללא שיווי משקל 1,2,3. תאים משתמשים בצינוריות ליפידים להובלה מפוזרת של חלבונים4 וחומצות גרעין5, כמו גם תקשורת בין תאים לתא 6,7. הרשתית האנדופלסמית ומנגנון גולג'י מעניינים במיוחד, שכן אברונים אלה הקשורים לממברנה הם המיקומים העיקריים לסינתזת שומנים וחלבונים, כמו גם להובלה של ביומולקולות אינטגרליות אלה בתוך הציטופלסמה של תא 8,9. הממברנות של אברונים אלה מורכבות ממיני שומנים מרובים כולל ספינגולפידים, כולסטרול ופוספוליפידים10 שבסופו של דבר עוזרים להגדיר את הפונקציונליות שלהם. לפיכך, כדי לשכפל ולחקור בצורה הדוקה יותר את האברונים הללו, יש לייצר LNTs במבחנה משלפוחית עם נוסחאות שומנים מורכבות יותר ויותר11.
בועיות חד-שכבתיות ענקיות (GUVs) משמשות באופן נרחב לחקר התנהגות קרום השומנים מכיוון שניתן לסנתז אותן באופן אמין עם פורמולציות מורכבות הכוללות כולסטרול, פוספטידילכולין (PC), פוספטידיל-ילתנולמין (PE), פוספטידיל-סרין (PS) ופוספטידילינוזיטול (PI)12,13. מתוארת כאן שיטה לייצור LNTs מ- GUVs עם נוסחאות ליפידים משתנות באמצעות בדיקת תנועתיות גלישה (GMA), שבה LNTs מובלטים על סמך העבודה המבוצעת על ידי מנועי קינזין וחוטים מיקרוטובולים הפועלים על גבי GUVs. במערכת זו, חלבונים מוטוריים של קינסין נספגים אל פני השטח מניעים מיקרוטובולים שעברו ביוטינילציה, וממירים אנרגיה כימית מהידרוליזה של ATP לעבודה שימושית (במיוחד, שחול של LNTs משלפוחיות ביוטינילציה)11. רשת LNT המתקבלת מספקת פלטפורמת מודל לחקר ההשפעות של ההבדלים בשלבי השומנים על שינויים במורפולוגיה של LNT.
בקצרה, חלבונים מוטוריים של קינזין מוכנסים לתא זרימה בתמיסה המכילה קזאין, המאפשרת את ספיגת המנועים על פני הזכוכית של התא. לאחר מכן, מיקרוטובולים שעברו ביוטינילציה בתמיסה המכילה ATP זורמים דרך התא ומותר להם להיקשר למנועי הקינזין ולהתחיל בתנועתיות. לאחר מכן מכניסים תמיסת סטרפטווידין לתוך התא ומאפשרים לה להיקשר באופן לא קוולנטי למיקרוטובולים. לבסוף, GUVs המכילים שומנים ביולוגיים מוכנסים לחדר ונקשרים למיקרוטובולים המצופה סטרפטווידין, ולאחר מכן מוציאים LNTs ליצירת רשתות בקנה מידה גדול במהלך 15-30 דקות. שיטה זו מייצרת רשתות LNT גדולות ומסועפות באמצעות ציוד מעבדה וריאגנטים סטנדרטיים בעלות נמוכה11.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. הכנת פתרונות מיקרוטובול מלאי
אזהרה: תמיד יש לענוד משקפי בטיחות, כפפות ומעיל מעבדה לאורך כל הפרוטוקול.
- הכן 5x BRB80 buffer: הוסף 24.19 גרם של PIPES (piperazine-N,N′-bis[2-חומצה אתאנסולפונית]) ו-0.38 גרם של EGTA (אתילן גליקול-ביס[אתר β-אמינואתיל]-N,N,N,N′,N′,N′-חומצה טטראצטית) לבקבוק זכוכית בנפח 1 ליטר. הוסף 1 מ"ל של 1 M MgCl2 והתאם את ה- pH ל- 6.9 עם KOH. הוסיפו מים שעברו דה-יוניזציה כדי להביא את התמיסה לנפח סופי של 500 מ"ל.
- הכן 100 mM מלאי של פתרון GTP: לשקול 52 מ"ג של GTP ולהשעות 1 מ"ל של מים מזוקקים. חלקו תמיסת 100 mM ל-20 μL aliquots ואחסנו בטמפרטורה של -20 מעלות צלזיוס.
- הכן פתרון GPEM: לערבב 200 μL של 5x BRB80, 10 μL של 100 mM GTP פתרון, 100 μL של 100% גליצרול, ו 600 μL של מים deionized. חלקו את תמיסת ה-GPEM ב-100 μL ב-100 מעלות צלזיוס ואחסנו בטמפרטורה של -20 מעלות צלזיוס.
- הכן תמיסת מיקרוטובול על ידי שחזור בקבוקונים של טובולין ליופילי זמין מסחרית (בקבוקון אחד כל אחד של ביוטינילציה, מסומן פלואורסצנטית וללא תווית) בתמיסת GPEM קרה (4 °C) לריכוז מלאי של 5 מ"ג / מ"ל.
- בצע פילמור של מיקרוטובולים על ידי ערבוב של 4 μL של טובולין ביוטינילי, 4 μL של טובולין המסומן בפלואורסצנטיות, ו-24 μL של טובולין ללא תווית (כולם בריכוזים של 5 מ"ג/מ"ל) כדי ליצור יחס של 1:1:6 בנפח סופי של 32 מ"ל. שמור אותו על קרח. מחלקים את תערובת טובולין ל-2 μL aliquots ומאחסנים בטמפרטורה של -80 מעלות צלזיוס עד הצורך.
הערה: פילמור יעיל דורש שריכוז הטובולין יהיה שווה לריכוז הקריטי (5 מ"ג/מ"ל)14 או מעליו. כאן, הבחירה של יחס טובולין מותאמת לריכוז מספיק של טובולין ביוטינילציה כדי לקשור ביעילות סטרפטווידין ו- GUVs, כמו גם ריכוז מספיק של טובולין פלואורסצנטי לאפיון מיקרוסקופי.
2. הכנת שלפוחיות חד-שכבתיות ענקיות (GUVs)
- הכנת סרט אגרוז
הערה: פרוטוקול זה מותאם מ- Greene et al.15.- הכינו תמיסה של 1% w/v על ידי ערבוב של 1 גרם אגרוז ב-100 מ"ל של מים שעברו דה-יוניזציה בבקבוקון Erlenmeyer של 250 מ"ל. השתמשו במיקרוגל סטנדרטי כדי לחמם את תמיסת האגרוס למשך 1-2 דקות.
הערה: הפתרון יהפוך שקוף ברגע שהאגרוז יתמוסס לחלוטין. אפשרו לתמיסה להתקרר ל-65-75 מעלות צלזיוס לפני השימוש. - השתמש בקצה פיפטה חתוך של 1,000 μL כדי לתמיסת פיפטה 300-400 μL של אגרוז על מכסה זכוכית בגודל 25 מ"מ x 25 מ"מ. תוך כדי החזקת קצה הכיסוי באצבעות עם כפפות, השתמש בקצה פיפטה נוסף של 1,000 μL כדי לפזר את האגרוס המומס באופן שווה על פני הכיסוי.
הערה: שמירה על האגרוז בטמפרטורה של 65-75 מעלות צלזיוס תאפשר התפשטות יעילה על משטח הכיסוי. - מייבשים את הכיסויים המצופים באגרוז באינקובטור של 37 מעלות צלזיוס למשך 2 שעות לפחות, ואז האגרוז יהפוך לשקוף. אחסנו את הכיסויים על ידי הצבת המשטח המצופה באגרוז הפונה כלפי מעלה על משטח נקי כגון נייר ללא מוך או סרט מבוסס שעווה בטמפרטורת החדר (RT).
- הכינו תמיסה של 1% w/v על ידי ערבוב של 1 גרם אגרוז ב-100 מ"ל של מים שעברו דה-יוניזציה בבקבוקון Erlenmeyer של 250 מ"ל. השתמשו במיקרוגל סטנדרטי כדי לחמם את תמיסת האגרוס למשך 1-2 דקות.
- נוסחת ליפידים
- שלפו ליפידים המומסים בכלורופורם ממקפיא של -20 מעלות צלזיוס והניחו אותם במכסה אדים כימי עד שהם מגיעים ל-RT.
- חשב את נפח מלאי השומנים של כל רכיב שומנים הדרוש לפורמולה באמצעות הנוסחה הבאה:
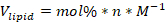
כאשר: שומנים V הוא נפח השומנים לשימוש, mol % הוא האחוז הטוחן של מרכיב השומנים, n הוא המספר הכולל של שומות של שומנים המשמשים בפורמולה, ו- M הוא ריכוז השומנים ביחידות טוחנות.
הערה: לדוגמה, אם משתמשים בפורמולציה המכילה 45 מול% 1,2-דיוליאויל-sn-גליצרו-3-פוספוצולין (DOPC) עם ריכוז תמיסת מלאי של 12.72 mM, ו-1 מיקרומול של סך השומנים בפורמולציה, נפח מלאי DOPC המשמש בפורמולציה יהיה: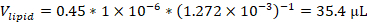
- מערבבים את השומנים יחד ביחס המחושב בבקבוקון זכוכית במכסה האדים הכימי.
- פיפטה 30 μL של תמיסת ליפידים על הכיסויים המצופה באגרוז על צלחת חמה מחוממת מראש הממוקמת מעל נקודת ההיתוך של מרכיב השומנים הרוויים של הפורמולה (למשל, צלחת חמה של 50 מעלות צלזיוס עבור ליפיד עם Tm של 40 מעלות צלזיוס).
- מפזרים את התמיסה על פני סרט האגרוס בתנועה מעגלית באמצעות הקצה הארוך של מחט של 18 גרם עד שהכלורופורם התאדה ונוצרה שכבה אחידה של שומנים. החזיקו את קצה הכיסוי באצבעות עם כפפות תוך כדי ביצוע שלב זה.
הערה: יש להקפיד שלא לפגוע בשכבת האגרוס עם המחט. - מניחים את הכיסוי בשכבת אגרוז וסרט שומנים בצלחת פטרי מכוסה בנייר אלומיניום, צד הסרט פונה כלפי מעלה, ומניחים את צלחת הפטרי במייבש ואקום למשך 2 שעות לפחות כדי להסיר ממס שיורי.
- בינתיים, להכין 560 mM תמיסת סוכרוז על ידי ערבוב 1.92 גרם של סוכרוז עם 10 מ"ל של מים deionized.
הערה: הריכוז של תמיסת הסוכרוז תלוי באוסמולריות של ה- GUVs של החיץ המדוללים פנימה. בדרך כלל, האוסמולריות של תמיסת הסוכרוז צריכה להיות גדולה בלא יותר מ-10% מהמאגר שבו מדולל ה-GUVs, במיוחד מאגר התנועתיות (ראו שלב 3.11). - היווצרות GUV
- הדביקו את תא ההדבקה על הכיסוי המצופה בסרט השומנים על ידי לחיצה עדינה של תא הדבקה על מכסה השומנים המצופה בשומנים כאשר סרט השומנים פונה כלפי מעלה, מה שמבטיח יצירת אטימה הדוקה.
- הוסף 400 μL של תמיסת סוכרוז 560 mM (שהוכן בשלב 2.3) לתא.
- מניחים את הכיסויים בתא הלחות וסוגרים את המכסה.
- מניחים את תא הלחות על פלטה חמה שחוממה מראש מעל נקודת ההיתוך של מרכיב השומנים הרוויים של הפורמולה.
- אפשרו לשלפוחית להיווצר במשך ≥1 שעות לפני ההתאוששות.
הערה: ניתן לבדוק את היווצרות השלפוחית באמצעות מיקרוסקופיה פלואורסצנטית עם עדשת אוויר אובייקטיבית פי 40.
3. הכנת מניות בדיקת תנועתיות וריאגנטים
- הכנת מלאי קזאין
- מוסיפים 3 גרם של קזאין יבש לצינור צנטריפוגה חרוטית של 50 מ"ל, ואז מוסיפים 30 מ"ל של 1x BRB80 ומסובבים עד שהתמיסה הופכת לצמיגות. צנטריפוגה הצינור ב 15,000 x g במשך 30 דקות.
- מעבירים את הסופרנטנט לתוך שפופרת צנטריפוגה חרוטית נוספת של 50 מ"ל ומשליכים את הכדור. סנן את התמיסה באמצעות מסנן מזרק 1 מיקרומטר, ואסף את התמיסה בבקבוקון חרוטי של 50 מ"ל. סנן את התמיסה באמצעות מסנן 0.2 מיקרומטר, ואסף את התמיסה בבקבוקון חרוטי של 50 מ"ל.
- קבע את ריכוז החלבון על ידי מדידת הספיגה ב-280 ננומטר באמצעות ספקטרופוטומטר UV-Vis וקוורץ קובט.
- חשב את ריכוז הקזאין במ"ג/מ"ל באמצעות הנוסחה הבאה:
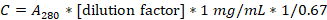
- דיללו את התמיסה ל-20 מ"ג/מ"ל ב-1x BRB80, חלקו ל-100 μL aliquots ואחסנו בטמפרטורה של -20 מעלות צלזיוס.
- הכינו תמיסת מלאי של גלוקוז אוקסידאז (2 מ"ג/מ"ל) על ידי ערבוב של 2 מ"ג של גלוקוז אוקסידאז עם 1 מ"ל של 1x BRB80. חלקו ל-100 μL aliquots ואחסנו בטמפרטורה של -20 מעלות צלזיוס.
- מכינים תמיסת ציר קטלאז (0.8 מ"ג/מ"ל) על ידי ערבוב של 0.8 מ"ג קטלאז עם 1 מ"ל של 1x BRB80. חלקו ל-100 μL aliquots ואחסנו בטמפרטורה של -20 מעלות צלזיוס.
- הכן 2 M תמיסת גלוקוז על ידי השעיה של 0.3 גרם של D-גלוקוז ב 1 מ"ל של מים שעברו דה-יוניזציה. חלקו ל-100 μL aliquots ואחסנו בטמפרטורה של -20 מעלות צלזיוס.
- הכן 100 mM DTT מלאי על ידי השעיית 0.015 גרם של DTT ב 1 מ"ל של מים deionized. חלקו ל-100 μL aliquots ואחסנו בטמפרטורה של -20 מעלות צלזיוס.
- הכן מלאי של 100 mM Mg-ATP על ידי השעיית 0.055 גרם של דיסודיום ATP בתמיסת 1 מ"ל של 100 mM MgCl2. חלקו ל-100 μL aliquots ואחסנו בטמפרטורה של -20 מעלות צלזיוס.
- הכן פתרון 100 mM Mg-AMP-PNP על ידי השעיה של 0.055 גרם של AMP-PNP בתמיסת 1 מ"ל של 100 mM MgCl2, ולאחר מכן חלק ל- 100 μL aliquots ואחסן ב - 20 ° C.
- הכן תמיסת 100 mM Trolox על ידי הוספת 25.03 מ"ג של Trolox ל-1 מ"ל של מתנול ואחסן בטמפרטורה של -20 °C (76 °F).
- הכינו תמיסת סטרפטווידין של 10 מ"ג/מ"ל על ידי הוספת 1 מ"ג סטרפטווידין ל-100 מיקרול'ל של BRB80, ואז חלקו ל-2 אליקוטים של μL ואחסנו בטמפרטורה של -80ۛ מעלות צלזיוס.
- הכן BRB90CAT על ידי ערבוב של 200 μL של 5x BRB80, 20 μL של תמיסת קזאין, 10 μL של תמיסת MgATP, 10 μL של Trolox, 5 μL של תמיסת paclitaxel, ו 765 μL של מים DI. יש לאחסן בטמפרטורה של 4 מעלות צלזיוס.
- הכן את תמיסת התנועתיות על ידי ערבוב של 192 μL של BRB80CAT, 2 μL של תמיסת D-גלוקוז, 2 μL של תמיסת גלוקוז אוקסידאז, 2 μL של תמיסת DTT ו- 2 μL של תמיסת קטלאז. יש לאחסן בטמפרטורה של 4 מעלות צלזיוס.
- הכן תמיסת קינסין של 1 μM על-ידי דילול תמיסת הקינזין ב- BRB80CAT (לדוגמה, 2 μL של תמיסת קינסין של 50 mM ב- 98 μL של BRB80CAT) ושמור ב- 4 °C .
- הכינו תמיסת מיקרוטובול של 10 מיקרוגרם/מ"ל על ידי דילול 10 μL של מיקרוטובולים מיוצבים ב-90 μL של טמפרטורת החדר BRB80CAT. יש לאחסן ב-RT.
- הכינו תמיסת סטרפטווידין של 10 מיקרוגרם/מ"ל על ידי הוספת תמיסת סטרפטווידין של 10 מ"ג/מ"ל ב-99.9 מיקרול' של תמיסת תנועתיות. יש לאחסן בטמפרטורה של 4 מעלות צלזיוס.
- הכן פתרון GUV של 12x על-ידי דילול 5 μL של מלאי GUV לפתרון תנועתיות של 55 μL. יש לאחסן בטמפרטורה של 4 מעלות צלזיוס.
- פילמור של טובולין למיקרוטובולים
- לאסוף 2 μL aliquot מוכן מראש של tubulin מן המקפיא -80 מעלות צלזיוס (מוכן בשלב 1.5) ולהניח לתוך אמבט מים 37 °C (37 °F) במשך 30 דקות.
- הכן תמיסת 2 mM paclitaxel על ידי הוספת 1.71 מ"ג של פקליטקסל ב 1 מ"ל של DMSO נטול מים, לחלק ל 10 μL aliquots, ולאחסן ב -20 °C (76 °F).
- הכן טרי BRB80T על ידי ערבוב 99.5 μL של 1x BRB80 עם 0.5 μL של 2 mM paclitaxel. חם 100 μL של BRB80T עד 37 °C באמבט המים.
- לאחר 30 דקות, מוסיפים את ה-100 μL של BRB80T לטובולין אליקווט כדי לייצב את המיקרוטובולים. יש לאחסן ב-RT.
4. בדיקת תנועתיות גלישה (GMA)
- הכינו תא זרימה על ידי הצמדת שתי רצועות של סרט דו-צדדי המופרדות ב-5 מ"מ על מגלשת זכוכית. חזרו על תהליך זה עד ששלוש שכבות של סרט הדבקה מרכיבות כל רצועה.
- מניחים כיסוי על גבי הקלטת, ואז לוחצים בעדינות על ממשק הכיסוי/סרט הדבקה עם פינצטה או עט כדי להבטיח הידבקות מספקת.
הערה: רוחב הערוץ צריך להיות 5 מ"מ על 25 מ"מ אורך על 300 מ"מ גובה. - פיפטה 30 μL של תמיסת קינסין 1 מ"מ (הוכן בשלב 3.12) לתוך תא הזרימה ולתת לו לדגום במשך 5 דקות.
הערה: הקזאין יוצר דו-שכבתי על פני השטח של מגלשת הכיסוי/זכוכית ומאפשר חיבור של זנב הקינזין לפני השטח. - פיפטה 30 μL של תמיסת מיקרוטובול 10 מיקרוגרם/מ"ל (שהוכנה בשלב 3.13) לתוך תא הזרימה, באמצעות מגבון מעבדה שנלחץ בעדינות כנגד הקצה הנגדי של תעלת הזרימה כדי להקל על חילופי תמיסות. אינקובציה למשך 5 דקות
- שטפו את תא הזרימה 1x-3x עם תמיסת תנועתיות פי 1 ב-RT (שהוכנה בשלב 3.11).
הערה: מיקרוסקופיה פלואורסצנטית באמצעות מטרת אוויר פי 40 עשויה לשמש בנקודה זו כדי לאשר חיבור מיקרוטובולים ותנועתיות. מיקרוטובולים מופיעים כחוטים פלואורסצנטיים (באורך של עשרות מיקרונים) הנעים (גולשים) על פני השטח במהירות של כ-0.5 מיקרומטר לשנייה (איור 1). - פיפטה 30 μL של תמיסת סטרפטווידין של 10 מיקרוגרם/מ"ל (שהוכנה בשלב 3.14) לתוך תא הזרימה באמצעות ניגוב מעבדה שנלחץ בעדינות כנגד הקצה הנגדי של תעלת הזרימה כדי להקל על חילופי התמיסות. דגירה למשך 10 דקות
- זרימה 30 μL של תמיסת GUV 12x (שהוכנה בשלב 3.15) לתוך הזרימה באמצעות מגבון מעבדה שנלחץ בעדינות כנגד הקצה הנגדי של תעלת הזרימה כדי להקל על חילופי התמיסות. דגירה למשך 30 דקות.
- הוסף 2 μL של תמיסת AMP-PNP של 100 mM (שהוכן בשלב 3.7) כדי לעצור את התנועתיות, ולאחר מכן אטום את התא בחומר איטום.
5. אפיון רשת LNT
- העבר את תא הזרימה למיקרוסקופ הפוך להדמיה.
- בחר את ערכת המסנן המתאימה בהתבסס על אורכי הגל של השומנים הפלואורסצנטיים או טובולין שבהם נעשה שימוש. לדוגמה, בעת שימוש בשומנים בעלי תווית אדומה של טקסס, השתמש במסנן עירור של 560 ננומטר/25 ננומטר ובמסנן פליטה של 607 ננומטר/36 ננומטר.
- השתמש במטרה של שמן פי 100 כדי להתמקד בפני השטח של הכיסוי.
- דמיינו את רשתות ה-LNT באמצעות מיקרוסקופיה פלואורסצנטית.
הערה: LNTs הם מבנים ליניאריים היוצאים מהבועיות הגדולות יותר. LNTs קטנים בהרבה מ-GUVs ובעלי אותות פלואורסצנטיים חלשים יותר. לפיכך, יש להתאים את החשיפה והניגודיות בהתאם ל- LNTs של התמונה. התאמות אלה מובילות גם לחשיפת יתר של ה- GUVs, ולכן, מומלץ לאפיין את הלמלריות והפרדת הפאזות ב- GUVs באופן עצמאי. - מקד את המיקרוסקופ ברשת של עניין וצלם תמונה סטנדרטית או מרוצפת.
- התאם את זמן החשיפה ואת מסנני הצפיפות הנייטרליים כדי לצלם את ה-LNTs ולמזער את החשיפה הרוויה של ה-GUVs. רכוש תמונות הן בערוצים אדומים והן בערוצים ירוקים.
הערה: כאן, הערוץ האדום מאפשר הדמיה של השומנים טקסס-אדומים, בעוד שהתעלה הירוקה מאפשרת הדמיה של המיקרוטובולים (למשל, שומנים ירוקים של אורגון וצבעי HiLyte488). - צור תמונה מורכבת על-ידי כיסוי של הערוצים האדומים והירוקים (איור 1).
- אפיון רשתות LNT על ידי מדידת אורך LNT
- פתח את התמונות שנרכשו באמצעות תוכנת ניתוח תמונות כגון ImageJ.
- כייל את קנה המידה של המיקרוסקופ באמצעות תכונת קנה המידה שנקבע, מלא את הפיקסלים למקדם ההמרה של מ"מ ולחץ על אישור.
הערה: מקדם ההמרה תלוי במיקרוסקופ, בעדשה האובייקטיבית ובמצלמה, וניתן להשיג אותו באמצעות שקופית כיול מיקרוסקופית. הוא מתבטא בדרך כלל בפיקסלים/מ"מ. - השתמש בכלי קו Multipoint כדי למדוד את אורך הננו-צינוריות החל מ- GUV האב. החזק Ctrl +M כדי למדוד את האורך.
- המשך למדוד את אורכי הצינורות הבודדים בהתאם לשלבים לעיל. כלי עיבוד התמונה ישמור כל מדידה חדשה בחלון התוצאות.
- החזק Ctrl + D לאחר ציור כל קו כדי לעקוב אחר הצינורות שנמדדו.
- מדידת עובי LNT (איור 2)
- פתח את התמונה ב- ImageJ ובחר את התכונה 'סף' תחת הכרטיסיה תמונה .
- לחץ על החל כדי להחיל את הסף.
- ציירו מלבן באורך ידוע מעל הצינור הרצוי (לפיקסלים שחורים יש ערך של 0, ולפיקסלים אדומים יש ערך של 255).
- מדוד את הצפיפות המשולבת של השטח.
- חלקו את הצפיפות באורך (בפיקסלים) של ה-LNT כדי לקבל את העובי (בפיקסלים).
הערה: ניתן להשוות את מדידות העובי בין תמונות רק כאשר הגדרות ההדמיה והסף מוגדרים באופן זהה.
- קביעת חלוקת השומנים בצמתים של LNTs (איור 3)
- פתח את התמונה ב- ImageJ.
- השתמש בכלי קו כדי לצייר קו מעל הצומת הרצוי.
- מדוד את עוצמת הצומת הן בערוצים הירוקים של אורגון והן בערוצים האדומים של טקסס.
- העבר את הקו ל-LNT ומדוד את עוצמת ה-LNT הן בערוצים הירוקים של אורגון והן בערוצים האדומים של טקסס.
Access restricted. Please log in or start a trial to view this content.
תוצאות
רשתות LNT (איור 4) יוצרו באמצעות הפרוטוקול המתואר, המשתמש בעבודה המבוצעת על ידי הובלת קינסין של מיקרוטובולים כדי להוציא LNTs מ-GUVs. בקצרה, GUVs הוכנו באמצעות התייבשות ג'ל אגרוז באמצעות תמיסת סוכרוז, ומיקרוטובולים פוזלו בתמיסת GPEM והתייצבו ב- BRB80T. לאחר מכן, מנועי קינסין הוכנסו לתא זר?...
Access restricted. Please log in or start a trial to view this content.
Discussion
רשתות LNT הן כלי שימושי למחקרים במבחנה לתכונות הממברנה ולהובלת ביומולקולות כגון חלבוני טרנס-ממברנה. יתר על כן, שימוש בפורמולות ליפידים מורכבות לייצור רשתות LNT מאפשר מחקרים רלוונטיים יותר מבחינה ביולוגית. מחקרי ייצור אחרים השתמשו ב-1) ניסוחי ליפידים פשוטים ושלפוחיות מולטי-למלר או 2) טכניקות ?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
המעבדות הלאומיות של סנדיה היא מעבדה רב-משימתית המנוהלת ומופעלת על ידי פתרונות טכנולוגיה והנדסה לאומיים של Sandia, LLC., חברת בת בבעלות מלאה של Honeywell International, Inc., עבור מינהל הביטחון הגרעיני הלאומי של ארה"ב DOE תחת חוזה DE-NA-0003525. מאמר זה מתאר תוצאות טכניות אובייקטיביות וניתוח. כל השקפה או דעה סובייקטיבית שעשויה לבוא לידי ביטוי בעיתון אינה מייצגת בהכרח את דעות משרד האנרגיה האמריקאי או של ממשלת ארצות הברית.
Acknowledgements
עבודה זו נתמכה על ידי מחלקת האנרגיה של ארה"ב, המשרד למדעי האנרגיה הבסיסיים, המחלקה למדעי החומרים וההנדסה (BES-MSE). סינתזת קינסין ומיקרוסקופיה פלואורסצנטית בוצעו באמצעות פרויקט משתמש (ZIM) במרכז לננו-טכנולוגיה משולבת, מתקן משתמשים של משרד המדע המופעל עבור משרד המדע האמריקאי (DOE).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 100x/1.4 Numerical Aperture Oil Immersion Objective | Olympus | 1-U2B836 | Olympus UPlanSApo 100x/1.40 Oil Objective Infinity Corrected, RMS Thread Working Distance 0.12mm |
| 3.0 ND Filter | Olympus | Neutral Density Filter | |
| AMP-PNP | Sigma-Aldrich | A2647 | (β,γ-imidoadenosine 5′-triphosphate) |
| ATP | Sigma-Aldrich | A7699 | Adenosine 5'-triphosphate disodium salt hydrate BioXtra |
| Brightline Pinkel DA/FI/TR/Cy5/Cy7-5X-A000 filter set | Semrock | LED-DA/FI/TR/Cy5/Cy7-5X-A-000 | BrightLine Pinkel filter set, optimized for DAPI, FITC, TRITC, Cy5 & Cy7 and other like fluorophores, illuminated with LED-based light sources |
| Casein | Sigma-Aldrich | 22090 | Casein hydrolysate for microbiology |
| Catalase | Sigma-Aldrich | C9322 | Catalase from Bovine Liver |
| Chloroform | Sigma-Aldrich | 288306 | Chloroform anhydrous contains 0.5-1.0% ethanol as stabilizer |
| Cholesterol | Avanti | 700000P | cholesterol (ovine wool, >98%) (powder) |
| D-Glucose | Sigma-Aldrich | G7021 | D-(+)-Glucose powder, BioReagent, suitable for cell culture, suitable for insect cell culture, suitable for plant cell culture, ≥99.5% |
| DOPC | Avanti | 850375C | 1,2-Dioleoyl-sn-glycero-3-phosphocholine (in chloroform) |
| DOPE-Biotin | Avanti | 870282C | 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(biotinyl) (sodium salt) |
| DPPC | Avanti | 850355P | 1,2-dipalmitoyl-sn-glycero-3-phosphocholine (powder) |
| DPPE-Biotin | Avanti | 870285P | 1,2-dipalmitoyl-sn-glycero-3-phosphoethanolamine-N-(biotinyl) (sodium salt) |
| DTT | Sigma-Aldrich | 43816 | DL-Dithiothreitol solution 1 M |
| EGTA | Sigma-Aldrich | E4378 | EGTA, Egtazic acid, Ethylene-bis(oxyethylenenitrilo)tetraacetic acid, Glycol ether diamine tetraacetic acid |
| Glucose Oxidase | Sigma-Aldrich | G6125 | Glucose Oxidase from Aspergillus niger Type II, ≥10,000 units/g solid (without added oxygen) |
| Glycerol | Fisher | G33 | Glycerol (Certified ACS), Fisher Chemical |
| GTP | Sigma-Aldrich | G8877 | Guanosine 5′-triphosphate sodium salt hydrate |
| IX-81 Olympus Microscope | Olympus | N/A | IX81 Inverted Microscope from Olympus |
| KOH | Sigma-Aldrich | 1050121000 | Potassium Hydroxide |
| Magnesium Chloride | Sigma-Aldrich | M1028 | 1.00 M magnesium chloride solution |
| Orca Flash 4.0 Digital Camera | Hamamatsu | C13440-20CU | ORCA-Flash 4.0 V3 Digital CMOS camera |
| Oregon Green-DHPE | Invitrogen | O12650 | Oregon Green 488 1,2-Dihexadecanoyl-sn-Glycero-3-Phosphoethanolamine |
| Paclitaxel | ThermoFisher | P3456 | Paclitaxel (Taxol Equivalent) - for use in research only |
| PIPES | Sigma-Aldrich | P6757 | 1,4-Piperazinediethanesulfonic acid, Piperazine-1,4-bis(2-ethanesulfonic acid), Piperazine-N,N′-bis(2-ethanesulfonic acid) |
| Texas Red-DHPE | Invitrogen | T1395MP | Texas Red 1,2-Dihexadecanoyl-sn-Glycero-3-Phosphoethanolamine, Triethylammonium Salt |
| Trolox | Sigma-Aldrich | 238813 | (±)-6-Hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid |
| Tubulin, Biotin | Cytoskeleton | T333P | Tubulin protein (biotin) porcine brain |
| Tubulin, Hy-Lite 488 | Cytoskeleton | TL488M | Tubulin protein (fluorescent HiLyte 488) porcine brain |
| Tubulin, Unlabeled | Cytoskeleton | T240 | Tubulin protein porcine brain |
References
- Bouxsein, N. F., Carroll-Portillo, A., Bachand, M., Sasaki, D. Y., Bachand, G. D. A continuous network of lipid nanotubes fabricated from the gliding motility of kinesin powered microtubule filaments. Langmuir. 29 (9), 2992-2999 (2013).
- Paxton, W. F., Bouxsein, N. F., Henderson, I. M., Gomez, A., Bachand, G. D. Dynamic assembly of polymer nanotube networks via kinesin powered microtubule filaments. Nanoscale. 7 (25), 10998-11004 (2015).
- Leduc, C., et al. Cooperative extraction of membrane nanotubes by molecular motors. Proceedings of the National Academy of Sciences of the United States of America. 101 (49), 17096-17101 (2004).
- Lippincott-Schwartz, J., Roberts, T. H., Hirschberg, K. Secretory protein trafficking and organelle dynamics in living cells. Annual Review of Cell and Developmental Biology. 16, 557-589 (2000).
- Belting, M., Wittrup, A. Nanotubes, exosomes, and nucleic acid-binding peptides provide novel mechanisms of intercellular communication in eukaryotic cells: implications in health and disease. Journal of Cell Biology. 183 (7), 1187-1191 (2008).
- Rustom, A., Saffrich, R., Markovic, I., Walther, P., Gerdes, H. H. Nanotubular highways for intercellular organelle transport. Science. 303 (5660), 1007-1010 (2004).
- Onfelt, B., Nedvetzki, S., Yanagi, K., Davis, D. M. Cutting edge: Membrane nanotubes connect immune cells. Journal of Immunology. 173 (3), 1511-1513 (2004).
- Sciaky, N., et al. Golgi tubule traffic and the effects of brefeldin A visualized in living cells. J Cell Biol. 139 (5), 1137-1155 (1997).
- Sprong, H., van der Sluijs, P., van Meer, G. How proteins move lipids and lipids move proteins. Nature Reviews Molecular Cell Biology. 2 (7), 504-513 (2001).
- Keenan, T. W., Morre, D. J. Phospholipid class and fatty acid composition of golgi apparatus isolated from rat liver and comparison with other cell fractions. Biochemistry. 9 (1), 19-25 (1970).
- Imam, Z. I., Bachand, G. D. Multicomponent and Multiphase Lipid Nanotubes Formed by Gliding Microtubule-Kinesin Motility and Phase-Separated Giant Unilamellar Vesicles. Langmuir. 35 (49), 16281-16289 (2019).
- Wesolowska, O., Michalak, K., Maniewska, J., Hendrich, A. B. Giant unilamellar vesicles - a perfect tool to visualize phase separation and lipid rafts in model systems. Acta Biochimica Polonica. 56 (1), 33-39 (2009).
- Momin, N., et al. Designing lipids for selective partitioning into liquid ordered membrane domains. Soft Matter. 11 (16), 3241-3250 (2015).
- Fygenson, D. K., Braun, E., Libchaber, A. Phase diagram of microtubules. Physical Review E. 50, 1579(1994).
- Greene, A. C., Sasaki, D. Y., Bachand, G. D. Forming Giant-sized Polymersomes Using Gel-assisted Rehydration. Journal of Visualized Experiments. (111), (2016).
- Bachand, M., et al. Directed self-assembly of 1D microtubule nano-arrays. Royal Society of Chemistry Advances. 4 (97), 54641-54649 (2014).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved