Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Herstellung von Mehrkomponenten-Lipid-Nanoröhrchen-Netzwerken unter Verwendung des Gliding Kinesin Motility Assays
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt ein Verfahren zur Herstellung von Lipid-Nanoröhrchen-Netzwerken unter Verwendung der Gleitkinesin-Motilität in Verbindung mit riesigen unilamellären Lipidvesikeln.
Zusammenfassung
Lipid-Nanoröhrchen-Netzwerke (LNT) stellen ein In-vitro-Modellsystem zur Untersuchung des molekularen Transports und der Lipidbiophysik dar, das für die ubiquitären Lipidtubuli in eukaryotischen Zellen relevant ist. In-vivo-LNTs sind jedoch stark ungleichgewichtsgleiche Strukturen, die chemische Energie und molekulare Motoren erfordern, um zusammengesetzt, aufrechterhalten und reorganisiert zu werden. Darüber hinaus ist die Zusammensetzung von in vivo LNTs komplex und besteht aus mehreren verschiedenen Lipidspezies. Typische Methoden zum Extrudieren von LNTs sind sowohl zeit- als auch arbeitsintensiv und erfordern optische Pinzetten, Mikroperlen und Mikropipetten, um Nanoröhrchen gewaltsam aus riesigen Lipidvesikeln zu ziehen. Hier wird ein Protokoll für den Gleitmotilitätsassay (GMA) vorgestellt, bei dem großflächige LNT-Netzwerke schnell aus riesigen unilamellären Vesikeln (GUVs) unter Verwendung von Kinesin-betriebener Mikrotubuli-Motilität erzeugt werden. Mit dieser Methode werden LNT-Netzwerke aus einer Vielzahl von Lipidformulierungen gebildet, die die Komplexität biologischer LNTs nachahmen, was sie für In-vitro-Studien der Lipidbiophysik und des membranassoziierten Transports immer nützlicher macht. Darüber hinaus ist diese Methode in der Lage, LNT-Netzwerke in kurzer Zeit (<30 min) mit gängigen Laborgeräten zuverlässig herzustellen. LNT-Netzwerkeigenschaften wie Länge, Breite und Lipidpartitionierung sind ebenfalls abstimmbar, indem die Lipidzusammensetzung der GUVs, die für die Herstellung der Netzwerke verwendet werden, geändert wird.
Einleitung
Die Herstellung von Lipid-Nanoröhrchen-Netzwerken (LNT) ist von zunehmendem Interesse für die In-vitro-Untersuchung von Nichtgleichgewichtslipidstrukturen 1,2,3. Zellen verwenden Lipidtubuli für den diffusiven Transport der Proteine4 und Nukleinsäuren5 sowie für die Zell-zu-Zell-Kommunikation 6,7. Das endoplasmatische Retikulum und der Golgi-Apparat sind besonders interessant, da diese membrangebundenen Organellen die primären Orte für die Lipid- und Proteinsynthese sowie den Transport dieser integralen Biomoleküle innerhalb des Zytoplasmas einer Zellesind 8,9. Die Membranen dieser Organellen bestehen aus mehreren Lipidspezies, einschließlich Sphingolipiden, Cholesterin und Phospholipiden10, die letztendlich dazu beitragen, ihre Funktionalität zu definieren. Um diese Organellen genauer zu replizieren und zu untersuchen, müssen daher in vitro LNTs aus Vesikeln mit immer komplexeren Lipidformulierungen hergestellt werden11.
Riesige unilamellare Vesikel (GUVs) werden häufig zur Untersuchung des Lipidmembranverhaltens verwendet, da sie zuverlässig mit komplexen Formulierungen synthetisiert werden können, die Cholesterin, Phosphatidylcholin (PC), Phosphatidylethanolamin (PE), Phosphatidylserin (PS) und Phosphatidylinositol (PI) 12,13 enthalten. Beschrieben wird hier ein Verfahren zur Herstellung von LNTs aus GUVs mit unterschiedlichen Lipidformulierungen unter Verwendung des Gleitmotilitätsassays (GMA), bei dem LNTs auf der Grundlage der Arbeit von Kinesin-Motoren und Mikrotubuli-Filamenten, die auf GUVs wirken, extrudiert werden. In diesem System treiben Kinesin-Motorproteine, die an einer Oberfläche adsorbiert werden, biotinylierte Mikrotubuli an und wandeln chemische Energie aus der Hydrolyse von ATP in nützliche Arbeit um (insbesondere die Extrusion von LNTs aus biotinylierten Vesikeln)11. Das resultierende LNT-Netzwerk bietet eine Modellplattform, um die Auswirkungen der Unterschiede in den Lipidphasen auf Veränderungen in der LNT-Morphologie zu untersuchen.
Kurz gesagt, Kinesin-Motorproteine werden in einer caseinhaltigen Lösung in eine Strömungskammer eingebracht, die die Adsorption der Motoren auf die Glasoberfläche der Kammer ermöglicht. Als nächstes fließen biotinylierte Mikrotubuli in einer ATP-haltigen Lösung durch die Kammer und dürfen an die Kinesin-Motoren binden und die Motilität beginnen. Eine Streptavidinlösung wird dann in die Kammer eingeführt und lässt nicht-kovalent an die Mikrotubuli binden. Schließlich werden GUVs, die ein biotinyliertes Lipid enthalten, in die Kammer eingeführt und binden an die Streptavidin-beschichteten Mikrotubuli, extrudieren dann LNTs, um im Laufe von 15-30 min großräumige Netzwerke zu bilden. Diese Methode erzeugt große, verzweigte LNT-Netzwerke unter Verwendung von Standardlaborgeräten und Reagenzien zu niedrigen Kosten11.
Access restricted. Please log in or start a trial to view this content.
Protokoll
1. Herstellung von Stamm-Mikrotubuli-Lösungen
ACHTUNG: Schutzbrille, Handschuhe und ein Laborkittel sollten während des gesamten Protokolls immer getragen werden.
- 5x BRB80-Puffer vorbereiten: 24,19 g PIPES (Piperazin-N,N′-bis[2-Ethansulfonsäure]) und 0,38 g EGTA (Ethylenglykol-bis[β-aminoethylether]-N,N,N′,N′-Tetraessigsäure) in eine 1 L Glasflasche geben. Fügen Sie 1 ml 1 M MgCl2 hinzu und stellen Sie den pH-Wert mit KOH auf 6,9 ein. Fügen Sie deionisiertes Wasser hinzu, um die Lösung auf ein Endvolumen von 500 ml zu bringen.
- Bereiten Sie 100 mM Vorrat an GTP-Lösung vor: Wiegen Sie 52 mg GTP und suspendieren Sie in 1 ml destilliertem Wasser. 100 mM Lösung in 20 μL Aliquots teilen und bei -20 °C lagern.
- Bereiten Sie die GPEM-Lösung vor: Mischen Sie 200 μL 5x BRB80, 10 μL 100 mM GTP-Lösung, 100 μL 100% Glycerin und 600 μL deionisiertes Wasser. GPEM-Lösung in 100 μL Aliquots teilen und bei -20 °C lagern.
- Herstellen einer Mikrotubulilösung durch Rekonstitution von Durchstechflaschen mit handelsüblichem, lyophilisiertem Tubulin (je eine Durchstechflasche mit biotinyliertem, fluoreszierend markiert und unmarkiert) in kalter (4 °C) GPEM-Lösung auf eine Stammkonzentration von 5 mg/ml.
- Führen Sie eine Mikrotubulipolymerisation durch, indem Sie 4 μL biotinyliertes Tubulin, 4 μL fluoreszenzmarkiertes Tubulin und 24 μL unmarkiertes Tubulin (alle bei 5 mg/ml-Konzentrationen) mischen, um ein Verhältnis von 1:1:6 bei einem Endvolumen von 32 ml zu erhalten. Halten Sie es auf Eis. Das Tubulingemisch in 2 μL Aliquots teilen und bei -80 °C lagern, bis es benötigt wird.
HINWEIS: Eine effiziente Polymerisation erfordert, dass die Tubulinkonzentration gleich oder höher als die kritische Konzentration (5 mg/ml)14 ist. Hier wird die Auswahl des Tubulinverhältnisses für eine ausreichende Konzentration von biotinyliertem Tubulin optimiert, um Streptavidin und GUVs effizient zu binden, sowie eine ausreichende Konzentration an fluoreszierendem Tubulin für die mikroskopische Charakterisierung.
2. Herstellung von riesigen unilamellären Vesikeln (GUVs)
- Agarose-Filmvorbereitung
HINWEIS: Dieses Protokoll wurde von Greene et al.15 übernommen.- Bereiten Sie eine 1% ige w/v-Lösung vor, indem Sie 1 g Agarose in 100 ml entionisiertem Wasser in einem 250 ml Erlenmeyerkolben mischen. Verwenden Sie eine Standardmikrowelle, um die Agaroselösung für 1–2 min zu erhitzen.
HINWEIS: Die Lösung wird durchscheinend, sobald die Agarose vollständig aufgelöst ist. Lassen Sie die Lösung vor Gebrauch auf 65–75 °C abkühlen. - Verwenden Sie eine geschnittene 1.000 μL Pipettenspitze, um 300–400 μL Agaroselösung auf ein 25 mm x 25 mm großes Glasdeckglas zu pipettieren. Während Sie den Rand des Deckglases mit behandschuhten Fingern halten, verwenden Sie eine weitere 1.000 μL Pipettenspitze, um die geschmolzene Agarose gleichmäßig über das Deckglas zu verteilen.
HINWEIS: Die Beibehaltung der Agarose bei 65–75 °C ermöglicht eine effiziente Verteilung auf der Deckglasoberfläche. - Trocknen Sie die mit Agarose beschichteten Deckgläser in einem 37 °C Inkubator für mindestens 2 h, woraufhin die Agarose transparent wird. Lagern Sie die Deckgläser, indem Sie die mit Agarose beschichtete Oberfläche nach oben auf eine saubere Oberfläche wie fusselfreies Papier oder Wachsfolie bei Raumtemperatur (RT) legen.
- Bereiten Sie eine 1% ige w/v-Lösung vor, indem Sie 1 g Agarose in 100 ml entionisiertem Wasser in einem 250 ml Erlenmeyerkolben mischen. Verwenden Sie eine Standardmikrowelle, um die Agaroselösung für 1–2 min zu erhitzen.
- Lipidformulierung
- In Chloroform gelöste Lipide aus einem Gefrierschrank von -20 °C entnehmen und in einen chemischen Rauch geben, bis sie RT erreichen.
- Berechnen Sie das Volumen des Lipidbestands jeder Komponente Lipid, die für die Formulierung benötigt wird, unter Verwendung der folgenden Formel:
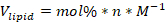
Dabei gilt: V-Lipid ist das zu verwendende Lipidvolumen, mol % ist der molare Prozentsatz der Lipidkomponente, n ist die Gesamtzahl der Mol Lipid, die in der Formulierung verwendet werden, und M ist die Konzentration des Lipids in molaren Einheiten.
HINWEIS: Wenn beispielsweise eine Formulierung verwendet wird, die 45 Mol-% 1,2-Dioleoyl-sn-glycero-3-phosphocholin (DOPC) mit einer Stammlösungskonzentration von 12,72 mM und 1 Mikromol Gesamtlipiden in der Formulierung enthält, wäre das Volumen des in der Formulierung verwendeten DOPC-Stammes: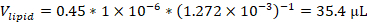
- Mischen Sie die Lipide im berechneten Verhältnis in einem Glasfläschchen im chemischen Abzug.
- Pipette 30 μL Lipidlösung auf die mit Agarosebeschichteten Deckgläser auf einer vorgewärmten Heizplatte, die über dem Schmelzpunkt der gesättigten Lipidkomponente der Formulierung eingestellt ist (z. B. 50 °C Heizplatte für ein Lipid mit T m von 40 °C).
- Verteilen Sie die Lösung über den Agarosefilm in einer kreisförmigen Bewegung mit dem langen Rand einer 18-G-Nadel, bis das Chloroform verdampft ist und sich eine gleichmäßige Lipidschicht gebildet hat. Halten Sie den Rand des Deckglases mit behandschuhten Fingern, während Sie diesen Schritt ausführen.
HINWEIS: Es sollte darauf geachtet werden, dass die Agaroseschicht nicht mit der Nadel beschädigt wird. - Legen Sie das Deckglas mit Agaroseschicht und Lipidfilm in eine mit Aluminiumfolie überzogene Petrischale, die Folienseite nach oben zeigt, und legen Sie die Petrischale mindestens 2 Stunden lang in einen Vakuum-Exsikkator, um das Restlösungsmittel zu entfernen.
- In der Zwischenzeit stellen Sie 560 mM Saccharoselösung bereit, indem Sie 1,92 g Saccharose mit 10 ml entionisiertem Wasser mischen.
HINWEIS: Die Konzentration der Saccharoselösung hängt von der Osmolarität des Puffers ab, in dem GUVs verdünnt werden. Typischerweise sollte die Osmolarität der Saccharoselösung nicht mehr als 10 % größer sein als der Puffer, in dem die GUVs verdünnt werden, insbesondere der Motilitätspuffer (siehe Schritt 3.11). - GUV-Bildung
- Kleben Sie eine mit dem Lipidfilm beschichtete Klebekammer auf das Abdeckglas, indem Sie die Klebekammer vorsichtig auf den lipidbeschichteten Deckglas drücken, wobei der Lipidfilm nach oben zeigt, um sicherzustellen, dass eine dichte Abdichtung gebildet wird.
- 400 μL 560 mM Saccharoselösung (hergestellt in Schritt 2.3) in die Kammer geben.
- Legen Sie den Deckglas in die Feuchtigkeitskammer und schließen Sie den Deckel.
- Legen Sie die Feuchtigkeitskammer auf eine vorgewärmte Heizplatte, die über dem Schmelzpunkt der gesättigten Lipidkomponente der Formulierung liegt.
- Lassen Sie die Vesikel für ≥1 h vor der Genesung bilden.
HINWEIS: Die Vesikelbildung kann mit einer Fluoreszenzmikroskopie mit einer 40-fachen Luftobjektivlinse überprüft werden.
3. Vorbereitung von Motilitätsassay-Beständen und Reagenzien
- Vorbereitung des Kaseinbestandes
- Fügen Sie 3 g trockenes Casein in ein konisches 50-ml-Zentrifugenröhrchen hinzu, fügen Sie dann 30 ml 1x BRB80 hinzu und drehen Sie, bis die Lösung viskos wird. Zentrieren Sie das Röhrchen bei 15.000 x g für 30 min.
- Den Überstand in ein weiteres 50 mL konisches Zentrifugenröhrchen geben und das Pellet entsorgen. Filtern Sie die Lösung durch einen 1-μm-Spritzenfilter und sammeln Sie die Lösung in einer 50 ml konischen Durchstechflasche. Filtern Sie die Lösung durch einen 0,2-μm-Filter und sammeln Sie die Lösung in einer 50 ml konischen Durchstechflasche.
- Bestimmen Sie die Proteinkonzentration, indem Sie die Absorption bei 280 nm mit einem UV-Vis-Spektralphotometer und einer Quarzküvette messen.
- Berechnen Sie die Kaseinkonzentration in mg/ml nach folgender Formel:
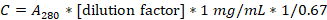
- Verdünnen Sie die Lösung auf 20 mg/ml in 1x BRB80, teilen Sie sie in 100 μL Aliquots und lagern Sie sie bei -20 °C.
- Stellen Sie Glucoseoxidase (2 mg / ml) Stammlösung her, indem Sie 2 mg Glucoseoxidase mit 1 ml 1x BRB80 mischen. In 100 μL Aliquots dividieren und bei -20 °C lagern.
- Bereiten Sie Katalase (0,8 mg / ml) Stammlösung vor, indem Sie 0,8 mg Katalase mit 1 ml 1x BRB80 mischen. In 100 μL Aliquots dividieren und bei -20 °C lagern.
- Bereiten Sie 2 M Glucoselösung vor, indem Sie 0,3 g D-Glucose in 1 ml deionisiertem Wasser suspendieren. In 100 μL Aliquots dividieren und bei -20 °C lagern.
- Bereiten Sie 100 mM DTT-Vorrat vor, indem Sie 0,015 g DTT in 1 ml deionisiertem Wasser suspendieren. In 100 μL Aliquots dividieren und bei -20 °C lagern.
- Bereiten Sie 100 mM Mg-ATP-Vorrat vor, indem Sie 0,055 g Dinatrium-ATP in 1 ml Lösung von 100 mMMgCl 2 suspendieren. In 100 μL Aliquots dividieren und bei -20 °C lagern.
- Bereiten Sie die 100 mM Mg-AMP-PNP-Lösung vor, indem Sie 0,055 g AMP-PNP in einer 1 ml Lösung von 100 mMMgCl 2 suspendieren, dann in 100 μL Aliquots teilen und bei -20 °C lagern.
- Bereiten Sie 100 mM Trolox-Lösung vor, indem Sie 25,03 mg Trolox zu 1 ml Methanol hinzufügen und bei -20 ° C lagern.
- Bereiten Sie 10 mg/ml Streptavidinlösung vor, indem Sie 1 mg Streptavidin zu 100 μL BRB80 hinzufügen, dann in 2 μL Aliquots teilen und bei -80ۛ °C lagern.
- Bereiten Sie BRB90CAT vor, indem Sie 200 μL 5x BRB80, 20 μL Kaseinlösung, 10 μL MgATP-Lösung, 10 μL Trolox, 5 μL Paclitaxellösung und 765 μL DI-Wasser mischen. Bei 4 °C lagern.
- Bereiten Sie die Motilitätslösung vor, indem Sie 192 μL BRB80CAT, 2 μL D-Glucoselösung, 2 μL Glucoseoxidaselösung, 2 μL DTT-Lösung und 2 μL Katalaselösung mischen. Bei 4 °C lagern.
- Eine 1 μM Kinesinlösung wird durch Verdünnen der Stammkinesinlösung in BRB80CAT (z. B. 2 μL 50 mM Kinesinlösung in 98 μL BRB80CAT) hergestellt und bei 4 °C gelagert.
- Bereiten Sie eine 10 μg/ml Mikrotubulilösung vor, indem Sie 10 μL stabilisierte Mikrotubuli in 90 μL Raumtemperatur BRB80CAT verdünnen. Speichern bei RT.
- Es wird eine 10 μg/ml Streptavidinlösung durch Zugabe von 0,1 μL 10 mg/ml Streptavidinlösung in 99,9 μL Motilitätslösung hergestellt. Bei 4 °C lagern.
- Bereiten Sie eine 12-fache GUV-Lösung vor, indem Sie 5 μL GUV-Material in 55 μL Motilitätslösung verdünnen. Bei 4 °C lagern.
- Polymerisation von Tubulin in Mikrotubuli
- Ein zuvor hergestelltes 2 μL Aliquot Tubulin wird aus dem Gefrierschrank von -80 °C (hergestellt in Schritt 1.5) gesammelt und für 30 min in ein 37 °C warmes Wasserbad gegeben.
- Bereiten Sie eine 2 mM Paclitaxel-Lösung vor, indem Sie 1,71 mg Paclitaxel in 1 ml wasserfreies DMSO hinzufügen, in 10 μL Aliquots teilen und bei -20 ° C lagern.
- BRB80T frisch zubereiten, indem Sie 99,5 μL 1x BRB80 mit 0,5 μL 2 mM Paclitaxel mischen. 100 μL BRB80T auf 37 °C im Wasserbad warm.
- Nach 30 min die 100 μL BRB80T in das Tubulinaliquot geben, um die Mikrotubuli zu stabilisieren. Speichern bei RT.
4. Gleitmotilitätsassay (GMA)
- Bereiten Sie eine Durchflusskammer vor, indem Sie zwei Streifen aus doppelseitigem Klebeband, die durch 5 mm getrennt sind, auf einen Glasschieber legen. Wiederholen Sie diesen Vorgang, bis jeder Streifen drei Bandschichten umfasst.
- Legen Sie ein Deckglas auf das Band und drücken Sie es dann vorsichtig mit einer Pinzette oder einem Stift auf die Deckglas-/Bandschnittstelle, um eine ausreichende Haftung zu gewährleisten.
HINWEIS: Der Kanal sollte 5 mm breit, 25 mm lang und 300 mm hoch sein. - 30 μL 1 mm Kinesinlösung (hergestellt in Schritt 3.12) in die Durchflusszelle pipettieren und 5 min inkubieren lassen.
HINWEIS: Das Casein bildet eine Doppelschicht auf der Oberfläche des Deckglases / Glasobjektträgers und erleichtert die Befestigung des Kinesin-Schwanzes an der Oberfläche. - Pipette 30 μL 10 μg/ml Mikrotubulielösung (hergestellt in Schritt 3.13) in die Durchflusszelle, wobei ein Labortuch verwendet wird, das sanft gegen das gegenüberliegende Ende des Strömungskanals gedrückt wird, um den Lösungsaustausch zu erleichtern. 5 min inkubieren
- Waschen Sie die Durchflusszelle 1x–3x mit 1x Motilitätslösung bei RT (vorbereitet in Schritt 3.11).
HINWEIS: Die Fluoreszenzmikroskopie mit einem 40-fachen Luftobjektiv kann an dieser Stelle verwendet werden, um die Mikrotubuli-Befestigung und -Motilität zu bestätigen. Mikrotubuli erscheinen als fluoreszierende Filamente (Dutzende von Mikrometern Länge), die sich mit ~0,5 μm/s über die Oberfläche bewegen (gleiten) (Abbildung 1). - Pipette 30 μL 10 μg/ml Streptavidinlösung (hergestellt in Schritt 3.14) in die Durchflusszelle unter Verwendung eines Labortuchs, das vorsichtig gegen das gegenüberliegende Ende des Strömungskanals gedrückt wird, um den Lösungsaustausch zu erleichtern. 10 min inkubieren
- Fließen Sie 30 μL 12x GUV-Lösung (hergestellt in Schritt 3.15) in den Durchfluss mit einem Labortuch, das vorsichtig gegen das gegenüberliegende Ende des Strömungskanals gedrückt wird, um den Lösungsaustausch zu erleichtern. 30 min inkubieren
- Geben Sie 2 μL 100 mM AMP-PNP-Lösung (hergestellt in Schritt 3.7), um die Motilität zu stoppen, und verschließen Sie dann die Kammer mit Dichtmittel.
5. Charakterisierung des LNT-Netzwerks
- Übertragen Sie die Durchflusskammer zur Bildgebung auf ein inverses Mikroskop.
- Wählen Sie den geeigneten Filtersatz basierend auf den Wellenlängen der verwendeten fluoreszierenden Lipide oder Tubuline. Wenn Sie beispielsweise Texas Red-markierte Lipide verwenden, verwenden Sie einen 560 nm/25 nm Anregungsfilter und einen 607 nm/36 nm Emissionsfilter.
- Verwenden Sie ein 100-faches Ölobjektiv, um auf die Oberfläche des Deckglases zu fokussieren.
- Stellen Sie die LNT-Netzwerke mithilfe der Fluoreszenzmikroskopie dar.
HINWEIS: LNTs sind lineare Strukturen, die aus den größeren Vesikeln extrudieren. LNTs viel kleiner als GUVs und haben schwächere Fluoreszenzsignale. Daher müssen die Belichtung und der Kontrast entsprechend den Bild-LNTs angepasst werden. Diese Anpassungen führen auch zu einer Überbelichtung der GUVs, und daher wird empfohlen, die Lamellen- und Phasentrennung in GUVs unabhängig voneinander zu charakterisieren. - Fokussieren Sie das Mikroskop auf ein interessantes Netzwerk und nehmen Sie ein Standard- oder Kachelbild auf.
- Passen Sie die Belichtungszeit und die Neutraldichtefilter an, um die LNTs abzubilden und die gesättigte Belichtung der GUVs zu minimieren. Erfassen Sie Bilder sowohl in roten als auch in grünen Kanälen.
HINWEIS: Hier ermöglicht der rote Kanal die Visualisierung der Texas-Red-Lipide, während der grüne Kanal die Visualisierung der Mikrotubuli (z. B. Oregon Green-Lipide und HiLyte488-Farbstoffe) ermöglicht. - Erstellen Sie ein zusammengesetztes Bild, indem Sie den roten und den grünen Kanal überlagern (Abbildung 1).
- Charakterisierung von LNT-Netzwerken durch Messung der LNT-Länge
- Öffnen Sie die aufgenommenen Bilder mit einer Bildanalysesoftware wie ImageJ.
- Kalibrieren Sie die Skala für das Mikroskop mithilfe der eingestellten Skalierungsfunktion, geben Sie die Pixel auf den Umrechnungsfaktor mm ein und klicken Sie auf OK.
HINWEIS: Der Umrechnungsfaktor hängt vom Mikroskop, dem Objektivobjektiv und der Kamera ab und kann mit einem Objektträger zur Kalibrierung des Mikroskops ermittelt werden. Sie wird im Allgemeinen in Pixel/mm ausgedrückt. - Verwenden Sie das Multipoint-Linienwerkzeug , um die Länge der Nanoröhrchen ausgehend vom Eltern-GUV zu messen. Halten Sie Strg + M gedrückt, um die Länge zu messen.
- Fahren Sie mit der Messung der Längen einzelner Rohre fort, indem Sie die obigen Schritte ausführen. Das Bildverarbeitungswerkzeug speichert jede neue Messung im Ergebnisfenster.
- Halten Sie Strg + D gedrückt, nachdem Sie jede Linie gezeichnet haben, um zu verfolgen, welche Rohre gemessen wurden.
- Messung der LNT-Dicke (Abbildung 2)
- Öffnen Sie das Bild in ImageJ, und wählen Sie unter der Registerkarte Bild die Funktion Schwellenwert aus.
- Klicken Sie auf Übernehmen, um den Schwellenwert anzuwenden.
- Zeichnen Sie ein Rechteck bekannter Länge über das gewünschte Rohr (schwarze Pixel haben einen Wert von 0 und rote Pixel haben einen Wert von 255).
- Messen Sie die integrierte Dichte der Fläche.
- Teilen Sie die Dichte durch die Länge (in Pixel) der LNT, um die Dicke (in Pixel) zu erhalten.
HINWEIS: Die Dickenmessungen können nur dann über Bilder hinweg verglichen werden, wenn die Bildeinstellungen und der Schwellenwert identisch eingestellt sind.
- Bestimmung der Lipidpartitionierung in Knoten von LNTs (Abbildung 3)
- Öffnen Sie das Bild in ImageJ.
- Verwenden Sie das Linienwerkzeug , um eine Linie über den gewünschten Knoten zu zeichnen.
- Messen Sie die Knotenintensität sowohl im Oregon Green- als auch im Texas Red-Kanal.
- Verschieben Sie die Linie zum LNT und messen Sie die LNT-Intensität sowohl im Oregon Green- als auch im Texas Red-Kanal.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
LNT-Netzwerke (Abbildung 4) wurden unter Verwendung des beschriebenen Protokolls hergestellt, das die Arbeit des Kinesin-Transports von Mikrotubuli verwendet, um LNTs aus GUVs zu extrudieren. Kurz gesagt, GUVs wurden unter Verwendung von Agarosegel-Rehydratation unter Verwendung von Saccharoselösung hergestellt, und Mikrotubuli wurden in GPEM-Lösung polymerisiert und in BRB80T stabilisiert. Als nächstes wurden Kinesin-Motoren in eine Durchflusszelle eingeführt, die eine aktive Schicht vo...
Access restricted. Please log in or start a trial to view this content.
Diskussion
LNT-Netzwerke sind ein nützliches Werkzeug für In-vitro-Studien zu Membraneigenschaften und dem Transport von Biomolekülen wie Transmembranproteinen. Darüber hinaus ermöglicht die Verwendung komplexer Lipidformulierungen zur Herstellung von LNT-Netzwerken biologisch relevantere Studien. Andere Herstellungsstudien haben entweder 1) einfache Lipidformulierungen und mehrfeldrige Vesikel oder 2) umständlichere Motilitätstechniken verwendet, um Netzwerke aus GUVs herzustellen, die aus komplexen Lipidformulierungen best...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Sandia National Laboratories ist ein Multimissionslabor, das von National Technology & Engineering Solutions of Sandia, LLC., einer hundertprozentigen Tochtergesellschaft von Honeywell International, Inc., für die National Nuclear Security Administration des US-amerikanischen DOE unter Vertrag DE-NA-0003525 verwaltet und betrieben wird. Dieses Papier beschreibt objektive technische Ergebnisse und Analysen. Alle subjektiven Ansichten oder Meinungen, die in dem Papier zum Ausdruck gebracht werden könnten, stellen nicht unbedingt die Ansichten des US-Energieministeriums oder der Regierung der Vereinigten Staaten dar.
Danksagungen
Diese Arbeit wurde vom U.S. Department of Energy, Office of Basic Energy Sciences, Division of Materials Sciences and Engineering (BES-) unterstützt. Kinesinsynthese und Fluoreszenzmikroskopie wurden im Rahmen eines Nutzerprojekts (ZIM) am Center for Integrated Nanotechnologies durchgeführt, einer Office of Science User Facility, die für das Office of Science des US-Energieministeriums (DOE) betrieben wird.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| 100x/1.4 Numerical Aperture Oil Immersion Objective | Olympus | 1-U2B836 | Olympus UPlanSApo 100x/1.40 Oil Objective Infinity Corrected, RMS Thread Working Distance 0.12mm |
| 3.0 ND Filter | Olympus | Neutral Density Filter | |
| AMP-PNP | Sigma-Aldrich | A2647 | (β,γ-imidoadenosine 5′-triphosphate) |
| ATP | Sigma-Aldrich | A7699 | Adenosine 5'-triphosphate disodium salt hydrate BioXtra |
| Brightline Pinkel DA/FI/TR/Cy5/Cy7-5X-A000 filter set | Semrock | LED-DA/FI/TR/Cy5/Cy7-5X-A-000 | BrightLine Pinkel filter set, optimized for DAPI, FITC, TRITC, Cy5 & Cy7 and other like fluorophores, illuminated with LED-based light sources |
| Casein | Sigma-Aldrich | 22090 | Casein hydrolysate for microbiology |
| Catalase | Sigma-Aldrich | C9322 | Catalase from Bovine Liver |
| Chloroform | Sigma-Aldrich | 288306 | Chloroform anhydrous contains 0.5-1.0% ethanol as stabilizer |
| Cholesterol | Avanti | 700000P | cholesterol (ovine wool, >98%) (powder) |
| D-Glucose | Sigma-Aldrich | G7021 | D-(+)-Glucose powder, BioReagent, suitable for cell culture, suitable for insect cell culture, suitable for plant cell culture, ≥99.5% |
| DOPC | Avanti | 850375C | 1,2-Dioleoyl-sn-glycero-3-phosphocholine (in chloroform) |
| DOPE-Biotin | Avanti | 870282C | 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(biotinyl) (sodium salt) |
| DPPC | Avanti | 850355P | 1,2-dipalmitoyl-sn-glycero-3-phosphocholine (powder) |
| DPPE-Biotin | Avanti | 870285P | 1,2-dipalmitoyl-sn-glycero-3-phosphoethanolamine-N-(biotinyl) (sodium salt) |
| DTT | Sigma-Aldrich | 43816 | DL-Dithiothreitol solution 1 M |
| EGTA | Sigma-Aldrich | E4378 | EGTA, Egtazic acid, Ethylene-bis(oxyethylenenitrilo)tetraacetic acid, Glycol ether diamine tetraacetic acid |
| Glucose Oxidase | Sigma-Aldrich | G6125 | Glucose Oxidase from Aspergillus niger Type II, ≥10,000 units/g solid (without added oxygen) |
| Glycerol | Fisher | G33 | Glycerol (Certified ACS), Fisher Chemical |
| GTP | Sigma-Aldrich | G8877 | Guanosine 5′-triphosphate sodium salt hydrate |
| IX-81 Olympus Microscope | Olympus | N/A | IX81 Inverted Microscope from Olympus |
| KOH | Sigma-Aldrich | 1050121000 | Potassium Hydroxide |
| Magnesium Chloride | Sigma-Aldrich | M1028 | 1.00 M magnesium chloride solution |
| Orca Flash 4.0 Digital Camera | Hamamatsu | C13440-20CU | ORCA-Flash 4.0 V3 Digital CMOS camera |
| Oregon Green-DHPE | Invitrogen | O12650 | Oregon Green 488 1,2-Dihexadecanoyl-sn-Glycero-3-Phosphoethanolamine |
| Paclitaxel | ThermoFisher | P3456 | Paclitaxel (Taxol Equivalent) - for use in research only |
| PIPES | Sigma-Aldrich | P6757 | 1,4-Piperazinediethanesulfonic acid, Piperazine-1,4-bis(2-ethanesulfonic acid), Piperazine-N,N′-bis(2-ethanesulfonic acid) |
| Texas Red-DHPE | Invitrogen | T1395MP | Texas Red 1,2-Dihexadecanoyl-sn-Glycero-3-Phosphoethanolamine, Triethylammonium Salt |
| Trolox | Sigma-Aldrich | 238813 | (±)-6-Hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid |
| Tubulin, Biotin | Cytoskeleton | T333P | Tubulin protein (biotin) porcine brain |
| Tubulin, Hy-Lite 488 | Cytoskeleton | TL488M | Tubulin protein (fluorescent HiLyte 488) porcine brain |
| Tubulin, Unlabeled | Cytoskeleton | T240 | Tubulin protein porcine brain |
Referenzen
- Bouxsein, N. F., Carroll-Portillo, A., Bachand, M., Sasaki, D. Y., Bachand, G. D. A continuous network of lipid nanotubes fabricated from the gliding motility of kinesin powered microtubule filaments. Langmuir. 29 (9), 2992-2999 (2013).
- Paxton, W. F., Bouxsein, N. F., Henderson, I. M., Gomez, A., Bachand, G. D. Dynamic assembly of polymer nanotube networks via kinesin powered microtubule filaments. Nanoscale. 7 (25), 10998-11004 (2015).
- Leduc, C., et al. Cooperative extraction of membrane nanotubes by molecular motors. Proceedings of the National Academy of Sciences of the United States of America. 101 (49), 17096-17101 (2004).
- Lippincott-Schwartz, J., Roberts, T. H., Hirschberg, K. Secretory protein trafficking and organelle dynamics in living cells. Annual Review of Cell and Developmental Biology. 16, 557-589 (2000).
- Belting, M., Wittrup, A. Nanotubes, exosomes, and nucleic acid-binding peptides provide novel mechanisms of intercellular communication in eukaryotic cells: implications in health and disease. Journal of Cell Biology. 183 (7), 1187-1191 (2008).
- Rustom, A., Saffrich, R., Markovic, I., Walther, P., Gerdes, H. H. Nanotubular highways for intercellular organelle transport. Science. 303 (5660), 1007-1010 (2004).
- Onfelt, B., Nedvetzki, S., Yanagi, K., Davis, D. M. Cutting edge: Membrane nanotubes connect immune cells. Journal of Immunology. 173 (3), 1511-1513 (2004).
- Sciaky, N., et al. Golgi tubule traffic and the effects of brefeldin A visualized in living cells. J Cell Biol. 139 (5), 1137-1155 (1997).
- Sprong, H., van der Sluijs, P., van Meer, G. How proteins move lipids and lipids move proteins. Nature Reviews Molecular Cell Biology. 2 (7), 504-513 (2001).
- Keenan, T. W., Morre, D. J. Phospholipid class and fatty acid composition of golgi apparatus isolated from rat liver and comparison with other cell fractions. Biochemistry. 9 (1), 19-25 (1970).
- Imam, Z. I., Bachand, G. D. Multicomponent and Multiphase Lipid Nanotubes Formed by Gliding Microtubule-Kinesin Motility and Phase-Separated Giant Unilamellar Vesicles. Langmuir. 35 (49), 16281-16289 (2019).
- Wesolowska, O., Michalak, K., Maniewska, J., Hendrich, A. B. Giant unilamellar vesicles - a perfect tool to visualize phase separation and lipid rafts in model systems. Acta Biochimica Polonica. 56 (1), 33-39 (2009).
- Momin, N., et al. Designing lipids for selective partitioning into liquid ordered membrane domains. Soft Matter. 11 (16), 3241-3250 (2015).
- Fygenson, D. K., Braun, E., Libchaber, A. Phase diagram of microtubules. Physical Review E. 50, 1579(1994).
- Greene, A. C., Sasaki, D. Y., Bachand, G. D. Forming Giant-sized Polymersomes Using Gel-assisted Rehydration. Journal of Visualized Experiments. (111), (2016).
- Bachand, M., et al. Directed self-assembly of 1D microtubule nano-arrays. Royal Society of Chemistry Advances. 4 (97), 54641-54649 (2014).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten