このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
グライダーキネシン運動性アッセイを用いた多成分脂質ナノチューブネットワークの構築
要約
このプロトコルは、巨大な単層脂質小胞と組み合わせて滑空キネシン運動性を使用して脂質ナノチューブネットワークを作製するためのプロセスを記載している。
要約
脂質ナノチューブ(LNT)ネットワークは、真核細胞に見られるユビキタス脂質細管に関連する分子輸送および脂質生物物理学を研究するためのin vitroモデルシステムを表す。しかし、in vivo LNTは高度に非平衡な構造であり、化学エネルギーと分子モーターを組み立て、維持、再編成する必要があります。さらに、インビボLNTsの組成物は、複合体であり、複数の異なる脂質種からなる。LNTを押し出す典型的な方法は、時間と労力の両方を要し、巨大な脂質小胞からナノチューブを強制的に引き抜くために光学ピンセット、マイクロビーズ、およびマイクロピペットを必要とする。ここに提示されるのは、キネシン駆動微小管運動性を使用して巨大な単層小胞(GUV)から大規模なLNTネットワークが迅速に生成される滑空運動性アッセイ(GMA)のプロトコルです。この方法を使用して、LNTネットワークは、生物学的LNTの複雑さを模倣する幅広い脂質製剤から形成され、脂質生物物理学および膜関連輸送のin vitro研究にますます有用になる。さらに、この方法は、一般的に使用される実験装置を使用して、短時間(<30分)でLNTネットワークを確実に製造することができる。長さ、幅、脂質分配などのLNTネットワーク特性も、ネットワークの構築に使用されるGUVの脂質組成を変更することによって調整可能です。
概要
脂質ナノチューブ(LNT)ネットワークの作製は、非平衡脂質構造のインビトロ検査のための関心が高まっている1、2、3。細胞は、タンパク質4および核酸5の拡散輸送ならびに細胞間通信6,7のために脂質細管を使用する。小胞体およびゴルジ体装置は、これらの膜結合小器官が脂質およびタンパク質合成ならびに細胞の細胞質内のこれらの不可欠な生体分子の輸送のための主要な場所であるため、特に興味深い8,9。これらの細胞小器官の膜は、スフィンゴ脂質、コレステロール、およびリン脂質10を含む複数の脂質種で構成されており、最終的にそれらの機能を定義するのに役立つ。したがって、これらの細胞小器官をより密接に複製および研究するためには、インビトロLNTは、ますます複雑な脂質製剤11を有する小胞から作製されなければならない。
巨大な単層小胞(GUV)は、コレステロール、ホスファチジルコリン(PC)、ホスファチジルエタノールアミン(PE)、ホスファチジルセリン(PS)、およびホスファチジルイノシトール(PI)12,13を含む複雑な製剤で確実に合成できるため、脂質膜挙動を研究するために広く使用されている。ここで説明するのは、グライダー運動性アッセイ(GMA)を使用して、GUVから様々な脂質製剤を有するGUVからLNTを製造する方法であり、LNTは、キネシンモーターおよびGUVに作用する微小管フィラメントによって行われる作業に基づいて押し出される。このシステムでは、表面に吸着したキネシンモータータンパク質がビオチン化微小管を推進し、ATPの加水分解からの化学エネルギーを有用な仕事(具体的には、ビオチン化小胞からのLNTの押し出し)に変換します11。得られたLNTネットワークは、LNT形態の変化に対する脂質相の違いの影響を研究するためのモデルプラットフォームを提供する。
簡単に言えば、キネシンモータータンパク質は、カゼインを含む溶液中のフローチャンバに導入され、チャンバのガラス表面へのモータの吸着を可能にする。次に、ATPを含む溶液中のビオチン化微小管がチャンバ内を流れ、キネシンモーターに結合し、運動性を開始する。次いで、ストレプトアビジン溶液をチャンバーに導入し、微小管に非共有結合で結合させる。最後に、ビオチン化脂質を含むGUVをチャンバーに導入し、ストレプトアビジン被覆微小管に結合し、LNTを押し出して15〜30分間にわたって大規模なネットワークを形成する。この方法は、標準的な実験装置と試薬を使用して大規模で分岐したLNTネットワークを低コストで生成します11。
Access restricted. Please log in or start a trial to view this content.
プロトコル
1. ストック微小管溶液の調製
警告: 安全ゴーグル、手袋、および白衣は、プロトコル全体を通して常に着用する必要があります。
- 5x BRB80バッファーを調製する:1Lのガラス瓶に、24.19gのパイプ(ピペラジン-N,N'-ビス[2-エタンスルホン酸])と0.38gのEGTA(エチレングリコール-ビス[β-アミノエチルエーテル]-N,N,N',N'-四酢酸)を加える。1 mL の 1 M MgCl2 を加え、KOH で pH を 6.9 に調整します。脱イオン水を加えて、溶液を500mLの最終容量にする。
- 100 mM ストックの GTP 溶液を調製する: 52 mg の GTP を秤量し、1 mL の蒸留水に懸濁する。100 mM 溶液を 20 μL アリコートに分割し、-20 °C で保存します。
- GPEM溶液を調製する:200μLの5x BRB80、10μLの100mM GTP溶液、100μLの100%グリセロール、および600μLの脱イオン水を混合する。GPEM溶液を100μLアリコートに分割し、-20°Cで保存する。
- 市販の凍結乾燥チューブリン(ビオチン化、蛍光標識、および非標識の各バイアル1本)のバイアルを低温(4°C)GPEM溶液中で再構成して微小管溶液を調製し、原液濃度5mg/mLにする。
- 4 μLのビオチン化チューブリン、4 μLの蛍光標識チューブリン、および24 μLの非標識チューブリン(すべて5 mg/mL濃度)を混合して微小管重合を行い、最終容量32 mLで1:1:6の比率を作成します。氷の上に保管してください。チューブリン混合物を2μLアリコートに分割し、必要になるまで-80°Cで保存する。
注:効率的な重合には、チューブリンの濃度が臨界濃度(5mg/mL)14以上である必要があります。ここで、チューブリン比の選択は、ストレプトアビジンおよびGUVを効率的に結合するのに十分な濃度のビオチン化チューブリン、ならびに顕微鏡的特性評価のための十分な濃度の蛍光チューブリンのために最適化される。
2. 巨大単層小胞(GUV)の作製
- アガロースフィルム調製
注:このプロトコルはGreene et al.15から適応されています。- 250 mL 三角フラスコ内の 100 mL の脱イオン水に 1 g のアガロースを混合して、1% w/v 溶液を調製します。標準的なマイクロ波を使用して、アガロース溶液を1〜2分間加熱します。
注:アガロースが完全に溶解すると、溶液は半透明になります。使用前に溶液を65〜75°Cに冷却してください。 - カットした 1,000 μL のピペットチップを使用して、300 ~ 400 μL のアガロース溶液を 25 mm x 25 mm のガラスカバースリップにピペットで送ります。手袋をはめた指でカバースリップの端を持ちながら、別の1,000 μLのピペットチップを使用して、溶けたアガロースをカバースリップ全体に均等に広げます。
注:アガロースを65~75°Cに維持すると、カバースリップ表面に効率的に広がることができます。 - アガロースコーティングされたカバースリップを37°Cのインキュベーターで少なくとも2時間乾燥させ、その時点でアガロースが透明になります。アガロースコーティング面を上向きにして、糸くずの出ない紙やワックス系フィルムなどの清潔な面に室温(RT)で置き、カバースリップを保管します。
- 250 mL 三角フラスコ内の 100 mL の脱イオン水に 1 g のアガロースを混合して、1% w/v 溶液を調製します。標準的なマイクロ波を使用して、アガロース溶液を1〜2分間加熱します。
- 脂質製剤
- クロロホルムに溶解した脂質を-20°Cの冷凍庫から取り出し、RTに達するまで化学ヒュームフードに入れます。
- 製剤化に必要な各成分脂質の脂質ストックの体積を下記式を用いて計算する:
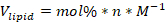
ここで、V脂質は使用する脂質の体積であり、モル%は脂質成分のモル百分率であり、nは製剤に使用される脂質の総モル数であり、Mはモル単位における脂質の濃度である。
注:例えば、原液濃度12.72mMの45モル%の1,2-ジオレオイル-sn-グリセロ-3-ホスホコリン(DOPC)および製剤中の総脂質1マイクロモルを含む製剤を使用する場合、製剤に使用されるDOPCストックの体積は、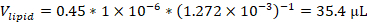
- 化学ヒュームフード内のガラスバイアル中で計算された比率で脂質を一緒に混合する。
- 脂質溶液30 μLのピペットを、製剤の飽和脂質成分の融点以上に設定された予熱ホットプレート上のアガロースコーティングカバーグラス上に(例えば、40°CのTmを有する脂質用の50°Cホットプレート)。
- クロロホルムが蒸発し、脂質の均一な層が形成されるまで、18G針の長い縁を使用して、アガロース膜全体に円運動で溶液を広げる。このステップを実行する間、手袋をはめた指でカバースリップの端を持ちます。
注:針でアガロース層を傷つけないように注意する必要があります。 - アルミ箔で覆われたシャーレにアガロース層と脂質膜の入ったカバースリップを置き、フィルム側を上向きにし、シャーレを真空デシケーターに2時間以上入れて残留溶媒を除去した。
- その間、1.92gのスクロースと10mLの脱イオン水を混合して560mMのスクロース溶液を調製する。
注:スクロース溶液の濃度は、GUVsが希釈される緩衝液の浸透圧に依存する。典型的には、スクロース溶液の浸透圧は、GUVが希釈される緩衝液、特に運動性緩衝液よりも10%大きくてはならない(ステップ3.11を参照のこと)。 - GUVフォーメーション
- 脂質フィルムが上を向いた状態で接着チャンバを脂質コーティングされたカバースリップに穏やかに押し付けることによって、脂質フィルムでコーティングされたカバースリップに接着チャンバを接着し、タイトなシールが形成されるようにする。
- 400 μLの560 mMスクロース溶液(ステップ2.3で調製)をチャンバーに加える。
- カバースリップを湿度室に置き、蓋を閉めます。
- 製剤の飽和脂質成分の融点以上に設定された予熱ホットプレート上に湿度チャンバーを置く。
- 回復前に小胞を≥1時間形成させる。
注:小胞の形成は、40倍の対物レンズを備えた蛍光顕微鏡で確認することができます。
3. 運動性アッセイストックおよび試薬の調製
- カゼインストックの準備
- 50mLの円錐形遠心管に3gの乾燥カゼインを加え、次いで30mLの1x BRB80を加え、溶液が粘性になるまで回転させる。チューブを15,000 x g で30分間遠心分離します。
- 上清を別の50mL円錐形遠沈管に移し、ペレットを廃棄する。溶液を1μmのシリンジフィルターでろ過し、溶液を50mLの円錐形バイアルに集める。溶液を0.2 μmフィルターでろ過し、溶液を50 mLの円錐形バイアルに集めます。
- UV-Vis分光光度計および石英キュベットを用いて280nmにおける吸光度を測定することによりタンパク質濃度を求める。
- カゼイン濃度を mg/mL 単位で計算するには、以下の式を使用します。
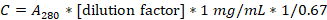
- 溶液を1x BRB80で20 mg/mLに希釈し、100 μLのアリコートに分割し、-20 °Cで保存します。
- グルコースオキシダーゼ2mgを1mLの1x BRB80と混合して、グルコースオキシダーゼ(2mg/mL)原液を調製する。100 μLのアリコートに分け、-20°Cで保存します。
- カタラーゼ0.8mgと1mLの1x BRB80を混合してカタラーゼ(0.8mg/mL)原液を調製する。100 μLのアリコートに分け、-20°Cで保存します。
- 1mLの脱イオン水に0.3gのD-グルコースを懸濁して2 Mグルコース溶液を調製する。100 μLのアリコートに分け、-20°Cで保存します。
- 1 mL の脱イオン水に 0.015 g の DTT を懸濁して、100 mM DTT ストックを調製します。100 μLのアリコートに分け、-20°Cで保存します。
- 0.055 g の ATP 二ナトリウムを 100 mM MgCl2 の 1 mL 溶液に懸濁することにより、100 mM Mg-ATP ストックを調製します。100 μLのアリコートに分け、-20°Cで保存します。
- 100 mM MgCl2 の 1 mL 溶液に 0.055 g の AMP-PNP を懸濁して 100 mM Mg-AMP-PNP 溶液を調製し、100 μL のアリコートに分割して -20 °C で保存します。
- メタノール1mLにトロロックス25.03mgを加えて100mMトロロックス溶液を調製し、-20°Cで保存する。
- BRB80 100 μL にストレプトアビジン 1 mg を加えてストレプトアビジン溶液 10 mg/mL を調製し、2 μL アリコートに分割して -80ۛ °C で保存します。
- BRB90CATは、BRB80の5倍量200 μL、カゼイン溶液20 μL、MgATP溶液10 μL、トロロックス10 μL、パクリタキセル溶液5 μL、DI水765 μLを混合して調製する。4°Cで保存する。
- BRB80CAT192 μL、D-グルコース溶液2 μL、グルコースオキシダーゼ溶液2 μL、DTT溶液2 μL、カタラーゼ溶液2 μLを混合して運動性溶液を調製した。4°Cで保存する。
- 原液のキネシン溶液をBRB80CATで希釈して1 μMキネシン溶液を調製し(例えば、BRB80CATの98 μLに2 μLの50 mMキネシン溶液を2 μL)、4°Cで保存する。
- 安定化微小管10 μLを室温BRB80CATの90 μLに希釈して、10 μg/mLの微小管溶液を調製する。RTで保存してください。
- 99.9 μLの運動性溶液に10 mg/mLストレプトアビジン溶液を0.1 μL加えて、10 μg/mLストレプトアビジン溶液を調製する。4°Cで保存する。
- 5 μL の GUV ストックを 55 μL の運動性溶液に希釈して、12x GUV 溶液を調製します。4°Cで保存する。
- チューブリンの微小管への重合
- 予め調製した2μLのチューブリンアリコートを-80°Cの冷凍庫(ステップ1.5で調製)から回収し、37°Cの水浴中に30分間入れる。
- 1 mLの無水DMSOに1.71 mgのパクリタキセルを加えて2 mM パクリタキセル溶液を調製し、10 μLのアリコートに分割し、-20°Cで保存する。
- 99.5 μL の 1x BRB80 と 0.5 μL の 2 mM パクリタキセルを混合して、BRB80T を新たに調製します。 100 μLのBRB80Tをウォーターバスで37°Cに温めます。
- 30分後、100μLのBRB80Tをチューブリンアリコートに添加して微小管を安定化させた。RTで保存してください。
滑空運動性アッセイ(GMA)
- スライドガラスに5mmで区切られた両面テープを2枚貼り付けてフローチャンバーを作製する。3 層のテープが各ストリップを構成するまで、このプロセスを繰り返します。
- カバースリップをテープの上に置き、ピンセットまたはペンでカバースリップ/テープのインターフェースを軽く押し下げて、十分な接着力を確保します。
メモ: チャネルは、幅 5 mm、長さ 25 mm、高さ 300 mm にする必要があります。 - 30 μLの1 mmキネシン溶液(ステップ3.12で調製)をフローセルにピペットで入れ、5分間インキュベートさせた。
注:カゼインは、カバースリップ/スライドガラスの表面に二重層を形成し、キネシンテールの表面への取り付けを容易にします。 - 10 μg/mL 微小管溶液 (ステップ 3.13 で調製) のピペット 30 μL をフローセルに入れ、ラボ用ワイプを使用して流路の反対側の端に優しく押し付けて、溶液交換を容易にします。5分間インキュベートする。
- フローセルをRTで1x運動性溶液(ステップ3.11で調製)で1x~3x洗浄します。
注:この時点で、40倍の空気対物レンズを使用した蛍光顕微鏡を使用して、微小管の付着と運動性を確認することができます。微小管は、蛍光フィラメント(長さ数十ミクロン)として現れ、表面を横切って約0.5μm/sで移動(滑空)します(図1)。 - 10 μg/mL ストレプトアビジン溶液 (ステップ 3.14 で調製) のピペット 30 μL をフローセルに挿入し、ラボ用ワイプを使用して流路の反対側の端に優しく押し付けて、溶液交換を容易にします。10分間インキュベートする。
- 溶液交換を容易にするために、12x GUV溶液(ステップ3.15で調製)の30μLを、流路の反対側の端に穏やかに押し付けた実験室用ワイプを用いて流れに流す。30分間インキュベートする。
- 2 μL の 100 mM AMP-PNP 溶液 (ステップ 3.7 で調製) を加えて運動性を停止し、チャンバーをシーラントで密封します。
5. LNTネットワークの特性評価
- フローチャンバを倒立顕微鏡に移してイメージングします。
- 使用する蛍光脂質またはチューブリンの波長に基づいて適切なフィルターセットを選択します。例えば、テキサスレッド標識脂質を使用する場合は、560nm/25nm励起フィルターと607nm/36nm発光フィルターを使用してください。
- 100x オイル対物レンズを使用して、カバースリップの表面に焦点を合わせます。
- 蛍光顕微鏡を用いてLNTネットワークを画像化する。
注:LNTは、より大きな小胞から押し出された線形構造です。LNTはGUVよりもはるかに小さく、蛍光シグナルが弱い。したがって、露出とコントラストは、画像LNTに応じて調整する必要があります。これらの調整はGUVの過剰暴露にもつながるため、GUVのラメラ性と相分離を独立して特徴付けることが推奨されます。 - 目的のネットワークに顕微鏡を集中させ、標準画像またはタイル画像を撮影します。
- 露光時間とニュートラル濃度フィルタを調整してLNTを撮像し、GUVの飽和露光量を最小限に抑えます。赤チャンネルと緑チャンネルの両方で画像を取得します。
注:ここでは、赤チャネルはテキサス - レッド脂質の視覚化を可能にし、緑色チャネルは微小管(例えば、オレゴングリーン脂質およびHiLyte488色素)の視覚化を可能にする。 - 赤と緑のチャンネルを重ね合わせて合成画像を作成します(図1)。
- LNTの長さ測定によるLNTネットワークの特性評価
- ImageJなどの画像解析ソフトで取得した画像を開きます。
- セットスケール機能を使用して顕微鏡のスケールを較正し、ピクセルをmm変換係数に塗りつぶして、「 OK」をクリックします。
注:変換係数は顕微鏡、対物レンズ、およびカメラに依存し、顕微鏡校正スライドを使用して取得できます。通常はピクセル/mm で表されます。 - マルチポイントラインツールを使用して、親GUVから始まるナノチューブの長さを測定します。Ctrl + M キーを押しながら長さを測定します。
- 上記の手順に従って、個々のチューブの長さの測定を続けます。画像処理ツールは、新しい各測定値を結果ウィンドウに保存します。
- 各線を引いた後に Ctrl + D を押したままにして、どのチューブが測定されたかを追跡します。
- LNT厚さの測定(図2)
- ImageJ で画像を開き、[画像] タブで [しきい値] 機能を選択します。
- 「適用」をクリックしてしきい値を適用します。
- 目的のチューブの上に既知の長さの四角形を描画します (黒いピクセルの値は 0、赤いピクセルの値は 255 です)。
- 面積の積分密度を測定します。
- 密度をLNTの長さ(ピクセル単位)で除算して、厚さ(ピクセル単位)を求めます。
メモ:厚さの測定値は、イメージング設定としきい値が同じように設定されている場合にのみ、画像間で比較できます。
- LNTのノードにおける脂質分配の決定(図3)
- ImageJ で画像を開きます。
- 線ツールを使用して、目的のノードに 線 を描画します。
- オレゴングリーンチャンネルとテキサスレッドチャンネルの両方でノード強度を測定します。
- ラインをLNTに移動し、オレゴングリーンチャンネルとテキサスレッドチャンネルの両方でLNT強度を測定します。
Access restricted. Please log in or start a trial to view this content.
結果
LNTネットワーク(図4)は、微小管のキネシン輸送によって実行される作業を使用して、GUVからLNTを押し出すために記載されたプロトコルを使用して製造されました。簡単に説明すると、GUVsは、スクロース溶液を用いたアガロースゲル再水和を用いて調製され、微小管は、GPEM溶液中で重合され、BRB80T中で安定化された。次に、キネシンモータをフローセルに導入し、カバ?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
LNTネットワークは、膜特性および膜貫通タンパク質などの生体分子の輸送に対するin vitro研究のための有用なツールである。さらに、複合脂質製剤を使用してLNTネットワークを製造することで、より生物学的に関連する研究が可能になります。他の作製研究は、1)単純な脂質製剤および多層状小胞、または2)複雑な脂質製剤からなるGUVからネットワークを作製するために、より厄介な運動性技?...
Access restricted. Please log in or start a trial to view this content.
開示事項
サンディア国立研究所は、米国DOEの国家核セキュリティ局(DE-NA-0003525)の契約に基づき、ハネウェル・インターナショナルの完全子会社であるサンディアLLCのナショナル・テクノロジー&エンジニアリング・ソリューションズが管理・運営するマルチミッション研究所です。このホワイトペーパーでは、客観的な技術的結果と分析について説明します。この論文で表明される可能性のある主観的な見解や意見は、必ずしも米国エネルギー省または米国政府の見解を表すものではありません。
謝辞
この研究は、米国エネルギー省基礎エネルギー科学局、材料科学工学部(BES-MSE)の支援を受けた。キネシン合成と蛍光顕微鏡は、米国エネルギー省(DOE)科学局のために運営されている科学局のユーザー施設である統合ナノテクノロジーセンターのユーザープロジェクト(ZIM)を通じて実施されました。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 100x/1.4 Numerical Aperture Oil Immersion Objective | Olympus | 1-U2B836 | Olympus UPlanSApo 100x/1.40 Oil Objective Infinity Corrected, RMS Thread Working Distance 0.12mm |
| 3.0 ND Filter | Olympus | Neutral Density Filter | |
| AMP-PNP | Sigma-Aldrich | A2647 | (β,γ-imidoadenosine 5′-triphosphate) |
| ATP | Sigma-Aldrich | A7699 | Adenosine 5'-triphosphate disodium salt hydrate BioXtra |
| Brightline Pinkel DA/FI/TR/Cy5/Cy7-5X-A000 filter set | Semrock | LED-DA/FI/TR/Cy5/Cy7-5X-A-000 | BrightLine Pinkel filter set, optimized for DAPI, FITC, TRITC, Cy5 & Cy7 and other like fluorophores, illuminated with LED-based light sources |
| Casein | Sigma-Aldrich | 22090 | Casein hydrolysate for microbiology |
| Catalase | Sigma-Aldrich | C9322 | Catalase from Bovine Liver |
| Chloroform | Sigma-Aldrich | 288306 | Chloroform anhydrous contains 0.5-1.0% ethanol as stabilizer |
| Cholesterol | Avanti | 700000P | cholesterol (ovine wool, >98%) (powder) |
| D-Glucose | Sigma-Aldrich | G7021 | D-(+)-Glucose powder, BioReagent, suitable for cell culture, suitable for insect cell culture, suitable for plant cell culture, ≥99.5% |
| DOPC | Avanti | 850375C | 1,2-Dioleoyl-sn-glycero-3-phosphocholine (in chloroform) |
| DOPE-Biotin | Avanti | 870282C | 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(biotinyl) (sodium salt) |
| DPPC | Avanti | 850355P | 1,2-dipalmitoyl-sn-glycero-3-phosphocholine (powder) |
| DPPE-Biotin | Avanti | 870285P | 1,2-dipalmitoyl-sn-glycero-3-phosphoethanolamine-N-(biotinyl) (sodium salt) |
| DTT | Sigma-Aldrich | 43816 | DL-Dithiothreitol solution 1 M |
| EGTA | Sigma-Aldrich | E4378 | EGTA, Egtazic acid, Ethylene-bis(oxyethylenenitrilo)tetraacetic acid, Glycol ether diamine tetraacetic acid |
| Glucose Oxidase | Sigma-Aldrich | G6125 | Glucose Oxidase from Aspergillus niger Type II, ≥10,000 units/g solid (without added oxygen) |
| Glycerol | Fisher | G33 | Glycerol (Certified ACS), Fisher Chemical |
| GTP | Sigma-Aldrich | G8877 | Guanosine 5′-triphosphate sodium salt hydrate |
| IX-81 Olympus Microscope | Olympus | N/A | IX81 Inverted Microscope from Olympus |
| KOH | Sigma-Aldrich | 1050121000 | Potassium Hydroxide |
| Magnesium Chloride | Sigma-Aldrich | M1028 | 1.00 M magnesium chloride solution |
| Orca Flash 4.0 Digital Camera | Hamamatsu | C13440-20CU | ORCA-Flash 4.0 V3 Digital CMOS camera |
| Oregon Green-DHPE | Invitrogen | O12650 | Oregon Green 488 1,2-Dihexadecanoyl-sn-Glycero-3-Phosphoethanolamine |
| Paclitaxel | ThermoFisher | P3456 | Paclitaxel (Taxol Equivalent) - for use in research only |
| PIPES | Sigma-Aldrich | P6757 | 1,4-Piperazinediethanesulfonic acid, Piperazine-1,4-bis(2-ethanesulfonic acid), Piperazine-N,N′-bis(2-ethanesulfonic acid) |
| Texas Red-DHPE | Invitrogen | T1395MP | Texas Red 1,2-Dihexadecanoyl-sn-Glycero-3-Phosphoethanolamine, Triethylammonium Salt |
| Trolox | Sigma-Aldrich | 238813 | (±)-6-Hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid |
| Tubulin, Biotin | Cytoskeleton | T333P | Tubulin protein (biotin) porcine brain |
| Tubulin, Hy-Lite 488 | Cytoskeleton | TL488M | Tubulin protein (fluorescent HiLyte 488) porcine brain |
| Tubulin, Unlabeled | Cytoskeleton | T240 | Tubulin protein porcine brain |
参考文献
- Bouxsein, N. F., Carroll-Portillo, A., Bachand, M., Sasaki, D. Y., Bachand, G. D. A continuous network of lipid nanotubes fabricated from the gliding motility of kinesin powered microtubule filaments. Langmuir. 29 (9), 2992-2999 (2013).
- Paxton, W. F., Bouxsein, N. F., Henderson, I. M., Gomez, A., Bachand, G. D. Dynamic assembly of polymer nanotube networks via kinesin powered microtubule filaments. Nanoscale. 7 (25), 10998-11004 (2015).
- Leduc, C., et al. Cooperative extraction of membrane nanotubes by molecular motors. Proceedings of the National Academy of Sciences of the United States of America. 101 (49), 17096-17101 (2004).
- Lippincott-Schwartz, J., Roberts, T. H., Hirschberg, K. Secretory protein trafficking and organelle dynamics in living cells. Annual Review of Cell and Developmental Biology. 16, 557-589 (2000).
- Belting, M., Wittrup, A. Nanotubes, exosomes, and nucleic acid-binding peptides provide novel mechanisms of intercellular communication in eukaryotic cells: implications in health and disease. Journal of Cell Biology. 183 (7), 1187-1191 (2008).
- Rustom, A., Saffrich, R., Markovic, I., Walther, P., Gerdes, H. H. Nanotubular highways for intercellular organelle transport. Science. 303 (5660), 1007-1010 (2004).
- Onfelt, B., Nedvetzki, S., Yanagi, K., Davis, D. M. Cutting edge: Membrane nanotubes connect immune cells. Journal of Immunology. 173 (3), 1511-1513 (2004).
- Sciaky, N., et al. Golgi tubule traffic and the effects of brefeldin A visualized in living cells. J Cell Biol. 139 (5), 1137-1155 (1997).
- Sprong, H., van der Sluijs, P., van Meer, G. How proteins move lipids and lipids move proteins. Nature Reviews Molecular Cell Biology. 2 (7), 504-513 (2001).
- Keenan, T. W., Morre, D. J. Phospholipid class and fatty acid composition of golgi apparatus isolated from rat liver and comparison with other cell fractions. Biochemistry. 9 (1), 19-25 (1970).
- Imam, Z. I., Bachand, G. D. Multicomponent and Multiphase Lipid Nanotubes Formed by Gliding Microtubule-Kinesin Motility and Phase-Separated Giant Unilamellar Vesicles. Langmuir. 35 (49), 16281-16289 (2019).
- Wesolowska, O., Michalak, K., Maniewska, J., Hendrich, A. B. Giant unilamellar vesicles - a perfect tool to visualize phase separation and lipid rafts in model systems. Acta Biochimica Polonica. 56 (1), 33-39 (2009).
- Momin, N., et al. Designing lipids for selective partitioning into liquid ordered membrane domains. Soft Matter. 11 (16), 3241-3250 (2015).
- Fygenson, D. K., Braun, E., Libchaber, A. Phase diagram of microtubules. Physical Review E. 50, 1579(1994).
- Greene, A. C., Sasaki, D. Y., Bachand, G. D. Forming Giant-sized Polymersomes Using Gel-assisted Rehydration. Journal of Visualized Experiments. (111), (2016).
- Bachand, M., et al. Directed self-assembly of 1D microtubule nano-arrays. Royal Society of Chemistry Advances. 4 (97), 54641-54649 (2014).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved