Method Article
בידוד ותרבות בו זמנית של מיוציטים פרך, מיוציטים חדריים, ולא מיוציטים מלב עכבר בוגר
In This Article
Summary
שיטה מתוארת לבידוד בו זמנית של מיוציטים ולא מיוציטים הן מהאטיה והן מחדרי הלב של עכבר בוגר יחיד. פרוטוקול זה מביא לתשואות עקביות של מיוציטים לבביים ברי קיימא מאוד ולא מיוציטים ומפרט תנאי תרבות אופטימליים ספציפיים לתאים עבור פנוטיפים וניתוח במבחנה.
Abstract
הבידוד והפולחן של מיוציטים לבביים מעכברים היו חיוניים לקידום ההבנה של פיזיולוגיה לבבית ופתופיזיולוגיה. בעוד בידוד מיוציטים מלבבות עכבר יילודים הוא פשוט יחסית, מיוציטים מהלב המורין הבוגר הם המועדפים. הסיבה לכך היא כי בהשוואה לתאי יילודים, מיוציטים בוגרים מדויק יותר recapitulate תפקוד התא כפי שהוא מתרחש בלב הבוגר vivo. עם זאת, מבחינה טכנית קשה לבודד מיוציטים לב עכבר בוגר בכמויות הדרושות ואת הכדאיות, אשר תורם למבוי סתום ניסיוני. יתר על כן, נהלים שפורסמו הם ספציפיים לבידוד של מיוציטים פרוזדוריים או חדריים על חשבון תאים פרוזדוריים חדריים שאינם מיוציטים. המתוארת כאן היא שיטה מפורטת לבידוד מיוציטים לבביים הן דרך האשורית והן החדרית, יחד עם מיוציטים לא-מיוציטים בין-מסלוליים חדריים, בו זמנית מלב עכבר יחיד. כמו כן מסופקים הפרטים עבור שיטות culturing תא ספציפי אופטימלי, אשר לשפר את הכדאיות של התא ותפקוד. פרוטוקול זה נועד לא רק לזרז את התהליך של בידוד תאי לב מורין למבוגרים, אלא גם כדי להגדיל את התשואה ואת הכדאיות של תאים לחקירות של תאי לב פרוזדוריים חדריים.
Introduction
תרבות התאים העיקרית היא משאב אינטגרלי המציע סביבה מבוקרת למחקרים מכניסטיים מפורטים של תפקוד מיוציטים לבביים. בשל האופי העמיד יותר שלהם וקלות הבידוד, ארוסת עכברוש יילודים ומיוציטים חדריים היו המקור המשותף לתרביות תאים כאלה1. עם זאת, מיוציטים של עכברים בוגרים חדריים (AMAMs ו- AMVMs) רצויים מאוד למחקרים במבחנה, מכיוון שהמאפיינים המולקולריים והתפקודיים שלהם מחקים טוב יותר את אלה של תאי לב בוגרים. לכן, הם הפכו רלוונטיים למחקרים הקשורים פתולוגיות לב, שרובם מתפתחים אצל מבוגרים2.
יתר על כן, הזמינות והשימוש במודלים של עכברים מהונדסים ומחלות מרחיבים את התועלת של מיוציטים לבביים בוגרים מבודדים. פרוטוקולים לבידוד ותרבות העכבר AMVMs למחקרים קצרי טווח וארוכי טווח תוארו בפרסומים קודמים רבים2,3,4,5,6,7,8,9,10,11. לשם השוואה, פרוטוקולים מעטים תוארו לבידוד של AMAMs. יתר על כן, אלה המתוארים מותאמים בעיקר למחקרים חריפים של תאים מבודדים טריים, ללא פרוטוקול culturing לטווח ארוך המתואר עד כה11,12,13. ככזה, פרוטוקולי בידוד AMAM לא נועדו לספק את השירות ואת צדדיות של פרוטוקולים שפורסמו עבור הבידוד והתרבות של AMVMs. יתר על כן, בעוד המחקרים החלוציים לבידוד של AMAMs ו- AMVMs הוכיחו תושייה, אין פרוטוקולים לבידוד ותרבות אופטימליים בו זמנית של AMAMs ו- AMVMs, מה שמוביל לשימוש יעיל בלב כולו לכל הכנה.
עד כה, פרוטוקולי בידוד AMAM ו- AMVM שפורסמו לא תוכננו לבידוד בו זמנית של שני סוגי התאים, מכיוון שלרוב המחקרים על תפקוד פרוזדור וחדר יש מיקוד ספציפי לתא. לדוגמה, AMAMs משמשים בעיקר כדי ללמוד אלקטרופיזיולוגיה מיוציטים פרוזדורים, בין היתר בגלל העניין פרפור פרוזדורים (AF), הפרעות קצב הלב הנפוצות ביותר בארה"ב. עם זאת, AF אינה מחלה המשפיעה על atria בבידוד, וזה כבר מעורב כבעל תפקיד סיבתי קל עד חמור תפקוד לקוי של החדר השמאלי14. יתר על כן, אלקטרוקרדיוגרמות מחולים עם אי ספיקת לב עם שבר פליטה משומר (HFpEF) הוכיחו כי גודל האבסורד השמאלי הוא אחד המנבאים החזקים ביותר עבור רגישות לאי ספיקת לב15.
בנוסף לתפקידו באלקטרופיזיולוגיה והתכווצות, האטריום הוא גם איבר אנדוקריני, מפריש קרדיוקינים (כלומר, פפטיד נטריורי פרוזדורי [ANP]) המווסת באופן הומיאוסטטי את לחץ הדם ואת נפח16,17. יתר על כן, ANP (ככל הנראה מ myocytes אבריאלי) יש תפקיד מגן בולט אנטי היפרטרופי מיוציטים חדריים16,17. אמנם יש השלכה חזקה של תקשורת נוירוהורמונלית בין atria ו ventricles במצבי מחלה שונים, המנגנונים שבבסיס תקשורת זו לא נחקרו במלואם. נקודה זו באה לידי ביטוי עוד יותר על ידי גל המחקר המתמקד 1) התפקיד של שאינם מיוציטים (במיוחד fibroblasts לב ותאי החיסון) בלב החולה ו 2) איך שיפוץ לב כפונקציה של מחלה משפיע ישירות על הכדאיות מיוציטים לב ותפקוד לב גלובלי18,19,20,21,22. לכן, לימוד תאי לב הן atria והן חדרים היא גישה הכרחית כדי לקבל תמונה מלאה יותר של תפקידם פתופיזיולוגיה לב.
הפרוטוקול הבא מתאר את הבידוד הסימולטני של מיוציטים ובלתי מיוציטים בין-חדריים ולא מיוציטים מלב עכבר יחיד בתנאים פיזיולוגיים ופתופיזיולוגיים. בנוסף, שיטה זו היא הראשונה לתאר את התנאים האופטימליים הדרושים לשמירה על תרבויות של מיוציטים לב פרך, כמו תנאים לשמירה על תרבויות של מיוציטים חדריים כבר פורסמו.
Protocol
כל המחקרים שבוצעו על עכברים שדווחו במאמר זה נבדקו ואושרו על ידי ועדת הטיפול והשימוש בבעלי חיים מוסדית של SDSU והיא תואמת את המדריך לטיפול ושימוש בחיות מעבדה שפורסם על ידי מועצת המחקר הלאומית.
1. הכנת תקשורת בידוד ותרבות וציפוי
- הכן 1 L של מדיה זלוף הלב לפני השימוש על ידי הוספת Joklik שונה מדיה חיונית מינימלית (MMEM) ל 1 L של מים סטריליים. כוונן את ה- pH ל- 7.36 עם 10 N NaOH ולאחר מכן סנן באמצעות מסנן של 0.2 מיקרומטר ואחסן ב- 4 °C (60 °F) למשך עד שבועיים.
הערה: יוקליק MMEM מורכב 112 mM NaCl, 5.4 mM KCl, 1 mM MgCl2, 9 מ"מ NaH2PO4, ו 11.1 מ"מ D-גלוקוז. זה בתוספת 10 mM HEPES (2.38 גרם / L), 30 mM טאורין (3.75 גרם / L), 2 מ"מ D-l-קרניטין (0.4 גרם / L), 2 קריאטין מ"מ, ו 10 mM בוטנדיונה monoxime (1.01 גרם / L). - הכן מאגר עיכול ממש לפני זלוף, כדלקמן: תוספת 50 מ"ל של מדיה זלוף הלב עם 6.25 μL של 100 mM CaCl2 (ראה שלב 1.3) וקולאז'נים מסוג 2 (פעילות אנזימטית ~ 310–320 U /mg dw).
הערה: לשקול את החיה לפני ההקרבה. כמות הקולגנאז מסוג 2 בתוספת מאגר העיכול מוכתבת על ידי משקל החיה (2.25 מ"ג קולגנאז מסוג 2 לכל 1 גרם משקל גוף). - כדי להכין 100 mM CaCl2, להוסיף 1.47 גרם של CaCl2 כדי 100 מ"ל של מים כיתה ביולוגיה מולקולרית. מערבבים עד להמסה, ואז עוברים דרך מסנן 0.2 מיקרומטר ומאחסנים בטמפרטורת החדר עד חודשיים.
- הכן myocyte עצירת מאגר 1 על ידי שכשהם 90 מ"ל של מאגר זלוף לב עם 10 מ"ל של סרום שור עוברי (FBS) ו 125 μL של 100 מ"מ CaCl2. לעבור דרך מסנן 0.2 מיקרומטר ולאחסן ב 4 מעלות צלזיוס עד 2 שבועות.
- הכן מאגר עצירת מיוציטים 2 על ידי השלמת 114 מ"ל של מאגר זלוף לב עם 6 מ"ל של FBS ו 150 μL של 10 mM CaCl2. לעבור דרך מסנן 0.2 מיקרומטר ולאחסן ב 4 מעלות צלזיוס עד 2 שבועות.
- הכן מדיום ציפוי מיוציטים פרוזדורי ממש לפני זלוף על ידי השלמת 95 מ"ל של מדיום הנשר שונה של Dulbecco (DMEM) עם 4 מ"ל של FBS, 1 מ"ל של עט 100x / סטרפטק-גלוטמין, 1 מ"ל של 100x אינסולין-transferin-סלניום, ו 1 מ"ל של 10 מיקרוגרם dexamasone. לעבור דרך מסנן 0.2 מיקרומטר ולאחסן ב 37 מעלות צלזיוס עד ציפוי.
- הכן בינוני ציפוי מיוציטים חדריים על ידי השלמת 95 מ"ל של מדיום חיוני מינימלי (MEM) עם 4 מ"ל של FBS, 1 מ"ל של עט 100x / סטרפטוקומגנטין, 10 מ"ל של 1 פתרון M HEPES, 1 מ"ל של 100x העברת אינסולין-סלניום, ו 0.1 גרם של monoxi butanedione. לעבור דרך מסנן 0.2 מיקרומטר ולאחסן ב 4 מעלות צלזיוס עד 2 שבועות.
- הכן מיוציטים חדריים שמירה על בינוני על ידי שכשהם 99 מ"ל של MEM עם 1 מ"ל של 100x אינסולין-transferin-סלניום, 0.1 מ"ג / מ"ל סרום סרום אלבומין (BSA), 10 מ"ל של 1 M HEPES פתרון ו 1 מ"ל של 100x עט / סטרפטוקוקוס גלוטמין. לעבור דרך מסנן 0.2 מיקרומטר ולאחסן ב 4 מעלות צלזיוס עד 2 שבועות.
- כדי להכין צלחות ושקופיות ניסיוניות מצופות למין, להפשיר את פתרון מלאי למין העכבר (1.19 מ"ג / מ"ל). הוסף 10 μL של פתרון מלאי למין לכל 1 מ"ל של DMEM, ומערבבים. מעיל צלחות ניסיוניות מגלשות באופן שווה ולאחסן 37 °C (77 °F), 5% CO2 חממה לפחות 1 שעה לפני זלוף כדי לאפשר שיווי משקל.
הערה: ניתן לאחסן לוחות ושקופיות ניסיוניים מצופים ב-4 מעלות צלזיוס למשך יומיים לכל כך הרבה זמן.
2. מנגנון בידוד
- לפני כל בידוד, לנקות את הצינור ורכיבים אחרים של המערכת עם שלוש שטיפות מלאות של 70% EtOH על ידי מילוי מלכודת הבועה לחלק העליון (לסגור את העצירה התחתונה ולשמור על stopcock העליון פתוח).
- לשטוף את המערכת המלאה 3x עם סטרילי H 2 O על ידי מילוימלכודתהבועה לחלק העליון (לסגור את stopcock התחתון ולשמור על stopcock העליון פתוח).
- יש לשטוף את המערכת המלאה במאגר זלוף לב ולמלא את מלכודת הבועה באמצע הדרך במדיה.
- הגדר את אמבט המים במחזור ל 37 מעלות צלזיוס.
- הגדר אמבט מים למדיה עד 37 מעלות צלזיוס.
- הסר את כל בועות האוויר בצינורות המשאבה peristaltic.
- התאם את קצב הזרימה של המשאבה הדיסטלטית ל-3 מ"ל/דקה.
3. הליך כירורגי (אי הישרדות)
- משרים מכשירים כירורגיים ב-70% EtOH למשך 5 דקות לפחות.
- מניחים את מדיית זלוף הלב, מאגרי עצירת מיוציטים ומאגר עיכול באמבט המים של 37 מעלות צלזיוס.
- מניחים את ציפוי מיוציטים atrial בינוני, בינוני מיוציטים חדריים ציפוי בינוני, ומיוציטים חדריים שמירה על בינוני ב 37 °C (70 °F), 5% CO2 אינקובטור 1 שעות לפני השימוש ולשחרר את הכובעים כדי לאפשר שיווי משקל.
- להזריק 10 שבועות זכר או נקבה C57b6/j עכברים תוך-אופן (i.p.) עם 0.35 מ"ל של הפרין, מדולל מלוחים אגירת פוספט (PBS) ל 100 IU / mL. אפשר לתרופה להיכנס לתוקף במשך כ -10 דקות.
הערה: אם יש לחשוף שני לבבות להליך בידוד זה, העכבר השני יכול להיות מורדם ומנוהל הפרין בשלב זה של ההליך הראשון. כדי למזער את הלחץ על החיה, הרדמה קלה יכולה להינתן באמצעות 2% isoflurane / תערובת חמצן בתא אינדוקציה אטום הרמטית. - להרדים את החיה עם 2% isoflurane / תערובת חמצן ולהזריק i.p. עם pentobarbital (0.3 מ"ל מ 10 מ"ג / מ"ל מלאי), ולאחר מכן להכין את החזה על ידי ניקוי עם 70% EtOH.
- הכינו תפר משי קשור 5-0 כדי להיות מוכנים להעביר את הלב לקנולה של זלוף. הר קנולה ממש ליד מיקרוסקופ כירורגי.
- פתח במהירות את החזה על ידי ביצוע חתך בעור קו האמצע, מאמצע הבטן ללסת, ולאחר מכן נכנס הצפק עם המספריים הגדולים, ניקוי הסרעפת משם על ידי ניתוח בוטה. לאחר מכן, חותכים את כלוב הצלעות באמצעות המספריים עם חתכים את דופן החזה על ההיבט הצדדי של שני הצדדים.
- לצלוח קשרים סיביים בין הלב לקיר החזה (כולל התימוס). ואז, לחתוך את כלוב הצלעות כולם ביחד. באמצעות מלקחיים ומספריים קטנים, בעדינות להרים את הלב על ידי השיא ולחשוף את ההיבט האחורי של הלב.
- explant את הלב על ידי ניתוח נחות מיד את העורק המציין על אב העורקים העולה ומיד למקם את הלב PBS קר כקרח או מדיה זלוף לב קר. לאחר מכן, לנתח במהירות את הרקמה שנותרה מהלב המחושב בתקשורת זלוף לב קר כקרח, חושף את העורקים העולים.
הערה: כדאי להסבר את הלב עם התימוס שלם לשימוש כציון דרך אנטומי. - נקה את האזור המקיף את העורקים של רקמות עודפות באמצעות מלקחיים ומספריים זעירים. מקם את העורקים על הצינורית באמצעות מלקחיים עדינים ומאובטח עם תפר משי 5-0.
הערה: המיקום הטוב ביותר מתרחש בדרך כלל עם סיומת הארכת כ 2 מ"מ על הצינורית. - לחלחל הלב cannulated עם מדיה זלוף הלב בקצב זרימה של 3 מ"ל / דקה במשך 4 דקות. לאחר מכן העבירו את המדיה ממדיית זלוף הלב למאגר עיכול למשך 15.0-17.5 דקות של זלוף (איור 1A).
הערה: קצב הזרימה כלילית צפוי לעלות, מה שמצביע על עיכול רקמות יעיל (כלומר, לב חיוור ונפוח). - לאסוף 8 מ"ל של זרימת חיץ העיכול דרך במהלך הדקות האחרונות של זלוף לשימוש מאוחר יותר בשלב 5.4.
- מוציאים את הלב מהקנולה ומניחים אותו על צלחת תרבית פלסטיק 60 מ"מ. הסר רקמה עודפת (כלומר, אבי העורקים, הוורידים) והטביע את הלב ב 2.5 מ"ל של מאגר עיכול כהכנה להפרדה מכנית.
הערה: בשלב זה, האטריה מנותחת משם, וניסוי אחד צריך לנהל את פרוטוקול בידוד התא הפטרוני, בעוד ניסוי שני צריך לנהל את בידוד תא החדר.
4. בידוד ותרבות תאיים בין-תאיים
- לנתח את האטריה הרחק מהלב ולמקם אותו לתוך צלחת תרבות פלסטיק 30 מ"מ. להטביע אותו 0.75 מ"ל של מאגר עיכול להפרדה מכנית. שמרו את החדרים בצלחת של 60 מ"מ (שלב 3.12) ובצעו את שיטות הבידוד הנפרדות בו זמנית (סעיף 5, איור 1B).
הערה: בשלב זה, atria ו החדרים יכולים לעבור הפרדה נוספת אם יש צורך לבודד את התאים בצד שמאל וימינה. - מתחילים לטחון להקניט את האטריה בנפרד, בתחילה עם מספריים כירורגיים עדינים ואחריו מלקחיים עדינים לטחון נוסף. הימנע מתסיס את הרקמה, ולא במהירות לפרק סיבי שריר.
- באמצעות קצה פיפטה העברה סטרילית, להמשיך בעדינות לערבב ולנתק את הרקמה במשך 15 דקות. כל 5 דקות, להתבונן ניתוק מיוציטים אצטריאלי מרקמות תחת מיקרוסקופ brightfield אובייקטיבי 10x. ככל שהרקמה מתעכלת עוד יותר, ממשיכים לערבב בעדינות ולנתק רקמה באמצעות קצה פיפטה סטרילי עם גודל נקבובי קטן יותר.
- העבר את השעיית התא לצינור מיקרו-צנטריפוגה סטרילי של 2 מ"ל. לשטוף את צלחת 30 מ"מ עם 0.75 מ"ל של 37 °C myocyte עצירת מאגר 1 ולשלב עם המתלה התא (נפח סוף = 1.5 מ"ל).
- אפשר myocytes בין המקרים משקעים על ידי כוח הכבידה במשך 10 דקות בטמפרטורת החדר. בעדינות להתסיס את השעיית התא כדי לאפשר מיוציטים משקעים לתחתית הצינור חרוט, ויוצרים גלולה גלויה.
- צנטריפוגה השעיית התא במשך 5 דקות ב 20 x g. בזהירות להסיר את supernatant, אשר מכיל את מיוציטים שאינם, ולהעביר צינור פוליפרופילן 15 מ"ל חרוט באמצעות קצה פיפטה סטרילי מבלי להפריע גלולה של מיוציטים פרוזדורים.
- צנטריפוגה שבר שאינו מיוציטים במשך 5 דקות ב 20,000 x g. לשאוף את supernatant ולהשתעלות מחדש את גלולה שאינם מיוציטים ב 10 מ"ל של DMEM בתוספת 10% סרום עגל עוברי (FCS).
- לספור שאינם מיוציטים באמצעות hemocytometer או שיטה אחרת, ולאחר מכן צלחת לפי הצרכים הניסיוניים, או לבודד עוד יותר לתוך אוכלוסיות תאים ספציפיות בודדות באמצעות מיון תאים המופעל על ידי פלואורסצנטיות (איור 1C).
- Resuspend גלולה של מיוציטים אצטריים מבודדים משלב 4.6 ב 1 מ"ל של מדיום ציפוי מיוציטים אצטריים ולהחיל 10 μL של השעיה זו על hemocytometer. בצע ספירת תאים של מיוציטים בצורת מוט לכל שדה.
- לשאוף למימינין מצלחות ניסיוניות מראש / שקופיות ו resuspend myocytes פרוזדורי מבודד בנפח המתאים של מדיום ציפוי מיוציטים פרוזדורי בתוספת 25 μM blebbistatin. צלחת בצפיפות הרצויה לצרכים ניסיוניים (איור 1C).
הערה: צפיפות ציפוי אופיינית עבור culturing לטווח ארוך המתואר כאן הוא 5 x 105 תאים / תא על ארבעה תאים (1.7 ס"מ2) שקופיות זכוכית.
5. בידוד ותרבות תאים חדריים
- התחילו לרכך ולהתגרות ברקמות החדר, תחילה עם מספריים כירורגיות עדינות ואחריהן מלקחיים עדינים לטחונים נוספים(איור 1B). הימנע מתסיס את הרקמה על ידי פירוק מהיר של סיבי השריר.
- העבר את השעיית התא לצינור חרוט פוליפרופילן 15 מ"ל. לשטוף את הצלחת עם 2.5 מ"ל של 37 °C myocyte עצירת מאגר 1 ולשלב עם השעיית התא (נפח סוף = 5 מ"ל).
- באמצעות טיפ פיפטה העברה סטרילית, להמשיך בעדינות לערבב ולנתק את הרקמה במשך 4 דקות. החל 10 μL של השעיית תא זה על השקופית לדמיין את נוכחותם של מיוציטים בצורת מוט כדי להבטיח את איכות הבידוד.
- להעביר את ההשעיה התא דרך מסנן ניילון סטרילי 100 מיקרומטר לתוך צינור חרוט פוליפרופילן 50 מ"ל. השתמש 2 מ"ל של מאגר העיכול שנאסף בשלב 3.12 לשטוף את כל התאים הנותרים את מסנן ניילון סטרילי.
- אפשרו למיוציטים בחדר להסיע לפי כוח המשיכה למשך 6 דקות בטמפרטורת החדר. בעדינות להתסיס את ההשעיה תא מסונן כדי לאפשר myocytes משקעים בתחתית החרוט, ויוצרים גלולה גלויה.
- מבלי להפריע לכדור של מיוציטים חדריים, להסיר בזהירות את supernatant (שאינם מיוציטים) ולהעביר צינור פוליפרופילן 50 מ"ל חרוט באמצעות קצה פיפטה סטרילי. צנטריפוגה שבר שאינו מיוציטים במשך 5 דקות ב 20,000 x g. לשאוף את supernatant ולהשתעלות מחדש את גלולה שאינו מיוציטים ב 10 מ"ל של DMEM בתוספת 10% FCS.
- לספור שאינם מיוציטים באמצעות hemocytometer ו resuspend בנפח המתאים של DMEM בתוספת 10% FCS. לאחר מכן, יש לשוט לפי הצרכים הניסיוניים, או לבודד עוד יותר לאוכלוסיות תאים ספציפיות באמצעות מיון תאים המופעל על ידי פלואורסצנטיות (איור 1C).
- Resuspend מיוציטים חדריים מבודדים ב 2 מ"ל של מיוציטים עצירת מאגר 2 ולהחיל 10 μL של השעיית תאים על hemocytometer. בצע ספירת תאים של מיוציטים בצורת מוט לכל שדה.
- הצגה מחדש של Ca2+ באמצעות פרדיגמה חורגת
הערה: שלבי החזרת סידן הם ספציפיים עבור מיוציטים חדריים ואין לבצעם עבור מיוציטים אבריאליים, שכן הדבר יגרום למוות של תאים.- הוסף 50 μL של 10 mM CaCl2 להשעיית תא מיוציטים חדרית. מערבבים היטב ודגרים במשך 4 דקות בטמפרטורת החדר.
- הוסף 50 μL נוספים של 10 mM CaCl2 להשעיית תא מיוציטים חדרית. מערבבים היטב ודגרים במשך 4 דקות בטמפרטורת החדר.
- הוסף 100 μL נוספים של 10 mM CaCl2 להשעיית תא מיוציטים חדרית. מערבבים היטב ודגרים במשך 4 דקות בטמפרטורת החדר.
- הוסף 80 μL של 100 מ"מ CaCl2 להשעיית תא מיוציטים חדרית. מערבבים היטב ודגרים במשך 4 דקות בטמפרטורת החדר.
- הסירו את ציפוי למינציה מלוחות או מגלשות והניחו מחדש את מיוציטים חדריים מבודדים בנפח מתאים של מדיום ציפוי מיוציטים חדרי לפי צרכים ניסיוניים (איור 1C).
הערה: צפיפות ציפוי אופיינית עבור culturing לטווח ארוך המתואר כאן הוא 5 x 105 תאים / תא על ארבעה תאים (1.7 ס"מ2) שקופיות זכוכית. הימנע ציפוי בצפיפות של יותר מ 75% מפגש, כמוצפיפות יתר הסלולר מקדם גושים התא, ובכך לעכב את ההחזקה לצלחת. יתר על כן, מספר גדול של תאים יאבדו במהלך השינוי הבינוני הראשון. תאי צלחת במהירות לאחר הבידוד, כמו Ca2+ חוץ תאיים מקדם hypercontraction ואובדן של מיוציטים קיימא. - אפשר למיוציטים בחדר להתיישב ולהיצמד לפחות שעה. לאחר מכן לשנות את המדיה myocyte חדרית שמירה על בינוני בתוספת 25 μM blebbistatin.
הערה: מיוציטים חדריים יכולים להיות תרבותיים עד 96 שעות לאחר ציפוי μM blebbistatin. ניסויים צריכים להתבצע מיוציטים חדריים שמירה על מדיום בהיעדר blebbistatin.
תוצאות
לב עכבר C57b6/j בן 10 שבועות מוביל בדרך כלל ל-75,000-150,000 מיוציטים א-טריים ו-1.0-1.5 x 106 מיוציטים חדריים, השווה לתשואה משוערת של 30%-50% עבור מיוציטים18,19. במהלך ומיד לאחר בידודים, מיוציטים לב קיימא צריך להופיע מוט בצורת ולא התכווצות. רוב מיוציטים לב מבודדים צריך להתאים את המורפולוגיה, המהווה אינדיקציה של זלוף יעיל. מורפולוגיה בצורת מוט יכולה גם להיות מנבא של הכדאיות. הפרוטוקול נועד לשפר את התשואה ואת הכדאיות של מיוציטים ולא מיוציטים מבודדים מלב עכבר חולה. יתר על כן, זה נבדק במודל של אי ספיקת לב הנגרמת על ידי עומס לחץ (נתונים לא מוצגים).
כדי לאשר בידוד הולם וניתן לשכפול של מיוציטים ולא מיוציטים מרקמת אבות ורקמות חדריות, התאים נצפו וצולמו בימים שונים בתרבות(איור 2). בנוסף, בוצעה תגובת שרשרת פולימראז כמותית של שעתוק הפוך (qRT-PCR) כדי למדוד את רמות התמלילים שהיו ספציפיים לסוג התא. טרופונין T שריר הלב(Tnnt2)הוא סמן של מיוציטים לבביים והתבטא בחוזקה הן בתרביות מיוציטים לבביות הן מבחינה משפטית והן בתרבויות מיוציטים לבביות חדריות(איור 3A). לעומת זאת, פפטיד נטריורטי פרך (Nppa, אשר מתבטא בדרך כלל אך ורק מיוציטים לב פרך למבוגרים בתנאים פיזיולוגיים) ושרשרת אור מיוסין 2 (Myl2, שהוא גן ספציפי myocyte חדרית) באו לידי ביטוי באופן חזק במיוחד בתרבויות מיוציטים לב מפרזדוריים חדריים, בהתאמה (איור 3B, C).
סמני פיברובלסט, פקטור שעתוק 21 (Tcf21), קולטן גורם גדילה שמקורו בטסיות הדם A (Pdgfra), ואשכול סמן תאים המופק ממונוציטט של התמיינות 68 (Cd68) באו לידי ביטוי אך ורק בתרבויות שאינן מיוציטים המבודדות הן מתאים פרוזדורים והן מחדרים חדריים (איור 3D-F). ההערכה היא כי שאינם מיוציטים להתפשר ~ 65% של כל תאי הלב וכי רוב אלה מקורם שושלת פיברובלסט או מונוציטים נגזר18,19,23,24. לפיכך, סמנים עבור שני שושלת אלה נבחרו להיות ייצוגיים, בהתחשב בהתעניינות באוכלוסיות הסלולר האלה במחקרים של מודלים ואטימולוגיות שונות של פתולוגיה לבבית.
חיסון של AMAMs ו- AMVMs עבור סמן t-tubule דיהידרופרידין (DHPR, שהוא ערוץ סידן תלוי מתח (L)-סוג) כמו גם קולטן ריאנודין (RYR2) הפגין t-tubules שלמים לאורך בידוד ותרבות לטווח ארוך (איור 4A,B). השפע של DHPR ולוקליזציה שהיה אופייני וייחודי למיוציטים אבריאליים חדריים הצביעו על נוכחותם של צינוריות. יתר על כן, קולוקליזציה של DHPR עם RYR2 immunostaining היה אינדיקטור של מבני דיאלאד שלמים. אימונוסטין עבור החלבון סרקומרי אלפא-actinin במיצ'יטים לב פרוזדוריים חדריים הביא דפוס פסים סרקומריים הצפוי. דפוס הפסים הסרקומי שימש להערכת הטוהר והכדאיות של מיוציטים לבביים מבודדים בשילוב עם צורה מורפולוגית בצורת מוט וכתמים גרעיניים עם TOPRO-3 (איור 4C,D; סגול ואדום). כצפוי, מיוציטים לבביים חדריים היו גדולים, והפגינו אורך ממוצע של ~ 150 מ"מ, ואילו מיוציטים לב פרך בממוצע ~ 75 מ"מ. יתר על כן, על ניתוח immunostaining, מיוציטים לב פרטלי (אבל לא מיוציטים לב חדריים) הציג ביטוי חזק של פפטיד נטריורטית פרזדורית (ANP) בתבנית מכתימה האופיינית לוקליזציה לרטיקולום אנדופלזמי וגרגרי הפרשה (איור 4C, D;ירוק).
מאפיין ייחודי מיוציטים לב אסטראלי הוא הסיווג שלה כתא אנדוקריני בנוסף לתא התכווצות. בעוד מיוציטים פרוזדורים מפרישים ANP בתנאים בסיסיים, הפרשת עולה בתגובה secretagogues (כלומר, אגוניסט אלפא-adrenergic, פנילפרין [PE]). יתר על כן, מיוציטים לב פרוזדורים להפריש ANP ושיתוף הפרשת לעבד חלק ההורמון ממצב מבשר שלה (Pro-ANP, 15 kD) לפפטיד המוצר (ANP 3kD)16,17. יכולת הפרשה זו ניתן לכמת באמצעות זיהוי immunoblot של ANP במדיה של מיוציטים לב אצטריים מבודדים בתגובה לטיפול PE חריפה (איור 4E). הפרשה זו ויכולת העיבוד של מיוציטים לב פנים נמצאה רגישה לתנאי culturing. לכן, זה הכרחי כי מדיום ציפוי מיוציטים פרסלי הוא בתוספת דקסמתזון, אינסולין, transferin, סלניום.
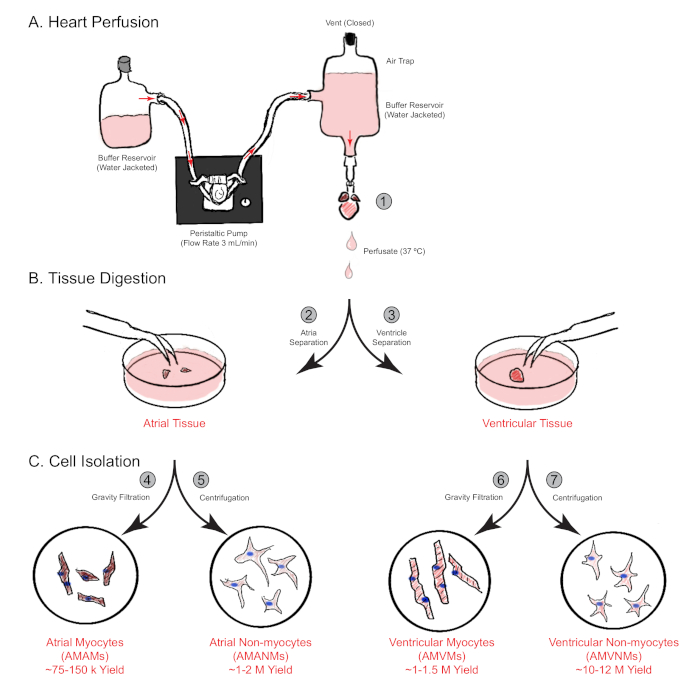
איור 1: סקירה סכמטית של זלוף לב מדרדר, עיכול ובידוד תאים. המוצגים הם השלבים העיקריים המעורבים בבידוד תאים הן מתאי האשכים והן מחדרי החדר בו זמנית מלב עכבר יחיד. (A) לב עכבר יחיד הוא משומר במהירות דרך העורקים העולה ו perfused באופן מדרדר. (B)הלב מופרד לרקמות פרוזדוריות חדריות להמשך עיכול והפרדה פיזית. (C) לאחר עיכול הולם, התאים מופרדים באמצעות סינון הכבידה לתוך סך של ארבעה שברים תאיים כי הם תרבותיים לניסויים הבאים. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
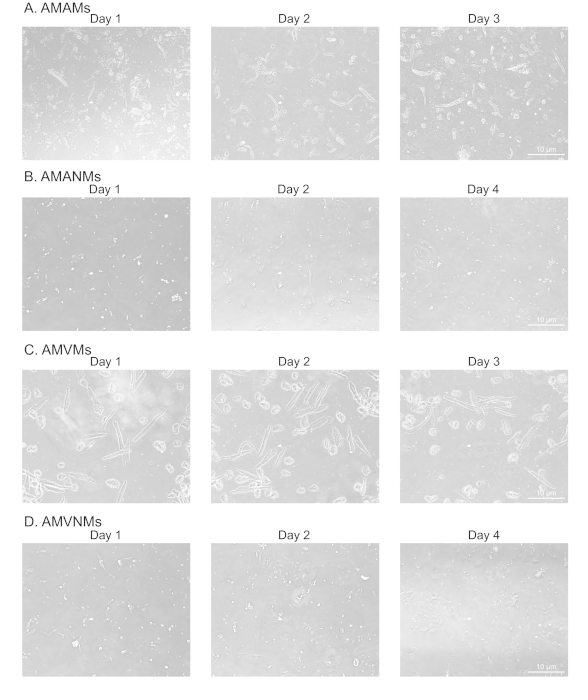
איור 2: ניתוח מורפולוגי של מיוציטים לבביים מבודדים בחדרים ולא מיוציטים בתרבות. (A) מיוציטים בין-תאיים של עכבר בוגר מבודד (AMAMs),(B)עכבר בוגר שאינו מיוציטים (AMANMs), (C) מיוציטים חדריים של עכבר בוגר (AMVMs), או (D) ) עכבר בוגר שאינו מיוציטים (AMVNMs) היו מצופים ב 5 x 105 תאים / תא על ארבעה תאים (1.7 ס"מ 2 ) שקופיותזכוכיתבמדיה מצופה בהתאמה. תמונות שלב התקבלו בימים המצוינים בתרבות באמצעות מטרה 10x תחת מיקרוסקופ epifluorescence. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
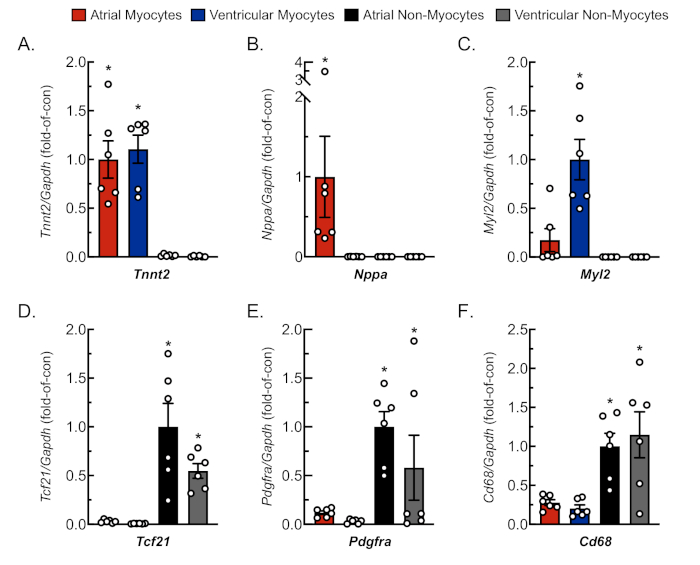
איור 3: ניתוח qRT-PCR מייצג של תרביות תאים מבודדות. RNA חולץ מיוציטים לב מבודדים טריים ולא מיוציטים, ורמות mRNA עבור סמני גנים ספציפיים לתאים נקבעו על ידי qRT-PCR4. (A) Tnnt2, טרופונין שריר הלב T (סמן מיוציטים לב); (B) Nppa, פפטיד נטריורטי מטריורי (סמן מיוציטים מטריאלי); (C) Myl2, שרשרת אור מיוסין 2 (סמן מיוציטים חדרי); (D) Tcf21, פקטור שעתוק 21 (סמן פיברובלסט); (E) Pdgfra, קולטן גורם גדילה נגזר טסיות הדם A (סמן פיברובלסט); (F) Cd68, אשכול של בידול 68 (סמן תא נגזר מונוציט). הנתונים מייצגים ממוצע ± SEM (*p ≤ 0.05 שונה מכל הערכים האחרים, כפי שנקבע על ידי ANOVA ואחריו הניתוח שלאחר הוק של ניומן קאול). לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
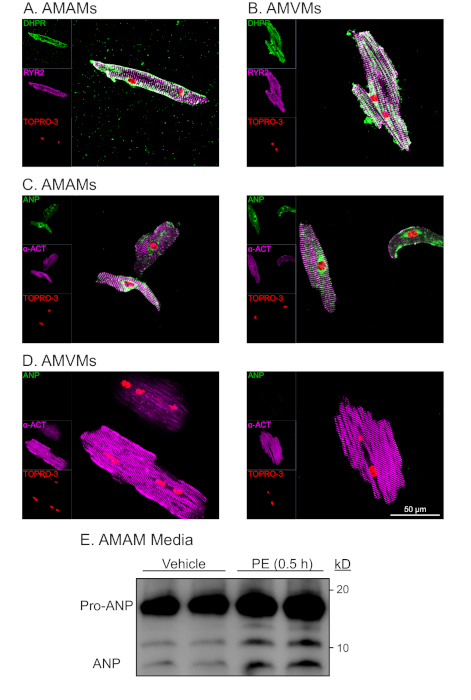
איור 4: ניתוח מורפולוגי ופונקציונלי מייצג של מיוקטי לב פרוזדוריים חדריים מבודדים. (A)AMAMs או (B) AMVMs היו מצופים ב 5 x 105 תאים / תא על ארבעה תאים (1.7 ס"מ2)שקופיות זכוכית במדיית ציפוי בהתאמה במשך 1 שעות כדי לאפשר הידבקות. זה היה ואחריו גם הזנה מחדש של מדיה ציפוי מיוציטים פרך או שינוי מיוציטים חדרית שמירה על מדיה בתוספת blebbistatin עבור 16 שעות נוספות. תרבויות תוקנו לאחר מכן אז immunostained עבור RYR2 (סגול), DHPR (ירוק), וכתם גרעיני TOPRO-3 (אדום). (C)AMAMs או (D) AMVMs היו מבודדים מצופים, לאחר מכן immunostained עבור a-actinin (סגול), ANP (ירוק), ו TOPRO-3 (אדום). מוצגות שתי תמונות מייצגות עבור כל סוג תא. (E)AMAMs היו מצופים ב 5 x 105 תאים / גם על צלחת תרבות 12 גם עבור 16 שעות במדיה ציפוי מיוציטים atrial. AMAMs טופלו לאחר מכן עבור 0.5 שעות עם הרכב או secretagogue ANP (פנילפרין, 50 מ"מ) לפני המדיה נאספו ונתון לניתוח immunoblot עבור ANP. לפני ניתוח immunoblot, דגימות מדיה היו צנטריפוגה ב 500 x g במשך 5 דקות כדי להסיר פסולת הסלולר ולהבטיח כי ANP שנצפה היה תוצאה של הפרשה פעילה של AMAMs. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
איכות התאים המבודדים באמצעות ההליך המתואר כאן, כפי שנקבע על ידי תשואת התא ובריאות כללית של התאים בתרבות, תלויה בגורמים רבים לשליטה. החל עם העכבר עצמו, זה תועד כי הלחץ שהוטל על החיה יכול להשפיע לרעה על תשואת התא ואת הכדאיות בתרבות, ככל הנראה בשל עודף קורטיזול מערכתי, קטכולאמינים, ואת המצב hypercontractile של רקמת לב2,5,7. מסיבות אלה, יש לנקוט צעדים כדי למנוע הבהבת החיה לפני ההקרבה. אמצעים אלה כוללים כיסוי הכלוב של החיה והגבלת זמן מחוץ vivarium לפני ההקרבה. הפרין וברביטורטים רבים המשמשים בדרך כלל המתת חסד יכולים להשפיע על מסלולי איתות; לפיכך, יש להתאים אישית את השיטה האופטימלית של המתת חסד בהתאם. לגיל החיה יש השפעה ניכרת על האיכות והכדאיות של תאים מבודדים, ככל הנראה עקב הצטברות מתקדמת של פיברוזיס ביניים המתרחשים במקביל לתהליך ההזדקנות, אשר יכול להשפיע על עיכולרקמות 25. בנתונים שאינם מוצגים כאן, בעוד שהשיטה המתוארת לעיל פועלת בעכברים בני עד 78 שבועות, איכות התאים הייתה נמוכה יותר בבעלי חיים מבוגרים אלה.
הצעד הקריטי ביותר בתהליך הבידוד המתואר, כמו גם פרוטוקולים אחרים הכוללים מנגנון לנגנדורף לזלוף מדרדר, הוא הקנציה והזלוף הראשוני של הלב. לקבלת תוצאות אופטימליות, הזמן מ explantation לב כדי שימורים של העורקים העולה חניכה של זלוף צריך לקחת לא יותר מ 90 s. בנוסף לזמן, שני גורמים חשובים נוספים הם עומק הצינורית ואפשרות להכניס אמבולי אוויר ממנגנון הזלוף. לפיכך, יש לקדם את הצינורית לתוך אבי העורקים העולה כדי לא להיכנס לשורש אבי העורקים ולחסום את שסתום אבי העורקים, אשר יפגע בזלוף כלי הדם הכליליים.
במהלך תהליך העיכול, חשוב לבדוק באופן קבוע את קשיחות הלב, כדי למנוע חשיפה ממושכת לקולאזנאז אנזים העיכול, אשר מפחית סובלנות סידן מיוציטים לב. הפרוטוקול שתואר לעיל להחזרת סידן לתרביות מיוציטים חדריות מבודדות נועד להגביל מוות מיוציטים לבביים באמצעות זרם סידן בלתי הולם באמצעות ערוצי סידן המופעלים בחנות. יש לציין כי החזרת הסידן החורגת לא צריכה להתבצע עבור תרבויות מיוציטים בין-תאיות מבודדות, שכן זה יקדם מוות תאי במהלך תרבות לטווח קצר וארוך12. לאמצעי זהירות נוספים, מאגרי זלוף ועיכול המשמשים כאן כוללים את מעכב התכווצות שריר הלב butanedione monoxime (BDM) כדי למנוע היפרcontraction של מיוציטים מבודדים, כמו גם את פרדוקס הסידן, שניהם משפיעים על הכדאיות myocyte26. עם זאת, יש לציין את המעבר מ- BDM לבביסטין, שכן הוא הסוכן האנטי-התכווצות המועדף בשמירה על מדיה עבור מיוציטים לבביים מבודדים. בנתונים שאינם מוצגים, blebbistatin מעניק כדאיות רבה יותר לתרבות ארוכת טווח של מיוציטים לבביים מבודדים.
מיד לאחר הבידוד, חשוב לשקול את ההשלכות של תרבות ארוכת טווח של תאי לב, במיוחד מיוציטים. הבידוד הלבבי שאינו מיוציטים ופרוטוקול culturing המתואר כאן מבוסס על שיטות נפוצות המנצלות את הצפיפות ותכונות הדבק השונות של תאי לב שונים. היתרון של מיוציטים שאינם מיוציטים הוא פוטנציאל ההתרחבות הגבוה שלהם בתרבות; לפיכך, שלא כמו מיוציטים לבביים, הם נוחים להנצחה. עם זאת, ידוע כי culturing תנאים, כולל תוספי בינוני עם FBS, יכול להשפיע על תפקוד מיוציטים לב27. המדיה התרבותית המתוארת כאן נועדה לייעל את הכדאיות ולהגביל את ההפרעות התפקודיות, במיוחד עבור מיוציטים בין-וסתיים מבודדים. בעוד שלא נצפתה יכולת התכווצות לקויה במיציטים לבביים מבודדים לאחר התרבות בהיעדר תוספי blebbistatin, מחקרים המתמקדים באלקטרופיזיולוגיה, התכווצות, ותא יחיד אחר באיתות מולקולרי מבוסס vivo צריכים להתבצע זמן קצר לאחר הבידוד, כאשר המבנה הסרקומי והחתימה המולקולרית עדיין מחקים את זה של הלב שלם.
מאפיין בולט של מיוציטים פרוזדורים הוא היכולת שלו לאור ירח כתא אנדוקריני עם יכולת הפרשה עצומה, בנוסף לתפקודם המתכווץ. בתנאים פיזיולוגיים, מיוציטים פרוזדוריים מייצרים כמויות גדולות של ANP, המאוחסן ברשתית האנדופלזמית ובגרגרי הפרשה גדולים בעלי ליבה צפופה הצפויים לאקסוציטוזיס מוסדר עם קבלתגירוי 16,17. בעוד שמחקרי מיוציטים אסציוניים מבודדים רבים מתמקדים בתכונות האלקטרופיזיולוגיות הייחודיות שלהם, זהו המחקר הראשון שמתכנן מדיה תרבותית. זה מאפשר הכדאיות לטווח ארוך, כמו גם קידום של הפונקציות המתוחזקות של תכונות אנדוקריניות והתכווצות של מיוציטים אסטראליים. שיטה חדשנית זו עבור culturing, כמו גם בידוד בו זמנית של כל סוגי התאים מתוך תאים אבריים חדריים מלב עכבר יחיד, יהיה שימושי ויעיל למחקרים על המאפיינים הפיזיולוגיים והפתופיזיולוגיים של מיוציטים בין אבות וחדריים כאחד.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
E.A.B. נתמך על ידי המכונים הלאומיים לבריאות (1F31HL140850), קרן ARCS, Inc., סן דייגו פרק, והוא ריס-Stealy קרן המחקר פיליפס Gausewitz, MD חוקר של מכון הלב SDSU. E.A.B ו-A.S.B נתמכו על ידי קרן אינמורי. CCG על ידי (NIH) מעניק R01 HL135893, R01 HL141463 ו HL149931.
Materials
| Name | Company | Catalog Number | Comments |
| (-)-Blebbistatin | Sigma-Aldrich | B0560 | |
| 1 Liter Water Jacketed Reservoir | Radnoti | 120142-1 | |
| 2,3-Butanedione monoxime | Sigma-Aldrich | B0753 | |
| 5-0 Silk Suture Thread | Fine Science Tools | 18020-50 | |
| Adenosine | Sigma-Aldrich | A9251 | |
| Bovine Serum Albumin | Sigma-Aldrich | A6003 | |
| Bubble Trap Compliance Chamber | Radnoti | 130149 | |
| Calcium Chloride Anhydrous | Fisher Scientific | C614-500 | |
| Carnitine hydrochloride | Sigma-Aldrich | C9500 | |
| Collagenase type 2 | Worthington Biochemical Corporation | LS004176 | |
| Creatine | Sigma-Aldrich | C0780 | |
| Dexamethasone | Sigma-Aldrich | D2915 | |
| DMEM/F12 (1:1; 1X) | Gibco | 11330-032 | |
| Dumont #7 - Fine Forceps | Fine Science Tools | 11274-20 | |
| Epifluorescent micropscpe | Olympus X70 | IX70 | |
| Fetal Bovine Serum (Heat Inactivated) | Omega Scientific | FB-12 | Lot# 206018 |
| Fine Scissors - Sharp | Fine Science Tools | 14060-09 | |
| Graefe Forceps | Fine Science Tools | 11051-10 | |
| Headband Magnifiers | Fine Science Tools | 28030-04 | |
| Hemacytometer (Bright-Line) | Hausser Scientific | 1475 | |
| HEPES (1M) | Gibco | 15630-080 | |
| Inosine | Sigma-Aldrich | I4125 | |
| Insulin-Transferrin-Selenium-X | Gibco | 51500-056 | |
| Isotemp 105 Water Bath | Fisher Scientific | NC0858659 | |
| Isotemp 3006 | Fisher Scientific | 13-874-182 | |
| Joklik Modified Minimum Essential Media | Sigma-Aldrich | M-0518 | |
| Laminin (Natural, Mouse) | Gibco | 1795024 | Lot# 1735572 |
| L-Glutamine | Sigma-Aldrich | G8540 | |
| Masterflex C/L Single-Channel Variable-Speed Compact Pump | Cole-Palmer | EW-77122-24 | |
| Minimum Essential Medium (MEM 1X) | Gibco | 12350-039 | |
| Molecular Biology Grade Water | Corning | 46-000-CM | |
| Pen Strep Glutamine (100X) | Gibco | 10378-016 | |
| Spring Scissors - 6mm Cutting Edge | Fine Science Tools | 15020-15 | |
| Taurine | Sigma-Aldrich | T-8691 |
References
- Peter, A. K., Bjerke, M. A., Leinwand, L. A. Biology of the cardiac myocyte in heart disease. Molecular Biology of the Cell. 27 (14), 2149-2160 (2016).
- Kruppenbacher, J. P., May, T., Eggers, H. J., Piper, H. M. Cardiomyocytes of adult mice in long-term culture. Naturwissenschaften. 80 (3), 132-134 (1993).
- Ackers-Johnson, M., et al. A Simplified, Langendorff-Free Method for Concomitant Isolation of Viable Cardiac Myocytes and Nonmyocytes From the Adult Mouse Heart. Circulation Research. 119 (8), 909-920 (2016).
- Jin, J. K., et al. ATF6 decreases myocardial ischemia/reperfusion damage and links ER stress and oxidative stress signaling pathways in the heart. Circulation Research. 120 (5), 862-875 (2017).
- Judd, J., Lovas, J., Huang, G. N. Isolation, Culture and Transduction of Adult Mouse Cardiomyocytes. Journal of Visualized Experiments. (114), e54012(2016).
- Li, D., Wu, J., Bai, Y., Zhao, X., Liu, L. Isolation and Culture of Adult Mouse Cardiomyocytes for Cell Signaling and in vitro Cardiac Hypertrophy. Journal of Visualized Experiments. (87), e51357(2014).
- O'Connell, T. D., Ni, Y. G., Lin, K. M., Han, H. P., Yan, Z. Isolation and culture of adult cardiac myocytes for signaling studies. AfCS Research Reports. 1 (5), 1-9 (2003).
- Pinz, I., Zhu, M., Mende, U., Ingwall, J. S. An improvised isolation procedure for adult mouse cardiomyocytes. Cell Biochemistry and Biophysics. 61 (1), 93-101 (2011).
- Piper, H. Culturing of calcium stable adult cardiac myocytes. Journal of Molecular and Cellular Cardiology. 14 (7), 397-412 (1982).
- Shioya, T. A simple technique for isolating healthy heart cells from mouse models. Journal of Physiological Sciences. 57 (6), 327-335 (2007).
- Omatsu-Kanbe, M., Yoshioka, K., Fukunaga, R., Sagawa, H., Matsuura, H. A simple antegrade perfusion method for isolating viable single cardiomyocytes from neonatal and aged mice. Physiological Reports. 6 (9), 13688(2018).
- Jansen, H. J., Rose, R. A. Isolation of Atrial Myocytes from Adult Mice. Journal of Visualized Experiments. (149), e59588(2019).
- Yao, C., et al. Enhanced Cardiomyocyte NLRP3 Inflammasome Signaling Promotes Atrial Fibrillation. Circulation. 138 (20), 2227-2242 (2018).
- Cha, Y., Redfield, M. M., Shen, W., Gersh, B. J. Atrial Fibrillation and Ventricular Dysfunction: A Vicious Electromechanical Cycle. Circulation. 109 (23), 2839-2843 (2004).
- Issa, O., et al. Left atrial size and heart failure hospitalization in patients with diastolic dysfunction and preserved ejection fraction. Journal of Cardiovascular Echography. 27 (1), 1-6 (2017).
- de Bold, A. J. Atrial natriuretic factor: a hormone produced by the heart. Science. 230 (4727), 767-770 (1985).
- McGrath, M. F., de Bold, M. L., de Bold, A. J. The endocrine function of the heart. Trends in Endocrinology and Metabolism. 16 (10), 459-477 (2005).
- Doevendans, P. A., Daemen, M. J., de Muinck, E. D., Smits, J. F. Cardiovascular phenotyping in mice. Cardiovascular Research. 39 (1), 34-49 (1998).
- Banerjee, I., Fuseler, J. W., Price, R. L., Borg, T. K., Baudino, T. A. Determination of cell types and numbers during cardiac development in the neonatal and adult rat and mouse. American Journal of Physiology. 293, 1883-1891 (2007).
- Jugdutt, B. I. Ventricular remodeling after infarction and the extracellular collagen matrix: when is enough enough. Circulation. 108, 1395-1403 (2003).
- Omatsu-Kanbe, M., et al. Identification of cardiac progenitors that survive in the ischemic human heart after ventricular myocyte death. Scientific Reports. , 7(2017).
- Song, K., et al. Heart repair by reprogramming non-myocytes with cardiac transcription factors. Nature. 485, 599-604 (2012).
- Limana, F., et al. bcl-2 overexpression promotes myocyte proliferation. Proceedings of the National Academy of Sciences of the United States of America. 99, 6257-6262 (2002).
- Pinto, A. R., et al. Revisiting cardiac cellular composition. Circulation Research. 118 (3), 400-409 (2015).
- Chen, W., Frangogiannis, N. G. The role of inflammatory and fibrogenic pathways in heart failure associated with aging. Heart Failure Reviews. 15, 415-422 (2010).
- Daly, M. J., Elz, J. S., Nayler, W. G. Contracture and the calcium paradox in the rat heart. Circulation Research. 61 (4), 560-569 (1987).
- Li, Z., Sharma, R. V., Duan, D., Davisson, R. L. Adenovirus-mediated gene transfer to adult mouse cardiomyocytes is selectively influenced by culture medium. Journal of Gene Medicine. 5 (9), 765-772 (2003).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved