Method Article
성인용 마우스 심장에서 심방 심근 세포, 심실 심근 세포 및 비근구의 동시 격리 및 문화
요약
단일 성인 마우스 심장의 심실과 심실 모두에서 심근세포 및 비근구의 동시 절연을 위한 방법이 설명된다. 이 프로토콜은 매우 실행 가능한 심장 심근세포 및 비 근구세포의 일관된 수율을 초래하고 페노티핑 및 체외 분석을 위한 최적의 세포 별 배양 조건을 자세히 설명합니다.
초록
마우스에서 심장 근구의 격리 및 배양은 심장 생리학 및 병리생리학의 이해를 증진하기 위해 필수적이었습니다. 신생아 마우스 심혼에서 근구를 분리하는 것은 상대적으로 간단하지만, 성인 뮤린 심혼에서 심근세포가 바람직하다. 이는 신생아 세포에 비해 성인 근세포가 생체 내 성인 심장에서 발생하는 세포 기능을 보다 정확하게 재구성하기때문이다. 그러나, 실험적인 난관에 기여하는 필요한 양과 생존력으로 성인 마우스 심장 근세포를 분리하는 것은 기술적으로 어렵습니다. 더욱이, 발표된 절차는 심방 및 심실 비근구 세포의 희생으로 심방 또는 심실 근구세포의 격리에 특이적이다. 여기에 설명된 심방 및 심실 심장 근세포, 심방 및 심실 비근구를 동시에 단일 마우스 심장에서 분리하는 상세한 방법이 다설명되어 있다. 또한 세포 생존력과 기능을 향상시키는 최적의 세포 별 배양 방법에 대한 세부 정보가 제공됩니다. 이 프로토콜은 성인 뮤린 심장 세포 격리 과정을 신속히 처리할 뿐만 아니라 심방 및 심실 심장 세포의 조사를 위한 세포의 수율과 생존가능성을 높이는 것을 목표로 합니다.
서문
1 차 적인 세포 배양은 심장 심근 세포 기능의 상세한 기계론적인 연구 결과를 위한 통제된 환경을 제공하는 필수적인 자원입니다. 그들의 더 튼튼한 성격과 고립의 용이성 때문에, 신생아 쥐 심방 및 심실 심근세포는 그 같은 세포 배양1의 일반적인근원이었습니다. 그러나, 성인 마우스 심방 및 심실 근세포 (AMAMM 및 AMVM)는 체외 연구에 매우 바람직하다, 그들의 분자 및 기능적 특성은 더 나은 성인 심장 세포의 모방하기 때문에. 따라서, 그(것)들은 성인2에서발전하는 심장 병리와 관련있는 연구 결과에 관하여 관련있게 되었습니다.
또한, 트랜스제닉 및 질병 마우스 모델의 가용성과 사용은 고립된 성인 심장 심근세포의 유용성을 확장합니다. 단기 및 장기 연구를 위한 마우스 AMVM의 격리 및 배양에 대한 프로토콜은 수많은 이전간행물2,3,4,5,6,7,8,9,10,11에기술되었다. 이에 비해 AMAM의 격리에 대해 설명된 프로토콜은 거의 없습니다. 더욱이, 기술된 사람들은 주로 현재까지 기술된 장기 배양 프로토콜없이 새로 고립된 세포의 급성 연구에 최적화되어 있으며,11,12,13에기술되지 않는다. 따라서 AMAM 격리 프로토콜은 AMVM의 격리 및 문화권에 대해 게시된 프로토콜의 유용성과 다재다능함을 제공하도록 설계되지 않았습니다. 또한 AmAM과 AMVM의 격리에 대한 선구적인 연구는 수완이 입증되었지만, AmAM과 AMVM의 최적의 동시 격리 및 문화권에 대한 프로토콜은 없으며, 이는 각 준비에 대한 전체 심장을 효율적으로 사용할 수 있습니다.
지금까지, 발표 된 AMAM 및 AMVM 격리 프로토콜은 심방 및 심실 기능에 대한 대부분의 연구가 챔버 별 초점을 가지고 있기 때문에 두 세포 유형의 동시 절연을 위해 설계되지 않았습니다. 예를 들면, AMAM는 심방 근세포 전기 생리학을 공부하기 위하여 주로 이용됩니다, 부분적으로 심방 세동에 대한 관심 때문에 (AF), 미국에서 가장 일반적인 심장 부정맥. 그러나, AF는 격리된 아리아에 영향을 미치는 질환이 아니며, 경증에서 중증 좌심실 기능장애(14)에대한 인과 역할을 갖는 것으로 연루되었다. 더욱이, 보존된 배출 분획(HFpEF)을 가진 심부전 환자로부터의 심전도사진은 심방 크기가심부전(15)에대한 감수성을 위한 가장 강력한 예측변수 중 하나라는 것을 보여주었습니다.
전기 생리학 및 수축에 그것의 역할 이외에, 심낭은 또한 내분비 기관, 심장 키인을 분비 (즉, 심방 natriuretic 펩티드 [ANP]) 즉, 정성 적으로 혈압과 부피를 조절16,17. 더욱이, ANP(심방 심사이클로 추정)는 심실 심근세포16,17에서눈에 띄는 보호 및 반비성 역할을 한다. 다양한 질병 상태에서 atria와 심실 사이 신경 호르몬 통신의 강한 연루가 있는 동안, 이 커뮤니케이션의 기초기계장치는 완전히 탐구되지 않았습니다. 이 점은 질병의 기능으로 직접 심장 근세포 생존및 글로벌 심장기능(18,19,20,21,22)에서비근세포(특히 심장 섬유아세포 및 면역세포)의 역할(특히 심장 섬유아세포 및 면역세포)의 역할에 의해 더욱 예시된다. 따라서, 심실 둘 다에서 심장 세포를 공부하는 것은 심장 병리생리학에 있는 그들의 역할의 더 완전한 그림을 얻기 위하여 필요한 접근입니다.
다음 프로토콜은 생리학적 및 병리학적 조건하에서 단일 마우스 심장에서 심방 및 심실 근세포 및 비 근구세포의 동시 절연을 설명합니다. 추가적으로, 이 방법은 심실 심근 세포의 문화를 유지하기 위한 조건이 이미 간행되었기 때문에 심방 심근 세포의 문화를 유지하는 데 필요한 최적의 조건을 설명하는 첫번째입니다.
프로토콜
이 논문에 보고된 마우스에 대한 모든 연구는 SDSU 기관 동물 관리 및 사용 위원회에 의해 검토되고 승인되었으며 국가 연구 위원회가 발표 한 실험실 동물의 치료 및 사용에 대한 가이드를 준수합니다.
1. 고립 및 문화 미디어 및 도금 준비
- Joklik 수정 최소 필수 매체 (MMEM)를 멸균 수의 1 L에 추가하여 사용하기 전에 심장 관류 미디어 1 L을 준비하십시오. pH를 10N NaOH로 7.36으로 조정한 다음 0.2 μm 필터를 통과한 다음 최대 2주 동안 4°C에 저장합니다.
참고: Joklik MMEM은 112mM NaCl, 5.4mM KCl, 1mM MgCl2,9m MM NaH2PO4,및 11.1 mM D-포도당으로 구성되어 있습니다. 이는 10mM HEPES(2.38g/L), 30mM 타우린(3.75g/L), 2m D-l-카르니틴(0.4 g/L), 2mM 크레아틴, 10m 부탄디온 모노시메(1.01 g/L)로 보충된다. - 관류 직전에 소화 완충제를 준비하십시오: 100mM CaCl2의 6.25 μL을 함유한 심장 관류 매체 50mL(단계 1.3 참조) 및 콜라게나아제 형 2(효소 활동 ~310-320 U/mg dw)를 보충한다.
참고: 희생 하기 전에 동물을 무게. 소화 완충제로 보충된 콜라게나아제 형 2형의 양은 동물의 무게에 의해 결정된다(체중 1g당 콜라게나아제 타입 2.25 mg). - 100 mM CaCl2를준비하려면, 분자 생물학 학년 수의 CaCl2 ~ 100 mL의 1.47 g를 추가합니다. 용해 될 때까지 저은 다음 0.2 μm 필터를 통과하고 실온에서 최대 2 개월 동안 보관하십시오.
- 심구체 정지 버퍼 1을 10mL의 심혈구 버퍼를 10mL의 태아 소 혈청(FBS)과 100mM CaCl2의125 μL로 보충하여 준비한다. 0.2 μm 필터를 통과하고 최대 2 주 동안 4 °C에서 저장합니다.
- 심구체 정지 버퍼 2를 6mL의 FBS와 10mM CaCl2의150 μL로 심혼 관류 버퍼 114mL을 보충하여 준비한다. 0.2 μm 필터를 통과하고 최대 2 주 동안 4 °C에서 저장합니다.
- 4mL의 FBS, 100x 펜/스트렙글루타민 1mL, 인슐린-트랜스퍼린 셀레늄 1mL, 10μm dexam.m. 0.2 μm 필터를 통과하고 도금될 때까지 37°C에 보관하십시오.
- FBS 4mL, 100x 펜/스트렙 글루타민 1mL, 1M HEPES 용액 10mL, 인슐린-트랜스퍼린 셀레늄 1mL, 0.1g의 최소 필수 매체(MEM)를 보충하여 심실 심사이클도금 배지를 준비합니다. 0.2 μm 필터를 통과하고 최대 2 주 동안 4 °C에서 저장합니다.
- 100x 인슐린-트랜스퍼린 셀레늄, 0.1 mg/mL 소 세럼 알부민(BSA), M HEPES 용액 10mL, 100x 펜/스트렙-글루타민 1mL로 MEM 99mL을 보충하여 심실 심사이클을 유지관리하여 배지를 유지합니다. 0.2 μm 필터를 통과하고 최대 2 주 동안 4 °C에서 저장합니다.
- 라미닌 코팅 실험 플레이트 및 슬라이드를 준비하려면 마우스 라미닌 스톡 솔루션(1.19 mg/mL)을 해동하십시오. DMEM의 1mL에 라미닌 스톡 용액 10μL을 넣고 섞습니다. 실험용 플레이트와 슬라이드를 균등하게 코팅하고 37°C, 5% CO2 인큐베이터에 구비하여 회형을 허용하기 전에 적어도 1시간 동안 보관합니다.
참고: 코팅된 실험판과 슬라이드는 최대 2일 동안 4°C로 저장할 수 있습니다.
2. 격리 장치
- 각 격리전에는 버블 트랩을 상단에 메우고 상단 스톱콕을 열어 70%의 세 가지 완전한 세척으로 튜브 및 기타 구성 요소를 청소하십시오.
- 버블 트랩을 상단에 메우고 전체 시스템 3x를 멸균 H2O로 헹구십시오(하단 스톱콕을 닫고 상단 스톱콕을 열어 두십시오).
- 심장 관류 버퍼로 전체 시스템을 헹구고 거품 트랩을 중간쯤에 미디어로 채웁니다.
- 순환 하는 수조를 37°C로 설정합니다.
- 37°C로 미디어에 수조를 설정합니다.
- 연동 펌프 튜브의 기포를 제거합니다.
- 연동 펌프의 유량을 3mL/분으로 조정합니다.
3. 외과 적 수술 (생존 금지)
- 수술 기구를 70% EtOH에 5분 이상 담가 십시오.
- 심장 관류 매체, 심근 세포 정지 버퍼 및 소화 완충액을 37 °C 수조에 놓습니다.
- 심방 심근세포 도금 매체, 심실 심낭 도금 매체 및 심실 심근세포는 37°C, 5% CO2 인큐베이터 1h에 배지를 유지하여 균형을 허용하도록 캡을 느슨하게 한다.
- 10주 된 남성 또는 여성 C57b6/j 마우스를 헤파린의 0.35 mL로 인산염 완충식염수(PBS)에서 100 IU/mL로 희석하여 인산염 완충식식염수체(PBS)를 주입한다. 약 10 분 동안 약물을 적용 할 수 있습니다.
참고: 두 개의 하트가 이 격리 절차를 거치려면 두 번째 마우스를 마취하고 첫 번째 절차에서 이 시점에서 헤파린을 투여할 수 있습니다. 동물에 대한 스트레스를 최소화하기 위해, 가벼운 마취는 밀폐 유도 챔버에서 2 % 이소플루란 / 산소 혼합물을 사용하여 투여 할 수 있습니다. - 동물을 2% 이소플루란/산소 혼합물로 마취시키고 펜토바르비탈(10 mg/mL 스톡에서 0.3mL)으로 i.p.p.를 주입한 다음, 70%의 EtOH로 헤빙하여 가슴을 준비합니다.
- 혼정을 관류 캐뉼라에 리로게이트할 수 있도록 5-0 실크 봉합사를 준비합니다. 수술 현미경 바로 옆에 캐뉼라 산.
- 먼저 중간 복부에서 턱에 이르기까지 중간 선 피부 절개를 한 다음 큰 가위로 복막에 들어가 무딘 해부로 다이어프램을 치우기으로써 가슴을 빠르게 엽니다. 그런 다음 양쪽의 측면 측면에 있는 흉벽을 잘라낸 가위를 사용하여 흉곽을 잘라냅니다.
- 심장과 가슴 벽 사이의 섬유성 연결을 잘라내세요 (흉선 포함). 그런 다음, 모두 함께 늑골 케이지를 잘라. 작은 집게와 가위를 사용하여 정점에 의해 심장을 부드럽게 들어 올리고 심장의 후방 측면을 노출시십시오.
- 오름차순 대동맥에 있는 지명 동맥에 즉시 열등하게 해부하여 심장을 절제하고 즉시 얼음 차가운 PBS 또는 차가운 심장 관류 매체에 심혼을 놓습니다. 그 후, 얼음 차가운 심장 관류 매체에 심어진 심장에서 남은 조직을 신속하게 해부하여 상승하는 대어를 노출시합니다.
참고: 해부학적 랜드마크로 사용하기 위해 흉선과 함께 심을 수 있습니다. - 마이크로 해부 집게와 가위를 사용하여 과잉 조직의 대어를 둘러싼 영역을 청소하십시오. 대어를 미세 한 포셉을 사용하여 캐뉼라에 배치하고 5-0 실크 봉합사로 고정하십시오.
참고: 가장 좋은 배치는 일반적으로 대어타가 캐뉼라에서 약 2mm까지 연장하는 데 발생합니다. - 4 분 동안 3 mL / 분의 유속으로 심장 관류 매체로 캔누클 된 심장을 퍼퓨즈하십시오. 그런 다음 심장 관류 매체에서 15.0-17.5 분 동안 소화 완충으로 미디어를 전환합니다(그림 1A).
참고: 관상 동맥 유량은 효과적인 조직 소화(즉, 창백하고 부은 심장)를 나타내는 증가가능성이 높습니다. - 5.4 단계에서 나중에 사용할 수 있는 관류의 마지막 분 동안 8mL의 소화 버퍼 흐름을 수집합니다.
- 캐뉼라에서 심장을 제거하고 60mm 플라스틱 배양 접시에 놓습니다. 과도한 조직(즉, 대어타, 정맥)을 제거하고 기계적 분리를 위해 2.5mL의 소화 완충제에 심장을 침수한다.
참고: 이 시점에서, 아트리아는 해부되고, 한 실험자는 심방 세포 격리 프로토콜을 수행해야 하며, 두 번째 실험자는 심실 세포 격리를 수행해야 합니다.
4. 심방 세포 격리 및 배양
- 심장에서 멀리 아리아를 해부하고 30mm 플라스틱 문화 접시에 넣습니다. 기계적 분리를 위해 소화 버퍼의 0.75 mL에 침수. 심실을 60mm 접시(3.12단계)에 보관하고 별도의 절연 방법을 동시에 수행합니다(5절, 도 1B).
참고: 이 시점에서, 심실은 왼쪽 과 오른쪽 세포를 격리할 필요가 있는 경우 추가 분리를 겪을 수 있습니다. - 처음에는 미세 팁 수술 가위로 아티아를 잘라내고 애타게 하기 시작하고 추가 다진 미세한 집게를 선택합니다. 조직을 동요하지 말고 근육 섬유를 빠르게 분해하지 마십시오.
- 멸균 이송 파이펫 팁을 사용하여 조직을 15분 동안 부드럽게 혼합하고 분리합니다. 매 5 분, 10 배 객관적인 밝은 필드 현미경에서 조직에서 심방 심근 세포 분리를 관찰. 조직이 더 소화됨에 따라 멸균 이송 파이펫 팁을 사용하여 조직을 부드럽게 혼합하고 해리하여 더 작은 모공 크기로 계속 혼합하고 해리합니다.
- 세포 현탁액을 2mL 멸균 마이크로 원심분리기 튜브로 이송합니다. 37°C 심근세포 정지 버퍼 1의 0.75 mL로 30mm 플레이트를 헹구고 셀 서스펜션(단부 = 1.5mL)과 결합한다.
- 심방 근세포가 실온에서 10 분 동안 중력에 의해 퇴적물을 허용하십시오. 세포 현탁액을 부드럽게 교반하여 심낭이 원문 관의 바닥에 퇴적물을 허용하여 눈에 보이는 펠릿을 형성합니다.
- 20 x g에서5 분 동안 세포 현탁액을 원심 분리합니다. 심근세포가 들어 있는 상체를 조심스럽게 제거하고, 심방 근세포의 펠릿을 방해하지 않고 멸균 파이펫 팁을 사용하여 15mL 폴리프로필렌 원내 튜브로 이송한다.
- 원심 분리는 20,000 x g에서5 분 동안 비 근구 분획을 합니다. 10% 태아 종아리 혈청(FCS)으로 보충된 DMEM의 10mL에서 초퍼를 흡인하고 비근구체 펠릿을 재연한다.
- 혈류계 또는 다른 방법을 사용하여 비근구를 계산한 다음 실험적 필요에 따라 플레이트를 플레이트하거나 형광 활성화 세포분류(도 1C)를통해 개별 특정 세포 집단으로 더 격리한다.
- 심방 심근 세포 도금 매체의 1 mL에서 4.6 단계에서 격리 된 심방 근세포의 펠릿을 다시 중단하고 이 현탁액의 10 μL을 혈종계에 적용합니다. 필드당 막대 모양의 심근세포의 셀 카운트를 수행합니다.
- 미리 코팅된 실험 판/슬라이드에서 흡인 라미닌과 25 μM blebbistatin으로 보충된 심방 심근세포 도금 매체의 적절한 부피에서 격리된 심방 근세포들을 재중단한다. 실험적 요구당 원하는 밀도로플레이트(도 1C).
참고: 여기에 기재된 장기 배양에 대한 전형적인 도금 밀도는 4챔버(1.7cm2)유리 슬라이드상에 5 x 105 세포/챔버이다.
5. 심실 세포 격리 및 배양
- 심실 조직을 잘라내고 애타게 하기 시작하고, 먼저 미세 팁 수술 가위로, 그리고 추가 다진 을 위한 미세한 집게(그림1B)를넣습니다. 근육 섬유를 빠르게 떼어내어 조직을 교반하지 마십시오.
- 셀 서스펜션을 15mL 폴리프로필렌 원내 튜브로 이송한다. 플레이트를 37°C 심사이클 정지 버퍼 1의 2.5mL로 헹구고 셀 서스펜션(말부 = 5mL)과 결합한다.
- 멸균 전달 파이펫 팁을 사용하여 조직을 4 분 동안 부드럽게 혼합하고 해리합니다. 이 셀 서스펜션의 10 μL을 슬라이드에 적용하고 막대 모양의 심근세포의 존재를 시각화하여 절연의 품질을 보장합니다.
- 100 μm 멸균 나일론 필터를 통해 셀 서스펜션을 50mL 폴리프로필렌 원내 튜브에 전달합니다. 3.12 단계에서 수집된 2mL의 소화 버퍼를 사용하여 멸균 나일론 필터에서 남은 세포를 씻어낸다.
- 실온에서 6 분 동안 중력에 의해 퇴적심 심근 세포가 퇴적할 수 있도록하십시오. 여과된 셀 현탁액을 부드럽게 교반하여 심낭이 원식 의 바닥에 퇴적물을 허용하여 눈에 보이는 펠릿을 형성합니다.
- 심실 심낭의 펠릿을 방해하지 않고, 상체(비근구)를 조심스럽게 제거하고 멸균 파이펫 팁을 사용하여 50mL 폴리프로필렌 원내튜브로 이송한다. 원심 분리는 20,000 x g에서5 분 동안 비 근구 분획을 합니다. 10% FCS로 보충된 DMEM의 10mL에서 초퍼를 흡인하고 비근구펠릿을 재연한다.
- 혈종계를 사용하여 비근구를 계산하고 10% FCS로 보충된 적절한 양의 DMEM으로 재보종합니다. 이어서, 실험적 필요에 따라 플레이트, 또는 형광 활성화 세포분류(도 1C)를통해 개별 특정 세포 집단으로 더 격리한다.
- 심근 세포 정지 버퍼 2의 2mL에서 격리된 심실 심근세포를 다시 중단하고 10 μL의 세포 현탁액을 혈중계에 적용한다. 필드당 막대 모양의 심근세포의 셀 카운트를 수행합니다.
- 단계적 패러다임을 사용하여 Ca2+ 재도입
참고: 칼슘 재도입 단계는 심실 근세포에 특정하며, 세포 사멸을 초래할 것이기 때문에 심방 근구를 위해 수행되어서는 안됩니다.- 심실 심근세포 현탁액에 10mM CaCl2의 50 μL을 추가합니다. 잘 섞어서 실온에서 4분 동안 인큐베이션하십시오.
- 심실 심근세포 현탁액에 10mM CaCl2의 50 μL을 추가합니다. 잘 섞어서 실온에서 4분 동안 인큐베이션하십시오.
- 심실 심근세포 현탁액에 10mM CaCl2의 100 μL을 추가합니다. 잘 섞어서 실온에서 4분 동안 인큐베이션하십시오.
- 심실 심근세포 현탁액에 100mM CaCl2의 80 μL을 추가합니다. 잘 섞어서 실온에서 4분 동안 인큐베이션하십시오.
- 플레이트 또는 슬라이드에서 라미닌 코팅을 제거하고 실험적요구(도 1C)에따라 심실 심사이클도금 배지의 적절한 부피에서 격리된 심실 근세포체를 재연한다.
참고: 여기에 기재된 장기 배양에 대한 전형적인 도금 밀도는 4챔버(1.7cm2)유리 슬라이드상에 5 x 105 세포/챔버이다. 세포 과밀도가 세포 응집력을 촉진하므로 75% 이상의 응력의 밀도로 도금을 피하여 플레이트에 부착을 억제합니다. 또한, 많은 수의 세포가 첫 번째 중간 변화 중에 손실됩니다. 세포외 Ca2+가 실행 가능한 근세포의 과수축 및 손실을 촉진함에 따라 격리 후 신속하게 플레이트 셀이 있습니다. - 심실 심근세포가 정착하여 적어도 1h를 붙이도록 합니다. 이어서 25 μM blebbistatin으로 보충된 매체를 유지 관리하는 심실 심근세포로 미디어를 변경합니다.
참고: 심실 심근세포는 μM blebbistatin에서 도금 후 최대 96h까지 배양될 수 있습니다. 실험은 블비스타틴이 없는 경우 배지를 유지하는 심실 심근세포에서 수행되어야 한다.
결과
야생형 10주 된 C57b6/j 마우스 심장은 일반적으로 75,000-150,000 심방 근세포와 1.0-1.5 x 106 심실 근구 사이를 생성하며, 심방 및 심실 내심19의대략적인수율과 동일시됩니다. 격리 중 및 격리 직후, 실행 가능한 심장 심근세포는 막대 모양및 비수축으로 나타나야 합니다. 고립 된 심장 심근 세포의 대다수는 효과적인 관류의 표시인 이 형태에 적응해야 합니다. 막대 모양 형태는 생존 가능성을 예측하는 것일 수도 있습니다. 이 프로토콜은 병들게 된 마우스 심장으로부터 분리된 근세포 및 비근구의 수율과 생존력을 향상시키는 것을 목표로 합니다. 더욱이, 압력 과부하 유발 심부전(데이터가 표시되지 않음)의 모델에서 테스트되었습니다.
심방 및 심실 조직에서 심근세포 및 비근구의 적절하고 복제적인 절연을 확인하기 위해, 세포는 문화권에서 다양한 날에 관찰 및 촬영하였다(도2). 또한, 정량적 역전사 폴리머라제 연쇄 반응(qRT-PCR)은 세포 유형 특이적 전사의 수준을 측정하기 위해 수행되었다. 심장 근육 트로포닌 T(Tnnt2)는심장 심근 세포의 마커이며 심방 및 심실 심장 심근 세포 배양(도 3A)에서강력하게 발현되었다. 대조적으로, 심방 나트리요성펩티드(Nppa는,전형적으로 생리적인 조건 하에서 성인 심방 심장 근세포에서 독점적으로 표현되는) 및 근신광사슬2(Myl2,심실 심세포 특이 유전자)는 각각 심방 및 심실 심장 심근세포 배양에서 견고하고 구체적으로 발현하였다(그림3,C).
섬유아세포 마커, 전사 인자(21),혈소판 유래 성장 인자 수용체 A(Pdgfra) 및 단핵 유래 세포 마커 클러스터(68(Cd68)는 심방 및 심실 챔버(도3D-F)로부터분리된 비심낭 배양물에서 독점적으로 발현되었다. 비근구가 모든 심장 세포의 ~65%를 손상시키며 이들 중 대다수가 섬유아세포 또는 단핵구 유래혈통(18,19,23,24)에서유래한 것으로 추정된다. 따라서, 이 두 혈통에 대한 마커는 심장 병리학의 다양한 모델 및 병인의 연구에서 이러한 세포 집단에 대한 관심을 감안할 때 대표로 선택되었다.
t-튜블러 마커 디하이드로피리딘(DHPR)에 대한 AMAMMs 및 AMVM의 면역염색(DHPR은 전압 의존성(L)형 칼슘 채널)과 라야노딘 수용체(RYR2)를 통해 절연 및 장기 배양(도4A,B)을통해 손상되지 않은 t-tubules를 입증하였다. 심방과 심실 심근 세포에 특이하고 독특한 DHPR및 국소화의 풍요로움은 t-tubules의 존재를 표시했습니다. 더욱이, RYR2 면역염색을 가진 DHPR의 공동지역화는 그대로 이화된 구조물의 표시기이었습니다. 심방 및 심실 심장 근세포에서 육종 단백질 알파 액티닌에 대한 면역 염색은 예상 육종 자구 패턴의 결과. 육종자 살리기 패턴은 TOPRO-3(도4C, D;보라색 및 빨간색)와 함께 막대 모양의 형태 및 핵 염색과 함께 분리된 심장 근구의 순도와 생존가능성을 평가하는 데 사용되었습니다. 예상대로 심실 심장 심근세포는 평균 ~150mm의 길이를 나타내는 반면, 심방 심장 심근세포는 평균 ~75mm를 나타냈다. 더욱이, 면역염색 분석에 따라, 심방 심장 근세포(심실 심장 근세포는 아님)는 내피성 망상및 분비 과립에 국소화의 특징이었던 염색 패턴에서 심방 내트리요성 펩티드(ANP)의 견고한 발현을나타냈다(도 4C,D;녹색).
심방 심장 심근세포에 독특한 특징은 수축 세포 이외에 내분비 세포로서의 분류입니다. 심방 근세포는 기저 조건 하에서 ANP를 분비하는 동안, 분비분비 (즉, 알파-adrenergic 작용제, 페닐레프린 [PE])에 대한 응답으로 증가합니다. 더욱이, 심방 심근세포는 ANP를 분비하고 호르몬의 일부를 전구체 상태(Pro-ANP, 15 kD)로부터 펩타이드(ANP 3kD)16,17로공동 처리한다. 이러한 분비 능력은 급성 PE 치료에 대한 응답으로 격리된 심방 심장 근세포의 매체에서 ANP의 면역블롯 검출을 통해 정량화될 수있다(도 4E). 심방 심장 근세포의 이 분비 및 처리 능력은 배양 조건에 민감한 것으로 나타났습니다. 따라서, 심방 심근세포 도금 매체는 덱사메타손, 인슐린, 이송린 및 셀레늄으로 보충되는 것이 필수적이다.
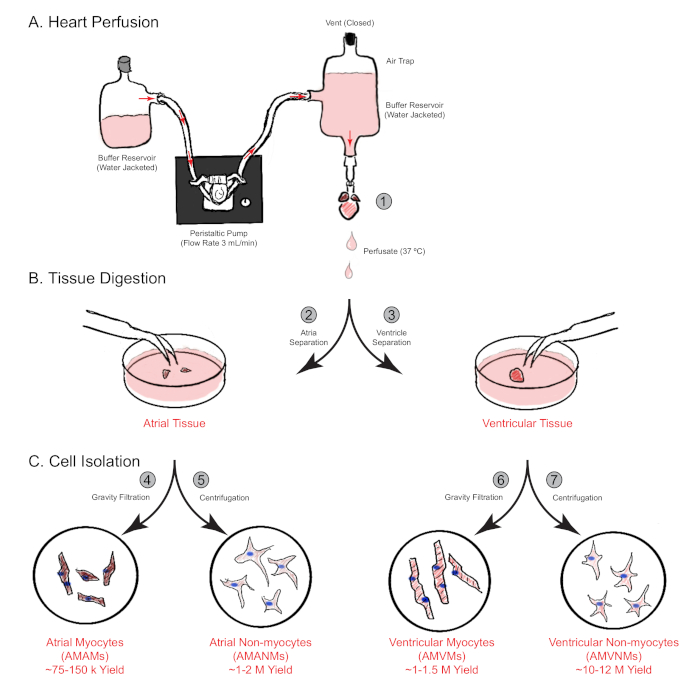
그림 1: 역행 심장 관류, 소화 및 세포 격리에 대한 회로도 개요. 단일 마우스 심혼에서 동시에 심방 과 심실 챔버모두에서 세포 격리에 관여하는 주요 단계는 도시된다. (A)단일 마우스 심장은 오름차순 대마를 통해 빠르게 수거되고 역행 방식으로 침투한다. (B)심혼은 추가 소화 및 물리적 분리를 위해 심방 및 심실 조직으로 분리됩니다. (C)적절한 소화에 따라, 세포는 중력 여과를 통해 후속 실험을 위해 배양되는 총 4개의 세포 분획으로 분리된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
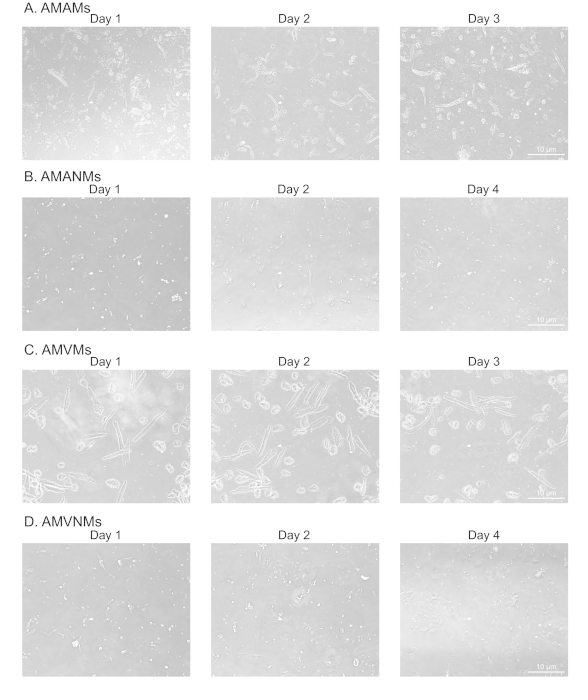
그림 2: 분리된 심방 및 심실 심장 근막 및 문화비 근막세포의 형태학적 분석. (A)고립된 성인 마우스 심방 심근세포(AMAMMs),(B)성인 마우스 심방 비심근세포(AMANMs),(C)성인 마우스 심실 심근세포(AMVM), 또는(D)성인 마우스 심실 비심낭(AMVNM)은 각각 4개의 챔버(1cm)에 5x 105세포/챔버에서 도금하였다. 위상 이미지는 상피 현미경의 밑에 10배 목표를 사용하여 배양에서 표시된 일에서 얻어졌습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
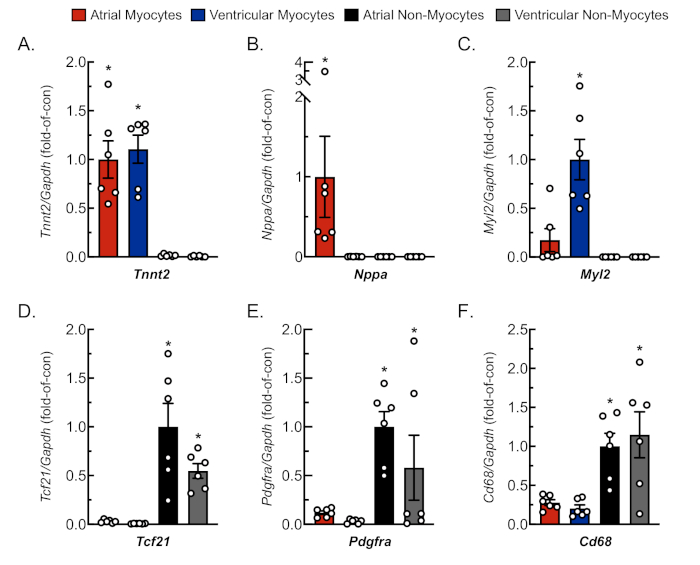
그림 3: 분리된 세포 배양의 대표적인 qRT-PCR 분석. RNA는 새로 분리된 심장 심근세포 및 비심낭체로부터 추출되었고, 세포 특이적 유전자 마커에 대한 mRNA 수준은 qRT-PCR4에의해 결정되었다. (A) Tnnt2,심장 근육 트로포닌 T (심장 심근 세포 마커); (B) Nppa,심방 나트리요르성 펩티드 (심방 심근 세포 마커); (C) Myl2,myosin 광 사슬 2 (심실 심근세포 마커); (D) Tcf21,전사 인자(21)(섬유아세포 마커); (E) Pdgfra,혈소판 유래 성장 인자 수용체 A (섬유아세포 마커); (F) Cd68,분화 68(단세포 유래 세포 마커)의 클러스터. 데이터는 ± ANOVA가 결정한 다음 뉴먼 쿨의 사후 분석으로 결정된 다른 모든 값과 다른 SEM(*p ≤ 0.05)을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
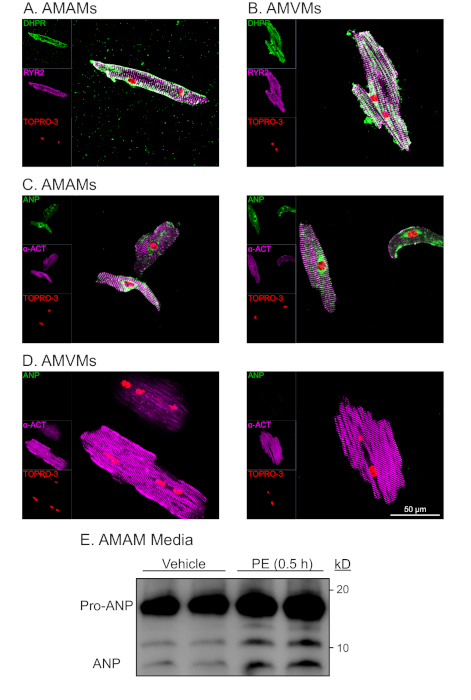
그림 4: 격리된 심방 및 심실 심장 근종의 대표적인 형태학적 및 기능적 분석. (A)AMAMM 또는(B)AMVM은 4 챔버 (1.7cm2)유리 슬라이드에 5 x 105 셀 /챔버에서 도금되어 1 h에 대한 각각의 도금 매체에서 접착제를 허용하였다. 이어서 심방 심근세포 도금 매체를 재공급하거나 16시간 동안 블비스타틴으로 보충된 심실 심근세포로 변경되었다. 배양은 이후 RYR2(보라색), DHPR(녹색), 핵 얼룩 TOPRO-3(빨간색)에 대해 면역염색된 후 고정되었다. (C)AMAMM 또는(D)AMVM은 분리 및 도금된 다음 액틴(보라색), ANP(녹색), 및 TOPRO-3(빨간색)에 대해 면역염색하였다. 각 셀 유형에 대한 두 가지 대표적인 이미지가 표시됩니다. (E)AMAM은 심방 심근 세포 도금 매체에서 16h에 대한 12 개의 잘 배양 접시에 5 x 105 세포 / 잘 도금되었다. AMAM은 이후에 미디어가 수집되고 ANP를 위한 면역blot 분석을 실시하기 전에 차량 또는 ANP 분비학(phenylephrine, 50 mMMMM)으로 0.5h를 치료하였다. 면역블롯 분석 이전에, 미디어 샘플은 500 x g에서 원심분리되어 세포 이물질을 제거하고 관측된 ANP가 AMAMM으로부터의 활성 분비의 결과였는지 확인하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
여기에 설명된 절차를 사용하여 분리된 세포의 품질은 배양에서 세포의 세포 수율 및 전반적인 건강에 의해 결정된 바와 같이, 수많은 제어 가능한 요인에 달려 있다. 마우스 자체부터, 동물에 부과된 스트레스가 과잉 전신 코티솔, 카테콜아민, 및 심장 조직의 과수축 상태로 인해 배양에서 세포 수율 과 생존에 부정적인 영향을 미칠 수 있다는 것을 문서화되었습니다2,5,7. 이러한 이유로, 희생하기 전에 동물을 놀라게하지 않도록 조치를 취해야한다. 이러한 조치에는 동물의 케이지를 덮고 희생하기 전에 비바리움 밖에서 시간을 제한하는 것이 포함됩니다. 안락사에 일반적으로 사용되는 헤파린과 많은 바르비투르산염은 신호 경로에 영향을 미칠 수 있습니다; 따라서, 안락사의 최적 방법은 그에 따라 사용자 정의되어야한다. 동물의 나이는 격리된 세포의 질 그리고 생존가능성에 상당한 영향을 미치며, 조직소화에영향을 미칠 수 있는 노화 과정과 동시에 발생하는 간질 섬유증의 점진적 축적으로 인해 가장 가능성이 높다. 여기에 제시되지 않은 데이터에서, 위에서 설명한 방법은 최대 78주 의 쥐에서 작동하지만, 세포의 질은 이 오래된 동물에서 더 낮았다.
기술된 격리 과정에서 가장 중요한 단계뿐만 아니라 역행 성 구류를 위한 랑엔도르프 장치를 특징으로 하는 다른 프로토콜은 심장의 수분 및 초기 관류입니다. 최적의 결과를 위해, 심장 절제에서 상승 하는 대어타및 관류의 개시에 시간이 더 이상 걸리지 않아야 90 s. 시간 이외에, 두 가지 추가적인 중요한 요인은 관혈 장치에서 수두의 깊이 와 공기 색전증을 도입할 가능성이있다. 따라서, 캐뉼라는 대동맥 뿌리에 들어가지 않도록 오름차순 대동맥으로 진행되어야하며 대동맥 판막을 방해하여 관상 동맥 혈관의 침전을 손상시켜야합니다.
소화 과정에서 심장 심근세포 내성을 감소시키는 소화 효소 콜라게나아제에 장기간 노출되지 않도록 심장의 강성을 정기적으로 테스트하는 것이 중요합니다. 상기 의정서는 칼슘재도입을 위해 고립된 심실 심사이클 배양으로 재도입하기 위해 매장 운영칼슘 채널을 통한 부적절한 칼슘 유입을 통해 심근세포 사멸을 제한하도록 설계되었다. 단년배양(12)의세포사멸을 촉진하기 때문에, 단계적 칼슘 재도입은 고립된 심방 근세포 배양에 대해 수행되어서는 안 된다는 점에 유의해야 한다. 추가 예방 조치를 위해, 여기에 사용되는 관류 및 소화 완충제는 고립 된 심근 세포의 과수축뿐만 아니라 칼슘 역설을 피하기 위해 심장 근육 수축 억제제 부탄 단축 (BDM)을 포함하며, 둘 다 근구생존력(26)에영향을 미친다. 그러나, BDM에서 blebbistatin로의 전환은 격리된 심근세포에 대한 미디어를 유지하는 데 바람직한 수축제이기 때문에 주목해야 한다. 표시되지 않은 데이터에서 blebbistatin은 격리된 심장 심근세포의 장기 문화에 대한 더 큰 생존력을 부여합니다.
격리 직후, 심장 세포, 특히 심근세포의 장기 배양의 파급 효과를 고려하는 것이 중요합니다. 여기에 설명된 심장 비근구 절연 및 배양 프로토콜은 상이한 심장 세포의 다른 밀도 및 접착제 특성을 활용하는 일반적인 방법을 기반으로 합니다. 비 근세포의 장점은 문화에서 높은 확장 잠재력입니다. 따라서, 심장 심근세포와는 달리, 그들은 영속을 위해 통과할 수 있습니다. 그러나, FBS를 가진 중간 보충을 포함하여 배양 조건이 심장 심근세포 기능에 영향을 미칠 수 있다는 것을 알려져 있습니다(27). 여기에 설명된 문화 매체는 특히 격리된 심방 근세포에 대해 생존력을 최적화하고 기능적 한계를 제한하도록 설계되었습니다. blebbistatin 보충의 부재에 문화 후 고립 된 심장 근세포에서 아무 과도 한 손상 된 수축 능력을 관찰 하는 동안, 전기 생리학에 초점을 맞춘 연구, 수축, 그리고 생체 기반 분자 신호에서 다른 단일 세포 격리 후 곧 수행 해야, 육종 구조와 분자 서명은 여전히 그대로 심장의 모방 하는 경우.
심방 근세포의 특징은 수축 기능 외에도 엄청난 분비 능력을 가진 내분비 세포로 달빛을 발하는 능력입니다. 생리학적 조건하에서, 심방 근세포는 방심 성 망상및 자극을 받으면 조절된 외세포증에 대한 자세가 큰 조밀 코어 분비 과립에 저장되는 ANP의 다량생성(16,17). 많은 고립 된 심방 심근 세포 연구는 독특한 전기 생리학적 특성에 초점을 맞추고 있지만, 이것은 문화 매체를 설계하는 첫 번째 연구입니다. 이것은 장기 생존뿐만 아니라 심방 심근세포의 내분비 및 수축 특성의 유지 기능의 촉진을 허용합니다. 단일 마우스 심혼에서 심방 및 심실 챔버에서 모든 세포 유형의 동시 격리뿐만 아니라 배양에 대한이 새로운 방법은 심방 및 심실 심근 세포의 생리적 및 병리학적 특성에 대한 연구에 유용하고 효과적일 것입니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
E.A.B.는 국립 보건원 (1F31HL140850), ARCS 재단, Inc., 샌디에고 지부의 지원을 받았으며, 리스 스텔피 연구 재단 필립스 가우세비츠, SDSU 심장 연구소의 M.D. 학자입니다. E.A..B 및 A.S..B 이나모리 재단의 지원을 받았습니다. CCG 바이(NIH)는 R01 HL135893, R01 HL141463 및 HL149931을 부여합니다.
자료
| Name | Company | Catalog Number | Comments |
| (-)-Blebbistatin | Sigma-Aldrich | B0560 | |
| 1 Liter Water Jacketed Reservoir | Radnoti | 120142-1 | |
| 2,3-Butanedione monoxime | Sigma-Aldrich | B0753 | |
| 5-0 Silk Suture Thread | Fine Science Tools | 18020-50 | |
| Adenosine | Sigma-Aldrich | A9251 | |
| Bovine Serum Albumin | Sigma-Aldrich | A6003 | |
| Bubble Trap Compliance Chamber | Radnoti | 130149 | |
| Calcium Chloride Anhydrous | Fisher Scientific | C614-500 | |
| Carnitine hydrochloride | Sigma-Aldrich | C9500 | |
| Collagenase type 2 | Worthington Biochemical Corporation | LS004176 | |
| Creatine | Sigma-Aldrich | C0780 | |
| Dexamethasone | Sigma-Aldrich | D2915 | |
| DMEM/F12 (1:1; 1X) | Gibco | 11330-032 | |
| Dumont #7 - Fine Forceps | Fine Science Tools | 11274-20 | |
| Epifluorescent micropscpe | Olympus X70 | IX70 | |
| Fetal Bovine Serum (Heat Inactivated) | Omega Scientific | FB-12 | Lot# 206018 |
| Fine Scissors - Sharp | Fine Science Tools | 14060-09 | |
| Graefe Forceps | Fine Science Tools | 11051-10 | |
| Headband Magnifiers | Fine Science Tools | 28030-04 | |
| Hemacytometer (Bright-Line) | Hausser Scientific | 1475 | |
| HEPES (1M) | Gibco | 15630-080 | |
| Inosine | Sigma-Aldrich | I4125 | |
| Insulin-Transferrin-Selenium-X | Gibco | 51500-056 | |
| Isotemp 105 Water Bath | Fisher Scientific | NC0858659 | |
| Isotemp 3006 | Fisher Scientific | 13-874-182 | |
| Joklik Modified Minimum Essential Media | Sigma-Aldrich | M-0518 | |
| Laminin (Natural, Mouse) | Gibco | 1795024 | Lot# 1735572 |
| L-Glutamine | Sigma-Aldrich | G8540 | |
| Masterflex C/L Single-Channel Variable-Speed Compact Pump | Cole-Palmer | EW-77122-24 | |
| Minimum Essential Medium (MEM 1X) | Gibco | 12350-039 | |
| Molecular Biology Grade Water | Corning | 46-000-CM | |
| Pen Strep Glutamine (100X) | Gibco | 10378-016 | |
| Spring Scissors - 6mm Cutting Edge | Fine Science Tools | 15020-15 | |
| Taurine | Sigma-Aldrich | T-8691 |
참고문헌
- Peter, A. K., Bjerke, M. A., Leinwand, L. A. Biology of the cardiac myocyte in heart disease. Molecular Biology of the Cell. 27 (14), 2149-2160 (2016).
- Kruppenbacher, J. P., May, T., Eggers, H. J., Piper, H. M. Cardiomyocytes of adult mice in long-term culture. Naturwissenschaften. 80 (3), 132-134 (1993).
- Ackers-Johnson, M., et al. A Simplified, Langendorff-Free Method for Concomitant Isolation of Viable Cardiac Myocytes and Nonmyocytes From the Adult Mouse Heart. Circulation Research. 119 (8), 909-920 (2016).
- Jin, J. K., et al. ATF6 decreases myocardial ischemia/reperfusion damage and links ER stress and oxidative stress signaling pathways in the heart. Circulation Research. 120 (5), 862-875 (2017).
- Judd, J., Lovas, J., Huang, G. N. Isolation, Culture and Transduction of Adult Mouse Cardiomyocytes. Journal of Visualized Experiments. (114), e54012(2016).
- Li, D., Wu, J., Bai, Y., Zhao, X., Liu, L. Isolation and Culture of Adult Mouse Cardiomyocytes for Cell Signaling and in vitro Cardiac Hypertrophy. Journal of Visualized Experiments. (87), e51357(2014).
- O'Connell, T. D., Ni, Y. G., Lin, K. M., Han, H. P., Yan, Z. Isolation and culture of adult cardiac myocytes for signaling studies. AfCS Research Reports. 1 (5), 1-9 (2003).
- Pinz, I., Zhu, M., Mende, U., Ingwall, J. S. An improvised isolation procedure for adult mouse cardiomyocytes. Cell Biochemistry and Biophysics. 61 (1), 93-101 (2011).
- Piper, H. Culturing of calcium stable adult cardiac myocytes. Journal of Molecular and Cellular Cardiology. 14 (7), 397-412 (1982).
- Shioya, T. A simple technique for isolating healthy heart cells from mouse models. Journal of Physiological Sciences. 57 (6), 327-335 (2007).
- Omatsu-Kanbe, M., Yoshioka, K., Fukunaga, R., Sagawa, H., Matsuura, H. A simple antegrade perfusion method for isolating viable single cardiomyocytes from neonatal and aged mice. Physiological Reports. 6 (9), 13688(2018).
- Jansen, H. J., Rose, R. A. Isolation of Atrial Myocytes from Adult Mice. Journal of Visualized Experiments. (149), e59588(2019).
- Yao, C., et al. Enhanced Cardiomyocyte NLRP3 Inflammasome Signaling Promotes Atrial Fibrillation. Circulation. 138 (20), 2227-2242 (2018).
- Cha, Y., Redfield, M. M., Shen, W., Gersh, B. J. Atrial Fibrillation and Ventricular Dysfunction: A Vicious Electromechanical Cycle. Circulation. 109 (23), 2839-2843 (2004).
- Issa, O., et al. Left atrial size and heart failure hospitalization in patients with diastolic dysfunction and preserved ejection fraction. Journal of Cardiovascular Echography. 27 (1), 1-6 (2017).
- de Bold, A. J. Atrial natriuretic factor: a hormone produced by the heart. Science. 230 (4727), 767-770 (1985).
- McGrath, M. F., de Bold, M. L., de Bold, A. J. The endocrine function of the heart. Trends in Endocrinology and Metabolism. 16 (10), 459-477 (2005).
- Doevendans, P. A., Daemen, M. J., de Muinck, E. D., Smits, J. F. Cardiovascular phenotyping in mice. Cardiovascular Research. 39 (1), 34-49 (1998).
- Banerjee, I., Fuseler, J. W., Price, R. L., Borg, T. K., Baudino, T. A. Determination of cell types and numbers during cardiac development in the neonatal and adult rat and mouse. American Journal of Physiology. 293, 1883-1891 (2007).
- Jugdutt, B. I. Ventricular remodeling after infarction and the extracellular collagen matrix: when is enough enough. Circulation. 108, 1395-1403 (2003).
- Omatsu-Kanbe, M., et al. Identification of cardiac progenitors that survive in the ischemic human heart after ventricular myocyte death. Scientific Reports. , 7(2017).
- Song, K., et al. Heart repair by reprogramming non-myocytes with cardiac transcription factors. Nature. 485, 599-604 (2012).
- Limana, F., et al. bcl-2 overexpression promotes myocyte proliferation. Proceedings of the National Academy of Sciences of the United States of America. 99, 6257-6262 (2002).
- Pinto, A. R., et al. Revisiting cardiac cellular composition. Circulation Research. 118 (3), 400-409 (2015).
- Chen, W., Frangogiannis, N. G. The role of inflammatory and fibrogenic pathways in heart failure associated with aging. Heart Failure Reviews. 15, 415-422 (2010).
- Daly, M. J., Elz, J. S., Nayler, W. G. Contracture and the calcium paradox in the rat heart. Circulation Research. 61 (4), 560-569 (1987).
- Li, Z., Sharma, R. V., Duan, D., Davisson, R. L. Adenovirus-mediated gene transfer to adult mouse cardiomyocytes is selectively influenced by culture medium. Journal of Gene Medicine. 5 (9), 765-772 (2003).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유