Method Article
Aislamiento simultáneo y cultura de los miocitos atriales, los miocitos ventriculares y los no miocitos de un corazón de ratón adulto
En este artículo
Resumen
Se describe un método para el aislamiento simultáneo de micocitos y no miocitos tanto de las adriículas como de los ventrículos de un solo corazón de ratón adulto. Este protocolo da como resultado rendimientos consistentes de micocitos cardíacos altamente viables y no miocitos y detalla condiciones óptimas de cultivo específicos de células para fenotipado y análisis in vitro.
Resumen
El aislamiento y la cultión de los miocitos cardíacos de ratones ha sido esencial para promover la comprensión de la fisiología cardíaca y la fisiopatología. Mientras que aislar los miocitos de corazones de ratón neonatales es relativamente sencillo, se prefieren los miocitos del corazón murino adulto. Esto se debe a que en comparación con las células neonatales, los micocitos adultos recapitulan con mayor precisión la función celular a medida que ocurre en el corazón adulto invivo. Sin embargo, es técnicamente difícil aislar a los micocitos cardíacos de ratón adultos en las cantidades y viabilidad necesarias, lo que contribuye a un impasse experimental. Además, los procedimientos publicados son específicos para el aislamiento de micocitos atriales o ventriculares a expensas de células no miocitos atriales y ventriculares. Aquí se describe un método detallado para aislar micocitos cardíacos auriculares y ventriculares, junto con micocitos no miocitos atriales y ventriculares, simultáneamente desde un solo corazón de ratón. También se proporcionan los detalles para métodos óptimos de cultivo específicos de la célula, que mejoran la viabilidad y la función de la célula. Este protocolo tiene como objetivo no sólo acelerar el proceso de aislamiento de células cardíacas murina adultas, sino también aumentar el rendimiento y viabilidad de las células para las investigaciones de células cardíacas auriculares y ventriculares.
Introducción
El cultivo celular primario es un recurso integral que ofrece un entorno controlado para estudios mecanicistas detallados de la función de miocitos cardíacos. Debido a su naturaleza más duradera y facilidad de aislamiento, los miocitos auriculares y ventriculares de ratas neonatales han sido la fuente común de tales cultivos celulares1. Sin embargo, los miocitos auriculares y ventriculares de ratón adultos (AMAMs y AMVMs) son altamente deseables para estudios in vitro, porque sus características moleculares y funcionales imitan mejor las de las células cardíacas adultas. Así, se han hecho relevantes para estudios relacionados con patologías cardíacas, la mayoría de los cuales se desarrollan en adultos2.
Además, la disponibilidad y el uso de modelos de ratón transgénicos y de enfermedades amplía la utilidad de los micocitos cardíacos adultos aislados. Los protocolos para el aislamiento y la cultura de los AMVMs de ratón para estudios a corto y largo plazo se han descrito en numerosas publicaciones anteriores2,3,4,5,6,7,8,9,10,11. En comparación, se han descrito pocos protocolos para el aislamiento de los AMAMs. Además, los que se describen están optimizados principalmente para estudios agudos de células recién aisladas, sin protocolo de cultivo a largo plazo descrito hasta la fecha11,12,13. Como tal, los protocolos de aislamiento AMAM no fueron diseñados para proporcionar la utilidad y versatilidad de los protocolos publicados para el aislamiento y la cultura de los AMVMs. Además, si bien los estudios pioneros para el aislamiento de amams y AMVMs han demostrado ser ingeniosos, no existen protocolos para un aislamiento y cultivo simultáneo óptimos tanto de los AMAMs como de los AMVMs, lo que resulta en un uso eficiente de todo el corazón para cada preparación.
Hasta ahora, los protocolos de aislamiento AMAM y AMVM publicados no estaban diseñados para el aislamiento simultáneo de ambos tipos de células, porque la mayoría de los estudios sobre la función auricular y ventricular tienen un enfoque específico de la cámara. Por ejemplo, los AMAMs se utilizan predominantemente para estudiar electrofisiología de miocitos auriculares, en parte debido al interés en la fibrilación auricular (AF), la arritmia cardíaca más común en los Estados Unidos. Sin embargo, af no es una enfermedad que afecta a la aria de forma aislada, y se ha implicado como tener un papel causal en la disfunción ventricular izquierda leve a grave14. Además, electrocardiogramas de pacientes con insuficiencia cardíaca con fracción de eyección preservada (HFpEF) han ilustrado que el tamaño del auricular izquierdo es uno de los predictores más fuertes para la susceptibilidad a la insuficiencia cardíaca15.
Además de su papel en la electrofisiología y la contractilidad, el atrio es también un órgano endocrino, secretando cardioquinas (es decir, péptido natriuretic auricular [ANP]) que regulan homeostáticamente la presión arterial y el volumen16,17. Además, ANP (presumiblemente de micocitos auriculares) tiene un papel protector y antihitrófico prominente en los miocitos ventriculares16,17. Si bien existe una fuerte implicación de la comunicación neurohormonal entre atria y ventrículos en varios estados de la enfermedad, los mecanismos subyacentes a esta comunicación no se han explorado completamente. Este punto se ejemplifica además por el aumento de la investigación centrándose en 1) el papel de los no miocitos (específicamente fibroblastos cardíacos y células inmunes) en el corazón enfermo y 2) cómo la remodelación cardíaca en función de la enfermedad afecta directamente a la viabilidad de los miocitos cardíacos y la función cardíaca global18,19,20,21,22. Por lo tanto, estudiar las células cardíacas tanto de atria como de ventrículos es un enfoque necesario para obtener una imagen más completa de sus roles en la fisiopatología cardíaca.
El siguiente protocolo describe el aislamiento simultáneo de micocitos auriculares y ventriculares y no micocitos de un solo corazón de ratón en condiciones fisiológicas y fisiológicas. Además, este método es el primero en describir las condiciones óptimas necesarias para el mantenimiento de cultivos de miocitos cardíacos auriculares, ya que ya se han publicado condiciones para el mantenimiento de cultivos de miocitos ventriculares.
Protocolo
Todas las investigaciones realizadas en ratones reportadas en este documento han sido revisadas y aprobadas por el Comité Institucional de Cuidado y Uso animal de la SDSU y se ajusta a la Guía para el Cuidado y Uso de Animales de Laboratorio publicada por el Consejo Nacional de Investigación.
1. Preparación de medios de aislamiento y cultura y chapado
- Prepare 1 L de medios de perfusión cardíaca antes de su uso añadiendo los medios esenciales mínimos modificados por Joklik (MMEM) a 1 L de agua estéril. Ajuste el pH a 7,36 con 10 N NaOH, luego filtre a través de un filtro de 0,2 μm y guárdelo a 4 °C durante un máximo de 2 semanas.
NOTA: Joklik MMEM consta de 112 mM NaCl, 5,4 mM KCl, 1 mM MgCl2,9 mM NaH2PO4y 11,1 mM D-glucosa. Esto se complementa con 10 mM HEPES (2,38 g/L), 30 mM taurina (3,75 g/L), 2 mM D-l-carnitina (0,4 g/L), 2 mM de creatina y 10 mM de butanedione monoxime (1,01 g/L). - Preparar el amortiguador de digestión justo antes de la perfusión, de la siguiente manera: suplemento 50 ml de medios de perfusión cardíaca con 6.25 μL de 100 mM CaCl2 (ver paso 1.3) y collagenase tipo 2 (actividad enzimática ~310–320 U/mg dw).
NOTA: Pesar al animal antes del sacrificio. La cantidad de colágenasa tipo 2 complementada en el búfer de digestión está dictada por el peso del animal (2,25 mg de colágenasa tipo 2 por 1 g de peso corporal). - Para preparar 100 mM CaCl2,añadir 1,47 g de CaCl2 a 100 ml de agua de grado de biología molecular. Revuelva hasta que se disuelva, luego pase a través de un filtro de 0,2 μm y guárdelo a temperatura ambiente durante un tiempo de hasta 2 meses.
- Preparar el amortiguador de parada de miocitos 1 complementando 90 ml de amortiguador de perfusión cardíaca con 10 ml de suero bovino fetal (FBS) y 125 μL de 100 mM CaCl2. Pase a través de un filtro de 0,2 μm y almacene a 4 °C durante un tiempo de hasta 2 semanas.
- Preparar el amortiguador de parada de miocitos 2 complementando 114 ml de amortiguador de perfusión cardíaca con 6 ml de FBS y 150 μL de CaCl2de 10 mM. Pase a través de un filtro de 0,2 μm y almacene a 4 °C durante un tiempo de hasta 2 semanas.
- Prepare el medio de chapado de miocitos auriculares justo antes de la perfusión complementando 95 ml del medio eagle modificado (DMEM) de Dulbecco con 4 ml de FBS, 1 ml de 100x pluma/estreptococo-glutamina, 1 ml de insulina-transferrina-selenio de 100x y 1 ml de 10 μM dexametasona. Pase a través de un filtro de 0,2 μm y almacene a 37 °C hasta el chapado.
- Preparar el medio de chapado de miocito ventricular complementando 95 ml de medio esencial mínimo (MEM) con 4 ml de FBS, 1 ml de 100x pluma/estreptocococo-glutamina, 10 ml de solución HEPES de 1 M, 1 ml de 100x de insulina-transferrina-selenio, y 0,1 g de monoxime de butanedione. Pase a través de un filtro de 0,2 μm y almacene a 4 °C durante un tiempo de hasta 2 semanas.
- Preparar miocito ventricular manteniendo el medio complementando 99 ml de MEM con 1 ml de 100x insulina-transferrina-selenio, 0,1 mg/mL de albúmina sérica bovina (BSA), 10 ml de solución HEPES de 1 M y 1 ml de 100x pluma/estreptococo-glutamina. Pase a través de un filtro de 0,2 μm y almacene a 4 °C durante un tiempo de hasta 2 semanas.
- Para preparar placas experimentales recubiertas de laminin y diapositivas, descongele la solución de material de laminin del ratón (1,19 mg/ml). Añadir 10 μL de solución de stock de laminin a cada 1 ml de DMEM, y mezclar. Cubra las placas experimentales y se deslice uniformemente y guárdelo en una incubadora de 37 °C, 5% CO2 durante al menos 1 h antes de la perfusión para permitir el equilibrio.
NOTA: Las placas experimentales recubiertas y las diapositivas se pueden almacenar a 4 °C durante un tiempo de hasta 2 días.
2. Aparato de aislamiento
- Antes de cada aislamiento, limpie el tubo y otros componentes del sistema con tres lavados completos del 70% etoh llenando la trampa de burbujas hasta la parte superior (cierre el stopcock inferior y mantenga el stopcock superior abierto).
- Enjuague el sistema completo 3x con H2O estéril rellenando la trampa de burbujas en la parte superior (cierre el stopcock inferior y mantenga el stopcock superior abierto).
- Enjuague el sistema completo con un búfer de perfusión cardíaca y llene la trampa de burbujas a mitad de camino con medios.
- Ajuste el baño de agua circulante a 37 °C.
- Ajuste un baño de agua para medios a 37 °C.
- Retire las burbujas de aire en el tubo de la bomba peristáltica.
- Ajuste el caudal de la bomba peristáltica a 3 ml/min.
3. Procedimiento quirúrgico (no supervivencia)
- Remoje los instrumentos quirúrgicos en etoh al 70% durante al menos 5 minutos.
- Coloque los medios de perfusión cardíaca, los amortiguadores de parada de miocitos y el amortiguador de digestión en el baño de agua de 37 °C.
- Coloque el medio de chapado de miocitos auriculares, el medio de chapado de miocito ventricular y el miocito ventricular manteniendo el medio en una incubadora de 37 °C, 5% CO2 1 h antes de usar y aflojar las tapas para permitir el equilibrio.
- Inyectar ratones C57b6/j machos o hembras de 10 semanas por vía intraperitoneally (i.p.) con 0,35 ml de heparina, diluido en solución salina tamponada de fosfato (PBS) a 100 UI/ml. Deje que el medicamento surta efecto durante unos 10 minutos.
NOTA: Si dos corazones van a ser sometidos a este procedimiento de aislamiento, el segundo ratón puede ser anestesiado y administrado heparina en este punto en el primer procedimiento. Para minimizar el estrés en el animal, la anestesia ligera se puede administrar utilizando una mezcla de isoflurano/oxígeno al 2% en una cámara de inducción herméticamente sellada. - Anestesiar al animal con una mezcla de isoflurano/oxígeno al 2% e inyectar i.p. con pentobarbital (0,3 ml de 10 mg/ml de caldo), luego preparar el pecho frotando con un 70% de EtOH.
- Prepara una sutura de seda atada 5-0 para estar listo para ligar el corazón a la cánula perfusión. Monte la cánula justo al lado del microscopio quirúrgico.
- Abra rápidamente el pecho primero haciendo una incisión de la piel de línea media, desde el medio abdomen hasta la mandíbula, luego entrando en el peritoneo con las grandes tijeras, despejando el diafragma por disección contundente. Luego, corte la caja torácica usando las tijeras con cortes en la pared torácica en el aspecto lateral de ambos lados.
- Cortar las conexiones fibrosas entre el corazón y la pared torácica (incluyendo el timo). Luego, corta la caja torácica. Usando las pequeñas fórceps y tijeras, levante suavemente el corazón por el ápice y exponga el aspecto posterior del corazón.
- Explantar el corazón diseccionando inmediatamente inferior a la arteria innominada en la aorta ascendente e inmediatamente colocar el corazón en PBS helado o medios de perfusión de corazón frío. Posteriormente, disecciona rápidamente el tejido restante del corazón explantado en medios de perfusión de corazón helado, exponiendo la aorta ascendente.
NOTA: Es útil explantar el corazón con el timo intacto para usarlo como un hito anatómico. - Limpie el área que rodea la aorta del exceso de tejido usando fórceps y tijeras micro-diseccionantes. Coloque la aorta en la cánula con fórceps de punta fina y asegure con una sutura de seda de 5-0.
NOTA: La mejor colocación generalmente ocurre con la aorta extendiéndose alrededor de 2 mm hacia arriba en la cánula. - Perfundir el corazón cannulado con medios de perfusión cardíaca a un caudal de 3 ml/min durante 4 min. A continuación, cambie el medio de perfusión cardíaca a búfer de digestión durante 15,0−17,5 min de perfusión (Figura 1A).
NOTA: El caudal coronario probablemente aumentará, lo que indica una digestión efectiva del tejido (es decir, corazón pálido e hinchado). - Recoger 8 ml de flujo de búfer de digestión durante los minutos finales de perfusión para su uso posterior en el paso 5.4.
- Retire el corazón de la cánula y colóquelo en un plato de cultivo plástico de 60 mm. Retire el exceso de tejido (es decir, aorta, venas) y sumerja el corazón en 2,5 ml de amortiguador de digestión en preparación para la separación mecánica.
NOTA: En este punto, las adriículas se diseccionan, y un experimentador debe llevar a cabo el protocolo de aislamiento de células auriculares, mientras que un segundo experimentador debe llevar a cabo el aislamiento de la célula ventricular.
4. Aislamiento y cultivo de células auriculares
- Disecciona el aria lejos del corazón y colóquela en un plato de cultivo plástico de 30 mm. Sumérgelo en 0,75 ml de amortiguador de digestión para separación mecánica. Conservar los ventrículos en el plato de 60 mm (paso 3.12) y llevar a cabo los métodos de aislamiento separados simultáneamente (sección 5, Figura 1B).
NOTA: En este punto, el adriícula y los ventrículos pueden sufrir una mayor separación si es necesario aislar las células del lado izquierdo y derecho. - Comience a picar y burlarse del atria aparte, inicialmente con tijeras quirúrgicas de punta fina y seguido de fórceps finos para más picar. Evite agitar el tejido y no desmonte rápidamente las fibras musculares.
- Usando una punta de pipeta de transferencia estéril, continúe mezclando y desvinculando suavemente el tejido durante 15 minutos. Cada 5 minutos, observe la desvinculación del miocito auricular del tejido bajo un microscopio de campo brillante objetivo de 10x. A medida que el tejido se digiere aún más, continúe mezclando y disociando suavemente el tejido usando una punta de pipeta de transferencia estéril con un tamaño de poro más pequeño.
- Transfiera la suspensión celular a un tubo de micro centrífuga estéril de 2 ml. Enjuague la placa de 30 mm con 0,75 ml de 37 °C de amortiguador de parada de miocitos 1 y combine con la suspensión celular (volumen final = 1,5 ml).
- Permita que los miocitos auriculares sedimenten por gravedad durante 10 minutos a temperatura ambiente. Agitar suavemente la suspensión celular para permitir que los miocitos se sedimenten en la parte inferior del tubo cónico, formando un pellet visible.
- Centrífuga la suspensión celular durante 5 min a 20 x g. Retire cuidadosamente el sobrenadante, que contiene los no miocitos, y transfiéralo a un tubo cónico de polipropileno de 15 ml utilizando una punta de pipeta estéril sin alterar el pellet de los miocitos auriculares.
- Centrífuga la fracción no miocítica durante 5 min a 20.000 x g. Aspirar el sobrenadante y resuspend el pellet no miocito en 10 ml de DMEM complementado con 10% suero de becerro fetal (FCS).
- Cuente los no miocitos utilizando un hemociclo o otro método, luego placa según necesidades experimentales, o aísle aún más en poblaciones celulares específicas individuales a través de la clasificación celular activada por fluorescencia (Figura 1C).
- Resuspend el pellet de miocitos auriculares aislados del paso 4.6 en 1 ml de medio de chapado de miocito auricular y aplicar 10 μL de esta suspensión en un hemocitometro. Realice un recuento celular de miocitos en forma de varilla por campo.
- Aspirar laminina de placas/diapositivas experimentales precoladas y resuspend los miocitos auriculares aislados en el volumen adecuado de miocitos atriales medio de chapado complementado con blebbistatina de 25 μM. Placa a la densidad deseada por necesidades experimentales (Figura 1C).
NOTA: La densidad de chapado típica para la culturing a largo plazo descrita aquí es de 5 x 105 celdas/cámara en diapositivas de vidrio de cuatro cámaras (1,7 cm2).
5. Aislamiento y cultivo celular ventricular
- Comience a picar y burlarse del tejido ventricular, primero con tijeras quirúrgicas de punta fina y seguido de fórceps finos para mincing adicional(Figura 1B). Evite agitar el tejido separando rápidamente las fibras musculares.
- Transfiera la suspensión celular a un tubo cónico de polipropileno de 15 ml. Enjuague la placa con 2,5 ml de 37 °C buffer de parada de miocitos 1 y combine con la suspensión celular (volumen final = 5 mL).
- Usando una punta de pipeta de transferencia estéril, continúe mezclando y desvinculando suavemente el tejido durante 4 minutos. Aplique 10 μL de esta suspensión celular en la diapositiva y visualice la presencia de miocitos en forma de varilla para garantizar la calidad del aislamiento.
- Pase la suspensión celular a través de un filtro de nylon estéril de 100 μm en un tubo cónico de polipropileno de 50 ml. Utilice 2 ml de búfer de digestión recogido en el paso 3.12 para lavar las células restantes del filtro de nylon estéril.
- Deje que los miocitos ventriculares se sedimenten por gravedad durante 6 minutos a temperatura ambiente. Agitar suavemente la suspensión celular filtrada para permitir que los miocitos se sedimenten en la parte inferior del cónico, formando un pellet visible.
- Sin perturbar el pellet de los miocitos ventriculares, retire cuidadosamente el sobrenadante (no miocitos) y transfiéralo a un tubo cónico de polipropileno de 50 ml utilizando una punta de pipeta estéril. Centrífuga la fracción no miocítica durante 5 min a 20.000 x g. Aspirar el sobrenadante y resuspend el pellet no miocito en 10 mL de DMEM complementado con 10% FCS.
- Cuente los no miocitos usando un hemociclo y resuspend en un volumen adecuado de DMEM complementado con 10% FCS. A continuación, placa de acuerdo con las necesidades experimentales, o aislar en poblaciones celulares específicas individuales a través de la clasificación celular activada por fluorescencia (Figura 1C).
- Resuspend los miocitos ventriculares aislados en 2 ml de amortiguador de parada de miocitos 2 y aplicar 10 μL de suspensión celular en hemocitos. Realice un recuento celular de miocitos en forma de varilla por campo.
- Reintroducción de Ca2+ utilizando un paradigma escalonado
NOTA: Los pasos de reintroducción de calcio son específicos para los miocitos ventriculares y no deben realizarse para los miocitos auriculares, ya que esto dará lugar a la muerte celular.- Añadir 50 μL de CaCl2 de 10 mM a la suspensión ventricular de células miocíticas. Mezcle bien e incuba durante 4 minutos a temperatura ambiente.
- Agregue 50 μL adicionales de CaCl2 de 10 mM a la suspensión ventricular de células miocíticas. Mezcle bien e incuba durante 4 minutos a temperatura ambiente.
- Añada 100 μL adicionales de CaCl2 de 10 mM a la suspensión ventricular de células miocíticas. Mezcle bien e incuba durante 4 minutos a temperatura ambiente.
- Añadir 80 μL de 100 mM CaCl2 a la suspensión ventricular de células miocíticas. Mezcle bien e incuba durante 4 minutos a temperatura ambiente.
- Retire el recubrimiento de laminin de placas o toboganes y resuspend los miocitos ventriculares aislados en un volumen adecuado de medio de chapado de miocito ventricular según necesidades experimentales (Figura 1C).
NOTA: La densidad de chapado típica para la culturing a largo plazo descrita aquí es de 5 x 105 celdas/cámara en diapositivas de vidrio de cuatro cámaras (1,7 cm2). Evite el chapado a una densidad superior al 75% de confluencia, ya que la sobre-densificación celular promueve el aglutinamiento celular, inhibiendo así el apego a la placa. Además, se perderá un gran número de células durante el primer cambio medio. Las células de placa rápidamente después del aislamiento, como ca2+ extracelular promueve la hipercontratción y la pérdida de micocitos viables. - Deje que los miocitos ventriculares se asienten y se adhieran por lo menos 1 h. Posteriormente cambie el medio a miocito ventricular manteniendo el medio complementado con blebbistatina de 25 μM.
NOTA: Los miocitos ventriculares se pueden cultivar hasta 96 h después de chapar en blebbistatina μM. Los experimentos deben realizarse en miocito ventricular manteniendo el medio en ausencia de blebbistatina.
Resultados
Un corazón de ratón C57b6/j de 10 semanas de antigüedad de 10 semanas de edad normalmente resulta en entre 75,000-150,000 miocitos auriculares y 1.0−1.5 x 106 miocitos ventriculares, un rendimiento aproximado del 30%-50% para los miocitos auriculares y ventriculares18,19. Durante e inmediatamente después de los aislamientos, los micocitos cardíacos viables deben aparecer en forma de varilla y no contraerse. La mayoría de los micocitos cardíacos aislados deben adaptar esta morfología, lo que es una indicación de perfusión efectiva. La morfología en forma de varilla también puede ser un predictor de viabilidad. El protocolo tiene como objetivo mejorar el rendimiento y la viabilidad de los miocitos y no miocitos aislados de un corazón de ratón enfermo. Además, se ha probado en un modelo de insuficiencia cardíaca inducida por sobrecarga de presión (datos no mostrados).
Para confirmar el aislamiento adecuado y replicable de micocitos y no miocitos del tejido auricular y ventricular, se observaron y fotografiaron células en varios días de cultivo(Figura 2). Además, se realizó una reacción cuantitativa en cadena de polimerasa de transcripción inversa (qRT-PCR) para medir los niveles de transcripciones que eran específicas del tipo de célula. Troponina muscular cardíaca T (Tnnt2) es un marcador de miocitos cardíacos y se expresó sólidamente en cultivos de miocitos cardíacos auriculares y ventriculares(Figura 3A). Por el contrario, los péptidos natriuréticos auriculares(Nppa, que normalmente se expresa exclusivamente en micocitos cardíacos auriculares adultos en condiciones fisiológicas) y la cadena de luz de miosina 2(Myl2,que es un gen específico del micocito ventricular) se expresaron sólida y específicamente en cultivos de micocitos cardíacos atriales y ventriculares, respectivamente (Figura 3B, C).
Los marcadores de fibroblasto, el factor de transcripción 21(Tcf21),el receptor de factor de crecimiento derivado de plaquetas A (Pdgfra)y el grupo de marcadores celulares derivados de monocitos de diferenciación 68 (Cd68) se expresaron exclusivamente en cultivos no miocitos aislados de cámaras auriculares y ventriculares (Figura 3D-F). Se estima que los no miocitos comprometen ~65% de todas las células cardíacas y que la mayoría de estas se originan a partir de un fibroblasto o linaje derivado del monocito18,19,23,24. Así, se eligieron marcadores para estos dos linajes para ser representativos, dado el interés en estas poblaciones celulares en estudios de diversos modelos y etiologías de patología cardiaca.
La inmunodetención de AMAMs y AMVMs para el marcador t-tubule dihydropyridine (DHPR, que es un canal de calcio tipo voltaje (L)), así como el receptor de ryanodina (RYR2) demostraron t-tubules intactos a lo largo del aislamiento y el cultivo a largo plazo (Figura 4A,B). La abundancia de DHPR y la localización que era característica y única de los miocitos atriales y ventriculares indicaban la presencia de t-tubules. Además, la colocación de DHPR con inmunostaining RYR2 fue un indicador de estructuras de diad intactas. La inmunodetención de la proteína sarcomerica alfa-actinina en micocitos cardíacos atriales y ventriculares dio lugar al patrón de desgaste sarcomerico esperado. El patrón de estriación sarcomerica se utilizó para evaluar la pureza y viabilidad de los micocitos cardíacos aislados junto con la forma morfológica en forma de varilla y la tinción nuclear con TOPRO-3(Figura 4C,D;púrpura y rojo). Como era de esperar, los miocitos cardíacos ventriculares eran grandes, exhibiendo una longitud media de ~150 mm, mientras que los micocitos cardíacos auriculares promediaban ~75 mm. Además, tras el análisis inmunostaining, los miocitos cardíacos auriculares (pero no los miocitos cardíacos ventriculares) mostraron una expresión robusta de péptido natriurético auricular (ANP) en un patrón de tinción que era característico de la localización a los gránulos endoplasmáticos de reticulum y secretor(Figura 4C,D;verde).
Una característica única de los miocitos cardíacos auriculares es su clasificación como una célula endocrina además de la célula contráctil. Mientras que los miocitos auriculares secretan ANP en condiciones basales, la secreción aumenta en respuesta a los secretagogos (es decir, el agonista alfa-adrenérgico, fenilefrina [PE]). Además, los miocitos cardíacos auriculares secretan ANP y procesan co-secretamente una porción de la hormona desde su estado precursor (Pro-ANP, 15 kD) hasta el péptido del producto (ANP 3kD)16,17. Esta capacidad secretora se puede cuantificar mediante la detección de inmunoblot de ANP en el medio de micocitos cardíacos auriculares aislados en respuesta al tratamiento agudo de EP(Figura 4E). Esta capacidad secretora y de procesamiento del miocito cardíaco auricular se encontró que era sensible a las condiciones de cultivo. Por lo tanto, es imperativo que el medio de chapado de miocito auricular se complemente con dexametasona, insulina, transferrina y selenio.
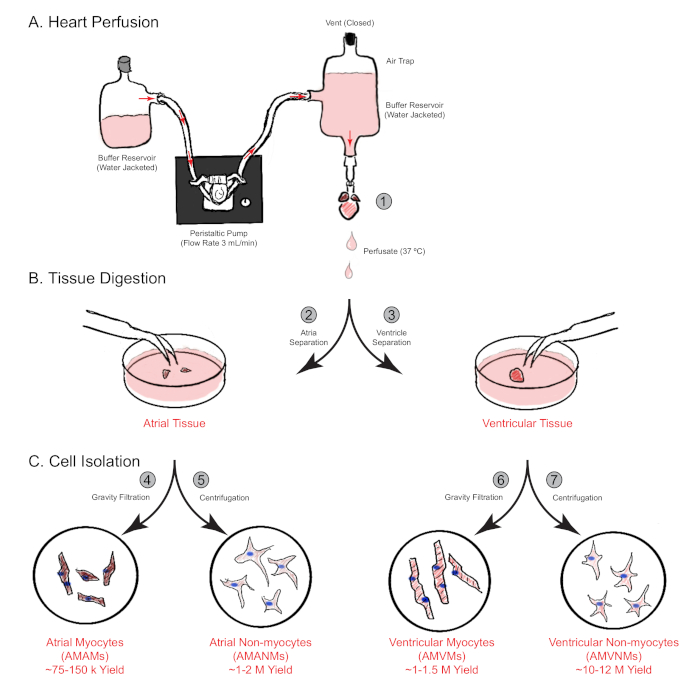
Figura 1: Visión general esquemática de perfusión cardíaca retrógrada, digestión y aislamiento celular. Se muestran los pasos principales implicados en el aislamiento celular de las cámaras auriculares y ventriculares simultáneamente desde un solo corazón de ratón. (A) Un solo corazón de ratón se puede cannular rápidamente a través de la aorta ascendente y perfundido de una manera retrógrada. (B) El corazón se separa en tejidos auriculares y ventriculares para una mayor digestión y separación física. (C) Después de una digestión adecuada, las células se separan mediante filtración por gravedad en un total de cuatro fracciones celulares que se cultivan para su posterior experimentación. Haga clic aquí para ver una versión más grande de esta figura.
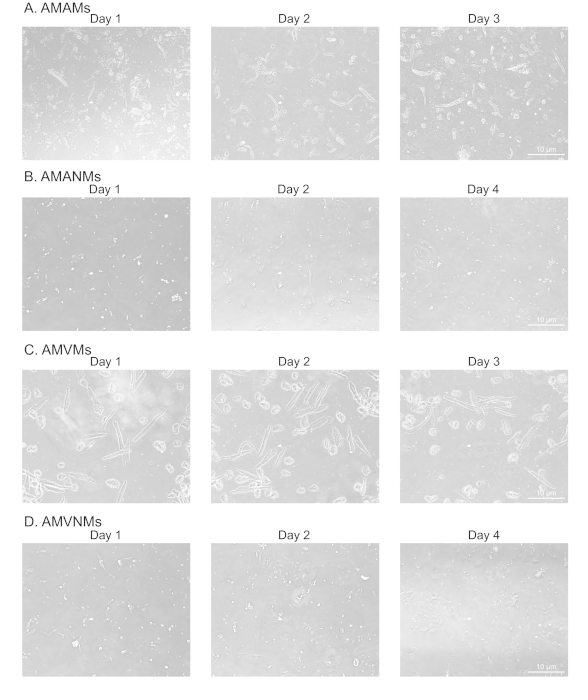
Figura 2: Análisis morfológico de micocitos cardíacos aislados auriculares y ventriculares y no micocitos en el cultivo. (A) micocitos auriculares de ratón adultos aislados (AMAMs), (B) litocitos auriculares de ratón adultos (AMANM), (C) miocitos ventriculares de ratón adultos (AMVMs) o (D) los ventrcitos ventriculares de ratón adultos (AMVNMs) fueron chapados en 5 x 105 celdas/cámara en toboganes de vidrio de cuatro cámaras (1,7 cm2)en los respectivos medios chapados. Las imágenes de fase se obtuvieron en días indicados en el cultivo utilizando un objetivo de 10x bajo un microscopio de epifluorescencia. Haga clic aquí para ver una versión más grande de esta figura.
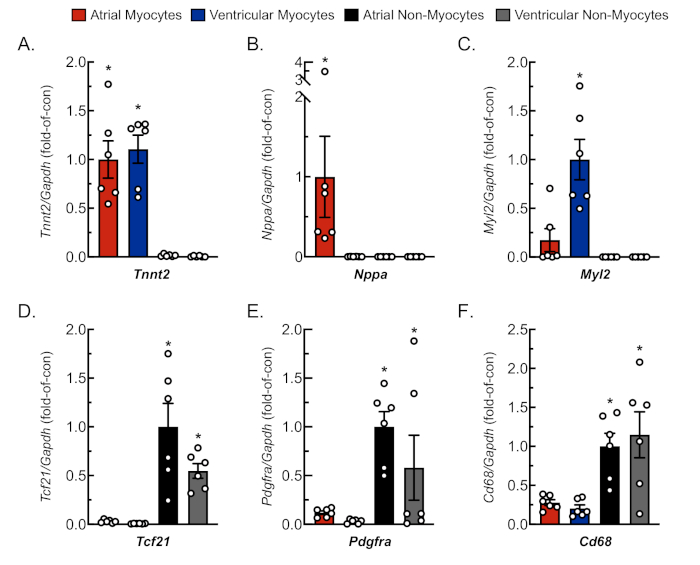
Figura 3: Análisis representativo qRT-PCR de cultivos celulares aislados. El ARN se extrajo de micocitos cardíacos y no miocitos recién aislados, y los niveles de ARNM para marcadores genéticos específicos de las células fueron determinados por qRT-PCR4. (A) Tnnt2, troponina muscular cardíaca T (marcador de miocito cardíaco); (B) Nppa,péptido natriurético auricular (marcador de miocito auricular); (C) Myl2, cadena de luz de miosina 2 (marcador de miocito ventricular); (D) Tcf21, factor de transcripción 21 (marcador de fibroblasto); (E) Pdgfra, receptor de factor de crecimiento derivado de plaquetas A (marcador de fibroblasto); (F) Cd68, clúster de diferenciación 68 (marcador de celda derivado de monocitos). Los datos representan una media ± SEM (*p ≤ 0,05 diferente de todos los demás valores, según lo determinado por ANOVA seguido del análisis post hoc de Newman Keul). Haga clic aquí para ver una versión más grande de esta figura.
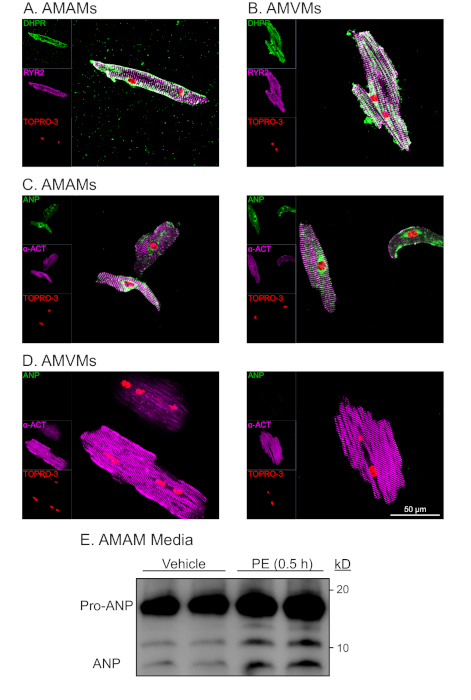
Figura 4: Análisis morfológico y funcional representativo de mioyctes cardíacos aislados auriculares y ventriculares. (A) Los AMAMs o (B) AMVMs fueron chapados en 5 x 105 celdas/cámara en diapositivas de vidrio de cuatro cámaras (1,7 cm2)en los respectivos soportes de chapado durante 1 h para permitir la adhesión. Esto fue seguido por la retroalimentación de medios de chapado de miocito auricular o el cambio a miocito ventricular manteniendo los medios complementados con blebbistatina por 16 h adicionales. Posteriormente se fijaron cultivos para RYR2 (púrpura), DHPR (verde) y mancha nuclear TOPRO-3 (rojo). (C) Los AMAMs o (D) AMVMs fueron aislados y chapados, luego inmunodeprimido para a-actinin (púrpura), ANP (verde) y TOPRO-3 (rojo). Se muestran dos imágenes representativas para cada tipo de celda. (E) Los AMAMs fueron chapados a 5 x 105 celdas/pozo en un plato de 12 cultivos de pozos durante 16 h en medios de chapado de miocitos auriculares. Posteriormente, los AMAMs fueron tratados durante 0,5 h con vehículo o el secretagogo ANP (fenilefrina, 50 mM) antes de que los medios de comunicación fueran recogidos y sometidos a análisis de inmunoblot para ANP. Antes del análisis de inmunoblot, las muestras de medios se centrifugaban a 500 x g durante 5 minutos para eliminar los desechos celulares y asegurar que el ANP observado fuera el resultado de la secreción activa de los AMAMs. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La calidad de las células aisladas utilizando el procedimiento descrito aquí, determinado por el rendimiento celular y la salud general de las células en el cultivo, depende de numerosos factores controlables. A partir del propio ratón, se ha documentado que el estrés impuesto al animal puede afectar negativamente el rendimiento celular y la viabilidad en el cultivo, presumiblemente debido al exceso de cortisol sistémico, catecolaminas y el estado hipercontratista del tejido cardíaco2,5,7. Por estas razones, se deben tomar medidas para evitar alarmar al animal antes del sacrificio. Tales medidas incluyen cubrir la jaula del animal y limitar el tiempo fuera del vivario antes del sacrificio. La heparina y muchos barbitúricos comúnmente utilizados para la eutanasia pueden afectar las vías de señalización; por lo tanto, el método óptimo de eutanasia debe personalizarse en consecuencia. La edad del animal tiene un impacto considerable en la calidad y viabilidad de las células aisladas, más probablemente debido a la acumulación progresiva de fibrosis intersticial que ocurre simultáneamente con el proceso de envejecimiento, que puede afectar a la digestión del tejido25. En los datos no presentados aquí, mientras que el método descrito anteriormente funciona en ratones de hasta 78 semanas de edad, la calidad de las células era menor en estos animales mayores.
El paso más crítico en el proceso de aislamiento descrito, así como otros protocolos con un aparato Langendorff para perfusión retrógrada, es la canulación y perfusión inicial del corazón. Para obtener resultados óptimos, el tiempo desde la explantación cardíaca hasta la canulación de la aorta ascendente y el inicio de la perfusión no debe tardar más de 90 s. Además del tiempo, dos factores importantes adicionales son la profundidad de la cánula y la posibilidad de introducir embolia de aire desde el aparato de perfusión. En consecuencia, la cánula debe avanzar hacia la aorta ascendente para no entrar en la raíz aórtica y obstruir la válvula aórtica, lo que perjudicaría la perfusión de los vasos coronarios.
Durante el proceso de digestión, es importante probar regularmente la rigidez del corazón para evitar la exposición prolongada a la enzima digestiva collagenase, que reduce la tolerancia al calcio de miocitos cardíacos. El protocolo descrito anteriormente para la reintroducción de calcio en los cultivos aislados de miocito ventricular fue diseñado para limitar la muerte por miocito cardíaco a través de una afluencia inadecuada de calcio a través de canales de calcio operados por la tienda. Cabe señalar que la reintroducción escalonada del calcio no debe realizarse para cultivos aislados de miocitos auriculares, ya que esto promoverá la muerte celular durante la cultura a corto y largo plazo12. Para mayor precaución, los tampones de perfusión y digestión utilizados aquí incluyen el inhibidor de contracción muscular cardíaca butanedione monoxime (BDM) para evitar la hipercontratción de micocitos aislados, así como la paradoja del calcio, ambos de los cuales afectan la viabilidad del miocito26. Sin embargo, el cambio de BDM a blebbistatina debe tenerse en cuenta, ya que es el agente anticontratista preferido en el mantenimiento de medios para micocitos cardíacos aislados. En los datos no mostrados, la blebbistatina confiere una mayor viabilidad para el cultivo a largo plazo de micocitos cardíacos aislados.
Inmediatamente después del aislamiento, es importante considerar las ramificaciones de la cultura a largo plazo de las células cardíacas, especialmente los miocitos. El protocolo cardíaco de aislamiento y culto no miocito descrito aquí se basa en métodos comunes que aprovechan las diferentes sensibilidades y propiedades adhesivas de diferentes células cardíacas. El beneficio de los no miocitos es su alto potencial de expansión en la cultura; por lo tanto, a diferencia de los miocitos cardíacos, son aptos para pasar por la perpetuación. Sin embargo, se sabe que las condiciones de cultivo, incluyendo la suplementación media con FBS, pueden afectar a la funcionalidad de miocitos cardíacos27. Los medios de cultivo descritos aquí fueron diseñados para optimizar la viabilidad y limitar los desorganización funcionales, especialmente para los miocitos auriculares aislados. Si bien no se observó una capacidad contráctil con discapacidad excesiva en micocitos cardíacos aislados después del cultivo en ausencia de suplementos de blebbistatina, los estudios que se centran en la electrofisiología, la contractilidad y otras señales moleculares in vivo de una sola célula deben realizarse poco después del aislamiento, cuando la estructura sarcomerica y la firma molecular todavía imitan la del corazón intacto.
Una característica distintiva del miocito auricular es su capacidad para la luz de la luna como una célula endocrina con inmensa capacidad secretora, además de su función contractile. En condiciones fisiológicas, los micocitos auriculares producen grandes cantidades de ANP, que se almacena en el reticulum endoplasmático y en grandes gránulos secretos de núcleo denso listos para la exocitosis regulada al recibir un estímulo16,17. Mientras que muchos estudios aislados de micocitos auriculares se centran en sus propiedades electrofisiológicas únicas, este es el primer estudio para diseñar un medio de cultivo. Esto permite la viabilidad a largo plazo, así como la promoción de las funciones mantenidas de las propiedades endocrinas y contractiles de los miocitos auriculares. Este novedoso método de culto, así como el aislamiento simultáneo de todos los tipos de células de cámaras auriculares y ventriculares de un solo corazón de ratón, serán útiles y eficaces para los estudios sobre las propiedades fisiológicas y fisiofisiológicas de los micocitos auriculares y ventriculares.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
E.A.B. fue apoyado por los Institutos Nacionales de Salud (1F31HL140850), la Fundación ARCS, Inc., Capítulo de San Diego, y es una Fundación de Investigación Rees-Stealy Phillips Gausewitz, M.D. Scholar del SDSU Heart Institute. E.A.B. y A.S.B. recibieron el apoyo de la Fundación Inamori. CCG by (NIH) otorga R01 HL135893, R01 HL141463 y HL149931.
Materiales
| Name | Company | Catalog Number | Comments |
| (-)-Blebbistatin | Sigma-Aldrich | B0560 | |
| 1 Liter Water Jacketed Reservoir | Radnoti | 120142-1 | |
| 2,3-Butanedione monoxime | Sigma-Aldrich | B0753 | |
| 5-0 Silk Suture Thread | Fine Science Tools | 18020-50 | |
| Adenosine | Sigma-Aldrich | A9251 | |
| Bovine Serum Albumin | Sigma-Aldrich | A6003 | |
| Bubble Trap Compliance Chamber | Radnoti | 130149 | |
| Calcium Chloride Anhydrous | Fisher Scientific | C614-500 | |
| Carnitine hydrochloride | Sigma-Aldrich | C9500 | |
| Collagenase type 2 | Worthington Biochemical Corporation | LS004176 | |
| Creatine | Sigma-Aldrich | C0780 | |
| Dexamethasone | Sigma-Aldrich | D2915 | |
| DMEM/F12 (1:1; 1X) | Gibco | 11330-032 | |
| Dumont #7 - Fine Forceps | Fine Science Tools | 11274-20 | |
| Epifluorescent micropscpe | Olympus X70 | IX70 | |
| Fetal Bovine Serum (Heat Inactivated) | Omega Scientific | FB-12 | Lot# 206018 |
| Fine Scissors - Sharp | Fine Science Tools | 14060-09 | |
| Graefe Forceps | Fine Science Tools | 11051-10 | |
| Headband Magnifiers | Fine Science Tools | 28030-04 | |
| Hemacytometer (Bright-Line) | Hausser Scientific | 1475 | |
| HEPES (1M) | Gibco | 15630-080 | |
| Inosine | Sigma-Aldrich | I4125 | |
| Insulin-Transferrin-Selenium-X | Gibco | 51500-056 | |
| Isotemp 105 Water Bath | Fisher Scientific | NC0858659 | |
| Isotemp 3006 | Fisher Scientific | 13-874-182 | |
| Joklik Modified Minimum Essential Media | Sigma-Aldrich | M-0518 | |
| Laminin (Natural, Mouse) | Gibco | 1795024 | Lot# 1735572 |
| L-Glutamine | Sigma-Aldrich | G8540 | |
| Masterflex C/L Single-Channel Variable-Speed Compact Pump | Cole-Palmer | EW-77122-24 | |
| Minimum Essential Medium (MEM 1X) | Gibco | 12350-039 | |
| Molecular Biology Grade Water | Corning | 46-000-CM | |
| Pen Strep Glutamine (100X) | Gibco | 10378-016 | |
| Spring Scissors - 6mm Cutting Edge | Fine Science Tools | 15020-15 | |
| Taurine | Sigma-Aldrich | T-8691 |
Referencias
- Peter, A. K., Bjerke, M. A., Leinwand, L. A. Biology of the cardiac myocyte in heart disease. Molecular Biology of the Cell. 27 (14), 2149-2160 (2016).
- Kruppenbacher, J. P., May, T., Eggers, H. J., Piper, H. M. Cardiomyocytes of adult mice in long-term culture. Naturwissenschaften. 80 (3), 132-134 (1993).
- Ackers-Johnson, M., et al. A Simplified, Langendorff-Free Method for Concomitant Isolation of Viable Cardiac Myocytes and Nonmyocytes From the Adult Mouse Heart. Circulation Research. 119 (8), 909-920 (2016).
- Jin, J. K., et al. ATF6 decreases myocardial ischemia/reperfusion damage and links ER stress and oxidative stress signaling pathways in the heart. Circulation Research. 120 (5), 862-875 (2017).
- Judd, J., Lovas, J., Huang, G. N. Isolation, Culture and Transduction of Adult Mouse Cardiomyocytes. Journal of Visualized Experiments. (114), e54012(2016).
- Li, D., Wu, J., Bai, Y., Zhao, X., Liu, L. Isolation and Culture of Adult Mouse Cardiomyocytes for Cell Signaling and in vitro Cardiac Hypertrophy. Journal of Visualized Experiments. (87), e51357(2014).
- O'Connell, T. D., Ni, Y. G., Lin, K. M., Han, H. P., Yan, Z. Isolation and culture of adult cardiac myocytes for signaling studies. AfCS Research Reports. 1 (5), 1-9 (2003).
- Pinz, I., Zhu, M., Mende, U., Ingwall, J. S. An improvised isolation procedure for adult mouse cardiomyocytes. Cell Biochemistry and Biophysics. 61 (1), 93-101 (2011).
- Piper, H. Culturing of calcium stable adult cardiac myocytes. Journal of Molecular and Cellular Cardiology. 14 (7), 397-412 (1982).
- Shioya, T. A simple technique for isolating healthy heart cells from mouse models. Journal of Physiological Sciences. 57 (6), 327-335 (2007).
- Omatsu-Kanbe, M., Yoshioka, K., Fukunaga, R., Sagawa, H., Matsuura, H. A simple antegrade perfusion method for isolating viable single cardiomyocytes from neonatal and aged mice. Physiological Reports. 6 (9), 13688(2018).
- Jansen, H. J., Rose, R. A. Isolation of Atrial Myocytes from Adult Mice. Journal of Visualized Experiments. (149), e59588(2019).
- Yao, C., et al. Enhanced Cardiomyocyte NLRP3 Inflammasome Signaling Promotes Atrial Fibrillation. Circulation. 138 (20), 2227-2242 (2018).
- Cha, Y., Redfield, M. M., Shen, W., Gersh, B. J. Atrial Fibrillation and Ventricular Dysfunction: A Vicious Electromechanical Cycle. Circulation. 109 (23), 2839-2843 (2004).
- Issa, O., et al. Left atrial size and heart failure hospitalization in patients with diastolic dysfunction and preserved ejection fraction. Journal of Cardiovascular Echography. 27 (1), 1-6 (2017).
- de Bold, A. J. Atrial natriuretic factor: a hormone produced by the heart. Science. 230 (4727), 767-770 (1985).
- McGrath, M. F., de Bold, M. L., de Bold, A. J. The endocrine function of the heart. Trends in Endocrinology and Metabolism. 16 (10), 459-477 (2005).
- Doevendans, P. A., Daemen, M. J., de Muinck, E. D., Smits, J. F. Cardiovascular phenotyping in mice. Cardiovascular Research. 39 (1), 34-49 (1998).
- Banerjee, I., Fuseler, J. W., Price, R. L., Borg, T. K., Baudino, T. A. Determination of cell types and numbers during cardiac development in the neonatal and adult rat and mouse. American Journal of Physiology. 293, 1883-1891 (2007).
- Jugdutt, B. I. Ventricular remodeling after infarction and the extracellular collagen matrix: when is enough enough. Circulation. 108, 1395-1403 (2003).
- Omatsu-Kanbe, M., et al. Identification of cardiac progenitors that survive in the ischemic human heart after ventricular myocyte death. Scientific Reports. , 7(2017).
- Song, K., et al. Heart repair by reprogramming non-myocytes with cardiac transcription factors. Nature. 485, 599-604 (2012).
- Limana, F., et al. bcl-2 overexpression promotes myocyte proliferation. Proceedings of the National Academy of Sciences of the United States of America. 99, 6257-6262 (2002).
- Pinto, A. R., et al. Revisiting cardiac cellular composition. Circulation Research. 118 (3), 400-409 (2015).
- Chen, W., Frangogiannis, N. G. The role of inflammatory and fibrogenic pathways in heart failure associated with aging. Heart Failure Reviews. 15, 415-422 (2010).
- Daly, M. J., Elz, J. S., Nayler, W. G. Contracture and the calcium paradox in the rat heart. Circulation Research. 61 (4), 560-569 (1987).
- Li, Z., Sharma, R. V., Duan, D., Davisson, R. L. Adenovirus-mediated gene transfer to adult mouse cardiomyocytes is selectively influenced by culture medium. Journal of Gene Medicine. 5 (9), 765-772 (2003).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados