Method Article
Isolamento simultaneo e cultura di miociti atriali, miociti ventricolari e non miociti da un cuore di topo adulto
In questo articolo
Riepilogo
Un metodo è descritto per l'isolamento simultaneo di miociti e non miociti sia dagli atri che dai ventricoli di un singolo cuore adulto di topo. Questo protocollo si traduce in rese costanti di miociti cardiaci altamente vitali e non miociti e descrive in dettaglio le condizioni ottimali di coltura specifica delle cellule per la fenotipizzazione e l'analisi in vitro.
Abstract
L'isolamento e la ristrutturazione dei miociti cardiaci dai topi è stato essenziale per promuovere la comprensione della fisiologia cardiaca e della fisiopatologia. Mentre isolare i miociti dai cuori neonatali del topo è relativamente semplice, i miociti dal cuore murino adulto sono preferiti. Questo perché rispetto alle cellule neonatali, i miociti adulti ricapitolano più accuratamente la funzione cellulare come avviene nel cuore adulto in vivo. Tuttavia, è tecnicamente difficile isolare i miociti cardiaci del topo adulto nelle quantità e nella vitalità necessarie, il che contribuisce a un'impasse sperimentale. Inoltre, le procedure pubblicate sono specifiche per l'isolamento dei miociti atriali o ventricolari a scapito delle cellule non miociti atriali e ventricolari. Qui descritto è un metodo dettagliato per isolare i miociti cardiaci atriali e ventricolari, insieme ai non miociti atriali e ventricolari, contemporaneamente da un singolo cuore di topo. Sono inoltre forniti i dettagli per metodi di coltivazione ottimali specifici delle cellule, che migliorano la vitalità e la funzione cellulare. Questo protocollo mira non solo ad accelerare il processo di isolamento delle cellule cardiache murine adulte, ma anche ad aumentare la resa e la vitalità delle cellule per le indagini sulle cellule cardiache atriali e ventricolari.
Introduzione
La coltura cellulare primaria è una risorsa integrale che offre un ambiente controllato per studi meccanicistici dettagliati sulla funzione del miocita cardiaco. A causa della loro natura più duratura e della facilità di isolamento, i miociti atriali e ventricolari del ratto neonatale sono stati la fonte comune di talicolture cellulari 1. Tuttavia, i miociti atriali e ventricolari del topo adulto (AMAM e AMVM) sono altamente desiderabili per gli studi in vitro, perché le loro caratteristiche molecolari e funzionali imitano meglio quelle delle cellule cardiache adulte. Pertanto, sono diventati rilevanti per gli studi relativi alle patologie cardiache, la maggior parte delle quali si sviluppano negliadulti 2.
Inoltre, la disponibilità e l'uso di modelli transgenici e di topi di malattia espande l'utilità di miociti cardiaci adulti isolati. I protocolli per l'isolamento e la coltura degli AMMM del topo per studi a breve e lungo termine sono stati descritti in numerosepubblicazioni precedenti 2,3,4,5,6,7,8,9,10,11. In confronto, sono stati descritti pochi protocolli per l'isolamento degli AMAM. Inoltre, quelli descritti sono principalmente ottimizzati per studi acuti di cellule appena isolate, senza alcun protocollo di coltivazione a lungo terminedescritto fino ad oggi 11,12,13. Pertanto, i protocolli di isolamento AMAM non sono stati progettati per fornire l'utilità e la versatilità dei protocolli pubblicati per l'isolamento e la cultura degli AMMM. Inoltre, mentre gli studi pionieristici per l'isolamento di AMAM e AMVM si sono dimostrati intraprendenti, non esistono protocolli per l'isolamento e la cultura simultanei ottimali sia degli AMAM che degli AMVM, il che si traduce in un uso efficiente di tutto il cuore per ogni preparazione.
Fino ad ora, i protocolli di isolamento AMAM e AMVM pubblicati non erano progettati per l'isolamento simultaneo di entrambi i tipi di cellule, perché la maggior parte degli studi sulla funzione atriale e ventricolare hanno un focus specifico della camera. Ad esempio, gli AMAM sono usati prevalentemente per studiare l'elettrofisiologia atriale dei miociti, in parte a causa dell'interesse per la fibrillazione atriale (AF), l'aritmia cardiaca più comune negli Stati Uniti. Tuttavia, l'AF non è una malattia che colpisce gli atri in isolamento, ed è stato implicato come avente un ruolo causale nella disfunzione ventricolare sinistra da lieve agrave 14. Inoltre, gli elettrocardiogrammi di pazienti con insufficienza cardiaca con frazione di espulsione preservata (HFpEF) hanno dimostrato che la dimensione atriale sinistra è uno dei predittori più forti per la suscettibilità all'insufficienza cardiaca15.
Oltre al suo ruolo nell'elettrofisiologia e nella contrattilità, l'atrio è anche un organo endocrino, secernendo cardiochine (cioè peptide natriuretico atriale [ANP]) che regolano omeostaticamente la pressione sanguigna e il volume16,17. Inoltre, l'ANP (presumibilmente da miociti atriali) ha un ruolo protettivo e anti-ipertrofico prominente nei miociti ventricolari16,17. Mentre c'è una forte implicazione della comunicazione neuroormonale tra atri e ventricoli in vari stati di malattia, i meccanismi alla base di questa comunicazione non sono stati completamente esplorati. Questo punto è ulteriormente esemplificato dall'impennata della ricerca incentrata su 1) il ruolo dei non miociti (in particolare fibroblasti cardiaci e cellule immunitarie) nel cuore mato e 2) come il rimodellamento cardiaco in funzione della malattia influenzi direttamente la vitalità dei miociti cardiaci e la funzione cardiaca globale18,19,20,21,22. Pertanto, lo studio delle cellule cardiache sia dagli atri che dai ventricoli è un approccio necessario per ottenere un quadro più completo del loro ruolo nella fisiopatologia cardiaca.
Il seguente protocollo descrive l'isolamento simultaneo di miociti atriali e ventricolari e non miociti da un singolo cuore di topo in condizioni fisiologiche e fisiopatiche. Inoltre, questo metodo è il primo a descrivere le condizioni ottimali necessarie per mantenere le colture di miociti cardiaci atriali, poiché sono già state pubblicate le condizioni per il mantenimento di colture di miociti ventricolari.
Protocollo
Tutte le ricerche effettuate sui topi riportate in questo documento sono state esaminate e approvate dal Comitato istituzionale per la cura e l'uso degli animali della SDSU ed è conforme alla Guida per la cura e l'uso degli animali da laboratorio pubblicata dal Consiglio Nazionale delle Ricerche.
1. Preparazione dei mezzi di isolamento e della cultura e placcatura
- Preparare 1 L di mezzi perfusione cardiaca prima dell'uso aggiungendo joklik media essenziali minimi modificati (MMEM) a 1 L di acqua sterile. Regolare il pH a 7,36 con 10 N NaOH, quindi filtrare attraverso un filtro da 0,2 μm e conservare a 4 °C per un massimo di 2 settimane.
NOTA: Joklik MMEM è composto da NaCl da 112 mM, 5,4 mM KCl, 1 mM MgCl2,9 mM NaH2PO4e 11,1 mM D-glucosio. Questo è integrato con 10 mM HEPES (2,38 g/L), 30 mM di taurina (3,75 g/L), 2 mM D-l-carnitina (0,4 g/L), 2 mM di creatina e 10 mM di butanedione monoxime (1,01 g/L). - Preparare il tampone di digestione appena prima della perfusione, come segue: integrare 50 mL di mezzi perfusionali cardiaci con 6,25 μL di CaCl2 da 100 mM (vedere fase 1.3) e collagenasi di tipo 2 (attività enzimatica ~310-320 U/mg dw).
NOTA: Pesare l'animale prima del sacrificio. La quantità di collagenasi di tipo 2 integrata nel tampone di digestione è dettata dal peso dell'animale (2,25 mg di collagenasi di tipo 2 per 1 g di peso corporeo). - Per preparare 100 mM CaCl2, aggiungere 1,47 g di CaClda 2 a 100 mL di acqua di biologia molecolare. Mescolare fino allo scioglimento, quindi passare attraverso un filtro da 0,2 μm e conservare a temperatura ambiente per un massimo di 2 mesi.
- Preparare il tampone di arresto del miocita 1 integrando 90 mL di tampone perfusione cardiaca con 10 mL di siero bovino fetale (FBS) e 125 μL di 100 mM CaCl2. Passare attraverso un filtro da 0,2 μm e conservare a 4 °C per un massimo di 2 settimane.
- Preparare il tampone di arresto del miocita 2 integrando 114 mL di tampone perfusione cardiaca con 6 mL di FBS e 150 μL di 10 mM CaCl2. Passare attraverso un filtro da 0,2 μm e conservare a 4 °C per un massimo di 2 settimane.
- Preparare il mezzo di placcatura del miocita atriale appena prima della perfusione integrando 95 mL del mezzo aquila modificato di Dulbecco (DMEM) con 4 mL di FBS, 1 mL di 100x penna/ strep-glutammina, 1 mL di 100x insulino-transferrina-selenio e 1 mL di 10 μM di desametasone. Passare attraverso un filtro da 0,2 μm e conservare a 37 °C fino alla placcatura.
- Preparare il mezzo di placcatura del miocita ventricolare integrando 95 mL di mezzo essenziale minimo (MEM) con 4 mL di FBS, 1 mL di penna/streptoammina 100x, 10 mL di soluzione hepes da 1 M, 1 mL di 100x insulino-transferrina-selenio e 0,1 g di monoxime di butanedione. Passare attraverso un filtro da 0,2 μm e conservare a 4 °C per un massimo di 2 settimane.
- Preparare il mezzo di mantenimento del miocita ventricolare integrando 99 mL di MEM con 1 mL di 100x insulino-transferrina-selenio, 0,1 mg/mL di albumina di siero bovino (BSA), 10 mL di 1 soluzione hepes e 1 mL di penna/strep-glutammina 100x. Passare attraverso un filtro da 0,2 μm e conservare a 4 °C per un massimo di 2 settimane.
- Per preparare lastre e vetrini sperimentali rivestiti di laminina, scongelare la soluzione di laminina del topo (1,19 mg/mL). Aggiungere 10 μL di soluzione di laminina ad ogni 1 mL di DMEM e mescolare. Rivestire le piastre sperimentali e gli scivoli in modo uniforme e conservare in un incubatore di CO2 da 37 °C, 5% per almeno 1 h prima della perfusione per consentire l'equilibrazione.
NOTA: Piastre sperimentali rivestite e vetrini possono essere conservati a 4 °C per un massimo di 2 giorni.
2. Apparecchi di isolamento
- Prima di ogni isolamento, pulire i tubi e altri componenti del sistema con tre lavaggi completi del 70% EtOH riempiendo la trappola a bolle verso l'alto (chiudere il fermagli inferiore e tenere aperto il fermagli superiore).
- Risciacquare il sistema completo 3x con sterile H2O riempiendo la trappola a bolle verso l'alto (chiudere il punto di arresto inferiore e tenere aperto il fermagli superiore).
- Risciacquare il sistema completo con tampone perfusione cardiaca e riempire la trappola a bolle a metà strada con i supporti.
- Impostare il bagno d'acqua circolante a 37 °C.
- Impostare un bagno d'acqua per i supporti a 37 °C.
- Rimuovere eventuali bolle d'aria nei tubi della pompa peristaltica.
- Regolare la portata della pompa peristaltica a 3 mL/min.
3. Procedura chirurgica (non sopravvivenza)
- Immergere gli strumenti chirurgici in EtOH al 70% per almeno 5 minuti.
- Posizionare i mezzi di perfusione cardiaca, i tamponi di arresto del miocita e il tampone di digestione nel bagno d'acqua a 37 °C.
- Posizionare il mezzo di placcatura del miocita atriale, il mezzo di placcatura del miocita ventricolare e il mezzo di mantenimento del miocita ventricolare in un'incubatrice di CO 2 5%1 h prima dell'uso e allentare i tappi per consentire l'equilibrazione.
- Iniettare topi C57b6/j di 10 settimane per via intraperitoneale (i.p.) con 0,35 mL di eparina, diluiti in soluzione salina tamponata di fosfato (PBS) a 100 UI/mL. Lasciare che il farmaco ha effetto per circa 10 minuti.
NOTA: Se due cuori devono essere sottoposti a questa procedura di isolamento, il secondo topo può essere anestetizzato e somministrato eparina a questo punto della prima procedura. Per ridurre al minimo lo stress sull'animale, l'anestesia leggera può essere somministrata utilizzando una miscela isoflurane/ossigeno al 2% in una camera di induzione ermeticamente sigillata. - Anestetizzare l'animale con una miscela isoflurane/ossigeno al 2% e iniettare i.p. con pentobarbital (0,3 mL da 10 mg/mL di stock), quindi preparare il torace tamponando con 70% EtOH.
- Preparare una sutura di seta 5-0 legata per essere pronti a legare il cuore alla cannula perfusione. Monta la cannula proprio accanto al microscopio chirurgico.
- Aprire rapidamente il torace prima facendo un'incisione della pelle di linea mediana, dal medio addome alla mascella, quindi entrando nel peritoneo con le grandi forbici, cancellando il diaframma via per dissezione smussata. Quindi, tagliare la gabbia toracica usando le forbici con tagli sulla parete toracica sull'aspetto laterale di entrambi i lati.
- Snip via connessioni fibrose tra il cuore e la parete toracica (incluso il timo). Quindi, taglia la gabbia toracica tutti insieme. Usando le piccole forcep e forbici, sollevare delicatamente il cuore dall'apice ed esporre l'aspetto posteriore del cuore.
- Espiantare il cuore sezionando immediatamente inferiore all'arteria innominata sull'aorta ascendente e posizionare immediatamente il cuore in PBS ghiacciato o mezzi perfusione cardiaca fredda. Successivamente, sezionare rapidamente il tessuto rimanente dal cuore esimpiantato nei mezzi di perfusione del cuore ghiacciato, esponendo l'aorta ascendente.
NOTA: È utile espiantare il cuore con il timo intatto da utilizzare come punto di riferimento anatomico. - Pulire l'area circostante l'aorta del tessuto in eccesso utilizzando forcelle e forbici microsezionanti. Posizionare l'aorta sulla cannula utilizzando forcep a punta fine e fissare con una sutura di seta 5-0.
NOTA: Il miglior posizionamento di solito si verifica con l'aorta che si estende per circa 2 mm sulla cannula. - Perfondere il cuore cannulato con mezzi di perfusione cardiaca ad una portata di 3 mL/min per 4 min. Quindi passare dal supporto perfusione cardiaca al tampone di digestione per 15,0−17,5 minuti di perfusione (Figura 1A).
NOTA: La portata coronarica aumenterà probabilmente, indicando un'efficace digestione dei tessuti (cioè un cuore pallido e gonfio). - Raccogliere 8 mL di flusso tampone di digestione durante gli ultimi minuti di perfusione per un uso successivo nel passaggio 5.4.
- Togliere il cuore dalla cannula e posizionarlo su un piatto di coltura di plastica da 60 mm. Rimuovere il tessuto in eccesso (cioè aorta, vene) e immergere il cuore in 2,5 mL di tampone di digestione in preparazione alla separazione meccanica.
NOTA: A questo punto, gli atri vengono sezionati e uno sperimentatore deve condurre il protocollo di isolamento cellulare atriale, mentre un secondo sperimentatore dovrebbe condurre l'isolamento cellulare ventricolare.
4. Isolamento e coltura delle cellule atriali
- Sezionare l'atria lontano dal cuore e posizionare in un piatto di coltura plastica da 30 mm. Immergerlo in 0,75 mL di tampone di digestione per la separazione meccanica. Tenere i ventricoli nella piastra da 60 mm (fase 3.12) ed eseguire simultaneamente i metodi di isolamento separati (sezione 5, figura 1B).
NOTA: A questo punto, gli atri e i ventricoli possono subire un'ulteriore separazione in caso di necessità di isolare le cellule sinistra e destra. - Inizia a tritare e prendere in giro l'atria a parte, inizialmente con forbici chirurgiche a punta fine e seguita da forcep fini per ulteriori tritacazioni. Evitare di agitare il tessuto e non smontare rapidamente le fibre muscolari.
- Utilizzando una punta sterile di pipetta di trasferimento, continuare a mescolare delicatamente e dissociare il tessuto per 15 minuti. Ogni 5 minuti, osservare la dissociazione atriale del miocita dal tessuto sotto un microscopio a campo luminoso obiettivo 10x. Man mano che il tessuto diventa ulteriormente digerito, continuare a mescolare e dissociare delicatamente il tessuto utilizzando una punta sterile di pipetta di trasferimento con una dimensione dei pori più piccola.
- Trasferire la sospensione cellulare in un tubo di micro-centrifuga sterile da 2 ml. Risciacquare la piastra da 30 mm con 0,75 mL di 37 °C di tampone di arresto del miocita 1 e combinarlo con la sospensione cellulare (volume finale = 1,5 mL).
- Lasciare che i miociti atriali sedimentino per gravità per 10 minuti a temperatura ambiente. Agitare delicatamente la sospensione cellulare per consentire ai miociti di sedimentare sul fondo del tubo conico, formando un pellet visibile.
- Centrifugare la sospensione cellulare per 5 min a 20 x g. Rimuovere con cura il supernatante, che contiene i non miociti, e trasferirlo in un tubo conico in polipropilene da 15 ml utilizzando una punta sterile senza disturbare il pellet di miociti atriali.
- Centrifugare la frazione non miocita per 5 min a 20.000 x g. Aspirare il supernatante e rimescolare il pellet non miocita in 10 mL di DMEM integrato con siero di vitello fetale al 10% (FCS).
- Contare i non miociti utilizzando un emocitometro o un altro metodo, quindi la piastra in base alle esigenze sperimentali o isolare ulteriormente in singole popolazioni cellulari specifiche tramite smistamento cellulare attivato dalla fluorescenza (Figura 1C).
- Rimescolare il pellet di miociti atriali isolati dal passo 4.6 in 1 mL di mezzo di placcatura del miocita atriale e applicare 10 μL di questa sospensione su un emocitometro. Eseguire un conteggio delle celle di miociti a forma di asta per campo.
- Aspirare la laminina da piastre/scivoli sperimentali prerivestiti e rimosombiare i miociti atriali isolati nel volume appropriato del mezzo di placcatura del miocita atriale integrato con blebbistatina da 25 μM. Piastra alla densità desiderata per esigenze sperimentali (Figura 1C).
NOTA: La densità di placcatura tipica per la ristrutturazione a lungo termine qui descritta è di 5 x 105 celle /camera su vetri a quattro camere (1,7 cm2).
5. Isolamento e coltura cellulare ventricolare
- Inizia a tritare e stuzzicare il cuore a parte il tessuto ventricolare, prima con forbici chirurgiche a punta fine e seguito da forcelle fini per ulteriori tritacazioni(Figura 1B). Evitare di agitare il tessuto separando rapidamente le fibre muscolari.
- Trasferire la sospensione cellulare su un tubo conico in polipropilene da 15 ml. Risciacquare la piastra con 2,5 mL di 37 °C di tampone di arresto del miocita 1 e combinare con la sospensione cellulare (volume finale = 5 mL).
- Utilizzando una punta sterile di pipetta di trasferimento, continuare a mescolare delicatamente e dissociare il tessuto per 4 minuti. Applicare 10 μL di questa sospensione cellulare sullo scivolo e visualizzare la presenza di miociti a forma di asta per garantire la qualità dell'isolamento.
- Passare la sospensione cellulare attraverso un filtro in nylon sterile da 100 μm in un tubo conico in polipropilene da 50 ml. Utilizzare 2 mL di tampone di digestione raccolto nel passaggio 3.12 per lavare eventuali cellule rimanenti dal filtro sterile in nylon.
- Lasciare che i miociti ventricolari sedimentano per gravità per 6 minuti a temperatura ambiente. Agitare delicatamente la sospensione cellulare filtrata per consentire ai miociti di sedimentare sul fondo del conico, formando un pellet visibile.
- Senza disturbare il pellet di miociti ventricolari, rimuovere con cura il supernatante (non miociti) e trasferirlo in un tubo conico in polipropilene da 50 ml utilizzando una punta sterile di pipetta. Centrifugare la frazione non miocita per 5 min a 20.000 x g. Aspirare il supernatante e rimescolare il pellet non miocita in 10 mL di DMEM integrato con FCS al 10%.
- Contare i non miociti utilizzando un emocitometro e rimescolare in un volume appropriato di DMEM integrato con FCS al 10%. Quindi, piastra in base alle esigenze sperimentali, o isolare ulteriormente in singole popolazioni cellulari specifiche tramite smistamento cellulare attivato dalla fluorescenza (Figura 1C).
- Rimescolare i miociti ventricolari isolati in 2 mL di tampone di arresto del miocita 2 e applicare 10 μL di sospensione cellulare sull'emocitometro. Eseguire un conteggio delle celle di miociti a forma di asta per campo.
- Reintroduzione di Ca2+ usando un paradigma graduale
NOTA: I passaggi di reintroduzione del calcio sono specifici per i miociti ventricolari e non devono essere eseguiti per i miociti atriali, in quanto ciò comporterà la morte cellulare.- Aggiungere 50 μL di CaCl2 da 10 mM alla sospensione della cella del miocita ventricolare. Mescolare bene e incubare per 4 minuti a temperatura ambiente.
- Aggiungere altri 50 μL di CaCl2 da 10 mM alla sospensione cellulare del miocita ventricolare. Mescolare bene e incubare per 4 minuti a temperatura ambiente.
- Aggiungere altri 100 μL di CaCl2 da 10 mM alla sospensione cellulare del miocita ventricolare. Mescolare bene e incubare per 4 minuti a temperatura ambiente.
- Aggiungere 80 μL di CaCl2 da 100 mM alla sospensione cellulare del miocita ventricolare. Mescolare bene e incubare per 4 minuti a temperatura ambiente.
- Rimuovere il rivestimento di laminina da piastre o diapositive e rimosodere i miociti ventricolari isolati in un volume appropriato di mezzo di placcatura del miocita ventricolare in base alle esigenze sperimentali (Figura 1C).
NOTA: La densità di placcatura tipica per la ristrutturazione a lungo termine qui descritta è di 5 x 105 celle /camera su vetri a quattro camere (1,7 cm2). Evitare la placcatura a una densità superiore al 75% di confluenza, poiché la sovrade densificazione cellulare favorisce il raggruppamento cellulare, inibendo così l'attaccamento alla piastra. Inoltre, un gran numero di cellule andrà perso durante il primo cambiamento medio. Le cellule piastra rapidamente dopo l'isolamento, poiché l'extracellulare Ca2 + promuove l'ipercontrazione e la perdita di miociti vitali. - Lasciare che i miociti ventricolari si sistemino e aderiscano per almeno 1 h. Successivamente cambiare il supporto in miocita ventricolare mantenendo il mezzo integrato con blebbistatina da 25 μM.
NOTA: I miociti ventricolari possono essere coltivati fino a 96 ore dopo la placcatura in blebbistatina μM. Gli esperimenti devono essere effettuati in mezzo di mantenimento del miocita ventricolare in assenza di blebbistatina.
Risultati
Un cuore di topo C57b6/j di tipo selvatico di 10 settimane in genere si traduce in tra 75.000−150.000 miociti atriali e 1,0−1,5 x 106 miociti ventricolari, pari a una resa approssimativa del 30%−50% per i miociti atriali e ventricolari18,19. Durante e immediatamente dopo gli isolamenti, i miociti cardiaci vitali dovrebbero apparire a forma di asta e non contraenti. La maggior parte dei miociti cardiaci isolati dovrebbe adattare questa morfologia, che è un'indicazione di perfusione efficace. La morfologia a forma di asta può anche essere un predittore della vitalità. Il protocollo mira a migliorare la resa e la vitalità di miociti e non miociti isolati da un cuore di topo mato. Inoltre, è stato testato in un modello di insufficienza cardiaca indotta da sovraccarico di pressione (dati non mostrati).
Per confermare un isolamento adeguato e replicabile di miociti e non miociti dal tessuto atriale e ventricolare, le cellule sono state osservate e fotografate in vari giorni dicoltura (figura 2). Inoltre, è stata eseguita una reazione quantitativa a catena della polimerasi a trascrizione inversa (qRT-PCR) per misurare i livelli di trascrizioni specifiche del tipo di cellula. La troponina muscolare cardiaca T (Tnnt2) è un marcatore dei miociti cardiaci ed è stata espressa in modo robusto sia nelle colture di miociti cardiaci atriali che ventricolari(Figura 3A). Al contrario, il peptide natriuretico atriale (Nppa, che è tipicamente espresso esclusivamente nei miociti cardiaci atriali adulti in condizioni fisiologiche) e la catena luminosa della miosina 2(Myl2, che è un gene specifico del miocita ventricolare) sono stati espressi rispettivamente in colture di miociti cardiaci atriali e ventricolari(figura 3B,C).
I marcatori di fibroblasti, il fattore di trascrizione 21 (Tcf21), il recettore del fattore di crescita derivato dalle piastrine A (Pdgfra) e il gruppo marcatore cellulare derivato dai monociti di differenziazione 68 (Cd68) sono stati espressi esclusivamente in colture non miocite isolate sia dalle camere atriali che ventricolari(figura 3D−F). Si stima che i non miociti compromettono ~ 65% di tutte le cellule cardiache e che la maggior parte di queste provengano da un fibroblasto o da un lignaggio derivato da monociti18,19,23,24. Così, i marcatori per questi due lignaggi sono stati scelti per essere rappresentativi, dato l'interesse per queste popolazioni cellulari negli studi di vari modelli ed eziologie di patologia cardiaca.
L'immunosottenimento di AMAM e AMVM per il marcatore t-tubulo diidropiridina (DHPR, che è un canale di calcio dipendente dalla tensione (L)) e il recettore della ryanodina (RYR2) hanno dimostrato t-tubuli intatti durante l'isolamento e la coltura a lungo termine(figura 4A,B). L'abbondanza di DHPR e localizzazione che era caratteristica e unica per i miociti atriali e ventricolari indicava la presenza di t-tubuli. Inoltre, la colocalizzazione del DHPR con l'immunosocienza RYR2 era un indicatore delle strutture di diad intatte. L'immunostaining per la proteina sarcomerica alfa-actina nei miociti cardiaci atriali e ventricolari ha portato al previsto modello di striazione sarcomerica. Il modello di striazione sarcomerica è stato utilizzato per valutare la purezza e la vitalità dei miociti cardiaci isolati in combinazione con la forma morfologica a forma di bastone e la colorazione nucleare con TOPRO-3(Figura 4C,D; viola e rosso). Come previsto, i miociti cardiaci ventricolari erano grandi, con una lunghezza media di ~ 150 mm, mentre i miociti cardiaci atriali erano in media ~ 75 mm. Inoltre, dopo l'analisi immunostaining, i miociti cardiaci atriali (ma non i miociti cardiaci ventricolari) mostravano una robusta espressione del peptide natriuretico atriale (ANP) in un modello di colorazione caratteristico della localizzazione al reticolo endoplasmatico e ai granuli di secretoria(figura 4C,D; verde).
Una caratteristica unica dei miociti cardiaci atriali è la sua classificazione come cellula endocrina oltre alla cellula contrattile. Mentre i miociti atriali secernono l'ANP in condizioni basali, la secrezione aumenta in risposta ai secretagoghi (cioè, l'agonista alfa-adrenergico, la fenilefrina [PE]). Inoltre, i miociti cardiaci atriali secernono ANP e elaborano co-secrezionalmente una porzione dell'ormone dal suo stato precursore (Pro-ANP, 15 kD) al peptide del prodotto (ANP 3kD)16,17. Questa capacità di secretoria può essere quantificata attraverso il rilevamento di immunoblot dell'ANP nei mezzi di miociti cardiaci atriali isolati in risposta al trattamento acuto dell'EDUCAZIONE (Figura 4E). Questa capacità di secrezione ed elaborazione del miocita cardiaco atriale è stata trovata sensibile alle condizioni di lavorazione. Pertanto, è imperativo che il mezzo di placcatura del miocita atriale sia integrato con desametasone, insulina, transferrina e selenio.
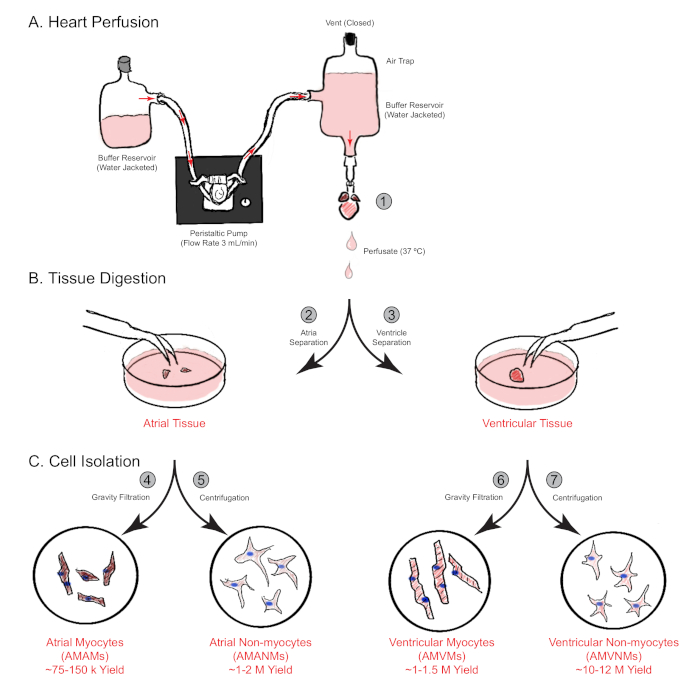
Figura 1: Panoramica schematica della perfusione cardiaca retrograda, della digestione e dell'isolamento cellulare. Sono mostrati i passaggi principali coinvolti nell'isolamento cellulare dalle camere atriali e ventricolari contemporaneamente da un singolo cuore di topo. (A) Un singolo cuore di topo viene rapidamente snobbato attraverso l'aorta ascendente e perfuso in modo retrogrado. (B) Il cuore è separato in tessuti atriali e ventricolari per un'ulteriore digestione e separazione fisica. (C) Dopo un'adeguata digestione, le cellule vengono separate mediante filtrazione gravitazionale in un totale di quattro frazioni cellulari che vengono coltivate per successive sperimentazioni. Clicca qui per visualizzare una versione più grande di questa figura.
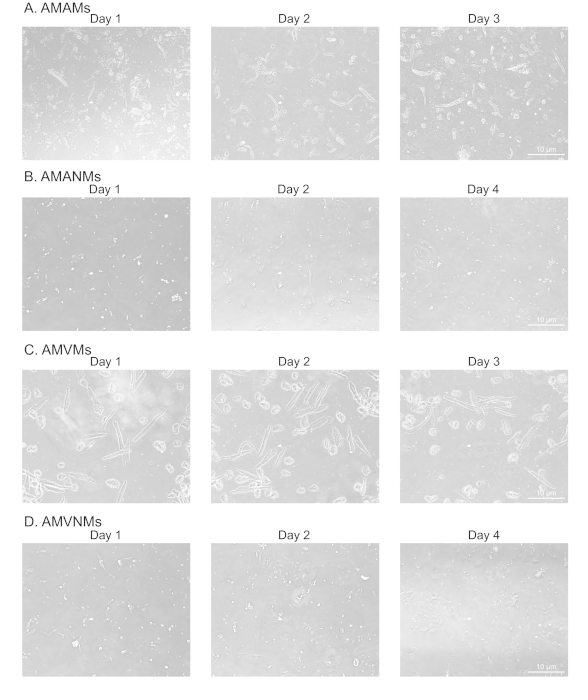
Figura 2: Analisi morfologica di miociti cardiaci atriali e ventricolari isolati e non miociti in coltura. (A) Miociti atriali di topo adulti isolati (AMA), (B) non miociti atriali adulti (AMANM), (C) miociti ventricolari adulti del topo (AMMO) o (D) i non miociti ventricolari adulti (AMVNM) sono stati placcati a 5 x 105 celle/camera su vetri a quattro camere (1,7 cm2)nei rispettivi supporti placcati. Le immagini di fase sono state ottenute nei giorni indicati in coltura utilizzando un obiettivo 10x al microscopio a epifluorescenza. Clicca qui per visualizzare una versione più grande di questa figura.
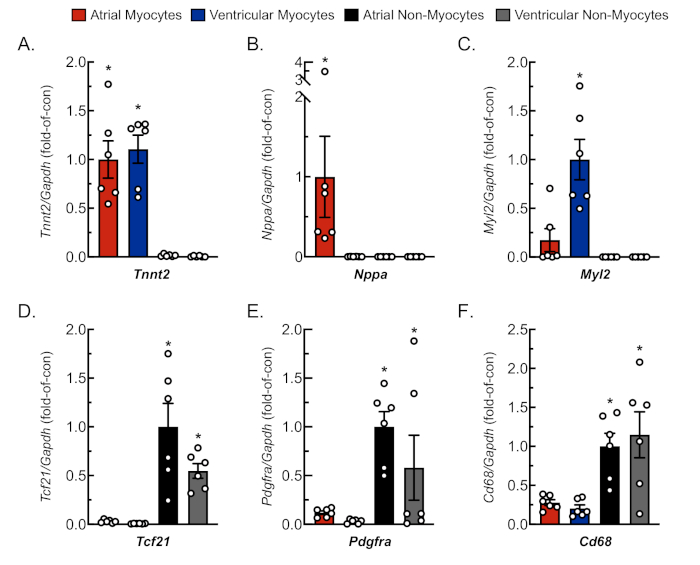
Figura 3: Analisi rappresentativa qRT-PCR delle colture cellulari isolate. L'RNA è stato estratto da miociti cardiaci e non miociti appena isolati, e i livelli di mRNA per marcatori genetici specifici delle cellule sono stati determinati da qRT-PCR4. (A) Tnnt2, troponina muscolare cardiaca T (marcatore del miocita cardiaco); (B) Nppa, peptide natriuretico atriale (marcatore del miocita atriale); (C) Myl2, catena luminosa del miosina 2 (marcatore di miocita ventricolare); (D) Tcf21, fattore di trascrizione 21 (marcatore fibroblasto); (E) Pdgfra, recettore del fattore di crescita derivato dalle piastrine A (marcatore fibroblasto); (F) Cd68, ammasso di differenziazione 68 (marcatore cellulare derivato dal monocito). I dati rappresentano ± SEM (*p ≤ 0,05 diverso da tutti gli altri valori, come determinato da ANOVA seguito dall'analisi post-hoc di Newman Keul). Clicca qui per visualizzare una versione più grande di questa figura.
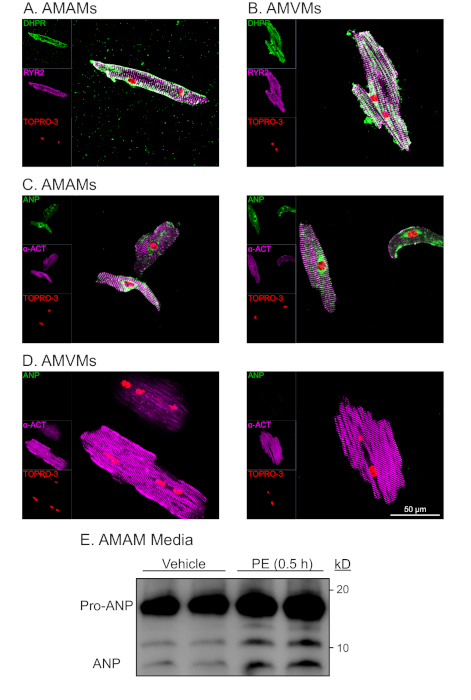
Figura 4: Analisi morfologica e funzionale rappresentativa dei miotti cardiaci atriali e ventricolari isolati. (A) Gli AMAM o (B) AMVM sono stati placcati a 5 x 105 celle/camera su vetri a quattro camere (1,7 cm2)nei rispettivi supporti di placcatura per 1 h per consentire l'adesione. Questo è stato seguito da supporti di placcatura del miocita atriale di riali o dal passaggio a mezzi di mantenimento del miocita ventricolare integrati con blebbistatina per altri 16 h. Le colture sono state successivamente fissate e poi immunostained per RYR2 (viola), DHPR (verde) e macchia nucleare TOPRO-3 (rosso). (C) Gli AMAM o (D) AMVM sono stati isolati e placcati, quindi immunostained per a-actina (viola), ANP (verde) e TOPRO-3 (rosso). Sono mostrate due immagini rappresentative per ogni tipo di cella. (E) Gli AMAM sono stati placcati a 5 x 105 celle/pozzo su un piatto di coltura di 12 pozzi per 16 ore in mezzi di placcatura del miocita atriale. Gli AMAM sono stati successivamente trattati per 0,5 ore con il veicolo o la secretagoga ANP (fenilefrina, 50 mM) prima che i supporti fossero raccolti e sottoposti ad analisi immunoblot per l'ANP. Prima dell'analisi immunoblot, i campioni di supporti sono stati centrifugati a 500 x g per 5 minuti per rimuovere i detriti cellulari e garantire che l'ANP osservato fosse il risultato della secrezione attiva dagli AMAM. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
La qualità delle cellule isolate secondo la procedura qui descritta, determinata dalla resa cellulare e dalla salute complessiva delle cellule in coltura, dipende da numerosi fattori controllabili. A partire dal topo stesso, è stato documentato che lo stress imposto all'animale può influire negativamente sulla resa cellulare e sulla vitalità in coltura, presumibilmente a causa dell'eccesso di cortisolo sistemico, catecolamine e dello stato ipercontrattuale del tessutocardiaco 2,5,7. Per questi motivi, dovrebbero essere adottate misure per evitare di allarmare l'animale prima del sacrificio. Tali misure comprendono la copertura della gabbia dell'animale e la limitazione del tempo al di fuori del vivario prima del sacrificio. L'eparina e molti barbiturici comunemente usati per l'eutanasia possono influenzare le vie di segnalazione; pertanto, il metodo ottimale di eutanasia dovrebbe essere personalizzato di conseguenza. L'età dell'animale ha un impatto considerevole sulla qualità e la vitalità delle cellule isolate, molto probabilmente a causa del progressivo accumulo di fibrosi interstiziale che si verifica in concomitanza con il processo di invecchiamento, che può influenzare la digestione deitessuti 25. Nei dati non presentati qui, mentre il metodo sopra descritto funziona in topi fino a 78 settimane, la qualità delle cellule era inferiore in questi animali più anziani.
Il passo più critico nel processo di isolamento descritto, così come altri protocolli con un apparato di Langendorff per la perfusione retrograda, è la cannulazione e la perfusione iniziale del cuore. Per risultati ottimali, il tempo dall'espianto cardiaco alla cannulazione dell'aorta ascendente e l'inizio della perfusione non dovrebbe richiedere più di 90 s. Oltre al tempo, altri due fattori importanti sono la profondità della cannula e la possibilità di introdurre emboli d'aria dall'apparato perfusione. Di conseguenza, la cannula deve essere avanzata nell'aorta ascendente in modo da non entrare nella radice aortica e ostruire la valvola aortica, il che comprometterebbe la perfusione dei vasi coronari.
Durante il processo di digestione, è importante testare regolarmente la rigidità del cuore per evitare un'esposizione prolungata all'enzima digestivo collagenasi, che riduce la tolleranza al calcio miocita cardiaco. Il protocollo sopra descritto per la reintroduzione del calcio nelle colture isolate di miociti ventricolari è stato progettato per limitare la morte dei miociti cardiaci attraverso un afflusso inappropriato di calcio attraverso canali di calcio gestiti dal negozio. Va notato che la reintroduzione graduale del calcio non deve essere eseguita per colture di miociti atriali isolate, in quanto ciò promuoverà la morte cellulare durante la coltura a breve e lungotermine 12. Per ulteriori precauzioni, i tamponi di perfusione e digestione qui utilizzati includono l'inibitore della contrazione muscolare cardiaca butanedione monoxime (BDM) per evitare l'ipercontrazione di miociti isolati, così come il paradosso del calcio, entrambi impatto sulla vitalità delmiocita 26. Tuttavia, va notato il passaggio da BDM a blebbistatin, in quanto è l'agente anti-contrattile preferito nella manutenzione dei supporti per miociti cardiaci isolati. Nei dati non mostrati, la blebbistatina conferisce una maggiore vitalità per la coltura a lungo termine di miociti cardiaci isolati.
Immediatamente dopo l'isolamento, è importante considerare le ramificazioni della coltura a lungo termine delle cellule cardiache, in particolare dei miociti. Il protocollo di isolamento e cultoe cardiaco non miocita descritto qui si basa su metodi comuni che sfruttano le diverse densità e proprietà adesive delle diverse cellule cardiache. Il beneficio dei non miociti è il loro alto potenziale di espansione nella cultura; quindi, a differenza dei miociti cardiaci, sono suscettibili di passarsi per la perpetuazione. Tuttavia, è noto che le condizioni di coltivazione, inclusa l'integrazione media con FBS, possono influenzare la funzionalità del miocita cardiaco27. I mezzi di coltura qui descritti sono stati progettati per ottimizzare la vitalità e limitare gli scompartimenti funzionali, specialmente per i miociti atriali isolati. Mentre non è stata osservata alcuna capacità contrattile troppo compromessa in miociti cardiaci isolati dopo la coltura in assenza di completamento della blebbistatina, gli studi che si concentrano sull'elettrofisiologia, la contrattilità e altri segnali molecolari a singola cellula in vivo dovrebbero essere eseguiti subito dopo l'isolamento, quando la struttura sarcomerica e la firma molecolare imitano ancora quella del cuore intatto.
Una caratteristica distintiva del miocita atriale è la sua capacità di lunare come cellula endocrina con un'immensa capacità di secretoria, oltre alla loro funzione contrattile. In condizioni fisiologiche, i miociti atriali producono grandi quantità di ANP, che viene immagazzinato nel reticolo endoplasmatico e in grandi granuli di secrezione a nucleo denso in bilico per l'esocitosi regolata dopo aver ricevuto unostimolo 16,17. Mentre molti studi isolati sui miociti atriali si concentrano sulle loro proprietà elettrofisiologiche uniche, questo è il primo studio a progettare un supporto culturale. Ciò consente la vitalità a lungo termine e la promozione delle funzioni mantenute delle proprietà endocrine e contrattili dei miociti atriali. Questo nuovo metodo di coltivazione, così come l'isolamento simultaneo di tutti i tipi di cellule dalle camere atriali e ventricolari da un unico cuore di topo, sarà utile ed efficace per gli studi sulle proprietà fisiologiche e fisiopatologiche dei miociti atriali e ventricolari.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
E.A.B. è stato supportato dal National Institutes of Health (1F31HL140850), dalla ARCS Foundation, Inc., San Diego Chapter, ed è una Rees-Stealy Research Foundation Phillips Gausewitz, M.D. Scholar dello SDSU Heart Institute. E.A.B. e A.S.B. sono state sostenute dalla Fondazione Inamori. CCG by (NIH) concede R01 HL135893, R01 HL141463 e HL149931.
Materiali
| Name | Company | Catalog Number | Comments |
| (-)-Blebbistatin | Sigma-Aldrich | B0560 | |
| 1 Liter Water Jacketed Reservoir | Radnoti | 120142-1 | |
| 2,3-Butanedione monoxime | Sigma-Aldrich | B0753 | |
| 5-0 Silk Suture Thread | Fine Science Tools | 18020-50 | |
| Adenosine | Sigma-Aldrich | A9251 | |
| Bovine Serum Albumin | Sigma-Aldrich | A6003 | |
| Bubble Trap Compliance Chamber | Radnoti | 130149 | |
| Calcium Chloride Anhydrous | Fisher Scientific | C614-500 | |
| Carnitine hydrochloride | Sigma-Aldrich | C9500 | |
| Collagenase type 2 | Worthington Biochemical Corporation | LS004176 | |
| Creatine | Sigma-Aldrich | C0780 | |
| Dexamethasone | Sigma-Aldrich | D2915 | |
| DMEM/F12 (1:1; 1X) | Gibco | 11330-032 | |
| Dumont #7 - Fine Forceps | Fine Science Tools | 11274-20 | |
| Epifluorescent micropscpe | Olympus X70 | IX70 | |
| Fetal Bovine Serum (Heat Inactivated) | Omega Scientific | FB-12 | Lot# 206018 |
| Fine Scissors - Sharp | Fine Science Tools | 14060-09 | |
| Graefe Forceps | Fine Science Tools | 11051-10 | |
| Headband Magnifiers | Fine Science Tools | 28030-04 | |
| Hemacytometer (Bright-Line) | Hausser Scientific | 1475 | |
| HEPES (1M) | Gibco | 15630-080 | |
| Inosine | Sigma-Aldrich | I4125 | |
| Insulin-Transferrin-Selenium-X | Gibco | 51500-056 | |
| Isotemp 105 Water Bath | Fisher Scientific | NC0858659 | |
| Isotemp 3006 | Fisher Scientific | 13-874-182 | |
| Joklik Modified Minimum Essential Media | Sigma-Aldrich | M-0518 | |
| Laminin (Natural, Mouse) | Gibco | 1795024 | Lot# 1735572 |
| L-Glutamine | Sigma-Aldrich | G8540 | |
| Masterflex C/L Single-Channel Variable-Speed Compact Pump | Cole-Palmer | EW-77122-24 | |
| Minimum Essential Medium (MEM 1X) | Gibco | 12350-039 | |
| Molecular Biology Grade Water | Corning | 46-000-CM | |
| Pen Strep Glutamine (100X) | Gibco | 10378-016 | |
| Spring Scissors - 6mm Cutting Edge | Fine Science Tools | 15020-15 | |
| Taurine | Sigma-Aldrich | T-8691 |
Riferimenti
- Peter, A. K., Bjerke, M. A., Leinwand, L. A. Biology of the cardiac myocyte in heart disease. Molecular Biology of the Cell. 27 (14), 2149-2160 (2016).
- Kruppenbacher, J. P., May, T., Eggers, H. J., Piper, H. M. Cardiomyocytes of adult mice in long-term culture. Naturwissenschaften. 80 (3), 132-134 (1993).
- Ackers-Johnson, M., et al. A Simplified, Langendorff-Free Method for Concomitant Isolation of Viable Cardiac Myocytes and Nonmyocytes From the Adult Mouse Heart. Circulation Research. 119 (8), 909-920 (2016).
- Jin, J. K., et al. ATF6 decreases myocardial ischemia/reperfusion damage and links ER stress and oxidative stress signaling pathways in the heart. Circulation Research. 120 (5), 862-875 (2017).
- Judd, J., Lovas, J., Huang, G. N. Isolation, Culture and Transduction of Adult Mouse Cardiomyocytes. Journal of Visualized Experiments. (114), e54012(2016).
- Li, D., Wu, J., Bai, Y., Zhao, X., Liu, L. Isolation and Culture of Adult Mouse Cardiomyocytes for Cell Signaling and in vitro Cardiac Hypertrophy. Journal of Visualized Experiments. (87), e51357(2014).
- O'Connell, T. D., Ni, Y. G., Lin, K. M., Han, H. P., Yan, Z. Isolation and culture of adult cardiac myocytes for signaling studies. AfCS Research Reports. 1 (5), 1-9 (2003).
- Pinz, I., Zhu, M., Mende, U., Ingwall, J. S. An improvised isolation procedure for adult mouse cardiomyocytes. Cell Biochemistry and Biophysics. 61 (1), 93-101 (2011).
- Piper, H. Culturing of calcium stable adult cardiac myocytes. Journal of Molecular and Cellular Cardiology. 14 (7), 397-412 (1982).
- Shioya, T. A simple technique for isolating healthy heart cells from mouse models. Journal of Physiological Sciences. 57 (6), 327-335 (2007).
- Omatsu-Kanbe, M., Yoshioka, K., Fukunaga, R., Sagawa, H., Matsuura, H. A simple antegrade perfusion method for isolating viable single cardiomyocytes from neonatal and aged mice. Physiological Reports. 6 (9), 13688(2018).
- Jansen, H. J., Rose, R. A. Isolation of Atrial Myocytes from Adult Mice. Journal of Visualized Experiments. (149), e59588(2019).
- Yao, C., et al. Enhanced Cardiomyocyte NLRP3 Inflammasome Signaling Promotes Atrial Fibrillation. Circulation. 138 (20), 2227-2242 (2018).
- Cha, Y., Redfield, M. M., Shen, W., Gersh, B. J. Atrial Fibrillation and Ventricular Dysfunction: A Vicious Electromechanical Cycle. Circulation. 109 (23), 2839-2843 (2004).
- Issa, O., et al. Left atrial size and heart failure hospitalization in patients with diastolic dysfunction and preserved ejection fraction. Journal of Cardiovascular Echography. 27 (1), 1-6 (2017).
- de Bold, A. J. Atrial natriuretic factor: a hormone produced by the heart. Science. 230 (4727), 767-770 (1985).
- McGrath, M. F., de Bold, M. L., de Bold, A. J. The endocrine function of the heart. Trends in Endocrinology and Metabolism. 16 (10), 459-477 (2005).
- Doevendans, P. A., Daemen, M. J., de Muinck, E. D., Smits, J. F. Cardiovascular phenotyping in mice. Cardiovascular Research. 39 (1), 34-49 (1998).
- Banerjee, I., Fuseler, J. W., Price, R. L., Borg, T. K., Baudino, T. A. Determination of cell types and numbers during cardiac development in the neonatal and adult rat and mouse. American Journal of Physiology. 293, 1883-1891 (2007).
- Jugdutt, B. I. Ventricular remodeling after infarction and the extracellular collagen matrix: when is enough enough. Circulation. 108, 1395-1403 (2003).
- Omatsu-Kanbe, M., et al. Identification of cardiac progenitors that survive in the ischemic human heart after ventricular myocyte death. Scientific Reports. , 7(2017).
- Song, K., et al. Heart repair by reprogramming non-myocytes with cardiac transcription factors. Nature. 485, 599-604 (2012).
- Limana, F., et al. bcl-2 overexpression promotes myocyte proliferation. Proceedings of the National Academy of Sciences of the United States of America. 99, 6257-6262 (2002).
- Pinto, A. R., et al. Revisiting cardiac cellular composition. Circulation Research. 118 (3), 400-409 (2015).
- Chen, W., Frangogiannis, N. G. The role of inflammatory and fibrogenic pathways in heart failure associated with aging. Heart Failure Reviews. 15, 415-422 (2010).
- Daly, M. J., Elz, J. S., Nayler, W. G. Contracture and the calcium paradox in the rat heart. Circulation Research. 61 (4), 560-569 (1987).
- Li, Z., Sharma, R. V., Duan, D., Davisson, R. L. Adenovirus-mediated gene transfer to adult mouse cardiomyocytes is selectively influenced by culture medium. Journal of Gene Medicine. 5 (9), 765-772 (2003).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon