Method Article
心房筋細胞、心室筋細胞、および非筋細胞の同時分離と培養
要約
単成マウス心臓の心房と心室の両方から筋細胞と非筋細胞を同時に分離する方法について説明する。このプロトコルは、高生存性心筋細胞および非筋細胞の一貫した収量をもたらし、フェノタイピングおよびインビトロ分析のための最適な細胞特異的培養条件を詳述する。
要約
マウスからの心臓筋細胞の分離と培養は、心臓生理学および病態生理学の理解を促進するために不可欠であった。新生児マウスの心臓から筋細胞を単離することは比較的簡単であるが、成人マウスの心臓からの筋細胞が好ましい。これは、新生児細胞と比較して、成人筋細胞は生体内の成人心臓において起こるように細胞機能をより正確に再現するためである。 しかし、実験の行き詰まりに寄与する必要な量と生存率で成人マウス心臓筋細胞を分離することは技術的に困難である。さらに、公開された手順は、心房および心室非筋細胞細胞を犠牲にして心房または心室筋細胞の単離に特異的である。ここでは、心房と心室心筋細胞の両方を単一のマウス心臓から同時に心房および心室非筋細胞と共に単離するための詳細な方法を説明する。また、細胞の生存率と機能を高める最適な細胞特異的培養方法の詳細も提供されています。このプロトコルは、成人マウス心臓細胞の分離のプロセスを促進するだけでなく、心房および心室心細胞の調査のための細胞の収量および生存率を高めることを目的としている。
概要
一次細胞培養は、心臓筋細胞機能の詳細な機械学的研究のための制御された環境を提供する不可欠な資源である。そのより耐久性があり、孤立しやすさのために、新生児ラット心房および心室筋細胞は、そのような細胞培養の共通の供給源であった1.しかし、成人マウス心房および心室筋細胞(AMAMおよびAMMV)は、その分子および機能的特性が成人の心臓細胞の分子および機能特性をよりよく模倣するため、インビトロ研究に非常に望ましい。したがって、それらは心臓病理に関連する研究に関連するようになり、そのほとんどは成人2で発症する。
さらに、トランスジェニックおよび疾患マウスモデルの利用可能性および使用は、単離された成人心筋細胞の有用性を拡大する。マウス AM の分離と、短期および長期の研究のための培養プロトコルは、多数の以前の出版物2、3、4、5、6、7、8、9、10、11.これに対し、Amam の分離に関するプロトコルはほとんど説明されていません。さらに、記載されているものは、主に、現在11、12、13に記載された長期培養プロトコルを有する、新たに単離された細胞の急性研究のために最適化される。そのため、AMAM 分離プロトコルは、AMVM の分離と文化に対して公開されたプロトコルの有用性と汎用性を提供するようには設計されていません。さらに、AMAMとAMVの分離に関する先駆的な研究は豊富であることが証明されていますが、AMAMとAMVMの両方の最適な同時分離と文化のためのプロトコルはなく、各準備のために心臓全体を効率的に使用します。
これまで、公開されたAMAMおよびAMVM絶縁プロトコルは、心房および心室機能に関するほとんどの研究がチャンバー固有の焦点を有するため、両方の細胞タイプの同時分離のために設計されなかった。例えば、AMAMは、米国で最も一般的な心臓不整脈である心房細動(AF)への関心もあって、心房筋細胞電気生理学を研究するために主に使用されています。しかし、AFは単独で心房に影響を与える疾患ではなく、軽度から重度の左心室機能不全14に原因となる役割を有するものとして関与している。さらに、保存された駆出率(HFpEF)を有する心不全患者からの心電図は、左心房サイズが心不全15に対する感受性の最も強い予測値の1つであることを示している。
電気生理学や収縮性におけるその役割に加えて、心房は内分泌器官でもあり、心管内圧(すなわち心房性心内尿素ペプチド[ANP])を恒分的に調節する心房性心内尿素ペプチド(ANP)を、16,17に恒分的に調節する。また、ANP(おそらく心房筋細胞由来)は、心室筋細胞16,17において顕著な保護及び抗肥大的役割を有する。様々な疾患状態における心房と心室の間の神経ホルモンコミュニケーションには強い意味があるが、このコミュニケーションの根底にあるメカニズムは十分に探求されていない。この点はさらに、疾患の機能としての心臓リモデリングが心筋細胞生存率および世界的な心機能18、19、20、21、22に直接影響を及ぼす疾患の非筋細胞(特に心臓線維芽細胞および免疫細胞)の役割を1)に焦点を当てた研究の急増によって例示される。したがって、心房と心室の両方から心臓細胞を研究することは、心臓病理生理学における彼らの役割のより完全な画像を得るために必要なアプローチである。
以下のプロトコルは、生理学的および病的生理学的条件下での単一のマウス心臓からの心房および心室筋細胞および非筋細胞の同時分離を記述する。さらに、心室筋細胞の培養を維持するための条件が既に発表されているとして、心房心筋細胞の培養を維持するために必要な最適な条件を記述する最初の方法である。
プロトコル
本論文で報告されたマウスに関して行われたすべての研究は、SDSU制度動物のケアと使用委員会によって審査され、承認されており、国立研究評議会が発表した実験動物のケアと使用のためのガイドに準拠しています。
1. 分離・培養メディアの作成とめっき
- ヨクリクの変更最小必須培地(MMEM)を1Lの滅菌水に添加して、使用前に1Lの心臓灌流培地を調製します。10 N NaOHでpHを7.36に調整し、0.2 μmフィルターを通してフィルターし、4°Cで最大2週間保存します。
注:ジョクリクMMEMは112 mM NaCl、5.4 mM KCl、1 mM MgCl2、9mM NaH2PO4、および11.1 mM D-グルコースで構成されています。これは10 mM HEPES(2.38 g/L)、30 mMタウリン(3.75 g/L)、2 mM D-l-カルニチン(0.4 g/L)、2 mMクレアチン、および10 mMブタンジオンモノキシム(1.01 g/L)を補充する。 - 灌流直前に消化バッファーを準備します: 100 mM CaCl2 の6.25 μL(ステップ1.3を参照)とコラゲラーゼタイプ2(酵素活性〜310〜310〜320 U/mg dw)で心臓灌流培地50 mLを補います。
注:犠牲の前に動物の重量を量る。消化バッファーに補うコラゲザーゼ2型の量は、動物の体重(体重1g当たり2型コラゲナーゼ2mg)によって決定される。 - 100 mM CaCl2を準備するには、1.47 g の CaCl2 ~ 100 mL の分子生物学グレードの水を加えます。溶解するまで撹拌し、0.2 μmのフィルターを通過し、室温で最大2ヶ月間保存します。
- 筋細胞停止バッファー 1 を、胎児ウシ血清 (FBS) の 10 mL と 100 mM CaCl2の 125 μL で 90 mL の心臓灌流バッファーを補って準備する。0.2 μmフィルターを通過し、4 °Cで最大2週間保管します。
- 6 mLのFBSと10 mM CaCl2の150 μLで114mLの心臓灌流バッファーを補って、ミオサイト停止バッファー2を調製する。0.2 μmフィルターを通過し、4 °Cで最大2週間保管します。
- 95 mLのDulbeccoの改変イーグル培地(DMEM)を4 mLのFBS、100xペン/ストレップグルタミン1mL、100xインスリントランスフェリンセレン1mL、10μMデキサキサメゾン1mLで補充し、灌流直前に心房筋細胞メッキ培地を調製します。0.2 μmフィルターを通過し、めっきするまで37°Cで保管します。
- FBSの4 mL、100xペン/ストレパプタミンの1mL、1M HEPES溶液の10mL、100xインスリントランスフェリンセレンの1mL、ブタネジョンモノメの0.1 gで最低必須培地(MEM)の95 mLを補うことによって心室筋細胞めっき培地を準備する。0.2 μmフィルターを通過し、4 °Cで最大2週間保管します。
- 100xインスリントランスフェリンセレン、0.1 mg/mLウシ血清アルブミン(BSA)、1M HEPES溶液10mの10mLおよび100xペン/ストレップグルタミンの1mLでMEMの99 mLを補うことによって、心室筋細胞維持培地を準備する。0.2 μmフィルターを通過し、4 °Cで最大2週間保管します。
- ラミニンコーティング実験プレートおよびスライドを調製するために、マウスラミニンストック溶液(1.19mg/mL)を解凍します。DMEMの1 mLごとに10μLのラミニンストック溶液を加え、混合します。実験プレートとスライドを均等にコーティングし、37°C、5%CO2インキュベーターに少なくとも1時間、灌流前に保存して平衡を可能にします。
注:コーティングされた実験プレートとスライドは、最大2日間4°Cで保存することができます。
2. 絶縁装置
- 各分離の前に、バブルトラップを上部に充填して70%EtOHの3回の完全な洗浄でシステムのチューブやその他のコンポーネントを清掃します(下のストップコックを閉じて、トップストップコックを開いたままにします)。
- バブルトラップを上部に充填して、完全なシステム3xを滅菌H2Oでリンスします(底栓を閉じて、トップストップコックを開いたままにします)。
- 心臓灌流バッファーで完全なシステムをすすい出し、媒体で途中でバブルトラップを埋めます。
- 循環水浴を37°Cに設定します。
- 37°Cにメディア用の水浴を設定します。
- 蠕動ポンプチューブ内の気泡を取り除く。
- 蠕動ポンプの流量を3 mL/minに調整します。
3. 外科手術(非生存)
- 手術器具を少なくとも5分間、70%のEtOHに浸す。
- 心臓灌流媒体、筋細胞停止バッファー、及び消化バッファーを37°Cの水浴に入れる。
- 心房筋細胞メッキ媒体、心室筋細胞めっき媒体、心室筋細胞メッキ培地、心室筋細胞維持培地を37°Cに入れ、5%CO2インキュベーターを使用する1時間前にカプセルを緩め、均衡を可能にしてキャップを緩める。
- 10週齢の雄または雌のC57b6/jマウスを腹腔内(i.p.)に0.35mLのヘパリンで注入し、リン酸緩衝生理食塩水(PBS)で100 IU/mLに希釈する。約10分間効果を出します。
注:2つの心臓がこの分離手順を受ける場合、第2のマウスは、最初の手順のこの時点で麻酔および投与ヘパリンすることができる。動物のストレスを最小限に抑えるために、気密シール誘導室で2%イオフルラン/酸素混合物を使用して軽麻酔を投与することができる。 - 2%のイオフルラン/酸素混合物で動物を麻酔し、ペントバルビタール(10 mg/mLストックから0.3 mL)でi.p.を注入し、70%のEtOHでスワッピングして胸を準備します。
- 結ばれた5-0シルク縫合糸を準備して、心臓を輸血カニューレに合う準備をします。外科顕微鏡のすぐ隣にカニューレを取り付ける。
- 最初に中腹部から顎まで中腹部を切開し、大きなはさみで腹膜に入り、鈍い解剖によって横隔膜を取り除くことによって、すぐに胸を開く。その後、両側の側面の胸壁を切り取って、はさみを使用してリブケージを切り取ります。
- 心臓と胸壁(胸腺を含む)の間の線維性の接続を切り取る。その後、リブケージをすべて一緒に切り取ります。小さな鉗子とはさみを使用して、心を頂点でそっと持ち上げ、心臓の後部側面を露出させる。
- 上流大動脈の分母にすぐ劣った動脈を解剖することによって心臓を外に出し、すぐに氷冷PBSまたは冷たい心臓灌流媒体に心臓を置く。その後、氷冷心臓灌流媒体中の外植心臓から残りの組織を素早く解剖し、上昇大起を露出させる。
注:解剖学的ランドマークとして使用するには、胸腺をそのままにして心臓を植え出すのに便利です。 - 過剰組織の大器官の周囲を、マイクロ解剖鉗子とはさみを使用して清掃します。細かい先端の鉗子を使用してカニューレに大オルタを置き、5-0シルク縫合糸で固定します。
注意:最良の配置は、通常、大オルタがカニューレの上に約2mm伸びて発生します。 - 3 mL/minの流量で心の透過媒体を4分間、カニュード心臓に浸透させます。次に、メディアを心臓灌流メディアから、15.0~17.5分間の消化バッファーに切り替えます(図1A)。
注:冠動脈流量が増加する可能性が高く、効果的な組織消化(すなわち、青白く、腫れた心臓)を示す。 - ステップ5.4で後で使用するために、灌流の最後の分の間に消化バッファーの流れの8 mLを収集します。
- カニューレから心臓を取り出し、60mmのプラスチック文化皿の上に置きます。過剰な組織(大器官、静脈)を除去し、機械的分離に備えて2.5mLの消化バッファーで心臓を沈下する。
注:この時点で、心房は解剖され、1人の実験者が心房細胞分離プロトコルを実施し、2人目の実験者は心室細胞分離を行うべきです。
4. 心房細胞の分離と培養
- 心臓から離れてアトリアを解剖し、30ミリメートルのプラスチック文化皿に置きます。機械的分離のために0.75 mLの消化バッファーに沈める。60 mm皿(ステップ3.12)に心室を入れておき、分離方法を同時に実行します(セクション5、図1B)。
注:この時点で、心房と心室は、左側および右側の細胞を分離する必要がある場合、さらなる分離を受けることができます。 - 最初は細かい先端の外科用ハサミで、さらにミンチのための細かい鉗子が続いて、離れてアトリアをミンチといじめ始めます。組織を攪拌することを避け、そして急速に筋線維を引き離さない。
- 無菌転移ピペットチップを使用して、15分間組織を穏やかに混合し、解体し続けます。5分ごとに、10倍の目的の明視野顕微鏡下で組織から心房筋細胞の解離を観察する。組織がさらに消化されるようになるにつれて、小さな細孔サイズで無菌転写ピペットチップを使用して組織を穏やかに混合し、解離し続けます。
- 細胞懸濁液を2 mLの無菌マイクロ遠心分離チューブに移す。30 mmプレートを0.75 mLの37°Cの筋細胞停止バッファー1でリンスし、セル懸濁液(エンドボリューム= 1.5 mL)と組み合わせます。
- 心房筋細胞を室温で10分間重力で沈下させます。細胞懸濁液を穏やかに攪拌し、筋細胞が円錐形チューブの底まで沈み込み、目に見えるペレットを形成するようにします。
- 20 x gで 5 分間の細胞懸濁液を遠心分離します。非筋細胞を含む上清を慎重に除去し、心房筋細胞のペレットを乱すことなく滅菌ピペットチップを使用して15 mLポリプロピレンコニカルチューブに移す。
- 遠心分離術非筋細胞分率は、20,000 x gで5分間.上清を吸引し、10%の胎児の子牛血清(FCS)を補充したDMEMの10 mLで非筋細胞ペレットを再懸濁する。
- 血球計または他の方法を用いて非筋細胞を数え、次に実験の必要性に従ってプレート、または蛍光活性化細胞分類を介して個々の特定細胞集団にさらに単離する(図1C)。
- 心房筋細胞メッキ培地のステップ4.6から1mLの分離された心筋細胞のペレットを再懸濁し、この懸濁液の10μLを血球計に塗布する。棒状の筋細胞の細胞数をフィールドごとに実行します。
- 予備コーティングされた実験プレート/スライドからラミニンを吸引し、25 μMブレビスタチンを添加した心房筋細胞メッキ培地の適切な体積で単離された心房筋細胞を再中断する。実験ニーズに応じて所望の密度でプレート(図1C)。
注:ここで説明する長期培養のための典型的なめっき密度は、4つのチャンバ(1.7 cm2)ガラススライド上の5 x 105細胞/チャンバーです。
5. 心室細胞の分離と培養
- 最初に細かい先端の外科用ハサミで心臓をミンチといじめ、さらにミンチのための細かい鉗子を始める(図1B)。急速に筋線維を引き離すことによって組織を攪拌を避けます.
- セル懸濁液を15 mLポリプロピレンコニカルチューブに移します。プレートを37°Cのミオサイト停止バッファー1の2.5 mLでリンスし、セル懸濁液(エンドボリューム= 5 mL)と組み合わせます。
- 滅菌転移ピペットチップを使用して、4分間組織を穏やかに混合し、解体し続けます。この細胞懸濁液の10 μLをスライドに塗布し、棒状の筋細胞の存在を可視化して、分離の質を確保します。
- 100 μmの無菌ナイロンフィルターを通して、50 mL ポリプロピレン製の円錐形チューブにセル懸濁液を通します。手順3.12で収集した消化バッファーの2 mLを使用して、残りの細胞を滅菌ナイロンフィルターから洗い流します。
- 心室筋細胞を室温で6分間重力で沈下させます。濾過された細胞懸濁液を穏やかに攪拌し、筋細胞が円錐の底に沈み込み、目に見えるペレットを形成することを可能にする。
- 心室筋細胞のペレットを乱すことなく、上清(非筋細胞)を慎重に除去し、滅菌ピペットチップを使用して50 mLポリプロピレンコニカルチューブに移します。遠心分離術非筋細胞分率は、20,000 x gで5分間.上清を吸引し、非ミオサイトペレットを10%FCSで補ったDMEMの10mLで再懸濁する。
- 血球計を使用して非筋細胞をカウントし、10%のFCSを補充したDMEMの適切な量で再中断します。そして、実験ニーズに応じたプレート、又は蛍光活性化細胞分類を介して個々の特異的細胞集団にさらに単離する(図1C)。
- 2 mLの筋細胞停止バッファー2で分離した心室筋細胞を再懸濁し、10 μLの細胞懸濁液を血球計に塗布する。棒状の筋細胞の細胞数をフィールドごとに実行します。
- ステップワイズパラダイムを用いたCa2+ の再導入
注:カルシウム再導入ステップは心室筋細胞に特異的であり、細胞死をもたらすため、心房筋細胞に対しては行うべきではない。- 50 μLの 10 mM CaCl2 を心室筋細胞懸濁液に加えます。よく混ぜて、室温で4分間インキュベートします。
- さらに50 μLの10 mMCaCl2 を心室筋細胞懸濁液に加えます。よく混ぜて、室温で4分間インキュベートします。
- 10 mM CaCl2 の 100 μL を心室筋細胞懸濁液に追加します。よく混ぜて、室温で4分間インキュベートします。
- 心室筋細胞懸濁液に80μLの100 mMCaCl2 を加えます。よく混ぜて、室温で4分間インキュベートします。
- プレートまたはスライドからラミニンコーティングを除去し、実験的ニーズに応じて適切な量の心室筋細胞めっき媒体で孤立した心室筋細胞を再中断する(図1C)。
注:ここで説明する長期培養のための典型的なめっき密度は、4つのチャンバ(1.7 cm2)ガラススライド上の5 x 105細胞/チャンバーです。75%以上の密度でめっきを避け、細胞過緻密化が細胞の凝集を促進し、それによってプレートへの付着を阻害するように。さらに、最初の中規模の変化の間に多数の細胞が失われます。細胞外Ca2+が過剰収縮および生存可能な筋細胞の喪失を促進するので、細胞は単離後に素早く細胞を培養する。 - 心室筋細胞が少なくとも1時間沈着するようにします。その後、25 μM ブレビスタチンを添加した培地を維持する心室筋細胞にメディアを変更します。
注意:心室筋細胞はμMブレビスタチンでめっきした後96時間まで培養することができる。ブレビスタチンがない場合に心室筋細胞維持培地で実験を行う必要があります。
結果
野生型の10週齢のC57b6/jマウス心臓は、通常、75,000-150,000心房筋細胞と1.0-1.5 x 106心室筋細胞の間で生じ、心房および心室筋細胞18、19のおよその収量に相当する。分離中および直後に、実行可能な心臓筋細胞は、棒状および非収縮に見えるべきである。孤立した心臓筋細胞の大部分は、効果的な灌流の指標であるこの形態を適応させるべきである。また、棒状形態は生存率の予測変数としても使用できます。このプロトコルは、病気のマウス心臓から分離された筋細胞および非筋細胞の収量および生存率を高めることを目的としている。さらに、過負荷誘発心不全のモデルで試験されている(データは示していない)。
心房組織および心室組織からの筋細胞および非筋細胞の適切かつ複製可能な分離を確認するために、培養中の様々な日に細胞を観察し、撮影した(図2)。さらに、定量的な逆転写ポリメラーゼ連鎖反応(qRT-PCR)を行い、細胞型特異的であった転写物のレベルを測定した。心臓筋トロポニンT(Tnnt2)は心筋細胞のマーカーであり、心房および心室心筋細胞培養の両方で強固に発現した(図3A)。対照的に、心房性心尿酸ペプチド(Nppaは、生理学的条件下で成人心房心筋細胞に排他的に発現する典型的な)および筋細胞軽鎖2(心室筋細胞特異的遺伝子であるMyl2)は、それぞれ心房および心室心筋細胞培養物において強く特異的に発現した( 図3B,C)。
線維芽細胞マーカーは、転写因子21(Tcf21)、血小板由来成長因子受容体A(Pdgfra)、および分化68(Cd68)の単球由来細胞マーカークラスターを、心房および心室の両方から分離した非筋細胞培養物で排他的に発現した(図3D−F)。非筋細胞は、全ての心臓細胞の65%を侵害し、これらの大部分は線維芽細胞または単球由来系統18、19、23、24に由来すると推定される。したがって、これらの2系統のマーカーは、心臓病理学の様々なモデルおよび病因の研究におけるこれらの細胞集団への関心を考えると、代表的なものとして選ばれた。
t-tubuleマーカージヒドロピリジン(DHPR、電圧依存(L)型カルシウムチャネル)およびリアノジン受容体(RYR2)に対するAMAMおよびAMMVの免疫染色は、単離および長期培養を通じて無傷のチューブを実証した(図4A,B)。心房および心室筋細胞に特有のDHPRおよび局在性の豊富さは、t-tubuleの存在を示した。さらに、DHPRとRYR2免疫染色の共局在化は、無傷のダイアッド構造の指標であった。心房および心室心筋細胞における肉体タンパク質α-アクチニンの免疫染色は、予想される肉体線条体パターンをもたらした。肉体線条発パターンは、棒状の形態形状およびTOPRO-3との核染色と併せて、単離心臓筋細胞の純度および生存率を評価するために使用された(図4C,D;紫および赤色)。予想通り、心室心筋細胞は大きかったが、平均長さは〜150mm、心房心筋細胞は平均〜75mmであった。さらに、免疫染色分析の際、心房心筋細胞(心室心筋細胞ではないが)は、心内用性心筋細胞(ANP)の強い発現を示し、小胞体および分泌顆粒に局在化する特徴である染色パターンを示した(図4C、D;緑色)。
心房心筋細胞に特有の特徴は、収縮細胞に加えて内分泌細胞としての分類である。心房筋細胞は基底条件下でANPを分泌するが、分泌物は分泌物(すなわち、αアドレナリン作動薬、フェニレフリン[PE])に応答して増加する。また、心房心筋細胞はANPを分泌し、その前駆体状態(Pro-ANP,15kD)から生成ペプチド(ANP3kD)16,17にホルモンの一部を共同分泌処理する。この分泌能は、急性PE治療に応答して単離された心房心筋細胞の培地中のANPの免疫ブロット検出を介して定量することができる(図4E)。心房心筋細胞のこの分泌および処理能力は、培養条件に敏感であることが判明した。したがって、心房筋細胞めっき培地は、デキサメタゾン、インスリン、トランスフェリン、セレンを添加することが不可欠である。
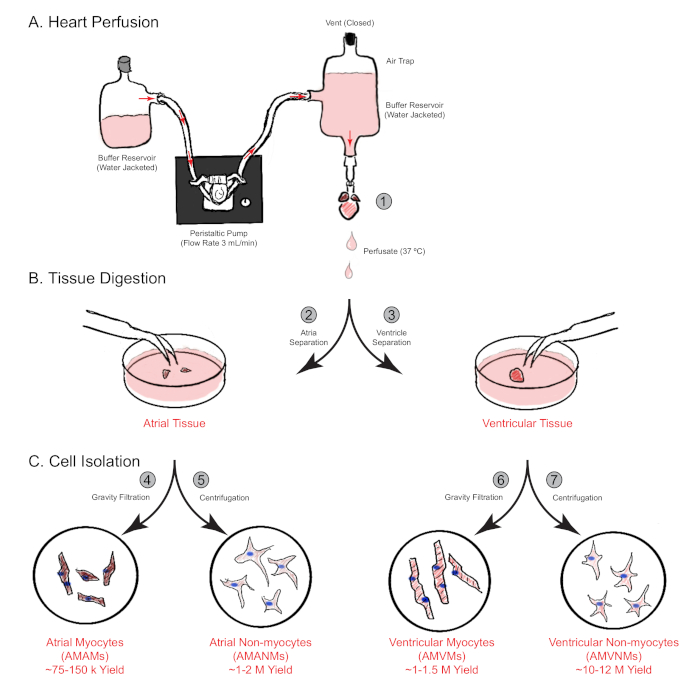
図1:逆行性の心臓灌流、消化、および細胞分離の概略図。 示されているのは、単一のマウス心臓からの心房および心室の両方からの細胞分離に関与する主なステップである。(A)単一のマウス心臓は、上昇大オルタを介して急速にカニューレ化され、逆行的に浸透する。(B) 心は心房と心室組織に分離され、さらなる消化と物理的分離が可能である。(C)適切な消化に続いて、細胞は重力濾過を介して、その後の実験のために培養される合計4つの細胞分画に分離される。 この図の大きなバージョンを表示するには、ここをクリックしてください。
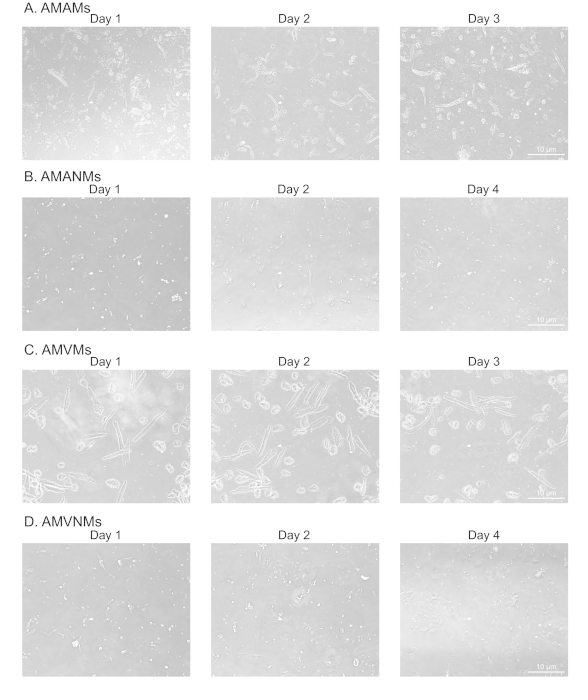
図2:培養中の単離心房および心室心筋細胞および非筋細胞の形態学的解析(A)単離された成体マウス心房筋細胞(AMAM)、(B)成人マウス心房非筋細胞(AMANMs)、(C)成体マウス心室筋細胞(AMVMs)、または(D)成体マウス心室非筋細胞(AMVNM)を4つのチャンバー(1.7cm)スライドでメッキした。位相画像は、10x目的を使用した培養中の示された日に、蛍光顕微鏡で得られた。この図の大きなバージョンを表示するには、ここをクリックしてください。
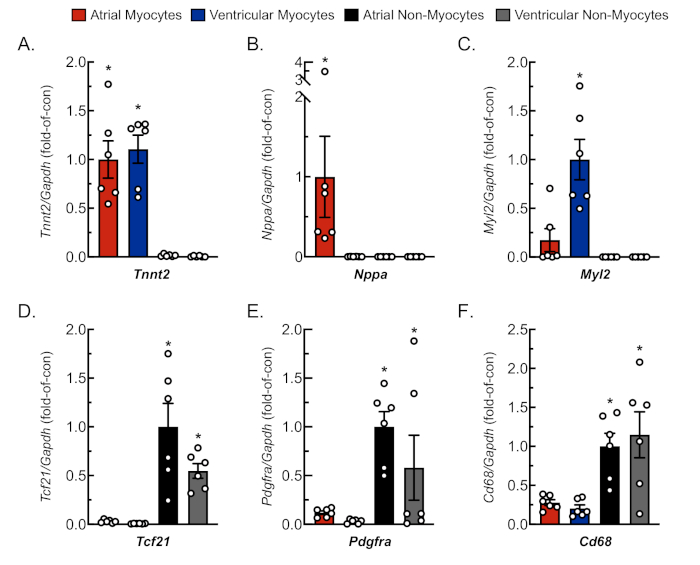
図3:分離細胞培養の代表的なqRT-PCR分析。RNAは、新たに単離された心臓筋細胞および非筋細胞から抽出し、細胞特異的遺伝子マーカーに対するmRNAレベルをqRT-PCR4により求めた。(A) Tnnt2、心筋トロポニンT(心臓筋細胞マーカー);(B)Nppa、心房性経尿毒ペプチド(心房筋細胞マーカー);(C) Myl2、筋細胞軽鎖2(心室筋細胞マーカー);(D) Tcf21, 転写因子 21 (線維芽細胞マーカー);(E) Pdgfra, 血小板由来増殖因子受容体 A (線維芽細胞マーカー);(F)Cd68、分化68のクラスター(単球由来細胞マーカー)。データは、SEM±平均値(*p≤、ANOVAによって決定された他のすべての値とは異なる0.05を表し、その後にニューマン・キュールのポストホック分析が続く)。この図の大きなバージョンを表示するには、ここをクリックしてください。
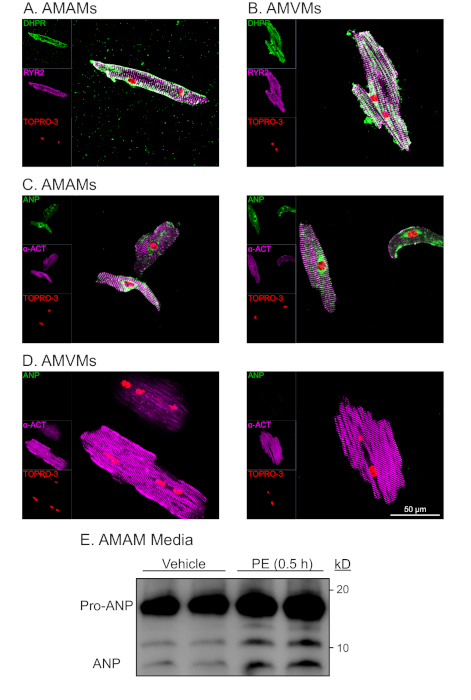
図4:孤立した心房および心室心筋膜の代表的な形態学的および機能的分析。(A)AMAMまたは(B)AMMは、接着を可能にするために、各めっき媒体の4つのチャンバー(1.7 cm2)のガラススライドに5 x 105細胞/チャンバーでメッキを行った。その後、心房筋細胞めっき培地を再給餌するか、またはブレビスタチンを補充した心室筋細胞維持培地に16時間変更した。その後、培養物を、RYR2(紫)、DHPR(緑色)、及び核染色TOPRO-3(赤色)について免疫染色を行った。(C) AMAM または (D) AMVM を単離してメッキし、アクチニン (紫色)、ANP (緑)、および TOPRO-3 (赤) に対して免疫染色した。各セルの種類に対応する 2 つの代表的なイメージを示します。(E) AAMを、心房筋細胞メッキ媒体中の12個のウェル培養皿に5 x 105細胞/ウェルでメッキした。AMAMは、その後、培地を収集してANPのイムノブロット分析を行う前に、車両またはANP分泌物(フェニレフリン、50mM)で0.5時間治療した。イムノブロット分析の前に、培地サンプルを5分間500 x gで遠心分離し、細胞の破片を除去し、観察されたANPがAMAMからの能動分泌の結果であることを確認した。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
ここで説明する手順を用いて単離される細胞の質は、培養中の細胞の収量および全体的な健康状態によって決定されるように、多数の制御可能な因子に依存する。マウス自体から、動物に課せられたストレスが培養中の細胞収量および生存率に悪影響を及ぼす可能性が文書化されており、おそらく過剰な全身性コルチゾール、カテコールアミン、および心臓組織2、5、7の過収縮状態に起因する。これらの理由から、犠牲を払う前に動物を驚かせないように対策を講じるべきである。このような措置には、動物のケージを覆い、犠牲の前にビバリウム外の時間を制限することが含まれます。安楽死に一般的に使用されるヘパリンおよび多くのバルビツール酸塩は、シグナル伝達経路に影響を与える可能性があります。したがって、安楽死の最適な方法は、それに応じてカスタマイズする必要があります。動物の年齢は、単離された細胞の質および生存率にかなりの影響を及ぼし、最も可能性の高い老化過程と同時に起こる間質線維化の進行性蓄積に起因し、組織消化に影響を及ぼす可能性がある25。ここで提示されていないデータでは、上記の方法は生後78週までのマウスで働くが、これらの古い動物では細胞の質が低かった。
記述された分離プロセスにおける最も重要なステップは、逆行灌流のためのランゲンドルフ装置を特徴とする他のプロトコルと同様に、心臓のカヌレーションおよび初期灌流である。最適な結果を得るには、心臓の排泄から上昇大オルタのカヌルへの時間と灌流の開始は90秒以下でなければなりません。時間に加えて、2つの追加の重要な要因は、カニューレの深さと灌流装置から空気塞栓を導入する可能性です。したがって、カニューレは大動脈根に入らず、冠状血管の灌流を損なう大動脈弁を妨げないように、上に大動脈に進むべきである。
消化プロセス中に、心臓筋細胞カルシウム耐性を低下させる消化酵素コラゲザーゼへの長期暴露を避けるために、定期的に心臓の剛性をテストすることが重要です。孤立した心室筋細胞培養へのカルシウム再導入のために上記のプロトコルは、店舗運営のカルシウムチャネルを介して不適切なカルシウム流入を介して心臓筋細胞死を制限するように設計された。これは、短期および長期培養12の間に細胞死を促進するので、段階的なカルシウム再導入は、単離心房筋細胞培養のために行われるべきではないことを留意すべきである。さらなる予防のために、ここで使用される灌流および消化バッファーには、単離された筋細胞の過収縮を避けるために心筋収縮抑制剤ブタンジオン単酸素(BDM)、ならびにカルシウムパラドックスが含まれ、いずれも筋細胞生存率26に影響を与える。しかし、BDMからブレビスタチンへの切り替えは、単離心臓筋細胞用の培地を維持する上で好ましい抗収縮剤であるため、注意すべきである。示されていないデータでは、ブレビスタチンは、単離心臓筋細胞の長期培養に対するより大きな生存率を打ち明ける。
単離直後に、心臓細胞、特に筋細胞の長期培養の影響を考慮することが重要である。ここで説明する心臓非筋細胞の分離および培養プロトコルは、異なる心臓細胞の異なる密度および接着特性を利用する一般的な方法に基づいている。非筋細胞の利点は、文化におけるその高い拡大の可能性です。したがって、心臓筋細胞とは異なり、それらは永続性のために通過可能である。しかし、FBSによる培地補充を含む培養条件が心臓筋細胞機能27に影響を及ぼす可能性が知られている。ここで説明する培養培地は、特に単離心筋細胞に対して、生存率を最適化し、機能的変性を制限するように設計された。ブレビスタチン補充がない培養後の単離心臓筋細胞では、収縮能力の異常は認められなかったが、肉体構造と分子シグネチャが依然として無傷の心臓を模倣している場合、電気生理学、収縮性、および生体内の単細胞に焦点を当てた研究は、単離後すぐに行われるべきである。
心房筋細胞の特徴は、収縮機能に加えて、膨大な分泌能力を持つ内分泌細胞として月光を灯す能力である。生理学的条件下では、心房筋細胞は、刺激を受けると調節された興奮性に備えて、小胞体および大きな高密度分泌顆粒に貯蔵されるANPを大量に産生する。多くの孤立した心房筋細胞研究は、そのユニークな電気生理学的特性に焦点を当てていますが、これは培養培地を設計する最初の研究です。これは、長期の生存可能性だけでなく、心房筋細胞の内分泌および収縮特性の維持機能の促進を可能にする。この新しい培養方法は、単一マウス心臓からの心房室および心室室からの全ての細胞タイプの同時単離と同様に、心房および心室筋細胞の生理学的および病理的特性に関する研究に有用かつ有効であろう。
開示事項
著者らは開示するものは何もない。
謝辞
E.A..Bは、国立衛生研究所(1F31HL140850)、ARCS財団、サンディエゴ支部、およびリーススティーリー研究財団フィリップスガウゼヴィッツ、SDSU心臓研究所のM.D.学者によってサポートされています。E.A.BとA.S..Bは稲盛財団の支援を受けています。CCG by (NIH) は、R01 HL135893、R01 HL141463 および HL149931 を付与します。
資料
| Name | Company | Catalog Number | Comments |
| (-)-Blebbistatin | Sigma-Aldrich | B0560 | |
| 1 Liter Water Jacketed Reservoir | Radnoti | 120142-1 | |
| 2,3-Butanedione monoxime | Sigma-Aldrich | B0753 | |
| 5-0 Silk Suture Thread | Fine Science Tools | 18020-50 | |
| Adenosine | Sigma-Aldrich | A9251 | |
| Bovine Serum Albumin | Sigma-Aldrich | A6003 | |
| Bubble Trap Compliance Chamber | Radnoti | 130149 | |
| Calcium Chloride Anhydrous | Fisher Scientific | C614-500 | |
| Carnitine hydrochloride | Sigma-Aldrich | C9500 | |
| Collagenase type 2 | Worthington Biochemical Corporation | LS004176 | |
| Creatine | Sigma-Aldrich | C0780 | |
| Dexamethasone | Sigma-Aldrich | D2915 | |
| DMEM/F12 (1:1; 1X) | Gibco | 11330-032 | |
| Dumont #7 - Fine Forceps | Fine Science Tools | 11274-20 | |
| Epifluorescent micropscpe | Olympus X70 | IX70 | |
| Fetal Bovine Serum (Heat Inactivated) | Omega Scientific | FB-12 | Lot# 206018 |
| Fine Scissors - Sharp | Fine Science Tools | 14060-09 | |
| Graefe Forceps | Fine Science Tools | 11051-10 | |
| Headband Magnifiers | Fine Science Tools | 28030-04 | |
| Hemacytometer (Bright-Line) | Hausser Scientific | 1475 | |
| HEPES (1M) | Gibco | 15630-080 | |
| Inosine | Sigma-Aldrich | I4125 | |
| Insulin-Transferrin-Selenium-X | Gibco | 51500-056 | |
| Isotemp 105 Water Bath | Fisher Scientific | NC0858659 | |
| Isotemp 3006 | Fisher Scientific | 13-874-182 | |
| Joklik Modified Minimum Essential Media | Sigma-Aldrich | M-0518 | |
| Laminin (Natural, Mouse) | Gibco | 1795024 | Lot# 1735572 |
| L-Glutamine | Sigma-Aldrich | G8540 | |
| Masterflex C/L Single-Channel Variable-Speed Compact Pump | Cole-Palmer | EW-77122-24 | |
| Minimum Essential Medium (MEM 1X) | Gibco | 12350-039 | |
| Molecular Biology Grade Water | Corning | 46-000-CM | |
| Pen Strep Glutamine (100X) | Gibco | 10378-016 | |
| Spring Scissors - 6mm Cutting Edge | Fine Science Tools | 15020-15 | |
| Taurine | Sigma-Aldrich | T-8691 |
参考文献
- Peter, A. K., Bjerke, M. A., Leinwand, L. A. Biology of the cardiac myocyte in heart disease. Molecular Biology of the Cell. 27 (14), 2149-2160 (2016).
- Kruppenbacher, J. P., May, T., Eggers, H. J., Piper, H. M. Cardiomyocytes of adult mice in long-term culture. Naturwissenschaften. 80 (3), 132-134 (1993).
- Ackers-Johnson, M., et al. A Simplified, Langendorff-Free Method for Concomitant Isolation of Viable Cardiac Myocytes and Nonmyocytes From the Adult Mouse Heart. Circulation Research. 119 (8), 909-920 (2016).
- Jin, J. K., et al. ATF6 decreases myocardial ischemia/reperfusion damage and links ER stress and oxidative stress signaling pathways in the heart. Circulation Research. 120 (5), 862-875 (2017).
- Judd, J., Lovas, J., Huang, G. N. Isolation, Culture and Transduction of Adult Mouse Cardiomyocytes. Journal of Visualized Experiments. (114), e54012(2016).
- Li, D., Wu, J., Bai, Y., Zhao, X., Liu, L. Isolation and Culture of Adult Mouse Cardiomyocytes for Cell Signaling and in vitro Cardiac Hypertrophy. Journal of Visualized Experiments. (87), e51357(2014).
- O'Connell, T. D., Ni, Y. G., Lin, K. M., Han, H. P., Yan, Z. Isolation and culture of adult cardiac myocytes for signaling studies. AfCS Research Reports. 1 (5), 1-9 (2003).
- Pinz, I., Zhu, M., Mende, U., Ingwall, J. S. An improvised isolation procedure for adult mouse cardiomyocytes. Cell Biochemistry and Biophysics. 61 (1), 93-101 (2011).
- Piper, H. Culturing of calcium stable adult cardiac myocytes. Journal of Molecular and Cellular Cardiology. 14 (7), 397-412 (1982).
- Shioya, T. A simple technique for isolating healthy heart cells from mouse models. Journal of Physiological Sciences. 57 (6), 327-335 (2007).
- Omatsu-Kanbe, M., Yoshioka, K., Fukunaga, R., Sagawa, H., Matsuura, H. A simple antegrade perfusion method for isolating viable single cardiomyocytes from neonatal and aged mice. Physiological Reports. 6 (9), 13688(2018).
- Jansen, H. J., Rose, R. A. Isolation of Atrial Myocytes from Adult Mice. Journal of Visualized Experiments. (149), e59588(2019).
- Yao, C., et al. Enhanced Cardiomyocyte NLRP3 Inflammasome Signaling Promotes Atrial Fibrillation. Circulation. 138 (20), 2227-2242 (2018).
- Cha, Y., Redfield, M. M., Shen, W., Gersh, B. J. Atrial Fibrillation and Ventricular Dysfunction: A Vicious Electromechanical Cycle. Circulation. 109 (23), 2839-2843 (2004).
- Issa, O., et al. Left atrial size and heart failure hospitalization in patients with diastolic dysfunction and preserved ejection fraction. Journal of Cardiovascular Echography. 27 (1), 1-6 (2017).
- de Bold, A. J. Atrial natriuretic factor: a hormone produced by the heart. Science. 230 (4727), 767-770 (1985).
- McGrath, M. F., de Bold, M. L., de Bold, A. J. The endocrine function of the heart. Trends in Endocrinology and Metabolism. 16 (10), 459-477 (2005).
- Doevendans, P. A., Daemen, M. J., de Muinck, E. D., Smits, J. F. Cardiovascular phenotyping in mice. Cardiovascular Research. 39 (1), 34-49 (1998).
- Banerjee, I., Fuseler, J. W., Price, R. L., Borg, T. K., Baudino, T. A. Determination of cell types and numbers during cardiac development in the neonatal and adult rat and mouse. American Journal of Physiology. 293, 1883-1891 (2007).
- Jugdutt, B. I. Ventricular remodeling after infarction and the extracellular collagen matrix: when is enough enough. Circulation. 108, 1395-1403 (2003).
- Omatsu-Kanbe, M., et al. Identification of cardiac progenitors that survive in the ischemic human heart after ventricular myocyte death. Scientific Reports. , 7(2017).
- Song, K., et al. Heart repair by reprogramming non-myocytes with cardiac transcription factors. Nature. 485, 599-604 (2012).
- Limana, F., et al. bcl-2 overexpression promotes myocyte proliferation. Proceedings of the National Academy of Sciences of the United States of America. 99, 6257-6262 (2002).
- Pinto, A. R., et al. Revisiting cardiac cellular composition. Circulation Research. 118 (3), 400-409 (2015).
- Chen, W., Frangogiannis, N. G. The role of inflammatory and fibrogenic pathways in heart failure associated with aging. Heart Failure Reviews. 15, 415-422 (2010).
- Daly, M. J., Elz, J. S., Nayler, W. G. Contracture and the calcium paradox in the rat heart. Circulation Research. 61 (4), 560-569 (1987).
- Li, Z., Sharma, R. V., Duan, D., Davisson, R. L. Adenovirus-mediated gene transfer to adult mouse cardiomyocytes is selectively influenced by culture medium. Journal of Gene Medicine. 5 (9), 765-772 (2003).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved