Method Article
Одновременно изоляция и культура миоцитов предсердий, желудочковых миоцитов и немиоцитов из сердца взрослой мыши
В этой статье
Резюме
Метод описывается для одновременной изоляции миоцитов и немиоцитов как от атрии, так и от желудочков сердца одной взрослой мыши. Этот протокол приводит к последовательной урожайности высоко жизнеспособных сердечных миоцитов и немиоцитов и детали оптимальных клеточных условий культуры для фенотипирования и анализа in vitro.
Аннотация
Изоляция и культивирование сердечных миоцитов у мышей имеет важное значение для дальнейшего понимания сердечной физиологии и патофизиологии. Хотя изоляция миоцитов от неонатальных сердец мыши относительно проста, миоциты из сердца взрослого мурина являются предпочтительными. Это потому, что по сравнению с неонатальными клетками, взрослые миоциты более точно повторить функцию клеток, как это происходит во взрослом сердце in vivo. Тем не менее, это технически трудно изолировать взрослых мыши сердечных миоцитов в необходимых количествах и жизнеспособности, что способствует экспериментальной тупик. Кроме того, опубликованные процедуры специфичны для изоляции либо предсердий или желудочков миоцитов за счет предсердий и желудочковой немиоцитов клеток. Описано здесь подробный метод для изоляции как предсердий и желудочков сердечных миоцитов, наряду с предсердий и желудочков, не-миоцитов, одновременно от одного сердца мыши. Также предусмотрены детали для оптимальных методов культивирования клеток, которые повышают жизнеспособность и функцию клеток. Данный протокол направлен не только на ускорение процесса изоляции клеток сердца взрослого мурина, но и на повышение урожайности и жизнеспособности клеток для исследования предсердий и желудочков сердечных клеток.
Введение
Культура первичных клеток является неотъемлемым ресурсом, который предлагает контролируемую среду для детального механистического исследования функции сердечного миоцита. Из-за их более прочный характер и легкость изоляции, неонатальной крысы предсердий и желудочков миоцитов были общим источником таких клеточныхкультур 1. Тем не менее, взрослые мыши предсердий и желудочковых миоцитов (AMAMs и AMVMs) являются весьма желательными для исследований in vitro, потому что их молекулярные и функциональные характеристики лучше имитировать взрослых клеток сердца. Таким образом, они стали актуальными для исследований, связанных с сердечными патологиями, большинство из которых развиваются увзрослых 2.
Кроме того, наличие и использование трансгенных и болезней мыши модели расширяет полезность изолированных взрослых миоцитов сердца. Протоколы изоляции и культуры мыши AMVMs для краткосрочных и долгосрочных исследований были описаны вмногочисленных предыдущих публикациях 2,3,4,5,6,7,8,9,10,11. Для сравнения было описано несколько протоколов об изоляции АМАМ. Кроме того, те, которые описаны в первую очередь оптимизированы для острых исследований свежеисположенных клеток, без долгосрочного протокола культивирования,описанного на сегодняшний день 11,12,13. Таким образом, протоколы изоляции AMAM не были разработаны для обеспечения полезности и универсальности опубликованных протоколов для изоляции и культуры AMVMs. Кроме того, хотя новаторские исследования по изоляции AMAMs и AMVMs оказались находчивыми, нет протоколов для оптимальной одновременной изоляции и культуры как AMAMs, так и AMVMs, что приводит к эффективному использованию всего сердца для каждой подготовки.
До сих пор опубликованные протоколы изоляции AMAM и AMVM не были предназначены для одновременной изоляции обоих типов клеток, поскольку большинство исследований по функции предсердий и желудочков имеют камерный фокус. Например, АМАМ используются преимущественно для изучения электрофизиологии предсердий миоцитов, отчасти из-за интереса к мерцательной аритмии (АФ), наиболее распространенной сердечной аритмии в США. Тем не менее, АФ не является заболеванием, которое влияет на атрию в изоляции, и он был вовлечен как имеющие причинно-следственную роль в легкой и тяжелой дисфункции левогожелудочка 14. Кроме того, электрокардиограммы у пациентов с сердечной недостаточностью с сохранившейся фракцией выброса (HFpEF) показали, что размер левого предсердия является одним из сильнейших предикторов восприимчивости к сердечнойнедостаточности 15.
В дополнение к своей роли в электрофизиологии и контрактности, атриум также эндокринный орган, секреция кардиокинов (т.е. предсердий натриетарного пептида (ANP), которые гомеостатически регулируют кровяноедавление и объем 16,17. Кроме того, ANP (предположительно из предсердий миоцитов) имеет видную защитную и анти-гипертрофическую роль в желудочковыхмиоцитах 16,17. Хотя существует сильное влияние нейрогормональной связи между предтеч и желудочков в различных состояниях болезни, механизмы, лежащие в основе этой связи не были полностью изучены. Этот момент является еще одним примером всплеска исследований упором на 1) роль немиоцитов (в частности, сердечной фибробластов и иммунных клеток) в больном сердце и 2), как сердечной реконструкции в качестве функции болезни непосредственно влияет на сердечно-миоцитовжизнеспособности и глобальной сердечной функции 18,19,20,21,22. Таким образом, изучение сердечных клеток как из атрии, так и из желудочков является необходимым подходом, чтобы получить более полную картину их роли в кардио патофизиологии.
Следующий протокол описывает одновременное изоляцию предсердий и желудочков миоцитов и немиоцитов от сердца одной мыши в физиологических и патофизиологических условиях. Кроме того, этот метод является первым для описания оптимальных условий, необходимых для поддержания культур предсердий сердечных миоцитов, так как условия для поддержания культур желудочковых миоцитов уже опубликованы.
протокол
Все исследования, проведенные на мышах, о которых сообщается в настоящем документе, были рассмотрены и одобрены Комитетом по институциональному уходу и использованию животных SDSU и соответствуют Руководству по уходу и использованию лабораторных животных, опубликованному Национальным исследовательским советом.
1. Подготовка изоляционных и культурных средств массовой информации и покрытия
- Подготовьте 1 л средств перфузии сердца перед использованием, добавив Joklik модифицированных минимальных необходимых средств массовой информации (MMEM) до 1 л стерильной воды. Отрегулируйте рН до 7,36 с 10 N NaOH, затем пройдите фильтр 0,2 мкм и храните при 4 градусах Цельсия в течение 2 недель.
ПРИМЕЧАНИЕ: Joklik MMEM состоит из 112 мМм NaCl, 5,4 мМ ККл, 1 мММгКл 2, 9 мМНаГ 2PO4, и 11,1 мММ D-глюкозы. Он дополнен 10 мМ HEPES (2,38 г/л), 30 мм таурин (3,75 г/л), 2 м Д-л карнитина (0,4 г/л), 2 мм креатина и 10 мм моноксима бутанедин (1,01 г/л). - Подготовь буфер пищеварения непосредственно перед перфузией, следующим образом: дополните 50 мл средств перфузии сердца 6,25 л 100 мМ CaCl2 (см. шаг 1.3) и коллагеназы типа 2 (энзиматическая активность 310-320 U/mg dw).
ПРИМЕЧАНИЕ: Взвесьте животное перед жертвоприношением. Количество коллагеназы типа 2, дополненное в буфер пищеварения, диктуется весом животного (2,25 мг коллагеназы типа 2 на 1 г массы тела). - Для подготовки 100 мМ. CaCl2, добавить 1,47 г CaCl2 до 100 мл молекулярной биологии класса воды. Перемешать до растворения, затем пройти через фильтр 0,2 мкм и хранить при комнатной температуре до 2 месяцев.
- Подготовьтесь к остановке миоцитов буфера 1, дополнив 90 мл буфера перфузии сердца 10 мл сыворотки крупного рогатого скота плода (FBS) и 125 МЛ 100 мМ CaCl2. Пройдите через фильтр 0,2 мкм и храните при 4 градусах Цельсия в течение 2 недель.
- Подготовьтесь к остановке миоцитов буфера 2, дополнив 114 мл буфера перфузии сердца 6 мл FBS и 150 МКЛ 10 мМ CaCl2. Пройдите через фильтр 0,2 мкм и храните при 4 градусах Цельсия в течение 2 недель.
- Подготовка предсердий миоцитов покрытие среды незадолго до перфузии, дополнив 95 мл модифицированной иглы Dulbecco среды (DMEM) с 4 мл FBS, 1 мл 100x пер/ стреп-глутамин, 1 мл 100x инсулин-трансферрин-селений, и 1 мл 10 МК dexthasone. Пройдите через фильтр 0,2 мкм и храните при 37 градусов по Цельсию до покрытия.
- Подготовка желудочкового миоцита покрытие среды путем дополнения 95 мл минимальной необходимой среды (MEM) с 4 мл FBS, 1 мл 100x пера / стрептококкамин, 10 мл 1 M HEPES решение, 1 мл 100x инсулин-трансферрин-селениум, и 0,1 г бутанедиона моноксима. Пройдите через фильтр 0,2 мкм и храните при 4 градусах Цельсия в течение 2 недель.
- Подготовка желудочковых миоцитов поддержания среды путем дополнения 99 мл MEM с 1 мл 100x инсулин-трансферрин-селений, 0,1 мг / мл бычьего альбумина сыворотки (BSA), 10 мл 1 M HEPES раствор и 1 мл 100x пера / стреп-глутамина. Пройдите через фильтр 0,2 мкм и храните при 4 градусах Цельсия в течение 2 недель.
- Для приготовления экспериментальных пластин и горок с ламинином, раствор ламинина (1,19 мг/мл). Добавьте 10 л раствора ламинина в каждые 1 мл DMEM и перемешайте. Пальто экспериментальных пластин и слайдов равномерно и хранить в 37 градусов по Цельсию, 5% CO2 инкубатор, по крайней мере 1 ч до перфузии, чтобы обеспечить равновесие.
ПРИМЕЧАНИЕ: Покрытые покрытием экспериментальные пластины и горки могут храниться при 4 градусах Цельсия в течение 2 дней.
2. Изоляционный аппарат
- Перед каждой изоляцией очистите трубы и другие компоненты системы тремя полными мойки 70% EtOH, заполнив пузырь ловушку на вершину (закрыть нижнюю стопкок и держать верхний стопкок открытым).
- Промыть полную систему 3x с стерильными H2O, заполнив пузырь ловушку на вершину (закрыть нижний стопкок и держать верхний стопкок открытым).
- Промыть полную систему с буфером перфузии сердца и заполнить пузырь ловушку на полпути со средствами массовой информации.
- Установите циркулирующую водяную баню до 37 градусов по Цельсию.
- Установите водяную баню для средств массовой информации до 37 градусов по Цельсию.
- Удалите любые пузырьки воздуха в перистальтической трубки насоса.
- Отрегулируйте скорость потока перистрального насоса до 3 мл/мин.
3. Хирургическая процедура (не выживание)
- Замочите хирургические инструменты в 70% EtOH, по крайней мере 5 мин.
- Поместите сердечные перфузионные средства, буферы остановки миоцитов и буфер пищеварения в водяной бане 37 градусов по Цельсию.
- Поместите предсердие миоцитов покрытие среды, желудочковой миоцитов покрытие среды, и желудочковых миоцитов поддержания среды в 37 градусов по Цельсию, 5% CO 2 инкубатор1 ч до использования и ослабить шапки, чтобы эквилибрации.
- Инъекция 10-недельного самца или самки C57b6/j мышей интраперитонически (i.p.) с 0,35 мл гепарина, разбавленного фосфатным буферным солевым раствором (PBS) до 100 МЕ/мл. Разрешить препарат в силу в течение 10 мин.
ПРИМЕЧАНИЕ: Если два сердца должны быть подвергнуты этой процедуре изоляции, вторая мышь может быть анестезирована и введена гепарин на данный момент в первой процедуре. Чтобы свести к минимуму нагрузку на животное, легкую анестезию можно вводить с помощью 2% изофлюран/кислородной смеси в герметично запечатанной индукционной камере. - Обезболить животное с 2% изофлюран / кислородной смеси и вводить т.п. с пентобарбиталом (0,3 мл от 10 мг/ мл запасов), а затем подготовить грудь путем мазка с 70% EtOH.
- Подготовка связали 5-0 шелковый шов, чтобы быть готовым ligate сердце перфузии канюли. Гора канюла рядом с хирургическим микроскопом.
- Быстро откройте грудь, сначала сделав разрез средней линии кожи, от середины живота до челюсти, а затем введя брюшной полости с большими ножницами, очистка диафрагмы прочь тупым вскрытием. Затем, отрезать грудную клетку с помощью ножниц с разрезает грудную стенку на боковой аспект обеих сторон.
- Отрежь волокнистые связи между сердцем и грудной стенки (в том числе тимуса). Затем, отрезать грудную клетку все вместе. Используя маленькие типсы и ножницы, аккуратно поднимите сердце на вершину и разоблачите задний аспект сердца.
- Высаживать сердце путем вскрытия сразу уступает инноизменной артерии на восходящей аорте и сразу же поместить сердце в ледяной PBS или холодного сердца перфузии средств массовой информации. Впоследствии, быстро вскрыть оставшиеся ткани от explanted сердца в ледяной сердце перфузии средств массовой информации, подвергая восходящей аорты.
ПРИМЕЧАНИЕ: Полезно, чтобы explant сердце с тимусом нетронутыми для использования в качестве анатомического ориентира. - Очистите территорию вокруг аорты от избытка тканей с помощью микро-рассечения типсов и ножниц. Распоимите аорту на канюлю с помощью щипчания с тонкой наконечником и закрепните 5-0 шелковым швом.
ПРИМЕЧАНИЕ: Лучшее размещение обычно происходит с аортой расширения около 2 мм на канюле. - Perfuse cannulated сердце с сердцем перфузии средств массовой информации с скоростью потока 3 мл / мин в течение 4 мин. Затем переключитесь мультимедиа с средств массовой информации перфузии сердца на буфер пищеварения для 15,0-17,5 мин перфузии(рисунок 1A).
ПРИМЕЧАНИЕ: Скорость коронарного потока, скорее всего, увеличится, что указывает на эффективное пищеварение тканей (т.е. бледное, опухшее сердце). - Соберите 8 мл буферного потока пищеварения в течение последних минут перфузии для более длительного использования в шаге 5.4.
- Удалите сердце из канюлы и поместите его на 60 мм пластиковой культуры блюдо. Удалить излишки ткани (т.е. аорты, вены) и погрузить сердце в 2,5 мл буфера пищеварения в рамках подготовки к механическому разделению.
ПРИМЕЧАНИЕ: На данный момент, предсердий вскрыты прочь, и один экспериментатор должен провести протокол изоляции предсердий клеток, в то время как второй экспериментатор должен проводить изоляции желудочковой клетки.
4. Изоляция и культура предсердий
- Рассекаете атрию вдали от сердца и поместите ее в 30-мм пластиковую культурную тарелку. Погрузите его в 0,75 мл буфера пищеварения для механического разделения. Храните желудочков в 60 мм блюдо (шаг 3.12) и выполнять отдельные методы изоляции одновременно (раздел 5, рисунок 1B).
ПРИМЕЧАНИЕ: На данный момент, предпись и желудочков может подвергнуться дальнейшему разделению, если есть необходимость изолировать левые и правые клетки. - Начните фарш и дразнить atria друг от друга, первоначально с тонкой наконечником хирургических ножниц, а затем штраф тибри для дальнейшего mincing. Избегайте агитации ткани, и не быстро тянуть друг от друга мышечные волокна.
- Используя стерильный наконечник пипетки передачи, продолжайте аккуратно смешивать и размежевать ткани в течение 15 минут. Каждые 5 минут наблюдайте диссоциацию предсердий миоцитов от ткани под 10-х объективным ярким микроскопом. По мере дальнейшего переваривания тканей продолжайте мягко смешивать и размежевать ткани с помощью стерильного наконечника пипетки с меньшим размером поры.
- Передача клеточной подвески в стерильную микро-центрифугу 2 мл трубки. Промыть 30-мм пластину с 0,75 мл 37 градусов по Цельсию миоцитов остановки буфера 1 и в сочетании с клеточной подвеской (конечный объем 1,5 мл).
- Разрешить предсердий миоцитов осадок под действием силы тяжести в течение 10 мин при комнатной температуре. Аккуратно агитировать клеточной суспензии, чтобы позволить миоцитов осадок на дно конической трубки, образуя видимые гранулы.
- Центрифуга клеточной суспензии в течение 5 мин при 20 х г. Тщательно удалите супернатант, который содержит немиоциты, и перенесите в 15 мл полипропиленовой конической трубки с помощью стерильного наконечника пипетки, не нарушая гранулы предсердий миоцитов.
- Центрифуга немиоцитов фракции в течение 5 мин на 20000 х г. Аспирировать супернатант и повторно излиться немиоцитов гранулы в 10 мл DMEM дополняется 10% плода теленка сыворотки (FCS).
- Подсчитайте немиоциты с помощью гемоцитометра или другого метода, затем пластины в соответствии с экспериментальными потребностями, или далее изолировать в отдельных конкретных популяций клеток через флуоресценции активированной сортировки клеток (Рисунок 1C).
- Resuspend гранулы изолированных миоцитов предсердий от шага 4.6 в 1 мл предсердий миоцитов покрытие среды и применить 10 йл этой подвески на гемоцитометр. Выполните количество клеток миоцитов в форме стержня на поле.
- Аспират ламинина из предварительно покрытием экспериментальных пластин / слайдов и повторно изолированных миоцитов предсердий в соответствующем объеме предсердий миоцитов покрытие среды дополняется 25 МКМ blebbistatin. Плита при желаемой плотности на экспериментальныепотребности (рисунок 1С).
ПРИМЕЧАНИЕ: Типичная плотность покрытия для долгосрочного культивирования описано здесь 5 х 105 клеток / камеры на четырехкамерных (1,7 см2) стеклянные слайды.
5. Изоляция желудочковых клеток и культура
- Начните фарш и дразнить сердце друг от друга желудочковой ткани, сначала с тонкой наконечником хирургических ножниц, а затем штраф тибры для дальнейшего mincing (Рисунок 1B). Избегайте агитации ткани, быстро потянув друг от друга мышечные волокна.
- Перенесите подвеску клетки в полипропиленовую коническую трубку 15 мл. Промыть пластину с 2,5 мл 37 градусов по Цельсию миоцитов остановки буфера 1 и в сочетании с клеточной подвеской (конечный объем 5 мл).
- Используя стерильный наконечник пипетки передачи, продолжайте аккуратно смешивать и диссоциировать ткани в течение 4 мин. Нанесите на слайд 10 МКЛ этой клеточной подвески и визуализируете наличие миоцитов в форме стержня, чтобы обеспечить качество изоляции.
- Перейдите подвеску клетки через 100 мкм стерильный нейлоновый фильтр в 50 мл полипропиленовой конической трубки. Используйте 2 мл буфера пищеварения, собранного в шаге 3.12, чтобы смыть оставшиеся клетки со стерильного нейлонового фильтра.
- Разрешить желудочковых миоцитов осадок под действием силы тяжести в течение 6 минут при комнатной температуре. Аккуратно агитировать фильтрованную подвесную клетку, чтобы позволить миоцитам от осадков в нижней части конической, образуя видимые гранулы.
- Не нарушая гранулы желудочковых миоцитов, тщательно удалите супернатант (немиоциты) и перенесите в полипропиленовую коническую трубку 50 мл с помощью стерильного наконечника пипетки. Центрифуга немиоцитов фракции в течение 5 мин на 20000 х г. Аспирировать супернатант и повторно помыть гранулы, не миоциты в 10 мл DMEM дополняется 10% FCS.
- Подсчитайте немиоциты с помощью гемоцитометра и повторного использования в соответствующем объеме DMEM, дополненном 10% FCS. Затем пластина в соответствии с экспериментальными потребностями, или далее изолировать в отдельных конкретных популяций клеток через флуоресценции активированных клетоксортировки (рисунок 1C).
- Resuspend изолированных желудочковых миоцитов в 2 мл миоцитов остановки буфера 2 и применить 10 МКЛ клеточной суспензии на гемоцитометр. Выполните количество клеток миоцитов в форме стержня на поле.
- Реинтродукция Ca2 "с помощью парадигмы шаг за шагом
ПРИМЕЧАНИЕ: Шаги реинтродукции кальция специфичны для желудочковых миоцитов и не должны выполняться для предсердий миоцитов, так как это приведет к гибели клеток.- Добавьте 50 МКЛ из 10 мМ CaCl2 к вентиляционной подвеске клеток миоцитов. Хорошо перемешать и инкубировать в течение 4 минут при комнатной температуре.
- Добавьте еще 50 МКЛ из 10 мМ CaCl2 к вентиляционной подвеске клеток миоцитов. Хорошо перемешать и инкубировать в течение 4 минут при комнатной температуре.
- Добавьте дополнительные 100 МКЛ 10 мМ CaCl2 к вентиляционной подвеске клеток миоцитов. Хорошо перемешать и инкубировать в течение 4 минут при комнатной температуре.
- Добавьте 80 МКЛ из 100 мМ CaCl2 к вентиляционной подвеске клеток миоцитов. Хорошо перемешать и инкубировать в течение 4 минут при комнатной температуре.
- Удалите ламининовое покрытие из пластин или слайдов и повторно посовестите изолированные желудочковые миоциты в соответствующем объеме желудочковой среды покрытия миоцитов в соответствии с экспериментальнымипотребностями (рисунок 1C).
ПРИМЕЧАНИЕ: Типичная плотность покрытия для долгосрочного культивирования описано здесь 5 х 105 клеток / камеры на четырехкамерных (1,7 см2) стеклянные слайды. Избегайте покрытия при плотности более 75% слияния, так как клеточное чрезмерное уплотнение способствует слипанию клеток, тем самым препятствуя привязанности к пластине. Кроме того, большое количество ячеек будет потеряно во время первого среднего изменения. Клетки плит быстро после изоляции, как внеклеточный Ca2 "способствует гиперконтракции и потери жизнеспособных миоцитов. - Разрешить желудочковых миоцитов, чтобы поселиться и придерживаться, по крайней мере 1 ч. Впоследствии изменить средства массовой информации желудочков миоцитов поддержания среды дополняется 25 МК blebbistatin.
ПРИМЕЧАНИЕ: Вентрикулярные миоциты могут быть отстояны до 96 ч после покрытия в blebbistatin. Эксперименты должны проводиться в желудочковой миоцитов поддержания среды при отсутствии blebbistatin.
Результаты
Дикий тип 10-недельного C57b6/j мыши сердце обычно приводит к между 75000-150000 предсердий миоцитов и 1,0-1,5 х 106 желудочковых миоцитов, что приравнивается к приблизительной урожайности 30% -50% для предсердий и желудочковмиоцитов 18,19. Во время и сразу после изоляции, жизнеспособные сердечные миоциты должны появиться стержня формы и без контракта. Большинство изолированных сердечных миоцитов должны адаптировать эту морфологию, которая является признаком эффективной перфузии. Морфология формы стержня также может быть предиктором жизнеспособности. Протокол направлен на повышение урожайности и жизнеспособности миоцитов и немиоцитов, изолированных от больного сердца мыши. Кроме того, он был протестирован в модели давления перегрузки индуцированной сердечной недостаточности (данные не показаны).
Для подтверждения адекватной и реплицируемой изоляции миоцитов и немиоцитов от предсердий и желудочковой ткани, клетки наблюдались и фотографировались в различные дни в культуре(рисунок 2). Кроме того, была проведена количественная обратная транскрипционная полимеразная цепная реакция (qRT-PCR) для измерения уровней транскрипций, характерных для типа клеток. Тропонин сердечной мышцы T (Tnnt2) является маркером сердечных миоцитов и был надежно выражен как в предсердий и желудочковой сердечной культуры миоцитов(рисунок 3A). В отличие от предсердий натриуретического пептида (Nppa, который обычно выражается исключительно во взрослых предсердий сердечных миоцитов в физиологических условиях) и миозин световой цепи 2 (Myl2, который является желудочковой миоцитов специфический ген) были надежно и конкретно выражены в предсердий и желудочковой сердечной миоцитов культур, соответственно (Рисунок 3B,C).
Фибробласты маркеры, транскрипционный фактор 21 (Tcf21), тромбоцитов фактор роста рецептора A (Pdgfra), и моноцитов полученных клеточных маркеров кластера дифференциации 68 (Cd68) были исключительно выражены в немиоцитов культур, изолированных от предсердий и желудочковой камер (Рисунок 3ДЗФ). Подсчитано, что немиоциты компромисс 65% всех клеток сердца, и что большинство из них происходят из фибробласта или моноцитовполученных линии 18,19,23,24. Таким образом, маркеры для этих двух линий были выбраны в качестве репрезентативных, учитывая интерес к этим клеточным популяциям в исследованиях различных моделей и этиологии сердечной патологии.
Иммуностимулирование АМАМ и АМВМ для дигидропиридина т-трубного маркера (DHPR, который зависит от напряжения (L) типа кальция), а также рецептора райанодина (RYR2) продемонстрировали нетронутые т-трубы на протяжении всей изоляции и долгосрочнойкультуры (рисунок 4A,B). Обилие DHPR и локализации, которая была характерна и уникальна для предсердий и желудочков миоцитов, указывает на наличие т-труб. Кроме того, колокализация DHPR с помощью иммуностимулятора RYR2 является показателем нетронутых структур диада. Иммуностимация саркомерного белка альфа-актинина в предсердии и желудочковых сердечных миоцитах привела к ожидаемой саркомерной полосте. Саркомерная модель стриминга использовалась для оценки чистоты и жизнеспособности изолированных сердечных миоцитов в сочетании с морфологической формой в форме стержня и ядерным окрашиванием с TOPRO-3(рисунок 4C,D;фиолетовый и красный). Как и ожидалось, желудочковые сердечные миоциты были большими, выставляли среднюю длину 150 мм, в то время как предсердие сердечных миоцитов в среднем 75 мм. Кроме того, при иммуностепенинговом анализе миоциты предсердий (но не желудочковые сердечные миоциты) продемонстрировали надежное выражение предсердий натриуретического пептида (ANP) в окрашивание шаблона, который был характерен для локализации эндоплазмической ретикулум и секреторных гранул(рисунок 4C,D; зеленый).
Характеристикой уникально к предсердию сердечные миоциты своя классифицирование как эндокринная клетка в дополнение к контрактильной клетке. В то время как предсердие миоцитов выделяет ANP в базальных условиях, секреция увеличивается в ответ на сеньягог (т.е. альфа-адренаргический агонист, фенилэфрин (PE). Кроме того, предсердие сердечных миоцитов выделяют ANP и совместно обрабатывать часть гормона от его состояния предшественника (Pro-ANP, 15 кД) к продукту пептид (ANP 3kD)16,17. Эта секреторная способность может быть количественно через иммуноблот обнаружения АНП в средствах массовой информации изолированных предсердий сердечных миоцитов в ответ на острое лечение PE (Рисунок 4E). Было установлено, что эта секреторная и вычислительная способность предсердий сердечного миоцита чувствительна к условиям культивирования. Таким образом, крайне важно, чтобы предсердие миоцитов покрытие среды дополняется дексаметазон, инсулин, трансферрин, и селен.
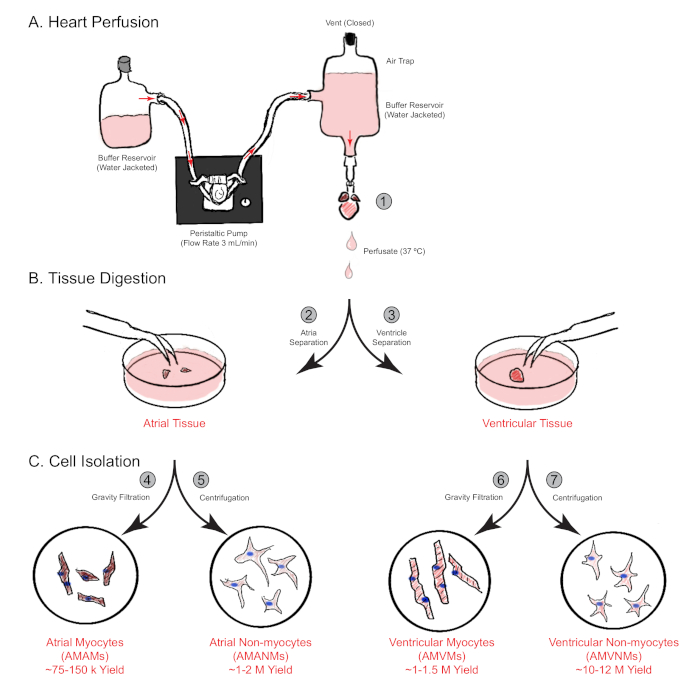
Рисунок 1: Схематический обзор ретроградной перфузии сердца, пищеварения и изоляции клеток. Показаны основные шаги, связанные с изоляцией клеток от предсердий и желудочковой камер одновременно от сердца одной мыши. (A) Сердце одной мыши быстро cannulated через восходящую аорту и проникнуты в ретроградной манере. (B)Сердце разделено на предсердие и желудочковые ткани для дальнейшего пищеварения и физического разделения. (C)После адекватного пищеварения, клетки разделены через гравитационную фильтрацию в общей сложности четыре клеточные фракции, которые культурикулироваться для последующих экспериментов. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
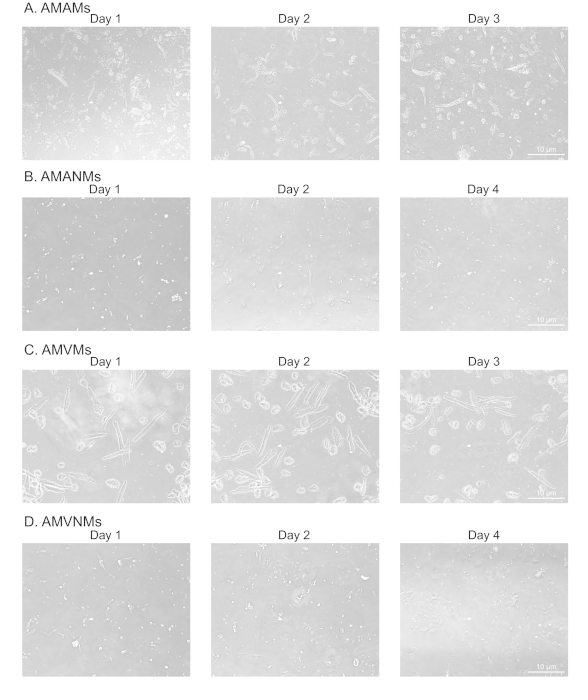
Рисунок 2: Морфологический анализ изолированных предсердий и желудочков сердечных миоцитов и немиоцитов в культуре. (A) Изолированные взрослые мыши предсердий миоцитов(AMAMs),( B ) взрослых мыши предсердий немиоцитов(AMANMs),( C ) взрослых мыши желудочковых миоцитов(AMVMs),или ( D ) взрослых мыши желудочковых немиоцитов (AMVNMs) были покрыны на 5х 10 5 клеток / камеры на четырех-камерных (1,7 см) Фазические изображения были получены в указанные дни в культуре с помощью 10-х целей под микроскопом эпифлуоресценции. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
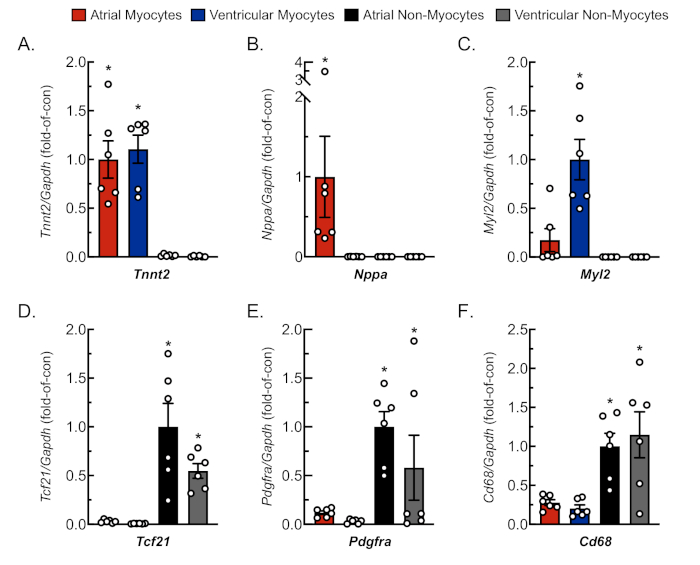
Рисунок 3: Представитель qRT-PCR анализ изолированных клеточных культур. РНК была извлечена из недавно изолированных сердечных миоцитов и немиоцитов, а уровни мРНК для клеточных маркеров генов определялись qRT-PCR4. (A) Tnnt2, сердечная мышца тропонин T (сердечный маркер миоцитов); (B) Nppa , предсердиенатриуретического пептида (маркер миоцитов предсердий); (C) Myl2, световая цепь миозин 2 (желудочковый маркер миоцитов); (D) Tcf21, транскрипционный фактор 21 (фибробластный маркер); (E) Pdgfra, тромбоцитов, полученных рецептор фактора роста А (фибробласт маркер); (F) Cd68, кластер дифференциации 68 (моноцитов полученных клеточных маркеров). Данные представляют собой среднее ± SEM (на ≤ 0,05 евро отличается от всех других значений, определяемых ANOVA с последующим пост-специальным анализом Ньюмана Кеула). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
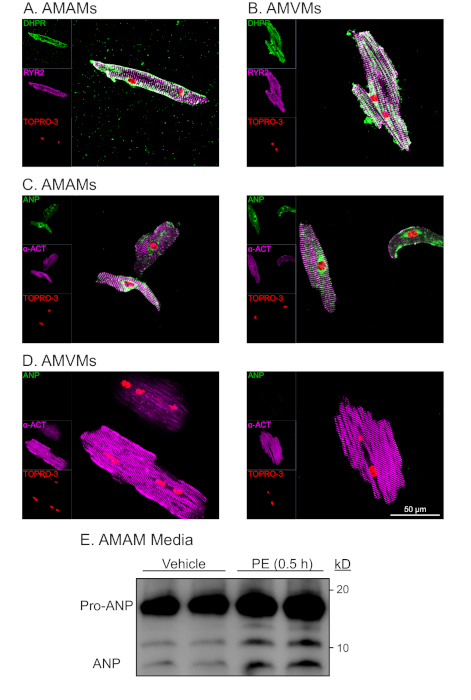
Рисунок 4: Репрезентативный морфологический и функциональный анализ изолированных предсердий и желудочков сердечных миоктов. (A) AMAMs или ( B )AMVMsбыли поцарны на 5 х 105 ячеек / камеры на четырех камерах (1,7см 2) стеклянные слайды в соответствующих покрытия средств массовой информации в течение 1 ч, чтобы обеспечить адгезию. За этим последовало либо перекармливание предсердий миоцитов покрытие средств массовой информации или переход на желудочковый миоцит поддержания средств массовой информации дополняется blebbistatin для дополнительных 16 ч. Культуры были впоследствии зафиксированы затем иммунотели для RYR2 (фиолетовый), DHPR (зеленый), и ядерное пятно TOPRO-3 (красный). (C) AMAMs или ( D )AMVMsбыли изолированы и позолочены, затем иммунотелин для а-актинина (фиолетовый), ANP (зеленый), и TOPRO-3 (красный). Показаны два репрезентативных изображения для каждого типа ячейки. (E) AMAMs были поцаривания на 5 х 105 клеток / хорошо на 12 хорошо культуры блюдо для 16 ч в предсердий миоцитов покрытие средств массовой информации. АМАМ впоследствии лечились на 0,5 ч с помощью транспортного средства или секретагога ANP (фенилэфрин, 50 мМ), прежде чем средства массовой информации были собраны и подвергнуты иммуноблот-анализу для ННП. До анализа иммуноблота образцы средств массовой информации были центрифугированы на уровне 500 х г в течение 5 минут для удаления клеточного мусора и обеспечения того, чтобы наблюдаемый АНП был результатом активной секреции от АМАМ. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Качество клеток, изолированных с помощью описанной здесь процедуры, определяемой выходом клеток и общим состоянием клеток в культуре, зависит от многочисленных контролируемых факторов. Начиная с самой мыши, было документально подтверждено, что стресс, наложенный на животное может негативно повлиять на урожайность клеток и жизнеспособность в культуре, предположительно из-за избыточного системного кортизола, катехоламинов, и гиперконтрактноесостояние сердечной ткани 2,5,7. По этим причинам следует принять меры, чтобы не насторожить животное перед жертвоприношением. Такие меры включают покрытие клетки животного и ограничение времени за пределами вивария до жертвоприношения. Гепарин и многие барбитураты, обычно используемые для эвтаназии, могут влиять на сигнальные пути; таким образом, оптимальный метод эвтаназии должен быть соответствующим образом настроен. Возраст животного оказывает значительное влияние на качество и жизнеспособность изолированных клеток, скорее всего, из-за прогрессивного накопления интерстициального фиброза, происходящего одновременно с процессом старения, который может повлиять на пищеварениетканей 25. В данных, не представленных здесь, в то время как метод, описанный выше, работает у мышей до 78 недель, качество клеток было ниже у этих старых животных.
Наиболее важным шагом в описанном процессе изоляции, а также других протоколах с аппаратом Лангендорфа для ретроградной перфузии является каннуляция и начальная перфузия сердца. Для достижения оптимальных результатов время от сердечной эксплантации до канюляции восходящей аорты и начала перфузии должно занять не более 90 с. Помимо времени, еще двумя важными факторами являются глубина канюли и возможность введения эмболии воздуха из перфузионные аппараты. Соответственно, канюлю следует продвинуть в восходящую аорту, чтобы не попасть в корень аорты и не мешать аортального клапана, что может повредить перфузию коронарных сосудов.
В процессе пищеварения важно регулярно тестировать жесткость сердца, чтобы избежать длительного воздействия пищеварительного фермента коллагеназы, который снижает толерантность к кальцию миоцитов сердца. Протокол, описанный выше для реинтродукции кальция в изолированных желудочковых миоцитов культур был разработан, чтобы ограничить сердечную смерть миоцитов через неуместный приток кальция через сохраненные управляемые каналы кальция. Следует отметить, что пошаговая реинтродукция кальция не должна проводиться для изолированных культур миоцитов предсердий, так как это будет способствовать гибели клеток во время краткосрочной идолгосрочной культуры 12. Для дальнейшей предосторожности, перфузии и пищеварения буферов, используемых здесь включают ингибитор сокращения сердечной мышцы butanedione моноксим (BDM), чтобы избежать гиперконтракции изолированных миоцитов, а также парадокс кальция, оба из которых влияют на жизнеспособностьмиоцитов 26. Тем не менее, переход от BDM к blebbistatin следует отметить, так как это предпочтительный анти-контрактильный агент в поддержании средств массовой информации для изолированных сердечных миоцитов. В данных не показано, blebbistatin придает большую жизнеспособность для долгосрочной культуры изолированных миоцитов сердца.
Сразу после изоляции важно учитывать последствия долгосрочной культуры сердечных клеток, особенно миоцитов. Описанная здесь сердечная изоляция немиоцитов и протокол культивирования основаны на общих методах, которые используют различные плотности и клеевые свойства различных сердечных клеток. Преимуществом немиоцитов является их высокий потенциал расширения в культуре; таким образом, в отличие от сердечных миоцитов, они подходят для прохода для увековечения. Тем не менее, известно, что культивирование условий, в том числе средних добавок с FBS, может повлиять на функциональность сердечного миоцита27. Описанные здесь культурные средства массовой информации были разработаны для оптимизации жизнеспособности и ограничения функциональных нарушений, особенно для изолированных миоцитов предсердий. Хотя никаких явных нарушений контрактильной способности наблюдалось в изолированных сердечных миоцитов после культуры в отсутствие blebbistatin добавок, исследования, которые сосредоточены на электрофизиологии, контрактности, и другие одноклеточные в виво основе молекулярной сигнализации должны быть выполнены вскоре после изоляции, когда саркомерная структура и молекулярная подпись по-прежнему имитирует, что из нетронутого сердца.
Отличительной чертой предсердий миоцита является его способность подрабатывать эндокринной клеткой с огромной секретной способностью, в дополнение к их контрактильной функции. В физиологических условиях, предсердий миоциты производят большое количество ANP, который хранится в эндоплазмической ретикулум и в больших плотных основных секреторных гранул, готовых к регулируемому экзоцитозу при получениистимула 16,17. Хотя многие изолированные исследования миоцитов предсердий сосредоточены на их уникальных электрофизиологических свойств, это первое исследование для разработки культуры средств массовой информации. Это обеспечивает долгосрочную жизнеспособность, а также содействие сохраненным функциям эндокринных и контрактильные свойства предсердий миоцитов. Этот новый метод культивирования, а также одновременной изоляции всех типов клеток от предсердий и желудочковых камер из сердца одной мыши будет полезен и эффективен для исследований физиологических и патофизиологических свойств как предсердий, так и желудочков миоцитов.
Раскрытие информации
Авторов нечего раскрывать.
Благодарности
E.A.B. была поддержана Национальными институтами здравоохранения (1F31HL140850), Фондом ARCS, Inc., отделением Сан-Диего, и является Rees-Stealy Research Foundation Phillips Gausewitz, M.D. Scholar of the SDSU Heart Institute. E.A.B. и A.S.B. были поддержаны Фондом Инаямори. CCG (NIH) предоставляет R01 HL135893, R01 HL141463 и HL149931.
Материалы
| Name | Company | Catalog Number | Comments |
| (-)-Blebbistatin | Sigma-Aldrich | B0560 | |
| 1 Liter Water Jacketed Reservoir | Radnoti | 120142-1 | |
| 2,3-Butanedione monoxime | Sigma-Aldrich | B0753 | |
| 5-0 Silk Suture Thread | Fine Science Tools | 18020-50 | |
| Adenosine | Sigma-Aldrich | A9251 | |
| Bovine Serum Albumin | Sigma-Aldrich | A6003 | |
| Bubble Trap Compliance Chamber | Radnoti | 130149 | |
| Calcium Chloride Anhydrous | Fisher Scientific | C614-500 | |
| Carnitine hydrochloride | Sigma-Aldrich | C9500 | |
| Collagenase type 2 | Worthington Biochemical Corporation | LS004176 | |
| Creatine | Sigma-Aldrich | C0780 | |
| Dexamethasone | Sigma-Aldrich | D2915 | |
| DMEM/F12 (1:1; 1X) | Gibco | 11330-032 | |
| Dumont #7 - Fine Forceps | Fine Science Tools | 11274-20 | |
| Epifluorescent micropscpe | Olympus X70 | IX70 | |
| Fetal Bovine Serum (Heat Inactivated) | Omega Scientific | FB-12 | Lot# 206018 |
| Fine Scissors - Sharp | Fine Science Tools | 14060-09 | |
| Graefe Forceps | Fine Science Tools | 11051-10 | |
| Headband Magnifiers | Fine Science Tools | 28030-04 | |
| Hemacytometer (Bright-Line) | Hausser Scientific | 1475 | |
| HEPES (1M) | Gibco | 15630-080 | |
| Inosine | Sigma-Aldrich | I4125 | |
| Insulin-Transferrin-Selenium-X | Gibco | 51500-056 | |
| Isotemp 105 Water Bath | Fisher Scientific | NC0858659 | |
| Isotemp 3006 | Fisher Scientific | 13-874-182 | |
| Joklik Modified Minimum Essential Media | Sigma-Aldrich | M-0518 | |
| Laminin (Natural, Mouse) | Gibco | 1795024 | Lot# 1735572 |
| L-Glutamine | Sigma-Aldrich | G8540 | |
| Masterflex C/L Single-Channel Variable-Speed Compact Pump | Cole-Palmer | EW-77122-24 | |
| Minimum Essential Medium (MEM 1X) | Gibco | 12350-039 | |
| Molecular Biology Grade Water | Corning | 46-000-CM | |
| Pen Strep Glutamine (100X) | Gibco | 10378-016 | |
| Spring Scissors - 6mm Cutting Edge | Fine Science Tools | 15020-15 | |
| Taurine | Sigma-Aldrich | T-8691 |
Ссылки
- Peter, A. K., Bjerke, M. A., Leinwand, L. A. Biology of the cardiac myocyte in heart disease. Molecular Biology of the Cell. 27 (14), 2149-2160 (2016).
- Kruppenbacher, J. P., May, T., Eggers, H. J., Piper, H. M. Cardiomyocytes of adult mice in long-term culture. Naturwissenschaften. 80 (3), 132-134 (1993).
- Ackers-Johnson, M., et al. A Simplified, Langendorff-Free Method for Concomitant Isolation of Viable Cardiac Myocytes and Nonmyocytes From the Adult Mouse Heart. Circulation Research. 119 (8), 909-920 (2016).
- Jin, J. K., et al. ATF6 decreases myocardial ischemia/reperfusion damage and links ER stress and oxidative stress signaling pathways in the heart. Circulation Research. 120 (5), 862-875 (2017).
- Judd, J., Lovas, J., Huang, G. N. Isolation, Culture and Transduction of Adult Mouse Cardiomyocytes. Journal of Visualized Experiments. (114), e54012(2016).
- Li, D., Wu, J., Bai, Y., Zhao, X., Liu, L. Isolation and Culture of Adult Mouse Cardiomyocytes for Cell Signaling and in vitro Cardiac Hypertrophy. Journal of Visualized Experiments. (87), e51357(2014).
- O'Connell, T. D., Ni, Y. G., Lin, K. M., Han, H. P., Yan, Z. Isolation and culture of adult cardiac myocytes for signaling studies. AfCS Research Reports. 1 (5), 1-9 (2003).
- Pinz, I., Zhu, M., Mende, U., Ingwall, J. S. An improvised isolation procedure for adult mouse cardiomyocytes. Cell Biochemistry and Biophysics. 61 (1), 93-101 (2011).
- Piper, H. Culturing of calcium stable adult cardiac myocytes. Journal of Molecular and Cellular Cardiology. 14 (7), 397-412 (1982).
- Shioya, T. A simple technique for isolating healthy heart cells from mouse models. Journal of Physiological Sciences. 57 (6), 327-335 (2007).
- Omatsu-Kanbe, M., Yoshioka, K., Fukunaga, R., Sagawa, H., Matsuura, H. A simple antegrade perfusion method for isolating viable single cardiomyocytes from neonatal and aged mice. Physiological Reports. 6 (9), 13688(2018).
- Jansen, H. J., Rose, R. A. Isolation of Atrial Myocytes from Adult Mice. Journal of Visualized Experiments. (149), e59588(2019).
- Yao, C., et al. Enhanced Cardiomyocyte NLRP3 Inflammasome Signaling Promotes Atrial Fibrillation. Circulation. 138 (20), 2227-2242 (2018).
- Cha, Y., Redfield, M. M., Shen, W., Gersh, B. J. Atrial Fibrillation and Ventricular Dysfunction: A Vicious Electromechanical Cycle. Circulation. 109 (23), 2839-2843 (2004).
- Issa, O., et al. Left atrial size and heart failure hospitalization in patients with diastolic dysfunction and preserved ejection fraction. Journal of Cardiovascular Echography. 27 (1), 1-6 (2017).
- de Bold, A. J. Atrial natriuretic factor: a hormone produced by the heart. Science. 230 (4727), 767-770 (1985).
- McGrath, M. F., de Bold, M. L., de Bold, A. J. The endocrine function of the heart. Trends in Endocrinology and Metabolism. 16 (10), 459-477 (2005).
- Doevendans, P. A., Daemen, M. J., de Muinck, E. D., Smits, J. F. Cardiovascular phenotyping in mice. Cardiovascular Research. 39 (1), 34-49 (1998).
- Banerjee, I., Fuseler, J. W., Price, R. L., Borg, T. K., Baudino, T. A. Determination of cell types and numbers during cardiac development in the neonatal and adult rat and mouse. American Journal of Physiology. 293, 1883-1891 (2007).
- Jugdutt, B. I. Ventricular remodeling after infarction and the extracellular collagen matrix: when is enough enough. Circulation. 108, 1395-1403 (2003).
- Omatsu-Kanbe, M., et al. Identification of cardiac progenitors that survive in the ischemic human heart after ventricular myocyte death. Scientific Reports. , 7(2017).
- Song, K., et al. Heart repair by reprogramming non-myocytes with cardiac transcription factors. Nature. 485, 599-604 (2012).
- Limana, F., et al. bcl-2 overexpression promotes myocyte proliferation. Proceedings of the National Academy of Sciences of the United States of America. 99, 6257-6262 (2002).
- Pinto, A. R., et al. Revisiting cardiac cellular composition. Circulation Research. 118 (3), 400-409 (2015).
- Chen, W., Frangogiannis, N. G. The role of inflammatory and fibrogenic pathways in heart failure associated with aging. Heart Failure Reviews. 15, 415-422 (2010).
- Daly, M. J., Elz, J. S., Nayler, W. G. Contracture and the calcium paradox in the rat heart. Circulation Research. 61 (4), 560-569 (1987).
- Li, Z., Sharma, R. V., Duan, D., Davisson, R. L. Adenovirus-mediated gene transfer to adult mouse cardiomyocytes is selectively influenced by culture medium. Journal of Gene Medicine. 5 (9), 765-772 (2003).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены