Method Article
בידוד ותרבות בודדים מודל מורנה של קבצי נייל-דרייפוס ניוון שרירים בתחילת לאחר לידה פיתוח
In This Article
Summary
כאן, אנו מציעים שיטה ביעילות להשיג סיבי שריר בודד בשלב מוקדם לאחר לידה התפתחותית מ homozygous מוטציה Lamin δ 8-11 מודל העכבר, מודל חמור מאוד עבור השרירים נייל-דרייפוס ניוון שרירים (edmd).
Abstract
אוטוזומבית הדומיננטי נייל-דרייפוס ניוון שרירים (EDMD) נגרמת על ידי מוטציות ב- Lmna gene, אשר מקודד את מסוג A-type גרעינית, חלבונים ביניים בינוניים הסובלים מעטפת גרעינית ורכיבים של האופאופלזמה. אנו דיווחו לאחרונה כי בזבוז שרירים ב EDMD ניתן לייחסו הפנימי אפיגנטי תפקוד המשפיעים על השריר (לווין) תאי גזע קיבולת רגנרטיבית. בידוד ותרבות של מיויוסיבי יחיד היא אחת הגישות הפיזיולוגיות ביותר לשעבר vivo לפקח על התנהגות תאים לווין בתוך הנישה שלהם, כפי שהם נשארים בין הבסיס לאמינה סביב סיבים ואת sarcolemma. לכן, היא מייצגת פרדיגמה ניסויית שאינה יסולא בפז ללמוד תאי לווין ממגוון דגמים מורניים. כאן, אנו מתארים שיטה מותאמת מחדש לבודד סיבים שלמים וקיימא מיותמים מן השרירים לאחר לידה הקודם (ה, החדש החדש, פושט הסוליה הארוך, חלזונות והסוליה). בעקבות פרוטוקול זה, הצלחנו ללמוד תאי לווין מ Lamin δ 8-11 -/-עכברים, מודל החמור edmd מוראו, רק 19 יום לאחר הלידה.
אנו מפרטים את הליך הבידוד, כמו גם את תנאי התרבות להשגת כמות טובה של סיבים מיואלה ושלהם הקשורים בתאי הלווין-צאצאי נגזר. כאשר מתורבת הצמיחה-גורמי בינוני עשיר, תאי לווין נגזר עכברים סוג פראי להפעיל, מתרבים, ובסופו של דבר להבדיל או לעבור התחדשות עצמית. ב homozygous Lamin δ 8-11-/-עכברים מוטנטים יכולות אלה לקויי פגיעה.
טכניקה זו, אם מלווה בקפדנות, מאפשרת ללמוד את כל התהליכים המקושרים לתאי הלווין המשויכים לאלה גם בשלב מוקדם של לאחר לידה בשלבים ההתפתחותיים ובשרירים שבריריים.
Introduction
שריר השלד הוא רקמה הבדיל עם אחת היכולת המורחבת ביותר להתחדש לאחר תרגיל או טראומה1. מאפיין זה הוא בעיקר בשל נוכחותם של תאי גזע, הנקרא תאי לווין בגלל המיקום ההיקפי שלהם בין לאמינה הבסיס ואת פלמאלאמה של מיוסיבי2. במהלך פיתוח לאחר לידה, תאי לווין מתרבים ובהדרגה להבדיל, ובכך לתרום צמיחת שריר השלד. פעם אחת בבגרות, תאי לווין נכנסים למצב שקט הפיך, ועל טראומה פיזיולוגית או פתולוגית, הם מפעילים, מתרבים ומבדילים כדי לתקן את השרירים הפגועים3. פגמים בקיבולת של תאים לווין כדי לעבור כראוי דרך שלבים אלה משובי שונים ולעבור התחדשות עצמית היתה קשורה היטב לבזבוז שרירים, או במהלך הזדקנות פיזיולוגית4,5,6 או במחלות ניווניות שרירים, כגון שרירי dystrophies7,8,9,10.
שתי גישות התרבות העיקריות קיימות כדי ללמוד תאים לווין ex-vivo: תרבויות מיוגניים הראשי של תאים מונונותים, מכנית וכימית הנתק מתוך שריר שלם11,12; או תרבות של מיוסיבים מבודדים13,14,15,16,17,18,19,20. במקרה הראשון, התהליך של בידוד תאים לווין כרוך הטריטורציה של שרירי שלם שחולצו מן העכבר, עיכול כימי, סינון, פלורסנט המופעל מיון התא (FACS)21. הליך זה, אם כי יעיל בבידוד תאי לווין ממגוון דגמים, כרוך במספר משתנים החושפים תאי לווין לסטרס ומשבש את הנישה הפיזיולוגית שלהם22,23. לעומת זאת, בידוד בסיבים כרוך בעיכול עדין יותר של רקמת השריר עם אנזימים משפילים מטריקס וגריסה מכנית הגורמת טראומה מופחתת לתאי גזע20. גישה זו השנייה מאפשרת אחזור הרבה יותר יעיל של תאי לווין קיימא, כי נשארים מחוברים פיזית היותסיבים שלהם בין הבסיס טרף ואת sarcolemma, ובכך מאפשר ניתוח בתוך נישה פיזיולוגית שלהם19,20.
פרוטוקולים רבים ושונים הוצעו במהלך השנים האחרונות כדי לבודד כראוי וביעילות בודד סיבי מיויום משרירי השלד. כבר ב 1986 Bischoff הציע פרוטוקול כדי לבודד סיבים מן כופף הדיגיטלי בקצר13 ומעלה, ב 1995, רוזנבלט ואח ' שינתה את הפרוטוקול כדי לקבל הפרדה יעילה יותר של סיבים מיוי114. מאז, מחברים רבים אחרים הציעו הליכים מותאמים על שרירים אחרים, כגון פושט היתר (אדי) והתהליכים הטיביים הקדמי (TA)15,16,17,18,19,20, כי הם יותר, אפילו אם יותר שברירי, השרירים14. לאחר מכן ניתן לטפח את הסיבים המבודדים באמצעות הדבקה, כדי לאפשר הרחבה של תאי לווין הנגזרים מmyoblasts או בתנאים צפים, עד 96 שעות, כדי לעקוב אחר צאצאים הנגזרים מתאי לווין בודדים19 (איור 1). ריכוזים משתנים של סרום בתוך המדיום התרבותי משמשים להפעלת תאי לווין הפעלה, התפשטות ו/או בידול, כדי ללמוד את יכולתם לעבור דרך תקינה בשלבים אלה שונים1.
לאחרונה תיארנו את המנגנון האפיגנטי מאחורי התשישות של הבריכה תא גזע הלוויין במודל העכבר של EDMD, Lamin δ 8-11-/-עכבר7. מאז עכברים אלה בדרך כלל מתים בין 4-8 שבועות של גיל24, בשל אובדן שרירים חמורים, נעשה ניסיון ללכוד את הפגמים המולקולריים הבסיסיים התחלתה של המחלה על ידי התמקדות הניתוח שלנו על פיתוח שרירים שלאחר לידה. שצפים בודדים מיוסיבים היו מבודדים ומתורבתים מסוג פראי, Lamin δ 8-11 -/-מוטציה7 19 ימים עכברים. בשלב זה, פגמים בשריר כבר ברור, אבל עכברים עדיין קיימא. עם זאת, מאז כל הפרוטוקולים שהוזכרו לעיל עבור הפקת סיבים בודדים היו ממוטבים עבור שרירי השלד של עכברים למבוגרים, היינו צריכים להתאים אותם למטרות שלנו: עכברים קטנים מאוד בתקופת הגיל והגודל, ומאוד שברירי מיוסיבי. כך, אנו מתארים כאן שלנו הסתגלות מחדש של הפרוטוקול המוצע על ידי המעבדה רודניקי19 כדי לקבל מספר משמעותי של מיוסיבי קיימא יחיד מעכברים במהלך פיתוח לאחר לידה ומפני השרירים הדיסטרומכולה חמורה, כגון אלה שנגזר lamin δ 8-11 -/-עכברים24. המטרה הסופית של גישה זו היא לספק הליך מתוקננת למחקר של מיותסיבים הקשורים בתאי גזע שרירים בכל מודל עכבר אחר כאשר השלבים המוקדמים של פיתוח לאחר לידה הם של עניין, או במקרה של מודלים העכבר נושאים כל מחלה ספציפית שהופך את הסיבים האלה רגישים יותר ללחץ מכני.
Protocol
כל ההליכים הניסיוניים בוצעו באישור האתי של משרד הבריאות האיטלקי והטיפול בבעלי חיים מוסדיים ובוועדת השימוש (אישור נ. 83/2019-PR). בעלי החיים שמרו במתקן מורשה בבית החולים סן רפאלה, מילאנו, איטליה (הסמכה נ. נ. 127/2012-א).
1. ניתוח שרירים ותרבית סיבים
- הכנת ציוד.
- לפני תחילת ההכנות, הכינו את כל הפתרונות הנחוצים כמתואר בטבלה 1. הפתרונות האלה צריכים להיות מוכנים טרי.
- לנקות את כל המשטחים וכלים שישמשו במהלך ההליך עם 70% אתנול.
- לפני תחילת הקורבנות עכברים, לבצע ציפוי של 100 מ"מ ו 35 מ"מ מנות פטרי באמצעות סרום סוס (HS). מעילים את כל הכלים כדי למנוע מסיבים לצרף את הפלסטיק. שקול להשתמש בצלחת 1 100 מ"מ ו 4 35 מ"מ מנות לכל עכבר.
- לאחר הסרת עודפי HS, יש לאחסן מנות מצופות בחממה ב-37 ° c למשך 30 דקות. לאחר מכן מלאו אותו בתמיסת כביסה או באמצעי תרבות (מנות 2 35 מ"מ לכל עכבר).
הערה: לחילופין, ניתן להשתמש בתמיסה של 10% HS במדיום של מבנה העיט (DMEM) השונה ביותר עבור מנות משותפות. . תמיד תשתמש בכלים מצופים ניתן להשתמש במנות תרבות בגודל שונה, אך מומלץ לעשות שימוש במידות מנות פטרי. - עבור בידוד סיבים, הכינו פיפטות פסטר סטריליים, כפי שמוצג באיור 2. עבור כל עכבר להכין חור אחד גדול נשא פיפטה לטיפול בשריר ופירוק מכני (איור 2A) ואחד צינורות חור קטן עבור בחירת סיבים (איור 2a). חותכים כל אחד מצינורות הזכוכית, ואולי משתמשים בעט ביהלום, לאורך הרצוי ולקצות הפיפטה החלקים בלהבה.
- מעיל כל פיפטה על ידי הרטבת אותו בקצרה עם HS לפני השימוש.
- הקרבת עכבר וניתוח שרירים
- חמם מראש את פתרון העיכול בטמפרטורת החדר במשך 10 דקות לפני תחילת הליך הניתוח. מיכלי פוליפרופילן FACS עגולים התחתון הם המכולות המתאים ביותר למטרה.
- מיד לפני תחילת אחזור שרירים, להקריב את העכבר על פי המלצה לאומית IACUC לאומי.
- רטוב הגוף התחתון עם 70% אתנול לפני חיתוך העור כדי להפוך את ההסרה של השיער קל.
- לשים את העכבר בתנוחה נוטה על תמיכה של פוליסטירן מכוסה נייר אלומיניום וחותכים את העור החל מאמצע longitudinally בגב ובכיוון של הרגליים.
- הסירו בזהירות את העור מבלי לגעת בשרירים ובגידים. . אפשר לקרוע את כל העור
- חותכים את שתי הרגליים של העכבר ולהמשיך במהירות עם הקרע.
הערה: אם הוא נוח יותר, ניתן להמשיך את הניתוח על העכבר כולו, אך העבודה על הרגל מאפשרת יותר ניידות ודיוק בחתכים המאוחרים יותר. - תקן את הרגל על התמיכה ברמה של כף הרגל באמצעות סיכה ולהתחיל בידוד שרירי השלד של העניין בסדר זה: TA, אדי, הגנקמיוס והסוליה.
- הרם את הגיד התחתון של TA עם פינצטה חדה בגובה הקרסול וחותכים אותו, ולאחר מכן חותכים עם מספריים עדינים בכל רחבי שריר TA לגיד אחרים ברמה של צלחית (איור 3a). . העבר לפתרון העיכול
- הרם את הגיד התחתון של אדי והפרד אותו משרירים אחרים על ידי המשך בעדינות למעלה עד לגיד האחר. חותכים ומניחים אותו לתוך פתרון העיכול.
הערה: מאחר שאדי עשוי להיות קטן מאוד לקיצוץ בנפרד מ-TA, ניתן לגזור אותם יחד (איור 3B). אז, אם השריר כולו הוא גדול מדי, לחתוך אותו 2-3 חתיכות החל גיד ובעקבות סיבים בכיוון האורך (איור 3C). - לסובב את הרגל מראה את השרירים האחורי ולתקן את הרגל באמצעות סיכה. הרימו את גיד האכילה , והוא נפרד באופן אוטומטי משרירים אחרים. הגיד העליון נמצא. בחלק האחורי של הפטלה חותכים אותו ומוסיפים את השריר לעיכול.
- הרם את גיד הרגל החיצוני (ביחס לגוף) וקבל את הסוליה. בעדינות להפריד אותו מן השרירים האחרים על ידי גלילה מתחת עם הטוויצר.
- עשה את אותו הדבר עבור הרגל השנייה (צעדים מ1.2.7 ל1.2.11.).
- שריר העיכול
- מודנת את פתרון העיכול המכיל את כל השרירים באמבט מים ב 37 ° c עבור כ 45-50 דקות. בזמן העיכול, בודקים בקביעות את השריר כדי להימנע מעיכול. כל 10 דקות להפוך את צינורות העיכול 10x עם תנועה אנרגטית (להימנע vortexing).
- להפסיק את העיכול כאשר השרירים מתחילים להשתחרר ומיוהים הסיבים גלויים.
- בסופו של דבר, זמן העיכול מטלטל את הדגימות.
- כדי לעצור את העיכול, להעביר בזהירות את השעיית העיכול לצלחת פטרי מראש 100 מ"מ עם 10 מ ל של פתרון כביסה.
הערה: הימנע השריר על העיכול כמו זה יהיה באופן בלתי נמנע לגרום לבידוד של סיבי hyper-התכווץ. בדרך כלל עם פרוטוקול זה, השרירים של עכברים homozygous מוטציה לקחת 45 דקות להיות מתעכל, בעוד השרירים של עכברים סוג פראי לקחת 50-55 דקות. זמן העיכול צריך להיות מאומת.
- סיבי בידוד
- ראשית לבודד את הסיבים כבר הנתק תחת מיקרוסקופ מבתר על ידי בחירת אותם בנפרד עם P200 מצופה הצינורות או חור קטן פסטר ולהעביר אותם 100 mm פטרי לתוך צלחת פטרי חדש 35 מ"מ עם 5 מ ל של פתרון כביסה מראש מחומם.
- כדי לשחרר עוד סיבים, פיפטה שריר למעלה ולמטה באמצעות חור גדול נשא פיפטה זכוכית עם בינוני חם, עד סיבים הם שוחרר מכנית. אל תהיה עקשן מדי כמו זה יגרום סיבים מזיקים.
- המשך לשחרר את הסיבים האלה מהשריר עד שהתבשיל מכיל כמות רצויה. אם צלחת פטרי נשמרת בטמפרטורת החדר עבור יותר מ 8 דקות, לעצור ולבצע מינימום של 5 דקות דגירה ב 37 ° c, 5% CO2 כדי לשחזר את המדיום.
- לפני שהעבירו את הסיבים היחידים למדיום התרבותי, השאירו אותם ב 37 ° c, 5% CO2 בצלחת לשטוף לפחות 1 h. זה מסייע לסיבים להסתגל למצב של מבחנה .
הערה: סיבים מיוניים רגישים פחות ללחץ וניתן לשטוף את ~ 2-3x. עם זאת, במצב זה (בגיל 19 ימים לאחר הלידה) עדיף לבצע רק אחד כביסה צעד כדי למנוע נזק מיוסיבי. לכן, תמיד לשים לב כדי לשמור על בחירה מיוסיבים מספיק נקי על ידי לא נושאת פסולת או סיבים היפרכווץ.
- תרבות אחת מיוסיבים
- העבר את הסיבים הבודדים לצלחת טרום-חמם חדשה עם מדיום התרבות המתאים (בינוני סרום גבוה כדי לאפשר הפעלה של תאי לווין, ראה איור 1).
- לשנות את המדיום לתוך סיבי מיוחים מבודדים, על ידי העברתו למנה מצופה חדשה עם מדיום התרבות החדשה, רק לאחר 48-72 h של התרבות כדי למנוע כל הלחץ שיוביל להפוך סיבים היפרציר והפרעה.
2. במטה יישומים: מיואוסיבים מרובי קישורים ומאימונולויונציה
הערה: תאי הלווין המשויכים לאלה עשויים להיות מוודעים על-ידי immunofluorescence בזמן העניין. מכיוון שמרבית הפרוטוקולים המתפרסמים ממוטבים לביצוע IF בסיבים מבוגרים, כאן פרוטוקול מפורט מוצג כדי לקבל תוצאות אמינות גם על סיבים מיוקיים מבודדים מפני השרירים שלאחר הלידה.
- מיוסיבים מרובי קישור
- לפני תחילת ההכנות, הכינו את כל הפתרונות הנחוצים כמתואר בטבלה 2.
- Precoat עיל עם HS כמו רבים 1.5 mL מיקרוצנטריפוגה צינורות כמו מספר דגימות. הקפד להסיר את כל HS לפני שתמשיך. כיוון שסיבים מקושרים קשים יותר מאלה החיים וקשים יותר לפיפטה, הקפידו להצליב את הקשר בנוגע לסיבים 200-300 בנפרד לכל צינור.
- תחת מיקרוסקופ מבתר, לאסוף את כל הסיבים שיכולים להיחשב בריאים, להעביר אותם שפופרת מיקרוצנטריפוגה ולהשאיר את הצינור אנכית עבור 5 דקות בתוך החממה כדי לאפשר סיבים להתיישב.
- הסר את הסופרנטנט לאט מאוד מהצינור.
- Crosslink סיבים על ידי הוספת 1 מ ל של 4% פאראפורמלדהיד (בתחתית) ב RT לצינור. עשה זאת בעדינות כדי למנוע מצוקה בסיבים.
- כדי למנוע התחברות של סיבים במהלך הקשר, לשמור את הצינור בעצבנות עדין מאוד עבור 10 דקות.
- שמור את הצינור בעמדה אנכית עבור 5 דקות ב-RT כדי לאפשר לסיבים להתיישב, ואז למחוק את הסופרנטאנט להבטיח להסיר את רוב נפח החצי החצי.
- הוסף 1 מ ל של פוספט מתכלה מתכלה (PBS) ולשמור את הצינורות אנכית עבור 5 דקות ב-RT כדי לתת את הסיבים למשקע.
- הסר את הסופרנטנט וחזור על הליך הכביסה (שלב 2.1.8.) שוב פעמיים.
- המשיכו לעקוב אחר דגימות מקושרות ב-4 ° c.
הערה: ניתן לשמור על הסיבים המקושרים ב -4 ° c במשך שבוע. אם הסיבים נותרים יותר משבוע במצב זה, הדבר יגרום באופן בלתי נמנע להיות מיוכן סיבים.
- אימונולווקורנציה
- שמור את הצינורות המכילים את הסיבים העומדים במצב RT עבור לפחות 5 דקות כדי לאפשר משקעי סיבים.
- הסר את הסופרנטאנט, משאיר רק אמצעי אחסון קטן כדי לוודא שלא תסיר סיבים.
- הוסף 1 mL של 0.5% טריטון X-100 ב PBS ו דגירה עבור 5 דקות עם עצבנות עדינה.
- לשים צינורות בתנוחה אנכית עבור 5 דקות, ולאחר מכן להסיר supernatant.
- הוסף 1.5 mL של PBS ו דגירה עם עצבנות עדינה עבור 5 דקות.
- לשמור על צינורות בתנוחה אנכית עבור 5 דקות, ולאחר מכן להסיר את supernatant.
- הוסף 1 מ ל של פתרון חסימה ו-מודטה עבור 1 h ב RT עם עצבנות עדינה.
- לשמור על צינורות 5 דקות במיקום אנכי, ולאחר מכן להסיר את supernatant.
- לדלל את הנוגדנים העיקריים בפתרון חסימה, להוסיף אותם לצינורות והדגירה מעל ללילה ב 4 ° צ' בעצבנות עדינה (עבור ריכוזי הציע לראות את הטבלה של חומרים).
הערה: לחלופין, את הנוגדן העיקרי ניתן מודבטים עבור 3 h ב RT. עם זאת, הדגירה לילה נתן כתמים אופטימליים. נפח הדגירה של הנוגדנים הן הראשי והמשני צריך להיות של 300 μL כאשר סיבי seמימדי להגיע לחריץ μL 100 של שפופרת מיקרוצנטריפוגה של 1.5 mL. כאשר סיבים הם פחות שופע, נפח של 100-200 μL מומלץ. - השאר את הצינורות בתנוחה אנכית עבור 5 דקות ולאחר מכן הסר את הסופרנטאנט.
- לבצע 3 שוטף 1 מ ל של 0.25% רצף-20 ב-PBS, הדגירה 5 דקות עצבנות עדין ולאחר מכן עוזב את הצינורות עומד 5 דקות בכל פעם.
הערה: מכאן והלאה, לבצע את כל השלבים בחושך, כדי למנוע fluorochromes הלבנת. - לדלל נוגדנים משניים בפתרון חסימה, להוסיף אותם לצינורות והדגירה עבור 1 h ב RT עם עצבנות עדינה (עבור ריכוזים לראות את הטבלה של חומרים).
- לשטוף פעמיים ב 1 מ ל של 0.1% רצף-20 ב-PBS, הדגירה עבור 5 דקות עם עצבנות עדינה ולאחר מכן לעזוב את הצינורות בתנוחה עמידה עבור 5 דקות.
- הסר את הסופרנטאנט, הוסף 1 מ ל של פתרון DAPI ו דגירה עבור 5 דקות עם עצבנות עדינה.
- תן את הצינורות לעמוד אנכית בתוך מתלה עבור 5 דקות, ולאחר מכן להסיר את הסופרנטאנט.
- לשטוף עם 1 mL של PBS, הדגירה עבור 5 דקות עם עצבנות עדין ולאחר מכן לעזוב את הצינורות לעמוד בארון למשך 5 דקות.
- הסר את הסופרנטאנט, והשאיר כמות של כ-50 μL.
- הרכבה של בעלי תווית בעלת תוויות בעזרת שקופיות מיקרוסקופ
- חותכים טיפ P200 מהצנרת ומעילים אותו בתמיסה חוסמת
הערה: כדי לחלוק את העצה, פיפטה את הפתרון למעלה ולמטה מספר פעמים לפני איסוף הסיבים, זה ימנע סיבים להיצמד לקיר קצה. - לאסוף את הסיבים מהצינור ולפזר אותם על שקופית זכוכית מיקרוסקופ.
- תחת מיקרוסקופ מבתר, תוך שימוש רק באור הטבעי המשתקף על-ידי המראה, השתמש בטיפ חדש (לא לחתוך) P200-מיכל הפיפטה כדי להפיץ את הסיבים ולהסיר את התמיסה הנוזלית העודפת.
- השאר את השקופיות לאוויר יבש בחשיכה במשך כ-10-15 דקות, עד שיישאר כמות נמוכה של פתרון.
- הוסף את מדיום ההרכבה על השקופית (הכמות הנכונה של בינונית הרכבה יש לכייל על הממד של coverslip: עבור שקופיות 24 x 40 מ"מ, 20 μL הוא מספיק) ולאחר מכן להניח לאט לשים זכוכית כיסוי על האזור המכיל את הסיבים. להיזהר לא ליצור בועות בין המשקפיים.
- לחץ על הכיסויים כך הסיבים יהיה לשכב על תוכנית אופקית אחת.
- תקן את הסרבל באמצעות לק.
- אחסן את הדגימות ב -4 ° צ' עד 4 שבועות.
- לרכוש את התמונות הרצויות של התווית המסומנים בעזרת פלואורוסקופים עם מיקרוסקופ קונפוקלית וקד.
- חותכים טיפ P200 מהצנרת ומעילים אותו בתמיסה חוסמת
תוצאות
אנחנו בדרך כלל לעכל ארבע שרירים שונים (TA, אדי, סוליה ו- גקטנמיוס) כדי לאחזר כמות טובה של סיבים ארוכים וקיימא שיכול לשרוד 96 h ב צמיחה-גורמי מדיום עשיר (איור 4א, ב). רק הסיבים השלמים ביותר צריכים להיות מועברים במדיום התרבותי, כפי שהם ישרדו; כל האחרים, כי קל להפלות ולבחור, צריך להיות מושלך.
כאשר מיוכו סיבים נשמרים בצמיחה-גורמים עשירים לווין תאים בינוניים נגזר עכברים סוג פראי להתחיל להפעיל מתרבים, ראה איור 1. על 48 h של תרבות, במצב בריא (Lamin δ 8-11 +/+), תאי לווין Upregulate myod ולעבור החטיבה הראשונה שלהם. מופעל Pax7 +/myod + תאים לווין מכן מתרבים ובאמצעות 72 h בתרבות, הם יוצרים אגרגטים תאים הקשורים ליוסיבי, כי הם אפילו יותר גלויים ב 96 h (איור 5). במהלך חטיבות אלה, חלק מהם יכולים לדכא ביטוי MyoD, שעובר התחדשות עצמית כדי לאכלס את בריכת תאי הגזע, בעוד אלה לשמר MyoD להיות מחויב לבידול על ידי להוריד ביטוי Pax7. לאחר 96 h, האשכולות תאים לווין מכילים בבירור מיוג + תאים מחויבים, כי יכול להבדיל לסיבים חדשים (איור 1 ואיור 6). בעיקר, עם ניסוי זה, תיארנו דינמיקה מושהית של בידול תא לווין ב homozygous מוטציה Lamin δ 8-11 עכברים (-/-) לעומת עמיתיהם סוג פראי שלהם (+/+), ראה איור 6.
התוצאה הסופית של כל ניסוי בודד לתת לנו לחשוב כי הפרוטוקול שפותחה עבור בידוד בודד סיבים ותרבות מן המודל הזה של ניוון שרירים חמורה מבטיח באיכות טובה מיוסיבי עבור כל היישומים הנוספים.
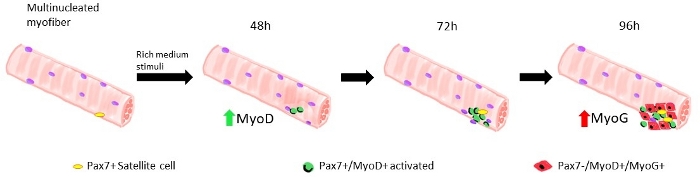
איור 1: ייצוג גרפי של שלבי ההתחדשות של תאי הלווין הדגם בסיבי מיוים צפים. על 48 h של התרבות הצמיחה-גורמי בינוני עשיר, Pax7 + תאים לקבל מופעל ולעבור את החטיבה הראשונה, המעניקה לשחרר את Pax7 +/myod + תאים. התאים החיוביים MyoD לאחר מכן להתרבות ולהרחיב, הנתינה, ב 72 h של התרבות, לאשכול של כמה תאים שהם צאצאים של תא לווין יחיד. על 96 h של תרבות Pax7 +/myod + תאים להיות מבדילים Pax7-/myog + תאים. במהלך שלב ההרחבה, קבוצת משנה של Pax7 +/MyoD + תאים להוריד את הביטוי MyoD העובר חידוש עצמי לתוך שקט. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: הכנת מנשא פסטר. (א) האורך והראייה הפרונטלית של איך החור הגדול נשא את הפיפטה חייב להופיע. (ב) האורך והראייה הפרונטלית של איך החור הקטן נשא את הפיפטה חייב להופיע לבסוף. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
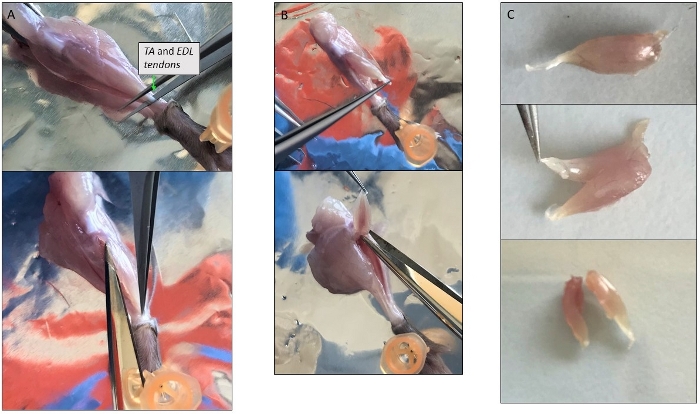
איור 3: תמונות מייצגות של ניתוח שריר יחיד. (א) בידוד של שריר ת א. הימנעות הסרת שכבה דקה המכסה את השריר מגן על סיבי מיואים בתוך. (ב) TA ו אדי שרירים מבודדים יחד עדיין מחוברים גיד העליון שלהם ברמה של patella. (ג) החטיבה של TA ו אדי לאחר בידוד על ידי חיתוך אותם לאורך ציר האורך. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
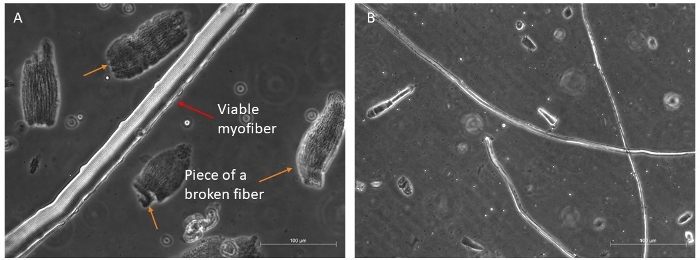
איור 4: דוגמאות לסיבים בריאים ובעלי קיימא. בניגוד לשלב מייצגים תמונות החדות של סיבי מיוכן בהשעיה. (א) החץ האדום מציין מיוסיבי עם ארגון סרקומר גלוי ותא לווין בצד שלו; החיצים הכתומים מציינים כמה פיסות של סיבי מיויולים שבורים, וחלק מהשרידים נמצאים במנה הראשונה לפני הבחירה הסופית לתרבות. סרגל בקנה מידה 100 μm. (ב) תצוגה מלאה יותר של סיבים מיואחרים בהגדלה קטנה יותר. סרגל קנה מידה 500 μm. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
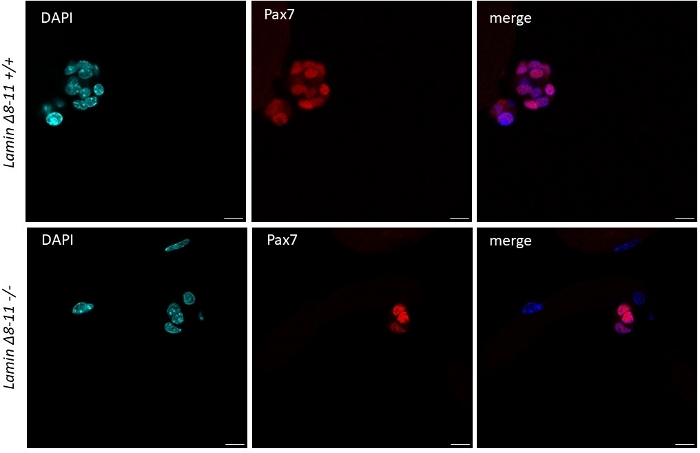
איור 5: ההבדל בממד של אשכולות תא גזע ב wt ועכברים מוטציה. Immunofluorescence כתמים של סיבים מיומים שחולצו מ 19 ימים Lamin δ 8-11 עכברים (+/+ ו-/-) לאחר 96 h של התרבות. Pax7 + תאי לווין מוצגים. הממד של אשכול התא ברוב המקרים היה גדול באופן משמעותי ב Lamin δ 8-11 +/+ מאשר ב lamin δ 8-11-/- במונחים של מספר תאים. סרגל בקנה מידה 10 μm. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
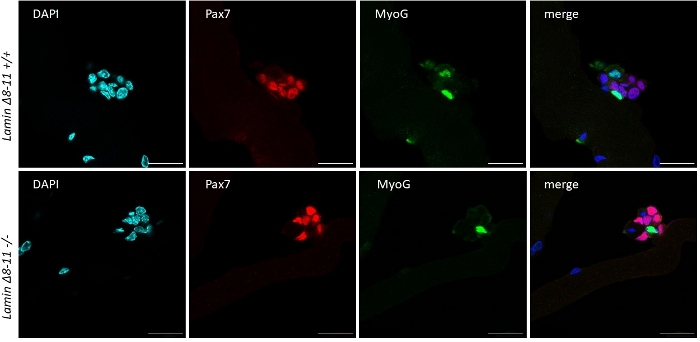
איור 6: ניסוי מוטארנציה מייצג. הניסוי של immunofluorescence לאחר 96 h של התרבות, על סיבים מיומים שחולצו מ 19 ימים Lamin δ 8-11 עכברים (+/+ ו-/-). Pax7 +/Myog-(אדום) ו Pax7-/myog + (ירוק) תאים נצפו. תמונות שהתקבלו עם מיקרוסקופ קונפוקלית וקד. סרגל בקנה מידה 25 μm. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| שם הפתרון בטקסט | רכיב | אחוז | אמצעי אחסון/דגימה סופיים שהוצעו | ערות | |
| פתרון כביסה | מיכל גלוקוז גבוה | 90% | 4 מ ל | המשיכו להיות עקרים, שמרו על 4 ° c עד השימוש. | |
| סרום לסוסים (HS) | 10 | ||||
| פתרון העיכול | מיכל גלוקוז גבוה | 9.80% | 20 מ ל | . אבקה מזיקה מאוד סנן פתרון עם מסנן 0.22 μm ולאחר מכן לשמור עקר. שמור על 4 ° צ' עד השימוש | |
| קולאגנאז אני | 0.20% | ||||
| מדיום לתרבות | מיכל גלוקוז גבוה | 78% | 10 מ ל | המשיכו להיות עקרים, שמרו על 4 ° c עד השימוש. | |
| סרום לשור עוברי (FBS) | 20 | ||||
| מחלץ עוף (CEE) | 1 | ||||
| פניצילין-סטרפטומיצין (P/S) | 1 | ||||
טבלה 1: מתכונים לפתרונות המשמשים בסעיף 1.
| שם הפתרון בטקסט | רכיב | אחוז | אמצעי אחסון/דגימה סופיים שהוצעו | ערות | |
| 4% בכיוון ההוא | פאראפורמלדהיד | 4 | 2-3 מ ל | אבקה ופתרון מזיקים מאוד | |
| PBS | 96% | ||||
| 0.5% טריטון X-100 | טריטון X-100 | 0.50% | 2-3 מ ל | טריטון X-100 הוא צמיגי מאוד, מעדיפים לחתוך את קצה הפיפטה כדי להגיע לכאן | |
| PBS | 99.50% | ||||
| 0.25% יצירת רצף-20 | יצירת רצף-20 | 0.25% | 10 מ ל | רצף 20 הוא צמיגי מאוד, מעדיפים לחתוך את הקצה של הפיפטה כדי לגזור אותו | |
| PBS | 99.75% | ||||
| 0.1% יצירת רצף-20 | יצירת רצף-20 | 0.10% | 10 מ ל | רצף 20 הוא צמיגי מאוד, מעדיפים לחתוך את הקצה של הפיפטה כדי לגזור אותו | |
| PBS | 99.90% | ||||
| חסימת פתרון | סרום לשור עוברי (FBS) | 10 | 10 מ ל | הכינו את התמיסה הטרייה והחנות ב -4 ° c במשך יותר מ -3 שבועות (בדקו תמיד לפני השימוש) | |
| PBS | 90% | ||||
| דאפי | דאפי | 0.10% | 2-3 מ ל | שמור בחושך | |
| PBS | 99.90% | ||||
טבלה 2: מתכונים לפתרונות המשמשים בסעיף 2.
Discussion
בידוד של סיבים מיותמים בודד היא שיטה חיונית בתחום של מיוגנזה כאשר המטרה העיקרית היא לאפיין את יכולות הרגנרציה של תאים בתאי גזע שרירים בתוך הנישה שלהם, בתנאים בריאים ופתולוגיים. עם זאת, כאשר מחקרים ביוכימיים או גנומית הם עניין, תאי לווין מבודדים FACS עשוי להיות האופציה הטובה ביותר.
בידוד מיואיים יחיד מאפשר לעקוב לשעבר vivo, אבל בדרך הפיזיולוגית ביותר, את הדינמיקה של כל השלבים תאים לווין לעבור במהלך התחדשות שרירים, כי הם: הפעלה, תא החטיבה (אסימטרי ו סימטרי), בידול ולחזור לשקט על ידי התחדשות עצמית. ברגע שהסיבים האלה גדלים בתנאים צפים, תאי הלווין היחידים מפעילים ומתרחבים ויוצרים מקבץ של תאים, כולם הנובעים מתא לווין זהה. ניתוח אימונוoforסנס להפצה, בידול, הפעלה או שטדיות סמנים הוא לאחר מכן אופטימלי כדי לכמת את הפרופורציה בין שלבי התאים.
הצעד העיקרי בפרוטוקול שלנו כדי להשיג סיבים קיימא ושלמים יכול להיחשב ניתוח שרירים מהירה אך עדין, על ידי בידוד גיד אל גיד, כדי למנוע נזק שרירים. העצה שלנו היא להשתמש רק מספריים חדים מלקחיים חדים קטנים להגביל את כל ההליך לניתוח שרירים לעשר דקות. כאשר קשה לבודד שרירים קטנים מאוד (כלומר, אדי ו-TA), אפשר לחתוך אותם יחד ומאוחר יותר לחלק אותם באמצעות מספריים עדינים חיתוך לאורך תוכנית האורך בעקבות הסיבים. אסטרטגיה זו תעניק בסופו של דבר פחות סיבים מיותמים, אך הכדאיות לא תהיה בסכנה. את אותו הדבר יש לבצע על שרירים גדולים כמו גקטמיוס כדי להקל על העיכול. אופטימיזציה של זמן העיכול, אשר צריך להיות מאומת בצורה מדעית, ומניפולציה מינימלית של סיבים מבודדים הם גם שני היבטים קריטיים עבור התוצאה החיובית של ניתוח עוקבות.
היתרון של הפרוטוקול המדווח כאן הוא שניתן למרוח על עכברים קטנים מאוד (בגיל ובמימד), גם כאשר השרירים שלהם מאוד שבירים. גם אם לא מוזכר לעיל, ניתן לבצע את הפרוטוקול הזה של הניתוח כדי לאחר מכן התרבות מיותסיבים לתקופה ארוכה יותר באמצעות מרתף מצופה ממברנה מנות18,19. חשוב לשקול כי מצב זה הוא שונה לחלוטין ממצב צף, שבו גירויים הדבקה וגירויים קרבה נעדרים.
Disclosures
. בלי אינטרסים מתחרים
Acknowledgements
אנו מודים לאנדריאה ביאנצ, לרשת האיטלקית של Laminopathies ולחברי המעבדה לתמיכה ולכל ההערות הקונסטרוקטיביות. אנו אסירי תודה על קיארה cordiglieri עבור עזרה יקר במיקרוסקופ קונפוקלית וקד. המחברים מודים לד ר ביאטריס ביפראלי על עזרתה בצילום תמונות לאיורים. העבודה שהוצגה כאן נתמכת על-ידי המענק הראשון שלי בחיל האוויר הקיסרי נ. 18535, AFM-שידור נ. 21030, שר הבריאות האיטלקי נ. GR-2013-02355413 וקאריפלו 2017-0649 C.L. C.M. נתמך על ידי המענק שלי AIRC הראשון n. 18993 ו-AFM-ש22489 ידור לשנת.
Materials
| Name | Company | Catalog Number | Comments |
| 4′,6-diamidino-2-phenylindole | Sigma | D9542 | |
| Chicken embryo extract | Seralab | CE650-DL | |
| Collagenase type I | SIGMA | C0130-500MG | |
| Donkey anti-Rabbit 488 antibody | Thermofisher | R37118 | to be used 1:200 |
| Dulbecco's modified Eagle's medium | Gibco | 10569-010 | |
| Fetal bovine serum | Corning | 35-015-CV | |
| Horse serum | Gibco | 26050-088 | |
| MyoG antibody | Millipore | 219998 | to be used 1:100 |
| Paraformaldehyde | SIGMA | P6148 | |
| Pax7 antibody | Developmental studies Hybridoma bank | to be used 1:20 | |
| Penicillin and Streptomycin | Euroclone | ECB3001D | |
| Phosphate saline buffer | Euroclone | ECB4004L | |
| Prolong gold antifade mountant | Thermofisher | P36930 | |
| Triton X-100 | SIGMA | T8787 | |
| Tween-20 | SIGMA | P1379 | |
| Lab equipment | Manufacturer | ||
| Bunsen burner | |||
| Confocal microscope | Leica | ||
| Diamond pen | bio-optica | ||
| Dissection pins | |||
| FACS polypropylene tubes | Falcon | ||
| Falcon tubes (50 and 15 mL) | Falcon | ||
| Glass coverslips | Thermofisher | ||
| Glass Pasteur pipettes (22cm) | VWR | ||
| Glass slides | Thermofisher | ||
| Micro dissecting scissors | |||
| Micropipette (1 mL and 200 µL) | Gilson | ||
| Micropipette tips | Corning | ||
| Petri dishes (100 and 35 mm diameter) | Thermofisher | ||
| Plastic pipettes (5 and 10 mL) | VWR | ||
| Rubber pipette bulbs | VWR | ||
| Sharp tweezers | |||
| Stereo dissection microscope with transmission illumination | Leica | ||
| Tissue culture hood or lamina flow cabinet | |||
| Tissue culture incubator (humidified, 37°C, 5% CO2) | |||
| Water bath at 37°C | VWR |
References
- Wang, Y. X., Dumont, N. A., Rudnicki, M. A. Muscle stem cells at a glance. Journal of Cell Science. 127 (21), 4543-4548 (2014).
- Le Grand, F., Rudnicki, M. A. Skeletal muscle satellite cells and adult myogenesis. Current Opinion in Cell Biology. 19 (6), 628-633 (2007).
- Zammit, P. S., Partridge, T. A., Yablonka-Reuveni, Z. The Skeletal Muscle Satellite Cell: The Stem Cell That Came in From the Cold. Journal of Histochemistry & Cytochemistry. 54 (11), 1177-1191 (2006).
- Franco, I., et al. Somatic mutagenesis in satellite cells associates with human skeletal muscle aging. Nature Communications. 9 (1), 800 (2018).
- Cosgrove, B. D., et al. Rejuvenation of the muscle stem cell population restores strength to injured aged muscles. Nature Medicine. 20 (3), 255-264 (2014).
- Bernet, J. D., et al. p38 MAPK signaling underlies a cell-autonomous loss of stem cell self-renewal in aged skeletal muscle. Nature Medicine. 20 (3), 265-271 (2014).
- Bianchi, A., et al. Dysfunctional polycomb transcriptional repression contributes to lamin A/C-dependent muscular dystrophy. Journal of Clinical Investigation. 130 (5), 2408-2421 (2020).
- Blau, H. M., Webster, C., Pavlath, G. K. Defective myoblasts identified in Duchenne muscular dystrophy. Proceedings of the National Academy of Sciences. 80 (15), 4856-4860 (1983).
- Jiang, C., et al. Notch signaling deficiency underlies age-dependent depletion of satellite cells in muscular dystrophy. Disease Models & Mechanisms. 7 (8), 997-1004 (2014).
- Vallejo, D., et al. PITX2 Enhances the Regenerative Potential of Dystrophic Skeletal Muscle Stem Cells. Stem Cell Reports. 10 (4), 1398-1411 (2018).
- Danoviz, M. E., Yablonka-Reuveni, Z. Skeletal Muscle Satellite Cells: Background and Methods for Isolation and Analysis in a Primary Culture System. Methods in Molecular Biology. (798), 21-52 (2012).
- Sacco, A., Doyonnas, R., Kraft, P., Vitorovic, S., Blau, H. M. Self-renewal and expansion of single transplanted muscle stem cells. Nature. 456 (7221), 502-506 (2008).
- Bischoff, R. Proliferation of muscle satellite cells on intact myofibers in culture. Developmental Biology. 115 (1), 129-139 (1986).
- Rosenblatt, J. D., Lunt, A. I., Parry, D. J., Partridge, T. A. Culturing satellite cells from living single muscle fiber explants. In Vitro Cellular & Developmental Biology - Animal. 31 (10), 773-779 (1995).
- Shefer, G., Yablonka-Reuveni, Z. Isolation and Culture of Skeletal Muscle Myofibers as a Means to Analyze Satellite Cells. Methods in Molecular Biology. (290), 281-304 (2005).
- Anderson, J. E., Wozniak, A. C., Mizunoya, W. Single Muscle-Fiber Isolation and Culture for Cellular, Molecular, Pharmacological, and Evolutionary Studies. Methods in Molecular Biology. 798, 85-102 (2012).
- Verma, M., Asakura, A. Efficient Single Muscle Fiber Isolation from Alcohol-Fixed Adult Muscle following β-Galactosidase Staining for Satellite Cell Detection. Journal of Histochemistry & Cytochemistry. 59 (1), 60-67 (2011).
- Keire, P., Shearer, A., Shefer, G., Yablonka-Reuveni, Z. Isolation and Culture of Skeletal Muscle Myofibers as a Means to Analyze Satellite Cells. Methods in Molecular Biology. 946 (206), 431-468 (2013).
- Pasut, A., Jones, A. E., Rudnicki, M. A. Isolation and Culture of Individual Myofibers and their Satellite Cells from Adult Skeletal Muscle. Journal of Visualized Experiments. (73), e50074 (2013).
- Gallot, Y., Hindi, S., Mann, A., Kumar, A. Isolation, Culture, and Staining of Single Myofibers. Bio-Protocol. 6 (19), 1942 (2016).
- Liu, L., Cheung, T. H., Charville, G. W., Rando, T. A. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting. Nature Protocols. 10 (10), 1612-1624 (2015).
- Machado, L., et al. In Situ Fixation Redefines Quiescence and Early Activation of Skeletal Muscle Stem Cells. Cell Reports. 21 (7), 1982-1993 (2017).
- Lucini, F., Bianchi, A., Lanzuolo, C. Formaldehyde-mediated snapshot of nuclear architecture. Methods in Molecular Biology. , (2020).
- Sullivan, T., et al. Loss of a-Type Lamin Expression Compromises Nuclear Envelope Integrity Leading to Muscular Dystrophy. The Journal of Cell Biology. 147 (5), 913-920 (1999).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved