Method Article
Erken Doğum Sonrası Gelişimde Emery-Dreifuss Musküler Distrofi'nin Murine Modelinden Tek Miyofiber İzolasyon ve Kültür
Bu Makalede
Özet
Burada, homozigot mutant Lamin Δ8-11 fare modeli, Emery-Dreifuss kas distrofisi (EDMD) için çok ciddi bir model erken doğum sonrası gelişim aşamalarında verimli bir şekilde tek kas lifleri elde etmek için bir yöntem öneriyoruz.
Özet
Otozomal dominant Emery-Dreifuss musküler distrofi (EDMD), LmNA genindeki mutasyonlardan kaynaklanır, bu mutasyonlar A-tipi nükleer laminleri, nükleer zarfı ve nükleoplazm bileşenlerini sürdüren ara filament proteinlerini kodlar. Yakın zamanda EDMD'de kas israfı kas (uydu) kök hücre rejeneratif kapasitesini etkileyen içsel epigenetik disfonksiyonlar atfedilebilir bildirdi. Tek miyofiberlerin izolasyonu ve kültürü, lif ve sarkoli çevreleyen bazal lamina arasında kalırken, kendi nişi içindeki uydu hücrelerinin davranışını izlemek için en fizyolojik ex-vivo yaklaşımlardan biridir. Bu nedenle, çeşitli murine modellerinden uydu hücrelerini incelemek için paha biçilmez bir deneysel paradigmayı temsil eder. Burada, doğum sonrası arka bacak kaslarından(Tibialis Anterior, Ekstansör Digitorum Longus, Gastroknemius ve Soleus)sağlam ve canlı tek miyofiberleri izole etmek için yeniden uyarlanmış bir yöntemi tanımlıyoruz. Bu protokolü takiben, doğumdan sadece 19 gün sonra, ciddi bir EDMD murine modeli olan Lamin Δ8-11 -/- farelerden gelen uydu hücrelerini inceleyebildik.
İzolasyon prosedürünün yanı sıra iyi miktarda miyofiber elde etmek için kültür koşullarını ve bunların uydu hücrelerinden elde edilen soyundan gelen leri ayrıntılarıyla anlatıyoruz. Büyüme faktörleri açısından zengin bir ortamda kültürlendiğinde, vahşi tip farelerden elde edilen uydu hücreleri etkinleştirilir, çoğalır ve sonunda kendi kendini yenilemek veya farklılaşmaya uğrar. Homozigot Lamin Δ8-11 -/- mutant farelerde bu yetenekler ciddi şekilde bozulur.
Bu teknik, kesinlikle takip edilirse, erken doğum sonrası gelişim aşamalarında ve kırılgan kaslarda bile miyofiber ilişkili uydu hücresine bağlı tüm süreçleri incelemek için izin verir.
Giriş
İskelet kası egzersiz veya travma1sonra yeniden en genişletilmiş yeteneği ile farklılaşmış bir dokudur. Bu özellik esas olarak bazal lamina ve miyofiberplazmalemmaarasındaki periferik konumu nedeniyle uydu hücreleri olarak adlandırılan kök hücrelerin varlığı nedeniyle 2 . Doğum sonrası gelişim sırasında uydu hücreleri çoğalır ve giderek farklılaşır, böylece iskelet kası büyümesine katkıda bulunur. Bir kez yetişkinlikte, uydu hücreleri geri dönüşümlü quiescent durumuna girmek, ve fizyolojik veya patolojik travma üzerine, onlar etkinleştirmek, çoğalır ve hasarlıkaslarıonarmak için ayırt 3 . Uydu hücrelerinin kapasitesindeki kusurları düzgün bu farklı rejeneratif aşamaları ile transit ve kendini yenileme geçmesi sıkıca kas israfı ile bağlantılı olmuştur, fizyolojik yaşlanma sırasında4,5,6 veya kas dejeneratif hastalıklarda, kas distrofiler gibi7,8,9,10.
İki ana kültür yaklaşımı uydu hücreleri ex-vivo çalışma var: mononükleli hücrelerden birincil miyojenik kültürler, mekanik ve kimyasal olarak bütün kas11,,12; veya izole miyofibers kültür13,14,15,16,17,18,,19,20. İlk durumda, uydu hücreleri izolasyon süreci fare, bir kimyasal sindirim, filtrasyon ve floresan aktif hücre sıralama (FACS)21çıkarılan bütün kasların trituration içerir. Bu prosedür, çeşitli modellerden uydu hücrelerini izole etkili olmasına rağmen, strese uydu hücreleri maruz ve fizyolojik niş bozan çeşitli değişkenler gerektirir22,23. Buna karşılık, miyofiber izolasyon matris aşağılayıcı enzimler ve kök hücrelere azaltılmış travma neden olan mekanik bir parçalama ile kas dokusunun daha nazik bir sindirim içerir20. Bu ikinci yaklaşım, fiziksel bazal lamina ve sarkolemma arasında miyofiyon bağlı kalır canlı uydu hücrelerinin çok daha verimli bir şekilde elde sağlar, böylece fizyolojik niş içinde analiz sağlayan19,20.
İskelet kaslarından tek miyofiberleri düzgün ve verimli bir şekilde izole etmek için son yıllarda birçok farklı protokol önerilmiştir. Zaten 1986 Yılında Bischoff Flexor Digitorum Brevis13 lifleri izole etmek için bir protokol önerdi13 ve daha sonra, içinde 1995, Rosenblatt ve ark. miyofibers daha verimli bir ayrım elde etmek için protokolü modifiye14. O zamandan beri, diğer birçok yazar extensor Digitorum Longus (EDL) ve Tibialis Anterior (TA)15,16, 17,,,,18,19,20gibi diğer kaslar üzerinde ayarlanmış prosedürler önerdi, daha kırılgan olsa bile, kaslar1814. İzole miyofiberler daha sonra hem yapışma da, uydu hücrelerinden elde edilen miyoblastların genişlemesine izin vermek için, ya da yüzen koşullarda, 96 saate kadar, tek uydu hücrelerinden elde edilen soyundan gelen leri takip etmek için yetiştirilebilir19 (Şekil 1). Kültür ortamı içinde serum değişken konsantrasyonları uydu hücrelerinin aktivasyon, çoğalma ve / veya farklılaşma tetiklemek için kullanılır, düzgün bu farklı aşamaları 1 ile transit kapasitelerini incelemek için1.
Yakın zamanda EDMD, Lamin Δ8-11 -/- fare7fare modelinde uydu kök hücre havuzunun tükenmesinin arkasındaki epigenetik mekanizmayı tanımladık. Bu fareler genellikle24yaş arasında 4-8 hafta arasında ölmek bu yana , şiddetli kas kaybı nedeniyle, bir girişim post-natal kas gelişimi bizim analiz odaklanarak hastalığın erken başlangıcı altında yatan moleküler kusurları yakalamak için yapıldı. Yüzen tek miyofiberler izole edildi ve yabani tip ve Lamin Δ8-11 -/- mutant7 19 günlük fareler kültürlü. Bu aşamada, kas kusurları zaten belirgindir, ama fareler hala uygulanabilir. Ancak, tek miyofiber çıkarma için yukarıda belirtilen tüm protokoller yetişkin farelerin iskelet kasları için optimize edilmiş olduğundan, onları amaçlarımıza uyarlamak gerekiyordu: yaş ve boyut açısından çok küçük fareler ve çok kırılgan miyofiberler. Böylece, burada Rudnicki laboratuvarı19 tarafından önerilen protokolün yeniden uyarlamızır, doğum sonrası gelişim sırasında farelerden ve Lamin Δ8-11 -/- farelerden türetilenler gibi şiddetli distrofik kaslardan önemli sayıda tek canlı miyofiber elde etmek için açıklıyoruz.24 Bu yaklaşımın nihai amacı, doğum sonrası gelişimin erken aşamalarında ilgi olduğunda veya miyofiberleri mekanik strese karşı daha duyarlı hale getiren herhangi bir özel hastalığı taşıyan fare modellerinde miyofiberlerle ilişkili kas kök hücrelerinin başka bir fare modelinde incelenmesi için standart bir prosedür sağlamaktır.
Protokol
Tüm deneysel işlemler İtalya Sağlık Bakanlığı ve Kurumsal Hayvan Bakım ve Kullanım Komitesi'nin (yetki n. 83/2019-PR) etik onayı ile gerçekleştirilmiştir. Hayvanlar San Raffaele Hastanesi, Milano, İtalya'da yetkili bir tesiste muhafaza edildi (yetki n. N. 127/2012-A).
1. Kas diseksiyonu ve miyofiber kültürü
- Ekipman hazırlığı.
- Başlamadan önce, Tablo 1'deaçıklandığı gibi gerekli tüm çözümleri hazırlayın. Bu çözümlerin taze olarak hazırlanması gerekir.
- İşlem sırasında kullanılacak tüm yüzeyleri ve araçları %70 etanol ile temizleyin.
- Fare kurban ile başlamadan önce, At Serumu (HS) kullanarak 100 mm ve 35 mm Petri çanak kaplama sıcalayın. Miyofiberlerin plastiğe bağlanmasını önlemek için tüm tabakları kaplar. Fare başına bir adet 100 mm çanak ve dört adet 35 mm çanak kullanmayı düşünün.
- HS fazlalığı giderildikten sonra, kaplanmış yemekleri 37 °C'de 30 dakika boyunca bir kuvözde saklayın. Daha sonra yıkama çözeltisi veya kültür ortamı (fare başına iki adet 35 mm tabak) ile doldurun.
NOT: Alternatif olarak, Dulbecco'nun modifiye Kartal ortamında (DMEM) %10 HS'lik bir çözelti, yemekleri kaplamak için kullanılabilir. Her zaman kaplamalı yemekler kullanın. Farklı büyüklükte kültür yemekleri kullanmak mümkündür, ancak küçük boyutlu Petri yemekleri önerilir. - Lif izolasyonu için Şekil 2'degösterildiği gibi steril Pasteur pipetleri hazırlayın. Her fare için kas işleme ve mekanik ayrışma için bir büyük delik delik li pipet hazırlamak(Şekil 2A) ve lifler seçimi için küçük bir delik pipet(Şekil 2B). Her cam pipet, muhtemelen bir elmas kalem kullanarak, istenilen uzunlukta ve pürüzsüz pipet kenarları bir alev kesin.
- Kullanmadan önce her pipeti HS ile kısa bir süre ıslatarak kaplar.
- Fare kurban ve kas diseksiyonu
- Diseksiyon işlemine başlamadan önce 10 dk oda sıcaklığında sindirim çözeltisini ısıtın. Polipropilen FACS yuvarlak alt tüpler amaç için en uygun kaplardır.
- Kas alımı başlamadan hemen önce, uygun ulusal IACUC önerisine göre fare kurban.
- Saç ların çıkarılmasını kolaylaştırmak için cildi kesmeden önce alt vücudunu %70 etanol ile ısla.
- Fareyi alüminyum kağıtla kaplı polistiren desteğine yatkın bir konuma getirin ve arka nın ortasından başlayarak ve bacakların yönünde deri kesin.
- Kas ve tendonlara dokunmadan deriyi dikkatlice çıkarın. Tüm deriyi koparmak mümkündür.
- Farenin iki bacağını kesin ve hızla diseksiyon ile devam edin.
NOT: Daha rahat sayılsa, tüm fareüzerinde diseksiyona devam etmek mümkündür ancak bacak üzerinde çalışmak daha sonraki kesimlerde daha fazla hareketlilik ve hassasiyet sağlar. - Bir pin kullanarak ayak düzeyinde destek bacak düzeltmek ve bu sırada ilgi iskelet kasları izole başlar: TA, EDL, Gastrocnemius ve Soleus.
- Ayak bileği yüksekliğinde keskin bir cıvık ile TA alt tendon kaldırın ve kesti, sonra patella düzeyinde diğer tendon için TA kas etrafında ince makas ile kesti(Şekil 3A). Sindirim çözeltisine aktarın.
- EDL'nin alt tendonunu kaldırın ve diğer tendona doğru yavaşça yukarı çekerek diğer kaslardan ayırın. Kesip sindirim çözeltisine yerleştirin.
NOT: EDL TA'dan ayrı kesilecek kadar küçük olabileceğinden birlikte kesilebilirler (Şekil 3B). Daha sonra, tüm kas çok büyük ise, tendondan başlayarak ve uzunlamasına yönde lifleri takip 2-3 adet kesip (Şekil 3C). - Arka kasları gösteren bacak döndürün ve pin kullanarak ayak düzeltmek. Aşil tendonu kaldırın, Gastrocnemius otomatik olarak diğer kaslardan ayrı olacaktır. Üst tendon patellanın arka kısmında. Kesin ve sindirim için kas ekleyin.
- Bacağın dış tendonunu kaldırın (vücuda göre) ve Soleus'u elde edin. Yavaşça cızırtıcı ile altında kaydırarak diğer kaslardan ayırın.
- Aynı şeyi diğer bacak için de yapın (1.2.7.'den 1.2.11'e kadar.).
- Kas sindirimi
- 37 °C'de bir su banyosunda tüm kasları içeren sindirim çözeltisini yaklaşık 45-50 dk kuluçkaya yatırın. Sindirim süresi boyunca, düzenli olarak aşırı sindirim önlemek için kas kontrol edin. Her 10 dk enerjik bir hareket ile sindirim tüpleri 10x ters (girdap kaçının).
- Kaslar gevşemeye başladığında ve miyolifler gözle görülürken sindirimi durdurun.
- Sindirim süresinin sonunda örnekleri sallayın.
- Sindirimi durdurmak için, 10 mL yıkama çözeltisi ile önceden ısıtılmış 100 mm Petri kabına dikkatlice sindirim süspansiyonu aktarın.
NOT: Bu kaçınılmaz hiper sözleşmeli miyofiberlerin izolasyon neden olacak gibi kas aşırı sindirim kaçının. Genellikle bu protokol ile homozigot mutant farelerin kasları sindirilir 45 dakika sürer, yabani tip farelerin kasları ise 50-55 dk. Sindirim süresi deneysel olarak doğrulanması gerekir.
- Tek miyofiber izolasyon
- First isolate the fibers already dissociated under a dissecting microscope by picking them individually with a coated P200 pipette or small hole Pasteur and transfer them from the 100 mm Petri into a new 35 mm Petri dish with 5 mL of pre-warmed washing solution.
- Daha fazla miyofibers serbest bırakmak için, pipet yukarı ve aşağı sıcak orta ile büyük bir delik delik cam pipet kullanarak kas, lifler mekanik serbest bırakılana kadar. Bu zararlı liflere neden olacak gibi çok kalıcı olmayın.
- Çanak istenilen miktarda içerene kadar kas gelen miyofibers serbest devam edin. Petri kabı 8 dakikadan fazla oda sıcaklığında tutulursa, ortamı yeniden dengelemek için en az 37 °C'de en az 5 dk kuluçka, %5 CO2 yapın.
- Tek miyofiberleri kültür ortamına aktarmadan önce, 37 °C,% 5 CO2 yıkama kabına en az 1 saat bekletin. Bu miyofiberler in vitro durumuna ayarlamak için yardımcı olur.
NOT: Erişkin miyofiberler strese karşı daha az hassastır ve ~ 2-3x yıkanabilir. Ancak, bu durumda (doğum sonrası 19 gün yaşında) miyofifiber hasarı önlemek için sadece bir yıkama adımı gerçekleştirmek daha iyidir. Bu nedenle, her zaman enkaz veya hipercontracted lifler taşımayarak yeterince temiz seçilen miyofiberler tutmaya dikkat edin.
- Tek miyofiber kültür
- Bireysel miyofiberleri uygun kültür ortamıyla önceden ısıtılmış yeni bir çanağa aktarın (uydu hücrelerinin aktivasyonuna izin vermek için yüksek serum ortamı, bkz. Şekil 1).
- Miyofiberler hiperkontraksiyon ve bozulmaya yol açacak herhangi bir stresönlemek için kültür 48-72 h sonra, yeni bir kültür ortamı ile yeni bir kaplama çanak aktararak, izole miyofiberler için orta değiştirin.
2. Downstream uygulamaları: Miyofiberler crosslinking ve immünofloresan
NOT: Miyofiberlerle ilişkili uydu hücreleri, ilgi sırasında immünoresans (IF) ile görüntülenebilir. Yayınlanan protokollerin çoğu yetişkin miyofiberler üzerinde IF gerçekleştirmek için optimize olduğundan, burada ayrıntılı bir protokol de post-natal kaslardan izole miyolifler üzerinde güvenilir sonuçlar elde etmek için sunulmaktadır.
- Miyofiber çapraz bağlama
- Başlamadan önce, Tablo 2'deaçıklandığı gibi gerekli tüm çözümleri hazırlayın.
- HS'li precoat, numune sayısı kadar 1,5 mL mikrosantrifüj tüp. Devam etmeden önce tüm HS kaldırmak için emin olun. Crosslinked lifler yaşayan olanlardan daha sert ve pipet daha zor olduğundan, tüp başına ayrı ayrı 200-300 lifleri hakkında crosslink emin olun.
- Bir diseksiyon mikroskop altında, sağlıklı kabul edilebilir tüm lifleri toplamak, mikrocentrifuge tüp aktarın ve lifler yerleşmek için izin vermek için inkübatör içinde 5 dakika için tüp dikey bırakın.
- Süpernatant'ı tüpten çok yavaş çıkarın.
- Tüpe RT'ye %4 paraformaldehit (PFA) 1 mL ekleyerek çapraz bağlantı lifleri. Liflersıkıntı önlemek için nazikçe yapın.
- Crosslinking sırasında iç içe lifleri önlemek için, 10 dakika boyunca çok nazik ajitasyon tüp tutun.
- Liflerin yerleşmesine izin vermek için tüpü RT'de 5 dakika boyunca dikey bir pozisyonda tutun, ardından PFA hacminin çoğunluğunu nisbeten kaldırmayı sağlayan süpernatant'ı atın.
- 1 mL fosfat tamponlu salin (PBS) ekleyin ve liflerin tortuya izin vermek için tüpleri RT'de 5 dakika dikey tutun.
- Supernatant çıkarın ve yıkama prosedürü tekrar (adım 2.1.8.) tekrar tekrarlayın.
- Çapraz bağlantılı örnekleri 4 °C'de tutun.
NOT: Çapraz bağlı miyofiberleri 4 °C'de bir hafta tutmak mümkündür. Lifler bu durumda bir haftadan fazla kalırsa, bu kaçınılmaz miyofibers iç içe neden olacaktır.
- İmmünofloresans
- Liflerin sedimantasyona izin vermek için en az 5 dakika boyunca RT'de duran lifleri içeren tüpleri tutun.
- Herhangi bir lif kaldırmak için emin olmak için sadece küçük bir hacim bırakarak, supernatant çıkarın.
- PBS'de %0,5 Triton X-100'ün 1 mL'sini ekleyin ve 5 dakika boyunca hafif ajitasyonla kuluçkaya yatırın.
- 5 dakika boyunca dikey pozisyonda tüpler koyun, sonra supernatant kaldırın.
- 1,5 mL PBS ekleyin ve 5 dakika boyunca nazik ajitasyon ile kuluçkaya yatırın.
- Tüpleri 5 dakika dikey pozisyonda tutun, sonra supernatant çıkarın.
- 1 mL bloklama çözeltisi ekleyin ve rt'de 1 saat boyunca nazik ajitasyonla kuluçkaya yatırın.
- Tüpleri dikey pozisyonda 5 dk tutun, sonra supernatant çıkarın.
- Birincil antikorları bloklama çözeltisinde seyreltin, tüplere ekleyin ve 4 °C'de gece boyunca hafif ajitasyonla kuluçkaya yatırın (önerilen konsantrasyonlar için Malzeme Tablosunabakın).
NOT: Alternatif olarak, primer antikor RT'de 3 saat kuluçkaya yatıya çıkabilir. Ancak, gece kuluçka optimal boyama verdi. Tortulanmış lifler 1,5 mL mikrosantrifüj tüpünün 100 μL çentik ulaştığında hem primer hem de sekonder antikorların kuluçka hacmi 300 μL olmalıdır. Lifler daha az bol olduğunda, 100-200 μL hacim önerilir. - Tüpleri dikey pozisyonda 5 dk bekletin ve sonra supernatant çıkarın.
- PBS'de %0,25 Tween-20'nin 1 mL'sinde 3 yıkama yapın, 5 dakika boyunca hafif ajitasyon la kuluçkaya yatın ve tüpleri her seferinde 5 dakika bekletin.
NOT: Bundan sonra florokromların beyazlatmasını önlemek için karanlıkta tüm adımları atın. - Blokaj çözeltisinde sekonder antikorları seyreltin, tüplere ekleyin ve rt'de 1 saat boyunca nazik ajitasyonla kuluçkaya yatırın (konsantrasyonlar için Malzeme Tablosunabakın).
- PBS'de %0,1 Ara-20'nin 1 mL'sinde iki kez yıkayın, 5 dakika boyunca hafif ajitasyonla kuluçkaya yatın ve tüpleri 5 dakika boyunca ayakta bırakarak bekletin.
- Supernatant çıkarın, DAPI çözeltisi 1 mL ekleyin ve nazik ajitasyon ile 5 dakika kuluçka.
- Tüpler 5 dakika boyunca bir raf ta dikey olarak standı, sonra supernatant kaldırın.
- 1 mL PBS ile yıkayın, 5 dakika boyunca hafif ajitasyonla kuluçkaya yatın ve tüpleri 5 dakika boyunca rafta bekletin.
- Yaklaşık 50 μL'lik bir hacim bırakarak süpernatant'ı çıkarın.
- Floresan etiketli miyofiberlerin mikroskop slaytlarına monte edilmesi
- P200 pipet ucunu kesin ve engelleme çözeltisi ile kaplayın
NOT: Uçları kaplamak için, pipet liflerini toplamadan önce birkaç kez yukarı ve aşağı çözelti, bu uç duvarına sopa lifleri önlemek olacaktır. - Tüpten lifleri toplamak ve bir mikroskop cam slayt onları yayıldı.
- Bir kesme mikroskop altında, ayna tarafından yansıtılan sadece doğal ışık kullanarak, lifleri yaymak ve aşırı sıvı çözeltisi kaldırmak için yeni bir (kesmez) P200 pipet ucu kullanın.
- Çok düşük miktarda çözelti kalana kadar, yaklaşık 10-15 dakika karanlıkta kuru maya slaytlar bırakın.
- Kaydırağa montaj ortamını ekleyin (kapak kayması boyutuna uygun montaj ortamı miktarı ayarlanmalıdır: 24 x 40 mm'lik bir kapak kayması için 20°L yeterlidir) ve daha sonra yavaşça lifleri içeren alana bir kapak camı yerleştirin. Gözlük arasında kabarcıklar oluşturmak için dikkatli olun.
- Liflerin tek bir yatay plan üzerinde yatacağı şekilde kapak kaymasını bastırın.
- Oje kullanarak coverslip düzeltin.
- Numuneleri 4 °C'de 4 haftaya kadar saklayın.
- Bir konfokal mikroskop ile floresan etiketli miyofiberlerin istenilen görüntüleri elde edin.
- P200 pipet ucunu kesin ve engelleme çözeltisi ile kaplayın
Sonuçlar
Biz genellikle büyüme faktörleri zengin ortamda 96 h hayatta olabilir uzun ve canlı liflerin iyi bir miktar almak için dört farklı kasları (TA, EDL, Soleus ve Gastrocnemius)sindirmek(Şekil 4A,B). Sadece en bozulmamış lifler kültür ortamına aktarılmalıdır, çünkü hayatta kalacaklar; ayrımcılık ve seçmek kolay olan diğer tüm diğerlerinin atılması gerekir.
Miyofiberler büyüme faktörleri nde korunduğunda, yabani farelerden elde edilen zengin orta uydu hücreleri etkinleştirmeye ve çoğalmaya başlar, bkz. 48 saat kültür de, sağlıklı durumda(Lamin Δ8-11 +/+), uydu hücreleri MyoD'yi düzenler ve birinci bölünmelere uğrarlar. Aktive Pax7+/MyoD+ uydu hücreleri daha sonra çoğalır ve kültürde 72 saat, miyofibere bağlı hücre agregaları oluştururlar, bu da 96 saat daha görünürdür(Şekil 5). Bu bölünmeler sırasında, bazıları MyoD ifadesini bastırabilir, kök hücre havuzunu yeniden doldurmak için kendi kendini yenilemekten geçerken, MyoD'yi koruyanlar Pax7 ifadesini aşağılayarak farklılaşmaya kendini adamış olurlar. 96 saat sonra uydu hücreleri kümeleri, yeni miyofiberlere ayrılayabilen açıkça görülebilen MyoG+ kararlı hücreler içerir(Şekil 1 ve Şekil 6). Özellikle, bu deney ile, homozigot mutant Lamin Δ8-11 farelerde (-/-) yabani tip benzerlerine (+/+) göre uydu hücresi farklılaşmasının gecikmiş dinamiklerini açıkladık, bkz.
Her bir deneyin nihai sonucu bize şiddetli kas distrofisi bu modelden tek miyofiberler izolasyon ve kültür için geliştirilen protokol tüm diğer uygulamalar için kaliteli miyofiberler sağlar düşünelim.
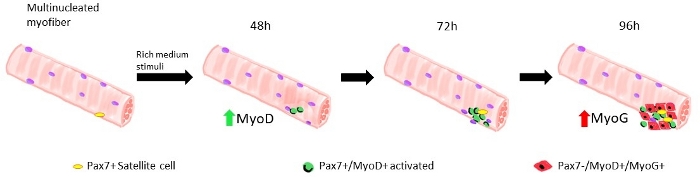
Şekil 1: Yüzen miyofiberlerde modellenmiş uydu hücrelerinin rejeneratif evrelerinin grafik gösterimi. Büyüme faktörleri açısından zengin ortamda 48 saat kültür üzerine, Pax7 + hücreleri aktive olsun ve pax7 + / MyoD + hücrelerin bir çift yol açan, birinci bölümü geçmesi. MyoD pozitif hücreler daha sonra çoğalır ve genişletmek, artış, doğurarak, 72 kültür h, tek bir uydu hücresi nin soyundan olan çeşitli hücrelerden oluşan bir küme. 96 saat kültür üzerine Pax7+/MyoD+ hücreleri Pax7-/MyoG+ hücrelerini farklıhale verir. Genişleme aşamasında, Pax7+/MyoD+ hücrelerinin bir alt kümesi, kendi kendini yenileme den gelen MyoD ifadesini küçültür. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Bore Pasteur pipetlerinin hazırlanması. (A) Büyük delik delik pipet nasıl boylamsal ve frontal görünümü. (B) Küçük delik delik pipet nihayet görünmesi gerekir nasıl uzunlamasına ve frontal görünümü. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
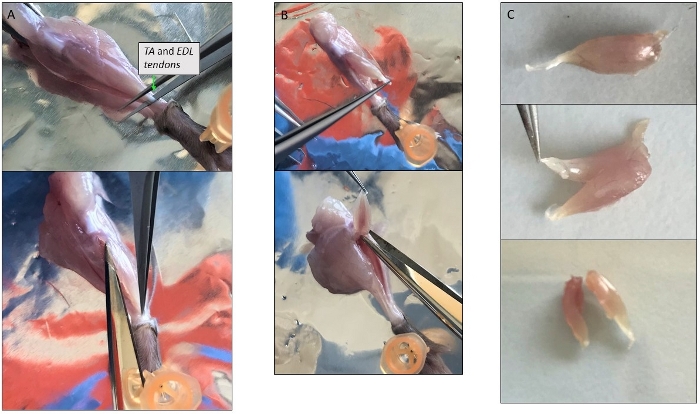
Şekil 3: Tek kas diseksiyonu temsili resimler. (A) TA kasının izolasyonu. Kas kapsayan ince tabakanın kaldırılmasını önlemek iç miyofibers korur. (B) TA ve EDL kasları birlikte izole hala patella düzeyinde üst tendon bağlı. (C) Ta ve EDL'nin izolasyondan sonra boylamsal eksen boyunca kesilerek bölünmesi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
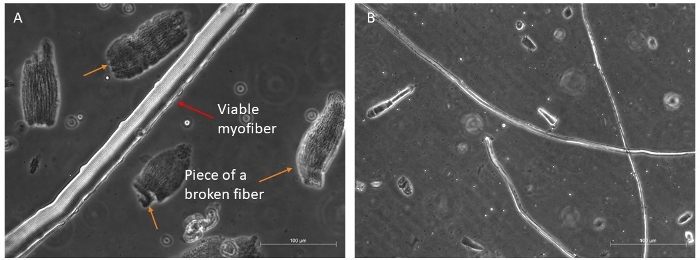
Şekil 4: Sağlıklı ve uygulanabilir miyofiber örnekleri. Süspansiyon da uygun miyofiberlerin temsili faz kontrast görüntüleri. (A) Kırmızı ok görünür sarcomere organizasyon ve yan bir uydu hücresi ile bir miyofiber gösterir; turuncu oklar kırık miyofiberler bazı parçaları gösterir, ve bazı enkaz kültür için son seçim önce ilk çanak mevcut. Ölçek çubuğu 100 μm. (B) Daha küçük bir büyütme altında diğer miyofiberlerin daha eksiksiz görünümü. Ölçek çubuğu 500 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
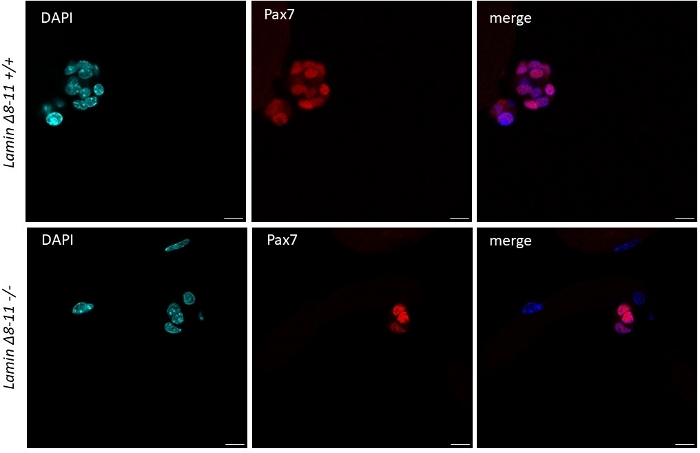
Şekil 5: WT ve mutant farelerde kök hücre kümelerinin boyutundaki farklılık. 19 gün Lamin Δ8-11 farelerinden (+/+ ve -/-) 96 saat sonra çıkarılan miyoliflerin immünofloresans boyama. Pax7+ uydu hücreleri gösterilir. Olguların çoğunda hücre kümesinin boyutu Lamin Δ8-11 +/+'da lamin Δ8-11 -/- hücre sayısı bakımından anlamlı olarak daha büyüktü. Ölçek çubuğu 10 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
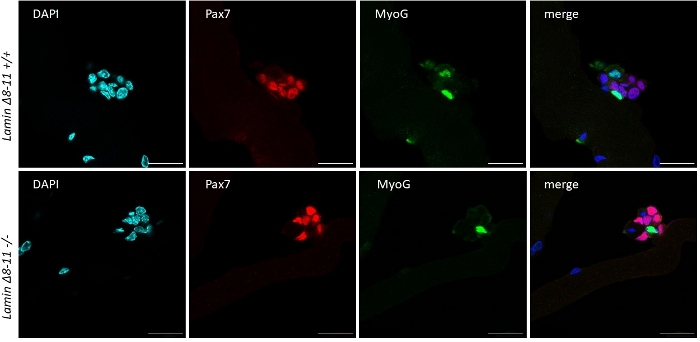
Şekil 6: Temsili immünofloresan deneyi. İmmünofloresans deneyi, kültürün 96 saat sonra, 19 gün Lamin Δ8-11 fareler (+/+ ve -/-) elde edilen miyofiberler üzerinde yapıldı. Pax7+/MyoG- (kırmızı) ve Pax7-/MyoG+ (yeşil) hücreler gözlendi. Konfokal mikroskopla elde edilen görüntüler. Ölçek çubuğu 25 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Metindeki çözümün adı | Bileşen | Yüzde | önerilen son hacim/örnek | Notlar | |
| yıkama çözeltisi | DMEM yüksek glikoz | 90% | 4 mL | Steril tutun, kullanıma kadar 4°C'de tutun | |
| At serumu (HS) | 10% | ||||
| sindirim çözümü | DMEM yüksek glikoz | 9.80% | 20 mL | Son derece zararlı toz. 0,22μm filtre ile filtre çözeltisi ve sonra steril tutmak. Kullanıma kadar 4°C'de tutun | |
| Kollajenaz I | 0.20% | ||||
| kültür ortamı | DMEM yüksek glikoz | 78% | 10 mL | Steril tutun, kullanıma kadar 4°C'de tutun | |
| Fetal büyükbaş serum (FBS) | 20% | ||||
| Tavuk embriyo ekstresi (CEE) | 1% | ||||
| Penisilin-Streptomisin (P/S) | 1% | ||||
Tablo 1: Bölüm 1'de kullanılan çözümler için tarifler.
| Metindeki çözümün adı | Bileşen | Yüzde | önerilen son hacim/örnek | Notlar | |
| %4 PFA | Paraformaldehit (PFA) | 4% | 2-3 mL | Toz ve sonra çözelti son derece zararlıdır | |
| Pbs | 96% | ||||
| %0.5 Triton X-100 | Triton X-100 | 0.50% | 2-3 mL | Triton X-100 son derece viskoz, tercihen aliquot pipet ucu kesilmiş | |
| Pbs | 99.50% | ||||
| %0.25 Tüm-20 | Tween-20 | 0.25% | 10 mL | Tween-20 son derece viskoz, tercihen aliquot için pipet ucunu kesmek | |
| Pbs | 99.75% | ||||
| %0.1 Tüm-20 | Tween-20 | 0.10% | 10 mL | Tween-20 son derece viskoz, tercihen aliquot için pipet ucunu kesmek | |
| Pbs | 99.90% | ||||
| çözüm engelleme | Fetal büyükbaş serum (FBS) | 10% | 10 mL | Taze çözelti hazırlayın ve 4°C'de 3 haftadan uzun süre saklayın (kullanımdan önce her zaman netliği kontrol edin) | |
| Pbs | 90% | ||||
| Demir | Demir | 0.10% | 2-3 mL | Karanlıkta kal. | |
| Pbs | 99.90% | ||||
Tablo 2: Bölüm 2'de kullanılan çözümler için tarifler.
Tartışmalar
Bozulmamış tek miyofiberlerin izolasyonu miyogenez alanında önemli bir yöntemdir, ana amaç kas kök hücrelerinin hücre otonom rejeneratif kapasitelerini sağlıklı ve patolojik koşullarda karakterize etmektir. Ancak, biyokimyasal veya genomik çalışmalar ilgi olduğunda, FACS izole uydu hücreleri en iyi seçenek olabilir.
Tek miyofiber izolasyon ex-vivo takip sağlar, ama en fizyolojik şekilde, tüm adımları tek uydu hücrelerinin dinamikleri kas rejenerasyonu sırasında geçmesi, yani: aktivasyon, hücre bölünmesi (asimetrik ve simetrik), farklılaşma ve kendini yenileme ile kusmislik dönmek. Miyofiberler yüzen koşullarda büyüdükten sonra, tek uydu hücreleri aynı uydu hücresinden kaynaklanan bir hücre kümesi oluşturarak aktive ve genişler. Proliferasyon, farklılaşma, aktivasyon veya kök belirteçleri için immünoforeskence analizi hücre aşamaları arasındaki oranı ölçmek için en uygun.
Uygulanabilir ve bozulmamış miyofiberler elde etmek için protokolümüzde önemli adım, herhangi bir kas hasarı önlemek için, tendon-tendon izolasyonu ile, hızlı ama nazik kas diseksiyonu olarak kabul edilebilir. Tavsiyemiz sadece keskin makas ve küçük keskin cımbız kullanmak ve on dakika tüm kas diseksiyonu prosedürü sınırlamak için. Çok küçük kasları (yani EDL ve TA) izole etmek zor olduğunda, lifleri takip eden uzunlamasına plan boyunca kesilen ince makas kullanarak onları bir araya getirmek ve daha sonra bölmek mümkündür. Bu strateji sonunda daha az bozulmamış miyofiberler verecektir, ancak canlılık tehlikeye olmayacaktır. Aynı sindirimi kolaylaştırmak için Gastrocnemius gibi büyük kaslar üzerinde yapılmalıdır. Ampirik olarak doğrulanması gereken sindirim süresinin optimizasyonu ve izole liflerin minimum manipülasyonu da sonraki analizin olumlu sonucu için iki önemli unsurdur.
Burada bildirilen protokolün avantajı, kasları son derece kırılgan olsa bile, çok küçük fareler (yaş ve boyut) üzerinde uygulanabilir olmasıdır. Yukarıda belirtilmese bile, bodrum membran kaplı yemekler18,19 kullanarak daha uzun süre kültür uygun miyofiberler için diseksiyon bu protokolü takip etmekmümkündür. Bu durumun, yapışma uyaranlarının ve yakınlık uyaranlarının bulunmadığı yüzen durumdan tamamen farklı olduğunu göz önünde bulundurmak önemlidir.
Açıklamalar
Rakip çıkarlar yok.
Teşekkürler
Biz Andrea Bianchi, Laminopathies İtalyan Ağı ve destek ve tüm yapıcı yorumlar için laboratuvar üyelerine teşekkür ederiz. Biz confocal mikroskop değerli yardım için Chiara Cordiglieri için müteşekkiriz. Yazarlar rakamlar için fotoğraf çekmek te yardımcı olduğu için Dr Beatrice Biferali teşekkür ederim. Burada sunulan çalışma My First AIRC Grant n tarafından desteklendi. 18535, AFM-Telethon n. 21030, İtalya Sağlık Bakanı n. GR-2013-02355413 ve Cariplo 2017-0649 C.M. My First AIRC hibe n.18993 ve AFM-Telethon n. 22489 tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 4′,6-diamidino-2-phenylindole | Sigma | D9542 | |
| Chicken embryo extract | Seralab | CE650-DL | |
| Collagenase type I | SIGMA | C0130-500MG | |
| Donkey anti-Rabbit 488 antibody | Thermofisher | R37118 | to be used 1:200 |
| Dulbecco's modified Eagle's medium | Gibco | 10569-010 | |
| Fetal bovine serum | Corning | 35-015-CV | |
| Horse serum | Gibco | 26050-088 | |
| MyoG antibody | Millipore | 219998 | to be used 1:100 |
| Paraformaldehyde | SIGMA | P6148 | |
| Pax7 antibody | Developmental studies Hybridoma bank | to be used 1:20 | |
| Penicillin and Streptomycin | Euroclone | ECB3001D | |
| Phosphate saline buffer | Euroclone | ECB4004L | |
| Prolong gold antifade mountant | Thermofisher | P36930 | |
| Triton X-100 | SIGMA | T8787 | |
| Tween-20 | SIGMA | P1379 | |
| Lab equipment | Manufacturer | ||
| Bunsen burner | |||
| Confocal microscope | Leica | ||
| Diamond pen | bio-optica | ||
| Dissection pins | |||
| FACS polypropylene tubes | Falcon | ||
| Falcon tubes (50 and 15 mL) | Falcon | ||
| Glass coverslips | Thermofisher | ||
| Glass Pasteur pipettes (22cm) | VWR | ||
| Glass slides | Thermofisher | ||
| Micro dissecting scissors | |||
| Micropipette (1 mL and 200 µL) | Gilson | ||
| Micropipette tips | Corning | ||
| Petri dishes (100 and 35 mm diameter) | Thermofisher | ||
| Plastic pipettes (5 and 10 mL) | VWR | ||
| Rubber pipette bulbs | VWR | ||
| Sharp tweezers | |||
| Stereo dissection microscope with transmission illumination | Leica | ||
| Tissue culture hood or lamina flow cabinet | |||
| Tissue culture incubator (humidified, 37°C, 5% CO2) | |||
| Water bath at 37°C | VWR |
Referanslar
- Wang, Y. X., Dumont, N. A., Rudnicki, M. A. Muscle stem cells at a glance. Journal of Cell Science. 127 (21), 4543-4548 (2014).
- Le Grand, F., Rudnicki, M. A. Skeletal muscle satellite cells and adult myogenesis. Current Opinion in Cell Biology. 19 (6), 628-633 (2007).
- Zammit, P. S., Partridge, T. A., Yablonka-Reuveni, Z. The Skeletal Muscle Satellite Cell: The Stem Cell That Came in From the Cold. Journal of Histochemistry & Cytochemistry. 54 (11), 1177-1191 (2006).
- Franco, I., et al. Somatic mutagenesis in satellite cells associates with human skeletal muscle aging. Nature Communications. 9 (1), 800 (2018).
- Cosgrove, B. D., et al. Rejuvenation of the muscle stem cell population restores strength to injured aged muscles. Nature Medicine. 20 (3), 255-264 (2014).
- Bernet, J. D., et al. p38 MAPK signaling underlies a cell-autonomous loss of stem cell self-renewal in aged skeletal muscle. Nature Medicine. 20 (3), 265-271 (2014).
- Bianchi, A., et al. Dysfunctional polycomb transcriptional repression contributes to lamin A/C-dependent muscular dystrophy. Journal of Clinical Investigation. 130 (5), 2408-2421 (2020).
- Blau, H. M., Webster, C., Pavlath, G. K. Defective myoblasts identified in Duchenne muscular dystrophy. Proceedings of the National Academy of Sciences. 80 (15), 4856-4860 (1983).
- Jiang, C., et al. Notch signaling deficiency underlies age-dependent depletion of satellite cells in muscular dystrophy. Disease Models & Mechanisms. 7 (8), 997-1004 (2014).
- Vallejo, D., et al. PITX2 Enhances the Regenerative Potential of Dystrophic Skeletal Muscle Stem Cells. Stem Cell Reports. 10 (4), 1398-1411 (2018).
- Danoviz, M. E., Yablonka-Reuveni, Z. Skeletal Muscle Satellite Cells: Background and Methods for Isolation and Analysis in a Primary Culture System. Methods in Molecular Biology. (798), 21-52 (2012).
- Sacco, A., Doyonnas, R., Kraft, P., Vitorovic, S., Blau, H. M. Self-renewal and expansion of single transplanted muscle stem cells. Nature. 456 (7221), 502-506 (2008).
- Bischoff, R. Proliferation of muscle satellite cells on intact myofibers in culture. Developmental Biology. 115 (1), 129-139 (1986).
- Rosenblatt, J. D., Lunt, A. I., Parry, D. J., Partridge, T. A. Culturing satellite cells from living single muscle fiber explants. In Vitro Cellular & Developmental Biology - Animal. 31 (10), 773-779 (1995).
- Shefer, G., Yablonka-Reuveni, Z. Isolation and Culture of Skeletal Muscle Myofibers as a Means to Analyze Satellite Cells. Methods in Molecular Biology. (290), 281-304 (2005).
- Anderson, J. E., Wozniak, A. C., Mizunoya, W. Single Muscle-Fiber Isolation and Culture for Cellular, Molecular, Pharmacological, and Evolutionary Studies. Methods in Molecular Biology. 798, 85-102 (2012).
- Verma, M., Asakura, A. Efficient Single Muscle Fiber Isolation from Alcohol-Fixed Adult Muscle following β-Galactosidase Staining for Satellite Cell Detection. Journal of Histochemistry & Cytochemistry. 59 (1), 60-67 (2011).
- Keire, P., Shearer, A., Shefer, G., Yablonka-Reuveni, Z. Isolation and Culture of Skeletal Muscle Myofibers as a Means to Analyze Satellite Cells. Methods in Molecular Biology. 946 (206), 431-468 (2013).
- Pasut, A., Jones, A. E., Rudnicki, M. A. Isolation and Culture of Individual Myofibers and their Satellite Cells from Adult Skeletal Muscle. Journal of Visualized Experiments. (73), e50074 (2013).
- Gallot, Y., Hindi, S., Mann, A., Kumar, A. Isolation, Culture, and Staining of Single Myofibers. Bio-Protocol. 6 (19), 1942 (2016).
- Liu, L., Cheung, T. H., Charville, G. W., Rando, T. A. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting. Nature Protocols. 10 (10), 1612-1624 (2015).
- Machado, L., et al. In Situ Fixation Redefines Quiescence and Early Activation of Skeletal Muscle Stem Cells. Cell Reports. 21 (7), 1982-1993 (2017).
- Lucini, F., Bianchi, A., Lanzuolo, C. Formaldehyde-mediated snapshot of nuclear architecture. Methods in Molecular Biology. , (2020).
- Sullivan, T., et al. Loss of a-Type Lamin Expression Compromises Nuclear Envelope Integrity Leading to Muscular Dystrophy. The Journal of Cell Biology. 147 (5), 913-920 (1999).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır