Method Article
Isolamento e cultura della miofibra singola da un modello Murine della distrofia muscolare di Emery-Dreifuss nei primi sviluppi post-Natal
In questo articolo
Riepilogo
Qui, proponiamo un metodo per ottenere in modo efficiente le singole fibre muscolari nelle prime fasi dello sviluppo post-natale dal mutante omozygoso lamin modello murino 8, un modello molto severo per la distrofia muscolare Emery-Dreifuss (EDMD).
Abstract
La distrofia muscolare emery-Dreifuss (EDMD) autosomica dominante è causata da mutazioni nel gene LMNA, che codifica le lamine nucleari di tipo A, le proteine del filamento intermedio che sostengono l'involucro nucleare e i componenti del nucleocosmo. Recentemente abbiamo riferito che lo spregio muscolare nell'EDMD può essere attribuito a disfunzioni epigenetiche intrinseche che interessano la capacità rigenerativa delle cellule staminali muscolari (satellite). L'isolamento e la coltura delle singole miofibre è uno degli approcci ex-vivo più fisiologici per monitorare il comportamento delle cellule satellitari all'interno della loro nicchia, in quanto rimangono tra la lamina basale che circonda la fibra e il sarcolemma. Pertanto, rappresenta un paradigma sperimentale inestimabile per studiare le cellule satellitari da una varietà di modelli murini. Qui, descriviamo un metodo riadattato per isolare le singole miofibre intatte e vitali dai muscoli degli arti posteriori post-natali (Tibialis Anterior, Extensor Digitorum Longus, Gastrocnemius e Soleus). Seguendo questo protocollo, siamo stati in grado di studiare le cellule satellitari dei topi Lamin -8-11 -/-, un grave murino EDMD, a soli 19 giorni dalla nascita.
Dettagliamo la procedura di isolamento, così come le condizioni di coltura per ottenere una buona quantità di miofibre e la loro progenie derivata da cellule satellitari associate. Quando coltivate in fattori di crescita ricco mezzo, le cellule satellitari derivate da topi di tipo selvatico si attivano, proliferano, e alla fine differenziano o subiscono l'auto-rinnovamento. Nell'omozigano Lamin - 8-11 -/- topi mutanti queste capacità sono gravemente compromesse.
Questa tecnica, se rigorosamente seguita, permette di studiare tutti i processi legati alla cellula satellitare associata alla miofibra anche nelle prime fasi dello sviluppo post-natale e nei muscoli fragili.
Introduzione
Il muscolo scheletrico è un tessuto differenziato con una delle capacità più estese di rigenerarsi dopo l'esercizio o il trauma1. Questa caratteristica è dovuta principalmente alla presenza di cellule staminali, chiamate cellule satellitari a causa della loro posizione periferica tra la lamina basale e il plasmalemma della miofibra2. Durante lo sviluppo post-natale, le cellule satellitari proliferano e si differenziano progressivamente, contribuendo così alla crescita muscolare scheletrica. Una volta in età adulta, le cellule satellitari entrano in uno stato quiescente reversibile, e su traumi fisiologici o patologici, si attivano, proliferano e si differenziano per riparare i muscoli danneggiati3. I difetti nella capacità delle cellule satellitari di transitare correttamente attraverso queste diverse fasi rigenerative e di subire l'auto-rinnovamento sono stati saldamente legati allo spredamento muscolare, sia durante l'invecchiamento fisiologico4,5,6 o in malattie degenerative muscolari, come distrofie muscolari7,8,9,10.
Esistono due principali approcci di coltura per studiare le cellule satellitari ex-vivo: colture miogeniche primarie da cellule mononleate, dissociate meccanicamente e chimicamente dal muscolo intero11,12; o coltura di miofibre isolate13,14,15,16,17,18,19,20. Nel primo caso, il processo di isolamento delle cellule satellitari comporta la triturazione di muscoli interi estratti dal topo, una digestione chimica, filtrazione e ordinamento fluorescente delle cellule attivate (FACS)21. Questa procedura, anche se efficace nell'isolare le cellule satellitari da una varietà di modelli, comporta diverse variabili che espongono le cellule satellitari a stress e interrompono la loro nicchia fisiologica22,23. Al contrario, l'isolamento della miofibra comporta una digestione più delicata del tessuto muscolare con enzimi degradanti a matrice e una triturazione meccanica che causa riduzione dei traumi alle cellule staminali20. Questo secondo approccio permette un recupero molto più efficiente di cellule satellitari vitali, che rimangono fisicamente attaccate alla loro miofibra tra la lamina basale e il sarcolemma, consentendo così l'analisi all'interno della loro nicchia fisiologica19,20.
Negli ultimi anni sono stati proposti molti protocolli diversi per isolare correttamente ed efficacemente le singole miofibre dai muscoli scheletrici. Già nel 1986 Bischoff ha proposto un protocollo per isolare le fibre dal Flexor Digitorum Brevis13 e più tardi, nel 1995, Rosenblatt et al. modificato il protocollo per ottenere una separazione più efficiente delle miofibre14. Da allora, molti altri autori hanno proposto procedure regolate su altri muscoli, come Extensor Digitorum Longus (EDL) e Tibialis Anterior (TA)15,16,1717,18,19,20, che sono più lunghi, anche se più fragili, muscoli14.20 Le miofibre isolate possono quindi essere coltivate sia in aderesione, per consentire l'espansione dei mioblasti derivati da cellule satellitari, sia in condizioni di galleggiamento, fino a 96 ore, per seguire la progenie derivata da singole cellule satellitari19 (Figura 1). Concentrazioni variabili di siero all'interno del mezzo di coltura sono utilizzate per attivare l'attivazione, la proliferazione e/o la differenziazione delle cellule satellitari, per studiare la loro capacità di transitare correttamente attraverso queste diverse fasi1.
Recentemente abbiamo descritto il meccanismo epigenetico dietro l'esaurimento del pool di cellule staminali satellitari nel modello murino di EDMD, il lamin -8 - topo 11 - /-7. Poiché questi topi di solito muoiono tra 4-8 settimane di età24, a causa di una grave perdita muscolare, è stato fatto un tentativo di catturare i difetti molecolari alla base dell'insorgenza precoce della malattia concentrando la nostra analisi sullo sviluppo muscolare post-natale. Le mitraglie singole galleggianti erano isolate e coltivate da un tipo7 selvaggio e topi mutanti 7 di 19 giorni. In questa fase, i difetti muscolari sono già evidenti, ma i topi sono ancora vitali. Tuttavia, poiché tutti i protocolli sopra menzionati per l'estrazione di singole miofibre sono stati ottimizzati per i muscoli scheletrici di topi adulti, dovevamo adattarli ai nostri scopi: topi molto piccoli in termini di età e dimensione e miofibre molto fragili. Così, descriviamo qui il nostro riadattamento del protocollo proposto dal laboratorio Rudnicki19 per ottenere un numero significativo di singole miofibre vitali dai topi durante lo sviluppo post-natale e da gravi muscoli distrofici, come quelli derivati da Lamin - 8-11 -/- topi24. L'obiettivo finale di questo approccio è quello di fornire una procedura standardizzata per lo studio delle cellule staminali muscolari associate alle miofibre in qualsiasi altro modello murino quando le prime fasi dello sviluppo post-natale sono di interesse, o nel caso di modelli murini che trasportano una malattia specifica che rende le miofibre più suscettibili allo stress meccanico.
Protocollo
Tutte le procedure sperimentali sono state eseguite sotto l'approvazione etica del Ministero della Salute italiano e del Comitato Istituzionale per la cura e l'uso degli animali (autorizzazione n. 83/2019-PR). Gli animali sono stati mantenuti in una struttura autorizzata presso l'Ospedale San Raffaele di Milano, Italia (autorizzazione n. N. 127/2012-A).
1. Dissezione muscolare e cultura della miofibra
- Preparazione dell'attrezzatura.
- Prima di iniziare, preparare tutte le soluzioni necessarie come descritto nella Tabella 1. Queste soluzioni devono essere preparate al momento.
- Pulire tutte le superfici e gli utensili che verranno utilizzati durante la procedura con il 70% di etanolo.
- Prima di iniziare con il sacrificio dei topi, eseguire il rivestimento di 100 mm e 35 mm piatti Petri utilizzando Horse Serum (HS). Rivestire tutti i piatti per evitare che le miofibre si attacchino alla plastica. Prendere in considerazione l'utilizzo di un piatto da 100 mm e quattro piatti da 35 mm per mouse.
- Dopo aver rimosso l'eccesso di HS, conservare i piatti rivestiti in un'incubatrice a 37 gradi centigradi per 30 min. Quindi riempirlo con soluzione di lavaggio o mezzo di coltura (due piatti da 35 mm per mouse).
NOTA: In alternativa, per rivestire i piatti piatti è possibile utilizzare una soluzione del 10% HS nel mezzo aquila modificato di Dulbecco (DMEM). Utilizzare sempre piatti rivestiti. È possibile utilizzare piatti di coltura di diverse dimensioni, ma si consigliano piatti Petri di piccole dimensioni. - Per l'isolamento delle fibre, preparare pipette Pasteur sterili come illustrato nella Figura 2. Per ogni topo preparare una pipetta foro di grandi dimensioni per la manipolazione muscolare e disaggregazione meccanica (Figura 2A) e una piccola pipetta foro per la selezione delle fibre (Figura 2B). Tagliare ogni pipetta di vetro, possibilmente utilizzando una penna di diamante, alla lunghezza desiderata e liscia bordi della pipetta su una fiamma.
- Coprire ogni pipetta bagnandola brevemente con HS prima dell'uso.
- Sacrificio del topo e dissezione muscolare
- Pre-riscaldare la soluzione di digestione a temperatura ambiente per 10 min prima di iniziare la procedura di dissezione. I tubi a fondo rotondo FACS in polipropilene sono i contenitori più adatti allo scopo.
- Immediatamente prima dell'inizio del recupero muscolare, sacrificare il mouse secondo la corretta raccomandazione nazionale IACUC.
- Sbucciare la parte inferiore del corpo con il 70% di etanolo prima di tagliare la pelle per facilitare la rimozione dei capelli.
- Mettere il mouse in una posizione prona su un supporto di polistirolo coperto con carta di alluminio e tagliare la pelle a partire dal centro della schiena longitudinalmente e nella direzione delle gambe.
- Rimuovere con attenzione la pelle senza toccare i muscoli e tendini. È possibile strappare tutta la pelle.
- Tagliare le due gambe del mouse e procedere rapidamente con la dissezione.
NOTA: Se è più comodo, è possibile continuare la dissezione sull'intero mouse ma lavorare sulla gamba consente una maggiore mobilità e precisione nei tagli successivi. - Fissare la gamba sul supporto a livello del piede utilizzando un perno e iniziare a isolare i muscoli scheletrici di interesse in questo ordine: TA, EDL, Gastrocnemius e Soleus.
- Sollevare il tendine inferiore di TA con una pinzetta affilata all'altezza della caviglia e tagliarlo, quindi tagliare con forbice fine tutto intorno al muscolo TA per l'altro tendine a livello della rotula (Figura 3A). Trasferire nella soluzione di digestione.
- Sollevare il tendine inferiore di EDL e separarlo dagli altri muscoli tirandolo delicatamente verso l'alto fino all'altro tendine. Tagliare e posizionarlo nella soluzione di digestione.
NOTA: poiché l'EDL può essere estremamente piccolo per essere tagliato separatamente da TA, possono essere sezionati insieme (Figura 3B). Quindi, se l'intero muscolo è troppo grande, tagliarlo in 2-3 pezzi partendo dal tendine e seguendo le fibre in una direzione longitudinale (Figura 3C). - Ruotare la gamba mostrando i muscoli della schiena e fissare il piede utilizzando il perno. Sollevare il tendine di Achille, Gastrocnemius si separerà automaticamente dagli altri muscoli. Il tendine superiore è nella parte posteriore della rotula. Tagliarlo e aggiungere il muscolo alla digestione.
- Sollevare il tendine esterno della gamba (rispetto al corpo) e ottenere il Soleus. Separarlo delicatamente dagli altri muscoli scorrendo sotto con la pinzetta.
- Fate lo stesso per l'altra gamba (passi da 1.2.7. a 1.2.11.).
- Digestione muscolare
- Incubare la soluzione di digestione contenente tutti i muscoli in un bagno d'acqua a 37 gradi centigradi per circa 45-50 min. Durante il tempo di digestione, controllare regolarmente il muscolo per evitare una digestione eccessiva. Ogni 10 min invertire i tubi di digestione 10x con un movimento energetico (evitare il vortice).
- Interrompere la digestione quando i muscoli iniziano ad allentarsi e le miofibre sono visibili.
- Alla fine del tempo di digestione scuotere i campioni.
- Per fermare la digestione, trasferire con cura la sospensione di digestione in una piastra Petri preriscaldata da 100 mm con 10 mL di soluzione di lavaggio.
NOTA: Evitare l'eccessiva digestione muscolare in quanto ciò comporterà inevitabilmente l'isolamento delle miofibre iper-contratto. Di solito con questo protocollo, i muscoli di topi mutanti omozici prendono 45 min per essere digeriti, mentre i muscoli di topi selvatici prendono 50-55 min. Il tempo di digestione deve essere convalidato sperimentalmente.
- Isolamento delle miofibre singole
- In primo luogo isolare le fibre già dissociate al microscopio dissettivo raccogliendole singolarmente con una pipetta P200 rivestita o un piccolo foro Pasteur e trasferirle dal Petri da 100 mm in una nuova piastra Petri da 35 mm con 5 mL di soluzione di lavaggio preriscaldato.
- Per rilasciare ulteriori miofibre, pipettare il muscolo su e giù utilizzando un grande foro foro pipetta di vetro con mezzo caldo, fino a quando le fibre sono rilasciate meccanicamente. Non essere troppo persistente in quanto ciò si tradurrà in fibre dannose.
- Continuare a rilasciare le miofibre dal muscolo fino a quando il piatto contiene una quantità desiderabile. Se la piastra Petri viene mantenuta a temperatura ambiente per più di 8 min, fermarsi ed eseguire un minimo di 5 min di incubazione a 37 , 5% CO2 per ri-equilivitare il mezzo.
- Prima di trasferire le singole miofibre al mezzo di coltura, lasciarle a 37 gradi centigradi, il 5% di CO2 nel piatto di lavaggio per almeno 1 h. Questo aiuta le miofibre ad adattarsi alla condizione in vitro.
NOTA: Le miofibre adulte sono meno sensibili allo stress e possono essere lavate 2-3x. Tuttavia, in questa condizione (a 19 giorni dopo l'età natale) è meglio eseguire una sola fase di lavaggio per prevenire danni ai mitragliatrici. Pertanto, prestare sempre attenzione a mantenere selezionate miofibre sufficientemente pulite non trasportando detriti o fibre ipercontratte.
- Cultura single della miofibra
- Trasferire singole miofibre in un nuovo piatto preriscaldato con il mezzo di coltura appropriato (medio siero alto per consentire l'attivazione di cellule satellitari, vedere la figura 1).
- Cambiare il mezzo alle miofibre isolate, trasferendole in un nuovo piatto rivestito con nuovo mezzo di coltura, solo dopo 48-72 h di cultura per evitare qualsiasi stress che porterà a miofibre ipercontrazione e rottura.
2. Applicazioni a valle: miofibre traslitti e immunofluorescenza
NOTA: Le cellule satellitari associate alle miofibre possono essere visualizzate per immunofluorescenza (IF) al momento dell'interesse. Poiché la maggior parte dei protocolli pubblicati sono ottimizzati per eseguire IF su miofibre adulte, qui viene presentato un protocollo dettagliato per ottenere risultati affidabili anche sulle miofibre isolate dai muscoli post-natali.
- Myofiber crosslinking
- Prima di iniziare, preparare tutte le soluzioni necessarie come descritto nella tabella 2.
- Precoat con HS come molti tubi di microcentrifuga da 1,5 mL come il numero di campioni. Assicurarsi di rimuovere tutto il HS prima di procedere. Dal momento che le fibre interconnesse sono più dure di quelle viventi e più difficili da pipettare, assicurati di incrociare circa 200-300 fibre separatamente per tubo.
- Sotto un microscopio dissezioso, raccogliere tutte le fibre che possono essere considerate sane, trasferirle al tubo di microcentrifuga e lasciare il tubo verticale per 5 min all'interno dell'incubatrice per consentire alle fibre di stabilirsi.
- Rimuovere il supernatante molto lentamente dal tubo.
- Fibre crosslink con l'aggiunta di 1 mL di 4% paraformaldeide (PFA) a RT al tubo. Fallo delicatamente per evitare il disagio delle fibre.
- Per evitare che le fibre si intreccino durante il collegamento incrociato, mantenere il tubo in agitazione molto delicata per 10 min.
- Mantenere il tubo in posizione verticale per 5 min a RT per consentire alle fibre di depositarsi, quindi scartare il supernatante assicurandosi di rimuovere la maggior parte del volume PFA.
- Aggiungere 1 mL di fosfato tampinato salina (PBS) e mantenere i tubi verticali per 5 min a RT per consentire alle fibre di sedimentarsi.
- Rimuovere il supernatante e ripetere la procedura di lavaggio (passaggio 2.1.8.) due volte.
- Tenere i campioni incrociati a 4 gradi centigradi.
NOTA: È possibile mantenere le miofibre incrociate a 4 gradi centigradi per una settimana. Se le fibre rimangono più di una settimana in questa condizione, questo inevitabilmente si tradurrà in miofibre intreccio.
- Immunofluorescenza
- Tenere i tubi contenenti le fibre in piedi a RT per almeno 5 min per consentire la sedimentazione della fibra.
- Rimuovere il supernatante, lasciando solo un piccolo volume per essere sicuri di non rimuovere qualsiasi fibra.
- Aggiungere 1 mL di 0,5% Triton X-100 in PBS e incubare per 5 min con agitazione delicata.
- Mettere i tubi in posizione verticale per 5 min, quindi rimuovere supernatante.
- Aggiungere 1,5 mL di PBS e incubare con agitazione delicata per 5 min.
- Mantenere i tubi in posizione verticale per 5 min, quindi rimuovere il supernatante.
- Aggiungere 1 mL di soluzione di blocco e incubare per 1 h a RT con agitazione delicata.
- Mantenere i tubi 5 min in posizione verticale, quindi rimuovere il supernatante.
- Diluire gli anticorpi primari nella soluzione di blocco, aggiungerli ai tubi e incubare per la notte a 4 gradi centigradi in agitazione delicata (per le concentrazioni suggerite vedere Tabella dei materiali).
NOTA: In alternativa, l'anticorpo primario può essere incubato per 3 h a RT. Tuttavia, l'incubazione durante la notte ha dato una colorazione ottimale. Il volume di incubazione per gli anticorpi primari e secondari deve essere di 300 gradi quando le fibre sedimentate raggiungono la tacca di 100 mL del tubo di microcentrifuga da 1,5 mL. Quando le fibre sono meno abbondanti, si raccomanda un volume di 100-200 l. - Lasciare i tubi in posizione verticale per 5 min e quindi rimuovere il supernatante.
- Eseguire 3 lavamenti in 1 mL di 0,25% Tween-20 in PBS, incubando per 5 min in agitazione delicata e poi lasciando i tubi in piedi per 5 min ogni volta.
NOTA: Da qui in mente, eseguire tutti i passaggi al buio, per evitare sbiancamenti fluorocromici. - Diluire gli anticorpi secondari in soluzione di blocco, aggiungerli ai tubi e incubare per 1 h a RT con agitazione delicata (per le concentrazioni vedere Tabella dei materiali).
- Lavare due volte in 1 mL dello 0,1% Tween-20 in PBS, incubando per 5 min con agitazione delicata e poi lasciando i tubi in posizione eretta per 5 min.
- Rimuovere il supernatante, aggiungere 1 mL di soluzione DAPI e incubare per 5 min con agitazione delicata.
- Lasciare i tubi in piedi verticalmente in un rack per 5 min, quindi rimuovere il supernatante.
- Lavare con 1 mL di PBS, incubando per 5 min con agitazione delicata e poi lasciando i tubi stare in un rack per 5 min.
- Rimuovere il supernatante, lasciando un volume di circa 50 l.
- Montaggio di miofibre fluorescenti etichettate su vetrini al microscopio
- Tagliare una punta di pipetta P200 e ricoprirla con una soluzione di blocco
NOTA: Per rivestire la punta, pipette la soluzione su e giù più volte prima di raccogliere le fibre, questo eviterà fibre di attaccare alla parete di punta. - Raccogliere le fibre dal tubo e diffonderle su un vetrino di vetro al microscopio.
- Al microscopio dissettivo, utilizzando solo la luce naturale riflessa dallo specchio, utilizzare una nuova punta di pipetta P200 (non tagliata) per diffondere le fibre e rimuovere la soluzione liquida in eccesso.
- Lasciare asciugare i vetrini all'aria al buio per circa 10-15 min, fino a quando rimane una quantità molto bassa di soluzione.
- Aggiungere il supporto di montaggio sul vetrino (la giusta quantità di supporto di montaggio deve essere calibrata sulla dimensione della vetrina: per un coperchio di 24 x 40 mm è sufficiente) e quindi posare lentamente un vetro di copertura sull'area contenente le fibre. Fare attenzione a non creare bolle tra gli occhiali.
- Premere il coperchio in modo che le fibre si poseranno su un unico piano orizzontale.
- Fissare la coverslip con smalto.
- Conservare i campioni a 4 gradi centigradi per un massimo di 4 settimane.
- Acquisire le immagini desiderate di miofibre fluorescenti etichettate con un microscopio confocale.
- Tagliare una punta di pipetta P200 e ricoprirla con una soluzione di blocco
Risultati
Digeriamo in genere quattro muscoli diversi (TA, EDL, Soleus e Gastrocnemius) per recuperare una buona quantità di fibre lunghe e vitali che potrebbero sopravvivere a 96 h in mezzo ricco di fattori di crescita (Figura 4A,B). Solo le fibre più intatte dovrebbero essere trasferite nel mezzo di coltura, in quanto sopravviveranno; tutti gli altri, che sono facili da discriminare e selezionare, devono essere scartati.
Quando le miofibre vengono mantenute in un ricco di fattori di crescita le cellule satellitari medie derivate da topi selvatici iniziano ad attivarsi e proliferare, vedere Figura 1. Dopo 48 h di coltura, in condizioni di salute (Lamin - 8-11 ) ), le cellule satellitari regolano MyoD e subiscono la loro prima divisione. Le cellule satellitari attivate Pax7/MyoD proliferano e di 72 h nella coltura generano aggregati cellulari legati alla miofibra, che sono ancora più visibili a 96 h (Figura 5). Durante queste divisioni, alcuni di loro possono reprimere l'espressione di MyoD, subendo l'auto-rinnovamento per ripopolare il pool di cellule staminali, mentre quelli che mantengono MyoD si impegnano a differenziare la espressione Pax7. Dopo 96 h, i cluster di cellule satellitari contengono celle mioG, chiaramente visibili, che possono differenziarsi in nuove miofibre (Figura 1 e Figura 6). In particolare, con questo esperimento, abbiamo descritto una dinamica ritardata della differenziazione delle cellule satellitari nei topi omozici mutanti Lamin -8-11 (-/-) rispetto alle loro controparti di tipo selvaggio (sezione /z), vedi Figura 6.
Il risultato finale di ogni singolo esperimento pensiamo che il protocollo sviluppato per l'isolamento delle singole miofibre e la cultura da questo modello di grave distrofia muscolare garantisca miofibre di buona qualità per tutte le ulteriori applicazioni.
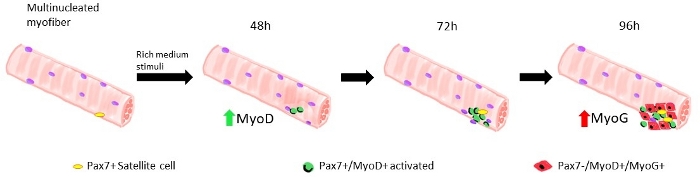
Figura 1: Rappresentazione grafica delle fasi rigenerative delle cellule satellitari modellate in miofibre galleggianti. Dopo 48 h di coltura in fattori di crescita ricco mezzo, le cellule Pax7 vengono attivate e subiscono la prima divisione, dando origine a un doppietto di cellule Pax7 / MyoD. Le cellule positive MyoD proliferano ed espandono, dando origine, in 72 h di coltura, a un gruppo di diverse cellule che sono la progenie di una singola cellula satellite. A 96 h di coltura le cellule Pax7/MyoD diventano cellule Pax7-/MyoG. Durante la fase di espansione, un sottoinsieme di celle Pax7/MyoD, downregulate MyoD espressione in fase di auto-rinnovamento in quiescenza. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Preparazione delle pipette Pasteur del foro. (A) Visione longitudinale e frontale di come deve apparire la pipetta del foro grande. (B) La visione longitudinale e frontale di come deve finalmente apparire la pipetta del foro piccolo foro. Fare clic qui per visualizzare una versione più grande di questa figura.
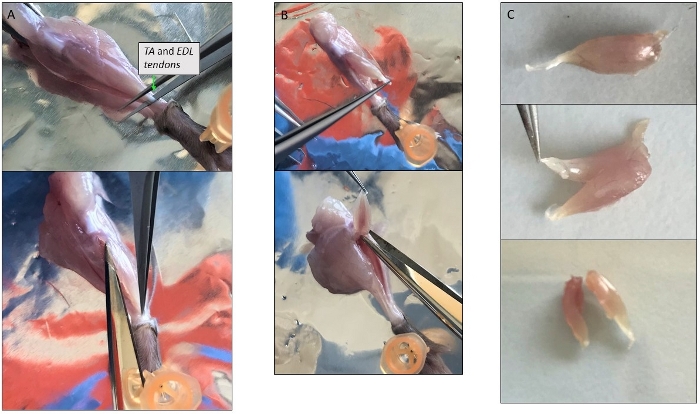
Figura 3: Immagini rappresentative della dissezione muscolare singola. (A) Isolamento del muscolo TA. Evitare la rimozione dello strato sottile che copre il muscolo protegge le miofibre all'interno. (B) I muscoli TA ed EDL isolati insieme ancora attaccati al loro tendine superiore a livello della rotula. (C) Divisione di TA e EDL dopo l'isolamento tagliandoli lungo l'asse longitudinale. Fare clic qui per visualizzare una versione più grande di questa figura.
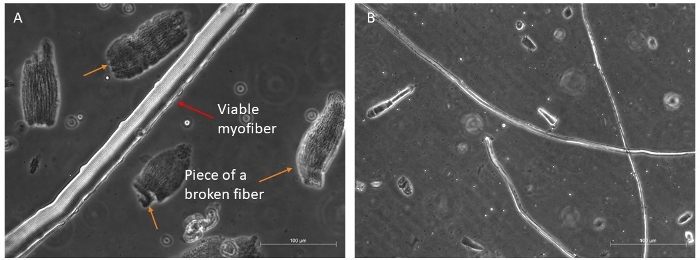
Figura 4: Esempi di miofibre sane e vitali. Immagini di contrasto di fase rappresentative di miofibre vitali in sospensione. (A) La freccia rossa indica una miofibra con organizzazione sarcomere visibile e una cellula satellitare su un lato; le frecce arancioni indicano alcuni pezzi di mitragliafibre rotte, e alcuni detriti presenti nel primo piatto prima della selezione finale per la cultura. Barra della scala di 100 m. (B) Visione più completa di altre miofibre sotto un ingrandimento più piccolo. Barra di scala 500 m. Fare clic qui per visualizzare una versione più grande di questa figura.
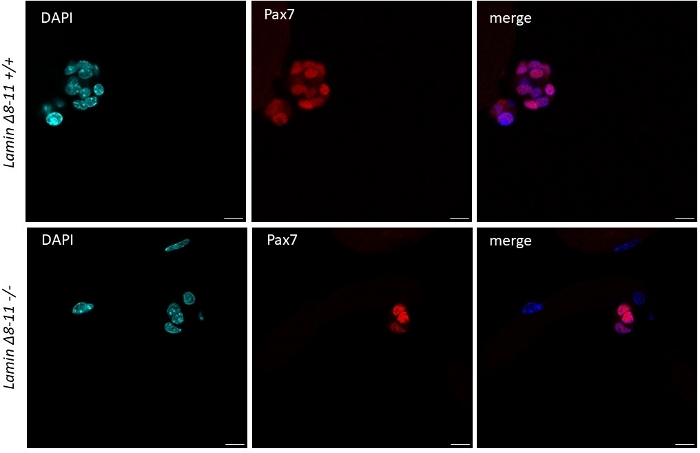
Figura 5: Differenza nella dimensione degli ammassi di cellule staminali nei topi mutanti e wt. Immunofluorescenza colorazione delle miofibre estratte da 19 giorni di lamin 8-11 topi (z/ e -/--) dopo 96 h di coltura. Vengono visualizzate le cellule satellitari Pax7. La quota dell'ammasso di cellule nella maggior parte dei casi era significativamente più grande in Lamin , 8-11 , rispetto a Lamin - 8 -// in termini di numero di cellule. Barra di scala di 10 m. Fare clic qui per visualizzare una versione più grande di questa figura.
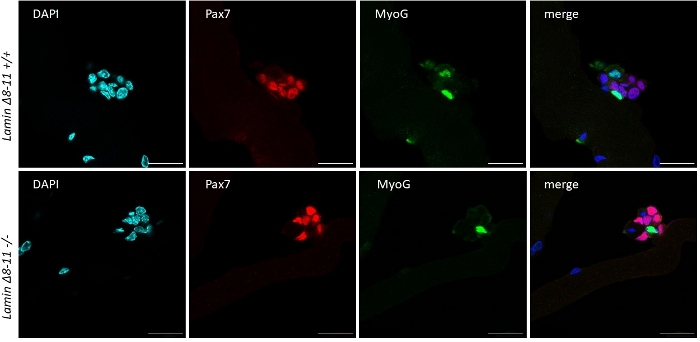
Figura 6: Esperimento di immunofluorescenza rappresentativo. Esperimento di immunofluorescenza eseguito, dopo 96 h di coltura, su miofibre estratte da 19 giorni di lamin-11 Sono state osservate cellule Pax7/MyoG- (rosso) e Pax7-/MyoG (verde). Immagini ottenute con un microscopio confocale. Barra di scala 25 m. Fare clic qui per visualizzare una versione più grande di questa figura.
| Nome della soluzione nel testo | Componente | Percentuale | volume/campione finale suggerito | Note | |
| soluzione di lavaggio | DMEM alto glucosio | 90% | 4 mL | Mantenere sterile, tenere a 4 gradi centigradi fino all'uso | |
| Siero di cavallo (HS) | 10% | ||||
| soluzione di digestione | DMEM alto glucosio | 9.80% | 20 mL | Polvere estremamente dannosa. Soluzione di filtro con filtro di 0,22 m e quindi mantenere sterile. Mantenere a 4 gradi centigradi fino all'utilizzo | |
| Collagenasi I | 0.20% | ||||
| mezzo di coltura | DMEM alto glucosio | 78% | 10 mL | Mantenere sterile, tenere a 4 gradi centigradi fino all'uso | |
| Siero bovino fetale (FBS) | 20% | ||||
| Estratto di embrione di pollo (CEE) | 1% | ||||
| Penicillina-Streptomycin (P/S) | 1% | ||||
Tabella 1: Ricette per le soluzioni utilizzate nella sezione 1.
| Nome della soluzione nel testo | Componente | Percentuale | volume/campione finale suggerito | Note | |
| 4% PFA | Paraformaldeide (PFA) | 4% | 2-3 mL | Polvere e poi soluzione sono estremamente dannosi | |
| Pbs | 96% | ||||
| 0,5% Triton X-100 | Triton X-100 | 0.50% | 2-3 mL | Triton X-100 è estremamente viscoso, preferibilmente tagliare la punta della pipetta ad esso aliquota aliquota | |
| Pbs | 99.50% | ||||
| 0.25% Tween-20 | Tween-20 | 0.25% | 10 mL | Tween-20 è estremamente viscoso, preferibilmente tagliare la punta della pipetta aliquota ad esso | |
| Pbs | 99.75% | ||||
| 0.1% Tween-20 | Tween-20 | 0.10% | 10 mL | Tween-20 è estremamente viscoso, preferibilmente tagliare la punta della pipetta aliquota ad esso | |
| Pbs | 99.90% | ||||
| soluzione di blocco | Siero bovino fetale (FBS) | 10% | 10 mL | Preparare una soluzione fresca e conservare a 4 gradi centigradi per non più di 3 settimane (controllare sempre la chiarezza prima dell'uso) | |
| Pbs | 90% | ||||
| Dapi | Dapi | 0.10% | 2-3 mL | Tenere al buio | |
| Pbs | 99.90% | ||||
Tabella 2: Ricette per le soluzioni utilizzate nella sezione 2.
Discussione
L'isolamento delle singole miofibre intatte è un metodo essenziale nel campo della miogenesi quando l'obiettivo principale è caratterizzare le capacità rigenerative cellule-autonome delle cellule staminali muscolari all'interno della loro nicchia, in condizioni sane e patologiche. Tuttavia, quando gli studi biochimici o genomici sono di interesse, le cellule satellitari isolate dal FACS potrebbero essere l'opzione migliore.
L'isolamento delle miofibre singole permette di seguire l'ex-vivo, ma nel modo più fisiologico, la dinamica di tutti i passi che le singole cellule satellitari subiscono durante la rigenerazione muscolare, ovvero: attivazione, divisione cellulare (asimmetrica e simmetrica), differenziazione e ritorno alla quiescenza mediante auto-rinnovamento. Una volta che le miofibre vengono coltivate in condizioni galleggianti, le singole cellule satellitari si attivano ed espandono formando un gruppo di cellule, tutte derivanti dalla stessa cellula satellitare. L'analisi dell'immunofluorescenza per la proliferazione, la differenziazione, l'attivazione o i marcatori di stelo è quindi ottimale per quantificare la proporzione tra gli stadi cellulari.
Il passo chiave nel nostro protocollo per ottenere miofibre vitali e intatte può essere considerata la dissezione muscolare rapida ma delicata, dall'isolamento tendine-tendine, per evitare danni muscolari. Il nostro consiglio è quello di utilizzare solo forbici affilate e piccole pinzette affilate e di limitare l'intera procedura di dissezione muscolare a dieci minuti. Quando è difficile isolare muscoli molto piccoli (cioè, EDL e TA), è possibile tagliarli insieme e dividerli successivamente utilizzando forbici fini che tagliano lungo il piano longitudinale seguendo le fibre. Questa strategia alla fine darà meno intatti miofibre, ma la vitalità non sarà compromessa. Lo stesso deve essere eseguito su grandi muscoli come Gastrocnemius per facilitare la digestione. Ottimizzazione del tempo di digestione, che deve essere convalidata empiricamente, e la manipolazione minima di fibre isolate sono anche due aspetti cruciali per l'esito positivo delle analisi successive.
Il vantaggio del protocollo riportato qui è che può essere applicato su topi molto piccoli (in età e dimensione), anche quando i loro muscoli sono estremamente fragili. Anche se non menzionato sopra, è possibile seguire questo protocollo di dissezione per poi coltura melofibre vitali per un periodo più lungo utilizzando piatti interrati rivestiti a membrana18,19. È importante considerare che questa situazione è completamente diversa dalla condizione galleggiante, dove gli stimoli di adesione e gli stimoli di prossimità sono assenti.
Divulgazioni
Nessun interesse concorrente.
Riconoscimenti
Ringraziamo Andrea Bianchi, la Rete Italiana di Laminopatie e i membri del laboratorio per il supporto e tutti i commenti costruttivi. Siamo grati a Chiara Cordiglieri per il prezioso aiuto al microscopio confocale. Gli autori ringraziano la dott.ssa Beatrice Biferali per il suo aiuto nello stopersi per scattare foto per figure. Il lavoro qui presentato è stato sostenuto da My First AIRC Grant n. 18535, AFM-Telethon n. 21030, il Ministro della Salute italiano n. GR-2013-02355413 e Cariplo 2017-0649 a C.L. C.M. è supportato da My First AIRC grant n.18993 e AFM-Telethon n. 22489.
Materiali
| Name | Company | Catalog Number | Comments |
| 4′,6-diamidino-2-phenylindole | Sigma | D9542 | |
| Chicken embryo extract | Seralab | CE650-DL | |
| Collagenase type I | SIGMA | C0130-500MG | |
| Donkey anti-Rabbit 488 antibody | Thermofisher | R37118 | to be used 1:200 |
| Dulbecco's modified Eagle's medium | Gibco | 10569-010 | |
| Fetal bovine serum | Corning | 35-015-CV | |
| Horse serum | Gibco | 26050-088 | |
| MyoG antibody | Millipore | 219998 | to be used 1:100 |
| Paraformaldehyde | SIGMA | P6148 | |
| Pax7 antibody | Developmental studies Hybridoma bank | to be used 1:20 | |
| Penicillin and Streptomycin | Euroclone | ECB3001D | |
| Phosphate saline buffer | Euroclone | ECB4004L | |
| Prolong gold antifade mountant | Thermofisher | P36930 | |
| Triton X-100 | SIGMA | T8787 | |
| Tween-20 | SIGMA | P1379 | |
| Lab equipment | Manufacturer | ||
| Bunsen burner | |||
| Confocal microscope | Leica | ||
| Diamond pen | bio-optica | ||
| Dissection pins | |||
| FACS polypropylene tubes | Falcon | ||
| Falcon tubes (50 and 15 mL) | Falcon | ||
| Glass coverslips | Thermofisher | ||
| Glass Pasteur pipettes (22cm) | VWR | ||
| Glass slides | Thermofisher | ||
| Micro dissecting scissors | |||
| Micropipette (1 mL and 200 µL) | Gilson | ||
| Micropipette tips | Corning | ||
| Petri dishes (100 and 35 mm diameter) | Thermofisher | ||
| Plastic pipettes (5 and 10 mL) | VWR | ||
| Rubber pipette bulbs | VWR | ||
| Sharp tweezers | |||
| Stereo dissection microscope with transmission illumination | Leica | ||
| Tissue culture hood or lamina flow cabinet | |||
| Tissue culture incubator (humidified, 37°C, 5% CO2) | |||
| Water bath at 37°C | VWR |
Riferimenti
- Wang, Y. X., Dumont, N. A., Rudnicki, M. A. Muscle stem cells at a glance. Journal of Cell Science. 127 (21), 4543-4548 (2014).
- Le Grand, F., Rudnicki, M. A. Skeletal muscle satellite cells and adult myogenesis. Current Opinion in Cell Biology. 19 (6), 628-633 (2007).
- Zammit, P. S., Partridge, T. A., Yablonka-Reuveni, Z. The Skeletal Muscle Satellite Cell: The Stem Cell That Came in From the Cold. Journal of Histochemistry & Cytochemistry. 54 (11), 1177-1191 (2006).
- Franco, I., et al. Somatic mutagenesis in satellite cells associates with human skeletal muscle aging. Nature Communications. 9 (1), 800 (2018).
- Cosgrove, B. D., et al. Rejuvenation of the muscle stem cell population restores strength to injured aged muscles. Nature Medicine. 20 (3), 255-264 (2014).
- Bernet, J. D., et al. p38 MAPK signaling underlies a cell-autonomous loss of stem cell self-renewal in aged skeletal muscle. Nature Medicine. 20 (3), 265-271 (2014).
- Bianchi, A., et al. Dysfunctional polycomb transcriptional repression contributes to lamin A/C-dependent muscular dystrophy. Journal of Clinical Investigation. 130 (5), 2408-2421 (2020).
- Blau, H. M., Webster, C., Pavlath, G. K. Defective myoblasts identified in Duchenne muscular dystrophy. Proceedings of the National Academy of Sciences. 80 (15), 4856-4860 (1983).
- Jiang, C., et al. Notch signaling deficiency underlies age-dependent depletion of satellite cells in muscular dystrophy. Disease Models & Mechanisms. 7 (8), 997-1004 (2014).
- Vallejo, D., et al. PITX2 Enhances the Regenerative Potential of Dystrophic Skeletal Muscle Stem Cells. Stem Cell Reports. 10 (4), 1398-1411 (2018).
- Danoviz, M. E., Yablonka-Reuveni, Z. Skeletal Muscle Satellite Cells: Background and Methods for Isolation and Analysis in a Primary Culture System. Methods in Molecular Biology. (798), 21-52 (2012).
- Sacco, A., Doyonnas, R., Kraft, P., Vitorovic, S., Blau, H. M. Self-renewal and expansion of single transplanted muscle stem cells. Nature. 456 (7221), 502-506 (2008).
- Bischoff, R. Proliferation of muscle satellite cells on intact myofibers in culture. Developmental Biology. 115 (1), 129-139 (1986).
- Rosenblatt, J. D., Lunt, A. I., Parry, D. J., Partridge, T. A. Culturing satellite cells from living single muscle fiber explants. In Vitro Cellular & Developmental Biology - Animal. 31 (10), 773-779 (1995).
- Shefer, G., Yablonka-Reuveni, Z. Isolation and Culture of Skeletal Muscle Myofibers as a Means to Analyze Satellite Cells. Methods in Molecular Biology. (290), 281-304 (2005).
- Anderson, J. E., Wozniak, A. C., Mizunoya, W. Single Muscle-Fiber Isolation and Culture for Cellular, Molecular, Pharmacological, and Evolutionary Studies. Methods in Molecular Biology. 798, 85-102 (2012).
- Verma, M., Asakura, A. Efficient Single Muscle Fiber Isolation from Alcohol-Fixed Adult Muscle following β-Galactosidase Staining for Satellite Cell Detection. Journal of Histochemistry & Cytochemistry. 59 (1), 60-67 (2011).
- Keire, P., Shearer, A., Shefer, G., Yablonka-Reuveni, Z. Isolation and Culture of Skeletal Muscle Myofibers as a Means to Analyze Satellite Cells. Methods in Molecular Biology. 946 (206), 431-468 (2013).
- Pasut, A., Jones, A. E., Rudnicki, M. A. Isolation and Culture of Individual Myofibers and their Satellite Cells from Adult Skeletal Muscle. Journal of Visualized Experiments. (73), e50074 (2013).
- Gallot, Y., Hindi, S., Mann, A., Kumar, A. Isolation, Culture, and Staining of Single Myofibers. Bio-Protocol. 6 (19), 1942 (2016).
- Liu, L., Cheung, T. H., Charville, G. W., Rando, T. A. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting. Nature Protocols. 10 (10), 1612-1624 (2015).
- Machado, L., et al. In Situ Fixation Redefines Quiescence and Early Activation of Skeletal Muscle Stem Cells. Cell Reports. 21 (7), 1982-1993 (2017).
- Lucini, F., Bianchi, A., Lanzuolo, C. Formaldehyde-mediated snapshot of nuclear architecture. Methods in Molecular Biology. , (2020).
- Sullivan, T., et al. Loss of a-Type Lamin Expression Compromises Nuclear Envelope Integrity Leading to Muscular Dystrophy. The Journal of Cell Biology. 147 (5), 913-920 (1999).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon