Method Article
Isolement et culture myofiber uniques à partir d’un modèle murin de la dystrophie musculaire Emery-Dreifuss dans le développement post-natal précoce
Dans cet article
Résumé
Ici, nous proposons une méthode pour obtenir efficacement des fibres musculaires simples aux premiers stades post-natals du développement de l’homozygote mutant Lamin Δ8-11 modèle de souris, un modèle très sévère pour Emery-Dreifuss dystrophie musculaire (EDMD).
Résumé
La dystrophie musculaire autosomique dominante Emery-Dreifuss (EDMD) est causée par des mutations dans le gène LMNA, qui code les lamines nucléaires de type A, les protéines de filament intermédiaire qui soutiennent l’enveloppe nucléaire et les composants du nucléoplasme. Nous avons récemment signalé que le gaspillage musculaire dans EDMD peut être attribué à des dysfonctionnements épigénétiques intrinsèques affectant la capacité régénératrice des cellules souches musculaires (satellites). L’isolement et la culture des myofibers simples est l’une des approches ex-vivo les plus physiologiques pour surveiller le comportement des cellules satellites dans leur niche, car ils restent entre la lamine basale entourant la fibre et le sarcolemme. Par conséquent, il représente un paradigme expérimental inestimable pour étudier les cellules satellites à partir d’une variété de modèles murins. Ici, nous décrivons une méthode ré-adaptée pour isoler les myofibers uniques intacts et viables des muscles postnatals de l’arrière --tibialis antérieur, Extensor Digitorum Longus, Gastrocnemius et Soleus). Suivant ce protocole, nous avons pu étudier les cellules satellites de Lamin Δ8-11 -/- souris, un modèle grave de murine EDMD, à seulement 19 jours après la naissance.
Nous détaillons la procédure d’isolement, ainsi que les conditions de culture pour obtenir une bonne quantité de myofibers et leur progéniture associée dérivée des cellules satellites. Lorsqu’elles sont cultivées dans un milieu riche en facteurs de croissance, les cellules satellites dérivées de souris de type sauvage activent, prolifèrent et finissent par se différencier ou subissent un auto-renouvellement. Chez les souris homozygotes Lamin Δ8-11 -/- mutantes, ces capacités sont gravement altérées.
Cette technique, si elle est strictement suivie, permet d’étudier tous les processus liés à la cellule satellite associée au myofiber, même au début des stades de développement postnatal et dans des muscles fragiles.
Introduction
Le muscle squelettique est un tissu différencié avec l’une des capacités les plus étendues à se régénérer après l’exercice ou un traumatisme1. Cette caractéristique est principalement due à la présence de cellules souches, appelées cellules satellites en raison de leur position périphérique entre la lamina basale et le plasmalemme du myofiber2. Pendant le développement postnatal, les cellules satellites prolifèrent et se différencient progressivement, contribuant ainsi à la croissance des muscles squelettiques. Une fois à l’âge adulte, les cellules satellites entrent dans un état de quiescent réversible, et sur un traumatisme physiologique ou pathologique, elles activent, prolifèrent et se différencient afin de réparer les muscles endommagés3. Les défauts dans la capacité des cellules satellites de passer correctement par ces différentes phases régénératrices et de subir l’auto-renouvellement ont été fermement liés au gaspillage musculaire, soit pendant le vieillissement physiologique4,5,6 ou dans les maladies dégénératives musculaires, telles que les dystrophies musculaires7,8,9,10.
Deux approches de culture principale existent pour étudier les cellules satellites ex vivo : les cultures myogènes primaires à partir de cellules mononucléées, mécaniquement et chimiquement dissociées du muscle entier11,12; ou culture des myofibers isolés13,14,15,16,17,18,19,20. Dans le premier cas, le processus d’isolement des cellules satellites implique la trituration des muscles entiers extraits de la souris, une digestion chimique, la filtration et le tri des cellules fluorescentes activées (FACS)21. Cette procédure, bien qu’efficace pour isoler les cellules satellites d’une variété de modèles, implique plusieurs variables qui exposent les cellules satellites au stress et perturbe leur niche physiologique22,23. En revanche, l’isolement du myofiber implique une digestion plus douce du tissu musculaire avec des enzymes dégradantes matricielles et un déchiquetage mécanique qui provoque une réduction des traumatismes aux cellules souches20. Cette deuxième approche permet une récupération beaucoup plus efficace des cellules satellites viables, qui restent physiquement attachées à leur myofiber entre la lamina basale et le sarcolemma, permettant ainsi l’analyse dans leur niche physiologique19,20.
De nombreux protocoles différents ont été proposés au cours des dernières années pour isoler correctement et efficacement les myofibers simples des muscles squelettiques. Déjà en 1986 Bischoff a proposé un protocole pour isoler les fibres du Flexor Digitorum Brevis13 et plus tard, en 1995, Rosenblatt et coll. ont modifié le protocole pour obtenir une séparation plus efficace des myofibers14. Depuis lors, de nombreux autres auteurs ont proposé des procédures ajustées sur d’autres muscles, tels que Extensor Digitorum Longus (EDL) et Tibialis Anterior (TA)15,16,17,18,19,20, qui sont plus longs, même si plus fragiles, muscles14. Les myoibers isolés peuvent alors être cultivés à la fois en adhérence, pour permettre l’expansion des myoblastes dérivés des cellules satellites, ou dans des conditions flottantes, jusqu’à 96 heures, pour suivre la descendance dérivée des cellules satellites simples19 (Figure 1). Des concentrations variables de sérum dans le milieu de culture sont utilisées pour déclencher l’activation, la prolifération et/ou la différenciation des cellules satellites, afin d’étudier leur capacité à transiter correctement par ces différentes phases1.
Nous avons récemment décrit le mécanisme épigénétique derrière l’épuisement de la piscine de cellules souches satellites dans le modèle de souris de l’EDMD, le Lamin Δ8-11 -/- souris7. Puisque ces souris meurent habituellement entre 4-8 semaines de l’âge24, en raison de la perte de muscle grave, une tentative a été faite pour capturer les défauts moléculaires sous-jacents au début tôt de la maladie en concentrant notre analyse sur le développement de muscle post-natal. Les myofibers flottants simples ont été isolés et cultivés de type sauvage et Lamin Δ8-11 -/- mutant7 souris de 19 jours. À ce stade, les défauts musculaires sont déjà évidents, mais les souris sont encore viables. Cependant, puisque tous les protocoles mentionnés ci-dessus pour l’extraction de myofibers simples ont été optimisés pour les muscles squelettiques des souris adultes, nous avons dû les adapter à nos objectifs : de très petites souris en termes d’âge et de taille, et des myofibers très fragiles. Ainsi, nous décrivons ici notre ré-adaptation du protocole proposé par le laboratoire Rudnicki19 pour obtenir un nombre significatif de myofibers viables simples de souris pendant le développement post-natal et des muscles dystrophiques graves, tels que ceux dérivés de Lamin Δ8-11 -/- souris24. L’objectif final de cette approche est de fournir une procédure normalisée pour l’étude des cellules souches musculaires associées aux myofibers dans n’importe quel autre modèle de souris lorsque les premiers stades du développement postnatal sont d’intérêt, ou dans le cas des modèles de souris portant une maladie spécifique qui rend les myofibers plus sensibles au stress mécanique.
Protocole
Toutes les procédures expérimentales ont été réalisées sous l’approbation éthique du Ministère italien de la santé et du Comité institutionnel de soins et d’utilisation des animaux (autorisation n. 83/2019-PR). Les animaux ont été maintenus dans un établissement autorisé à l’hôpital San Raffaele, Milan, Italie (autorisation n. N. 127/2012-A).
1. Dissection musculaire et culture myofiber
- Préparation de l’équipement.
- Avant de commencer, préparer toutes les solutions nécessaires telles que décrites dans le tableau 1. Ces solutions doivent être préparées fraîchement.
- Nettoyez toutes les surfaces et les outils qui seront utilisés pendant la procédure avec 70% d’éthanol.
- Avant de commencer par le sacrifice des souris, effectuer le revêtement de 100 mm et 35 mm petri plats à l’aide de sérum de cheval (HS). Enrober tous les plats pour empêcher les myofibers de s’attacher au plastique. Envisagez d’utiliser un plat de 100 mm et quatre plats de 35 mm par souris.
- Après avoir enlevé l’excès de SH, conserver les plats enrobés dans un incubateur à 37 °C pendant 30 min. Remplissez-le ensuite d’une solution de lavage ou d’un milieu de culture (deux plats de 35 mm par souris).
REMARQUE : Alternativement, une solution de 10 % de HS dans le milieu modifié de l’Aigle (DMEM) de Dulbecco peut être utilisée pour enrober les plats. Utilisez toujours des plats enrobés. Il est possible d’utiliser des plats de culture de différentes tailles, mais les petits plats Petri de dimension sont recommandés. - Pour l’isolation des fibres, préparez des pipettes Pasteur stériles comme le montre la figure 2. Pour chaque souris préparer une pipette de forage grand trou pour la manipulation musculaire et la désagrégation mécanique (Figure 2A) et une pipette petit trou pour la sélection des fibres (Figure 2B). Couper chaque pipette en verre, éventuellement à l’aide d’un stylo diamant, sur la longueur désirée et les bords lisses de la pipette sur une flamme.
- Enrober chaque pipette en la mouillant brièvement avec du SH avant utilisation.
- Sacrifice de souris et dissection musculaire
- Préchauffer la solution de digestion à température ambiante pendant 10 min avant de commencer la procédure de dissection. Les tubes à fond rond FACS en polypropylène sont les contenants les plus appropriés à cet effet.
- Immédiatement avant le début de la récupération musculaire, sacrifier la souris selon la recommandation nationale appropriée IACUC.
- Mouiller son bas du corps avec 70% d’éthanol avant de couper la peau pour faciliter l’enlèvement des cheveux.
- Mettez la souris dans une position couchée sur un support de polystyrène recouvert de papier d’aluminium et coupez la peau à partir du milieu du dos longitudinalement et dans la direction des jambes.
- Retirez soigneusement la peau sans toucher les muscles et les tendons. Il est possible d’arracher toute la peau.
- Couper les deux pattes de la souris et procéder rapidement à la dissection.
REMARQUE : S’il est plus confortable, il est possible de poursuivre la dissection sur l’ensemble de la souris, mais travailler sur la jambe permet plus de mobilité et de précision dans les coupes ultérieures. - Fixer la jambe sur le support au niveau du pied à l’aide d’une broche et commencer à isoler les muscles squelettiques d’intérêt dans cet ordre: TA, EDL, Gastrocnemius et Soleus.
- Soulevez le tendon inférieur de TA avec une pince à épiler forte à hauteur de cheville et coupez-le, puis coupez-le avec des ciseaux fins tout autour du muscle TA à l’autre tendon au niveau de la rotule (Figure 3A). Transférer dans la solution de digestion.
- Soulevez le tendon inférieur de l’EDL et séparez-le des autres muscles en le tirant doucement vers le haut jusqu’à l’autre tendon. Coupez-le et placez-le dans la solution de digestion.
REMARQUE : Étant donné que l’EDL peut être extrêmement petit à couper séparément de l’AT, ils peuvent être disséqués ensemble (figure 3B). Ensuite, si le muscle entier est trop grand, coupez-le en 2-3 morceaux à partir du tendon et en suivant les fibres dans une direction longitudinale (Figure 3C). - Faire pivoter la jambe montrant les muscles du dos et fixer le pied à l’aide de la broche. Soulevez le tendon de l’Achille, Gastrocnemius se séparera automatiquement des autres muscles. Le tendon supérieur est à l’arrière de la rotule. Coupez-le et ajoutez le muscle à la digestion.
- Soulevez le tendon externe de la jambe (par rapport au corps) et obtenez le Soleus. Séparez-le doucement des autres muscles en faisant défiler sous la pince à épiler.
- Faites de même pour l’autre jambe (étapes de 1.2.7. à 1.2.11.).
- Digestion musculaire
- Incuber la solution de digestion contenant tous les muscles d’un bain d’eau à 37 °C pendant environ 45-50 min. Pendant la digestion, vérifiez régulièrement le muscle pour éviter la sur digestion. Toutes les 10 minutes inversent les tubes de digestion 10x avec un mouvement énergétique (éviter le vortex).
- Arrêter la digestion lorsque les muscles commencent à se desserrer et les myofibers sont visibles.
- À la toute fin du temps de digestion secouer les échantillons.
- Pour arrêter la digestion, transférer soigneusement la suspension de digestion dans une boîte de Pétri préchauffée de 100 mm avec 10 mL de solution de lavage.
NOTE : Évitez la sur digestion musculaire car cela se traduira inévitablement par l’isolement des myofibers hyper-contractés. Habituellement avec ce protocole, les muscles des souris mutantes homozygotes prennent 45 min à digérer, tandis que les muscles des souris de type sauvage prennent 50-55 min. Le temps de digestion doit être validé expérimentalement.
- Isolement des myofibers uniques
- Isoler d’abord les fibres déjà dissociées sous un microscope à dissection en les choisissant individuellement avec une pipette P200 enduite ou un petit trou Pasteur et les transférer du Petri de 100 mm dans une nouvelle boîte de Pétri de 35 mm avec 5 mL de solution de lavage préchauffée.
- Pour libérer d’autres myofibers, pipette le muscle de haut en bas à l’aide d’un grand trou portait pipette en verre avec milieu chaud, jusqu’à ce que les fibres sont libérés mécaniquement. Ne soyez pas trop persistant car cela se traduira par des fibres dommageables.
- Continuer à libérer les myofibers du muscle jusqu’à ce que le plat contienne une quantité souhaitable. Si la boîte de Pétri est conservée à température ambiante pendant plus de 8 min, arrêtez-vous et effectuez une incubation d’au moins 5 min à 37 °C, 5 % de CO2 pour rééquilibrer le milieu.
- Avant de transférer les myofibères simples au milieu de culture, laissez-les à 37 °C, 5% de CO2 dans le plat de lavage pendant au moins 1 h. Cela aide les myofibers à s’adapter à l’état in vitro.
REMARQUE : Les myoibers adultes sont moins sensibles au stress et peuvent être lavés ~ 2-3x. Cependant, dans cet état (à 19 jours d’âge postnatal), il est préférable d’effectuer seulement une étape de lavage pour empêcher des dommages de myofiber. Par conséquent, toujours faire attention à garder les myofibers sélectionnés suffisamment propre en ne transportant pas de débris ou de fibres hypercontractées.
- Culture myofiber unique
- Transférer les myoibers individuels dans un nouveau plat préchauffé avec le milieu de culture approprié (milieu sérique élevé pour permettre l’activation des cellules satellites, voir la figure 1).
- Changez le milieu pour les myofibers isolés, en les transférant dans un nouveau plat enrobé avec un nouveau milieu de culture, seulement après 48-72 h de culture pour éviter tout stress qui conduira à l’hypercontraction et la perturbation des myofibers.
2. Applications en aval : Myofibers crosslinking et immunofluorescence
REMARQUE : Les cellules satellites associées aux myofibers peuvent être visualisées par immunofluorescence (IF) au moment de l’intérêt. Puisque la plupart des protocoles publiés sont optimisés pour effectuer la FI sur les myofibers adultes, ici un protocole détaillé est présenté pour obtenir des résultats fiables également sur les myofibers isolés des muscles postnatals.
- Myofiber crosslinking
- Avant de commencer, préparer toutes les solutions nécessaires décrites dans le tableau 2.
- Précoat avec HS autant de tubes de microcentrifuge de 1,5 mL que le nombre d’échantillons. Assurez-vous de supprimer tous les SH avant de procéder. Puisque les fibres croisées sont plus dures que les fibres vivantes et plus difficiles à pipette, assurez-vous de croiser environ 200-300 fibres séparément par tube.
- Sous un microscope de dissection, recueillir toutes les fibres qui peuvent être considérées comme saines, les transférer au tube de microcentrifuge et laisser le tube vertical pendant 5 min à l’intérieur de l’incubateur pour permettre aux fibres de s’installer.
- Retirer le supernatant très lentement du tube.
- Fibres crosslink en ajoutant 1 mL de 4% de paraformaldéhyde (PFA) à RT au tube. Faites-le doucement pour éviter la détresse des fibres.
- Pour éviter l’entrelacement des fibres pendant le croisement, gardez le tube dans une agitation très douce pendant 10 min.
- Gardez le tube en position verticale pendant 5 min à RT pour permettre aux fibres de s’installer, puis jetez le supernatant en veillant à enlever la majorité du volume PFA.
- Ajouter 1 mL de saline tamponnée de phosphate (PBS) et garder les tubes verticaux pendant 5 min à RT pour laisser les fibres aux sédiments.
- Retirez le supernatant et répétez la procédure de lavage (étape 2.1.8.) deux fois à nouveau.
- Conservez les échantillons croisés à 4 °C.
REMARQUE : Il est possible de conserver les myofibers croisés à 4 °C pendant une semaine. Si les fibres restent plus d’une semaine dans cet état, cela se traduira inévitablement par l’intersiment des myofibers.
- Immunofluorescence
- Gardez les tubes contenant les fibres debout à RT pendant au moins 5 min pour permettre la sédimentation des fibres.
- Retirez le supernatant, en laissant juste un petit volume pour être sûr de ne pas enlever toute fibre.
- Ajouter 1 mL de 0,5% de Triton X-100 en PBS et incuber pendant 5 min avec une légère agitation.
- Mettre les tubes en position verticale pendant 5 min, puis retirer le supernatant.
- Ajouter 1,5 mL de PBS et incuber avec une douce agitation pendant 5 min.
- Maintenir les tubes en position verticale pendant 5 min, puis retirer le supernatant.
- Ajouter 1 mL de solution de blocage et incuber pendant 1 h à RT avec une agitation douce.
- Garder les tubes 5 min en position verticale, puis retirer le supernatant.
- Diluer les anticorps primaires dans la solution de blocage, les ajouter aux tubes et incuber sur nuit à 4 °C dans une agitation douce (pour les concentrations suggérées voir Tableau des matériaux).
REMARQUE : Alternativement, l’anticorps primaire peut être incubé pendant 3 h à RT. Cependant, l’incubation de nuit a donné la coloration optimale. Le volume d’incubation des anticorps primaires et secondaires devrait être de 300 μL lorsque les fibres sédimentées atteignent l’encoche de 100 μL du tube de microcentrifuge de 1,5 m L. Lorsque les fibres sont moins abondantes, un volume de 100-200 μL est recommandé. - Laissez les tubes en position verticale pendant 5 min, puis retirez le supernatant.
- Effectuer 3 lavages en 1 mL de 0,25% Tween-20 en PBS, incuber pendant 5 min dans une agitation douce, puis laisser les tubes debout pendant 5 min à chaque fois.
NOTE: À partir de maintenant, effectuer toutes les étapes dans l’obscurité, pour éviter le blanchiment des fluorochromes. - Diluer les anticorps secondaires dans la solution de blocage, les ajouter aux tubes et incuber pendant 1 h à RT avec une agitation douce (pour les concentrations voir Tableau des matériaux).
- Laver deux fois en 1 mL de 0,1% Tween-20 en PBS, incuber pendant 5 min avec une légère agitation, puis laisser les tubes en position debout pendant 5 min.
- Retirer le supernatant, ajouter 1 mL de solution DAPI et incuber pendant 5 min avec une agitation douce.
- Laisser les tubes reposer verticalement dans un rack pendant 5 min, puis retirer le supernatant.
- Laver avec 1 mL de PBS, incuber pendant 5 min avec une légère agitation, puis laisser les tubes reposer dans une grille pendant 5 min.
- Retirer le supernatant, en laissant un volume d’environ 50 μL.
- Montage de myofibers fluorescents étiquetés sur des lames de microscope
- Couper une pointe de pipette P200 et l’enrober d’une solution de blocage
REMARQUE : Pour enrober la pointe, pipette la solution de haut en bas plusieurs fois avant de ramasser les fibres, ceci évitera des fibres pour coller au mur de pointe. - Recueillir les fibres du tube et les étaler sur une lame de verre microscope.
- Sous un microscope de dissection, en utilisant uniquement la lumière naturelle réfléchie par le miroir, utilisez une nouvelle pointe de pipette P200 (non coupée) pour répandre les fibres et pour enlever l’excès de solution liquide.
- Laisser sécher les lames à l’air dans l’obscurité pendant environ 10-15 min, jusqu’à ce que la très faible quantité de solution reste.
- Ajouter le support de montage sur la lame (la quantité appropriée de support de montage doit être calibrée sur la dimension du couvercle : pour un couvercle de 24 x 40 mm, 20 μL suffit) puis posez lentement un verre de couverture sur la zone contenant les fibres. Veillez à ne pas créer de bulles entre les verres.
- Appuyez sur le couvercle de sorte que les fibres seront couchés sur un plan horizontal unique.
- Fixer le couvercle à l’aide de vernis à ongles.
- Conserver les échantillons à 4 °C jusqu’à 4 semaines.
- Acquérir les images souhaitées de myofibers fluorescents étiquetés avec un microscope confocal.
- Couper une pointe de pipette P200 et l’enrober d’une solution de blocage
Résultats
Nous digérons généralement quatre muscles différents (TA, EDL, Soleus et Gastrocnemius)pour récupérer une bonne quantité de fibres longues et viables qui pourraient survivre 96 h dans le milieu riche en facteurs de croissance (Figure 4A,B). Seules les fibres les plus intactes devraient être transférées dans le milieu de la culture, car elles survivront; tous les autres, qui sont faciles à discriminer et à sélectionner, doivent être écartés.
Lorsque les myofibers sont maintenus dans un système de croissance riche en cellules satellites moyennes dérivés de souris de type sauvage commencent à s’activer et à proliférer, voir la figure 1. À 48 h de culture, en bon état(Lamin Δ8-11 +/+), les cellules satellites upregulent myoD et subissent leur première division. Activées Pax7+/MyoD+ cellules satellites prolifèrent alors et par 72 h en culture, ils génèrent des agrégats cellulaires liés au myofiber, qui sont encore plus visibles à 96 h (Figure 5). Au cours de ces divisions, certains d’entre eux peuvent réprimer l’expression MyoD, subissant l’auto-renouvellement pour repeupler la piscine de cellules souches, tandis que ceux qui maintiennent MyoD s’engagent à la différenciation en réduisant l’expression Pax7. Après 96 h, les groupes de cellules satellites contiennent des cellules committed MyoG+ clairement visibles, qui peuvent se différencier en nouveaux myofibers (figure 1 et figure 6). Notamment, avec cette expérience, nous avons décrit une dynamique retardée de la différenciation cellulaire par satellite chez les souris lamin Δ8-11 mutants homozygotes (-/-) par rapport à leurs homologues de type sauvage (+/+), voir figure 6.
Le résultat final de chaque expérience nous permet de penser que le protocole développé pour l’isolement des myofibers unique et la culture de ce modèle de dystrophie musculaire sévère assure myofibers de bonne qualité pour toutes les autres applications.
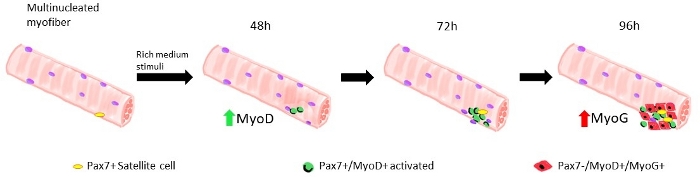
Figure 1 : Représentation graphique des phases régénératrices des cellules satellites modélisées dans des myofibers flottants. Sur 48 h de culture dans les facteurs de croissance riches, les cellules Pax7+ sont activées et subissent la première division, donnant lieu à un doublet de cellules Pax7+/MyoD+. Les cellules positives myoD prolifèrent et se développent, donnant lieu, en 72 h de culture, à un amas de plusieurs cellules qui sont la descendance d’une seule cellule satellite. À 96 h de culture, les cellules Pax7+/MyoD+ deviennent différenciantes les cellules Pax7-/MyoG+. Au cours de la phase d’expansion, un sous-ensemble de cellules Pax7+/MyoD+ downregulate l’expression MyoD subissant l’auto-renouvellement en quiescence. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 2 : Préparation des pipettes pasteur. (A) Vue longitudinale et frontale de l’apparence de la pipette de forage du grand trou. (B) Vue longitudinale et frontale de la façon dont la pipette de forage de petit trou doit finalement apparaître. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
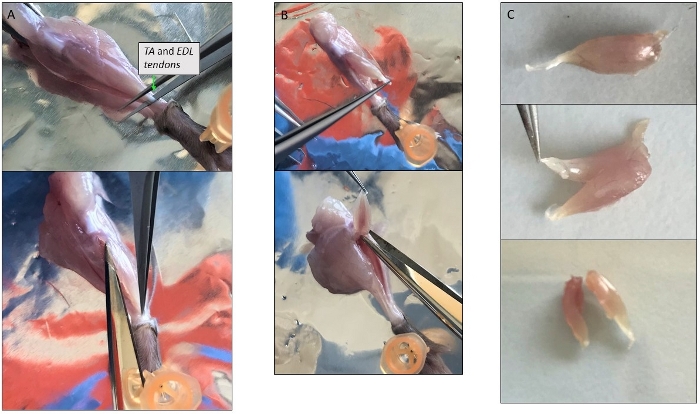
Figure 3 : Photos représentatives de la dissection musculaire unique. (A) Isolement du muscle TA. Éviter l’enlèvement de la couche mince couvrant le muscle protège les myofibers à l’intérieur. (B) Muscles TA et EDL isolés ensemble encore attachés à leur tendon supérieur au niveau de la rotule. (C) Division de TA et EDL après isolement en les coupant le long de l’axe longitudinal. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
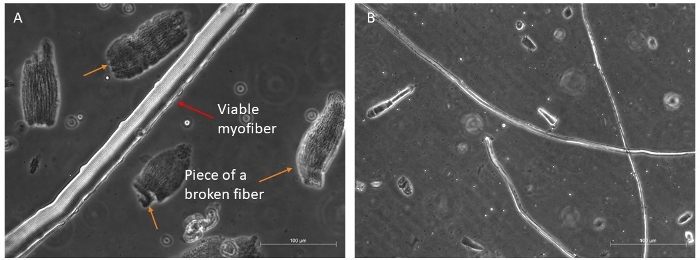
Figure 4 : Exemples de myofibers sains et viables. Phase représentative contraste des images de myofibers viables en suspension. (A) La flèche rouge indique un myofiber avec une organisation sarcomère visible et une cellule satellite sur le côté; les flèches oranges indiquent quelques morceaux de myofibers cassés, et quelques débris présents dans le premier plat avant la sélection finale pour la culture. Barre d’échelle 100 μm. (B) Vue plus complète des autres myofibers sous un grossissement plus petit. Barre d’échelle 500 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
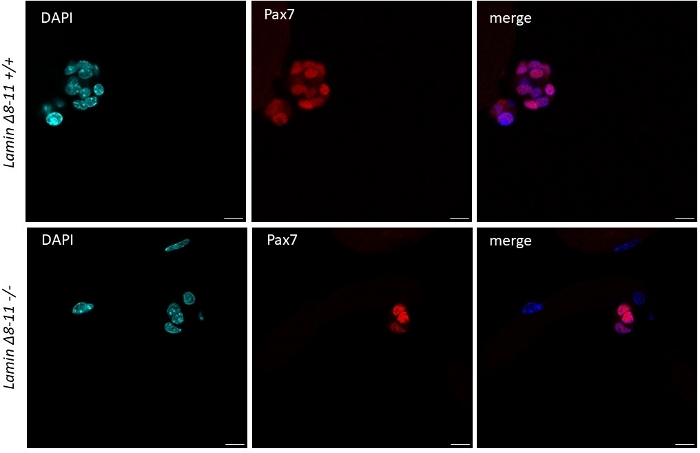
Figure 5 : Différence dans la dimension des grappes de cellules souches chez les souris wt et mutantes. Coloration d’immunofluorescence des myofibers extraites de 19 jours de souris Lamin Δ8-11 (+/+ et -/-) après 96 h de culture. Les cellules satellites Pax7+ sont affichées. La dimension du groupe cellulaire dans la plupart des cas était significativement plus grande chez Lamin Δ8-11 +/+ que chez Lamin Δ8-11 -/- en termes de nombre de cellules. Barre d’échelle 10 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
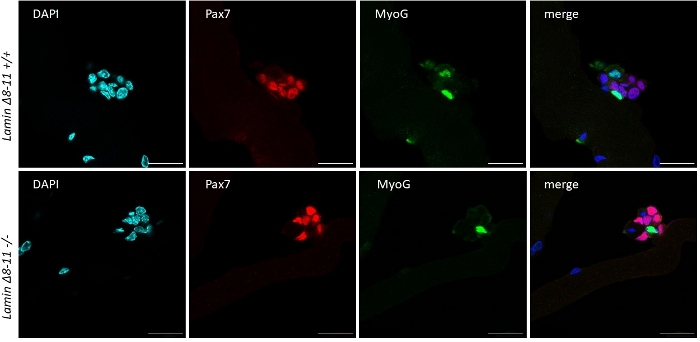
Figure 6 : Expérience d’immunofluorescence représentative. L’expérience d’immunofluorescence a effectué, après 96 h de culture, sur des myofibères extraits de 19 jours de souris Lamin Δ8-11 (+/+ et -/-). Des cellules Pax7+/MyoG- (rouge) et Pax7-/MyoG+ (vertes) ont été observées. Images obtenues au microscope confocal. Barre d’échelle 25 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
| Nom de la solution dans le texte | Composant | Pourcentage | volume/échantillon final suggéré | Notes | |
| solution de lavage | DMEM taux élevé de glucose | 90% | 4 mL | Garder stérile, garder à 4°C jusqu’à l’utilisation | |
| Sérum de cheval (HS) | 10% | ||||
| solution de digestion | DMEM taux élevé de glucose | 9.80% | 20 mL | Poudre extrêmement nocive. Filtrer la solution avec un filtre de 0,22 μm, puis conserver stérile. Conserver à 4°C jusqu’à l’utilisation | |
| Collagène I | 0.20% | ||||
| milieu culturel | DMEM taux élevé de glucose | 78% | 10 mL | Garder stérile, garder à 4°C jusqu’à l’utilisation | |
| Sérum fœtal bovin (FBS) | 20% | ||||
| Extrait d’embryon de poulet (CEE) | 1% | ||||
| Pénicilline-Streptomycine (P/S) | 1% | ||||
Tableau 1 : Recettes de solutions utilisées à la section 1.
| Nom de la solution dans le texte | Composant | Pourcentage | volume/échantillon final suggéré | Notes | |
| 4% PFA | Paraformaldéhyde (PFA) | 4% | 2-3 mL | La poudre puis la solution sont extrêmement nocives | |
| Pbs | 96% | ||||
| 0,5 % Triton X-100 | Triton X-100 | 0.50% | 2-3 mL | Triton X-100 est extrêmement visqueux, coupez préférentiellement la pointe de la pipette pour l’aliquote | |
| Pbs | 99.50% | ||||
| 0,25% Tween-20 | Tween-20 | 0.25% | 10 mL | Tween-20 est extrêmement visqueux, coupez de préférence la pointe de la pipette pour l’aliquoter | |
| Pbs | 99.75% | ||||
| 0,1 % Tween-20 | Tween-20 | 0.10% | 10 mL | Tween-20 est extrêmement visqueux, coupez de préférence la pointe de la pipette pour l’aliquoter | |
| Pbs | 99.90% | ||||
| solution de blocage | Sérum fœtal bovin (FBS) | 10% | 10 mL | Préparer une solution fraîche et conserver à 4°C pendant au plus 3 semaines (vérifiez toujours la clarté avant l’utilisation) | |
| Pbs | 90% | ||||
| Dapi | Dapi | 0.10% | 2-3 mL | Restez dans l’obscurité | |
| Pbs | 99.90% | ||||
Tableau 2 : Recettes de solutions utilisées à la section 2.
Discussion
L’isolement des myofibers uniques intacts est une méthode essentielle dans le domaine de la myogenèse lorsque l’objectif principal est de caractériser les capacités régénératrices autonomes des cellules souches musculaires dans leur niche, dans des conditions saines et pathologiques. Cependant, lorsque les études biochimiques ou génomiques sont intéressantes, les cellules satellites isolées par le FACS pourraient être la meilleure option.
L’isolement des myofibers uniques permet de suivre l’ex-vivo, mais de la manière la plus physiologique, la dynamique de toutes les étapes que subissent les cellules satellites uniques pendant la régénération musculaire, c’est-à-dire : activation, division cellulaire (asymétrique et symétrique), différenciation et retour à la quiescence par auto-renouvellement. Une fois que les myofibers sont cultivés dans des conditions flottantes, les cellules satellites uniques s’activent et se dilatent formant un amas de cellules, toutes provenant de la même cellule satellite. L’analyse de l’immunofluorescence pour les marqueurs de prolifération, de différenciation, d’activation ou de stemness est alors optimale pour quantifier la proportion entre les stades cellulaires.
L’étape clé de notre protocole pour obtenir des myofibers viables et intacts peut être considérée comme la dissection musculaire rapide mais douce, par l’isolement tendon-tendon, pour éviter tout dommage musculaire. Notre conseil est d’utiliser seulement des ciseaux pointus et de petites pinces pointues et de limiter toute la procédure de dissection musculaire à dix minutes. Lorsqu’il est difficile d’isoler de très petits muscles (c.-à-d. EDL et TA), il est possible de les couper ensemble et de les diviser plus tard en utilisant des ciseaux fins coupant le long du plan longitudinal suivant les fibres. Cette stratégie finira par donner moins de myofibers intacts, mais la viabilité ne sera pas compromise. La même chose doit être effectuée sur les grands muscles comme Gastrocnemius pour faciliter la digestion. L’optimisation du temps de digestion, qui doit être validée empiriquement, et la manipulation minimale des fibres isolées sont également deux aspects cruciaux pour le résultat positif de l’analyse ultérieure.
L’avantage du protocole rapporté ici est qu’il peut être appliqué sur de très petites souris (en âge et en dimension), même lorsque leurs muscles sont extrêmement fragiles. Même s’il n’est pas mentionné ci-dessus, il est possible de suivre ce protocole de dissection à la culture myofibers viable pour une plus longue période en utilisant des plats recouverts de membrane de sous-sol18,19. Il est important de considérer que cette situation est complètement différente de la condition flottante, où les stimuli d’adhérence et les stimuli de proximité sont absents.
Déclarations de divulgation
Pas d’intérêts concurrents.
Remerciements
Nous remercions Andrea Bianchi, le Réseau italien de Laminopathies et les membres du laboratoire pour le soutien et tous les commentaires constructifs. Nous sommes reconnaissants à Chiara Cordiglieri pour l’aide précieuse au microscope confocal. Les auteurs remercient la Dre Béatrice Biferali pour son aide dans la prise de photos pour les chiffres. Le travail présenté ici a été soutenu par My First AIRC Grant n. 18535, AFM-Téléthon n. 21030, le ministre italien de la Santé n. GR-2013-02355413 et Cariplo 2017-0649 à C.L. C.M. est soutenu par My First AIRC grant n.18993 et AFM-Téléthon n. 22489.
matériels
| Name | Company | Catalog Number | Comments |
| 4′,6-diamidino-2-phenylindole | Sigma | D9542 | |
| Chicken embryo extract | Seralab | CE650-DL | |
| Collagenase type I | SIGMA | C0130-500MG | |
| Donkey anti-Rabbit 488 antibody | Thermofisher | R37118 | to be used 1:200 |
| Dulbecco's modified Eagle's medium | Gibco | 10569-010 | |
| Fetal bovine serum | Corning | 35-015-CV | |
| Horse serum | Gibco | 26050-088 | |
| MyoG antibody | Millipore | 219998 | to be used 1:100 |
| Paraformaldehyde | SIGMA | P6148 | |
| Pax7 antibody | Developmental studies Hybridoma bank | to be used 1:20 | |
| Penicillin and Streptomycin | Euroclone | ECB3001D | |
| Phosphate saline buffer | Euroclone | ECB4004L | |
| Prolong gold antifade mountant | Thermofisher | P36930 | |
| Triton X-100 | SIGMA | T8787 | |
| Tween-20 | SIGMA | P1379 | |
| Lab equipment | Manufacturer | ||
| Bunsen burner | |||
| Confocal microscope | Leica | ||
| Diamond pen | bio-optica | ||
| Dissection pins | |||
| FACS polypropylene tubes | Falcon | ||
| Falcon tubes (50 and 15 mL) | Falcon | ||
| Glass coverslips | Thermofisher | ||
| Glass Pasteur pipettes (22cm) | VWR | ||
| Glass slides | Thermofisher | ||
| Micro dissecting scissors | |||
| Micropipette (1 mL and 200 µL) | Gilson | ||
| Micropipette tips | Corning | ||
| Petri dishes (100 and 35 mm diameter) | Thermofisher | ||
| Plastic pipettes (5 and 10 mL) | VWR | ||
| Rubber pipette bulbs | VWR | ||
| Sharp tweezers | |||
| Stereo dissection microscope with transmission illumination | Leica | ||
| Tissue culture hood or lamina flow cabinet | |||
| Tissue culture incubator (humidified, 37°C, 5% CO2) | |||
| Water bath at 37°C | VWR |
Références
- Wang, Y. X., Dumont, N. A., Rudnicki, M. A. Muscle stem cells at a glance. Journal of Cell Science. 127 (21), 4543-4548 (2014).
- Le Grand, F., Rudnicki, M. A. Skeletal muscle satellite cells and adult myogenesis. Current Opinion in Cell Biology. 19 (6), 628-633 (2007).
- Zammit, P. S., Partridge, T. A., Yablonka-Reuveni, Z. The Skeletal Muscle Satellite Cell: The Stem Cell That Came in From the Cold. Journal of Histochemistry & Cytochemistry. 54 (11), 1177-1191 (2006).
- Franco, I., et al. Somatic mutagenesis in satellite cells associates with human skeletal muscle aging. Nature Communications. 9 (1), 800 (2018).
- Cosgrove, B. D., et al. Rejuvenation of the muscle stem cell population restores strength to injured aged muscles. Nature Medicine. 20 (3), 255-264 (2014).
- Bernet, J. D., et al. p38 MAPK signaling underlies a cell-autonomous loss of stem cell self-renewal in aged skeletal muscle. Nature Medicine. 20 (3), 265-271 (2014).
- Bianchi, A., et al. Dysfunctional polycomb transcriptional repression contributes to lamin A/C-dependent muscular dystrophy. Journal of Clinical Investigation. 130 (5), 2408-2421 (2020).
- Blau, H. M., Webster, C., Pavlath, G. K. Defective myoblasts identified in Duchenne muscular dystrophy. Proceedings of the National Academy of Sciences. 80 (15), 4856-4860 (1983).
- Jiang, C., et al. Notch signaling deficiency underlies age-dependent depletion of satellite cells in muscular dystrophy. Disease Models & Mechanisms. 7 (8), 997-1004 (2014).
- Vallejo, D., et al. PITX2 Enhances the Regenerative Potential of Dystrophic Skeletal Muscle Stem Cells. Stem Cell Reports. 10 (4), 1398-1411 (2018).
- Danoviz, M. E., Yablonka-Reuveni, Z. Skeletal Muscle Satellite Cells: Background and Methods for Isolation and Analysis in a Primary Culture System. Methods in Molecular Biology. (798), 21-52 (2012).
- Sacco, A., Doyonnas, R., Kraft, P., Vitorovic, S., Blau, H. M. Self-renewal and expansion of single transplanted muscle stem cells. Nature. 456 (7221), 502-506 (2008).
- Bischoff, R. Proliferation of muscle satellite cells on intact myofibers in culture. Developmental Biology. 115 (1), 129-139 (1986).
- Rosenblatt, J. D., Lunt, A. I., Parry, D. J., Partridge, T. A. Culturing satellite cells from living single muscle fiber explants. In Vitro Cellular & Developmental Biology - Animal. 31 (10), 773-779 (1995).
- Shefer, G., Yablonka-Reuveni, Z. Isolation and Culture of Skeletal Muscle Myofibers as a Means to Analyze Satellite Cells. Methods in Molecular Biology. (290), 281-304 (2005).
- Anderson, J. E., Wozniak, A. C., Mizunoya, W. Single Muscle-Fiber Isolation and Culture for Cellular, Molecular, Pharmacological, and Evolutionary Studies. Methods in Molecular Biology. 798, 85-102 (2012).
- Verma, M., Asakura, A. Efficient Single Muscle Fiber Isolation from Alcohol-Fixed Adult Muscle following β-Galactosidase Staining for Satellite Cell Detection. Journal of Histochemistry & Cytochemistry. 59 (1), 60-67 (2011).
- Keire, P., Shearer, A., Shefer, G., Yablonka-Reuveni, Z. Isolation and Culture of Skeletal Muscle Myofibers as a Means to Analyze Satellite Cells. Methods in Molecular Biology. 946 (206), 431-468 (2013).
- Pasut, A., Jones, A. E., Rudnicki, M. A. Isolation and Culture of Individual Myofibers and their Satellite Cells from Adult Skeletal Muscle. Journal of Visualized Experiments. (73), e50074 (2013).
- Gallot, Y., Hindi, S., Mann, A., Kumar, A. Isolation, Culture, and Staining of Single Myofibers. Bio-Protocol. 6 (19), 1942 (2016).
- Liu, L., Cheung, T. H., Charville, G. W., Rando, T. A. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting. Nature Protocols. 10 (10), 1612-1624 (2015).
- Machado, L., et al. In Situ Fixation Redefines Quiescence and Early Activation of Skeletal Muscle Stem Cells. Cell Reports. 21 (7), 1982-1993 (2017).
- Lucini, F., Bianchi, A., Lanzuolo, C. Formaldehyde-mediated snapshot of nuclear architecture. Methods in Molecular Biology. , (2020).
- Sullivan, T., et al. Loss of a-Type Lamin Expression Compromises Nuclear Envelope Integrity Leading to Muscular Dystrophy. The Journal of Cell Biology. 147 (5), 913-920 (1999).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon