Method Article
초기 산후 발달에 있는 에머리 드레이푸스 근 이영양증의 Murine 모형에서 단 근섬유 격리 및 문화
요약
여기서, 우리는 동종구균 돌연변이 라민 Δ8-11 마우스 모델, 에머리-드레이퍼스 근 위축증(EDMD)에 대한 매우 가혹한 모델으로부터 초기 산후 발달 단계에서 단일 근육 섬유를 효율적으로 획득하는 방법을 제안한다.
초록
자가 지배적 인 에머리 드레이퍼스 근이영양증 (EDMD)은 핵 봉투와 핵 봉투의 성분을 유지하는 A 형 핵 라민, 중간 필라멘트 단백질을 인코딩하는 LMNA 유전자의 돌연변이에 의해 발생합니다. 우리는 최근에 EDMD에 있는 근육 낭비가 근육에 영향을 미치는 본질적인 후생유전학 역기능에 기인할 수 있다는 것을 보고했습니다 (위성) 줄기 세포 재생 용량. 단일 근섬유의 격리 및 문화는 섬유와 사르콜렘을 둘러싼 기저 라미나 사이에 남아 있기 때문에 틈새 시장 내에서 위성 세포 행동을 모니터링하는 가장 생리적인 전 생체 접근법 중 하나입니다. 따라서, 다양한 뮤린 모델으로부터 위성 세포를 연구하는 귀중한 실험 패러다임을 나타낸다. 여기서, 우리는 산후 뒷다리 근육(티비아리스 전방, 엑스텐소르 디포룸 롱투스, 위장혈증 및 솔레우스)에서그대로 실행 가능한 단일 근섬유를 분리하는 재적응 된 방법을 설명합니다. 이 프로토콜에 따라, 우리는 라빈 Δ8-11 -/- 생쥐에서 위성 세포를 연구할 수 있었다, 심한 EDMD 뮤린 모델, 출생 후 불과 19 일.
우리는 격리 절차뿐만 아니라 근섬유와 그 관련 위성 세포 유래 자손의 양수를 얻기위한 배양 조건을 자세히 설명합니다. 성장인자가 풍부한 배지에서 배양될 때, 야생형 마우스에서 유래한 위성 세포는 활성화, 증식, 그리고 결국 자기 재생을 분화하거나 겪는다. homozygous Lamin Δ8-11 -/- 돌연변이 마우스에서 이러한 기능은 심각하게 손상된다.
이 기술은, 엄격하게 따르는 경우에, 초기 산후 발달 단계 및 연약한 근육에서조차 근섬유 관련 위성 세포에 연결된 모든 프로세스를 공부할 수 있습니다.
서문
골격 근은 운동 또는 외상 1 후에 재생하는 가장 확장된 능력 중 하나를 가진분화조직이다. 이러한 특성은 주로 줄기 세포의 존재 에 기인, 때문에 기저 라미나와 근섬유의 혈장 사이의 그들의 주변 위치의 위성 세포라고2. 산후 발달 도중, 위성 세포는 증식하고 점진적으로 분화하여, 따라서 골격 근육 성장에 기여합니다. 성인기에 일단, 위성 세포는 가역적인 정지 상태에 들어가고, 생리적 또는 병리학적 외상에, 손상된 근육을 복구하기 위하여 활성화하고, 증식하고 분화하고3. 이러한 상이한 재생 단계를 통해 제대로 통과하고 자기 갱신을 거치는 위성 세포의 용량에 결함이 단단히 근육 낭비에 연결되어, 생리노화동안4,5,,6 또는 근육 이영양증 과 같은 근육 퇴행성 질환에서7,,8,,9,,10.
두 가지 주요 배양 접근법은 위성 세포 전 생체 내 연구를 위해 존재합니다: 단핵 세포에서 1차 근생 배양, 기계적 및 화학적으로 전체근육에서 분리11,,12; 또는 격리된 근섬유의배양(13,,14,,15,16,,17,,18,,,19,,20). 첫 번째 경우, 위성 세포 격리 과정은 마우스에서 추출된 전체 근육의 트리튜레이션, 화학 소화, 여과 및 형광 활성화 세포 정렬(FACS)21을포함한다. 이 절차는 다양한 모델에서 위성 세포를 격리하는 데 효과적이지만 위성 세포를 스트레스에 노출시키고 생리적 틈새 시장을 방해하는 여러 변수를 수반합니다22,,23. 대조적으로, 근섬유 분리는 매트릭스 분해 효소와 줄기 세포에 감소 된 외상을 일으키는 기계적 파쇄와 근육 조직의 부드러운 소화를 포함한다20. 이 두 번째 접근 은 생존 가능한 위성 세포의 훨씬 더 효율적인 검색을 허용, 그 물리적으로 기저 라미나와 사르콜렘 사이 그들의 근섬유에 부착 남아, 따라서 그들의 생리 틈새 시장 내에서 분석을 허용19,,20.
많은 다른 프로토콜은 골격 근육에서 단일 근섬유를 적절하고 효율적으로 분리하기 위해 지난 몇 년 동안 제안되었습니다. 이미 1986 년 Bischoff는 1995 년, 로젠 블라트 등 에서 Flexorum Brevis13에서 섬유를 분리하는 프로토콜을제안했다. 그 이후로, 다른 많은 저자는 엑스텐소 디포럼 롱우스 (EDL) 및 티비아리스 전방 (TA),15,16,,17,18,,19,20과같은 다른 근육에 대한 조정 절차를 제안, 더 연약하더라도, 근육14.,, 그 후 분리된 근섬유는 위성 세포 유래 근막세포의 팽창을 허용하기 위해, 또는 부동 조건에서 최대 96시간, 단일 위성 세포로부터 유래된 자손을 따라갈 수있다(도1). 배양 배지 내의 혈청의 가변 농도는 위성 세포 활성화, 증식 및/또는 분화를 유발하는 데 사용되며, 이러한 상이한 단계1을통해 적절하게 통과할 수 있는 능력을 연구한다.
우리는 최근에 EDMD의 마우스 모델에서 위성 줄기 세포 풀의 고갈 뒤에 후성 유전학 적 메커니즘을 설명, 라빈 Δ8-11 -/- 마우스7. 이 마우스는 일반적으로 나이의 4-8 주 사이 정지 하기 때문에24,심한 근육 손실 때문에, 산후 근육 개발에 우리의 분석을 집중 하 여 질병의 초기 발병의 근본적인 분자 결함을 캡처 하는 시도 했다. 부동 단일 심근섬유는 야생형 및 라민 Δ8-11-/- 돌연변이7 19일 생쥐로부터 분리및 배양되었다. 이 단계에서, 근육 결함은 이미 분명, 하지만 마우스는 여전히 실행 가능한. 그러나, 단일 근섬유 추출을 위한 모든 위에서 언급한 프로토콜이 성인 마우스의 골격 근육에 최적화되었기 때문에, 우리는 우리의 목적에 적응할 필요가 있었습니다: 나이와 크기의 기간에 아주 작은 마우스, 아주 깨지기 쉬운 근섬유. 따라서, 우리는 여기에 Rudnicki 실험실에 의해 제안된 프로토콜의 우리의 재적응을설명합니다 (19 산후 발달 도중 마우스에서 단 하나 실행 가능한 근섬유의 상당수를 얻기 위하여 및 라민 Δ8-11-/- 마우스24에서유래한 것과 같은 가혹한 dystrophic 근육에서. 이 접근법의 최종 목표는 산후 발달의 초기 단계가 관심있을 때 또는 마우스 모델이 기계적 스트레스에 더 취약하게 만드는 특정 질병을 운반하는 마우스 모델의 경우 다른 마우스 모델에서 근섬유 와 관련된 근육 줄기 세포의 연구를위한 표준화 된 절차를 제공하는 것입니다.
프로토콜
모든 실험 절차는 이탈리아 보건부와 기관 동물 관리 및 사용 위원회의 윤리적 승인에 따라 수행되었습니다 (승인 n. 83/2019-PR). 동물들은 이탈리아 밀라노 산 라파엘레 병원의 공인 시설에서 유지되었습니다(승인 n. N. 127/2012-A).
1. 근육 해부 및 근섬유 배양
- 장비 준비.
- 시작하기 전에 표 1에설명된 모든 필요한 솔루션을 준비합니다. 이러한 솔루션은 신선하게 준비되어야 합니다.
- 70%의 에탄올로 시술 중에 사용될 모든 표면과 도구를 청소합니다.
- 마우스 희생으로 시작하기 전에 말 세럼 (HS)을 사용하여 100mm 및 35mm 페트리 접시의 코팅을 수행하십시오. 모든 접시를 코팅하여 근섬유가 플라스틱에 부착되는 것을 방지합니다. 마우스 당 100mm 접시 1개, 35mm 요리 4개를 사용하는 것이 좋습니다.
- HS의 과잉을 제거 한 후, 37 °C에서 인큐베이터에 코팅 된 요리를 30 분 동안 저장합니다. 그런 다음 세척 용액 또는 배양 매체 (마우스 당 35mm 접시 2 개)로 채웁니다.
참고: 덜벡코의 수정된 이글 매체(DMEM)에서 10% HS의 솔루션을 사용하여 접시를 코팅할 수 있습니다. 항상 코팅 된 요리를 사용합니다. 다양한 크기의 문화 요리를 사용할 수 있지만, 작은 차원의 페트리 요리를 추천합니다. - 섬유 절연을 위해 도 2에도시된 것처럼 멸균 파스퇴 파이펫을 준비하십시오. 각 마우스에 대해 근육 처리 및 기계적 분리(도 2A)및 섬유 선택을위한 하나의 작은 구멍 파이펫을 위한 하나의 큰 구멍 보어 파이펫을 준비(도 2B). 각 유리 파이펫을 다이아몬드 펜을 사용하여 원하는 길이와 부드러운 파이펫 가장자리로 잘라냅니다.
- 사용하기 전에 HS로 잠깐 적시어 각 파이펫을 코팅합니다.
- 마우스 희생 과 근육 해부
- 해부 절차를 시작하기 전에 실온에서 10 분 동안 소화 용액을 미리 데우습니다. 폴리 프로필렌 FACS 라운드 하단 튜브는 목적에 가장 적합한 컨테이너입니다.
- 근육 검색의 시작 직전에, 적절한 국가 IACUC 권고에 따라 마우스를 희생.
- 모발을 쉽게 제거하기 위해 피부를 절단하기 전에 70 % 에탄올로 하반신을 적시십시오.
- 알루미늄 종이로 덮인 폴리스티렌의 지지에 마우스를 넣고 뒤쪽의 중간에서 다리 방향으로 피부를 잘라냅니다.
- 근육과 힘줄을 만지지 않고 조심스럽게 피부를 제거합니다. 모든 피부를 찢어 버릴 수 있습니다.
- 마우스의 두 다리를 잘라 신속하게 해부로 진행합니다.
참고: 더 편안하다면 전체 마우스의 해부를 계속할 수 있지만 다리에서 작업하면 이후 컷에서 더 많은 이동성과 정밀도가 가능합니다. - TA, EDL, 위장혈증 및 솔레우스: 핀을 사용하여 발의 수준에서 지지에 다리를 고정하고이 순서에 관심의 골격 근육을 격리 시작합니다.
- 발목 높이에서 날카로운 트위저로 TA의 하부 힘줄을 들어 올리고 잘라낸 다음 TA 근육 주위의 미세 한 가위로 슬개골 수준에서 다른 힘줄로 자른다(그림3A). 소화 용액으로 전달합니다.
- EDL의 낮은 힘줄을 들어 올리고 다른 힘줄까지 부드럽게 위로 당겨 다른 근육과 분리하십시오. 잘라 소화 용액에 넣습니다.
참고: EDL은 TA와 별도로 절단하는 것이 매우 작을 수 있기 때문에 함께 해부될 수있습니다(그림 3B). 그런 다음, 전체 근육이 너무 큰 경우, 힘줄에서 시작하여 경도 방향으로 섬유를 따르는 2-3 개로 자른다(도3C). - 뒤쪽 근육을 보여주는 다리를 회전시키고 핀을 사용하여 다리를 고정합니다. 아킬레의 힘줄을 들어 올리고, 위장혈증은 자동으로 다른 근육과 분리됩니다. 상부 힘줄은 슬개골 뒤쪽에 있습니다. 그것을 잘라 소화에 근육을 추가합니다.
- 다리의 외부 힘줄을 들어 올리고 (신체에 대하여) 솔루스를 얻습니다. 트위저로 아래를 스크롤하여 다른 근육과 부드럽게 분리합니다.
- 다른 다리(1.2.7에서 1.2.11로 단계)에 대해동일한 작업을 수행합니다.
- 근육 소화
- 약 45-50 분 동안 37 °C에서 수조의 모든 근육을 포함하는 소화 용액을 배양하십시오. 소화 시간 동안, 정기적으로 과다 소화를 피하기 위해 근육을 확인. 10분마다 소화관을 10배 반전시키고 활기찬 움직임으로 (소용돌이를 피하십시오).
- 근육이 느슨해지고 근섬유가 보이면 소화를 중지하십시오.
- 소화 시간의 끝에서 샘플을 흔들어.
- 소화를 막기 위해 소화 현탁액을 10mL의 세탁 용액으로 미리 데운 100mm 페트리 접시에 조심스럽게 전달합니다.
참고: 근육 과잉 소화를 피하면 필연적으로 하이퍼 계약 된 심근 섬유의 격리가 발생할 수 있습니다. 일반적으로 이 프로토콜을 사용하면, 동종수 돌연변이 마우스의 근육은 소화되기 위하여 45 분, 야생 형 마우스의 근육은 50-55 분 걸리는 동안. 소화 시간은 실험적으로 검증될 필요가 있습니다.
- 단일 심섬유 절연
- 먼저 코팅 된 P200 파이펫 또는 작은 구멍 파스퇴르로 개별적으로 선택하여 해부 현미경으로 이미 해부 된 섬유를 분리하고 100mm 페트리에서 5 mL의 사전 따뜻하게 세척 용액이있는 새로운 35mm 페트리 접시로 옮기습니다.
- 더 myofibers를 방출하기 위해 섬유가 기계적으로 방출 될 때까지, 따뜻한 매체와 큰 구멍 구멍 구멍 유리 파이펫을 사용하여 근육을 위아래로 파이펫. 이 섬유를 손상 발생할 것입니다 너무 지속되지 마십시오.
- 접시가 바람직한 양을 포함 할 때까지 근육에서 근섬유를 계속 방출. 페트리 접시가 8분 이상 실온에서 보관되면, 중지하고 37°C에서 최소 5분 배양, 5%CO2를 수행하여 배지를 다시 상형화한다.
- 단일 심섬유를 배양 배지로 옮기기 전에, 37°C, 5%CO2를 적어도 1시간 동안 세척 접시에 둡니다. 이것은 근섬유가 체외 상태에 적응하는 것을 돕습니다.
참고: 성인 근섬유는 스트레스에 덜 취약하며 ~ 2-3배 세척할 수 있습니다. 그러나, 이 조건(산후 19일)에서는 근섬유 손상을 방지하기 위해 단 하나의 세척 단계를 수행하는 것이 좋습니다. 따라서, 항상 파편이나 과계약 섬유를 운반하지 않음으로써 선택된 근섬유를 충분히 깨끗하게 유지하기 위해주의를 기울입니다.
- 단일 심섬유 배양
- 개별 심섬유를 적절한 배양 배지로 새로운 사전 데운 접시로 옮기는 것입니다(위성 세포 활성화를 허용하는 높은 혈청 배지, 도 1참조).
- 배지를 분리된 근섬유로 변경하여, 새로운 배양 배지를 가진 새로운 코팅 된 접시로 전송하여, 심섬유 과잉 수축 및 중단으로 이어질 어떤 스트레스를 피하기 위해 문화의 48-72 시간 후에만.
2. 다운스트림 응용 분야: 심섬유교차 연결 및 면역 형광
참고: 근섬유 관련 위성 세포는 관심 시 면역 형광(IF)에 의해 시각화될 수 있다. 게시된 프로토콜의 대부분은 성인 근섬유에 IF를 수행하기 위해 최적화되어 있기 때문에, 여기에 상세한 프로토콜은 산후 근육에서 분리된 근섬유에 대한 신뢰할 수 있는 결과를 얻기 위해 제시된다.
- 근섬유 스크로스링크
- 시작하기 전에 표 2에설명된 모든 필요한 솔루션을 준비합니다.
- HS를 시료 수만큼 1.5mL 마이크로센트심분리기 튜브로 사전 코팅합니다. 진행하기 전에 모든 HS를 제거하십시오. 교차 연결 섬유는 살아있는 섬유보다 강하고 파이펫이 더 어렵기 때문에 튜브 당 약 200-300 섬유를 개별적으로 교차 연결해야합니다.
- 해부 현미경하에서, 건강한 것으로 간주 될 수있는 모든 섬유를 수집, 마이크로 원심 분리기 튜브로 전송하고 섬유가 정착 할 수 있도록 인큐베이터 내부 5 분 동안 수직 튜브를 둡니다.
- 관에서 매우 천천히 상체를 제거합니다.
- 크로스링크 섬유는 RT에 4% 파라포름알데히드(PFA)의 1mL을 튜브에 첨가하여. 섬유의 고민을 피하기 위해 부드럽게 하십시오.
- 교차 연결 중에 섬유가 교차하는 것을 방지하기 위해 튜브를 10 분 동안 매우 부드러운 동요에 유지하십시오.
- 섬유가 정착할 수 있도록 RT에서 5분 동안 튜브를 수직 위치에 두어, 대부분의 PFA 부피를 제거할 수 있도록 상체를 폐기하십시오.
- 포스페이트 완충식식염(PBS) 1mL을 추가하고 RT에서 5분 동안 튜브를 수직으로 유지하여 섬유가 퇴적물을 할 수 있도록 합니다.
- 상체를 제거하고 세척 절차 (단계 2.1.8.)를 두 번 반복하십시오.
- 교차 링크된 샘플을 4°C로 유지합니다.
참고 : 일주일 동안 4 °C에서 교차 된 심섬유를 유지할 수 있습니다. 섬유가이 조건에서 일주일 이상 남아 있는 경우에, 이것은 필연적으로 근섬유 상호 작용귀착될 것입니다.
- 면역형광
- 섬유 침전을 허용하기 위해 적어도 5 분 동안 RT에 서 섬유를 포함하는 튜브를 유지합니다.
- 상체를 제거하여 섬유질을 제거하지 않도록 소량만 둡이 남습니다.
- PBS에 0.5% 트리톤 X-100의 1mL을 추가하고 부드러운 동요로 5 분 동안 배양하십시오.
- 튜브를 수직 위치에 5분 동안 놓은 다음 상체를 제거합니다.
- PBS 1.5mL를 추가하고 부드러운 교반으로 5 분 동안 배양하십시오.
- 튜브를 수직 위치에 5분 동안 유지한 다음 상체를 제거합니다.
- 블로킹 솔루션 1mL을 추가하고 RT에서 1h에 부드러운 교반을 할 수 있습니다.
- 튜브를 수직 위치에 5분 유지한 다음 상체를 제거합니다.
- 차단 용액에서 1 차 적인 항체를 희석시키고, 튜브에 추가하고 부드러운 동요에서 4 °C에서 밤새 배양하십시오 (권장 농도는 재료 의 표를참조하십시오).
참고: 대안적으로, 1차 항체는 RT에서 3시간 동안 배양될 수 있다. 그러나 하룻밤 잠복은 최적의 염색을 주었습니다. 1차 및 이차 항체모두에 대한 배양 부피는 퇴적섬유가 1.5mL 마이크로센심분리기 튜브의 100 μL 노치에 도달할 때 300 μL이어야 한다. 섬유가 덜 풍부하면 100-200 μL의 부피를 권장합니다. - 튜브를 수직 위치에 5분 동안 방치한 다음 상체를 제거합니다.
- PBS에서 0.25% Tween-20의 1mL에서 3개의 세서스를 수행하고, 부드러운 동요로 5분 동안 배양한 다음 튜브를 매번 5분 동안 방치합니다.
참고 : 여기에서, 불소 크롬 표백을 방지하기 위해, 어둠 속에서 모든 단계를 수행. - 차단 용액에 이차 항체를 희석하고, 튜브에 추가하고 부드러운 교반으로 RT에서 1 h에 대한 배양 (농도는 재료의 표를참조하십시오).
- PBS에서 0.1% Tween-20의 1mL로 두 번 세척하고 부드러운 동요로 5 분 동안 배양한 다음 튜브를 5 분 동안 서있는 위치에 둡시.
- 상체를 제거하고 DAPI 솔루션 1mL을 추가하고 부드러운 교반으로 5 분 동안 배양하십시오.
- 튜브가 랙에 수직으로 5분 동안 서게 한 다음 상체를 제거합니다.
- PBS 1mL로 세척하고 부드러운 교반으로 5 분 동안 배양 한 다음 튜브를 5 분 동안 랙에 둡시하십시오.
- 상체를 제거하여 약 50 μL의 부피를 남깁니다.
- 현미경 슬라이드에 형광 표시 근섬유의 장착
- P200 파이펫 팁을 잘라 블로킹 솔루션으로 코팅
참고: 섬유를 따기 전에 용액을 여러 번 위아래로 피펫으로 코팅하려면 섬유가 팁 벽에 달라붙지 않도록 합니다. - 튜브에서 섬유를 수집하고 현미경 유리 슬라이드에 확산.
- 해부 현미경에서, 거울에 의해 반사되는 자연 광만을 사용하여, 섬유를 확산하고 여분의 액체 용액을 제거하기 위해 새로운 (절단되지 않음) P200 파이펫 팁을 사용합니다.
- 매우 낮은 양의 용액이 남아있을 때까지 약 10-15 분 동안 어둠 속에서 건조 슬라이드를 둡니다.
- 슬라이드에 장착 매체를 추가 (적절한 양의 장착 매체는 커버 슬립의 치수에 보정되어야한다 : 24 x 40mm 커버 슬립, 20 μL은 충분하다) 섬유를 포함하는 영역에 커버 유리를 천천히 놓는다. 안경 사이에 거품을 만들지 않도록 주의하십시오.
- 섬유가 단일 수평 계획에 놓이게 되도록 커버슬립을 누릅니다.
- 매니큐어를 사용하여 커버 슬립을 수정합니다.
- 샘플을 최대 4주 동안 4°C로 저장합니다.
- 공초점 현미경으로 형광성 표지된 근섬유의 원하는 이미지를 획득한다.
- P200 파이펫 팁을 잘라 블로킹 솔루션으로 코팅
결과
우리는 전형적으로 4개의 다른 근육 (TA, EDL, 솔레루스 및 Gastrocnemius)를소화하여 성장 인자 풍부한 매체에서 96 h를 살아남을 수있는 길고 실행 가능한 섬유의 좋은 양을 회수합니다(그림 4A, B). 가장 온전한 섬유만이 생존할 수 있기 때문에 배양 매체로 옮겨져야 합니다. 차별하고 선택하기 쉬운 다른 모든 것들은 폐기해야 합니다.
근섬유가 야생형 마우스로부터 유래된 성장인자 풍부한 중형 위성 세포에서 유지되면 활성화및 증식하기 시작하면 도 1을참조한다. 배양의 48 h에 따라, 건강한 상태(라민 Δ8-11 +/+), 위성 세포는 MyoD를 업규제하고 첫 번째 부문을 겪는다. 활성화 된 Pax7+/MyoD+ 위성 세포는 배양시 72h로 증식하고, 96h(그림5)에서더욱 보이는 근섬유에 바인딩된 세포 응집체를 생성합니다. 이러한 분열 동안, 그들 중 일부는 줄기 세포 풀을 다시 채우기 위해 자기 갱신을 겪고, MyoD를 유지하는 사람들은 Pax7 표현을 다운 조절하여 차별화에 최선을 다하고있는 동안, MyoD 표현을 억압 할 수 있습니다. 96h 후, 위성 세포 클러스터는 명확하게 눈에 보이는 MyoG + 커밋된 세포를 포함, 그 새로운 심섬유로 분화 할 수(그림 1 및 도 6). 특히, 이 실험을 통해, 우리는 그들의 야생 형 대응 (+/+)에 비해 호머자구스 돌연변이 라빈 Δ8-11 마우스 (-/-)에서 위성 세포 분화의 지연된 역학을 설명, 도 6을참조하십시오.
각 단일 실험의 최종 결과는 우리가 심각한 근육 이영양증의이 모델에서 단일 근섬유 격리 및 문화를 위해 개발 된 프로토콜이 모든 추가 응용 프로그램에 대한 좋은 품질의 근섬유를 보장한다고 생각할 수 있습니다.
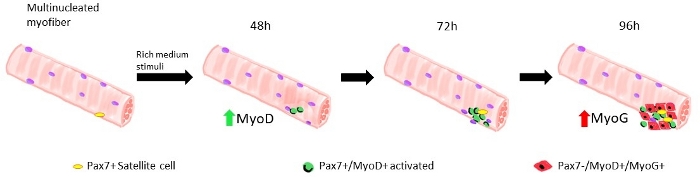
그림 1: 부동 심근섬유를 모델로 한 위성 세포의 재생 단계의 그래픽 표현. 성장 인자가 풍부한 매체에서 배양의 48 h에 따라, Pax7+ 세포는 활성화되고 첫번째 분열을 겪습니다, Pax7+/MyoD+ 세포의 이중을 초래하는. MyoD 양성 세포는 그 때 증식하고 팽창하고, 증가, 배양의 72 h에서, 단일 위성 세포의 자손인 몇몇 세포의 클러스터로. 배양 Pax7+/MyoD+ 세포의 96h에 따라 Pax7-/MyoG+ 세포를 분화하게 합니다. 확장 단계에서 Pax7+/MyoD+ 셀의 하위 집합은 자가 갱신을 통해 퀴스콘션으로 자체 갱신을 받는 MyoD 발현을 다운규제합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 보어 파스퇴르 파이펫 준비. (A)큰 구멍 보어 파이펫이 어떻게 나타나야 하는지에 대한 경도 및 정면 보기. (B)작은 구멍 보어 파이펫이 마침내 나타나야 하는 방법의 경도 및 정면 보기. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
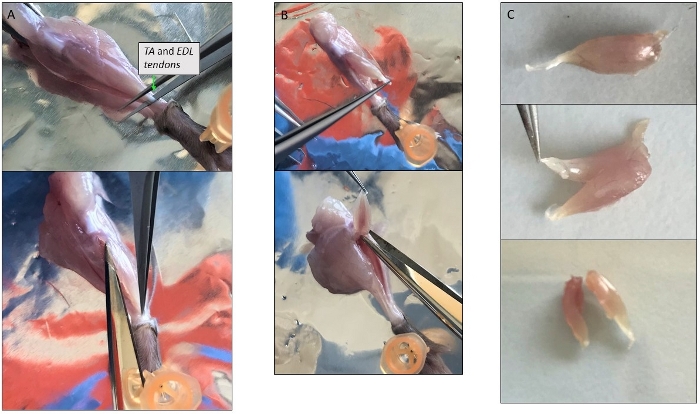
그림 3: 단일 근육 해부의 대표적인 사진입니다. (A)TA 근육의 격리. 근육을 덮는 얇은 층의 제거를 피함으로써 내부의 근섬유질을 보호합니다. (B)TA와 EDL 근육은 슬개골 의 수준에서 그들의 상부 힘줄에 여전히 부착된 함께 분리됩니다. (C)종방향 축을 따라 절단하여 격리 후 TA 및 EDL의 분할. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
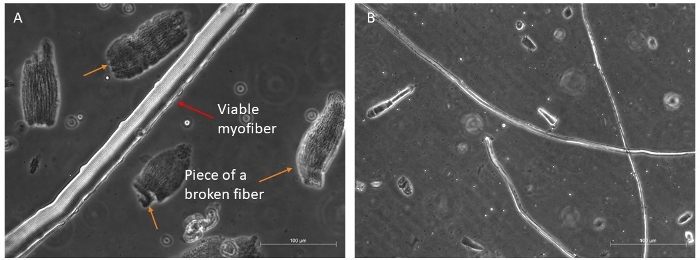
그림 4: 건강하고 실행 가능한 근섬유의 예. 서스펜션에서 실행 가능한 근섬유의 대표적인 위상 대비 이미지. (A)적색 화살표는 눈에 보이는 sarcomere 조직과 그 측면에 위성 세포가있는 근섬유를 나타냅니다. 주황색 화살표는 깨진 근섬유의 일부 조각을 나타내고, 문화에 대한 최종 선택 전에 첫 번째 접시에 존재하는 일부 파편. 스케일 바 100 μm.(B)더 작은 배율 하에서 다른 근섬유의 더 완전한 보기. 배율 막대 500 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
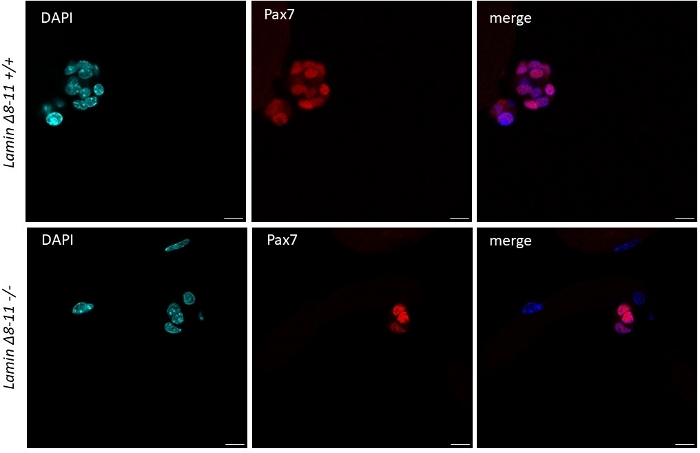
그림 5: wt 및 돌연변이 마우스에서 줄기 세포 클러스터의 치수차이. 19일 부터 추출된 근섬유의 면역형광 염색(+/++및---)은 96h의 배양 후 추출하였다. Pax7+ 위성 셀이 표시됩니다. 대부분의 경우 셀 클러스터의 치수는 라빈 Δ8-11 +/+에서 셀 수 측면에서 라빈 Δ8-11-/-에서보다 훨씬 더 컸다. 배율 막대 10 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
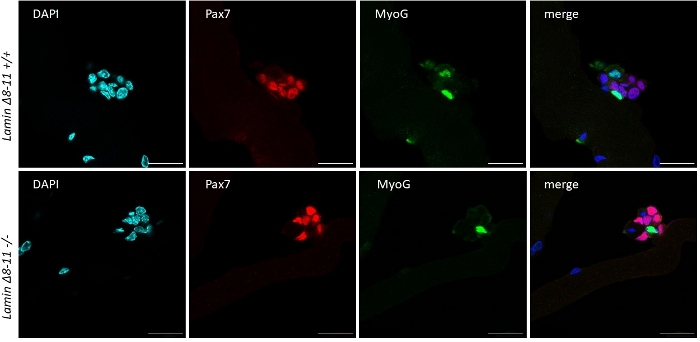
그림 6: 대표적인 면역형광 실험. 면역형광 실험은 19일 라민 Δ8-11 마우스(+/++및-/--)로부터 추출된 근섬유에 대한 96h의 배양 후 수행하였다. Pax7+/MyoG-(적색) 및 Pax7-/MyoG+(녹색) 세포가 관찰되었다. 공초점 현미경으로 얻은 이미지. 배율 막대 25 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 텍스트의 솔루션 이름 | 구성 요소 | 비율 | 제안된 최종 볼륨/샘플 | 노트 | |
| 세탁 용액 | DMEM 높은 포도당 | 90% | 4 mL | 멸균을 유지하고 사용량이 될 때까지 4 °C에서 보관하십시오. | |
| 말 세럼 (HS) | 10% | ||||
| 소화 용액 | DMEM 높은 포도당 | 9.80% | 20mL | 매우 유해한 분말. 0.22μm 필터로 용액을 걸은 다음 멸균을 유지합니다. 사용량이 될 때까지 4°C로 유지 | |
| 콜라게나제 I | 0.20% | ||||
| 문화 매체 | DMEM 높은 포도당 | 78% | 10mL | 멸균을 유지하고 사용량이 될 때까지 4 °C에서 보관하십시오. | |
| 태아 소 혈청 (FBS) | 20% | ||||
| 닭 배아 추출물 (CEE) | 1% | ||||
| 페니실린-연쇄절제술 (P/S) | 1% | ||||
표 1: 섹션 1에 사용되는 솔루션에 대한 조리법.
| 텍스트의 솔루션 이름 | 구성 요소 | 비율 | 제안된 최종 볼륨/샘플 | 노트 | |
| PFA 4% | 파라포름데히드 (PFA) | 4% | 2-3 mL | 분말 및 용액은 매우 유해합니다. | |
| Pbs | 96% | ||||
| 0.5% 트리톤 X-100 | 트리톤 X-100 | 0.50% | 2-3 mL | 트리톤 X-100은 매우 점성이 있으며, 피펫 끝을 우대적으로 잘라 알리쿼트합니다. | |
| Pbs | 99.50% | ||||
| 0.25% 트위엔-20 | 트웬-20 | 0.25% | 10mL | Tween-20은 매우 점성이 있으며, 피펫 끝을 우대적으로 잘라 알리쿼트합니다. | |
| Pbs | 99.75% | ||||
| 0.1% 트위엔-20 | 트웬-20 | 0.10% | 10mL | Tween-20은 매우 점성이 있으며, 피펫 끝을 우대적으로 잘라 알리쿼트합니다. | |
| Pbs | 99.90% | ||||
| 차단 솔루션 | 태아 소 혈청 (FBS) | 10% | 10mL | 신선한 솔루션을 준비하고 3주 이상 4°C에 보관하십시오(항상 사용 전에 명확성을 확인) | |
| Pbs | 90% | ||||
| DAPI | DAPI | 0.10% | 2-3 mL | 어둠 속에서 유지 | |
| Pbs | 99.90% | ||||
표 2: 섹션 2에 사용되는 솔루션에 대한 조리법.
토론
그대로 단일 근섬유의 분리는 주요 목적이 그들의 틈새 시장 내에서 근육 줄기 세포의 세포 자율 재생 용량을 특성화하는 것입니다 때 근신생 의 분야에서 필수적인 방법입니다, 건강하고 병리학적인 조건에서. 그러나 생화학적 또는 유전체 연구가 관심이있을 때 FACS 격리 위성 세포가 최선의 선택이 될 수 있습니다.
단일 심섬유 격리는 전 생체 외를 따를 수 있지만, 가장 생리적인 방법으로, 단일 위성 세포가 근육 재생 중에 겪는 모든 단계의 역학, 즉 활성화, 세포 분열 (비대칭 및 대칭), 분화 및 자기 갱신에 의한 퀴시즈로 돌아갑니다. 근섬유가 부동 조건에서 성장하면 단일 위성 세포가 활성화되어 확장하여 동일한 위성 세포에서 파생됩니다. 증식, 분화, 활성화 또는 줄기 마커를 위한 면역 형광 분석은 세포 단계 사이의 비율을 정량화하는 것이 최적입니다.
실행 가능하고 그대로 근섬유를 얻기 위한 프로토콜의 핵심 단계는 힘줄에서 힘줄 간 격리에 의하여 근육 손상을 피하기 위해 빠르지만 부드러운 근육 해부로 간주될 수 있습니다. 우리의 조언은 날카로운 가위와 작은 날카로운 핀셋만 사용하고 전체 근육 해부 절차를 10 분으로 제한하는 것입니다. 아주 작은 근육(즉, EDL 및 TA)을 분리하기가 어려울 때, 섬유에 따른 세로 계획을 따라 절단된 미세 가위를 사용하여 함께 절단하고 나중에 분할할 수 있습니다. 이 전략은 결국 덜 그대로 근섬유를 줄 것이다, 하지만 생존은 손상되지 않습니다. 소화를 용이하게 하기 위해 위트로크리혈증과 같은 큰 근육에서도 동일한 결과를 수행해야 합니다. 경험적으로 검증되어야 하는 소화 시간의 최적화, 격리된 섬유의 최소한의 조작은 후속 분석의 긍정적인 결과에 대한 두 가지 중요한 측면이기도 합니다.
여기에 보고된 프로토콜의 장점은 근육이 매우 연약하더라도 매우 작은 쥐 (나이와 차원에서)에 적용 될 수 있다는 것입니다. 위에서 언급하지 않더라도, 지하 막 코팅 된 접시18,,19를사용하여 장기간 동안 가능한 근섬유를 배양하기 위해 해부의 이 프로토콜을 따를 수 있다. 이 상황은 접착 자극과 근접 자극이 없는 부동 상태와 완전히 다르다는 것을 고려하는 것이 중요합니다.
공개
경쟁적인 관심사가 없습니다.
감사의 말
우리는 안드레아 비안치, 라미노 파리스의 이탈리아 네트워크와 지원과 모든 건설적인 의견에 대한 실험실의 구성원을 감사드립니다. 우리는 공초점 현미경에서 귀중한 도움에 대한 키아라 코르디글리에감사드립니다. 저자는 베아트리체 비페랄리 박사에게 그림 촬영을 도와준 것에 대해 감사를 표합니다. 여기에 제시 된 작품은 내 첫 번째 AIRC 그랜트 n에 의해 지원되었다. 18535, AFM-Telethon n. 21030, 이탈리아 보건 장관 n. GR-2013-02355413 및 Cariplo 2017-0649 to C.L. C.M.은 나의 첫 번째 AIRC 보조금 n.18993 및 AFM-Telethon n249.
자료
| Name | Company | Catalog Number | Comments |
| 4′,6-diamidino-2-phenylindole | Sigma | D9542 | |
| Chicken embryo extract | Seralab | CE650-DL | |
| Collagenase type I | SIGMA | C0130-500MG | |
| Donkey anti-Rabbit 488 antibody | Thermofisher | R37118 | to be used 1:200 |
| Dulbecco's modified Eagle's medium | Gibco | 10569-010 | |
| Fetal bovine serum | Corning | 35-015-CV | |
| Horse serum | Gibco | 26050-088 | |
| MyoG antibody | Millipore | 219998 | to be used 1:100 |
| Paraformaldehyde | SIGMA | P6148 | |
| Pax7 antibody | Developmental studies Hybridoma bank | to be used 1:20 | |
| Penicillin and Streptomycin | Euroclone | ECB3001D | |
| Phosphate saline buffer | Euroclone | ECB4004L | |
| Prolong gold antifade mountant | Thermofisher | P36930 | |
| Triton X-100 | SIGMA | T8787 | |
| Tween-20 | SIGMA | P1379 | |
| Lab equipment | Manufacturer | ||
| Bunsen burner | |||
| Confocal microscope | Leica | ||
| Diamond pen | bio-optica | ||
| Dissection pins | |||
| FACS polypropylene tubes | Falcon | ||
| Falcon tubes (50 and 15 mL) | Falcon | ||
| Glass coverslips | Thermofisher | ||
| Glass Pasteur pipettes (22cm) | VWR | ||
| Glass slides | Thermofisher | ||
| Micro dissecting scissors | |||
| Micropipette (1 mL and 200 µL) | Gilson | ||
| Micropipette tips | Corning | ||
| Petri dishes (100 and 35 mm diameter) | Thermofisher | ||
| Plastic pipettes (5 and 10 mL) | VWR | ||
| Rubber pipette bulbs | VWR | ||
| Sharp tweezers | |||
| Stereo dissection microscope with transmission illumination | Leica | ||
| Tissue culture hood or lamina flow cabinet | |||
| Tissue culture incubator (humidified, 37°C, 5% CO2) | |||
| Water bath at 37°C | VWR |
참고문헌
- Wang, Y. X., Dumont, N. A., Rudnicki, M. A. Muscle stem cells at a glance. Journal of Cell Science. 127 (21), 4543-4548 (2014).
- Le Grand, F., Rudnicki, M. A. Skeletal muscle satellite cells and adult myogenesis. Current Opinion in Cell Biology. 19 (6), 628-633 (2007).
- Zammit, P. S., Partridge, T. A., Yablonka-Reuveni, Z. The Skeletal Muscle Satellite Cell: The Stem Cell That Came in From the Cold. Journal of Histochemistry & Cytochemistry. 54 (11), 1177-1191 (2006).
- Franco, I., et al. Somatic mutagenesis in satellite cells associates with human skeletal muscle aging. Nature Communications. 9 (1), 800 (2018).
- Cosgrove, B. D., et al. Rejuvenation of the muscle stem cell population restores strength to injured aged muscles. Nature Medicine. 20 (3), 255-264 (2014).
- Bernet, J. D., et al. p38 MAPK signaling underlies a cell-autonomous loss of stem cell self-renewal in aged skeletal muscle. Nature Medicine. 20 (3), 265-271 (2014).
- Bianchi, A., et al. Dysfunctional polycomb transcriptional repression contributes to lamin A/C-dependent muscular dystrophy. Journal of Clinical Investigation. 130 (5), 2408-2421 (2020).
- Blau, H. M., Webster, C., Pavlath, G. K. Defective myoblasts identified in Duchenne muscular dystrophy. Proceedings of the National Academy of Sciences. 80 (15), 4856-4860 (1983).
- Jiang, C., et al. Notch signaling deficiency underlies age-dependent depletion of satellite cells in muscular dystrophy. Disease Models & Mechanisms. 7 (8), 997-1004 (2014).
- Vallejo, D., et al. PITX2 Enhances the Regenerative Potential of Dystrophic Skeletal Muscle Stem Cells. Stem Cell Reports. 10 (4), 1398-1411 (2018).
- Danoviz, M. E., Yablonka-Reuveni, Z. Skeletal Muscle Satellite Cells: Background and Methods for Isolation and Analysis in a Primary Culture System. Methods in Molecular Biology. (798), 21-52 (2012).
- Sacco, A., Doyonnas, R., Kraft, P., Vitorovic, S., Blau, H. M. Self-renewal and expansion of single transplanted muscle stem cells. Nature. 456 (7221), 502-506 (2008).
- Bischoff, R. Proliferation of muscle satellite cells on intact myofibers in culture. Developmental Biology. 115 (1), 129-139 (1986).
- Rosenblatt, J. D., Lunt, A. I., Parry, D. J., Partridge, T. A. Culturing satellite cells from living single muscle fiber explants. In Vitro Cellular & Developmental Biology - Animal. 31 (10), 773-779 (1995).
- Shefer, G., Yablonka-Reuveni, Z. Isolation and Culture of Skeletal Muscle Myofibers as a Means to Analyze Satellite Cells. Methods in Molecular Biology. (290), 281-304 (2005).
- Anderson, J. E., Wozniak, A. C., Mizunoya, W. Single Muscle-Fiber Isolation and Culture for Cellular, Molecular, Pharmacological, and Evolutionary Studies. Methods in Molecular Biology. 798, 85-102 (2012).
- Verma, M., Asakura, A. Efficient Single Muscle Fiber Isolation from Alcohol-Fixed Adult Muscle following β-Galactosidase Staining for Satellite Cell Detection. Journal of Histochemistry & Cytochemistry. 59 (1), 60-67 (2011).
- Keire, P., Shearer, A., Shefer, G., Yablonka-Reuveni, Z. Isolation and Culture of Skeletal Muscle Myofibers as a Means to Analyze Satellite Cells. Methods in Molecular Biology. 946 (206), 431-468 (2013).
- Pasut, A., Jones, A. E., Rudnicki, M. A. Isolation and Culture of Individual Myofibers and their Satellite Cells from Adult Skeletal Muscle. Journal of Visualized Experiments. (73), e50074 (2013).
- Gallot, Y., Hindi, S., Mann, A., Kumar, A. Isolation, Culture, and Staining of Single Myofibers. Bio-Protocol. 6 (19), 1942 (2016).
- Liu, L., Cheung, T. H., Charville, G. W., Rando, T. A. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting. Nature Protocols. 10 (10), 1612-1624 (2015).
- Machado, L., et al. In Situ Fixation Redefines Quiescence and Early Activation of Skeletal Muscle Stem Cells. Cell Reports. 21 (7), 1982-1993 (2017).
- Lucini, F., Bianchi, A., Lanzuolo, C. Formaldehyde-mediated snapshot of nuclear architecture. Methods in Molecular Biology. , (2020).
- Sullivan, T., et al. Loss of a-Type Lamin Expression Compromises Nuclear Envelope Integrity Leading to Muscular Dystrophy. The Journal of Cell Biology. 147 (5), 913-920 (1999).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유