Method Article
Одноместный Myofiber изоляции и культуры от Мюрин Модель Эмери-Дрейфус мышечной дистрофии в начале послеродового развития
В этой статье
Резюме
Здесь мы предлагаем метод для эффективного получения одно мышечных волокон на ранних послеродовых стадиях развития от гомозиготной мутант Ламина 8-11 мыши модели, очень тяжелой модели для Эмери-Дрейфусс мышечной дистрофии (EDMD).
Аннотация
Аутосомно-доминирующая мышечная дистрофия Эмери-Дрейфуса (EDMD) вызвана мутациями в гене LMNA, который кодирует ядерные ламины типа А, промежуточные нити, которые поддерживают ядерную оболочку и компоненты нуклеоплазмы. Недавно мы сообщили, что мышечная трата в EDMD может быть приписана внутренней эпигенетической дисфункции, влияющие на мышцы (спутник) стволовых клеток регенеративной способности. Изоляция и культура одиночных миофиберов является одним из самых физиологических подходов экс-виво для мониторинга поведения спутниковых клеток в своей нише, так как они остаются между базальной ламиной, окружающей волокно, и сарколеммой. Таким образом, он представляет собой бесценную экспериментальную парадигму для изучения спутниковых клеток из различных моделей мурина. Здесь мы описываем повторно адаптированный метод, чтобы изолировать нетронутыми и жизнеспособные одиночные миофиберы из послеродовых мышц заднего мозга(Tibialis Anterior, Extensor Digitorum Longus, Gastrocnemius и Soleus). Следуя этому протоколу, мы смогли изучить спутниковые клетки из Ламина No8-11 -/- мышей, тяжелой модели EDMD murine, всего через 19 дней после рождения.
Мы подробно процедуры изоляции, а также культурные условия для получения хорошего количества миофиберов и связанных с ними спутниковых клеток полученных потомства. Когда культивируется в росте-факторов богатых средних, спутниковые клетки, полученные от диких мышей типа активировать, размножаться, и в конечном итоге дифференцировать или пройти самообновление. У гомозиготных ламинов No8-11 -/- мышей-мутантов эти возможности серьезно нарушены.
Этот метод, если строго соблюдаться, позволяет изучать все процессы, связанные с миофибером спутниковой клетки даже на ранних постродовых стадиях развития и в хрупких мышцах.
Введение
Скелетная мышца является дифференцированной ткани с одним из наиболее расширенной способности к регенерации после физических упражнений или травмы1. Эта характеристика в основном из-за присутствия стволовых клеток, называемых спутниковых клеток из-за их периферического положения между базальной ламиной и плазмалемоймиофибера 2. Во время послеродового развития спутниковые клетки размножаются и постепенно дифференцируются, способствуя тем самым росту скелетных мышц. После того, как в зрелом возрасте, спутниковые клетки входят в обратимое состояние покоя, и при физиологической или патологической травмы, они активируются, размножаются и дифференцируются для того, чтобы восстановить поврежденные мышцы3. Дефекты в способности спутниковых клеток правильно транзита через эти различные регенеративные фазы и пройти самообновление были прочно связаны с мышечной тратой, либо во время физиологического старения4,,5,6 или в мышечных дегенеративных заболеваний, таких как мышечная дистрофия7,8,9,10.
Существуют два основных подхода к культуре для изучения спутниковых клеток ex-vivo: первичные миогенные культуры из мононуклеированных клеток, механически и химически отмежеваемые от целых мышц11,12; или культура изолированных миофиберов13,14,15,16,,17,18,19,20. В первом случае процесс изоляции спутниковых клеток включает в себя тритурацию целых мышц, извлеченных из мыши, химическое пищеварение, фильтрацию и флуоресцентную активированную сортировку клеток (FACS)21. Эта процедура, хотя и эффективна в изоляции спутниковых клеток от различных моделей, влечет за собой несколько переменных, которые подвергают спутниковые клетки стрессу и нарушает их физиологическую нишу22,23. В отличие от этого, миофибер изоляции включает в себя мягче переваривания мышечной ткани с матрицы деградации ферментов и механического измельчения, что приводит к снижению травмы стволовых клеток20. Этот второй подход позволяет гораздо более эффективное извлечение жизнеспособных спутниковых клеток, которые остаются физически привязаны к их миофибер между базальной ламиной и сарколеммой, тем самым позволяя анализ в их физиологической нише19,20.
Много различных протоколов были предложены в течение последних лет, чтобы правильно и эффективно изолировать один миофиберов от скелетных мышц. Уже в 1986 году Бишофф предложил протокол, чтобы изолировать волокна от Flexorum Brevis13, а затем, в 1995 году, Rosenblatt и др. изменили протокол, чтобы получить более эффективное разделение миофиберов14. С тех пор многие другие авторы предложили скорректированные процедуры на другие мышцы, такие как Extensor Digitorum Longus (EDL) и Tibialis Anterior (TA)15,16,17,18,19,20, которые длиннее, даже если более хрупкими, мышцы14.16 Изолированные миофиберы могут быть культивированы как в спайке, чтобы позволить расширение спутниковых клеток, полученных миобласты, или в плавучих условиях, до 96 часов, чтобы следовать потомству, полученному из одной спутниковой клетки19 (Рисунок 1). Переменные концентрации сыворотки в среде культуры используются для запуска активации, пролиферации и/или дифференциации спутниковых клеток для изучения их способности правильно проходить через эти различные фазы1.
Недавно мы описали эпигенетический механизм за истощение пула стволовых клеток спутника в мышиной модели EDMD, Ламин 8-11 -/- мышь7. Так как эти мыши обычно умирают в возрасте 4-8 недель в возрасте24, из-за тяжелой потери мышечной массы, была предпринята попытка захватить молекулярные дефекты, лежащие в основе раннего начала заболевания, сосредоточив наш анализ на послеродовое развитие мышц. Плавающие одиночные миофиберы были изолированы и культивирулись от дикого типа и Ламина No8-11 -/-мутантов 7 19 дней-старых мышей. На данном этапе, мышечные дефекты уже очевидны, но мыши по-прежнему жизнеспособны. Однако, поскольку все вышеперечисленные протоколы для самостоятельной извлечения миофиберов были оптимизированы для скелетных мышц взрослых мышей, нам нужно было адаптировать их к нашим целям: очень маленьким мышам по возрасту и размеру, и очень хрупким миофиберам. Таким образом, мы описываем здесь нашу переадаптацию протокола, предложенного лабораториейРудницкого 19 для получения значительного количества одинных жизнеспособных миофиберов от мышей во время послеродового развития и от тяжелых дистрофических мышц, таких как те, которые получены из Ламина 8-11 -/- мышей24. Конечная цель этого подхода заключается в предоставлении стандартизированной процедуры для изучения миофиберов связанных мышечных стволовых клеток в любой другой модели мыши, когда ранние стадии послеродового развития представляют интерес, или в случае мышиных моделей проведения каких-либо конкретных заболеваний, что делает миофиберы более восприимчивы к механическому стрессу.
протокол
Все экспериментальные процедуры проводились в соответствии с этическим одобрением Министерства здравоохранения Италии и Институционального комитета по уходу и использованию животных (авторизация No 83/2019-PR). Эти животные находились в разрешенном учреждении больницы Сан-Раффаэле, Милан, Италия (авторизация No 127/2012-A).
1. Мышечное рассечение и культура миофиберов
- Подготовка оборудования.
- Прежде чем начать, подготовить все необходимые решения, как описано в таблице 1. Эти решения должны быть хорошо подготовлены.
- Очистите все поверхности и инструменты, которые будут использоваться во время процедуры с 70% этанола.
- Перед началом с мышей жертвоприношения, выполнять покрытие 100 мм и 35 мм Петри блюда с помощью лошади сыворотки (HS). Пальто все блюда, чтобы предотвратить миофиберов от присоединения к пластику. Рассмотрите возможность использования одного 100-мм блюда и четырех 35-мм блюд на мышь.
- После удаления избытка HS, хранить посуду с покрытием в инкубаторе при 37 градусов по Цельсию в течение 30 минут. Затем заполните его стиральным раствором или культурной средой (два 35 мм посуды на мышь).
ПРИМЕЧАНИЕ: Кроме того, решение 10% HS в модифицированной среде Орла Dulbecco (DMEM) может быть использован для пальто блюд. Всегда используйте посуду с покрытием. Можно использовать блюда культуры разного размера, но небольшое измерение Петри блюда рекомендуется. - Для изоляции волокон, подготовить стерильные пастерные пипетки, как показано на рисунке 2. Для каждой мыши подготовить одно большое отверстие отверстие отверстие пипетки для обработки мышц и механической дезагрегации (Рисунок 2A) и один небольшой пипетки отверстие для выбора волокон (Рисунок 2B). Вырезать каждый стеклянный пипетки, возможно, с помощью алмазной ручкой, до нужной длины и гладкой трубоуборки края на огне.
- Пальто каждого пипетки, кратко смачивая его с HS перед использованием.
- Мышь жертвоприношения и мышечного вскрытия
- Предварительно разогреть раствор пищеварения при комнатной температуре в течение 10 минут перед началом процедуры вскрытия. Полипропилен FACS круглые дно трубы являются наиболее подходящими контейнерами для этой цели.
- Непосредственно перед началом поиска мышц, жертвуйте мышью в соответствии с надлежащей национальной рекомендацией IACUC.
- Влажные нижней части тела с 70% этанола перед резки кожи, чтобы сделать удаление волос легче.
- Положите мышь в положение лежа на поддержку полистирола покрыты алюминиевой бумагой и сократить кожу, начиная с середины спины продольно и в направлении ног.
- Аккуратно удалите кожу, не касаясь мышц и сухожилий. Можно сорвать всю кожу.
- Вырежьте две ноги мыши и быстро приступить к вскрытию.
ПРИМЕЧАНИЕ: Если это более удобно, можно продолжить вскрытие на всю мышь, но работа на ноге позволяет больше мобильности и точности в более поздних разрезов. - Закрепите ногу на опоре на уровне стопы с помощью булавки и начните изолировать скелетные мышцы, представляющие интерес в этом порядке: TA, EDL, Gastrocnemius и Soleus.
- Поднимите нижнее сухожилие TA с острым пинцетом на высоте лодыжки и сократить его, а затем сократить с тонкими ножницами все вокруг мышцы TA на другое сухожилие на уровне коленной чашечки (Рисунок 3A). Передача в раствор пищеварения.
- Поднимите нижнее сухожилие EDL и отделить его от других мышц, осторожно потянув его вверх до другого сухожилия. Вырезать и поместить его в раствор пищеварения.
ПРИМЕЧАНИЕ: Поскольку EDL может быть очень мала, чтобы быть сокращены отдельно от TA, они могут быть вскрыты вместе (Рисунок 3B). Затем, если вся мышца слишком велика, разрезать его на 2-3 части, начиная с сухожилия и после волокон в продольном направлении (Рисунок 3C). - Поверните ногу, показывающую мышцы спины и исправить ногу с помощью штифта. Поднимите ахиллово сухожилие, Gastrocnemius автоматически отделяется от других мышц. Верхнее сухожилие в задней части коленной чашечки. Вырезать его и добавить мышцы пищеварения.
- Поднимите внешнее сухожилие ноги (по отношению к телу) и получите Soleus. Аккуратно отделить его от других мышц, прокручивая под пинцетом.
- Сделайте то же самое для другой ноги (шаги от 1.2.7. до 1.2.11.).
- Мышечное пищеварение
- Инкубировать раствор пищеварения, содержащий все мышцы в водяной бане при 37 градусов по Цельсию в течение 45-50 мин. Во время пищеварения, регулярно проверяйте мышцы, чтобы избежать чрезмерного пищеварения. Каждые 10 минут инвертировать пищеварение трубки 10x с энергичным движением (избежать вихря).
- Остановить пищеварение, когда мышцы начинают ослабевать и миофиберы видны.
- В самом конце времени пищеварения встряхните образцы.
- Чтобы остановить пищеварение, аккуратно перенесите суспензию пищеварения в предварительно разогретую 100 мм чашку Петри с 10 мл стирального раствора.
ПРИМЕЧАНИЕ: Избегайте чрезмерного пищеварения мышц, так как это неизбежно приведет к изоляции гипер-контрактных миофиберов. Обычно с этим протоколом мышцы гомозиготных мышей-мутантов перевариваются 45 минут, в то время как мышцы мышей дикого типа занимают 50-55 мин. Время пищеварения необходимо экспериментально проверить.
- Одноместный миофиберов изоляции
- Сначала изолировать волокна уже разобщены под рассекающим микроскопом, выбирая их индивидуально с покрытием P200 пипетки или небольшое отверстие Пастер и передать их из 100 мм Петри в новую 35 мм Петри блюдо с 5 мЛ предварительно разогретого стирального раствора.
- Для того чтобы выпустить более далее myofibers, pipette мышца вверх и вниз используя большое отверстие bore стекло pipette с теплой средой, до тех пор пока волокна механически не выпущены. Не будьте слишком стойкими, как это приведет к повреждению волокон.
- Продолжайте выпускать миофиберы из мышцы, пока блюдо не содержит желательное количество. Если чашка Петри хранится при комнатной температуре более 8 мин, остановитесь и выполните не менее 5 мин инкубации при температуре 37 градусов по Цельсию, 5% CO2 для повторного равновесия в среде.
- Перед передачей одного миофиберов в культурную среду оставьте их при 37 градусах Цельсия, 5% CO2 в стиральной тарелке не менее 1 ч. Это помогает миофиберам приспособиться к состоянию in vitro.
ПРИМЕЧАНИЕ: Взрослые миофиберы менее восприимчивы к стрессу и могут быть вымыты 2-3x. Однако в этом состоянии (в 19 дней послеродового возраста) лучше выполнить только один шаг для мытья, чтобы предотвратить повреждение миофибера. Поэтому всегда обращайте внимание на то, чтобы нужно было достаточно очистить выбранных миофиберов, не перенося мусор или гиперконтрактные волокна.
- Одинокая культура миофиберов
- Перенесите отдельные миофиберы на новое предварительно разогретое блюдо с соответствующей культурной средой (высокой средой сыворотки, чтобы позволить активации спутниковых клеток, см. рисунок 1).
- Изменение среды изолированных миофиберов, путем передачи их на новый покрытие блюдо с новой среде культуры, только после 48-72 ч культуры, чтобы избежать любого стресса, который приведет к гиперконтрактации миофиберов и нарушения.
2. Приложения вниз по течению: Myofibers перекрестного и иммунофлуоресценции
ПРИМЕЧАНИЕ: Связанные с миофиберами спутниковые клетки могут быть визуализированы с помощью иммунофлуоресценции (ИФ) во время интереса. Поскольку большинство опубликованных протоколов оптимизированы для выполнения ИФ на взрослых миофиберов, здесь представлен подробный протокол для получения надежных результатов также на миофиберов, изолированных от постродовых мышц.
- Миофибер поперечное звено
- Прежде чем начать, подготовить все необходимые решения, как описано в таблице 2.
- Предварительное пальто с HS столько 1,5 мЛ микроцентрифуг труб, как количество образцов. Не забудьте удалить все HS, прежде чем продолжить. Так как перекрестные волокна жестче, чем живые и более трудными для пипетки, не забудьте перекрестить около 200-300 волокон отдельно на трубку.
- Под рассекающим микроскопом, собрать все волокна, которые можно считать здоровыми, передать их в трубку микроцентрифуги и оставить трубку вертикальной в течение 5 минут внутри инкубатора, чтобы волокна урегулировать.
- Удалите супернатант очень медленно из трубки.
- Crosslink волокон, добавив 1 мл 4% параформальдегида (PFA) на RT в трубку. Сделайте это осторожно, чтобы избежать бедствия волокна.
- Чтобы предотвратить переплетение волокон во время перекрестного звона, держите трубку в очень нежном возбуждении в течение 10 минут.
- Держите трубку в вертикальном положении в течение 5 минут на RT, чтобы волокна осесть, а затем отказаться от супернатанта обеспечения для удаления большинства объема PFA.
- Добавьте 1 мл фосфата буферизированного солевого раствора (PBS) и держите трубы вертикальными в течение 5 минут на RT, чтобы волокна осадок.
- Удалите супернатант и повторите процедуру стирки (шаг 2.1.8.) еще дважды.
- Храните перекрестные образцы при 4 градусах Цельсия.
ПРИМЕЧАНИЕ: Можно держать перекрестные миофиберы на уровне 4 градусов по Цельсию в течение недели. Если волокна остаются более чем на неделю в этом состоянии, это неизбежно приведет к переплетению миофиберов.
- Иммунофлуоресценция
- Держите трубки, содержащие волокна, стоящие на RT, по крайней мере 5 минут, чтобы позволить для отложения волокна.
- Удалите супернатант, оставив только небольшой объем, чтобы быть уверенным, чтобы не удалить любое волокно.
- Добавить 1 мл 0,5% Triton X-100 в PBS и инкубировать в течение 5 мин с нежным возбуждением.
- Положите трубки в вертикальное положение в течение 5 минут, затем удалите супернатант.
- Добавьте 1,5 мл PBS и инкубировать нежным возбуждением в течение 5 минут.
- Держите трубки в вертикальном положении в течение 5 минут, а затем удалите супернатант.
- Добавьте 1 мл блокирующего раствора и инкубировать на 1 ч на RT с нежным возбуждением.
- Держите трубки 5 мин в вертикальном положении, затем удалите супернатант.
- Разбавить первичные антитела в блокирующий раствор, добавить их в трубки и инкубировать в течение ночи при 4 градусов по Цельсию в нежной агитации (для предлагаемых концентраций см. Таблицу Материалов).
ПРИМЕЧАНИЕ: Кроме того, первичное антитело может быть инкубировано в течение 3 ч на RT. Однако ночная инкубация дала оптимальное окрашивание. Объем инкубации как первичных, так и вторичных антител должен составлять 300 мл, когда осадочные волокна достигают 100 градусов по цельсию из 1,5 мл микроцентрифугной трубки. Когда волокна менее обильные, рекомендуется объем 100-200 мл. - Оставьте трубки в вертикальном положении на 5 мин, а затем удалите супернатант.
- Выполните 3 моет в 1 мл 0,25% Tween-20 в PBS, инкубации в течение 5 минут в нежное возбуждение, а затем оставить трубы стоял в течение 5 минут каждый раз.
ПРИМЕЧАНИЕ: С этого момента, выполните все шаги в темноте, чтобы избежать отбеливания фторхромов. - Разбавить вторичные антитела в блокирующий раствор, добавить их в трубки и инкубировать на 1 ч на RT с нежным возбуждением (для концентраций см. Таблицу материалов).
- Вымойте дважды в 1 мл 0,1% Tween-20 в PBS, инкубации в течение 5 мин с нежным возбуждением, а затем оставить трубки в положении стоя в течение 5 мин.
- Снимите супернатант, добавьте 1 мл раствора DAPI и инкубировать в течение 5 мин с нежным возбуждением.
- Пусть трубки стоять вертикально в стойке в течение 5 минут, а затем удалить супернатант.
- Вымойте с 1 мл PBS, инкубации в течение 5 минут с нежным возбуждением, а затем оставить трубки стоять в стойке в течение 5 минут.
- Удалите супернатант, оставив объем около 50 л.
- Монтаж флуоресцентно помеченных миофиберов на слайдах микроскопа
- Вырежьте P200 пипетки наконечник и покрыть его блокирующим решением
ПРИМЕЧАНИЕ: Чтобы покрыть кончик, пипетки решение вверх и вниз несколько раз, прежде чем выбрать волокна, это позволит избежать волокон придерживаться кончика стены. - Соберите волокна из трубки и разложите их на стеклянной слайде микроскопа.
- Под рассекающим микроскопом, используя только естественный свет, отраженный зеркалом, используйте новый (не вырезанный) наконечник пипетки P200 для распространения волокон и удаления избыточного жидкого раствора.
- Оставьте слайды сухим воздухом в темноте около 10-15 минут, пока не останется очень низкое количество раствора.
- Добавьте монтажную среду на слайд (правильное количество монтажной среды должно быть откалибровано по размеру крышки: для 24 х 40 мм крышки, 20 МЛ достаточно), а затем медленно заложить крышку стекла на области, содержащей волокна. Будьте осторожны, чтобы не создавать пузыри между очками.
- Нажмите на крышку так, чтобы волокна лежали на одном горизонтальном плане.
- Исправить крышку с помощью лака для ногтей.
- Храните образцы при 4 градусов по Цельсию до 4 недель.
- Приобретите желаемые изображения флуоресцентно помеченных миофиберов с конфокальным микроскопом.
- Вырежьте P200 пипетки наконечник и покрыть его блокирующим решением
Результаты
Мы обычно перевариваем четыре различных мышц (TA, EDL, Soleus и Gastrocnemius), чтобы получить хорошее количество длинных и жизнеспособных волокон, которые могли бы выжить 96 ч в росте факторов богатой средой (Рисунок 4A, B). Только самые нетронутые волокна должны быть переданы в среде культуры, так как они выживут; все остальные, которые легко различать и выбирать, должны быть отброшены.
Когда миофиберы поддерживаются в росте-факторы богатых средних спутниковых клеток, полученных из диких мышей типа начинают активировать и размножаться, см. рисунок 1. На 48 ч культуры, в здоровом состоянии (Ламин No 8-11 й / З), спутниковые клетки upregulate MyoD и пройти их первое деление. Активированные спутниковые клетки Pax7/MyoD затем размножаются и на 72 ч в культуре, они генерируют клеточные агрегаты, привязанные к миофиберу, которые еще более заметны при 96 ч(рисунок 5). Во время этих разделений, некоторые из них могут подавлять выражение MyoD, проходя самообновление, чтобы заселить пул стволовых клеток, в то время как те, которые поддерживают MyoD стать привержены дифференциации путем downregulating Pax7 выражения. После 96 ч, кластеры спутниковых клеток содержат четко видимые клетки MyoG, совершенные, которые могут дифференцироваться в новые миофиберы(рисунок 1 и рисунок 6). Примечательно, что с помощью этого эксперимента мы описали запоздалую динамику дифференциации спутниковых клеток в гомозиготных мутантах Ламина 8-11 мышей (-/-) по сравнению с их дикими аналогами типа (яп.) см. рисунок 6.
Окончательный результат каждого эксперимента позволяет нам думать, что протокол, разработанный для изоляции одного миофиберов и культуры из этой модели тяжелой мышечной дистрофии обеспечивает хорошее качество миофиберов для всех дальнейших применений.
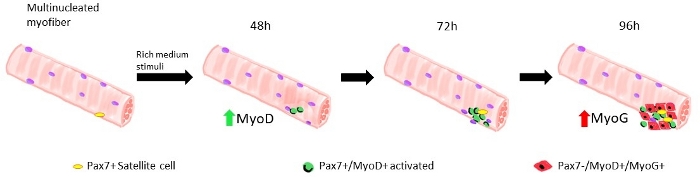
Рисунок 1: Графическое представление регенеративных фаз спутниковых клеток, смоделированных в плавающих миофиберах. На 48 ч культуры в росте-факторов богатых средних, Pax7 "клетки активируются и проходят первое деление, что приводит к дублету Pax7"/MyoD" клеток. МиОД положительные клетки затем размножаются и расширяются, что приводит, в 72 ч культуры, к скоплению из нескольких клеток, которые являются потомством одной спутниковой клетки. На 96 ч культуры клетки Pax7/MyoD' становятся дифференцирующими клетками Pax7-/MyoG. Во время фазы расширения подмножество клеток Pax7/MyoD, сводит на нет выражение MyoD, перестраховывая самообновление, в quiescence. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.

Рисунок 2: Подготовка родила Пастер пипетки. () Продольноеи фронтальное представление о том, как большая дыра родила пипетки должны появиться. (B) Продольное и фронтальное представление о том, как небольшое отверстие родила пипетки должны, наконец, появиться. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.
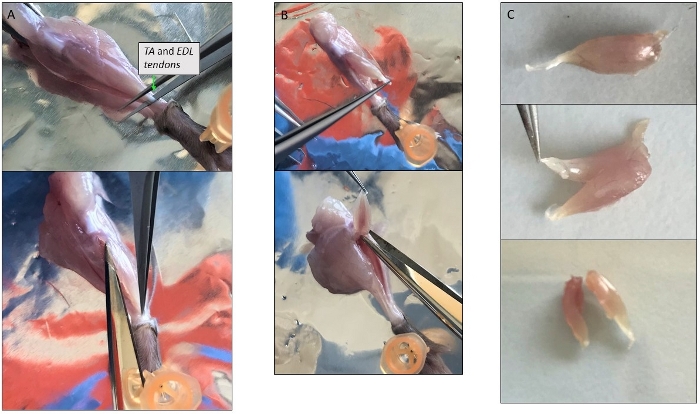
Рисунок 3: Представитель фотографии одного мышечного вскрытия. (A) Изоляция мышцы TA. Как избежать удаления тонкого слоя, покрывающего мышцы защищает миофиберов внутри. (B) TA и EDL мышцы изолированы вместе по-прежнему прилагается к их верхней сухожилия на уровне коленной чашечки. (C) Отдел TA и EDL после изоляции путем резки их вдоль продольной оси. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.
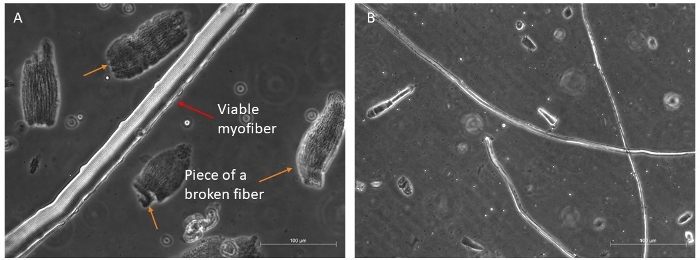
Рисунок 4: Примеры здоровых и жизнеспособных миофиберов. Представитель фазы контраст изображения жизнеспособных миофиберов в подвеске. (A) Красная стрелка указывает на миофибер с видимой саркомерной организацией и спутниковой ячейкой на боку; оранжевые стрелки указывают на некоторые кусочки сломанных миофиберов, а некоторые обломки присутствуют в первом блюде перед окончательным отбором для культуры. Масштаб бар 100 мкм . (B) Более полное представление других миофиберов под меньшим увеличением. Масштабная панель 500 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.
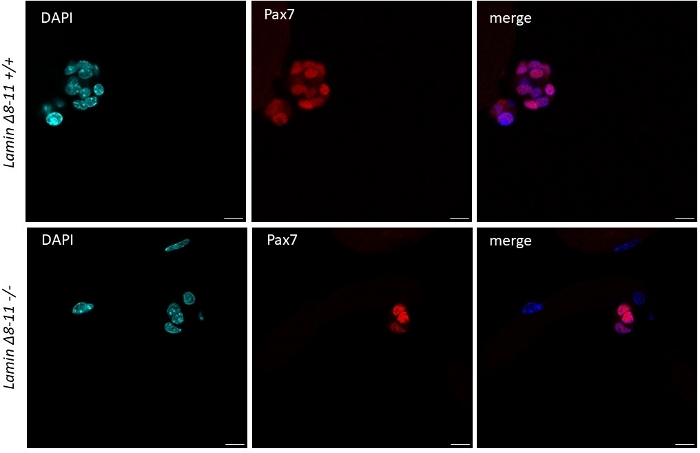
Рисунок 5: Разница в измерении кластеров стволовых клеток у wt и мутантных мышей. Иммунофлуоресцентное окрашивание миофиберов, извлеченных из 19 дней Ламина 8-11 мышей (я/з) и -/-) после 96 ч культуры. Показаны спутниковые ячейки Pax7. Размер клеточного кластера в большинстве случаев был значительно больше в Ламине No8-11, чем в Ламине 8-11 -/- с точки зрения количества клеток. Масштабная панель 10 м. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.
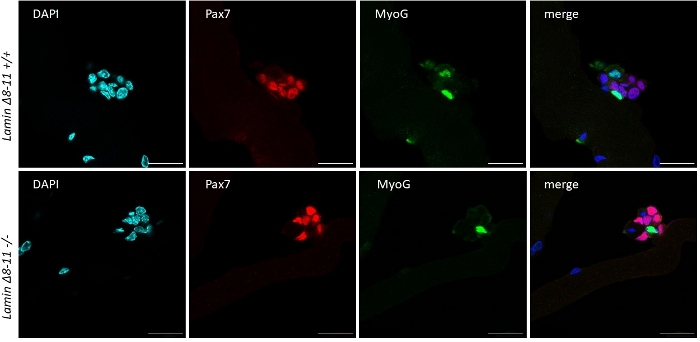
Рисунок 6: Представитель иммунофлуоресценции эксперимента. Эксперимент иммунофлуоресценции выполнен, после 96 ч культуры, на миофиберах, извлеченных из 19 дней Ламина 8-11 мышей (я/з) и -/-). Наблюдались клетки Pax7/MyoG- (красный) и Pax7-/MyoG (зеленый) клетки. Изображения, полученные с помощью конфокального микроскопа. Масштаб бар 25 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.
| Название решения в тексте | Компонент | Процент | предложенный окончательный объем/образец | Заметки | |
| стиральное решение | DMEM с высоким содержанием глюкозы | 90% | 4 мл | Держите стерильным, держите на уровне 4 градусов до использования | |
| Лошадиная сыворотка (HS) | 10% | ||||
| решение пищеварения | DMEM с высоким содержанием глюкозы | 9.80% | 20 мл | Чрезвычайно вредный порошок. Фильтр решение с 0,22 мкм фильтр, а затем сохранить стерильным. Держите на уровне 4 градусов до использования | |
| Коллагеназа I | 0.20% | ||||
| культурная среда | DMEM с высоким содержанием глюкозы | 78% | 10 мл | Держите стерильным, держите на уровне 4 градусов до использования | |
| Сыворотка плода из крупного рогатого скота (FBS) | 20% | ||||
| Экстракт куриного эмбриона (CEE) | 1% | ||||
| Пенициллин-стрептомицин (P/S) | 1% | ||||
Таблица 1: Рецепты решений, используемых в разделе 1.
| Название решения в тексте | Компонент | Процент | предложенный окончательный объем/образец | Заметки | |
| 4% PFA | Параформальдегид (PFA) | 4% | 2-3 мл | Порошок, а затем раствор чрезвычайно вредны | |
| Pbs | 96% | ||||
| 0,5% Тритон X-100 | Тритон X-100 | 0.50% | 2-3 мл | Triton X-100 очень вязкий, преимущественно вырезать кончик пипетки, чтобы aliquot его | |
| Pbs | 99.50% | ||||
| 0,25% Tween-20 | Твин-20 | 0.25% | 10 мл | Tween-20 является чрезвычайно вязким, предпочтительно сократить кончик пипетки, чтобы aliquot его | |
| Pbs | 99.75% | ||||
| 0,1% Tween-20 | Твин-20 | 0.10% | 10 мл | Tween-20 является чрезвычайно вязким, предпочтительно сократить кончик пипетки, чтобы aliquot его | |
| Pbs | 99.90% | ||||
| блокирующее решение | Сыворотка плода из крупного рогатого скота (FBS) | 10% | 10 мл | Подготовка свежего раствора и хранить при 4'C не более 3 недель (всегда проверяйте ясность перед использованием) | |
| Pbs | 90% | ||||
| ДАПИ | ДАПИ | 0.10% | 2-3 мл | Держите в темноте | |
| Pbs | 99.90% | ||||
Таблица 2: Рецепты решений, используемых в разделе 2.
Обсуждение
Изоляция нетронутых одиночных миофиберов является важным методом в области миогенеза, когда основной целью является характеристика клеточно-автономных регенеративных возможностей мышечных стволовых клеток в их нише, в здоровых и патологических условиях. Однако, когда биохимические или геномные исследования представляют интерес, facS-изолированные спутниковые клетки могут быть лучшим вариантом.
Однократная изоляция миофиберов позволяет следовать за экс-виво, но самым физиологическим образом, динамика всех шагов одиночных спутниковых клеток проходит во время мышечной регенерации, то есть: активация, деление клеток (асимметричное и симметричное), дифференциация и возвращение к тишине путем самообновления. После того, как миофиберы выращиваются в плавучих условиях, одиночные спутниковые клетки активируются и расширяются, образуя скопление клеток, которые выходят из одной и той же спутниковой ячейки. Иммунофлуоресцентный анализ для распространения, дифференциации, активации или маркеров стволовой год является оптимальным для количественной оценки пропорции между клеточными стадиями.
Ключевым шагом в нашем протоколе для получения жизнеспособных и нетронутыми миофиберов можно считать быстрый, но нежный мышечной вскрытия, сухожилия к сухожилию изоляции, чтобы избежать каких-либо повреждений мышц. Наш совет – использовать только острые ножницы и небольшие острые пинцеты и ограничить всю процедуру вскрытия мышц десятью минутами. Когда трудно изолировать очень маленькие мышцы (т.е. EDL и TA), можно сократить их вместе, а затем разделить их с помощью тонких ножниц резки вдоль продольного плана после волокон. Эта стратегия в конечном итоге даст меньше нетронутыми myofibers, но жизнеспособность не будет скомпрометирована. То же самое должно быть выполнено на больших мышцах, как Gastrocnemius для облегчения пищеварения. Оптимизация времени пищеварения, которая должна быть эмпирически проверена, и минимальные манипуляции изолированных волокон также два важнейших аспекта для положительного результата последующего анализа.
Преимущество протокола, о которого сообщается здесь, заключается в том, что он может применяться на очень маленьких мышах (по возрасту и размеру), даже если их мышцы чрезвычайно хрупкие. Даже если не упоминается выше, можно следовать этому протоколу вскрытия, чтобы затем культура жизнеспособной миофиберов в течение более длительного периода использования подвала мембраны покрытием блюда18,19. Важно учитывать, что эта ситуация полностью отличается от плавающего состояния, где отсутствуют стимулы сцепления и стимулы близости.
Раскрытие информации
Никаких конкурирующих интересов.
Благодарности
Мы благодарим Андреа Бьянки, Итальянскую сеть ламинопатий и членов лаборатории за поддержку и все конструктивные комментарии. Мы благодарны Кьяре Кордиглиери за драгоценную помощь в конфокальном микроскопе. Авторы благодарят доктора Беатрис Биферали за помощь в съемке фигур. Работа, представленная здесь, была поддержана My First AIRC Grant n. 18535, AFM-Telethon n. 21030, итальянский министр здравоохранения n. GR-2013-02355413 и Cariplo 2017-0649 к C.L. C.M. поддерживается моим первым грантом AIRC No.18993 и AFM-Telethon n.
Материалы
| Name | Company | Catalog Number | Comments |
| 4′,6-diamidino-2-phenylindole | Sigma | D9542 | |
| Chicken embryo extract | Seralab | CE650-DL | |
| Collagenase type I | SIGMA | C0130-500MG | |
| Donkey anti-Rabbit 488 antibody | Thermofisher | R37118 | to be used 1:200 |
| Dulbecco's modified Eagle's medium | Gibco | 10569-010 | |
| Fetal bovine serum | Corning | 35-015-CV | |
| Horse serum | Gibco | 26050-088 | |
| MyoG antibody | Millipore | 219998 | to be used 1:100 |
| Paraformaldehyde | SIGMA | P6148 | |
| Pax7 antibody | Developmental studies Hybridoma bank | to be used 1:20 | |
| Penicillin and Streptomycin | Euroclone | ECB3001D | |
| Phosphate saline buffer | Euroclone | ECB4004L | |
| Prolong gold antifade mountant | Thermofisher | P36930 | |
| Triton X-100 | SIGMA | T8787 | |
| Tween-20 | SIGMA | P1379 | |
| Lab equipment | Manufacturer | ||
| Bunsen burner | |||
| Confocal microscope | Leica | ||
| Diamond pen | bio-optica | ||
| Dissection pins | |||
| FACS polypropylene tubes | Falcon | ||
| Falcon tubes (50 and 15 mL) | Falcon | ||
| Glass coverslips | Thermofisher | ||
| Glass Pasteur pipettes (22cm) | VWR | ||
| Glass slides | Thermofisher | ||
| Micro dissecting scissors | |||
| Micropipette (1 mL and 200 µL) | Gilson | ||
| Micropipette tips | Corning | ||
| Petri dishes (100 and 35 mm diameter) | Thermofisher | ||
| Plastic pipettes (5 and 10 mL) | VWR | ||
| Rubber pipette bulbs | VWR | ||
| Sharp tweezers | |||
| Stereo dissection microscope with transmission illumination | Leica | ||
| Tissue culture hood or lamina flow cabinet | |||
| Tissue culture incubator (humidified, 37°C, 5% CO2) | |||
| Water bath at 37°C | VWR |
Ссылки
- Wang, Y. X., Dumont, N. A., Rudnicki, M. A. Muscle stem cells at a glance. Journal of Cell Science. 127 (21), 4543-4548 (2014).
- Le Grand, F., Rudnicki, M. A. Skeletal muscle satellite cells and adult myogenesis. Current Opinion in Cell Biology. 19 (6), 628-633 (2007).
- Zammit, P. S., Partridge, T. A., Yablonka-Reuveni, Z. The Skeletal Muscle Satellite Cell: The Stem Cell That Came in From the Cold. Journal of Histochemistry & Cytochemistry. 54 (11), 1177-1191 (2006).
- Franco, I., et al. Somatic mutagenesis in satellite cells associates with human skeletal muscle aging. Nature Communications. 9 (1), 800 (2018).
- Cosgrove, B. D., et al. Rejuvenation of the muscle stem cell population restores strength to injured aged muscles. Nature Medicine. 20 (3), 255-264 (2014).
- Bernet, J. D., et al. p38 MAPK signaling underlies a cell-autonomous loss of stem cell self-renewal in aged skeletal muscle. Nature Medicine. 20 (3), 265-271 (2014).
- Bianchi, A., et al. Dysfunctional polycomb transcriptional repression contributes to lamin A/C-dependent muscular dystrophy. Journal of Clinical Investigation. 130 (5), 2408-2421 (2020).
- Blau, H. M., Webster, C., Pavlath, G. K. Defective myoblasts identified in Duchenne muscular dystrophy. Proceedings of the National Academy of Sciences. 80 (15), 4856-4860 (1983).
- Jiang, C., et al. Notch signaling deficiency underlies age-dependent depletion of satellite cells in muscular dystrophy. Disease Models & Mechanisms. 7 (8), 997-1004 (2014).
- Vallejo, D., et al. PITX2 Enhances the Regenerative Potential of Dystrophic Skeletal Muscle Stem Cells. Stem Cell Reports. 10 (4), 1398-1411 (2018).
- Danoviz, M. E., Yablonka-Reuveni, Z. Skeletal Muscle Satellite Cells: Background and Methods for Isolation and Analysis in a Primary Culture System. Methods in Molecular Biology. (798), 21-52 (2012).
- Sacco, A., Doyonnas, R., Kraft, P., Vitorovic, S., Blau, H. M. Self-renewal and expansion of single transplanted muscle stem cells. Nature. 456 (7221), 502-506 (2008).
- Bischoff, R. Proliferation of muscle satellite cells on intact myofibers in culture. Developmental Biology. 115 (1), 129-139 (1986).
- Rosenblatt, J. D., Lunt, A. I., Parry, D. J., Partridge, T. A. Culturing satellite cells from living single muscle fiber explants. In Vitro Cellular & Developmental Biology - Animal. 31 (10), 773-779 (1995).
- Shefer, G., Yablonka-Reuveni, Z. Isolation and Culture of Skeletal Muscle Myofibers as a Means to Analyze Satellite Cells. Methods in Molecular Biology. (290), 281-304 (2005).
- Anderson, J. E., Wozniak, A. C., Mizunoya, W. Single Muscle-Fiber Isolation and Culture for Cellular, Molecular, Pharmacological, and Evolutionary Studies. Methods in Molecular Biology. 798, 85-102 (2012).
- Verma, M., Asakura, A. Efficient Single Muscle Fiber Isolation from Alcohol-Fixed Adult Muscle following β-Galactosidase Staining for Satellite Cell Detection. Journal of Histochemistry & Cytochemistry. 59 (1), 60-67 (2011).
- Keire, P., Shearer, A., Shefer, G., Yablonka-Reuveni, Z. Isolation and Culture of Skeletal Muscle Myofibers as a Means to Analyze Satellite Cells. Methods in Molecular Biology. 946 (206), 431-468 (2013).
- Pasut, A., Jones, A. E., Rudnicki, M. A. Isolation and Culture of Individual Myofibers and their Satellite Cells from Adult Skeletal Muscle. Journal of Visualized Experiments. (73), e50074 (2013).
- Gallot, Y., Hindi, S., Mann, A., Kumar, A. Isolation, Culture, and Staining of Single Myofibers. Bio-Protocol. 6 (19), 1942 (2016).
- Liu, L., Cheung, T. H., Charville, G. W., Rando, T. A. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting. Nature Protocols. 10 (10), 1612-1624 (2015).
- Machado, L., et al. In Situ Fixation Redefines Quiescence and Early Activation of Skeletal Muscle Stem Cells. Cell Reports. 21 (7), 1982-1993 (2017).
- Lucini, F., Bianchi, A., Lanzuolo, C. Formaldehyde-mediated snapshot of nuclear architecture. Methods in Molecular Biology. , (2020).
- Sullivan, T., et al. Loss of a-Type Lamin Expression Compromises Nuclear Envelope Integrity Leading to Muscular Dystrophy. The Journal of Cell Biology. 147 (5), 913-920 (1999).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены