Method Article
Isolamento e Cultura de Miofibra único de um modelo murino de distrofia muscular em emery-dreifuss no desenvolvimento pós-natal antecipado
Neste Artigo
Resumo
Aqui, propomos um método para obter eficientemente fibras musculares únicas nos estágios iniciais pós-natal do modelo de camundongo Lamin Δ8-11, um modelo muito severo para distrofia muscular Emery-Dreifuss (EDMD).
Resumo
A distrofia muscular emery-dreifuss dominante autossômica (EDMD) é causada por mutações no gene LMNA, que codifica as laminas nucleares do tipo A, proteínas de filamento intermediário que sustentam o envelope nuclear e os componentes do nucleoplasma. Recentemente, relatamos que o perda muscular em EDMD pode ser atribuído a disfunções epigenéticas intrínsecas que afetam a capacidade regenerativa das células-tronco musculares (satélite). O isolamento e a cultura dos miofibers solteiros é uma das abordagens ex-vivo mais fisiológicas para monitorar o comportamento das células satélites dentro de seu nicho, pois permanecem entre a lamina basal em torno da fibra e o sarcolemma. Portanto, representa um paradigma experimental inestimável para estudar células satélites de uma variedade de modelos murinos. Aqui, descrevemos um método refogado para isolar myofibers únicos intactos e viáveis dos músculos hindlimb pós-natal(Tibialis Anterior, Extensor Digitorum Longus, Gastrocnemius e Soleus). Seguindo este protocolo, pudemos estudar células satélites de Lamin Δ8-11 -/- camundongos, um modelo de murina EDMD grave, com apenas 19 dias após o nascimento.
Detalhamos o procedimento de isolamento, bem como as condições culturais para obter uma boa quantidade de miofibers e sua prole derivada de células satélite associadas. Quando cultivadas em fatores de crescimento ricos, as células satélites derivadas de ratos do tipo selvagem ativam, proliferam e eventualmente se diferenciam ou passam por auto-renovação. Em Lamin Δ8-11 homozigos -/- camundongos mutantes essas capacidades são severamente prejudicadas.
Esta técnica, se estritamente seguida, permite estudar todos os processos ligados à célula satélite associada à miofibra, mesmo em estágios iniciais de desenvolvimento pós-natal e em músculos frágeis.
Introdução
O músculo esquelético é um tecido diferenciado com uma das capacidades mais estendidas de regeneração após exercício ou trauma1. Essa característica deve-se principalmente à presença de células-tronco, chamadas células satélites devido à sua posição periférica entre a lamina basal e o plasmalemma da miofibra2. Durante o desenvolvimento pós-natal, as células satélites proliferam e se diferenciam progressivamente, contribuindo para o crescimento muscular esquelético. Uma vez na idade adulta, as células satélites entram em um estado quiescente reversível, e após trauma fisiológico ou patológico, ativam, proliferam e diferenciam para reparar os músculos danificados3. Defeitos na capacidade das células satélites transitam adequadamente por essas diferentes fases regenerativas e se submeterem à auto-renovação têm sido firmemente ligados ao perda muscular, seja durante o envelhecimento fisiológico4,,5,,6 ou em doenças degenerativas musculares, como distrofias musculares7,,8,,9,,10.
Existem duas abordagens culturais principais para estudar células satélites ex-vivo: culturas miogênicas primárias de células mononucleadas, mecanicamente e quimicamente dissociadas de todo o músculo11,12; ou cultura de miofibers isolados13,14,15,16,17,18,19,20. No primeiro caso, o processo de isolamento das células satélites envolve a trituração de músculos inteiros extraídos do camundongo, uma digestão química, filtração e triagem celular ativada fluorescente (FACS)21. Este procedimento, embora eficaz na isolação de células satélites de uma variedade de modelos, envolve várias variáveis que expõem as células satélites ao estresse e interrompe seu nicho fisiológico22,23. Em contraste, o isolamento da miofibra envolve uma digestão mais suave do tecido muscular com enzimas degradantes de matriz e uma trituração mecânica que causa trauma reduzido às células-tronco20. Esta segunda abordagem permite uma recuperação muito mais eficiente de células satélite viáveis, que permanecem fisicamente ligadas à sua miofibra entre a lamina basal e o sarcolemma, permitindo assim a análise dentro de seu nicho fisiológico19,20.
Muitos protocolos diferentes foram propostos durante os últimos anos para isolar de forma adequada e eficiente miofibers únicos de músculos esqueléticos. Já em 1986 Bischoff propôs um protocolo para isolar fibras do Flexor Digitorum Brevis13 e mais tarde, em 1995, Rosenblatt et al. modificaram o protocolo para obter uma separação mais eficiente dos myofibers14. Desde então, muitos outros autores propuseram procedimentos ajustados em outros músculos, como Extensor Digitorum Longus (EDL) e Tibialis Anterior (TA)15,16,17,18,19,20, que são mais longos, mesmo que mais frágeis, músculos14. Myofibers isolados podem então ser cultivados tanto na adesão, para permitir a expansão de mióblastos derivados de células satélites, ou em condições flutuantes, até 96 horas, para seguir a prole derivada de células satélitesúnicas 19 (Figura 1). Concentrações variáveis de soro dentro do meio de cultura são utilizadas para desencadear ativação, proliferação e/ou diferenciação de células satélites, para estudar sua capacidade de transitar adequadamente por essas diferentes fases1.
Recentemente, descrevemos o mecanismo epigenético por trás da exaustão da piscina de células-tronco do satélite no modelo de camundongos do EDMD, o Lamin Δ8-11 -/- mouse7. Como esses camundongos geralmente morrem entre 4 e 8 semanas de idade24, devido à grave perda muscular, foi feita uma tentativa de capturar os defeitos moleculares subjacentes ao início precoce da doença, focando nossa análise no desenvolvimento muscular pós-natal. Myofibers monoevitantes flutuantes foram isolados e cultivados a partir do tipo selvagem e Lamin Δ8-11 -/- mutantes7 19 dias de idade ratos. Nesta fase, os defeitos musculares já são evidentes, mas os ratos ainda são viáveis. No entanto, como todos os protocolos acima mencionados para extração de miofibers individuais foram otimizados para músculos esqueléticos de camundongos adultos, precisávamos adaptá-los aos nossos propósitos: camundongos muito pequenos em termos de idade e tamanho, e miofibers muito frágeis. Assim, descrevemos aqui a nossa readaptação do protocolo proposto pelo laboratório Rudnicki19 para obter um número significativo de miofibers viáveis únicos de camundongos durante o desenvolvimento pós-natal e de músculos distróficos graves, como os derivados de Lamin Δ8-11 -/- ratos24. O objetivo final desta abordagem é fornecer um procedimento padronizado para o estudo de células-tronco musculares associadas a miofibers em qualquer outro modelo de camundongo quando os estágios iniciais do desenvolvimento pós-natal são de interesse, ou no caso de modelos de camundongos portadores de qualquer doença específica que torne os miofibers mais suscetíveis ao estresse mecânico.
Protocolo
Todos os procedimentos experimentais foram realizados sob aprovação ética do Ministério da Saúde italiano e do Comitê Institucional de Cuidados e Uso de Animais (autorização nº 83/2019-PR). Os animais foram mantidos em uma instalação autorizada no Hospital San Raffaele, em Milão, Itália (autorização n. n. n. 127/2012-A).
1. Dissecção muscular e cultura miofibra
- Preparação do equipamento.
- Antes de começar, prepare todas as soluções necessárias conforme descrito na Tabela 1. Essas soluções precisam ser preparadas recentemente.
- Limpe todas as superfícies e ferramentas que serão utilizadas durante o procedimento com 70% de etanol.
- Antes de começar com o sacrifício de ratos, realize o revestimento de pratos petri de 100 mm e 35 mm usando o Soro de Cavalo (HS). Cubra todos os pratos para evitar que os miofibers se conectem ao plástico. Considere usar um prato de 100 mm e quatro pratos de 35 mm por mouse.
- Depois de remover o excesso de HS, armazene pratos revestidos em uma incubadora a 37 °C por 30 min. Em seguida, preencha-o com solução de lavagem ou meio de cultura (dois pratos de 35 mm por mouse).
NOTA: Alternativamente, uma solução de 10% de HS no meio de Águia modificado (DMEM) modificado de Dulbecco pode ser usada para revestir pratos. Use sempre pratos revestidos. É possível usar pratos de cultura de diferentes tamanhos, mas pratos de petri de pequena dimensão são recomendados. - Para o isolamento das fibras, prepare as pipetas pasteur estéreis, como mostrado na Figura 2. Para cada rato prepare uma pipeta furada grande para manuseio muscular e desagregação mecânica(Figura 2A) e uma pequena pipeta furada para seleção de fibras(Figura 2B). Corte cada pipeta de vidro, possivelmente usando uma caneta de diamante, ao comprimento desejado e bordas lisas da pipeta em uma chama.
- Cubra cada pipeta molhando-a brevemente com HS antes de usar.
- Sacrifício de rato e dissecção muscular
- Pré-aqueça a solução de digestão à temperatura ambiente por 10 minutos antes de iniciar o procedimento de dissecção. Os tubos de fundo redondo FACS de polipropileno são os recipientes mais adequados para o efeito.
- Imediatamente antes do início da recuperação muscular, sacrifique o rato de acordo com a recomendação nacional adequada da IACUC.
- Molhe sua parte inferior do corpo com 70% de etanol antes de cortar a pele para facilitar a remoção do cabelo.
- Coloque o mouse em uma posição propensa em um suporte de poliestireno coberto com papel de alumínio e corte a pele a partir do meio da parte de trás longitudinalmente e na direção das pernas.
- Remova cuidadosamente a pele sem tocar nos músculos e tendões. É possível arrancar toda a pele.
- Corte as duas pernas do mouse e prossiga rapidamente com a dissecação.
NOTA: Se for mais confortável, é possível continuar a dissecção em todo o mouse, mas trabalhar na perna permite mais mobilidade e precisão nos cortes posteriores. - Fixar a perna no suporte ao nível do pé usando um pino e começar a isolar os músculos esqueléticos de interesse nesta ordem: TA, EDL, Gastrocnemius e Soleus.
- Levante o tendão inferior da TA com uma pinça afiada na altura do tornozelo e corte-o, em seguida, corte com uma tesoura fina ao redor do músculo TA para o outro tendão ao nível da patela(Figura 3A). Transfira para a solução de digestão.
- Levante o tendão inferior do EDL e separe-o de outros músculos puxando-o suavemente para cima até o outro tendão. Corte e coloque na solução de digestão.
NOTA: Uma vez que o EDL pode ser extremamente pequeno para ser cortado separadamente do TA, eles podem ser dissecados juntos(Figura 3B). Em seguida, se todo o músculo for muito grande, corte-o em 2-3 peças partindo do tendão e seguindo as fibras em uma direção longitudinal(Figura 3C). - Gire a perna mostrando os músculos das costas e conserte o pé usando o pino. Levante o tendão do Achille, Gastrocnemius se separará automaticamente de outros músculos. O tendão superior está na parte de trás da patela. Corte-o e adicione o músculo à digestão.
- Levante o tendão externo da perna (com relação ao corpo) e obtenha o Soleus. Separe-o suavemente dos outros músculos, rolando para baixo com a pinça.
- Faça o mesmo para a outra perna (passos de 1.2.7. para 1.2.11.).
- Digestão muscular
- Incubar a solução de digestão contendo todos os músculos em um banho de água a 37 °C por cerca de 45-50 min. Durante o tempo de digestão, verifique regularmente o músculo para evitar a digestão excessiva. A cada 10 minutos inverta os tubos de digestão 10x com um movimento energético (evite vórtices).
- Pare a digestão quando os músculos começarem a se soltar e os miofibers são visíveis.
- No final do tempo de digestão, agite as amostras.
- Para parar a digestão, transfira cuidadosamente a suspensão de digestão para uma placa petri pré-aquecida de 100 mm com 10 mL de solução de lavagem.
NOTA: Evite a digestão excessiva muscular, pois isso inevitavelmente resultará no isolamento de miofibers hipercon contraídos. Normalmente com este protocolo, os músculos de camundongos mutantes homozigos levam 45 minutos para serem digeridos, enquanto os músculos de ratos do tipo selvagem levam 50-55 min. O tempo de digestão precisa ser validado experimentalmente.
- Isolamento único dos miofibers
- Primeiro isole as fibras já dissociadas sob um microscópio dissecado, escolhendo-as individualmente com uma pipeta P200 revestida ou pasteur pequeno e transfira-as do Petri de 100 mm para uma nova placa de Petri de 35 mm com 5 mL de solução de lavagem pré-aquecida.
- Para liberar ainda mais miofibers, pipeta o músculo para cima e para baixo usando uma grande pipeta de vidro furado com meio quente, até que as fibras sejam liberadas mecanicamente. Não seja muito persistente, pois isso resultará em fibras prejudiciais.
- Continue liberando miofibers do músculo até que o prato contenha uma quantidade desejável. Se a placa de Petri for mantida em temperatura ambiente por mais de 8 minutos, pare e realize uma incubação mínima de 5 minutos a 37 °C, 5% de CO2 para ree equilibrar o meio.
- Antes de transferir os miofibers únicos para o meio de cultura, deixe-os a 37 °C, 5% de CO2 na lava-jato por pelo menos 1h. Isso ajuda os miofibers a se adaptarem à condição in vitro.
NOTA: Os miofibers adultos são menos suscetíveis ao estresse e podem ser lavados ~ 2-3x. No entanto, nesta condição (aos 19 dias após a idade natal) é melhor realizar apenas uma etapa de lavagem para evitar danos à miofibra. Portanto, preste sempre atenção para manter os miofibers selecionados suficientemente limpos, não carregando detritos ou fibras hipercontratadas.
- Cultura miofibra única
- Transfira myofibers individuais para um novo prato pré-aquecido com o meio de cultura adequado (meio de alta sérica para permitir a ativação de células satélites, ver Figura 1).
- Mude o meio para o miofibers isolado, transferindo-os para um novo prato revestido com novo meio de cultura, somente após 48-72 h de cultura para evitar qualquer estresse que leve à hipercontração e interrupção dos miofibers.
2. Aplicações a jusante: Myofibers crosslinking e imunofluorescência
NOTA: As células satélites associadas a miofibers podem ser visualizadas por imunofluorescência (IF) no momento do interesse. Como a maioria dos protocolos publicados são otimizados para realizar IF em myofibers adultos, aqui é apresentado um protocolo detalhado para obter resultados confiáveis também em myofibers isolados dos músculos pós-natal.
- Crosslinking de miofibra
- Antes de começar, prepare todas as soluções necessárias conforme descrito na Tabela 2.
- Precoat com HS tantos tubos de microcentrifuuge de 1,5 mL quanto o número de amostras. Certifique-se de remover todo o HS antes de prosseguir. Uma vez que as fibras cruzadas são mais resistentes do que as vivas e mais difíceis de pipeta, certifique-se de cruzar cerca de 200-300 fibras separadamente por tubo.
- Sob um microscópio dissecando, colete todas as fibras que podem ser consideradas saudáveis, transfira-as para o tubo de microcentrifuuagem e deixe o tubo vertical por 5 minutos dentro da incubadora para permitir que as fibras se instalem.
- Remova o supernatante muito lentamente do tubo.
- Fibras crosslink adicionando 1 mL de 4% de paraformaldeído (PFA) no RT ao tubo. Faça isso suavemente para evitar a angústia das fibras.
- Para evitar que as fibras se entrelaçam durante o crosslinking, mantenha o tubo em agitação muito suave por 10 minutos.
- Mantenha o tubo em posição vertical por 5 minutos no RT para permitir que as fibras se instalem e, em seguida, descarte o supernasal que garante remover a maior parte do volume pfa.
- Adicione 1 mL de salina tamponada de fosfato (PBS) e mantenha os tubos verticais por 5 minutos em RT para deixar as fibras para sedimentar.
- Retire o supernatante e repita o procedimento de lavagem (passo 2.1.8.) duas vezes novamente.
- Mantenha amostras cruzadas a 4 °C.
NOTA: É possível manter myofibers cruzados a 4 °C por uma semana. Se as fibras permanecerem mais de uma semana nesta condição, isso inevitavelmente resultará em interligação de miofibers.
- Imunofluorescência
- Mantenha os tubos contendo as fibras em pé na RT por pelo menos 5 minutos para permitir a sedimentação da fibra.
- Remova o supernaspeuta, deixando apenas um pequeno volume para ter certeza de não remover nenhuma fibra.
- Adicione 1 mL de 0,5% Triton X-100 em PBS e incubar por 5 min com agitação suave.
- Coloque tubos na posição vertical por 5 minutos e, em seguida, remova o supernaspe.
- Adicione 1,5 mL de PBS e incubar com agitação suave por 5 min.
- Mantenha os tubos na posição vertical por 5 minutos e, em seguida, remova o sobrenante.
- Adicione 1 mL de solução de bloqueio e incubar por 1h no RT com agitação suave.
- Mantenha os tubos 5 minutos na posição vertical e, em seguida, remova o sobrenante.
- Diluir os anticorpos primários na solução de bloqueio, adicioná-los aos tubos e incubar durante a noite a 4 °C em agitação suave (para concentrações sugeridas ver Tabela de Materiais).
NOTA: Alternativamente, o anticorpo primário pode ser incubado por 3 h no RT. No entanto, a incubação noturna deu uma coloração ótima. O volume de incubação para anticorpos primários e secundários deve ser de 300 μL quando as fibras sedimentadas atingirem o entalhe de 100 μL do tubo de microcentrifuuge de 1,5 mL. Quando as fibras são menos abundantes, recomenda-se um volume de 100-200 μL. - Deixe os tubos em posição vertical por 5 minutos e, em seguida, remova o sobrenatante.
- Realize 3 lavagens em 1 mL de 0,25% Tween-20 em PBS, incubando por 5 minutos em agitação suave e, em seguida, deixando os tubos parados por 5 minutos cada vez.
NOTA: A partir de agora, realize todos os passos no escuro, para evitar o branqueamento de fluorochromes. - Diluir anticorpos secundários na solução de bloqueio, adicioná-los aos tubos e incubar por 1h em RT com agitação suave (para concentrações ver Tabela de Materiais).
- Lave duas vezes em 1 mL de 0,1% Tween-20 em PBS, incubando por 5 minutos com agitação suave e, em seguida, deixando os tubos em posição de pé por 5 minutos.
- Retire o supernatante, adicione 1 mL de solução DAPI e incuba por 5 minutos com agitação suave.
- Deixe os tubos pararem verticalmente em um rack por 5 minutos, em seguida, remova o supernatante.
- Lave com 1 mL de PBS, incubando por 5 minutos com agitação suave e, em seguida, deixando os tubos em um rack por 5 minutos.
- Remova o supernaspetivo, deixando um volume de cerca de 50 μL.
- Montagem de miofibers fluorescentes rotulados em slides de microscópio
- Corte uma ponta de pipeta P200 e cubra-a com solução de bloqueio
NOTA:Para revestir a ponta, pipeta a solução várias vezes antes de colher as fibras, isso evitará que as fibras grudem na parede da ponta. - Recolhe as fibras do tubo e espalhe-as em uma lâmina de vidro de microscópio.
- Sob um microscópio dissecando, usando apenas a luz natural refletida pelo espelho, use uma nova (não cortada) ponta de pipeta P200 para espalhar as fibras e remover a solução líquida em excesso.
- Deixe os slides secos no escuro por cerca de 10-15 minutos, até que a quantidade muito baixa de solução permaneça.
- Adicione o meio de montagem no slide (a quantidade adequada do meio de montagem deve ser calibrada na dimensão do deslizamento de cobertura: para um deslizamento de cobertura de 24 x 40 mm, 20 μL é suficiente) e, em seguida, lentamente coloque um vidro de cobertura na área que contém as fibras. Tenha cuidado para não criar bolhas entre os óculos.
- Pressione a tampa para que as fibras coloquem em um único plano horizontal.
- Fixar a mancha de cobertura usando esmalte.
- Armazene as amostras a 4 °C por até 4 semanas.
- Adquira as imagens desejadas de miofibers fluorescentes rotulados com um microscópio confocal.
- Corte uma ponta de pipeta P200 e cubra-a com solução de bloqueio
Resultados
Normalmente digerimos quatro músculos diferentes (TA, EDL, Soleus e Gastrocnemius) para recuperar uma boa quantidade de fibras longas e viáveis que poderiam sobreviver a 96 h em fatores de crescimento ricos(Figura 4A,B). Apenas as fibras mais intactas devem ser transferidas em meio cultural, pois sobreviverão; todos os outros, que são fáceis de discriminar e selecionar, precisam ser descartados.
Quando os micreiros são mantidos em um fator de crescimento, células de satélite médias ricas derivadas de ratos do tipo selvagem começam a se ativar e proliferar, veja a Figura 1. Após 48 h de cultura, em condições saudáveis(Lamin Δ8-11 +/+), as células satélites regulam o MyoD e passam por sua primeira divisão. As células satélites Pax7+/MyoD+ ativadas então proliferam e, em 72 horas, na cultura, geram agregados celulares ligados à miofibra, que são ainda mais visíveis a 96 h(Figura 5). Durante essas divisões, algumas delas podem reprimir a expressão myoD, passando por auto-renovação para repovoar o pool de células-tronco, enquanto aqueles que mantêm MyoD tornam-se comprometidos com a diferenciação, diminuindo a expressão Pax7. Após 96 h, os aglomerados de células satélites contêm células claramente visíveis do MioG+, que podem se diferenciar em novos miofibers(Figura 1 e Figura 6). Notavelmente, com este experimento, descrevemos uma dinâmica retardada da diferenciação de células satélites em camundongos mutantes homozigos Lamin Δ8-11 (-/-) em comparação com seus homólogos do tipo selvagem (+/+), ver Figura 6.
O resultado final de cada experimento, vamos pensar que o protocolo desenvolvido para o isolamento e cultura de myofibers únicos a partir deste modelo de distrofia muscular grave garante myofibers de boa qualidade para todas as outras aplicações.
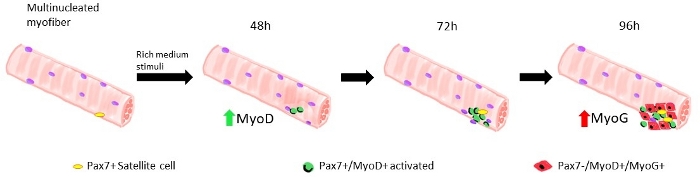
Figura 1: Representação gráfica das fases regenerativas das células satélites modeladas em miofibers flutuantes. Após 48h de cultura em fatores de crescimento ricos, as células Pax7+ são ativadas e submetidas à primeira divisão, dando origem a um duplo de células Pax7+/MyoD+. As células positivas do miroD então proliferam e expandem-se, dando origem, em 72 h de cultura, a um aglomerado de várias células que são a prole de uma única célula satélite. Após 96 h de cultura, as células Pax7+/MyoD+ tornam-se diferenciando as células Pax7-/MyoG+. Durante a fase de expansão, um subconjunto de células Pax7+/MyoD+ diminui a expressão MyoD submetida à auto-renovação em quiescência. Clique aqui para ver uma versão maior desta figura.

Figura 2: Preparação de pipetas pasteur furas. (A) Visão longitudinal e frontal de como a pipeta do furo grande deve aparecer. (B) Visão longitudinal e frontal de como a pipeta do furo pequeno deve finalmente aparecer. Clique aqui para ver uma versão maior desta figura.
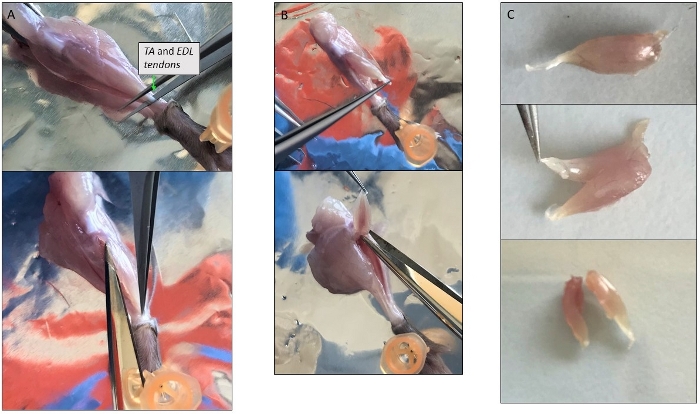
Figura 3: Fotos representativas de dissecção muscular única. (A) Isolamento do músculo TA. Evitar a remoção da camada fina que cobre o músculo protege os miofibers dentro. (B) Os músculos TA e EDL isolados juntos ainda ligados ao tendão superior ao nível da patela. (C) Divisão de TA e EDL após isolamento, cortando-os ao longo do eixo longitudinal. Clique aqui para ver uma versão maior desta figura.
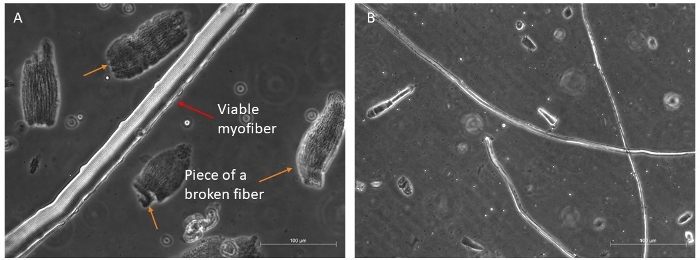
Figura 4: Exemplos de miofibers saudáveis e viáveis. Imagens de contraste de fase representativa de myofibers viáveis em suspensão. (A) A seta vermelha indica uma miofibra com organização de sarcomere visível e uma célula satélite ao seu lado; as setas laranja indicam alguns pedaços de miofibers quebrados, e alguns detritos presentes no primeiro prato antes da seleção final para a cultura. Barra de escala 100 μm. (B) Visão mais completa de outros miofibers sob uma ampliação menor. Barra de escala 500 μm. Clique aqui para ver uma versão maior desta figura.
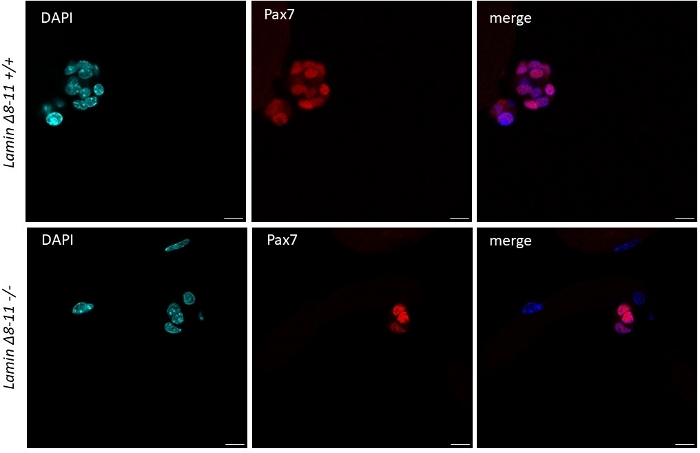
Figura 5: Diferença na dimensão dos aglomerados de células-tronco em camundongos wt e mutantes. A coloração de imunofluorescência de miofibers extraídos de 19 dias lamin δ8-11 ratos (+/+ e -/-) após 96 h de cultura. Células de satélite Pax7+ são mostradas. A dimensão do aglomerado celular na maioria dos casos foi significativamente maior em Lamin Δ8-11 +/+ do que em Lamin Δ8-11 -/- em termos de número de células. Barra de escala 10 μm. Clique aqui para ver uma versão maior desta figura.
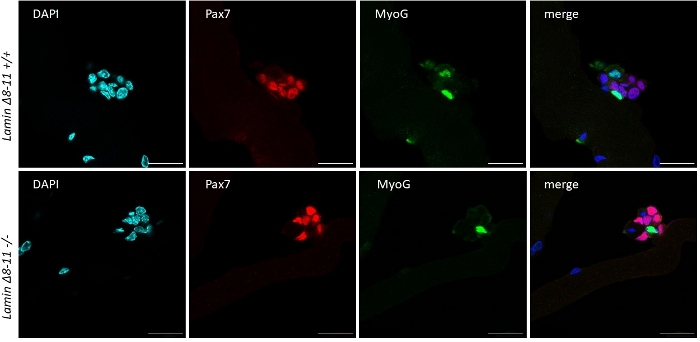
Figura 6: Experimento representativo de imunofluorescência. O experimento de imunofluorescência realizado, após 96 h de cultura, em miofibers extraídos de 19 dias Lamin Δ8-11 ratos (+/+ e -/-). Foram observadas células Pax7+/MyoG- (vermelha) e Pax7-/MyoG+ (verde). Imagens obtidas com um microscópio confocal. Barra de escala 25 μm. Clique aqui para ver uma versão maior desta figura.
| Nome da solução no texto | Componente | Porcentagem | volume/amostra final sugerido | Notas | |
| solução de lavagem | DMEM alta glicose | 90% | 4 mL | Mantenha-se estéril, mantenha-se a 4°C até o uso | |
| Soro de cavalo (HS) | 10% | ||||
| solução de digestão | DMEM alta glicose | 9.80% | 20 mL | Pó extremamente prejudicial. Filtrar a solução com filtro de 0,22μm e, em seguida, manter-se estéril. Mantenha a 4°C até o uso | |
| Colagenase I | 0.20% | ||||
| meio de cultura | DMEM alta glicose | 78% | 10 mL | Mantenha-se estéril, mantenha-se a 4°C até o uso | |
| Soro bovino fetal (FBS) | 20% | ||||
| Extrato de embrião de frango (CEE) | 1% | ||||
| Penicilina-Estreptomicina (P/S) | 1% | ||||
Tabela 1: Receitas para soluções utilizadas na seção 1.
| Nome da solução no texto | Componente | Porcentagem | volume/amostra final sugerido | Notas | |
| 4% PFA | Paraformaldeído (PFA) | 4% | 2-3 mL | Pó e, em seguida, solução são extremamente prejudiciais | |
| Pbs | 96% | ||||
| 0,5% Tritão X-100 | Tritão X-100 | 0.50% | 2-3 mL | Tritão X-100 é extremamente viscoso, preferencialmente cortar a ponta da pipeta para aliquot-lo | |
| Pbs | 99.50% | ||||
| 0,25% Tween-20 | Tween-20 | 0.25% | 10 mL | Tween-20 é extremamente viscoso, preferencialmente cortar a ponta da pipeta para aliquot-lo | |
| Pbs | 99.75% | ||||
| 0,1% Tween-20 | Tween-20 | 0.10% | 10 mL | Tween-20 é extremamente viscoso, preferencialmente cortar a ponta da pipeta para aliquot-lo | |
| Pbs | 99.90% | ||||
| solução de bloqueio | Soro bovino fetal (FBS) | 10% | 10 mL | Prepare a solução fresca e armazene a 4°C por não mais do que 3 semanas (sempre verifique a clareza antes do uso) | |
| Pbs | 90% | ||||
| DAPI | DAPI | 0.10% | 2-3 mL | Mantenha-se no escuro | |
| Pbs | 99.90% | ||||
Tabela 2: Receitas para soluções utilizadas na seção 2.
Discussão
O isolamento de miofibers únicos intactos é um método essencial no campo da miogênese quando o objetivo principal é caracterizar capacidades regenerativas de células-autônomas de células-tronco musculares dentro de seu nicho, em condições saudáveis e patológicas. No entanto, quando estudos bioquímicos ou genômicos são de interesse, células de satélite isoladas do FACS podem ser a melhor opção.
O isolamento único dos myofibers permite seguir ex-vivo, mas da forma mais fisiológica, a dinâmica de todas as etapas que as células satélites individuais sofrem durante a regeneração muscular, ou seja: ativação, divisão celular (assimétrica e simétrica), diferenciação e retorno à quiescência por auto-renovação. Uma vez que os miofibers são cultivados em condições flutuantes, as células de satélite únicas ativam e expandem formando um conjunto de células, todas derivadas da mesma célula satélite. A análise da imunofluorescência para proliferação, diferenciação, ativação ou marcadores de haste é então ideal para quantificar a proporção entre os estágios celulares.
O passo chave em nosso protocolo para obter miofibers viáveis e intactos pode ser considerado a dissecção muscular rápida, mas suave, pelo isolamento tendinoso-tendão, para evitar qualquer dano muscular. Nosso conselho é usar apenas tesouras afiadas e pequenas pinças afiadas e limitar todo o procedimento de dissecção muscular a dez minutos. Quando é difícil isolar músculos muito pequenos (ou seja, EDL e TA), é possível cortá-los juntos e depois dividi-los usando uma tesoura fina cortando ao longo do plano longitudinal seguindo as fibras. Esta estratégia eventualmente dará myofibers menos intactos, mas a viabilidade não será comprometida. O mesmo deve ser realizado em músculos grandes como Gastrocnemius para facilitar a digestão. Otimização do tempo de digestão, que precisa ser validado empiricamente, e manipulação mínima de fibras isoladas também são dois aspectos cruciais para o resultado positivo da análise subsequente.
A vantagem do protocolo aqui relatado é que ele pode ser aplicado em camundongos muito pequenos (em idade e dimensão), mesmo quando seus músculos são extremamente frágeis. Mesmo que não seja mencionado acima, é possível seguir este protocolo de dissecção para então cultivar miofibers viáveis por um período mais longo usando pratos revestidos de membrana do porão18,19. É importante considerar que essa situação é completamente diferente da condição flutuante, onde faltam estímulos de adesão e proximidade.
Divulgações
Sem interesses concorrentes.
Agradecimentos
Agradecemos a Andrea Bianchi, a Rede Italiana de Laminopatias e aos membros do laboratório pelo apoio e todos os comentários construtivos. Somos gratos a Chiara Cordiglieri pela preciosa ajuda no microscópio confocal. Os autores agradecem a ajuda da Dra. O trabalho aqui apresentado foi apoiado pelo My First AIRC Grant n. 18535, AFM-Teleton n. 21030, o Ministro da Saúde italiano n. GR-2013-02355413 e Cariplo 2017-0649 para C.L. C.M. é apoiado pela minha primeira subvenção AIRC n.18993 e AFM-Telethon n. 22489.
Materiais
| Name | Company | Catalog Number | Comments |
| 4′,6-diamidino-2-phenylindole | Sigma | D9542 | |
| Chicken embryo extract | Seralab | CE650-DL | |
| Collagenase type I | SIGMA | C0130-500MG | |
| Donkey anti-Rabbit 488 antibody | Thermofisher | R37118 | to be used 1:200 |
| Dulbecco's modified Eagle's medium | Gibco | 10569-010 | |
| Fetal bovine serum | Corning | 35-015-CV | |
| Horse serum | Gibco | 26050-088 | |
| MyoG antibody | Millipore | 219998 | to be used 1:100 |
| Paraformaldehyde | SIGMA | P6148 | |
| Pax7 antibody | Developmental studies Hybridoma bank | to be used 1:20 | |
| Penicillin and Streptomycin | Euroclone | ECB3001D | |
| Phosphate saline buffer | Euroclone | ECB4004L | |
| Prolong gold antifade mountant | Thermofisher | P36930 | |
| Triton X-100 | SIGMA | T8787 | |
| Tween-20 | SIGMA | P1379 | |
| Lab equipment | Manufacturer | ||
| Bunsen burner | |||
| Confocal microscope | Leica | ||
| Diamond pen | bio-optica | ||
| Dissection pins | |||
| FACS polypropylene tubes | Falcon | ||
| Falcon tubes (50 and 15 mL) | Falcon | ||
| Glass coverslips | Thermofisher | ||
| Glass Pasteur pipettes (22cm) | VWR | ||
| Glass slides | Thermofisher | ||
| Micro dissecting scissors | |||
| Micropipette (1 mL and 200 µL) | Gilson | ||
| Micropipette tips | Corning | ||
| Petri dishes (100 and 35 mm diameter) | Thermofisher | ||
| Plastic pipettes (5 and 10 mL) | VWR | ||
| Rubber pipette bulbs | VWR | ||
| Sharp tweezers | |||
| Stereo dissection microscope with transmission illumination | Leica | ||
| Tissue culture hood or lamina flow cabinet | |||
| Tissue culture incubator (humidified, 37°C, 5% CO2) | |||
| Water bath at 37°C | VWR |
Referências
- Wang, Y. X., Dumont, N. A., Rudnicki, M. A. Muscle stem cells at a glance. Journal of Cell Science. 127 (21), 4543-4548 (2014).
- Le Grand, F., Rudnicki, M. A. Skeletal muscle satellite cells and adult myogenesis. Current Opinion in Cell Biology. 19 (6), 628-633 (2007).
- Zammit, P. S., Partridge, T. A., Yablonka-Reuveni, Z. The Skeletal Muscle Satellite Cell: The Stem Cell That Came in From the Cold. Journal of Histochemistry & Cytochemistry. 54 (11), 1177-1191 (2006).
- Franco, I., et al. Somatic mutagenesis in satellite cells associates with human skeletal muscle aging. Nature Communications. 9 (1), 800 (2018).
- Cosgrove, B. D., et al. Rejuvenation of the muscle stem cell population restores strength to injured aged muscles. Nature Medicine. 20 (3), 255-264 (2014).
- Bernet, J. D., et al. p38 MAPK signaling underlies a cell-autonomous loss of stem cell self-renewal in aged skeletal muscle. Nature Medicine. 20 (3), 265-271 (2014).
- Bianchi, A., et al. Dysfunctional polycomb transcriptional repression contributes to lamin A/C-dependent muscular dystrophy. Journal of Clinical Investigation. 130 (5), 2408-2421 (2020).
- Blau, H. M., Webster, C., Pavlath, G. K. Defective myoblasts identified in Duchenne muscular dystrophy. Proceedings of the National Academy of Sciences. 80 (15), 4856-4860 (1983).
- Jiang, C., et al. Notch signaling deficiency underlies age-dependent depletion of satellite cells in muscular dystrophy. Disease Models & Mechanisms. 7 (8), 997-1004 (2014).
- Vallejo, D., et al. PITX2 Enhances the Regenerative Potential of Dystrophic Skeletal Muscle Stem Cells. Stem Cell Reports. 10 (4), 1398-1411 (2018).
- Danoviz, M. E., Yablonka-Reuveni, Z. Skeletal Muscle Satellite Cells: Background and Methods for Isolation and Analysis in a Primary Culture System. Methods in Molecular Biology. (798), 21-52 (2012).
- Sacco, A., Doyonnas, R., Kraft, P., Vitorovic, S., Blau, H. M. Self-renewal and expansion of single transplanted muscle stem cells. Nature. 456 (7221), 502-506 (2008).
- Bischoff, R. Proliferation of muscle satellite cells on intact myofibers in culture. Developmental Biology. 115 (1), 129-139 (1986).
- Rosenblatt, J. D., Lunt, A. I., Parry, D. J., Partridge, T. A. Culturing satellite cells from living single muscle fiber explants. In Vitro Cellular & Developmental Biology - Animal. 31 (10), 773-779 (1995).
- Shefer, G., Yablonka-Reuveni, Z. Isolation and Culture of Skeletal Muscle Myofibers as a Means to Analyze Satellite Cells. Methods in Molecular Biology. (290), 281-304 (2005).
- Anderson, J. E., Wozniak, A. C., Mizunoya, W. Single Muscle-Fiber Isolation and Culture for Cellular, Molecular, Pharmacological, and Evolutionary Studies. Methods in Molecular Biology. 798, 85-102 (2012).
- Verma, M., Asakura, A. Efficient Single Muscle Fiber Isolation from Alcohol-Fixed Adult Muscle following β-Galactosidase Staining for Satellite Cell Detection. Journal of Histochemistry & Cytochemistry. 59 (1), 60-67 (2011).
- Keire, P., Shearer, A., Shefer, G., Yablonka-Reuveni, Z. Isolation and Culture of Skeletal Muscle Myofibers as a Means to Analyze Satellite Cells. Methods in Molecular Biology. 946 (206), 431-468 (2013).
- Pasut, A., Jones, A. E., Rudnicki, M. A. Isolation and Culture of Individual Myofibers and their Satellite Cells from Adult Skeletal Muscle. Journal of Visualized Experiments. (73), e50074 (2013).
- Gallot, Y., Hindi, S., Mann, A., Kumar, A. Isolation, Culture, and Staining of Single Myofibers. Bio-Protocol. 6 (19), 1942 (2016).
- Liu, L., Cheung, T. H., Charville, G. W., Rando, T. A. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting. Nature Protocols. 10 (10), 1612-1624 (2015).
- Machado, L., et al. In Situ Fixation Redefines Quiescence and Early Activation of Skeletal Muscle Stem Cells. Cell Reports. 21 (7), 1982-1993 (2017).
- Lucini, F., Bianchi, A., Lanzuolo, C. Formaldehyde-mediated snapshot of nuclear architecture. Methods in Molecular Biology. , (2020).
- Sullivan, T., et al. Loss of a-Type Lamin Expression Compromises Nuclear Envelope Integrity Leading to Muscular Dystrophy. The Journal of Cell Biology. 147 (5), 913-920 (1999).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados