Method Article
פיתוח ובדיקה של מבחני PCR כמותיים ספציפיים למינים עבור יישומי DNA סביבתיים
* These authors contributed equally
In This Article
Summary
בדיקות DNA סביבתיות דורשות תכנון קפדני, בדיקות, אופטימיזציה ואימות לפני תחילת איסוף נתוני השדה. כאן, אנו מציגים פרוטוקול שייקח את המשתמשים דרך כל שלב של תכנון בדיקת qPCR ספציפית למינים, מבוססת בדיקה לגילוי וכימות של דנ"א של מיני יעד מדגימות סביבתיות.
Abstract
שיטות חדשות ולא פולשניות לגילוי וניטור נוכחות מינים מפותחות כדי לסייע בניהול הדיג ושימור חיות הבר. השימוש בדגימות DNA סביבתיות (eDNA) לגילוי מקרוביוטה הוא קבוצה כזו של שיטות שהופכות במהירות לפופולריות ומיושמות בתוכניות ניהול לאומיות. כאן אנו מתמקדים בפיתוח מבחנים ממוקדים ספציפיים למינים עבור יישומי PCR כמותי (qPCR) מבוססי בדיקה. שימוש qPCR מבוסס בדיקה מציע ספציפיות רבה יותר מאשר אפשרי עם פריימרים בלבד. יתר על כן, היכולת לכמת את כמות ה- DNA במדגם יכולה להיות שימושית בהבנתנו את האקולוגיה של eDNA ואת הפרשנות של דפוסי זיהוי eDNA בתחום. יש צורך בשיקול דעת זהיר בפיתוח ובדיקה של מבחנים אלה כדי להבטיח את הרגישות והספציפיות של גילוי מיני היעד מדגם סביבתי. בפרוטוקול זה נתוו את השלבים הדרושים לתכנון ובדיקה של מבחנים מבוססי בדיקה לגילוי מין יעד; כולל יצירת מסדי נתונים של רצף, עיצוב מבחנים, בחירה ואופטימיזציה, בדיקת ביצועים של מבחני ביצועים ואימות שדות. ביצוע שלבים אלה יסייע בהשגת חקירה יעילה, רגישה וספציפית שניתן להשתמש בה בביטחון. אנו מדגימים תהליך זה עם ההסתערות שלנו המיועדת לאוכלוסיות של הרפש(Actinonaias רצועה),מינים מולים מים מתוקים נמצאו בנהר Clinch, ארה"ב.
Introduction
חוקרים ומנהלים מתעניינים יותר ויותר בשימוש ב-DNA סביבתי לגילוי מינים. במשך שלושה עשורים, PCR כמותי או בזמן אמת (qPCR / rtPCR) שימש בתחומים רבים לגילוי וכימות ספציפיים לרצף של חומצות גרעין1,2. בתוך התחום החדש יחסית של מחקר eDNA, השימוש ב מבחנים אלה עם עקומה סטנדרטית לכימות עותקים של DNA היעד לכל נפח או משקל של דגימת eDNA הפך עכשיו בפועל שגרתי. רצפי דנ"א מיטוכונדריאליים ממוקדים בדרך כלל ב-eDNA assays מכיוון שהגנום המיטוכונדריאלי קיים באלפי עותקים לתא, אך גם בדיקות לדנ"א גרעיני או לרצפי RNA אפשריות. חשוב להבין כי מבחנים שפורסמו עבור דגימות eDNA אינם תמיד שווים בביצועים. האמינות של בדיקה לגילוי דנ"א של מין יעד בלבד (כלומר, ספציפיות) וזיהוי כמויות נמוכות של דנ"א מטרה (כלומר, רגישות) עשויות להשתנות במידה ניכרת בשל הבדלים באופן שבו הבדיקה תוכננה, נבחרה, אופטימלה ונבדקה. בעבר התעלמו במידה רבה מהמדדים הכמותיים המדווחים לביצועי מבחנים, אך לאחרונה התעלמו מהסטנדרטים לשיפורהשקיפותבפיתוח מבחנים 3,4,5,6,7,8.
אופטימיזציה ודיווח של עזרי ביצועים מבחני מחקר בעיצוב מחקר ופרשנות של תוצאות סקר eDNA. מבחנים המצליבים עם דנ"א של מינים שאינם מיועדים למטרה עלולים להוביל לגילויים חיוביים כוזבים, בעוד שמבחנים בעלי רגישות לקויה עלולים להיכשל בזיהוי הדנ"א של מיני היעד גם כאשר הוא נמצא במדגם (תשלילים כוזבים). הבנה של רגישות ובחירה במהלך הבחינת תסייע ליידע את מאמץ הדגימה הדרוש לגילוי מינים נדירים. בגלל שיש מקורות טבעיים רבים של וריאציה eDNA, מחקרים חייבים להגביל מקורות לשליטה של וריאציה ככל האפשר, כולל אופטימיזציה מלאה ואפיון eDNA assay3.
תנאים המשפיעים ישירות על הספציפיות או הרגישות של ההסתעפות ישנו את ביצועי ההסתעפות. זה יכול להתרחש בתנאי מעבדה שונים (כלומר, ריאגנטים שונים, משתמשים, מכונות וכו '). לכן, יש לבחון מחדש פרוטוקול זה בעת החלת בדיקה בתנאים חדשים. אפילו מבחנים המאופיינים היטב בספרות צריך להיבדק אופטימיזציה כאשר אומץ על ידי מעבדה חדשה או בעת שימוש ריאגנטים שונים (למשל, פתרון מאסטר לערבב)5,9. הספציפיות של בדיקה עשויה להשתנות כאשר היא חלה על אזור גיאוגרפי אחר, מכיוון שהבדיקה מוחלת על דגימות מקהילה ביוטית חדשה שעשויה לכלול מינים שאינם יעדים שהבדיקה לא נבדקה נגדם, וייתכן שתתרחש שונות גנטית במין היעד. שוב, יש להעריך מחדש את ההסתעפות בעת שימוש במיקום חדש. תנאי השדה שונים מתנאי מעבדה כי בתחום מעכבי PCR נוטים יותר להיות נוכחים בדגימות. מעכבי PCR משפיעים ישירות על תגובת ההגברה ובכך משפיעים על ביצועי ההגברה. מסיבה זו, נדרשת שליטה חיובית פנימית בעת פיתוח בדיקת eDNA.
לבסוף, התנאים הסביבתיים בשטח יכולים להשפיע על מולקולות הדנ"א של מיני המטרה ועל לכידתן באמצעות השפלת דנ"א, הובלה ושימור. יתר על כן, פרוטוקולים שונים לאיסוף וחילוץ DNA משתנים ביעילותם וביכולתם לשמור על DNA. עם זאת, חשוב לציין כי תהליכים אלה משפיעים על יכולת הגילוי של eDNA אך לא על הביצועים של מבחנים מולקולריים. לכן, יכולת הגילוי של DNA ממין היעד בדגימות שדה היא פונקציה של הביצועים הטכניים של בדיקת qPCR, כמו גם תנאי שדה ופרוטוקולי איסוף, אחסון וחילוץ. בעת שימוש בהסתעפות מאופיינת היטב וביצועים גבוהים, משתמשים יכולים להרגיש בטוחים ביכולות של ההסתעפות; מתן אפשרות לחוקרים להתמקד כעת בהבנת גורמי ההסתעפות החיצוניים (כלומר, משתנים סביבתיים, הבדלים בפרוטוקולי לכידה או חילוץ) המשפיעים על זיהוי eDNA.
כאן אנו מתמקדים במיוחד בביצועים הטכניים של Assay באמצעות תכנון ואופטימיזציה קפדניים. אנו מדגימים את הפרוטוקול באמצעות בדיקה מבוססת בדיקה שפותחה לגילוי מולים של מים מתוקים, הראקט(רצועה Actinonaias),ממים שנדגמו בנהר קלינץ ', ארה"ב. לאחרונה Thalinger et al. (2020) הציג הנחיות לאימות מבחני eDNA ממוקדים. תכנון מבחנים בהתאם לפרוטוקול שלנו יביא מבחנים לרמה 4 של תלינגר ואח 'בתוספת צעד נוסף לקראת רמה 56. בשלב זה הביצועים הטכניים של בדיקה יהיו ממוטבים והיא תהיה מוכנה לשימוש קבוע ביישומי מעבדה ושדה. שימוש נוסף ב- assay במעבדה, mesocosm, וניסויי שדה לאחר מכן יכול לענות על שאלות לגבי זיהוי eDNA וגורמים המשפיעים על יכולת הגילוי, השלבים הסופיים עבור אימות רמה 56.
Protocol
1. יצירת מסד נתונים רצף של רצפי DNA מיטוכונדריאליים ממין היעד ולא היעד של עניין
- הגדר את השאלה, היעדים והמערכת המטופלים. זהה את מין היעד לגילוי eDNA. זהה את המערכת הגיאוגרפית שבה ייעשה שימוש במהלך ההסתעפות. הכינו רשימה של מינים בעלי עניין, כולל מיני היעד, מינים סימפטיים (המתרחשים במשותף) בתוך אותה מסה (בדרך כלל סדר או רמת משפחה), ומינים אלופטריים קרובים, כאלה שאולי אינם באותו מיקום גיאוגרפי כמו היעד (איור 1).
הערה: כאן, אוכלוסיות נהר Clinch של המין A. רצועה היו ממוקדים. - חפש והורד רצפים מאזורי גנים מרובים עבור מינים ברשימה משלב 1. מסדי נתונים רצף כגון NCBI (המרכז הלאומי למידע ביוטכנולוגיה), BOLD (ברקוד של מסד נתונים של החיים), EMBL (המעבדה האירופית לביולוגיה מולקולרית) ו DDBJ (דנ"א נתונים בנק של יפן) ניתן להשתמש. NCBI, EMBL ו- DDBJ משתפים מידע רצף.
- באמצעות מסד הנתונים Nucleotide של NCBI, לחפש את האורגניזם היעד (למשל, Actinonaias רצועה)ואזור גנים (למשל, ציטוכרום c אוקסידאז I (COI) או NADH-דהידרוגנאז 1 (ND1); מחרוזת חיפוש לדוגמה: רצועה Actinonaias ו- ND1)
- לאחר מכן, בחר את כל הרצפים התואמים למפרטים ובחר שלח אל. בחר הקלטה מלאה, תבנית קובץ והורדה כ- GenBank או FASTA ולאחר מכן צור קובץ. רצפים אלה נשמרים כעת במחשב.
- חזור על שלבים אלה עבור כל המינים ברשימה המוגדרת בשלב 1. שמור רצפים עבור כל אזור גנים בקובץ נפרד כמו אלה ינותח בנפרד.
- הורד את כל הרצפים הרלוונטיים (או חלק גדול ומייצג של רצפים) עבור מיני היעד שזוהו בשלב 1. כלול משתנים גיאוגרפיים במידת האפשר.
- חזור על רצפי החיפוש וההורדה עבור מינים קשורים וסימפטריים שאינם יעד מאותה קבוצה טקסונומית שזוהו בשלב 1 (למשל, אם מין היעד הוא הרפש (A. רצועה) להוריד רצפים עבור כל מינים אחרים של מולים מים מתוקים ב Unionidae המשפחה המתרחשים במערכת של עניין).
- חזור על החיפוש וההורדה עבור מינים הקשורים קשר הדוק אך allopatric (נפרד גיאוגרפית) המפורטים בשלב 1.1.
הערה: לא כל המינים (יעדים ולא מטרות) יהיו זמינים במאגרי המידע הציבוריים. הגדל את מאגר הייחוס המקומי על-ידי הגברה ורצף של דגימות מאומתות טקסונומית של מינים בעלי עניין בתוך הבית. אם עובדים עם מין בעל מגוון גנטי גבוה בתוך המינים או עובדים באזור גדול גיאוגרפית שבו ניתן לצפות לגרסאות גיאוגרפיות, אספו רצפים מרחבי הטווח.
2. עיצוב אסאי
- ישר רצפים מכל אזור גנים בנפרד באמצעות תוכנת יישור שניתן למצוא בתוכניות שונות לעריכת רצף גנטי וביואינפורמטי. בצע יישור זה עבור כל אחד מאזורי הגנים השונים.
- לדוגמה, באמצעות תוכנת Geneious Prime (https://www.geneious.com) לייבא את קבצי הרצף שהורדו לתוך התוכנית.
- צור תיקיות נפרדות עבור כל אזור גנים.
- בתוך תיקיה המכילה רצפים מאזור גנים אחד, בחר את כל הרצפים.
- השתמש בכלי יישור מרובה כדי ליצור יישור נוקלאוטידים של הרצפים שנבחרו. ייתכנו מספר אפשרויות עבור סוג היישור, באמצעות היישורים Geneious או MUSCLE ופרמטרים ברירת המחדל עובד היטב.
- בחר אזורים מבטיחים לעיצוב מבחנים באמצעות הפריט החזותי של נתוני רצף מיושרים. אזור שיש בו הרבה נתוני רצף זמינים עבור מינים מעניינים, הוא מאוד שונה בין מינים, ומראה וריאציה נמוכה בתוך המינים הוא מועמד טוב. זה יגדיל את הסבירות כי פריימרים ובדיקות שתוכננו יוכלו להפלות את היעד מ מינים שאינם יעד, תוך הבטחת גרסאות תוך ספציפיות יגבירו עם הבדיקה.
- תכנון של פרייומרים ובדיקה.
- השתמש בתוכנת תכנון של מבחני qPCR ובצע את ההוראות. כלי PrimerQuest של IDT (https://www.idtdna.com/) לעיצוב 5 סטים של מבחני qPCR שימש כאן.
- הדבק את הרצף שנבחר בשלב 2.2 בתיבה ערך רצף. אם היישור יצר רווחים, מחק אותם מהרצף.
- בחר qPCR 2 פריימרים + בדיקה באפשרות בחר את העיצוב שלך.
- הורד את התסעפויות המומלצות.
- העתק את הרצפים מהפריימריז קדימה של ההסתעפות הראשונה וחפש רצף פריימר זה ביישור שנוצר בשלב 2.1.4. בשעת שימוש ב-Geneious Prime, השתמשו בכלי ביאורים וחיזוי כדי להוסיף את אזור הפריימריז ליישור. עשה זאת עבור כל שילובי הפריימריז והגשושים (איור 2).
- בדוק אזורים אלה של היישור עבור וריאציה בתוך מיני היעד, כמו גם בתוך המינים המתרחשים יחד.
- אם יש וריאציה גנטית תוך-ספציפית, חפש מבחנים שבהם הפריימריז והגשוש אינם נמצאים באזורים אלה.
- כדי למנוע הגברה של מינים שאינם מיועדים למטרה, חפשו אי-התאמות עם מינים שאינם מיועדים למטרה. בחר מבחנים עם מספר אי-ההתאמות הרב ביותר לאימות נוסף. Currier et al. (2018) מציע לבחור סטים עם לפחות שניים משלושת האזורים (שני פריימרים, או פריימר ובדיקה) שיש לפחות שתי אי התאמות עם כל המינים שאינם היעד. עם זאת, יש לזכור כי אי התאמות בבדיקה לתרום פחות ספציפיות10.
הערה: הבדלים בתוך 3 זוגות בסיסים של הקצה 3 ' של כל פריימר להגדיל את הספציפיות טוב יותר מאשר הבדלים 5 'בסוף פריימרים10.
- שקול את הפרמטרים החשובים הבאים בעיצוב מבחנים.
- לקבוע את טמפרטורות ההיתוך והחישול של הפריימריז והגשוש. באופן אידיאלי טמפרטורת ההיתוך (Tm) של פרייומרים צריך להיות בין 60-64 מעלות צלזיוס ובתוך 2 מעלות צלזיוס אחד מהשני, ואת Tm של החללית צריך להיות 6-8 מעלות גבוה יותר מאשר Tm של פרייומרים. הגדר את טמפרטורת חישול (Ta) של תגובת qPCR 5 מעלות צלזיוס מתחת לטמפרטורת ההיתוך, סביב 55-60 מעלות צלזיוס11.
- בדוק את תוכן ה- GC. בחר בין 35 - 65% תוכן GC, והימנע מאזורים עם 4 Gs רצופים או יותר. לאחר 1 או 2 Gs או Cs ב 5 הבסיסים האחרונים של סוף 3 ' של פריימר (מהדק GC) עשוי להגביר את הספציפיות כפי שהוא יעזור פריימר לעשות קשר חזקיותר 12.
- חפשו סיכות ראש ומבנים עמומים יותר. בדיקת פריימרים ובדיקה עבור מבנים סיכת ראש חזוי dimers באמצעות תוכנית ניתוח אוליגונוקלאוטידים (למשל, OligoAnalyzer -IDT13; אוליגוקולקטור14). מבנים אלה יכולים לגרום הגברה שאינה יעד ויעילות נמוכה יותר. הימנע מבחנים אשר צפויים ליצור מבנים אלה.
- קבע את אורך פריימר. כוון לפריימרים באורך של 18-25 בסיסים ואורך בדיקה בין 20 ל-25 בסיסים. פריימרים ובדיקות ארוכים יותר עשויים להיות בעלי יעילות הגברה נמוכה יותר.
- קבע את אורך האמפליקון. זה צריך להיות בין כ 100 ו 250 זוגות בסיס. טווח זה הוא בדרך כלל קצר מספיק עבור יעילות PCR גבוהה, אבל מספיק זמן כדי להקל על אימות על ידי רצף סנגר4,15.
- גשושי תכנון. ודא את הבדיקות אין בסיס G בסוף 5 ', כי זה יכול לעמעם את האות מצבעים ירוקים וצהובים11. עיצבנו בדיקות מרווה כפולה, עם IDT 3IABkFQ ומרווה ZEN ופלואורים FAM או HEX.
הערה: לקבוע את בדיקות MGB: TaqMan MGB (קלסר חריץ קטין) בדיקות משמשים לעתים קרובות עבור מחקרים eDNA. עם זאת, מכיוון שבדיקות אלה קצרות מאוד, הן יכולות להיקשר למטרות שאינן מטרות אפילו עם אי התאמה של זוג בסיס 2 או3 10. - לקבוע את הבדיקה Tm. טמפרטורת ההיתוך של החללית צריכה להיות 6-8 מעלות צלזיוס גבוה יותר מאשר פרייומרים. טמפרטורות נמוכות יותר להקטין את ההצלחה מחייבת של החללית.
- קבע את אורך ומיקום הבדיקה. החללית צריכה להיות בין 20 ל 25 bp אורך וממוקם באופן אידיאלי קרוב לאתר מחייב פריימר על אותו גדיל מבלי לחפוף אותו.
3. בדיקת סינון ואופטימיזציה
- בסיליקו מבחני פיתוח ובדיקות. לפני הזמנת סטים פריימר-בדיקה, להעריך את הספציפיות (הגברה פוטנציאלית שאינה יעד) על ידי בדיקת הגברה פריימר ב silico.
- בדוק פריימרים באמצעות פריימר-Blast16 של NCBI או תוכניות דומות שיכולות לזהות מטרות פוטנציאליות שאינן מטרות במסד הנתונים nt/nr של NCBI שעשויות להגביר עם הבדיקה. אם משתמשים בפריימר-בלאסט להדביק פריימרים בתיבה השתמש בפריימר שלי תחת פרמטרים של פריימר. באפשרויות פרמטרים של בדיקת ספציפיות זוג פריימר, בחר nr כמסד הנתונים והקלד את סדר האורגניזם המעניין (למשל, "Unionida" או "Unionoida") בתיבה אורגניזם.
- המשך להעריך ערכות פריימר/בדיקה באופן חזותי בנתוני רצף מיושרים.
- על מנת להעריך פריימרים ובדיקות בו זמנית בסיליקו, צור מחרוזת טקסט של פריימר קדימה, 12 N של, החללית, 12 N של, ואת המשלים ההפוך של פריימר הפוך. אם רצף הבדיקה נמצא בטווח של 12 זוגות בסיסים של אחד מהפריימריז, השתמש במספר N המתאים למספר זוגות הבסיס בין פריימר לבדיקה.
- השתמש בחיפוש Nucleotide Blast של NCBI (Blastn) כדי לחפש מול מסד הנתוניםnr 17. השתמש בכרטיסיה טקסונומיה כדי לחפש מינים שאינם מיועדים ליעד עם מעט אי-התאמות; אלה צריכים להיבדק במעבדה במהלך אופטימיזציה assay.
הערה: בבדיקות silico מסייע לשלול מבחנים לא ספציפיים, אבל מבחנים ספציפיים פוטנציאליים חייב להיבדק אמפירית (במבחנה), כמו לא כל המינים יש רצפים במסדי הנתונים הגנטיים פריימר ובדיקות עדיין יכול להיקשר למטרות שאינן גם אם נחשב סביר על ידי התוכנה.
- בחר שלושה עד חמישה שילובי פריימר /בדיקה לבדיקה במעבדה.
- הזמינו פריימרים, בדיקות ותקן דנ"א סינתטי, כמו גם פריימרים נוספים עם זנב M13 לריצוף אמפליקון.
- הזמן פרייימריז ובדיקות אוליגונוקלאוטידים סינתטיים מחברה שמייצרת אוליגוס. הגשושים מסומנים בצבע פלואורסצנטי ומרווה. יש לבחור פלואורופורים שונים עבור מבחנים שיש לבצע מולטיפלקסים. בדוק את מכשיר qPCR שלך לקבלת רשימה של אילו פלואורופורים המכשיר יכול לזהות.
- תכנון והזמנה של פריימרים זנב M13 לאימות זיהויי qPCR עם רצף סנגר על ידי הוספת רצף M13 קדימה (-20), GTA AAA CGA CGG CCA GT, עד קצה 5 ' של פריימר קדימה, ואת M13 הפוך (-27) רצף, CAG GAA ACA GCT ATG AC, עד סוף 5' של פריימר הפוך.
- תקן הדנ"א הסינתטי מכיל את רצף היעד (כולל אזורי פריימר) בריכוז ידוע בעותקים/μL. כימת דגימות לא ידועות בהתבסס על עקומה שנעשתה על ידי ריכוזים ידועים של תקן זה (כלומר, העקומה הסטנדרטית). לרכוש את התקן הסינתטי מאותה חברה המייצרת את פרייומרים ובדיקה. פעל בהתאם להמלצות היצרן לשימוש חוזר ולאחסון. דילל תקנים במאגר TE עם ספק tRNA המשתמש בכלי פלסטיק בעלי החזקה נמוכה להפחתת הידרוליזה ואיגוד למשטחים.
הערה: אם העקומה הסטנדרטית אינה מתפקדת היטב (יעילות PCR ירודה, ראה שלב 3.4.2), נסה להשעות מחדש את התקן במים או Tris-HCl. - השעה פריימרים ובדיקות במים ללא גרעין, Tris-HCl או מאגר TE בריכוזים נוחים לשימוש בבדיקה. בדרך כלל, לדלל מניות עבודה 20-פי בתמהיל הראשי כדי להשיג את הריכוז הסופי אופטימיזציה. יש לאחסן אוליגוס מושעים ב-20 °C (69 °F) קבוע כאשר אינם בשימוש.
- במבחנה (במעבדה) בדיקות אופטימיזציה ובדיקות. לדחות מבחנים שיש להם יעילות ירודה, להגיב עם מינים המתרחשים במשותף, או יש רגישות ירודה18. כלול את השימוש בפקד חיובי פנימי (IPC) במהלך פיתוח מבחנים וכן בעת הפעלת דגימות בפועל.
- ראשית, למצוא את הטמפרטורה האופטימלית ואת ערכי ריכוז פריימר / בדיקה עבור הבדיקה. לאחר שפרמטרים אלה מוטבו ליעילות PCR (שלב 3.4.2), תגובתיות צולבת (שלב 3.4.3) ורגישות (שלב 3.4.4), המשך לבדוק את הבדיקה באמצעות IPC מרובה ערכים (שלב 3.4.5).
- בדוק טמפרטורת חישול אופטימלית (Ta) עבור פריימר ובדיקות באמצעות שיפוע טמפרטורת PCR ממורכז 5° C מתחת Tm פריימר הממוצע החזוי.
- בדוק את ריכוזי הפרימר והבדיקה האופטימליים. בדרך כלל נבדקים ריכוזי פריימר של 200 ננומטר, 400 ננומטר ו-800 ננומטר וריכוזי בדיקה של 75 ננומטר, 125 ננומטר ו-200 ננומטר.
- צור עקומה סטנדרטית וקבע יעילות וטווח ליניארי. בדקו לפחות שישה דילולים של תקן דנ"א סינתטי פי 10 המכיל את רצף המטרה, במהירות של כ-100 עותקים/תגובה ל-10 5 עותקים/תגובה(איור 3A).
- השתמש בתוכנת qPCR כדי להתוות את ערך Cq (סף למחזור לכימות) של כל תקן על ציר y ואת בסיס יומן הרישום 10 של הריכוז הסטנדרטי הראשוני בעותקים /תגובה על ציר ה- x. תוכנת qPCR אמורה להפעיל באופן אוטומטי רגרסיה ליניארית (איור 3B).
- לחשב את היעילות מן השיפוע של הרגרסיה, E = -1 + 10(-1/שיפוע). לדוגמה, אם השיפוע הוא -3.4, E= -1 + 10(0.29) = 0.97 או 97%. בדוק גם את ערכי r2 המציינים עד כמה השכפולים הסטנדרטיים מתאימים לעקומה. תוכנת qPCR צריכה לחשב זאת באופן אוטומטי גם כן (איור 3B). כוון לערכי יעילות של 100% (±10%) וערכי r2 של ≥0.989,15,19,20,21,22.
- בדוק באופן חזותי את עקומת התקן לאיתור הטיה, כלומר סטיות מהנסיגה בכיוון עקבי או לביצועי עקומה סטנדרטיים ירודים כפי שהם נמדדים על-ידי ערכי יעילות וערכי r2 (איור 3C ו- 3D).
- ספציפיות: להעריך תגובתיות צולבת עם מינים שאינם יעד כדי להקטין את הסיכוי לחיוביות שגויות. כאשר זיהויי eDNA עלולים לגרום להחלטות ניהול יקרות, אמת גילויים חיוביים על-ידי רצף אמפליקון.
- לא מטרות: להפעיל את ההסתערות נגד עקירות DNA גנומי של דגימות מאומתות טקסונומית של מינים קשורים של מינים משותפים גיאוגרפית; כאשר העדיפות הגבוהה ביותר היא לבחון מינים הקשורים קשר הדוק, המתרחשים במשותף. השתמש בריכוזי דנ"א כוללים דומים הן לדגימות יעד והן לדגימות שאינן מטרות. הריכוז שנבחר אמור להניב הגברה מדגימות מיני יעד בסמוך לאמצע הטווח הליניארי של העקום הסטנדרטי. הגברה יש לראות רק עם מיני היעד.
- אם נצפתה הגברה שאינה יעד, נקה וסדר את המוצר כדי לאמת את זהותו. אין זה נדיר לראות זיהום ממין היעד בדגימות רקמה של מינים שאינם יעד, ולכן כל הגברות בשלב זה צריך להיות מאומת על ידי רצף. תדגמו מחדש אמפליונים מנוקים מבדיקות ספציפיות באמצעות פריימרים זנב M13 ורצף עם פריימרים M13.
- במעבדה שלאחר PCR, להעביר את מוצרי qPCR להיות רצף צינורות טריים. הסר פריימרים שיורית ורכיבי תגובה עם ערכת ניקוי (למשל, ערכת טיהור PCR MinElute).
- הפוך 1:100 דילולים של elutions ולהגבר 1 μL של כל אחד במשך 30 מחזורים בתגובת PCR 50 μL עם פריימרים זנב M13 ופולימראז נאמנות גבוהה (למשל, פולימראז DNA פידליטי גבוהה של Phusion).
- הפעל 10 μL של כל תגובה על ג'ל 1% agarose כדי לבדוק להקה אחת בגודל הצפוי. אם לא נצפתה רצועה, הגדילו את מספר המחזורים או את כמות הדגימה. אם נצפו מספר להקות, יש לטהר את הרצועה בגודל הצפוי.
- הסר פרייומרים שיורית ורכיבי תגובה עם ערכת ניקוי כאמור לעיל ולמדוד את ריכוזי ה- DNA של elutions.
- הגדר תגובות רצף עם פרייומרים M13 על פי ההוראות של מתקן הרצף.
הערה: לעולם אל תפתח דגימות מוגברות במעבדת qPCR. הכינו דגימות לריצוף במעבדה המוקדשת לדגימות שלאחר PCR.
- רגישות: רגישות משפיעה על הסיכוי לתשלילים כוזבים, או כשלים בזיהוי הדנ"א של מיני היעד כאשר הוא קיים. להעריך את מגבלת הגילוי (LOD) ואת מגבלת הכימות (LOQ) עבור כל מבחנים. לבסוף, לכלול שליטה חיובית פנימית (IPC) כדי להעריך עיכוב PCR של דגימות. מולטיפלקס ולבדוק את הבדיקה IPC עם הבדיקה המתוכננת כדי להבטיח את שתי הבדיקות לא להפריע אחד לשני.
- LOD: בצעו שישה דילולים סדרתיים פי 4 של תקן הדנ"א הסינתטי, עם 8-24 שכפולים לדילול סטנדרטי (איור 4). חשב את הריכוז ההתחלתי הנמוך ביותר עם זיהוי של 95%. ניתן ליצור חלקות LOD ו- LOQ באמצעות מחשבון LOD/LOQ R Script5.
הערה: אין לצנזר נתונים מתחת ללוד. בשל הספציפיות של PCR, אין גבול נמוך יותר עבור תוצאות חיוביות אמיתיות. LOD הוא הריכוז הגבוה ביותר שמתחתיו צפויים להתרחש תשלילים כוזבים. - LOQ: מאותה סדרת דילול, לחשב את הריכוז הסטנדרטי ההתחלתי הנמוך ביותר DNA לכימות עם מקדם של וריאציה (CV) מתחת 35%.
הערה: יש לדווח על LOD ו- LOQ בעותקים/תגובה. בעת שימוש ב- assay מאומת ודגימות שדה להגביר מתחת LOQ, יש לדווח על תוצאות כמו % גילויים ולא ריכוזי eDNA, כי הריכוז המדויק לא ניתן למדוד בביטחון5.
- LOD: בצעו שישה דילולים סדרתיים פי 4 של תקן הדנ"א הסינתטי, עם 8-24 שכפולים לדילול סטנדרטי (איור 4). חשב את הריכוז ההתחלתי הנמוך ביותר עם זיהוי של 95%. ניתן ליצור חלקות LOD ו- LOQ באמצעות מחשבון LOD/LOQ R Script5.
- השתמש בבקרה חיובית פנימית (IPC) כדי לבדוק עיכוב PCR. עיכוב יכול להוביל לירידה ברגישות ותשלילים כוזבים. בדוק את היכולת של הבדיקה IPC להיות מולטיפלקסים עם הבדיקה היעד.
- בדיקה IPC יכול להיות מולטיפלקסים עם הבדיקה היעד באמצעות בדיקה עם צבע כתב שונה מאשר הבדיקה היעד. בדיקה זו של IPC מורכבת מרצף דנ"א סינתטי קצר ממין שאינו קשור למסה היעד, המשולב בתמהיל האב qPCR בריכוז נמוך של כ -102 עותקים / תגובה, יחד עם פריימר ובדיקות המזהות אותו. ריכוז נמוך זה נחוץ כדי למנוע תחרות עם רצף היעד עבור פולימראז ונוקלאוטידים23.
- השווה את ערך ה- Cq של תבנית ה- IPC של הדוגמה לזה של תבנית IPC בפקד ללא תבנית. בפקד זה ללא תבנית (NTC), קלט ה- DNA היחיד הוא זה של תבנית IPC. תבנית IPC בתגובה זו אמורה להגביר כצפוי. אם תבנית IPC במדגם מגבירה ב- 2 מחזורים או יותר השונים מאלה של תבנית IPC ב- NTC, דוגמת eDNA מעוכבת. דגימות המראות עיכוב ניתן לדלל 1:10 ולבדוק מחדש. אם דגימה נשארת מעוכבת, יש להסיר דגימה זו מניתוח.
- ראשית, למצוא את הטמפרטורה האופטימלית ואת ערכי ריכוז פריימר / בדיקה עבור הבדיקה. לאחר שפרמטרים אלה מוטבו ליעילות PCR (שלב 3.4.2), תגובתיות צולבת (שלב 3.4.3) ורגישות (שלב 3.4.4), המשך לבדוק את הבדיקה באמצעות IPC מרובה ערכים (שלב 3.4.5).
- באתרו מבחני פיתוח ובדיקות
- במעבדה: אם גישה לאורגניזם במעבדה, כמו גם מינים סימפדים זמין; לקחת דגימות מים ממארזים עם מינים אלה, לעבד את הדגימות ולבדוק את הבדיקה נגד דגימות eDNA אלה. מוצרי רצף כאמור לעיל כדי לאמת הגברה של היעד המיועד באמצעות פריימרים זנב M13.
- בשדה:
- זהה אתרים שבהם ידוע שאורגניזם היעד מתרחש וידוע שלא יתרחש. עדיף להיות מידה מסוימת של שפע בכל אתר שבו מיני היעד מתרחשת.
- החלט באילו אמצעי אחסון לדוגמה ושיטות איסוף לדוגמה (לדוגמה, סינון, צנטריפוגה וכו') ייעשה שימוש.
- כלול פקד שדה ריק או שלילי בכל אתר, זהו מים נקיים שהובאו לאתר השדה ולאחר מכן נאספו והוכנו עם אותם ציוד שדה ופרוטוקולים המשמשים לדגימה eDNA24. מטרת השדה הריק היא לזהות זיהום של ציוד הדגימה וציוד השדה שהובאו לאתר. קח את השדה ריק לפני עיבוד דגימות מים שדה.
- קח דגימות מים מרובות לכל אתר, רצוי 3 דגימות לכל אתר.
- בחזרה למעבדה, לעבד ולחלץ דגימות.
- הפעילו את ההסתעפות באמצעות לוח שהוגדר בדומה לאיור 5A והשוו את הריכוז ותדירות האיתור של eDNA להבדלים ידועים בין התרחשות לשפע. אשר את כל הזיהויים על ידי רצף24,25.
הערה: האמור לעיל יאמת בדיקה עד רמה 4 של Thalinger et al.s (2020) סולם 6 (אופטימיזציה שלהביצועים הטכניים של ההסמכה) ולהתחיל לאסוף נתונים התומכים באימות בדיקה ברמה 5. רמה 5 משלבת מידול הסתברות ושימוש במבחן לאקולוגיה eDNA. אנו מרגישים שזה מעבר להיקף של פיתוח מבחני בדיקה בסיסיים, אך אנו מעודדים יישומים אלה של מבחני מעבדה ושדה שנבדקו כדי לשפר את העיצוב ופרשנות הנתונים.
תוצאות
בתכנון מבחני qPCR ספציפיים למינים עבור הרפש (A. רצועה), הורדו רצפים זמינים של כל מיני יונידיה בנהר קלינץ '. מינים קרובים כגון Lampsilis siliquoidea נכללו גם במסד הנתונים של הייחוס למרות שהם לא נמצאים באותו נהר. לא כל המינים במערכת הנהר של עניין נמצאו GenBank, כך מינים נוספים היו רצף בבית. רצפים היו מיושרים באמצעות תוכנת Geneious ותוכנת Primer Quest (IDT) שימשה לתכנון מבחנים מרובים. חמישה סטים של פריימטרים וגשוש נוספו ליישור להערכה חזותית (איור 2). לאחר מכן הם נבדקו בסיליקו באמצעות Primer-Blast, ולאחר מכן הם הוזמנו לבדיקות נוספות במבחנה. במעבדה נבדקו כל הבדיקות באמצעות עקירות דנ"א של 27 מינים זמינים כדי לאמת את הספציפיות. בדיקת כפיים אחת (A.lig.1) הגבירה בהצלחה רק את מיני המטרה (טבלה 1; טבלה 2). בדיקה זו התקדמה לבדיקה נוספת של יעילות הבדיקה, LOD ו- LOQ. יש לו אורך אמפליפון של 121 זוגות בסיסים. טבלה 3 מציגה את הרצף המשמש עבור תקן ה- DNA הסינתטי A. רצועה. איור 3A ואיור 3B מציגים את התוצאות של בדיקה מוצלחת עם יעילות טובה וערכי r2. איור 3C ואיור תלת-ממד מציגים מבחני עקום סטנדרטיים שיש להם יעילות ירודה; ההסתעפות הזו הושלכה. LOD ו LOQ עבור assay שנבחר (A.lig.1) נמצאו שניהם להיות 5.00 עותקים / תגובה באמצעות השיטה דיסקרטית המתוארת קלימוס ואח'5. ה- IPC שהיה מרובה עם ה- assay (טבלאות 3-6) לא השפיע על העקומה הסטנדרטית של A. רצועה. IPC אנו משתמשים הוא קטע של תעתיק HemT העכבר. מבחנים אלה עוצבו מראש על ידי IDT עבור יישום אחר, אך שינינו את השימוש בו כ- IPC עבור יישומי eDNA של המעבדה שלנו.
הפעלת qPCR מוצלחת אמורה לעמוד בקריטריונים מסוימים עבור כל מדד ביצועים (כלומר, הגברה סטנדרטית של עקומה, שליטה חיובית בדנ"א גנומי, ללא בקרת תבנית ובקרה חיובית פנימית). תקני מבחני היעד צריכים להיות בעלי עקומות הגברה אקספוננציאליות. עקומות אלה אמורות להגיע לרמת נקודת קצה אם מותר להפעיל מספיק מחזורים. הדבר מעיד על כך שהגשושית הפלואורסצנטית נצרכת לחלוטין במהלך התגובה, ורמות הפלואורסצנטיות מגיעות למגבלה מקסימלית. תקני ההגברה המאוחרים יותר עשויים שלא להגיע לרמה ב-40 מחזורים. לבקרות החיוביות (DNA גנומי ו- IPC) צריך להיות אותו דפוס. לא ידועים עשויים או לא יכולים להגביר, אבל הגברה בלא נודע צריכה להיות גם תבנית מעריכית ורמת נקודת קצה (איור 5).
ב qPCR איכות, דילול סטנדרטי להגביר באופן שווה מרווח Cq של כ 3.3 מחזורים עבור כל הבדל 10-פי ריכוז. כל שכפול של דילול סטנדרטי מגבר באופן מקובץ היטב בעל כמעט אותו Cq (מיוצג על ידי ערכי r2). כל הדילול הסטנדרטי צריך להפגין הגברה(איור 3A). ב qPCR גרוע, סטנדרטים עשויים להפגין צורה לא מעריכית, וריאציה אחידה בערכי Cq בין דילולים, לא להגיע לרמה של נקודת קצה, או כמה דילולים לא יכול להגביר בכלל (איור 3D).
הפרמטרים החשובים עבור עקומה סטנדרטית הם יעילות, r2, שיפוע ויירוט y. יעילות צריכה ליפול בין 90%-110% עם ערכים אידיאליים ליד 100% וערכי r2 צריכים להיות מעל 0.98 עם תוצאות אידיאליות המתקרבות ל- 1.015,22. ערכי השיפוע צריכים להיות בין -3.2 ל- -3.5 עם תוצאות אידיאליות ליד -3.322. ערכי היירוט y צריכים ליפול בין Cq של 34-41 עם תוצאות אידיאליות שיש Cq של 37.0. y-יירוט הוא Cq החזוי של תגובה עם עותק אחד של רצף היעד, היחידה הקטנה ביותר שניתן למדוד qPCR יחיד. לא ידוע עם Cq של גדול יותר מאשר y-ליירט צפויים להיות מעוכבים. פועל יותר מ 40 מחזורים של PCR עשוי להיות נחוץ כדי לזהות את היעד במקרה של עיכוב או ערכת פריימר לא יעיל, אולם כימות אינו אפשרי בנסיבות אלה ופקדים שליליים נוספים ללא רצף היעד, אבל המכיל DNA הכולל דומה לא ידוע, יש להפעיל כדי לשלול הגברה ממקורות לא ספציפיים.
יש להשוות את הגברת הבקרה החיובית הפנימית (IPC) בדגימות לא ידועות לתוצאות IPC של בקרת התבנית השלילית, מכיוון שאין תחרות על ריאגנטים ואין מעכבים. לא ידוע עם IPC בעל Cq של 2 מחזורים או גדול יותר מהערך הממוצע Cq של NTC, או שאינם להגביר צריך להיחשב מעוכבים. אם לא קיימים מעכבים בדגימות, אז כל הגברה IPC צריך להיות קיבוץ הדוק בחלקה עם ערכי Cq ליד זהה NTC (איור 6).
לבסוף, באתרו בדיקות של הבדיקה התרחשה. 20 דגימות מים מנהר קלינץ' ושלוש דגימות שדה ריקות סוננו בין התאריכים 25-26 בספטמבר 2019 במרחק של 500 מטרים ממיטת מולים הידועה כבעלת רצועה A.. . כארבע דגימות מים של 1 L סוננו לכל מיקום דגימה. אתרי מיקום כלולים בתחתית מיטת המולים בנחל, בתחתית מיטת המולים ליד החוף, 100 מ ' במורד הזרם של המיטה בנחל, 500 מ 'במורד הזרם של המיטה בנחל ו 500 מ 'במורד הזרם של המיטה ליד החוף(איור 7). במעבדה, כל מסנן נחתך לשניים והדנ"א הוצא רק מחצי מסנן. מחצית המסנן הנותרת עבור כל דגימה אוחסנה במקפיא של -80 מעלות צלזיוס. דגימות מופעלות לאחר מכן באמצעות A.lig.1 מבחני מולטיפלקס עם IPC. מתוך 23 הדגימות, חמש נמצאו מעוכבות. דגימות אלה היו מדוללות 1: 10 ודילולים היו מחדש לרוץ. 19 מתוך 20 דגימות השדה מוגברות באמצעות ההסתעפות המעוצבת. מתוך 19 דגימות אלה, חמש היו מעל LOD של assay ו LOQ של 5 עותקים / תגובה; כלומר רוב הדגימות היו זיהוי eDNA אבל ברמה שבה תוצאות שליליות כוזבות צפויות להתרחש וכי הבדיקה לא יכול לכמת בביטחון את מספר העותק עבור אלה 14 דגימות. עם זאת, 75 עד 100% מארבעת האתרים הביולוגיים משוכפלים מוגברים בכל מיקום דגימה. שניים משלושת כדורי השדה הריקים היו שליליים, בעוד ששדה ריק אחד הראה הגברה, והדגיש את החשיבות של טכניקה נקייה בשדה.

איור 1: זרימת עבודה לבניית מסד נתונים של רצף DNA מיטוכונדריאלי. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: יישורי רצף למינים של מולים בנהר קלינץ' עם פריימריים ובדיקות פוטנציאליים לבדיקת הרצועה ND1 של Actinonaias. פריימרים קדמיים בירוק כהה, בדיקה באדום והיפוך פריימר בירוק בהיר. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
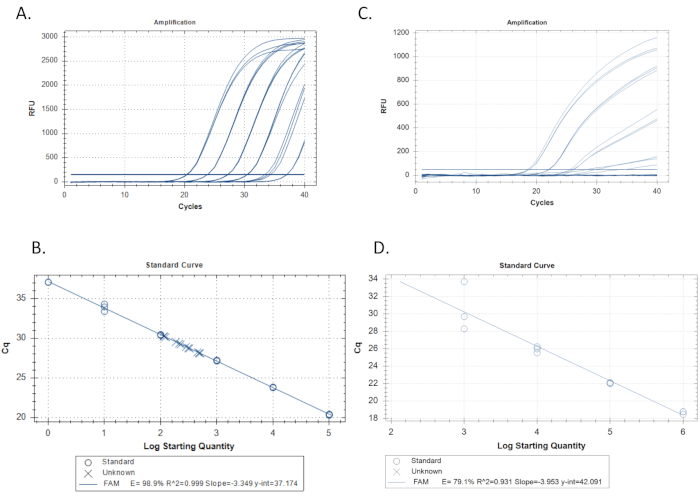
איור 3: דוגמאות סטנדרטיות לעקומה ורגרסיה ליניארית. A. דוגמה לעקומה סטנדרטית מקובלת הנגזרת מהגברה של שלושה משכפלת כל אחד משישה דילולים סטנדרטיים. סדרת דילול סטנדרטית פי 10 עם הריכוז הגבוה ביותר של התקן משמאל, עם ירידה בריכוזים הנעים ימינה. הקו האופקי החוצה את כל העקבות הוא הסף למחזור בכמות (Cq). כאשר כל עקבות חוצות את הסף הזה הוא המקום שבו Cq נקבע. B. רגרסיה ליניארית העשויה מהשכפולים הסטנדרטיים של איור 3A. שכפולים של הדילול הסטנדרטי מותווים במעגלים והבלתי ידועים (דוגמאות) מותווים ב- x's. היעילות היא 98.9%, r2 מתקרב 1.0, ושיפוע של -3.349. C. דוגמה לעקומה סטנדרטית ירודה הנגזרת מהגברה של שלושה משכפלת כל אחד משישה דילולים סטנדרטיים. D. רגרסיה ליניארית היוצרת את העקומה הסטנדרטית עבור השכפולים הסטנדרטיים המוגברים בדוגמה 3C. שים לב ליעילות הירודה ולערכי r2. כמו כן, שים לב שרק 4 מתוך 6 התקנים מוגברים. אם לאחר ריצות חוזרות, העקומה הסטנדרטית אינה משתפרת, הבעיה עשויה להיות עם ערכת פריימר / בדיקה גרועה שאינה מגבירה את ה- DNA של היעד כצפוי ובמקרה זה, אין לקחת בחשבון בדיקה זו. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
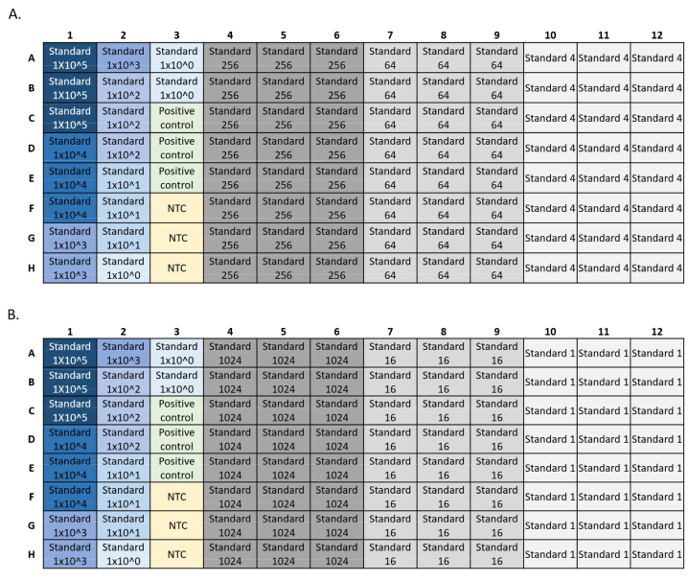
איור 4: דוגמאות להגדרות לוח עבור ריצות qPCR סטנדרטיות של LOD ו- LOQ. הסטנדרטים המשמשים בעקומה הם בכחול, ריכוז סטנדרטי פוחת מחושך לכחול בהיר. בקרת DNA חיובית בירוק וללא בקרת תבנית (NTC) בצהוב. ריכוזים סטנדרטיים ניסיוניים באפור המציגים 24 שכפולים עבור כל דילול סטנדרטי. סדרת הדילול הייתה מצופה על פני שתי צלחות (A, B), כל אחת עם עקומה סטנדרטית, שליטה חיובית ו- NTC. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
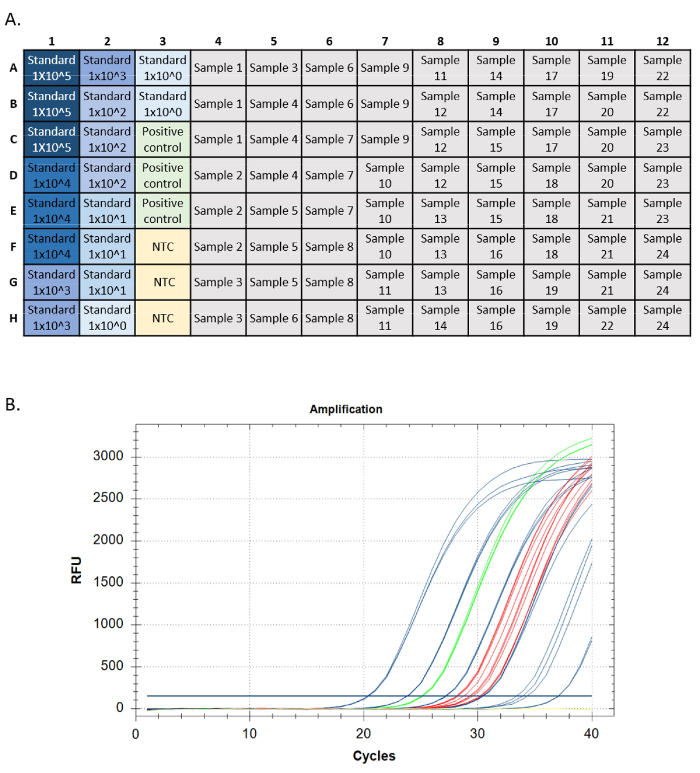
איור 5: הגדרת לוח ועקבות הגברה מהפעלת qPCR. A. הגדרת צלחת, סטנדרטים המוצגים בצבע כחול, כהה יותר המציין את הריכוז הגבוה ביותר של התקן. שליטה חיובית DNA בירוק, אין פקדי תבנית בצהוב (NTC), מטרות מדגם באפור. B.מעקבי הגברה מהפעלת qPCR. תקנים המוצגים בכחול, שליטה חיובית DNA בירוק, אין פקדי תבנית בצהוב, ולא ידוע באדום. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
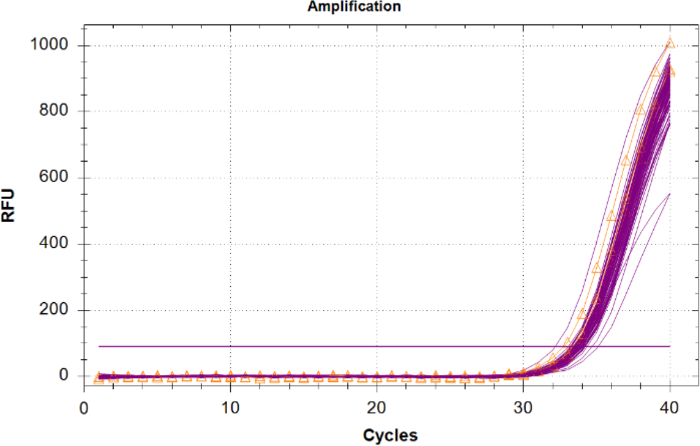
איור 6: מעקבי הגברה עבור הפקד החיובי הפנימי (IPC). מעקבי IPC עבור כל הדגימות הלא ידועות במגנטה וה- IPC מפקדי התבנית (NTCs) ללא תבנית המוצגים בכתום עם משולשים. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
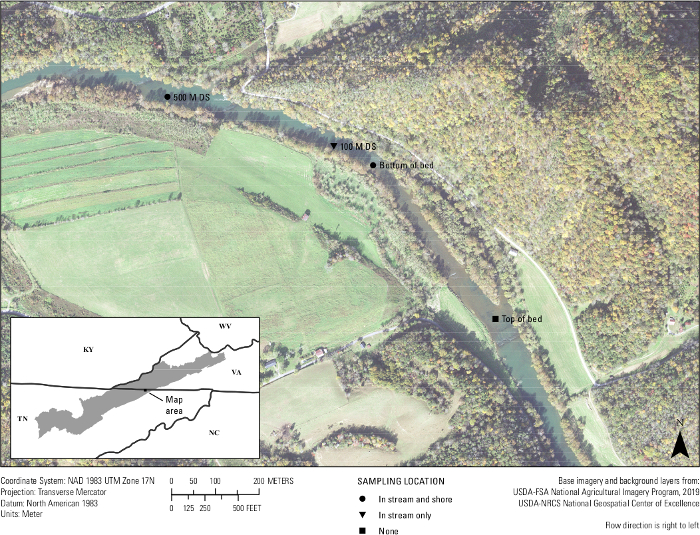
איור 7: מפה המציגה את אתרי האיסוף eDNA של מיטת מולים בנהר קלינץ' לאורך גבול וירג'יניה/טנסי. דגימות נאספו בוולנס בנד בתחתית המיטה, 100 מטר במורד הזרם של המיטה, ו 500 מ 'במורד הזרם של המיטה. אתרים נאספו באמצע הנחל (בנחל) או בערך 1 - 2 מטרים מקו החוף. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| רכיב | שם | רצף 5' – 3' | תווית פלואורסצנטית | |
| פריימר קדימה | א.ליגה.1-ו | CCCTקטקטקטטקטטאק | ||
| הפוך פריימר | א.ליג.1-ר | גאגאטג'קקטאטאקאטה | ||
| בדיקה | גשוש A.lig.1 | TTCאטגאגטאג'קג'גט | FAM (FAM) | |
טבלה 1: הבדיקה המתוכננת של Actinonaias רצועה qPCR (A.lig.1) כולל רצפים עבור פריימרים קדימה והפוך ואת החללית.
| מינים | מוגבר | בנהר קלינץ' |
| 1. רצועה אקטינוניאס | כן | כן |
| 2. אקטינונאס פקטורוסה | לא | כן |
| 3. אמבלמה פליקאטה | לא | כן |
| 4. קורביקולה spp. | לא | כן |
| 5. מונודונטה קמברלנדיה | לא | כן |
| 6. ציקלונאיאס טוברקולטה | לא | כן |
| 7. ציפרוגניה סטגריה | לא | כן |
| 8. אליפטיו דילאטה | לא | כן |
| 9. אפיובלסמה ברווידנס | לא | כן |
| 10. אפיובלסמה קפספורמיס | לא | כן |
| 11. אפיובלסמה פלורנטינה אורולה | לא | כן |
| 12. טריקסטרה אפיובלסמה | לא | כן |
| 13. פוסקוניה קור | לא | כן |
| 14. פוסקוניה סובוטונדה | לא | כן |
| 15. לאמפסיליס אובטה | לא | כן |
| 16. לאמפסיליס סיליקואידאה | לא | לא |
| 17. לזמיגונה קוסטאטה | לא | כן |
| 18. ליימוקס רימוסוס | לא | כן |
| 19. לקסינגטוןיה דולבלוידס | לא | כן |
| 20. מדיוןדוס קונרדיקוס | לא | כן |
| 21. פלטהובסוס ציפיוס | לא | כן |
| 22. מליאת פלורוימה | לא | כן |
| 23. פטיכוברנצ'וס פאסיולריס | לא | כן |
| 24. תת-קרקעי פטיכוברנצ'וס | לא | כן |
| 25. קוואדרולה פוסטולוסה | לא | כן |
| 26. סטרופיטוס אונולטוס | לא | כן |
| 27. וילוסה איריס | לא | כן |
טבלה 2: רשימה של מינים המשמשים לבדיקות ספציפיות במבחנה של הבדיקה A.lig.1. בדיקת הדנ"א הגנומי המוגבר של המטרה (Actinonaias רצועה) ולא הגבירה אף אחד ממיני הלא-מטרה.
| רכיב | רצף 5'-3' | ||||
| תקן אקטינונאס ליגמנטינה | CCCTקטקאגטק CTCTTAATCCTATAGGTGTCקטקטאקאקTCTTCTTGAACGTA | ||||
| AAGCCCTCGGGT אקטטקאאטקאגאג'קקאאטהאגאטגאטגקטק | |||||
| צ'אקטגטאגקטגקטקטאקטקטאגאגאטהאגאגאטאגאטאקאקקט | |||||
| קאקטאקטקקטאקקטגטאגקט | |||||
| גאקאטאטקטקטקאטקאטגאטגאטגטקטטקט | |||||
| TGTGTATCTCCTCCTCTCTTTAקטאקטטאקטטאקטגגאגאגגגאטקאקאקאקה | |||||
| אאטטגקטקטטגאגקאקהאקאטקטאטטגטאטגטקטאגטקטגטקהגטקה | |||||
| טאאק (1999 | |||||
| תבנית IPC (Hem-T) | CTACATAAGTAACCTCTCTCTTקטגטקTCTGTGTCTCגאטקטCAGACGCT | ||||
| GTATGACAGTCTCCTTCGTGGAACATTCGGCTCTCTATCTCTAGGAGGGGCAC | |||||
טבלה 3: רצף (5'-3') של תקן הרצועה Actinonaias ותבנית IPC (Hem-T) המשמשת לבדיקה זו. הרצף של פרייומרים קדימה והפוך הוא מודגש ונטוי, וזה של החללית מודגש.
| רכיב | שם | רצף 5' – 3' | תווית פלואורסצנטית | |
| פריימר קדימה | הימ-ט-ו | TCTGTGTCTCGAATCT | ||
| הפוך פריימר | הי-מ-ר | GCAGTCCTTGAאגאגאגגגC | ||
| בדיקה | הימ-פי | TGACAGTCTCCTCTTGTGGAACATTCG | צ'י5 | |
טבלה 4: הבדיקה 'בקרה חיובית פנימית' (IPC) כולל רצפים עבור פרייומרים קדימה והפוך והבדיקה.
| נפח לדגימה (μL) | רכיב |
| 10 | תערובת הורים סביבתית |
| 1 | 20uM A. lig.1 F/R לערבב |
| 1 | 2.5uM A. lig.1 בדיקה |
| 1 | 5uM IPC תערובת פריימר (HemT-F / R) |
| 0.75 | בדיקה IPC 2.5uM (HemT-P) |
| 1.5 | 1 X 103 ריכוז של תבנית IPC |
| 2.75 | H20 |
| 2 | לדוגמה |
| 20 | סה"כ נפח |
טבלה 5: תערובת ה-PCR המשמשת לבדיקת A.lig.1 מרובת ערכים עם בדיקת IPC.
| צעד | טמפרטורה (°C) | זמן | |
| 1 | דנאטורה ראשונית | 95 | 10 דקות |
| 2 | דנאטורה (לא כולל) | 95 | 15 שניות |
| 3 | חישול | 60 | דקה 1 |
| 4 | עבור לשלב 2, חזור על 39X |
טבלה 6: תנאי תגובה לבדיקת A.lig.1.
Discussion
כמו בכל מחקר, הגדרת השאלה שיש לטפל בה היא הצעד הראשון ועיצוב מבחני eDNA תלוי בהיקף המחקר26. לדוגמה, אם מטרת המחקר או הסקר היא לזהות מין אחד או כמה, בדיקה ממוקדת מבוססת בדיקה היא הטובה ביותר. אם, לעומת זאת, המטרה היא להעריך חבילה גדולה יותר או מכלול של מינים, מבחני metabarcoding רצף תפוקה גבוהה מתאימים יותר. לאחר שייקבע איזו גישה לנקוט, מומלץ לבצע מחקר פיילוט הכולל תכנון מבחנים, בדיקות ואופטימיזציה.24. עיצוב Assay מתחיל עם רשימה של מינים כמתואר ב איור 1. רשימה זו תיחשב כבסיס להבנת הביצועים הטובים של בדיקה במונחים של ספציפיות והטווח הגיאוגרפי עליו היא עשויה לחול6,10. מומלץ לעצב את הבדיקה עבור אזור גיאוגרפי מסוים, המאפשרת למעצב לבחון טוב יותר בדיקה לתגובה צולבת נגד מינים אחרים באזור זה, ולהיות מודע למגבלות שיש לכך על הרחבת בדיקה לאזורים אחרים שבהם מין יעד עלול להתרחש24. לאחר השלמת הרשימה, ניתן להוריד רצפים ממאגרי מידע גנטיים ציבוריים. מאחר שמסדי נתונים אלה אינם שלמים27יש לרצף כמה שיותר מינים ברשימה כדי להשלים את מסד הנתונים המקומי של רצפים שישמשו בעיצוב מבחנים. לתעדף מינים הקשורים זה לזה, שכן אלה הם המטרות הלא-מטרות הסבירות ביותר שיגברו. התמקדות בכל המינים בתוך אותו סוג או משפחה כמו מיני היעד היא מקום טוב להתחיל בו. השוואות עם מינים קרובים יסייעו בזיהוי אזורי רצף ייחודיים למין היעד. פעולה זו יכולה לסייע בהיידע כיצד ההסכמה עשויה לתפקד במערכות או במיקומים אחרים. אזורים מיטוכונדריים הם הבחירה הרגילה להתפתחות מבחנים, מכיוון שיותר מידע רצף ממגוון רחב יותר של מינים זמין בגנים מיטוכונדריים ששימשו בפרויקטים של ברקוד של החיים, ומכיוון שדנ"א מיטוכונדריאלי קיים בריכוז גדול בהרבה בעותקים/תאים מאשר DNA גרעיני24,28,29. אזורי גנים מרובים יש להעריך להתפתחות בדיקה נוספת כמו כיסוי רצף משתנה בין taxa במסדי הנתונים מאגר גנטי. לאחר יצירת מסד נתונים מקומי זה של רצפי הפניה, שילוב של הדמיה ידנית של נתוני רצף מיושרים ותוכנות מחשב משמש לעיצוב מבחני פריימר/בדיקה. אין להסתמך אך ורק על תוכנה כדי לקבוע אילו מבחנים לבדוק. חשוב לאמת באופן חזותי על יישורים שבו פריימרים ובדיקות לשבת על המטרות ולא מטרות כדי לקבל הבנה טובה יותר של איך הם עשויים לפעול PCR. לבסוף בדיקה סינון ואופטימיזציה כולל שלוש רמות (ב silico, במבחנה וב situ)6,7,24,25. ב silico עיצוב ובדיקות חשובים להפקת רשימה קצרה של מבחנים עם סיכוי טוב להצלחה, אבל אמפירי (במבחנה) בדיקות הוא חיוני לבחירת הבדיקה עם הביצועים הטובים ביותר בפועל. אין ויטרו אופטימיזציה ובדיקה של מבחנים כוללים מדידת יעילות התגובה והגדרת הרגישות והספציפיות של הבדיקה. גבולות הזיהוי והכימות הם שני פרמטרים שלעתים קרובות מתעלמים מהם בפיתוח מבחנים אך חשובים לפרשנות נתונים. על ידי הפעלת עותקים משוכפלים מרובים של עקומות סטנדרטיות עבור מבחנים, LOD ו LOQ ניתן למדוד בקלות1,5,30. מחקרים מעטים דנים בתוצאות ביחס ללוד או LOQ של הבדיקה, אך סנגופטה ואח ' (2019) משלבים את LOD ו- LOQ של הבדיקה שלהם בפרשנות הנתונים והגרפיקה שלהם להבנה ברורה יותר של התוצאות שלהם31. פקדים חיוביים פנימיים צריכים להיות מולטיפלקס לתוך ההסתערות המתוכננת גם כן. ללא בדיקה של עיכוב PCR בדגימות, תשלילים כוזבים עלולים להתרחש24,32. אנו מציעים את השימוש בבדיקת IPC מרובתxed עם הבדיקה היעד כשיטה הקלה ביותר עבור בדיקות עיכוב PCR23. לבסוף, בבדיקות situ של הבדיקה משדה ומעבדה שנאספו דגימות יש צורך להבטיח הגברה היעד מתרחשת בדגימות סביבתיות24.
קיימות מגבלות לשימוש במינים ספציפיים למינים, בדיקות qPCR מבוססות בדיקה עם דגימות eDNA. לדוגמה, תכנון מבחנים מרובים לבדיקה עשוי להיות מוגבל על ידי זמינות רצף, וייתכן שיהיה צורך להתפשר על היבטים של ביצועים הבדיקה. בחירות אלה חייבות להיות מונחות על ידי מטרות המחקר ויש לדווח עליהן עם התוצאות26. לדוגמה, אם המטרה היא זיהוי של מין נדיר וצפויות מעט תוצאות חיוביות, ניתן יהיה להשתמש במבחן עם ספציפיות לא מושלמת (כלומר הגברה של מינים שאינם מיועדים למטרה) אם כל הגילויים יאומתו על ידי רצף. אם המטרה היא ניטור הטווח הגיאוגרפי של מין ונתוני ריכוז eDNA אין צורך, ניתן להשתמש ב-assay עם יעילות לא מושלמת ונתונים שדווחו רק כאחוזי זיהוי. יתר על כן, אלא אם כן כל conspecifics הפוטנציאלי נבדקים במעבדה, אשר לעתים רחוקות אפשרי, אי אפשר לדעת בוודאות מוחלטת את הספציפיות האמיתית של בדיקה. לדוגמה, הבדיקה תוכננה ונבדקה מול מספר מיני מולים של מים מתוקים בנהר קלינץ'. כדי להשתמש בבדיקה זו במערכת נהר אחרת, נצטרך לבדוק אותה מול חבילה של מינים במיקום החדש. וריאציה גנטית בתוך המין או האוכלוסייה שאינה נבדקת במהלך התפתחות בדיקה עשויה להשפיע גם על הספציפיות. לבסוף, גם אם בדיקה אומתה כבעלת ביצועים טכניים גבוהים; התנאים משתנים בעת עבודה בשדה. תנאים שאינם קשורים לפיקוח כגון זרימת מים, pH והתנהגות בעלי חיים יכולים לשנות את יכולת הגילוי של eDNA כפי שניתן להשתמש בפרוטוקולי איסוף ומיצוי שונים של eDNA. שימוש בהסתעפויות ממוטבות ומתוארות היטב יסייע להקל על הבנת ההשפעה שיש לפרמטרים כאלה על זיהוי eDNA.
תחום eDNA מתבגר מעבר לשלב של ניתוח גישוש להגברת הסטנדרטיזציה של שיטות וטכניקות. התפתחויות אלה ישפרו את הבנתנו את הטכניקות, היכולות והמגבלות של eDNA. תהליך האופטימיזציה שאנו מתארים לעיל משפר את הרגישות, הספציפיות והשחזור של ההסמכה. המטרה הסופית של עידון זה ותקינה של שיטות eDNA היא לשפר את היכולות של החוקרים כדי להפוך מסקנות המבוססות על נתוני eDNA, כמו גם להגדיל את אמון משתמש הקצה ובעל היתד בתוצאות.
Disclosures
המחברים מצהירים שאין ניגוד עניינים. לספונסרים המממנים לא היה תפקיד בעיצוב המחקר; באיסוף, בניתוחים או בפרשנות של נתונים; בכתיבת כתב היד; או בהחלטה לפרסם את התוצאות.
Acknowledgements
אנו מודים לאלווי ווד וטרודי פרוסט שעזרו בפיתוח ובדיקות ראשוניות. המימון לתכנון מבחנים שדווח במחקר זה סופק על ידי התוכנית למחקר ופיתוח סביבתי אסטרטגי של משרד ההגנה (RC19-1156). כל שימוש בשמות מסחריים, מוצרים או חברות הוא למטרות תיאוריות בלבד ואינו מרמז על תמיכה של ממשלת ארה"ב. נתונים שנוצרו במהלך מחקר זה זמינים כמו מהדורת נתונים USGS https://doi.org/10.5066/P9BIGOS5.
Materials
| Name | Company | Catalog Number | Comments |
| 96 Place Reversible Racks with Covers | Globe Scientific | 456355AST | |
| Clean gloves (ie. latex, nitrile, etc.) | Kimberly-Clark | 43431, 55090 | |
| CFX96 Touch Real-Time PCR Detection System | Bio-Rad | 1855196 | |
| Fisherbrand Premium Microcentrifuge Tubes: 1.5mL | Fisher Scientific | 5408129 | |
| Fisherbrand Premium Microcentrifuge Tubes: 2.0mL | Fisher Scientific | 2681332 | |
| Hard-Shell 96-Well PCR Plates, low profile, thin wall, skirted, white/clear | Bio-Rad | #HSP9601 | |
| IPC forward and reverse primers | Integrated DNA Technologies, Inc. | none | custom product |
| IPC PrimeTime qPCR Probes | Integrated DNA Technologies, Inc. | none | custom product |
| IPC Ultramer DNA Oligo synthetic template | Integrated DNA Technologies, Inc. | none | custom product |
| Labnet MPS 1000 Compact Mini Plate Spinner Centrifuge for PCR Plates | Labnet | C1000 | |
| Microcentrifuge machine | Various | - | Any microcentrifuge machine that hold 1.5mL and 2.0mL tubes is typically okay. |
| Microseal 'B' PCR Plate Sealing Film, adhesive, optical | Bio-Rad | MSB1001 | |
| Nuclease-Free Water (not DEPC-Treated) | Invitrogen | AM9932 | |
| Pipette Tips GP LTS 1000 µL F 768A/8 | Rainin | 30389272 | |
| Pipette Tips GP LTS 20 µL F 960A/10 | Rainin | 30389274 | |
| Pipette Tips GP LTS 200 µL F 960A/10 | Rainin | 30389276 | |
| Pipettes | Rainin | Various | Depending on lab preference, manual or electronic pipettes can be used at various maximum volumes. |
| TaqMan Environmental Master Mix 2.0 | Thermo Fisher Scientific | 4396838 | |
| Target forward and reverse primers | Integrated DNA Technologies, Inc. | none | custom product |
| Target PrimeTime qPCR Probes | Integrated DNA Technologies, Inc. | none | custom product |
| Target synthetic gBlock gene fragment | Integrated DNA Technologies, Inc. | none | custom product. used for qPCR standard dilution series |
| TE Buffer | Invitrogen | AM9849 | |
| VORTEX-GENIE 2 VORTEX MIXER | Fisher Scientific | 50728002 |
References
- Kubista, M., et al. The real-time polymerase chain reaction. Mol Aspects Med. 27 (2-3), 95-125 (2006).
- Higuchi, R. D., Walsh, P. S., Griffith, R. Simultaneous amplification and detection of specific DNA sequences. Biotechnology. 10, 5(1992).
- Mauvisseau, Q., et al. Influence of accuracy, repeatability and detection probability in the reliability of species-specific eDNA based approaches. Scientific Reports. 9 (1), 580(2019).
- Hernandez, C., et al. 60 specific eDNA qPCR assays to detect invasive, threatened, and exploited freshwater vertebrates and invertebrates in Eastern Canada. Environmental DNA. , (2020).
- Klymus, K. E., et al. Reporting the limits of detection and quantification for environmental DNA assays. Environmental DNA. , (2019).
- Thalinger, B., et al. A validation scale to determine the readiness of environmental DNA assays for routine species monitoring. bioRxiv. , (2020).
- Helbing, C. C., Hobbs, J. Environmental DNA Standardization Needs for Fish and Wildlife Population Assessments and Monitoring. CSA Group. , (2019).
- Sepulveda, A. J., Nelson, N. M., Jerde, C. L., Luikart, G. Are Environmental DNA Methods Ready for Aquatic Invasive Species Management. Trends in Ecology & Evolution. , (2020).
- Svec, D., Tichopad, A., Novosadova, V., Pfaffl, M. W., Kubista, M. How good is a PCR efficiency estimate: Recommendations for precise and robust qPCR efficiency assessments. Biomolecular Detection and Quantification. 3, 9-16 (2015).
- Wilcox, T. M., et al. Robust detection of rare species using environmental DNA: the importance of primer specificity. PLoS One. 8 (3), 59520(2013).
- Prediger, E. How to design primers and probes for PCR and qPCR. IDT. , Available from: http://www.idtdna.cco/pages/education/decoded/article/designing-pcr-primers-and-probes (2020).
- Thornton, B., Basu, C. Real-time PCR (qPCR) primer design using free online software. Biochemistry and Molecular Biology Education. 39, 145-154 (2011).
- Owczarzy, R., et al. IDT SciTools: a suite for analysis and design of nucleic acid oligomers. Nucleic Acids Research. 36, Web Server issue 163-169 (2008).
- Kibbe, W. A. OligoCalc: an online oligonucleotide properties calculator. Nucleic Acids Research. 35, Web Server issue 43-46 (2007).
- Taylor, S. C., et al. The Ultimate qPCR Experiment: Producing Publication Quality, Reproducible Data the First Time. Trends in Biotechnology. 37 (7), 761-774 (2019).
- Ye, J., et al. Primer-BLAST: A tool to design target-specific primers for polymerase chain reaction. BMC Bioinformatics. 13 (134), 11(2012).
- Altschul, S. F., Gish, W., Miller, W., Myers, E. W., Lipman, D. J. Basic Local Alignment Search Tool. Journal of Molecular Biology. 215, 403-410 (1990).
- Bustin, S. A., et al. The MIQE guidelines: minimum information for publication of quantitative real-time PCR experiments. Clinical Chemistry. 55 (4), 611-622 (2009).
- Bio-Rad. Bio-Rad Vol. 5279. , ed Bio-Rad (2020).
- Bio-Rad. Bio-Rad Vol. 6894. , Bio-Rad (2020).
- Eurogentec. Eurogentec. Vol. 0708-V2. , ed Eurogentec (2020).
- Bustin, S., Huggett, J. qPCR primer design revisited. Biomolecular Detection and Quantification. 14, 19-28 (2017).
- Hoorfar, J., et al. Practical considerations in design of internal amplification controls for diagnostic PCR assays. Journal of Clinical Microbiology. 42 (5), 1863-1868 (2004).
- Goldberg, C. S., et al. Critical considerations for the application of environmental DNA methods to detect aquatic species. Methods in Ecology and Evolution. 7 (11), 1299-1307 (2016).
- Guan, X., et al. Environmental DNA (eDNA) Assays for Invasive Populations of Black Carp in North America. Transactions of the American Fisheries Society. 148 (6), 1043-1055 (2019).
- Mosher, B. A., et al. Successful molecular detection studies require clear communication among diverse research partners. Frontiers in Ecology and the Environment. 18 (1), 43-51 (2019).
- Kwonga, S., Srivathsana, A., Meier, R. An update on DNA barcoding: low species coverage and numerous unidentified sequences. Cladistics. 28, 6(2012).
- Rees, H. C., et al. REVIEW: The detection of aquatic animal species using environmental DNA - a review of eDNA as a survey tool in ecology. Journal of Applied Ecology. 51 (5), 1450-1459 (2014).
- Evans, N. T., Lamberti, G. A. Freshwater fisheries assessment using environmental DNA: A primer on the method, its potential, and shortcomings as a conservation tool. Fisheries Research. 197, 60-66 (2018).
- Forootan, A., et al. Methods to determine limit of detection and limit of quantification in quantitative real-time PCR (qPCR). Biomolecular Detection and Quantification. 12, 1-6 (2017).
- Sengupta, M. E., et al. Environmental DNA for improved detection and environmental surveillance of schistosomiasis. Proceedings of the National Academy of Sciences of the United States of America. 116 (18), 8931-8940 (2019).
- Klymus, K. E., Richter, C. A., Chapman, D. C., Paukert, C. Quantification of eDNA shedding rates from invasive bighead carp Hypophthalmichthys nobilis and silver carp Hypophthalmichthys molitrix. Biological Conservation. 183, 77-84 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved