A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בידוד ובחירה של פטריות אנטומופתוגניות מדגימות קרקע והערכה של אלימות פטרייתית נגד מזיקי חרקים
In This Article
Summary
כאן אנו מציגים פרוטוקול המבוסס על מערכת פיתיון תולעי הארוחות (Tenebrio molitor) ששימשה לבידוד ובחירה של פטריות אנטומופתוגניות (EPF) מדגימות קרקע. נוסחת מספר קונידיה יעילה (ECN) משמשת לבחירת EPF עמיד בפני מתח גבוה המבוסס על מאפיינים פיזיולוגיים לבקרת מזיקים מיקרוביאלית בתחום.
Abstract
פטריות אנטומופתוגניות (EPF) הן אחד מסוכני הבקרה המיקרוביאלית לניהול מזיקים משולב. כדי לשלוט במזיקים מקומיים או פולשניים, חשוב לבודד ולבחור EPF ילידי. לכן, שיטת פיתיון הקרקע בשילוב עם פיתיון חרקים (תולעת ארוחה, מוליטור טנבריו) שימש במחקר זה עם כמה שינויים. EPF המבודד היה אז נתון לבדיקת virulence נגד המזיק החקלאי Spodoptera ליטורה. יתר על כן, זני EPF הפוטנציאליים היו נתונים לזיהויים מורפולוגיים ומולקולריים. בנוסף, ייצור קונידיה ובוח התרמוטולנס בוצעו עבור זני EPF מבטיחים והשוו; נתונים אלה הוחלפו עוד יותר בנוסחה של מספר קונידיה יעיל (ECN) לדירוג מעבדה. ניתן לשפר את מערכת תולעי הפיתיון בקרקע ואת נוסחת ECN על ידי החלפת מיני חרקים ושילוב גורמי לחץ נוספים להערכת מסחור ויישום שדה. פרוטוקול זה מספק גישה מהירה ויעילה לבחירת EPF וישפר את המחקר על סוכני בקרה ביולוגיים.
Introduction
כיום, פטריות אנטומופתוגניות (EPF) נמצאות בשימוש נרחב בשליטה מיקרוביאלית של מזיקים חקלאיים, יערות וגננות. היתרונות של EPF הם טווחי המארח הרחבים שלה, הסתגלות סביבתית טובה, טבע ידידותי לסביבה, וכי ניתן להשתמש בו עם כימיקלים אחרים כדי להראות את האפקט הסינרגיסטי לניהול מזיקים משולב1,2. עבור היישום כסוכן הדברה, יש צורך לבודד מספר גדול של EPF מחרקים חולים או מהסביבה הטבעית.
הדגימה של אורגניזמים אלה מן המארחים שלהם מסייעת בהבנת ההתפלגות הגיאוגרפית ואת שיעור השכיחות של EPF במארחים טבעיים3,4,5. עם זאת, אוסף החרקים הנגועים הפטרייתיים מוגבל בדרך כלל על ידי גורמים סביבתיים ואוכלוסיות חרקים בשטח4. בהתחשב בכך שמארחי חרקים ימותו לאחר זיהום EPF ואז ייפלו לאדמה, בידוד EPF מדגימות קרקע עשוי להיות משאב יציב3,6. לדוגמה, saprophytes ידועים להשתמש המארח המת כמשאב שלהם לצמיחה. פיתיון הקרקע ומערכות בינוניות סלקטיביות שימשו באופן נרחב כדי לזהות ולבודד EPF מהקרקע3,4,7,8,9,10.
בשיטה הבינונית הסלקטיבית, תמיסת הקרקע המדוללת מצופה על מדיום המכיל אנטיביוטיקה רחבת טווח (למשל, כלורמפניקול, טטרציקלין או סטרפטומיצין) כדי לעכב את צמיחת החיידקים2,3,9,11. עם זאת, דווח כי שיטה זו עלולה לעוות את המגוון והצפיפות של הזן ועלול לגרום להערכת יתר או תת-הערכה של קהילות מיקרוביות רבות6. יתר על כן, הזנים המבודדים הם פחות פתוגניים ומתחרים עם saprophytes במהלך הבידוד. קשה לבודד את EPF מפתרון הקרקע מדולל3. במקום להשתמש במדיום סלקטיבי, שיטת פיתיון הקרקע מבודדת את EPF מהחרקים המתים הנגועים, שניתן לאחסן במשך שבועיים-שלושה, ובכך מספקת שיטת הפרדת EPF יעילה וסטנדרטית יותר3,4,7,6. מכיוון שהשיטה קלה לתפעול, ניתן לבודד מגוון זנים פתוגניים בעלות נמוכה4. לכן, הוא נמצא בשימוש נרחב על ידי חוקרים רבים.
כאשר משווים בין הסוגים השונים של מערכות פיתיון חרקים, בובריה באסיאנה ו- Metarhizium anisopliae הם המינים הנפוצים ביותר של EPF הנמצאים בחרקים השייכים להמיפטרה, לפידופטרה, בלטלה וקולופטרה6,12,13,14. בין פיתיונות חרקים אלה, גלריה mellonella (סדר Lepidoptera) ו נמיריו מוליטור (סדר Coleoptera) להראות שיעורי התאוששות גבוהים יותר של בובריה ו Metarhizium spp., בהשוואה לחרקים אחרים. לכן, G. mellonella ו T. מוליטור משמשים בדרך כלל לפיתיון חרקים. במהלך השנים הקימה מחלקת החקלאות של ארצות הברית ספריית EPF (אוסף שירותי מחקר חקלאי של תרביות EPF, ARSEF) המכילה מגוון רחב של מינים, כולל 4081 מינים של בובריה spp., 18 מינים של Clonostachys spp., 878 מינים של קורדיספס spp., 2473 מינים של Metarhizium spp., 226 מינים של Purpureocillium spp., ו-13 מינים של פוצ'וניה, בין היתר15. ספריית EPF נוספת נבנתה על ידי המעבדה לחקר אנטומולוגיה (ERL) מאוניברסיטת ורמונט בארצות הברית במשך כ-30 שנה. הוא כולל 1345 זנים של EPF מארצות הברית, אירופה, אסיה, אפריקה והמזרח התיכון16.
כדי לשלוט במזיקים מקומיים או פלישה בטייוואן, בידוד ובחירה של EPF ילידים נדרש. לכן, בפרוטוקול זה, שינינו ותיארנו את ההליך של שיטת פיתיון הקרקע ושילבנו אותה עם מערכת פיתיון החרקים (תולעת הארוחה, מוליטור טנבריו) 17. בהתבסס על פרוטוקול זה, ספריית EPF הוקמה. שני סבבי הקרנה (כימות חיסון) בוצעו עבור בידוד EPF הראשוני. בידודי EPF הראו פתוגניות לחרקים. הזנים הפוטנציאליים היו נתונים לזיהויים מורפולוגיים ומולקולריים ונותחו עוד יותר על ידי בדיקת התרמו-סובלנות והייצור השובת. יתר על כן, הוצע גם מושג של מספר קונידיה יעיל (ECN). באמצעות נוסחת ECN וניתוח רכיבים עיקרי (PCA), הזנים הפוטנציאליים נותחו תחת לחץ סביבתי מדומה כדי להשלים את תהליך ההקמה וההקרנה של ספריית EPF. לאחר מכן, פתוגניות של זני EPF מבטיחים נבדקו עבור מזיק היעד (למשל, Spodoptera ליטורה). הפרוטוקול הנוכחי משלב נתוני תרמוטולרנס וייצור חמיתי בנוסחת ECN וניתוח PCA, אשר יכול לשמש כמערכת דירוג סטנדרטית למחקר הקשור ל- EPF.
Access restricted. Please log in or start a trial to view this content.
Protocol
הערה: תרשים הזרימה כולו מוצג באיור 1.
1. בידוד ובחירה של פטריות אנטומופתוגניות פוטנציאליות (EPF)
- לאסוף את דגימת הקרקע
- מוציאים 1 ס"מ מהקרקע, ואז אוספים את הקרקע בעומק של 5-10 ס"מ באמצעות את חפירה מכל אתר דגימה.
הערה: אתרי דגימה יהיו הר, יער, או אזורים מאוכלסים בדלילות כדי למנוע זיהום של זני EPF שרוססו באופן מלאכותי. ודא שאזורים לאיסוף דגימות הקרקע מכוסים בעצים על פני השטח. אדמה יבשה או אדמה לחה אינה מתאימה לניסוי זה. - תעד את הפרטים של כל אתר דגימה, כולל GPS, גובה, סוג שדה, טמפרטורה שנתית, משקעים שנתיים, זמן איסוף (עונה), סוג קרקע וערך pH.
- לאסוף 100 גרם של דגימת הקרקע לתוך שקית ניילון ולשמור אותו בטמפרטורת החדר אם כפוף אותו לפרוטוקול בידוד פטרייתי במעבדה בתוך 3 שעות.
הערה: אם לא ניתן להשתמש במדגם תוך 3 שעות, יש לאחסן את האדמה בטמפרטורת החדר בתנאים כהים. אם הניסוי אינו מבוצע באופן מיידי, ניתן לאחסן את דגימת הקרקע ב 4 °C (75 °F) למשך שבוע אחד עד תחילת הפרוטוקול18,19.
- מוציאים 1 ס"מ מהקרקע, ואז אוספים את הקרקע בעומק של 5-10 ס"מ באמצעות את חפירה מכל אתר דגימה.
- פיתיון ולבודד את EPF עם תולעת ארוחה (מוליטור טנבריו)
- מניחים 100 גרם מדגם הקרקע בכוס פלסטיק (קוטר מכסה = 8.5 ס"מ, גובה = 12.5 ס"מ), ולאחר מכן מניחים 5 תולעי ארוחה על פני הקרקע בטמפרטורת החדר בחושך במשך שבועיים.
הערה: ניתן להשתמש גם בסוגים אחרים של מיכלי כוסות פלסטיק. אם הקרקעות יבשות מדי (סדוקות או חוליות), רססו ddH2O מעוקר (כ-5-10 מ"ל) על הקרקעות. אורך הגוף c.a. 2.5 ס"מ (14 instar) של זחלי T. מוליטור מסייע במסכי בידוד פטרייתיים20. - התבונן ותיעד את הזחלים מדי יום לתמותה ומיקוסיס; שומרים את הזחלים המתים בכוס עד שבועיים לבידוד פטרייתי.
הערה: נבג conidia פטרייתי בדגימות הקרקע יהיה לצרף את זחלי תולעי הארוחה במהלך התהליך לעיל. מיקוסיס פטרייתי יהיה נצפה כמו hyphae לגדול מן הממברנה הבין-צדדית, ולאחר מכן כל הגוף יהיה מכוסה עם תפטיר. הניבוי יתחיל לאחר 7 ימים וצבע הזיהום הפטרייתי ישתנה לצבע של מסת conidia. - מעבירים את החרקים המתים לספסל נקי ומשתמשים בקיסם סטרילי כדי לאסוף את הקונידיה. פסים אותם על רבע כוח Sabouraud דקסטרוז אגר בינוני (1/4 SDA) צלחת (55 מ"מ) במעבדה21. לדגור על צלחת התרבות ב 25 °C (7 ימים) כדי להשיג את התרבות העיקרית של פטריות.
הערה: צלחת SDA 1/4 מוכנה כדלקמן: לערבב 1.5 גרם של מרק Sabouraud דקסטרוז ו 3 גרם אגר ב 200 מ"ל של H2O, ולאחר מכן לחטא במשך 20 דקות. Aliquot 1/4 SDA לתוך כל צלחת פטרי 55 מ"מ לפני התגבשות. לוחות SDA מוצקים 1/4 מאוחסנים ב 4 °C (5 °F) עד השימוש. - פס מחדש כל פטריות תרבות ראשונית על צלחת SDA אחת 55 מ"מ 1/4 בזרימה למינארית ודגרת צלחת התרבות ב 25 °C (7 ימים) כדי להשיג מושבות בודדות של פטריות.
- חזור על בידוד מחדש זה ~ 2-3 פעמים ולצפות תחת מיקרוסקופיה קלה כדי להשיג מושבות פטרייתיות מורפולוגיות יחיד וטהור.
הערה: בודדו את כל EPF באמצעות T. מוליטור-פיתיון ולאחסן כמתואר בסעיף הבא. ההפרדה, השימור, התרבות הטהורה והפסים חייבים להתבצע בזרימה למינארית בחלקים הבאים.
- מניחים 100 גרם מדגם הקרקע בכוס פלסטיק (קוטר מכסה = 8.5 ס"מ, גובה = 12.5 ס"מ), ולאחר מכן מניחים 5 תולעי ארוחה על פני הקרקע בטמפרטורת החדר בחושך במשך שבועיים.
- אחסון מבודדי EPF
- חותכים 3 של בלוקי אגר 5 מ"מ בקצה של כל צלחת תרבותית פטרייתית טהורה מבודדת עם בולע שעם ומניחים אותו לתוך צינור צנטריפוגה מיקרו 1.5 מ"ל כמו אחד לשכפל.
הערה: שלושה שכפולים עבור כל בידוד פטרייתי מומלצים לאחסון זני EPF לאחר בדיקת virulence השנייה . זיהוי מולקולרי מומלץ גם אם שטח האחסון מוגבל. - הוסף 250 μL של פתרון פעילי שטח 0.03% (שולחן החומרים) ו 250 μL של 60% גליסול לתוך צינור 1.5 מ"ל מיקרו צנטריפוגה באמצעות מיקרופיט; ואז, מערבולת ל-10.
- לאטום את צינור 1.5 מ"ל מיקרו צנטריפוגה עם סרט פרפין מראש זה במקרר -20 °C במשך 24 שעות. לאחר מכן, להעביר את המניות הפטרייתיות מראש למקרר -80 מעלות צלזיוס עבור cryopreservation.
הערה: צלחות תרבות פטרייתיות טהורות במיוחד (מלבד הדגימות שהשתמרו על ידי הקפאה) שימשו בסעיף 1.4.
- חותכים 3 של בלוקי אגר 5 מ"מ בקצה של כל צלחת תרבותית פטרייתית טהורה מבודדת עם בולע שעם ומניחים אותו לתוך צינור צנטריפוגה מיקרו 1.5 מ"ל כמו אחד לשכפל.
- מסך פתוגניות 1 לבידוד פטרייתי
- מניחים חמישה זחלי תוליטור ישירות על פני השטח של כל צלחת תרבות פטרייתית טהורה ב 25 °C (70 °F).
- להתבונן ולתעד את המיקוזיס והתמותה במשך 10 ימים. בחר את הבידוד הפטרייתי לניתוח נוסף.
הערה: מבודדים פטרייתיים הגורמים לתמותה של 100% נבחרים לבדיקת וירוליאנס שנייה כדי לאשר את הנדיפות שלהם לזחלי T. molitor . לחלופין, החוקר יכול להתאים את הקריטריונים לפי המחקר שלהם.
- מבחן נדיפות שני של מבודד פטרייתי
הערה: בהתבסס על מסך הפתוגניות 1st, לשחזר את מבודד פטרייתי שנבחר מ -80 °C (70 °F) עבור בדיקת virulence השני . מטרת מבחן ה-virulence השני היא לכמת את הפתוגניות של מבודדי הפטריות שנבחרו לאחר הסיבוב הראשון של ההקרנה.- קציר conidia של כל בידוד פטרייתי על ידי מערבולת במשך 1 דקות ולספור את מספר conidia באמצעות המוציטומטר.
- התאימו את ההשעיה לקונדיה לריכוז של 1 x 107 קונידיה/מ"ל בתמיסה של 0.03% פעילי שטח (טבלת חומרים).
- מורחים 10 μL של ההשעיה הפטרייתית על לוחות SDA 55 מ"מ 1/4 ולגדול במשך 7 ימים ב 25 °C (7 °F) בחושך.
- מניחים חמישה זחלי תוליטור ישירות על פני השטח של כל צלחת תרבות פטרייתית טהורה (למשל 6 x 107 קונידיה). אוטמים את הצלחות עם סרט פרפין ודגרה ב 25 °C (5 °F) בחושך.
- להתבונן ולתעד את המיקוזיס והתמותה במשך 10 ימים.
- חזור על הבדיקה (מהשלב 1.51 עד 1.5.5) בשליפליקציה עבור כל בידוד פטרייתי.
הערה: מבודדים פטרייתיים הגורמים לתמותה של 100% נבחרים לבדיקת וירולנס שלישית כדי לאשר את הארס שלהם כדי למקד את המזיק.
- מבחן ארס שלישי של מבודד פטרייתי למזיקי מטרה (Spodoptera litura כדוגמה)
- חזור על שלבים 1.5.2 עד 1.5.6 עם מבודדים נבחרים מארס 2 כדי לבדוק את הארס מול מזיק היעד.
- חשב את ה-LT50 של כל איזולט פטרייתי22.
הערה: ה- LT50 של כל בידוד פטרייתי חושב באמצעות דגמים ליניאריים כלליים (GLMs) באמצעות אולפן R (גירסה 3.4.1); ניתן להשתמש בהתפלגות השגיאות המ-quasibinomial ופונקציית קישור יומן רישום כדי להסביר את ההפרשה יתר.
2. זיהוי מולקולרי של EPF
- הפקת דנ"א גנומי פטרייתי
- לאסוף c.a. 1 cm2 EPF מ 7 ימים 1/4 צלחת SDA.
- לחלץ את ה- DNA הגנומי הפטרייתי באמצעות ערכת מיצוי DNA גנומית פטרייתית על פי הוראות היצרן23 (טבלת החומרים).
- הגברת PCR ורצף DNA
- להגביר את אזור ה- PCR של דגימת ה- DNA21 באמצעות תמהיל מאסטר PCR (2x), ערכת פריימר ITS1F / ITS4R24 (טבלה 1) עם תוכנית ה- PCR הבאה: 94 °C (1 דקות), ולאחר מכן 35 מחזורים של 94 °C (30 °F) עבור 30 s, 55 °C (55 °F) עבור 30 s ו 72 °C (72 °F) למשך דקה אחת, ואחריו הארכה סופית של 7 דקות ב 72 °C (72 °F).
הערה: ערכת הפריימרים ITS1F/ITS4R מיועדת לזיהוי רמת הסוג. - רצף את ה- PCR על-ידי שירות רצף מסחרי.
- השתמש בחיפוש NCBI BLAST אחר פטריות דומות במסד הנתונים של NCBI ובחר את המינים הפטרייתיים היחסיים לניתוח פילוגנטי.
הערה: המינים הפטרייתיים השייכים לסוג של מטרהיזיום או בובריה צריכים להיות מזוהים עוד יותר לרמת המינים עם טף-983F / tef-2218R פריימר להגדיר25 (שלבים חוזרים 2.1.1 עד 2.2.3). עבור פטריות שאינן שייכות לגנים Metarhizium או Beauveria, סמנים מולקולריים אחרים יכולים לשמש כדי לזהות את המינים, כולל DNA ליאז (APN2), בטא טובולין (BTUB), RNA פולימראז II subunit הגדול ביותר (RPB1), RNA פולימראז II תת-unit השני בגודלו (RPB2), וחלק 3 ' של גורם התארכות תרגום 1 אלפא (TEF)25,26 .
- להגביר את אזור ה- PCR של דגימת ה- DNA21 באמצעות תמהיל מאסטר PCR (2x), ערכת פריימר ITS1F / ITS4R24 (טבלה 1) עם תוכנית ה- PCR הבאה: 94 °C (1 דקות), ולאחר מכן 35 מחזורים של 94 °C (30 °F) עבור 30 s, 55 °C (55 °F) עבור 30 s ו 72 °C (72 °F) למשך דקה אחת, ואחריו הארכה סופית של 7 דקות ב 72 °C (72 °F).
- ניתוח פילוגנטי
- השתמש בתוכנת ClustalX 2.127 כדי ליישר את הרצפים המרובים מהשלבים 2.2.2 ו- 2.2.3. חתוך את אזור הרצפים השמורים באופן ידני באמצעות GeneDoc28.
- בצע את הניתוח הפילוגנטי על ידי תוכנת MEGA729 בהתבסס על האבולוציה המינימלית (ME), הצטרפות שכנים (NJ) וסבירות מרבית (ML) שיטות.
הערה: ביצוע כל שלוש השיטות יכול לעזור לאשר ולהסיק במדויק את מצב הסיווג. המבודדים הפטרייתיים המוקרנים על ידי מסך הפתוגניות 1 משמשים לזיהוי מולקולרי ברמת הסוג. המבודדים הפטרייתיים המוקרנים על ידי בדיקת הוולולנס השנייה משמשים לזיהוי מולקולרי ומורפולוגי ברמת המינים.
3. זיהוי מורפולוגי של EPF
- התבוננות במורפולוגיה של המושבה הפטרייתית
- השתמש במצלמה כדי ללכוד את צמיחת מושבת התרבות הפטרייתית במשך 7 ימים, ולתעד את הצמיחה, הצורה (רכה, מוצקה) וצבע המושבות.
- תצפית על קונידיה וקונדיופורים
- לגרד conidia מן המושבה פטרייתית תרבות טהורה עם לולאת חיסון ולהעביר את הנבגים למגלשת זכוכית עם 0.1% פתרון Tween 80. לאחר מכן, לכסות עם כיסוי עבור תצפית מיקרוסקופית קלה של conidia.
- השתמש באזמל כדי לחתוך בלוק אגר 5 מ"מ של גדיל hyphal בקצה המושבה הפטרייתית, ולאחר מכן להעביר את בלוק אגר למגלשת זכוכית.
- בצע את הניקוי כדלקמן: מוסיפים את תמיסה 0.1% Tween 80 על בלוק אגר עם טפטפת פלסטיק לשטוף את רוב conidia עודף באמצעות פינצטה. לאחר מכן, לכסות אותו עם כיסוי עבור תצפית לייטמיקרוסקופית.
הערה: 0.1% Tween 80 ניתן להחליף עם עוד פעילי שטח חזקים יותר (שולחן החומרים) בהתאם למינים פטרייתיים והידרופוביה. - למדוד ולתעד את הרוחב והאורך של conidia ו conidiophores כדי להשוות את ההבדלים בין מבודד פטרייתי שונים.
- השתמש במבחן ANOVA של וולש ובבדיקה במשחקים-האוול (מבחן פוסט הוק) כדי לנתח את הרוחב והאורך החנוחים של כל זן באמצעות סטודיו R (גרסה 3.4.1).
הערה: ניתוח נתונים של תווים מורפולוגיים יכול להיות מותאם על ידי מקרים. המבודדים הפטרייתיים המוקרנים במבחן ה-virulence השלישי משמשים לאפיון הפיזיולוגי ולדירוג ECN בסעיפים 4 ו-5.
4. חקירת פרודוקטיביות ותרמו-סובלנות חבית
- בדיקת ייצור חמימה
- תרבות הבידוד הפטרייתי שנבחר על 1/4 בינוני SDA ב 25 ± 1 °C (50 °F) בחושך במשך 10 ימים.
- הכן 1 מ"ל של ההשעיה הקונדיאלית של בידוד פטרייתי בפתרון 0.03% פעילי שטח ולהתאים 1 x 107 conidia / mL כמתואר לעיל.
- זרוק שלוש טיפות של 10 μL של השעיה conidial על 1/4 SDA ודגרה ב 25 °C (7,10, ו 14 ימים כדי לספור את הניבוי של פטריות.
הערה: 10 μL הוא הנפח הטוב ביותר כדי לאסוף את בלוק 5 מ"מ עם אפילו נבג פטרייתי לאחר צמיחה פטרייתית במשך 7-14 ימים. - השתמש ב Borer הפקק לנתק בלוק אגר 5 מ"מ ממרכז המושבה ולהעביר לתוך 1 מ"ל של 0.03% פתרון פעילי שטח (שולחן החומרים) בצינור צנטריפוגה מיקרו 1.5 מ"ל בכל נקודת זמן.
- מערבולת את הצינור ב 3,000 סל"ד בטמפרטורת החדר במשך 15 דקות ולהשתמש hemocytometer לספור את מספר conidia.
הערה: הנוסחה המשמשת לספירה היא מספר conidia לכל 25 ריבועים של התא הקטן ביותר (גודל = 0.025 מ"מ2; עומק התא = 0.1 מ"מ):
סה"כ לא של conidia ב 5 ריבועים ÷ 80 × (4 × 106) - חזור שלוש פעמים עבור כל בידוד.
- מראיית תרמוטולנס
- תרבות הבידוד הפטרייתי שנבחר על 1/4 בינוני SDA ב 25 ± 1 °C (50 °F) בחושך במשך 10 ימים.
- הכן 1 מ"ל של ההשעיה conidial של בידוד פטרייתי ב 0.03% פתרון פעילי שטח ולהתאים 1 x 107 conidia / mL כמתואר לעיל.
- מערבולת את ההשעיה conidial לחמם אותו באמבט יבש 45 °C במשך 0, 30, 60, 90, ו 120 דקות. זרוק שלוש טיפות של 5 μL של ההשעיה conidial על 55 מ"מ 1/4 SDA בינוני בכל נקודת זמן לאחר חשיפה לחום ודגורה ב 25 ± 1 °C (5 °F) במשך 18 שעות.
הערה: הימנע מהפצת טיפות פטרייתיות כדי להיות מסוגל להתמקד טוב יותר באזור. - ספרו את מספר נבגי הקונידיה הנבטים עם חמישה שדות שנבחרו באקראי תחת מיקרוסקופיית אור של 200x כדי לקבוע את קצב הנביטה.
- בצע שלושה שכפולים עבור כל מבודד.
5. דירוג מספר קונידיה אפקטיבי (ECN)
- חישוב ECN
הערה: השג את נתוני הייצור התרמוטולנס של כל זן פטרייתי פוטנציאלי לפני חישוב סך ECN21.- חשב את השינוי הקיפול (FC) של ייצור חבית בכל נקודת זמן:
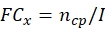
כאשר, x = נקודת זמן לאיסוף נתונים; ncp = מספר conidia לאחר כל יום של צמיחה; ואני = המספר הראשוני של קונידיה זרעים. - חשב את מספר conidia תחת טיפול הלחץ בכל נקודת זמן באמצעות הנוסחה הבאה:

איפה, y = ECN של נקודת הזמן תחת טיפול; TT0 = שיעור הנביטה של conidia לא עובר מתח חום (= שיעור נביטה של 0 דקות טיפול בחום); TTz = מקדם מתח הוא שיעור הנביטה conidia בזמנים שונים של טיפול בחום (z). - חשב את ה- ECN הכולל באמצעות הנוסחה הבאה:

- השווה את ה- ECN של כל זן פטרייתי.
- חשב את השינוי הקיפול (FC) של ייצור חבית בכל נקודת זמן:
- ניתוח רכיבים עיקרי (PCA) של זנים פטרייתיים
הערה: ניתוח PCA מאשר את הדירוג של ECN ומסייע בהבנת המתאם בין ערכי התווים הפיזיולוגיים. השווה את ערכי ה- ECN ובחר EPF מבודד בעלי ערכי ECN גבוהים יותר. - השתמש בתוכנת R כדי ליצור PCA על-ידי קידוד:
#Input קובץ נתונים של PCA
a = read.table("PCA.csv",sep=',',',כותרת=T)- # עיבוד נתונים לדוגמה
row.names(א) <- c("NCHU-9", "NCHU-11", "NCHU-64", "NCHU-69", "NCHU-95", "NCHU-113")
X= row.names(a)
df<- a[2:11] - חישוב #PCA
pca <- prcomp(df, center = TRUE, scale = TRUE)
vars <- (pca$sdev)^2
pc1_percent = vars[1] / sum(vars)
pc2_percent = vars[2] / sum(vars)
ערך = pca$x - קובץ תצוגה חזותית של PCA #Output
png(קובץ = 'pca.png', גובה = 2000, רוחב = 2000, res = 300)
הערה: השתמש בייצור קונוסי של 7 עד 14 ימים ובכל נתוני התרמו-סובלנות כדי לבצע ניתוח רכיבים ראשי (PCA) לאישור דירוג ה- ECN.
- # עיבוד נתונים לדוגמה
- בחר את הזנים הפטרייתיים בעלי הביצועים הטובים ביותר המבוססים על ECN או PCA ובצע את בדיקת virulence של מזיקי יעד למחקר נוסף.
Access restricted. Please log in or start a trial to view this content.
תוצאות
בידוד ובחירה של פטריות אנטומופתוגניות פוטנציאליות (EPF)
על ידי שימוש בשיטת בניית ספריית אנטומופתוגנית בתיווך Tenebrio molitor (EPF), מספר הפטריות ללא פעילות הרג חרקים יוחרג; לכן, יעילות הבידוד ובחירת EPF יכול להיות מוגבר במידה רבה. במהלך היישום של שיטה זו, המידע של אתר...
Access restricted. Please log in or start a trial to view this content.
Discussion
פטריות אנטומופתוגניות (EPF) שימשו לבקרת חרקים. קיימות מספר שיטות לבידוד, בחירה וזיהוי של EPF30,31,32. בהשוואה בין הסוגים השונים של שיטות פיתיון חרקים, בובריה באסיאנה ו Metarhizium אניסופליה נמצאו בדרך כלל פיתיונים חרקים6,12,13,14.
Access restricted. Please log in or start a trial to view this content.
Disclosures
המחברים מצהירים כי אין ניגוד אינטרסים המעורב בעבודה זו.
Acknowledgements
מחקר זה נתמך על ידי גרנט 109-2313-B-005-048 -MY3 ממשרד המדע והטכנולוגיה (MOST).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Agar Bacteriological grade | BIOMAN SCIENTIFIC Co., Ltd. | AGR001 | Suitable in most cell culture/molecular, biology applications. |
| AGAROSE, Biotechnology Grade | BIOMAN SCIENTIFIC Co., Ltd. | AGA001 | For DNA electrophoresis. |
| BioGreen Safe DNA Gel Buffer | BIOMAN | SDB001T | |
| Brass cork borer | Dogger | D89A-44001 | |
| Canon kiss x2 | Canon | EOS 450D | For record strain colony morphology |
| Constant temperature incubator | Yihder Co., Ltd. | LE-509RD | Fungal keeping. |
| cubee Mini-Centrifuge | GeneReach | MC-CUBEE | |
| DigiGel 10 Digital Gel Image System | TOPBIO | DGIS-12S | |
| Finnpipette F2 0.2 to 2 µL Pipette | Thermo Scientific | 4642010 | |
| Finnpipette F2 1 to 10 µL Pipette | Thermo Scientific | 4642030 | |
| Finnpipette F2 10 to 100 µL Pipette | Thermo Scientific | 4642070 | |
| Finnpipette F2 100 to 1000 µL Pipette | Thermo Scientific | 4642090 | |
| Finnpipette F2 2 to 20 µL Pipette | Thermo Scientific | 4642060 | |
| Finnpipette F2 20 to 200 µL Pipette | Thermo Scientific | 4642080 | |
| GeneAmp PCR System 9700 | Applied Biosystems | 4342718 | |
| GenepHlow Gel/PCR Kit | Geneaid | DFH100 | |
| Genius Dry Bath Incubator | Major Science | MD-01N | |
| Graduated Cylinder Custom A 100mL | SIBATA | SABP-1195906 | Measure the volume of reagents. |
| Hand tally counter | SDI | NO.1055 | |
| Hemocytometer | bioman | AP-0650010 | Calculate the number of spore |
| Inoculating loop | Dogger | D8GA-23000 | |
| lid | IDEAHOUSE | RS92004 | |
| Micro cover glass | MUTO PURE CHEMICALS CO.,LTD | 24241 | |
| Microscope imaging system | SAGE VISION CO.,LTD | SGHD-3.6C | |
| Microscope Slides | DOGGER | DG75001-07105 | |
| Mupid-2plus DNA Gel Electrophoresis | ADVANCE | AD110 | |
| Nikon optical microscope | SAGE VISION CO.,LTD | Eclipse CI-L | |
| Plastic cup | IDEAHOUSE | CS60016 | |
| Presto Mini gDNA Yeast Kit | Geneaid | GYBY300 | Fungal genomic DNA extraction kit |
| Sabouraud Dextrose Broth (Sabouraud Liquid Medium) | HiMedia Leading BioSciences Company | M033 | Used for cultivation of yeasts, moulds and aciduric microorganisms. |
| Scalpel Blade No.23 | Swann-Morton | 310 | |
| Scalpel Handle No.4 | AGARWAL SURGICALS | SSS -FOR-01-91 | |
| Shovel | Save & Safe | A -1580242 -00 | |
| Silwet L-77 | bioman(phytotech) | S7777 | Surfactant |
| Sorvall Legend Micro 17 Microcentrifuge | Thermo Scientific | 75002403 | |
| Steel Tweezers | SIPEL ELECTRONIC SA | GG-SA | |
| Sterile Petri Dish | BIOMAN SCIENTIFIC Co., Ltd. | 1621 | Shallow cylindrical containers with fitted lids, specifically for microbiology or cell culture use. |
| ThermoCell MixingBlock | BIOER | MB-101 | |
| Tween 80 | FUJIFILM Wako Pure Chemical Corporation | 164-21775 | |
| TwinGuard ULT Freezer | Panasonic Healthcare Holdings Co., Ltd. | MDF-DU302VX | -80°C sample stored. |
| Vertical floor type cabinet | Chih Chin | BSC-3 | Fungal operating culturing. |
| Vortex Genie II | Scientific | SIG560 | |
| Zipper storage bags | Save & Safe | A -1248915 -00 | |
| 100 bp DNA Ladder | Geneaid | DL007 | |
| -20°C Freezer | FRIGIDAIRE | Frigidaire FFFU21M1QW | -20°C sample and experimental reagents stored. |
| 2X SuperRed PCR Master Mix | TOOLS | TE-SR01 | |
| 50X TAE Buffer | BIOMAN | TAE501000 |
References
- Wraight, S. P., Carruthers, R. I. Biopesticides: use and Delivery. , Springer. 233-269 (1999).
- Chase, A., Osborne, L., Ferguson, V. Selective isolation of the entomopathogenic fungi Beauveria bassiana and Metarhizium anisopliae from an artificial potting medium. Florida Entomologist. , 285-292 (1986).
- Meyling, N. V. Methods for isolation of entomopathogenic fungi from the soil environment. University of Copenhagen. , Frederiksberg Denmark. Department of Ecology 1-18 (2007).
- Zimmermann, G. The 'Galleria bait method'for detection of entomopathogenic fungi in soil. Journal of applied Entomology. 102 (1-5), 213-215 (1986).
- Schneider, S., Widmer, F., Jacot, K., Kölliker, R., Enkerli, J. Spatial distribution of Metarhizium clade 1 in agricultural landscapes with arable land and different semi-natural habitats. Applied Soil Ecology. 52, 20-28 (2012).
- Hallouti, A., et al. Diversity of entomopathogenic fungi associated with Mediterranean fruit fly (Ceratitis capitata (Diptera: Tephritidae)) in Moroccan Argan forests and nearby area: impact of soil factors on their distribution. BMC Ecology. 20 (1), 1-13 (2020).
- Meyling, N. V., Eilenberg, J. Occurrence and distribution of soil borne entomopathogenic fungi within a single organic agroecosystem. Agriculture, Ecosystems and Environment. 113 (1-4), 336-341 (2006).
- Skalický, A., Bohatá, A., Šimková, J., Osborne, L. S., Landa, Z. Selection of indigenous isolates of entomopathogenic soil fungus Metarhizium anisopliae under laboratory conditions. Folia Microbiologica. 59 (4), 269-276 (2014).
- Veen, K., Ferron, P. A selective medium for the isolation of Beauveria tenella and of Metarrhizium anisopliae. Journal of Invertebrate Pathology. 8 (2), 268-269 (1966).
- Goettel, M., Inglis, D. Manual of Techniques in Insect Pathology. Lacy, L. , Academic. Amsterdam. 213-249 (1997).
- Luz, C., Netto, M. C. B., Rocha, L. F. N. In vitro susceptibility to fungicides by invertebrate-pathogenic and saprobic fungi. Mycopathologia. 164 (1), 39-47 (2007).
- Mantzoukas, S., et al. Trapping entomopathogenic fungi from vine terroir soil samples with insect baits for controlling serious pests. Applied Sciences. 10 (10), 3539(2020).
- Goble, T., Dames, J., Hill, M., Moore, S. The effects of farming system, habitat type and bait type on the isolation of entomopathogenic fungi from citrus soils in the Eastern Cape Province, South Africa. BioControl. 55 (3), 399-412 (2010).
- Nishi, O., Iiyama, K., Yasunaga-Aoki, C., Shimizu, S. Isolation of entomopathogenic fungi from soil by using bait method with termite, Reticulitermes speratus. Enotomotech. 35, 21-26 (2011).
- Castrillo, L. ARS Collection of Entomopathogenic Fungal Cultures (ARSEF). , (2014).
- Fungal database WorldWide Collection of Entomopathogenic Fungi. University of Vermont. , Available from: http://www.uvm.edu/~entlab/Fungus.html (2019).
- Kim, J. C., et al. Tenebrio molitor-mediated entomopathogenic fungal library construction for pest management. Journal of Asia-Pacific Entomology. 21 (1), 196-204 (2018).
- Keyser, C. A., Henrik, H., Steinwender, B. M., Meyling, N. V. Diversity within the entomopathogenic fungal species Metarhizium flavoviride associated with agricultural crops in Denmark. BMC Microbiology. 15 (1), 1-11 (2015).
- Quesada-Moraga, E., Navas-Cortés, J. A., Maranhao, E. A., Ortiz-Urquiza, A., Santiago-Álvarez, C. Factors affecting the occurrence and distribution of entomopathogenic fungi in natural and cultivated soils. Mycological Research. 111 (8), 947-966 (2007).
- Park, J. B., et al. Developmental characteristics of Tenebrio molitor larvae (Coleoptera: Tenebrionidae) in different instars. International Journal of Industrial Entomology. 28 (1), 5-9 (2014).
- Chang, J. -C., et al. Construction and selection of an entomopathogenic fungal library from soil samples for controlling Spodoptera litura. Frontiers in Sustainable Food Systems. 5, 15(2021).
- Podder, D., Ghosh, S. K. A new application of Trichoderma asperellum as an anopheline larvicide for eco friendly management in medical science. Scientific reports. 9 (1), 1-15 (2019).
- Geneaid Biotech Ltd. Presto Mini gDNA Yeast, Ver. 04.27.17. , Available from: https://www.geneaid.com/data/files/1605664221308055331.pdf (2021).
- White, T. J., Bruns, T., Lee, S., Taylor, J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. PCR protocols: A guide to methods and applications. 18 (1), 315-322 (1990).
- Kepler, R. M., Humber, R. A., Bischoff, J. F., Rehner, S. A. Clarification of generic and species boundaries for Metarhizium and related fungi through multigene phylogenetics. Mycologia. 106 (4), 811-829 (2014).
- Kepler, R. M. A phylogenetically-based nomenclature for Cordycipitaceae (Hypocreales). IMA Fungus. 8 (2), 335-353 (2017).
- National Resource for Biomedical Supercomputing. GeneDoc: a tool for editing and annotating multiple sequence alignments. Pittsburgh Supercomputing Center's National Resource for Biomedical Supercomputing. , Available from: http://www.nrbsc.org/downloads (1997).
- Thompson, J. D., Gibson, T. J., Plewniak, F., Jeanmougin, F., Higgins, D. G. The CLUSTAL_X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools. Nucleic Acids Research. 25 (24), 4876-4882 (1997).
- Kumar, S., Stecher, G., Tamura, K. MEGA7: Molecular evolutionary genetics analysis version 7.0 for bigger datasets. Molecular Biology and Evolution. 33 (7), 1870-1874 (2016).
- Herlinda, S., Mulyati, S. I. Selection of isolates of entomopathogenic fungi and the bioefficacy of their liquid production against Leptocorisa oratorius nymphs. Microbiology Indonesia. 2 (3), 9(2008).
- Herlinda, S., Irsan, C., Mayasari, R., Septariani, S. Identification and selection of entomopathogenic fungi as biocontrol agents for Aphis gossypii from South Sumatra. Microbiology Indonesia. 4 (3), 137-142 (2010).
- Montes-Bazurto, L. G., Peteche-Yonda, Y., Medina-Cardenas, H. C., Bustillo-Pardey, A. E. Selection of entomopathogenic fungi for the biological control of Demotispa neivai (Coleoptera: Chrysomelidae) in oil palm plantations in Colombia. Journal of Entomological Science. 55 (3), 388-404 (2020).
- Shin, T. -Y., Choi, J. -B., Bae, S. -M., Koo, H. -N., Woo, S. -D. Study on selective media for isolation of entomopathogenic fungi. International Journal of Industrial Entomology. 20 (1), 7-12 (2010).
- Sharma, L., Oliveira, I., Torres, L., Marques, G. Entomopathogenic fungi in Portuguese vineyards soils: Suggesting a 'Galleria-Tenebrio-bait method'as bait-insects Galleria and Tenebrio significantly underestimate the respective recoveries of Metarhizium (robertsii) and Beauveria (bassiana). MycoKeys. (38), 1(2018).
- Rodríguez, M., Gerding, M., France, A. Selección de Hongos Entomopatógenos para el Control de Varroa destructor (Acari: Varroidae). Chilean journal of agricultural research. 69 (4), 534-540 (2009).
- Yang, H., et al. Persistence of Metarhizium (Hypocreales: Clavicipitaceae) and Beauveria bassiana (Hypocreales: Clavicipitaceae) in tobacco soils and potential as biocontrol agents of Spodoptera litura (Lepidoptera: Noctuidae). Environmental entomology. 48 (1), 147-155 (2019).
- Muñiz-Reyes, E., Guzmán-Franco, A. W., Sánchez-Escudero, J., Nieto-Angel, R. Occurrence of entomopathogenic fungi in tejocote (C rataegus mexicana) orchard soils and their pathogenicity against R hagoletis pomonella. Journal of Applied Microbiology. 117 (5), 1450-1462 (2014).
- Lacey, L. A., et al. Goettel Insect pathogens as biological control agents: Back to the future. Journal of Invertebrate Pathology. 132, 1-41 (2015).
- Humber, R. A. Manual of techniques in insect pathology. , Elsevier. 153-185 (1997).
- Rehner, S. A., Buckley, E. A Beauveria phylogeny inferred from nuclear ITS and EF1-α sequences: evidence for cryptic diversification and links to Cordyceps teleomorphs. Mycologia. 97 (1), 84-98 (2005).
- Quandt, C. A., et al. Phylogenetic-based nomenclatural proposals for Ophiocordycipitaceae (Hypocreales) with new combinations in Tolypocladium. IMA fungus. 5 (1), 121-134 (2014).
- Shah, F. A., Wang, C. S., Butt, T. M. Nutrition influences growth and virulence of the insect-pathogenic fungus Metarhizium anisopliae. FEMS Microbiology Letters. 251 (2), 259-266 (2005).
- Ignoffo, C. Environmental factors affecting persistence of entomopathogens. Florida Entomologist. , 516-525 (1992).
- Rodrigues, I. W., Forim, M., Da Silva, M., Fernandes, J., Batista Filho, A. Effect of ultraviolet radiation on fungi Beauveria bassiana and Metarhizium anisopliae, pure and encapsulated, and bio-insecticide action on Diatraea saccharalis. Advances in Entomology. 4 (3), 151-162 (2016).
- Paula, A. R., Ribeiro, A., Lemos, F. J. A., Silva, C. P., Samuels, R. I. Neem oil increases the persistence of the entomopathogenic fungus Metarhizium anisopliae for the control of Aedes aegypti (Diptera: Culicidae) larvae. Parasites and Vectors. 12 (1), 1-9 (2019).
- Morley-Davies, J., Moore, D., Prior, C. Screening of Metarhizium and Beauveria spp. conidia with exposure to simulated sunlight and a range of temperatures. Mycological Research. 100 (1), 31-38 (1996).
- Rangel, D. E., Braga, G. U., Flint, S. D., Anderson, A. J., Roberts, D. W. Variations in UV-B tolerance and germination speed of Metarhizium anisopliae conidia produced on insects and artificial substrates. Journal of Invertebrate Pathology. 87 (2-3), 77-83 (2004).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved