Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Выделение и отбор энтомопатогенных грибов из образцов почвы и оценка грибковой вирулентности против насекомых-вредителей
В этой статье
Резюме
Здесь мы представляем протокол, основанный на системе приманки мучного червя (Tenebrio molitor), которая использовалась для выделения и отбора энтомопатогенных грибов (EPF) из образцов почвы. Эффективная формула числа конидий (ECN) используется для выбора высокострессоустойчивого EPF на основе физиологических характеристик для борьбы с микробами вредителей в полевых условиях.
Аннотация
Энтомопатогенные грибы (EPF) являются одним из микробных средств борьбы с вредителями. Для борьбы с местными или инвазивными вредителями важно изолировать и выбрать местные EPF. Поэтому метод почвенной приманки в сочетании с системой приманки для насекомых (мучный червь, Tenebrio molitor) был использован в данном исследовании с некоторыми модификациями. Затем изолированные EPF были подвергнуты тесту на вирулентность против сельскохозяйственного вредителя Spodoptera litura. Кроме того, потенциальные штаммы EPF подвергались морфологической и молекулярной идентификации. Кроме того, были проведены анализ производства конидий и термотолерантности для перспективных штаммов EPF и проведено сравнение; эти данные были далее заменены в формулу эффективного числа конидий (ECN) для лабораторного ранжирования. Система почвенных приманок-мучных червей и формула ECN могут быть улучшены путем замены видов насекомых и интеграции большего количества стрессовых факторов для оценки коммерциализации и применения в полевых условиях. Этот протокол обеспечивает быстрый и эффективный подход к выбору EPF и улучшит исследования агентов биологического контроля.
Введение
В настоящее время энтомопатогенные грибы (EPF) широко используются в микробной борьбе с сельскохозяйственными, лесными и садоводческими вредителями. Преимуществами EPF являются его широкие диапазоны хозяев, хорошая приспособляемость к окружающей среде, экологичная природа и то, что он может использоваться с другими химическими веществами, чтобы показать синергетический эффект для комплексной борьбы с вредителями1,2. Для применения в качестве средства борьбы с вредителями необходимо выделить большое количество EPF либо от больных насекомых, либо от естественной среды.
Выборка этих организмов у их хозяев помогает понять географическое распределение и распространенность EPF у естественных хозяев3,4,5. Однако коллекция грибковых зараженных насекомых обычно ограничена факторами окружающей среды и популяциями насекомых в полевых условиях4. Учитывая, что насекомые-хозяева умирают после заражения EPF, а затем попадают в почву, выделение EPF из образцов почвы может быть стабильным ресурсом3,6. Например, известно, что сапрофиты используют мертвого хозяина в качестве своего ресурса для роста. Почвенные приманки и системы селективных сред широко используются для обнаружения и изоляции EPF из почвы3,4,7,8,9,10.
В методе селективной среды разбавленный почвенный раствор наносят на среду, содержащую антибиотики широкого спектра действия (например, левомицетин, тетрациклин или стрептомицин) для ингибирования роста бактерий2,3,9,11. Однако сообщалось, что этот метод может исказить разнообразие и плотность штамма и может привести к переоценке или недооценке многих микробных сообществ6. Более того, выделенные штаммы менее патогенны и конкурируют с сапрофитами при выделении. Трудно выделить EPF из разбавленного почвенного раствора3. Вместо использования селективной среды метод почвенной приманки изолирует EPF от зараженных мертвых насекомых, которые могут храниться в течение 2-3 недель, тем самым обеспечивая более эффективный и стандартный метод разделения EPF3,4,7,6. Поскольку метод прост в эксплуатации, можно выделить различные патогенные штаммы при низких затратах4. Поэтому он широко используется многими исследователями.
При сравнении различных типов систем приманки для насекомых, Beauveria bassiana и Metarhizium anisopliae являются наиболее распространенными видами EPF, которые встречаются у насекомых, принадлежащих к Hemiptera, Lepidoptera, Blattella и Coleoptera6,12,13,14. Среди этих насекомых-приманок Galleria mellonella (отряд Lepidoptera) и Tenebrio molitor (отряд Coleoptera) показывают более высокие показатели восстановления Beauveria и Metarhizium spp., если сравнивать с другими насекомыми. Поэтому G. mellonella и T. molitor обычно используются для травли насекомых. За эти годы Министерство сельского хозяйства США (USDA) создало библиотеку EPF (Agricultural Research Service Collection of EPF cultures, ARSEF), которая содержит широкий спектр видов, включая 4081 вид Beauveria spp., 18 видов Clonostachys spp., 878 видов Cordyceps spp., 2473 вида Metarhizium spp., 226 видов Purpureocillium spp., и 13 видов Pochonia spp. среди прочих15. Еще одна библиотека EPF была построена Исследовательской лабораторией энтомологии (ERL) из Университета Вермонта в Соединенных Штатах в течение 30 лет. Он включает в себя 1345 штаммов EPF из США, Европы, Азии, Африки и Ближнего Востока16.
Для борьбы с местными или инвазионными вредителями на Тайване требуется изоляция и отбор местных EPF. Поэтому в данном протоколе мы модифицировали и описали процедуру почвенного метода приманки и объединили ее с системой приманки для насекомых (мучный червь, Tenebrio molitor)17. На основе этого протокола была создана библиотека EPF. Для предварительных изолятов EPF было проведено два раунда скрининга (количественная оценка инокуляции). Изоляты EPF показали патогенность насекомых. Потенциальные штаммы подвергали морфологической и молекулярной идентификации и дополнительно анализировали термотолерантность и конидиальный производственный анализ. Кроме того, была также предложена концепция эффективного числа конидий (ECN). Используя формулу ECN и анализ главных компонентов (PCA), потенциальные штаммы были проанализированы под смоделированным давлением окружающей среды для завершения процесса создания и скрининга библиотеки EPF. Впоследствии патогенность перспективных штаммов EPF была проверена на целевом вредителе (например, Spodoptera litura). Текущий протокол интегрирует данные о термотолерантности и конидиальном производстве в формулу ECN и анализ PCA, которые могут использоваться в качестве стандартной системы ранжирования для исследований, связанных с EPF.
протокол
ПРИМЕЧАНИЕ: Вся блок-схема показана на рисунке 1.
1. Выделение и отбор потенциальных энтомопатогенных грибов (EPF)
- Соберите образец почвы
- Удалите 1 см поверхностного грунта, а затем соберите почву в пределах глубины 5-10 см с помощью лопаты с каждого участка отбора проб.
ПРИМЕЧАНИЕ: Места отбора проб будут горными, лесными или малонаселенными районами, чтобы избежать загрязнения искусственно распыленными штаммами EPF. Убедитесь, что участки для сбора проб почвы покрыты сорняками на поверхности. Сухая почва или влажная почва не подходит для этого эксперимента. - Запишите подробную информацию о каждом участке отбора проб, включая GPS, высоту, тип поля, годовую температуру, годовое количество осадков, время сбора (сезон), тип почвы и значение pH.
- Соберите 100 г образца почвы в полиэтиленовый пакет и поддерживайте его при комнатной температуре, если подвергните его протоколу грибковой изоляции в лаборатории в течение 3 ч.
ПРИМЕЧАНИЕ: Если образец не может быть использован в течение 3 ч, храните почву при комнатной температуре в темных условиях. Если эксперимент не проводится сразу, образец почвы можно хранить при 4 °C в течение 1 недели до начала протокола18,19.
- Удалите 1 см поверхностного грунта, а затем соберите почву в пределах глубины 5-10 см с помощью лопаты с каждого участка отбора проб.
- Приманка и выделение EPF с мучным червем (Tenebrio molitor)
- Поместите 100 г образца почвы в пластиковый стаканчик (диаметр колпачка = 8,5 см, высота = 12,5 см), а затем поместите 5 мучных червей на поверхность почвы при комнатной температуре в темноте на 2 недели.
ПРИМЕЧАНИЕ: Другие типы пластиковых контейнеров для чашек также могут быть использованы. Если почвы слишком сухие (потрескавшиеся или песчаные), распылите на почвы стерилизованный ddH2O (около 5-10 мл). Длина тела около 2,5 см (14-я звезда) личинок T. molitor помогает в оболочке грибков20. - Ежедневно наблюдают и регистрируют личинок на предмет смертности и микоза; держать мертвых личинок в чашке до 2 недель для грибковой изоляции.
ПРИМЕЧАНИЕ: Споры грибковых конидий в образцах почвы будут прикрепляться к личинкам мучного червя во время вышеуказанного процесса. Грибковый микоз будет наблюдаться по мере роста гиф из межсегментальной мембраны, и тогда все тело будет покрыто мицелием. Споруляция начнется через 7 дней и цвет грибковой инфекции изменится на цвет конидийной массы. - Перенесите мертвых насекомых на чистую скамейку и используйте стерильную зубочистку для сбора конидий. Проведите их на четверть прочности декстроза агаровой средней (1/4 SDA) пластины (55 мм) в лаборатории21. Инкубируют культуральную пластину при 25 °C в течение 7 дней для получения первичной культуры грибов.
ПРИМЕЧАНИЕ: Пластину 1/4 SDA готовят следующим образом: Смешайте 1,5 г бульона декстрозы Сабуро и 3 г агара в 200 мл H2O, а затем стерилизуйте в течение 20 мин. Aliquot 1/4 SDA в каждую чашку Петри 55 мм перед затвердеванием. Затвердевшие пластины 1/4 SDA хранят при 4 °C до использования. - Повторно проведите полоску каждой первичной культуры грибов на одной пластине 55 мм 1/4 SDA в ламинарном потоке и инкубируйте культуральную пластину при 25 °C в течение 7 дней для получения одиночных колоний грибов.
- Повторите эту повторную изоляцию ~2-3 раза и наблюдайте под световой микроскопией для получения единичных и чистых морфологических грибковых колоний.
ПРИМЕЧАНИЕ: Изолируйте все EPF с помощью T. molitor-bait и храните, как описано в следующем разделе. Разделение, консервация, чистое культивирование и стрейкование должны выполняться в ламинарном потоке на последующих участках.
- Поместите 100 г образца почвы в пластиковый стаканчик (диаметр колпачка = 8,5 см, высота = 12,5 см), а затем поместите 5 мучных червей на поверхность почвы при комнатной температуре в темноте на 2 недели.
- Хранение изолятов EPF
- Вырежьте 3 из 5 мм агаровых блоков по краю каждой изолированной чистой грибковой культивируемой пластины пробковой бурильщиком и поместите ее в микроцентрифужную трубку объемом 1,5 мл в качестве одной реплики.
ПРИМЕЧАНИЕ: Три реплики для каждого грибкового изолята рекомендуются для хранения штаммов EPF после 2-го теста на вирулентность. Молекулярная идентификация также рекомендуется, если пространство для хранения ограничено. - Добавьте 250 мкл 0,03% раствора поверхностно-активного вещества (Таблица материалов) и 250 мкл 60% глицерина в микроцентрифужную трубку объемом 1,5 мл с помощью микропипетки; затем вихрь в течение 10 с.
- Запечатайте микроцентрифужную трубку объемом 1,5 мл парафиновой пленкой и предварительно охладите ее в холодильнике при температуре -20 °C в течение 24 ч. Затем переложите предварительно охлажденные грибковые запасы в холодильник с температурой -80 °C для криоконсервации.
ПРИМЕЧАНИЕ: В разделе 1.4 использовались пластины для экстра чистых грибковых культур (помимо криоконсервированных образцов).
- Вырежьте 3 из 5 мм агаровых блоков по краю каждой изолированной чистой грибковой культивируемой пластины пробковой бурильщиком и поместите ее в микроцентрифужную трубку объемом 1,5 мл в качестве одной реплики.
- 1-й скрининг патогенности для грибковых изолятов
- Поместите пять личинок T. molitor непосредственно на поверхность каждой чистой грибковой культуральной пластины при 25 °C.
- Наблюдают и регистрируют микоз и смертность в течение 10 дней. Выберите грибковый изолят для дальнейшего анализа.
ПРИМЕЧАНИЕ: Грибковые изоляты, вызывающие 100% смертность, отбираются для 2-го теста на вирулентность для подтверждения их вирулентности личинкам T. molitor . Кроме того, исследователь может скорректировать критерии в соответствии со своим собственным исследованием.
- 2-й тест на вирулентность грибковых изолятов
ПРИМЕЧАНИЕ: На основе 1-го скрининга патогенности восстановите выбранные грибковые изоляты от -80 °C для 2-го теста на вирулентность. Целью 2-го теста на вирулентность является количественная оценка патогенности выбранных грибковых изолятов после 1-го раунда скрининга.- Собирают конидии каждого грибкового изолята путем вихря в течение 1 мин и подсчитывают количество конидий с помощью гемоцитометра.
- Отрегулируйте суспензию конидий до концентрации 1 х 107 конидий/мл в 0,03% растворе поверхностно-активного вещества (Таблица материалов).
- Нанесите 10 мкл грибковой суспензии на пластины 55 мм 1/4 SDA и выращивайте в течение 7 дней при 25 °C в темноте.
- Поместите пять личинок T. molitor непосредственно на поверхность каждой чистой грибковой культуральной пластины (c.a. 6 x 107 conidia). Запечатайте пластины парафиновой пленкой и инкубируйте при 25 °C в темноте.
- Наблюдают и регистрируют микоз и смертность в течение 10 дней.
- Повторите тест (с этапа 1.51 по 1.5.5) в трех экземплярах для каждого грибкового изолята.
ПРИМЕЧАНИЕ: Грибковые изоляты, вызывающие 100% смертность, отбираются для 3-го теста на вирулентность, чтобы подтвердить их вирулентность для нацеливания на вредителя.
- 3-й тест на вирулентность фунгальных изолятов для целевого вредителя (Spodoptera litura в качестве примера)
- Повторите шаги 1.5.2-1.5.6 с выбранными изолятами из 2-й вирулентности для проверки вирулентности против целевого вредного организма.
- Рассчитайте LT50 каждого грибкового изолята22.
ПРИМЕЧАНИЕ: LT50 каждого грибкового изолята рассчитывали с помощью обобщенных линейных моделей (GLM) с использованием R studio (версия 3.4.1); квазибиномиальное распределение ошибок и функция логарифмической связи могут использоваться для учета чрезмерного расхождения.
2. Молекулярная идентификация EPF
- Экстракция грибковой геномной ДНК
- Соберите около 1 см2 EPF с 7-дневной пластины 1/4 SDA.
- Извлеките грибковую геномную ДНК с помощью набора для экстракции грибковой геномной ДНК в соответствии с инструкциями производителя23 (Таблица материалов).
- Амплификация ПЦР и секвенирование ДНК
- Амплифицируйте грибковую область ITS методом ПЦР образца ДНК21 с помощью PCR Master Mix (2x), набора праймеров ITS1F/ITS4R24 (таблица 1) со следующей программой ПЦР: 94 °C в течение 1 мин, а затем 35 циклов 94 °C в течение 30 с, 55 °C в течение 30 с и 72 °C в течение 1 мин, с последующим 7-минутным окончательным расширением при 72 °C.
ПРИМЕЧАНИЕ: Набор праймеров ITS1F/ITS4R предназначен для идентификации на уровне рода. - Секвенирование ПЦР с помощью коммерческой службы секвенирования.
- Используйте NCBI BLAST для поиска похожих грибов в базе данных NCBI и выберите относительные виды грибкового типа для филогенетического анализа.
ПРИМЕЧАНИЕ: Грибковые виды, относящиеся к роду Metarhizium или Beauveria, должны быть дополнительно идентифицированы до видового уровня с помощью грунтовки tef-983F/tef-2218R25 (повторите шаги 2.1.1-2.2.3). Для грибов, которые не принадлежат к родам Metarhizium или Beauveria, для идентификации вида могут использоваться другие молекулярные маркеры, включая ДНК-лиазу (APN2), бета-тубулин (BTUB), крупнейшую субъединицу РНК-полимеразы II (RPB1), вторую по величине субъединицу РНК-полимеразы II (RPB2) и 3'-ю часть коэффициента удлинения трансляции 1 альфа (TEF)25,26 .
- Амплифицируйте грибковую область ITS методом ПЦР образца ДНК21 с помощью PCR Master Mix (2x), набора праймеров ITS1F/ITS4R24 (таблица 1) со следующей программой ПЦР: 94 °C в течение 1 мин, а затем 35 циклов 94 °C в течение 30 с, 55 °C в течение 30 с и 72 °C в течение 1 мин, с последующим 7-минутным окончательным расширением при 72 °C.
- Филогенетический анализ
- Используйте программное обеспечение ClustalX 2.127 для выравнивания нескольких последовательностей из шагов 2.2.2 и 2.2.3. Обрежьте область сохраненных последовательностей вручную с помощью GeneDoc28.
- Выполните филогенетический анализ с помощью программного обеспечения MEGA729 на основе методов минимальной эволюции (ME), соседского соединения (NJ) и максимальной вероятности (ML).
ПРИМЕЧАНИЕ: Выполнение всех трех методов может помочь подтвердить и точно заключить классификационный статус. Грибковые изоляты, экранированные 1-м скринингом патогенности, используются для молекулярной идентификации на уровне рода. Грибковые изоляты, проверенные 2-м тестом на вирулентность, используются для молекулярной и морфологической идентификации на уровне вида.
3. Морфологическая идентификация EPF
- Наблюдение за морфологией грибковой колонии
- Используйте камеру, чтобы запечатлеть рост колонии грибковой культуры в течение 7 дней и записать рост, форму (пушистую, твердую) и цвет колоний.
- Наблюдение конидий и конидиофоров
- Соскоблить конидии из чистокультурной грибковой колонии с помощью петли инокуляции и перенести споры на стеклянный слайд с 0,1% раствором Tween 80. Затем накройте чехлом для легкого микроскопического наблюдения конидий.
- Используйте скальпель, чтобы разрезать блок агара размером 5 мм2 гифальной нити на краю грибковой колонии, а затем перенести агаровый блок на стеклянную горку.
- Выполните очистку следующим образом: Добавьте 0,1% раствор Tween 80 на блок агара пластиковой капельницей и смойте большую часть излишков конидий с помощью пинцета. Затем накройте его чехлом для легкомикроскопического наблюдения.
ПРИМЕЧАНИЕ: 0,1% Tween 80 может быть заменен другим более мощным поверхностно-активным веществом (Таблица материалов) в зависимости от видов грибов и гидрофобности. - Измерьте и запишите ширину и длину конидий и конидиофоров, чтобы сравнить различия между различными грибковыми изолятами.
- Используйте тест ANOVA Уэлча и тест Геймса-Хауэлла (пост-специальный тест) для анализа конидиальной ширины и длины каждого штамма с помощью R studio (версия 3.4.1).
ПРИМЕЧАНИЕ: Анализ данных морфологических признаков может быть скорректирован по случаям. Грибковые изоляты, прошедшие скрининг с помощью 3-го теста на вирулентность, используются для физиологической характеристики и ранжирования ECN в разделах 4 и 5.
4. Исследование конидиальной продуктивности и термотолерантности
- Конидиальный производственный анализ
- Культивировать выбранный грибковый изолят на 1/4 среды SDA при 25 ± 1 °C в темноте в течение 10 дней.
- Готовят 1 мл конидиальной суспензии грибкового изолята в 0,03% растворе поверхностно-активного вещества и доводят до 1 х 107 конидий/мл, как описано выше.
- Капните три капли по 10 мкл конидиальной суспензии на 1/4 SDA и инкубируйте при 25 °C в темноте в течение 7, 10 и 14 дней, чтобы подсчитать споруляцию грибов.
ПРИМЕЧАНИЕ: 10 мкл является лучшим объемом для сбора блока 5 мм с равномерной грибковой споруляцией после роста грибка в течение 7-14 дней. - Используйте пробковый бур для отсоединения 5-миллиметрового агарового блока от центра колонии и переноса в 1 мл 0,03% раствора поверхностно-активного вещества (Таблица материалов) в микроцентрифужной трубке объемом 1,5 мл в каждый момент времени.
- Вращайте трубку при 3000 об/мин при комнатной температуре в течение 15 мин и используйте гемоцитометр для подсчета количества конидий.
ПРИМЕЧАНИЕ: Формула, используемая для подсчета, представляет собой количество конидий на 25 квадратов наименьшей ячейки (размер = 0,025 мм2; глубина камеры = 0,1 мм):
Всего конидий в 5 квадратах ÷ 80 × (4 × 106) - Повторите три раза для каждого изолята.
- Термотолерансный анализ
- Культивировать выбранный грибковый изолят на 1/4 среды SDA при 25 ± 1 °C в темноте в течение 10 дней.
- Приготовьте 1 мл конидиальной суспензии грибкового изолята в 0,03% растворе поверхностно-активного вещества и доведите до 1 х 107 конидий/мл, как описано выше.
- Вращайте конидиальную суспензию и нагревайте ее в сухой ванне при температуре 45 °C в течение 0, 30, 60, 90 и 120 мин. Капните три капли по 5 мкл конидиальной суспензии на 55 мм 1/4 среды SDA в каждый момент времени после теплового воздействия и инкубируйте при 25 ± 1 °C в течение 18 ч.
ПРИМЕЧАНИЕ: Избегайте распространения грибковых капель, чтобы иметь возможность лучше сосредоточиться на области. - Подсчитайте количество проросших спор конидий с пятью случайно выбранными полями под 200-кратной световой микроскопией, чтобы определить скорость прорастания.
- Выполните три реплики для каждого изолята.
5. Эффективное ранжирование числа конидий (ECN)
- Расчет ECN
ПРИМЕЧАНИЕ: Получение данных о конидиальной продукции и термотолерантности каждого потенциального штамма грибка перед расчетом общего ECN21.- Рассчитайте коэффициент сгиба (FC) конидиального производства в каждой точке времени:
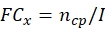
где, x = временная точка сбора данных; ncp = количество конидий после каждого дня роста; и I = начальное число посеянных конидий. - Рассчитайте число конидий при лечении стресса в каждый момент времени, используя следующую формулу:

где, y = ECN рассматриваемой временной точки; TT0 = скорость прорастания конидий, не подвергающихся тепловому стрессу (= скорость прорастания 0 мин термической обработки); TTz = коэффициент напряжения — скорость прорастания конидий в разное время термообработки (z). - Рассчитайте общий ECN, используя следующую формулу:

- Сравните ECN каждого грибкового штамма.
- Рассчитайте коэффициент сгиба (FC) конидиального производства в каждой точке времени:
- Анализ главных компонентов (PCA) грибковых штаммов
ПРИМЕЧАНИЕ: Анализ PCA подтверждает ранжирование ECN и помогает понять корреляцию между значениями физиологического характера. Сравните значения ECN и выберите изоляты EPF с более высокими значениями ECN. - Используйте программное обеспечение R для создания PCA путем кодирования:
#Input файл данных PCA
a = read.table("PCA.csv";sep=',',header=T)- # Обработка образцов данных
row.names(a) <-c("NCHU-9","NCHU-11", "NCHU-64", "NCHU-69", "NCHU-95", "NCHU-113")
X=строка.имена(a)
дф<- а[2:11] - расчет #PCA
pca <- prcomp(df, центр = ИСТИНА, масштаб = ИСТИНА)
vars <- (pca$sdev)^2
pc1_percent = vars[1] / sum(vars)
pc2_percent = vars[2] / sum(vars)
значение = pca$x - #Output файл визуализации PCA
png(файл = 'pca.png', высота = 2000, ширина = 2000, res = 300)
ПРИМЕЧАНИЕ: Используйте от 7 до 14 дней конидиального производства и все данные термотолерантности для выполнения анализа главных компонентов (PCA) для подтверждения рейтинга ECN.
- # Обработка образцов данных
- Выберите наиболее эффективные грибковые штаммы на основе ECN или PCA и проведите тест на вирулентность целевых вредителей для дальнейших исследований.
Результаты
Выделение и отбор потенциальных энтомопатогенных грибов (EPF)
Используя метод построения библиотеки энтомопатогенных грибов (EPF), опосредованный молитором Tenebrio, количество грибов без активности уничтожения насекомых будет исключено; таким образом, эфф...
Обсуждение
Энтомопатогенные грибы (EPF) использовались для борьбы с насекомыми. Существует несколько методов изоляции, выбора и идентификации EPF30,31,32. Сравнивая различные типы методов приманки для насекомых, Beauveria bassiana и Metarhizium anisopliae обычн...
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов, связанного с этой работой.
Благодарности
Это исследование было поддержано грантом 109-2313-B-005 -048 -MY3 от Министерства науки и технологий (MOST).
Материалы
| Name | Company | Catalog Number | Comments |
| Agar Bacteriological grade | BIOMAN SCIENTIFIC Co., Ltd. | AGR001 | Suitable in most cell culture/molecular, biology applications. |
| AGAROSE, Biotechnology Grade | BIOMAN SCIENTIFIC Co., Ltd. | AGA001 | For DNA electrophoresis. |
| BioGreen Safe DNA Gel Buffer | BIOMAN | SDB001T | |
| Brass cork borer | Dogger | D89A-44001 | |
| Canon kiss x2 | Canon | EOS 450D | For record strain colony morphology |
| Constant temperature incubator | Yihder Co., Ltd. | LE-509RD | Fungal keeping. |
| cubee Mini-Centrifuge | GeneReach | MC-CUBEE | |
| DigiGel 10 Digital Gel Image System | TOPBIO | DGIS-12S | |
| Finnpipette F2 0.2 to 2 µL Pipette | Thermo Scientific | 4642010 | |
| Finnpipette F2 1 to 10 µL Pipette | Thermo Scientific | 4642030 | |
| Finnpipette F2 10 to 100 µL Pipette | Thermo Scientific | 4642070 | |
| Finnpipette F2 100 to 1000 µL Pipette | Thermo Scientific | 4642090 | |
| Finnpipette F2 2 to 20 µL Pipette | Thermo Scientific | 4642060 | |
| Finnpipette F2 20 to 200 µL Pipette | Thermo Scientific | 4642080 | |
| GeneAmp PCR System 9700 | Applied Biosystems | 4342718 | |
| GenepHlow Gel/PCR Kit | Geneaid | DFH100 | |
| Genius Dry Bath Incubator | Major Science | MD-01N | |
| Graduated Cylinder Custom A 100mL | SIBATA | SABP-1195906 | Measure the volume of reagents. |
| Hand tally counter | SDI | NO.1055 | |
| Hemocytometer | bioman | AP-0650010 | Calculate the number of spore |
| Inoculating loop | Dogger | D8GA-23000 | |
| lid | IDEAHOUSE | RS92004 | |
| Micro cover glass | MUTO PURE CHEMICALS CO.,LTD | 24241 | |
| Microscope imaging system | SAGE VISION CO.,LTD | SGHD-3.6C | |
| Microscope Slides | DOGGER | DG75001-07105 | |
| Mupid-2plus DNA Gel Electrophoresis | ADVANCE | AD110 | |
| Nikon optical microscope | SAGE VISION CO.,LTD | Eclipse CI-L | |
| Plastic cup | IDEAHOUSE | CS60016 | |
| Presto Mini gDNA Yeast Kit | Geneaid | GYBY300 | Fungal genomic DNA extraction kit |
| Sabouraud Dextrose Broth (Sabouraud Liquid Medium) | HiMedia Leading BioSciences Company | M033 | Used for cultivation of yeasts, moulds and aciduric microorganisms. |
| Scalpel Blade No.23 | Swann-Morton | 310 | |
| Scalpel Handle No.4 | AGARWAL SURGICALS | SSS -FOR-01-91 | |
| Shovel | Save & Safe | A -1580242 -00 | |
| Silwet L-77 | bioman(phytotech) | S7777 | Surfactant |
| Sorvall Legend Micro 17 Microcentrifuge | Thermo Scientific | 75002403 | |
| Steel Tweezers | SIPEL ELECTRONIC SA | GG-SA | |
| Sterile Petri Dish | BIOMAN SCIENTIFIC Co., Ltd. | 1621 | Shallow cylindrical containers with fitted lids, specifically for microbiology or cell culture use. |
| ThermoCell MixingBlock | BIOER | MB-101 | |
| Tween 80 | FUJIFILM Wako Pure Chemical Corporation | 164-21775 | |
| TwinGuard ULT Freezer | Panasonic Healthcare Holdings Co., Ltd. | MDF-DU302VX | -80°C sample stored. |
| Vertical floor type cabinet | Chih Chin | BSC-3 | Fungal operating culturing. |
| Vortex Genie II | Scientific | SIG560 | |
| Zipper storage bags | Save & Safe | A -1248915 -00 | |
| 100 bp DNA Ladder | Geneaid | DL007 | |
| -20°C Freezer | FRIGIDAIRE | Frigidaire FFFU21M1QW | -20°C sample and experimental reagents stored. |
| 2X SuperRed PCR Master Mix | TOOLS | TE-SR01 | |
| 50X TAE Buffer | BIOMAN | TAE501000 |
Ссылки
- Wraight, S. P., Carruthers, R. I. . Biopesticides: use and Delivery. , 233-269 (1999).
- Chase, A., Osborne, L., Ferguson, V. Selective isolation of the entomopathogenic fungi Beauveria bassiana and Metarhizium anisopliae from an artificial potting medium. Florida Entomologist. , 285-292 (1986).
- Meyling, N. V. Methods for isolation of entomopathogenic fungi from the soil environment. University of Copenhagen. , 1-18 (2007).
- Zimmermann, G. The 'Galleria bait method'for detection of entomopathogenic fungi in soil. Journal of applied Entomology. 102 (1-5), 213-215 (1986).
- Schneider, S., Widmer, F., Jacot, K., Kölliker, R., Enkerli, J. Spatial distribution of Metarhizium clade 1 in agricultural landscapes with arable land and different semi-natural habitats. Applied Soil Ecology. 52, 20-28 (2012).
- Hallouti, A., et al. Diversity of entomopathogenic fungi associated with Mediterranean fruit fly (Ceratitis capitata (Diptera: Tephritidae)) in Moroccan Argan forests and nearby area: impact of soil factors on their distribution. BMC Ecology. 20 (1), 1-13 (2020).
- Meyling, N. V., Eilenberg, J. Occurrence and distribution of soil borne entomopathogenic fungi within a single organic agroecosystem. Agriculture, Ecosystems and Environment. 113 (1-4), 336-341 (2006).
- Skalický, A., Bohatá, A., Šimková, J., Osborne, L. S., Landa, Z. Selection of indigenous isolates of entomopathogenic soil fungus Metarhizium anisopliae under laboratory conditions. Folia Microbiologica. 59 (4), 269-276 (2014).
- Veen, K., Ferron, P. A selective medium for the isolation of Beauveria tenella and of Metarrhizium anisopliae. Journal of Invertebrate Pathology. 8 (2), 268-269 (1966).
- Goettel, M., Inglis, D., Lacy, L. . Manual of Techniques in Insect Pathology. , 213-249 (1997).
- Luz, C., Netto, M. C. B., Rocha, L. F. N. In vitro susceptibility to fungicides by invertebrate-pathogenic and saprobic fungi. Mycopathologia. 164 (1), 39-47 (2007).
- Mantzoukas, S., et al. Trapping entomopathogenic fungi from vine terroir soil samples with insect baits for controlling serious pests. Applied Sciences. 10 (10), 3539 (2020).
- Goble, T., Dames, J., Hill, M., Moore, S. The effects of farming system, habitat type and bait type on the isolation of entomopathogenic fungi from citrus soils in the Eastern Cape Province, South Africa. BioControl. 55 (3), 399-412 (2010).
- Nishi, O., Iiyama, K., Yasunaga-Aoki, C., Shimizu, S. Isolation of entomopathogenic fungi from soil by using bait method with termite, Reticulitermes speratus. Enotomotech. 35, 21-26 (2011).
- Castrillo, L. . ARS Collection of Entomopathogenic Fungal Cultures (ARSEF). , (2014).
- Kim, J. C., et al. Tenebrio molitor-mediated entomopathogenic fungal library construction for pest management. Journal of Asia-Pacific Entomology. 21 (1), 196-204 (2018).
- Keyser, C. A., Henrik, H., Steinwender, B. M., Meyling, N. V. Diversity within the entomopathogenic fungal species Metarhizium flavoviride associated with agricultural crops in Denmark. BMC Microbiology. 15 (1), 1-11 (2015).
- Quesada-Moraga, E., Navas-Cortés, J. A., Maranhao, E. A., Ortiz-Urquiza, A., Santiago-Álvarez, C. Factors affecting the occurrence and distribution of entomopathogenic fungi in natural and cultivated soils. Mycological Research. 111 (8), 947-966 (2007).
- Park, J. B., et al. Developmental characteristics of Tenebrio molitor larvae (Coleoptera: Tenebrionidae) in different instars. International Journal of Industrial Entomology. 28 (1), 5-9 (2014).
- Chang, J. -. C., et al. Construction and selection of an entomopathogenic fungal library from soil samples for controlling Spodoptera litura. Frontiers in Sustainable Food Systems. 5, 15 (2021).
- Podder, D., Ghosh, S. K. A new application of Trichoderma asperellum as an anopheline larvicide for eco friendly management in medical science. Scientific reports. 9 (1), 1-15 (2019).
- . Geneaid Biotech Ltd. Presto Mini gDNA Yeast, Ver. 04.27.17 Available from: https://www.geneaid.com/data/files/1605664221308055331.pdf (2021)
- White, T. J., Bruns, T., Lee, S., Taylor, J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. PCR protocols: A guide to methods and applications. 18 (1), 315-322 (1990).
- Kepler, R. M., Humber, R. A., Bischoff, J. F., Rehner, S. A. Clarification of generic and species boundaries for Metarhizium and related fungi through multigene phylogenetics. Mycologia. 106 (4), 811-829 (2014).
- Kepler, R. M. A phylogenetically-based nomenclature for Cordycipitaceae (Hypocreales). IMA Fungus. 8 (2), 335-353 (2017).
- Thompson, J. D., Gibson, T. J., Plewniak, F., Jeanmougin, F., Higgins, D. G. The CLUSTAL_X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools. Nucleic Acids Research. 25 (24), 4876-4882 (1997).
- Kumar, S., Stecher, G., Tamura, K. MEGA7: Molecular evolutionary genetics analysis version 7.0 for bigger datasets. Molecular Biology and Evolution. 33 (7), 1870-1874 (2016).
- Herlinda, S., Mulyati, S. I. Selection of isolates of entomopathogenic fungi and the bioefficacy of their liquid production against Leptocorisa oratorius nymphs. Microbiology Indonesia. 2 (3), 9 (2008).
- Herlinda, S., Irsan, C., Mayasari, R., Septariani, S. Identification and selection of entomopathogenic fungi as biocontrol agents for Aphis gossypii from South Sumatra. Microbiology Indonesia. 4 (3), 137-142 (2010).
- Montes-Bazurto, L. G., Peteche-Yonda, Y., Medina-Cardenas, H. C., Bustillo-Pardey, A. E. Selection of entomopathogenic fungi for the biological control of Demotispa neivai (Coleoptera: Chrysomelidae) in oil palm plantations in Colombia. Journal of Entomological Science. 55 (3), 388-404 (2020).
- Shin, T. -. Y., Choi, J. -. B., Bae, S. -. M., Koo, H. -. N., Woo, S. -. D. Study on selective media for isolation of entomopathogenic fungi. International Journal of Industrial Entomology. 20 (1), 7-12 (2010).
- Sharma, L., Oliveira, I., Torres, L., Marques, G. Entomopathogenic fungi in Portuguese vineyards soils: Suggesting a 'Galleria-Tenebrio-bait method'as bait-insects Galleria and Tenebrio significantly underestimate the respective recoveries of Metarhizium (robertsii) and Beauveria (bassiana). MycoKeys. (38), 1 (2018).
- Rodríguez, M., Gerding, M., France, A. Selección de Hongos Entomopatógenos para el Control de Varroa destructor (Acari: Varroidae). Chilean journal of agricultural research. 69 (4), 534-540 (2009).
- Yang, H., et al. Persistence of Metarhizium (Hypocreales: Clavicipitaceae) and Beauveria bassiana (Hypocreales: Clavicipitaceae) in tobacco soils and potential as biocontrol agents of Spodoptera litura (Lepidoptera: Noctuidae). Environmental entomology. 48 (1), 147-155 (2019).
- Muñiz-Reyes, E., Guzmán-Franco, A. W., Sánchez-Escudero, J., Nieto-Angel, R. Occurrence of entomopathogenic fungi in tejocote (C rataegus mexicana) orchard soils and their pathogenicity against R hagoletis pomonella. Journal of Applied Microbiology. 117 (5), 1450-1462 (2014).
- Lacey, L. A., et al. Goettel Insect pathogens as biological control agents: Back to the future. Journal of Invertebrate Pathology. 132, 1-41 (2015).
- Humber, R. A. . Manual of techniques in insect pathology. , 153-185 (1997).
- Rehner, S. A., Buckley, E. A Beauveria phylogeny inferred from nuclear ITS and EF1-α sequences: evidence for cryptic diversification and links to Cordyceps teleomorphs. Mycologia. 97 (1), 84-98 (2005).
- Quandt, C. A., et al. Phylogenetic-based nomenclatural proposals for Ophiocordycipitaceae (Hypocreales) with new combinations in Tolypocladium. IMA fungus. 5 (1), 121-134 (2014).
- Shah, F. A., Wang, C. S., Butt, T. M. Nutrition influences growth and virulence of the insect-pathogenic fungus Metarhizium anisopliae. FEMS Microbiology Letters. 251 (2), 259-266 (2005).
- Ignoffo, C. Environmental factors affecting persistence of entomopathogens. Florida Entomologist. , 516-525 (1992).
- Rodrigues, I. W., Forim, M., Da Silva, M., Fernandes, J., Batista Filho, A. Effect of ultraviolet radiation on fungi Beauveria bassiana and Metarhizium anisopliae, pure and encapsulated, and bio-insecticide action on Diatraea saccharalis. Advances in Entomology. 4 (3), 151-162 (2016).
- Paula, A. R., Ribeiro, A., Lemos, F. J. A., Silva, C. P., Samuels, R. I. Neem oil increases the persistence of the entomopathogenic fungus Metarhizium anisopliae for the control of Aedes aegypti (Diptera: Culicidae) larvae. Parasites and Vectors. 12 (1), 1-9 (2019).
- Morley-Davies, J., Moore, D., Prior, C. Screening of Metarhizium and Beauveria spp. conidia with exposure to simulated sunlight and a range of temperatures. Mycological Research. 100 (1), 31-38 (1996).
- Rangel, D. E., Braga, G. U., Flint, S. D., Anderson, A. J., Roberts, D. W. Variations in UV-B tolerance and germination speed of Metarhizium anisopliae conidia produced on insects and artificial substrates. Journal of Invertebrate Pathology. 87 (2-3), 77-83 (2004).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены