É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Isolamento e Seleção de Fungos Entomopatômicos de Amostras de Solo e Avaliação da Virulência Fúngica contra Pragas de Insetos
Neste Artigo
Resumo
Aqui apresentamos um protocolo baseado no sistema de isca mealworm (Tenebrio molitor)-isca que foi utilizado para isolar e selecionar fungos entomopatômicos (EPF) a partir de amostras de solo. Uma fórmula eficaz de número de conidia (ECN) é usada para selecionar EPF tolerante ao alto estresse com base em características fisiológicas para controle microbiano de pragas no campo.
Resumo
Os fungos entomopatômicos (EPF) são um dos agentes de controle microbiano para o manejo integrado de pragas. Para controlar pragas locais ou invasivas, é importante isolar e selecionar ePF indígena. Por isso, o método de isca de solo combinado com o sistema isca de inseto (minhoca, Tenebrio molitor) foi utilizado neste estudo com algumas modificações. Os EPF isolados foram então submetidos ao teste de virulência contra a praga agrícola Spodoptera litura. Além disso, as cepas potenciais de EPF foram submetidas a identificações morfológicas e moleculares. Além disso, foram realizados ensaios de produção conidia e termotolerância para as promissoras cepas de EPF e comparadas; esses dados foram substituídos ainda na fórmula do número efetivo de conidia (ECN) para classificação laboratorial. O sistema de isca-míope do solo e a fórmula ECN podem ser melhorados substituindo espécies de insetos e integrando mais fatores de estresse para a avaliação da comercialização e aplicação do campo. Este protocolo fornece uma abordagem rápida e eficiente para a seleção da EPF e melhorará a pesquisa sobre agentes de controle biológico.
Introdução
Atualmente, os fungos entomopatômicos (EPF) são amplamente utilizados no controle microbiano de pragas agrícolas, florestais e horticulturais. As vantagens do EPF são suas amplas faixas de hospedagem, boa adaptabilidade ambiental, natureza ecológica, e que pode ser usada com outros produtos químicos para mostrar o efeito sinérgico para o manejo integrado de pragas1,2. Para a aplicação como agente de controle de pragas, é necessário isolar um grande número de EPF de insetos doentes ou do ambiente natural.
A amostragem desses organismos de seus hospedeiros ajuda na compreensão da distribuição geográfica e da prevalência da EPF em hospedeiros naturais3,4,5. No entanto, a coleta de insetos infectados fúngicos são geralmente limitadas por fatores ambientais e populações de insetos no campo4. Considerando que os hospedeiros de insetos morrerão após a infecção pelo EPF e, em seguida, cairão no solo, o isolamento do EPF das amostras do solo pode ser um recurso estável3,6. Por exemplo, saprophytes são conhecidos por usar o hospedeiro morto como seu recurso para o crescimento. A isca do solo e os sistemas médios seletivos têm sido amplamente utilizados para detectar e isolar o EPF do solo3,4,7,8,9,10.
No método médio seletivo, a solução de solo diluído é banhada em um meio contendo antibióticos de amplo espectro (por exemplo, clorofenicol, tetraciclina ou estreptomicina) para inibir o crescimento de bactérias2,3,9,11. No entanto, foi relatado que esse método pode distorcer a diversidade e densidade da cepa e pode causar uma super ou subestimação de muitas comunidades microbianas6. Além disso, as cepas isoladas são menos patogênicas e competem com saprofitos durante o isolamento. É difícil isolar a EPF da solução de solo diluída3. Em vez de usar um meio seletivo, o método de isca do solo isola o EPF dos insetos mortos infectados, que podem ser armazenados por 2-3 semanas, fornecendo assim um método de separação EPF mais eficiente e padrão3,4,7,6. Como o método é fácil de operar, pode-se isolar uma variedade de cepas patogênicas a um baixo custo4. Portanto, é amplamente utilizado por muitos pesquisadores.
Ao comparar os diferentes tipos de sistemas de isca de insetos, Beauveria bassiana e Metarhizium anisopliae são as espécies EPF mais comuns que são encontradas em insetos pertencentes à Hemiptera, Lepidoptera, Blattella e Coleoptera6,12,13,14. Entre essas iscas de insetos, Galleria mellonella (ordem Lepidoptera) e Tenebrio molitor (ordem Coleoptera) mostram maiores taxas de recuperação de Beauveria e Metarhizium spp., quando comparados com outros insetos. Portanto, G. mellonella e T. molitor são comumente usados para isca de insetos. Ao longo dos anos, o Departamento de Agricultura dos Estados Unidos (USDA) estabeleceu uma Biblioteca EPF (Coleção de Serviços de Pesquisa Agrícola de culturas EPF, ARSEF) que contém uma grande variedade de espécies, incluindo 4081 espécies de Beauveria spp., 18 espécies de Clonostachys spp., 878 espécies de Cordyceps spp., 2473 espécies de Metarhizium spp., 226 espécies de Purpureocillium spp., e 13 espécies de Pochonia spp. entre outras15. Outra Biblioteca EPF foi construída pelo Laboratório de Pesquisa em Entomologia (ERL) da Universidade de Vermont, nos Estados Unidos, por 30 anos. Inclui 1345 cepas de EPF dos Estados Unidos, Europa, Ásia, África e Oriente Médio16.
Para controlar pragas locais ou de invasão em Taiwan, é necessário o isolamento e a seleção de EPF indígenas. Portanto, neste protocolo, modificamos e descrevemos o procedimento do método de isca do solo e o combinamos com o sistema isca de inseto (minhoca, Tenebrio molitor)17. Com base neste protocolo, foi criada uma biblioteca da EPF. Foram realizadas duas rodadas de triagem (quantificação da inoculação) para os isolados preliminares da EPF. Os isolados do EPF apresentaram patogenicidade aos insetos. As cepas potenciais foram submetidas a identificações morfológicas e moleculares e posteriormente analisadas pelo ensaio termotolerância e produção conidial. Além disso, também foi proposto um conceito de número de conidia eficaz (ECN). Utilizando a fórmula ECN e a análise de componentes principais (PCA), as cepas potenciais foram analisadas sob pressão ambiental simulada para concluir o processo de criação e triagem da biblioteca do EPF. Posteriormente, foram testadas patogenicidades de cepas promissoras de EPF para a praga alvo (por exemplo, Spodoptera litura). O protocolo atual integra dados de termotolerância e produção conidial na fórmula ECN e análise pca, que podem ser utilizados como um sistema de classificação padrão para pesquisas relacionadas ao EPF.
Protocolo
NOTA: Todo o fluxograma é mostrado na Figura 1.
1. Isolamento e seleção de potenciais fungos entomopatogênicos (EPF)
- Coletar a amostra do solo
- Remova 1 cm do solo superficial e colete o solo dentro da profundidade de 5-10 cm usando uma pá de cada local de amostragem.
NOTA:Os locais de amostragem seriam uma montanha, floresta ou áreas pouco povoadas para evitar a contaminação de cepas de EPF artificialmente pulverizadas. Certifique-se de que as áreas para a coleta de amostras de solo estejam cobertas com a identidade na superfície. Solo seco ou solo úmido não é adequado para este experimento. - Regissua os detalhes de cada local de amostragem, incluindo GPS, elevação, tipo de campo, temperatura anual, precipitação anual, tempo de coleta (estação), tipo de solo e valor de pH.
- Colete 100 g da amostra do solo em um saco plástico e mantenha-o à temperatura ambiente se submá-lo ao protocolo de isolamento fúngico em laboratório dentro de 3h.
NOTA: Se a amostra não puder ser usada dentro de 3h, armazene o solo à temperatura ambiente em condições escuras. Se o experimento não for realizado imediatamente, a amostra do solo pode ser armazenada a 4 °C por 1 semana até o início do protocolo18,19.
- Remova 1 cm do solo superficial e colete o solo dentro da profundidade de 5-10 cm usando uma pá de cada local de amostragem.
- Isca e isolar o EPF com minhoca (Tenebrio molitor)
- Coloque 100 g da amostra do solo em um copo plástico (diâmetro da tampa = 8,5 cm, altura = 12,5 cm), e depois coloque 5 minhocas na superfície do solo à temperatura ambiente no escuro por 2 semanas.
NOTA: Outros tipos de recipientes de copo plástico também podem ser usados. Se os solos estiverem muito secos (rachados ou arenosos), pulverize ddH2O esterilizado (cerca de 5-10 mL) nos solos. O comprimento do corpo c.a. 2,5 cm (14th instar) de larvas T. molitor ajuda em telas de isolamento fúngico20. - Observar e registrar as larvas diariamente para mortalidade e micose; manter as larvas mortas no copo até 2 semanas para isolamento fúngico.
NOTA: O esporo de conidia fúngica nas amostras do solo se anexará às larvas de minhoca durante o processo acima. A micose fúngica será observada à medida que a hifa crescer a partir da membrana intersegmental, e então todo o corpo será coberto com o micélio. A esporulação começará após 7 dias e a cor da infecção fúngica mudará para a cor da massa conidia. - Transfira os insetos mortos para um banco limpo e use um palito estéril para coletar a conidia. Listra-los em um quarto de força Sabouraud dextrose agar medium (1/4 SDA) placa (55 mm) no laboratório21. Incubar a placa de cultura a 25 °C durante 7 dias para obter a cultura primária dos fungos.
NOTA: A placa 1/4 SDA é preparada da seguinte forma: Misture 1,5 g de caldo de dextrose Sabouraud e 3 g de ágar em 200 mL de H2O e, em seguida, esterilize por 20 min. Alíquota 1/4 SDA em cada placa de Petri de 55 mm antes da solidificação. As placas SDA solidificadas 1/4 são armazenadas a 4 °C até usar. - Re-raiar cada fungo de cultura primária em uma placa SDA de 55 mm 1/4 em um fluxo laminar e incubar a placa de cultura a 25 °C por 7 dias para obter colônias únicas de fungos.
- Repita este re-isolamento ~2-3 vezes e observe sob microscopia leve para obter colônias fúngicas morfológicas únicas e puras.
NOTA: Isole todo o EPF usando T. molitor-isca e armazene conforme descrito na seção a seguir. A separação, preservação, cultura pura e estonteamento devem ser realizadas em um fluxo laminar nas seções subsequentes.
- Coloque 100 g da amostra do solo em um copo plástico (diâmetro da tampa = 8,5 cm, altura = 12,5 cm), e depois coloque 5 minhocas na superfície do solo à temperatura ambiente no escuro por 2 semanas.
- Armazene os isolados do EPF
- Corte 3 dos blocos de ágar de 5 mm na borda de cada placa cultivada pura e pura isolada com um borer de rolha e coloque-o em um tubo de microcrédito de 1,5 mL como uma réplica.
NOTA: São recomendadas três réplicas para cada isolado fúngico para o armazenamento das cepas EPF após o 2º teste de virulência. A identificação molecular também é recomendada se o espaço de armazenamento for limitado. - Adicione 250 μL de solução surfactante de 0,03% (Tabela de Materiais) e 250 μL de 60% de glicerol no tubo de microcrédito de 1,5 mL usando uma micropipette; então, vórtice para 10 s.
- Sele o tubo de microcrédito de 1,5 mL com filme de parafina e pré-la em uma geladeira de -20 °C por 24 h. Em seguida, transfira os estoques fúngicos pré-cozidos para um refrigerador de -80 °C para criopreservação.
NOTA: Foram utilizadas placas de cultura fúngica extra pura (além das amostras preservadas por criocultura) na seção 1.4.
- Corte 3 dos blocos de ágar de 5 mm na borda de cada placa cultivada pura e pura isolada com um borer de rolha e coloque-o em um tubo de microcrédito de 1,5 mL como uma réplica.
- 1ª tela de patogenicidade para isolados fúngicos
- Coloque cinco larvas T. molitor diretamente na superfície de cada placa de cultura fúngica pura a 25 °C.
- Observe e regise a micose e a mortalidade por 10 dias. Selecione o isolado fúngico para análise posterior.
NOTA: Isolados fúngicos que causam 100% de mortalidade são selecionados para o 2º teste de virulência para confirmar sua virulência às larvas T. molitor . Alternativamente, o pesquisador pode ajustar os critérios conforme seu próprio estudo.
- 2º teste de virulência de isolados fúngicos
NOTA: Com base na 1ª tela de patogenicidade, recupere os isolados fúngicos selecionados a partir de -80 °C para o 2º teste de virulência. O objetivo do 2º teste de virulência é quantificar a patogenicidade dos isolados fúngicos selecionados após a 1ª rodada de triagem.- Colher conidia de cada fúngico isolado por vórtice por 1 min e contar o número de conidia usando um hemótmetro.
- Ajuste a suspensão conidia a uma concentração de 1 x 107 conidia/mL em uma solução surfactante de 0,03% (Tabela de Materiais).
- Espalhe 10 μL da suspensão fúngica em placas 55 mm 1/4 SDA e cresça por 7 dias a 25 °C no escuro.
- Coloque cinco larvas T. molitor diretamente na superfície de cada placa de cultura fúngica pura (c.a. 6 x 107 conidia). Sele as placas com filme de parafina e incubar a 25 °C no escuro.
- Observe e regise a micose e a mortalidade por 10 dias.
- Repita o teste (da etapa 1,51 a 1,5,5) em triplicado para cada isolado fúngico.
NOTA: Isolados fúngicos que causam 100% de mortalidade são selecionados para o 3º teste de virulência para confirmar sua virulência para atingir a praga.
- 3º teste de virulência de isolados fúngicos para pragas alvo (Spodoptera litura como exemplo)
- Repetir as etapas 1.5.2 a 1.5.6 com isolados selecionados da 2ª virulência para testar a virulência contra praga alvo.
- Calcule o LT50 de cada isolado fúngico22.
NOTA: O LT50 de cada isolado fúngico foi calculado através de modelos lineares generalizados (GLMs) utilizando o estúdio R (versão 3.4.1); a distribuição de erros quaseibinomiais e uma função de link de registro podem ser usadas para explicar a superdispersão.
2. Identificação molecular da EPF
- Extração de DNA genômico fúngico
- Recolher c.a. 1 cm2 EPF da placa SDA de 7 dias 1/4.
- Extrair o DNA genômico fúngico usando um kit de extração de DNA genômico fúngico de acordo com as instruções do fabricante23 (Tabela de Materiais).
- Amplificação pcr e sequenciamento de DNA
- Amplie a região de FUNGAL ITS por PCR da amostra de DNA21 usando o conjunto de primer PCR Master Mix (2x), ITS1F/ITS4R24 (Tabela 1) com o seguinte programa PCR: 94 °C por 1 min, e, em seguida, 35 ciclos de 94 °C para 30 s, 55 °C para 30 s e 72 °C para 1 min, seguido por uma extensão final de 7 min a 72 °C.
NOTA: O conjunto de primer ITS1F/ITS4R é para identificação do nível do gênero. - Sequenciar o PCR pelo serviço de sequenciamento comercial.
- Use a pesquisa NCBI BLAST para fungos semelhantes no banco de dados NCBI e selecione as espécies relativas do tipo fúngico para análise filogenética.
NOTA: As espécies fúngicas pertencentes ao gênero de Metarhizium ou Beauveria devem ser identificadas ainda mais ao nível da espécie com tef-983F/tef-2218R primer set25 (passos repetidos 2.1.1 a 2.2.3). Para fungos que não pertencem aos gêneros Metarhizium ou Beauveria, outros marcadores moleculares podem ser usados para identificar as espécies, incluindo DNA lyase (APN2), beta tubulin (BTUB), RNA polymerase II maior subunidade (RPB1), RNA polymerase II segunda maior subunidade (RPB2) e porção de 3' do fator de alongamento de tradução 1 alfa (TEF)25,26 .
- Amplie a região de FUNGAL ITS por PCR da amostra de DNA21 usando o conjunto de primer PCR Master Mix (2x), ITS1F/ITS4R24 (Tabela 1) com o seguinte programa PCR: 94 °C por 1 min, e, em seguida, 35 ciclos de 94 °C para 30 s, 55 °C para 30 s e 72 °C para 1 min, seguido por uma extensão final de 7 min a 72 °C.
- Análise filogenética
- Use o software ClustalX 2.127 para alinhar as múltiplas sequências das etapas 2.2.2 e 2.2.3. Apare manualmente a região de sequências conservadas com GeneDoc28.
- Realize a análise filogenética pelo software MEGA729 com base nos métodos de evolução mínima (ME), Junção de Vizinhos (NJ) e probabilidade máxima (ML).
NOTA: A execução dos três métodos pode ajudar a confirmar e concluir com precisão o status de classificação. Os isolados fúngicos rastreados pela 1ª tela de patogenicidade são usados para identificação molecular no nível do gênero. Os isolados fúngicos examinados pelo 2º teste de virulência são usados para a identificação molecular e morfológica do nível da espécie.
3. Identificação morfológica da EPF
- Observação da morfologia da colônia fúngica
- Use uma câmera para capturar o crescimento da colônia de cultura fúngica por 7 dias, e registrar o crescimento, forma (fofa, firme) e cor das colônias.
- Observação de conidia e conidioforos
- Raspe conidia da colônia fúngica de cultura pura com um laço de inoculação e transfira os esporos para um escorregador de vidro com solução 0,1% Tween 80. Em seguida, cubra com um tapa-tampa para observação microscópica leve de conidia.
- Use um bisturi para cortar um bloco de 5 mm2 de ágar da cadeia de hignênicos na borda da colônia fúngica e, em seguida, transfira o bloco de ágar para um slide de vidro.
- Realize a limpeza da seguinte forma: Adicione a solução 0,1% Tween 80 no bloco de ágar com um conta-gotas de plástico e lave a maior parte do excesso de conidia usando pinças. Em seguida, cubra-o com um tapa-tampa para observação leve.
NOTA: 0,1% Interpol 80 pode ser substituída por outra surfactante mais potente (Tabela de Materiais) dependendo de espécies fúngicas e hidroofobidade. - Meça e regisse a largura e o comprimento das conidia e conidioforos para comparar as diferenças entre diferentes isolados fúngicos.
- Use o teste ANOVA da Welch e o teste Games-Howell (teste pós-hoc) para analisar a largura e o comprimento conidiais de cada cepa usando o estúdio R (versão 3.4.1).
NOTA: A análise de dados de caracteres morfológicos pode ser ajustada por casos. Os isolados fúngicos selecionados com o 3º teste de virulência são utilizados para a caracterização fisiológica e o ranking ECN nas seções 4 e 5.
4. Investigação de produtividade conidial e termotolerância
- Ensaio de produção conidial
- Cultura o fúngico selecionado isolar em 1/4 SDA médio a 25 ± 1 °C no escuro por 10 dias.
- Prepare 1 mL da suspensão conidial do isolado fúngico em solução surfactante de 0,03% e ajuste para 1 x 107 conidia/mL conforme descrito acima.
- Solte três gotículas de 10 μL de suspensão conidial on1/4 SDA e incubar a 25 °C no escuro por 7, 10 e 14 dias para contar a esporulação de fungos.
NOTA: 10 μL é o melhor volume para coletar o bloco de 5 mm com esporulação fúngica uniforme após o crescimento fúngico por 7-14 dias. - Use o borer de cortiça para desconectar 5 mm do bloco de ágar do centro da colônia e transferir para 1 mL de solução surfactante de 0,03% (Tabela de Materiais) em um tubo de micro centrífugas de 1,5 mL em cada ponto de tempo.
- Vórtice o tubo a 3.000 rpm à temperatura ambiente por 15 minutos e use um hemótmetro para contar o número de conidia.
NOTA: A fórmula utilizada para a contagem é o número de conidia por 25 quadrados da menor célula (tamanho = 0,025 mm2; profundidade da câmara = 0,1 mm):
Total Não de conidia em 5 praças ÷ 80 × (4 × 106) - Repita três vezes para cada isolado.
- Ensaio de termotolerância
- Cultura o fúngico selecionado isolar em 1/4 SDA médio a 25 ± 1 °C no escuro por 10 dias.
- Prepare 1 mL da suspensão conidial do isolado fúngico em solução surfactante de 0,03% e ajuste para 1 x 107 conidia/mL conforme descrito acima.
- Vórtice a suspensão conidial e aqueça-a em um banho seco de 45 °C por 0, 30, 60, 90 e 120 min. Solte três gotículas de 5 μL da suspensão conidial em 55 mm 1/4 SDA médio em cada ponto após a exposição ao calor e incubar a 25 ± 1 °C por 18 h.
NOTA: Evite espalhar as gotículas fúngicas para poder se concentrar melhor na área. - Conte o número de esporos de conidia germinados com cinco campos selecionados aleatoriamente sob microscopia leve de 200x para determinar a taxa de germinação.
- Execute três réplicas para cada isolado.
5. Classificação de número de conidia eficaz (ECN)
- Cálculo da ECN
NOTA: Obtenha os dados de produção conidial e termotolerância de cada cepa fúngica potencial antes de calcular o ECN21 total.- Calcule a troca de dobras (FC) da produção conidial em cada ponto de tempo:
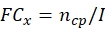
onde, x = ponto de tempo para coleta de dados; ncp = número de conidia após cada dia de crescimento; e I = número inicial de conidia semeada. - Calcule o número de conidia sob o tratamento de estresse em cada ponto de tempo usando a seguinte fórmula:

Onde, y = o ECN do ponto de tempo em tratamento; TT0 = a taxa de germinação da conidia não submetida ao estresse térmico (= taxa de germinação de 0 min tratamento térmico); TTz = coeficiente de estresse é a taxa de germinação conidia em diferentes momentos de tratamento térmico (z). - Calcule o ECN total usando a seguinte fórmula:

- Compare a ECN de cada cepa fúngica.
- Calcule a troca de dobras (FC) da produção conidial em cada ponto de tempo:
- Análise de componentes principais (PCA) de cepas fúngicas
NOTA:A análise do PCA confirma o ranking da ECN e ajuda na compreensão da correlação entre os valores do caráter fisiológico. Compare os valores ECN e selecione isolados EPF com valores de ECN mais elevados. - Use o software R para criar PCA codificando:
#Input arquivo de dados PCA
a = read.table ("PCA.csv",sep=',',cabeçalho=T)- # Processamento de dados amostrais
row.names(a) <- c("NCHU-9", "NCHU-11", "NCHU-64", "NCHU-69", "NCHU-95", "NCHU-113")
X=row.names(a)
df<- a[2:11] - cálculo #PCA
pca <-prcomp(df, centro = TRUE, escala = TRUE)
vars <- (pca$sdev)^2
pc1_percent = vars[1] / soma(vars)
pc2_percent = vars[2] / soma(vars)
valor = pca$x - #Output arquivo de visualização PCA
png (arquivo = 'pca.png', altura = 2000, largura = 2000, res = 300)
NOTA: Utilize de 7 a 14 dias de produção conidial e todos os dados de termotolerância para executar a análise de componentes principais (PCA) para confirmar o ranking da ECN.
- # Processamento de dados amostrais
- Selecione as cepas fúngicas de melhor desempenho com base na ECN ou PCA e realize o teste de virulência de pragas-alvo para novas pesquisas.
Resultados
Isolamento e seleção de potenciais fungos entomopatômicos (EPF)
Utilizando o método de construção da biblioteca de fungos entomopatômicos mediados pelo Tenebrio molitor (EPF), o número de fungos sem atividade de matança de insetos seria excluído; assim, a eficiência de isolamento e seleção de EPF poderia ser em grande parte aumentada. Durante a aplicação deste método, foram registradas as informações dos locais de amostragem, amostras de sol...
Discussão
Fungos entomopatômicos (EPF) têm sido usados para o controle de insetos. Existem vários métodos para isolar, selecionar e identificar EPF30,31,32. Comparando os diferentes tipos de métodos de isca de insetos, a anisopliae Beauveria bassiana e Metarhizium foram comumente encontradas em iscas de insetos6,12,13,14.
Divulgações
Os autores declaram que não há conflito de interesse envolvido neste trabalho.
Agradecimentos
Esta pesquisa foi apoiada pelo Grant 109-2313-B-005 -048 -MY3 do Ministério da Ciência e Tecnologia (MOST).
Materiais
| Name | Company | Catalog Number | Comments |
| Agar Bacteriological grade | BIOMAN SCIENTIFIC Co., Ltd. | AGR001 | Suitable in most cell culture/molecular, biology applications. |
| AGAROSE, Biotechnology Grade | BIOMAN SCIENTIFIC Co., Ltd. | AGA001 | For DNA electrophoresis. |
| BioGreen Safe DNA Gel Buffer | BIOMAN | SDB001T | |
| Brass cork borer | Dogger | D89A-44001 | |
| Canon kiss x2 | Canon | EOS 450D | For record strain colony morphology |
| Constant temperature incubator | Yihder Co., Ltd. | LE-509RD | Fungal keeping. |
| cubee Mini-Centrifuge | GeneReach | MC-CUBEE | |
| DigiGel 10 Digital Gel Image System | TOPBIO | DGIS-12S | |
| Finnpipette F2 0.2 to 2 µL Pipette | Thermo Scientific | 4642010 | |
| Finnpipette F2 1 to 10 µL Pipette | Thermo Scientific | 4642030 | |
| Finnpipette F2 10 to 100 µL Pipette | Thermo Scientific | 4642070 | |
| Finnpipette F2 100 to 1000 µL Pipette | Thermo Scientific | 4642090 | |
| Finnpipette F2 2 to 20 µL Pipette | Thermo Scientific | 4642060 | |
| Finnpipette F2 20 to 200 µL Pipette | Thermo Scientific | 4642080 | |
| GeneAmp PCR System 9700 | Applied Biosystems | 4342718 | |
| GenepHlow Gel/PCR Kit | Geneaid | DFH100 | |
| Genius Dry Bath Incubator | Major Science | MD-01N | |
| Graduated Cylinder Custom A 100mL | SIBATA | SABP-1195906 | Measure the volume of reagents. |
| Hand tally counter | SDI | NO.1055 | |
| Hemocytometer | bioman | AP-0650010 | Calculate the number of spore |
| Inoculating loop | Dogger | D8GA-23000 | |
| lid | IDEAHOUSE | RS92004 | |
| Micro cover glass | MUTO PURE CHEMICALS CO.,LTD | 24241 | |
| Microscope imaging system | SAGE VISION CO.,LTD | SGHD-3.6C | |
| Microscope Slides | DOGGER | DG75001-07105 | |
| Mupid-2plus DNA Gel Electrophoresis | ADVANCE | AD110 | |
| Nikon optical microscope | SAGE VISION CO.,LTD | Eclipse CI-L | |
| Plastic cup | IDEAHOUSE | CS60016 | |
| Presto Mini gDNA Yeast Kit | Geneaid | GYBY300 | Fungal genomic DNA extraction kit |
| Sabouraud Dextrose Broth (Sabouraud Liquid Medium) | HiMedia Leading BioSciences Company | M033 | Used for cultivation of yeasts, moulds and aciduric microorganisms. |
| Scalpel Blade No.23 | Swann-Morton | 310 | |
| Scalpel Handle No.4 | AGARWAL SURGICALS | SSS -FOR-01-91 | |
| Shovel | Save & Safe | A -1580242 -00 | |
| Silwet L-77 | bioman(phytotech) | S7777 | Surfactant |
| Sorvall Legend Micro 17 Microcentrifuge | Thermo Scientific | 75002403 | |
| Steel Tweezers | SIPEL ELECTRONIC SA | GG-SA | |
| Sterile Petri Dish | BIOMAN SCIENTIFIC Co., Ltd. | 1621 | Shallow cylindrical containers with fitted lids, specifically for microbiology or cell culture use. |
| ThermoCell MixingBlock | BIOER | MB-101 | |
| Tween 80 | FUJIFILM Wako Pure Chemical Corporation | 164-21775 | |
| TwinGuard ULT Freezer | Panasonic Healthcare Holdings Co., Ltd. | MDF-DU302VX | -80°C sample stored. |
| Vertical floor type cabinet | Chih Chin | BSC-3 | Fungal operating culturing. |
| Vortex Genie II | Scientific | SIG560 | |
| Zipper storage bags | Save & Safe | A -1248915 -00 | |
| 100 bp DNA Ladder | Geneaid | DL007 | |
| -20°C Freezer | FRIGIDAIRE | Frigidaire FFFU21M1QW | -20°C sample and experimental reagents stored. |
| 2X SuperRed PCR Master Mix | TOOLS | TE-SR01 | |
| 50X TAE Buffer | BIOMAN | TAE501000 |
Referências
- Wraight, S. P., Carruthers, R. I. . Biopesticides: use and Delivery. , 233-269 (1999).
- Chase, A., Osborne, L., Ferguson, V. Selective isolation of the entomopathogenic fungi Beauveria bassiana and Metarhizium anisopliae from an artificial potting medium. Florida Entomologist. , 285-292 (1986).
- Meyling, N. V. Methods for isolation of entomopathogenic fungi from the soil environment. University of Copenhagen. , 1-18 (2007).
- Zimmermann, G. The 'Galleria bait method'for detection of entomopathogenic fungi in soil. Journal of applied Entomology. 102 (1-5), 213-215 (1986).
- Schneider, S., Widmer, F., Jacot, K., Kölliker, R., Enkerli, J. Spatial distribution of Metarhizium clade 1 in agricultural landscapes with arable land and different semi-natural habitats. Applied Soil Ecology. 52, 20-28 (2012).
- Hallouti, A., et al. Diversity of entomopathogenic fungi associated with Mediterranean fruit fly (Ceratitis capitata (Diptera: Tephritidae)) in Moroccan Argan forests and nearby area: impact of soil factors on their distribution. BMC Ecology. 20 (1), 1-13 (2020).
- Meyling, N. V., Eilenberg, J. Occurrence and distribution of soil borne entomopathogenic fungi within a single organic agroecosystem. Agriculture, Ecosystems and Environment. 113 (1-4), 336-341 (2006).
- Skalický, A., Bohatá, A., Šimková, J., Osborne, L. S., Landa, Z. Selection of indigenous isolates of entomopathogenic soil fungus Metarhizium anisopliae under laboratory conditions. Folia Microbiologica. 59 (4), 269-276 (2014).
- Veen, K., Ferron, P. A selective medium for the isolation of Beauveria tenella and of Metarrhizium anisopliae. Journal of Invertebrate Pathology. 8 (2), 268-269 (1966).
- Goettel, M., Inglis, D., Lacy, L. . Manual of Techniques in Insect Pathology. , 213-249 (1997).
- Luz, C., Netto, M. C. B., Rocha, L. F. N. In vitro susceptibility to fungicides by invertebrate-pathogenic and saprobic fungi. Mycopathologia. 164 (1), 39-47 (2007).
- Mantzoukas, S., et al. Trapping entomopathogenic fungi from vine terroir soil samples with insect baits for controlling serious pests. Applied Sciences. 10 (10), 3539 (2020).
- Goble, T., Dames, J., Hill, M., Moore, S. The effects of farming system, habitat type and bait type on the isolation of entomopathogenic fungi from citrus soils in the Eastern Cape Province, South Africa. BioControl. 55 (3), 399-412 (2010).
- Nishi, O., Iiyama, K., Yasunaga-Aoki, C., Shimizu, S. Isolation of entomopathogenic fungi from soil by using bait method with termite, Reticulitermes speratus. Enotomotech. 35, 21-26 (2011).
- Castrillo, L. . ARS Collection of Entomopathogenic Fungal Cultures (ARSEF). , (2014).
- Kim, J. C., et al. Tenebrio molitor-mediated entomopathogenic fungal library construction for pest management. Journal of Asia-Pacific Entomology. 21 (1), 196-204 (2018).
- Keyser, C. A., Henrik, H., Steinwender, B. M., Meyling, N. V. Diversity within the entomopathogenic fungal species Metarhizium flavoviride associated with agricultural crops in Denmark. BMC Microbiology. 15 (1), 1-11 (2015).
- Quesada-Moraga, E., Navas-Cortés, J. A., Maranhao, E. A., Ortiz-Urquiza, A., Santiago-Álvarez, C. Factors affecting the occurrence and distribution of entomopathogenic fungi in natural and cultivated soils. Mycological Research. 111 (8), 947-966 (2007).
- Park, J. B., et al. Developmental characteristics of Tenebrio molitor larvae (Coleoptera: Tenebrionidae) in different instars. International Journal of Industrial Entomology. 28 (1), 5-9 (2014).
- Chang, J. -. C., et al. Construction and selection of an entomopathogenic fungal library from soil samples for controlling Spodoptera litura. Frontiers in Sustainable Food Systems. 5, 15 (2021).
- Podder, D., Ghosh, S. K. A new application of Trichoderma asperellum as an anopheline larvicide for eco friendly management in medical science. Scientific reports. 9 (1), 1-15 (2019).
- . Geneaid Biotech Ltd. Presto Mini gDNA Yeast, Ver. 04.27.17 Available from: https://www.geneaid.com/data/files/1605664221308055331.pdf (2021)
- White, T. J., Bruns, T., Lee, S., Taylor, J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. PCR protocols: A guide to methods and applications. 18 (1), 315-322 (1990).
- Kepler, R. M., Humber, R. A., Bischoff, J. F., Rehner, S. A. Clarification of generic and species boundaries for Metarhizium and related fungi through multigene phylogenetics. Mycologia. 106 (4), 811-829 (2014).
- Kepler, R. M. A phylogenetically-based nomenclature for Cordycipitaceae (Hypocreales). IMA Fungus. 8 (2), 335-353 (2017).
- Thompson, J. D., Gibson, T. J., Plewniak, F., Jeanmougin, F., Higgins, D. G. The CLUSTAL_X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools. Nucleic Acids Research. 25 (24), 4876-4882 (1997).
- Kumar, S., Stecher, G., Tamura, K. MEGA7: Molecular evolutionary genetics analysis version 7.0 for bigger datasets. Molecular Biology and Evolution. 33 (7), 1870-1874 (2016).
- Herlinda, S., Mulyati, S. I. Selection of isolates of entomopathogenic fungi and the bioefficacy of their liquid production against Leptocorisa oratorius nymphs. Microbiology Indonesia. 2 (3), 9 (2008).
- Herlinda, S., Irsan, C., Mayasari, R., Septariani, S. Identification and selection of entomopathogenic fungi as biocontrol agents for Aphis gossypii from South Sumatra. Microbiology Indonesia. 4 (3), 137-142 (2010).
- Montes-Bazurto, L. G., Peteche-Yonda, Y., Medina-Cardenas, H. C., Bustillo-Pardey, A. E. Selection of entomopathogenic fungi for the biological control of Demotispa neivai (Coleoptera: Chrysomelidae) in oil palm plantations in Colombia. Journal of Entomological Science. 55 (3), 388-404 (2020).
- Shin, T. -. Y., Choi, J. -. B., Bae, S. -. M., Koo, H. -. N., Woo, S. -. D. Study on selective media for isolation of entomopathogenic fungi. International Journal of Industrial Entomology. 20 (1), 7-12 (2010).
- Sharma, L., Oliveira, I., Torres, L., Marques, G. Entomopathogenic fungi in Portuguese vineyards soils: Suggesting a 'Galleria-Tenebrio-bait method'as bait-insects Galleria and Tenebrio significantly underestimate the respective recoveries of Metarhizium (robertsii) and Beauveria (bassiana). MycoKeys. (38), 1 (2018).
- Rodríguez, M., Gerding, M., France, A. Selección de Hongos Entomopatógenos para el Control de Varroa destructor (Acari: Varroidae). Chilean journal of agricultural research. 69 (4), 534-540 (2009).
- Yang, H., et al. Persistence of Metarhizium (Hypocreales: Clavicipitaceae) and Beauveria bassiana (Hypocreales: Clavicipitaceae) in tobacco soils and potential as biocontrol agents of Spodoptera litura (Lepidoptera: Noctuidae). Environmental entomology. 48 (1), 147-155 (2019).
- Muñiz-Reyes, E., Guzmán-Franco, A. W., Sánchez-Escudero, J., Nieto-Angel, R. Occurrence of entomopathogenic fungi in tejocote (C rataegus mexicana) orchard soils and their pathogenicity against R hagoletis pomonella. Journal of Applied Microbiology. 117 (5), 1450-1462 (2014).
- Lacey, L. A., et al. Goettel Insect pathogens as biological control agents: Back to the future. Journal of Invertebrate Pathology. 132, 1-41 (2015).
- Humber, R. A. . Manual of techniques in insect pathology. , 153-185 (1997).
- Rehner, S. A., Buckley, E. A Beauveria phylogeny inferred from nuclear ITS and EF1-α sequences: evidence for cryptic diversification and links to Cordyceps teleomorphs. Mycologia. 97 (1), 84-98 (2005).
- Quandt, C. A., et al. Phylogenetic-based nomenclatural proposals for Ophiocordycipitaceae (Hypocreales) with new combinations in Tolypocladium. IMA fungus. 5 (1), 121-134 (2014).
- Shah, F. A., Wang, C. S., Butt, T. M. Nutrition influences growth and virulence of the insect-pathogenic fungus Metarhizium anisopliae. FEMS Microbiology Letters. 251 (2), 259-266 (2005).
- Ignoffo, C. Environmental factors affecting persistence of entomopathogens. Florida Entomologist. , 516-525 (1992).
- Rodrigues, I. W., Forim, M., Da Silva, M., Fernandes, J., Batista Filho, A. Effect of ultraviolet radiation on fungi Beauveria bassiana and Metarhizium anisopliae, pure and encapsulated, and bio-insecticide action on Diatraea saccharalis. Advances in Entomology. 4 (3), 151-162 (2016).
- Paula, A. R., Ribeiro, A., Lemos, F. J. A., Silva, C. P., Samuels, R. I. Neem oil increases the persistence of the entomopathogenic fungus Metarhizium anisopliae for the control of Aedes aegypti (Diptera: Culicidae) larvae. Parasites and Vectors. 12 (1), 1-9 (2019).
- Morley-Davies, J., Moore, D., Prior, C. Screening of Metarhizium and Beauveria spp. conidia with exposure to simulated sunlight and a range of temperatures. Mycological Research. 100 (1), 31-38 (1996).
- Rangel, D. E., Braga, G. U., Flint, S. D., Anderson, A. J., Roberts, D. W. Variations in UV-B tolerance and germination speed of Metarhizium anisopliae conidia produced on insects and artificial substrates. Journal of Invertebrate Pathology. 87 (2-3), 77-83 (2004).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados