Method Article
באתרו הדמיה של גדילה וצמיחה של דינמיקת חרוט אקסון בתרביות פרוסות מוח עובריות אקס-ויוו חריפות
In This Article
Summary
פרוטוקול זה מדגים שיטה פשוטה וחזקה לחקר גדילת אקסון באתרו ודינמיקת חרוט גדילה. הוא מתאר כיצד להכין פרוסות מוח חריפות רלוונטיות מבחינה פיזיולוגית ex vivo ומספק צינור ניתוח ידידותי למשתמש.
Abstract
במהלך ההתפתחות העצבית, אקסונים מנווטים בסביבה קליפת המוח כדי להגיע ליעדם הסופי וליצור קשרים סינפטיים. אצטרובלים גדילה - המבנים החושיים הממוקמים בקצות הדיסטליים של פיתוח אקסונים - מבצעים את התהליך הזה. חקר המבנה והדינמיקה של חרוט הגדילה חיוני להבנת ההתפתחות האקסונאלית והאינטראקציות עם מערכת העצבים המרכזית (CNS) הסובבת אותה ומאפשרות לה ליצור מעגלים עצביים. זה חיוני כאשר מתכננים שיטות לשילוב מחדש של אקסונים במעגלים עצביים בעקבות פגיעה במחקר בסיסי ובהקשרים פרה-קליניים. עד כה, ההבנה הכללית של דינמיקת חרוט הצמיחה מבוססת בעיקר על מחקרים של נוירונים שעברו תרבית בשני ממדים (דו-ממדיים). למרות שהם ללא ספק בסיסיים לידע הנוכחי של דינמיקה מבנית של חרוט גדילה ותגובה לגירויים, מחקרים דו-ממדיים מציגים באופן שגוי את הסביבה התלת-ממדית הפיזיולוגית (התלת-ממדית) שבה נתקלים מדוכים של גדילה עצבית ברקמת CNS שלמה. לאחרונה, ג'לים של קולגן שימשו כדי להתגבר על חלק מהמגבלות הללו, מה שאפשר לחקור את ההתפתחות העצבית בתלת-ממד. עם זאת, הן סביבות דו-ממדיות סינתטיות והן סביבות תלת-ממדיות חסרות רמזי איתות בתוך רקמת מערכת העצבים המרכזית, המכוונים את ההרחבה ואת איתור הנתיב של אקסונים מתפתחים. פרוטוקול זה מספק שיטה לחקר אקסונים ואצטרובלים גדילה באמצעות פרוסות מוח אורגנוטיפיות, שבהן אקסונים מתפתחים נתקלים ברמזים פיזיקליים וכימיים רלוונטיים מבחינה פיזיולוגית. על ידי שילוב של כוונון עדין באלקטרופורציה של רחם ואקס רחם כדי לספק בדלילות כתבים פלואורסצנטיים יחד עם מיקרוסקופיה ברזולוציה גבוהה במיוחד, פרוטוקול זה מציג צינור מתודולוגי להדמיה של דינמיקת אקסון וחרוט גדילה באתרם. יתר על כן, כלול תיאור מפורט של ערכת כלים של ניתוח נתוני הדמיה ארוכי טווח ותאים חיים.
Introduction
נוירונים הם תאים מקוטבים מאוד המייצגים את היחידה החישובית הבסיסית במערכת העצבים. הם מקבלים ופולטים מידע המסתמך על מידור של אתרי קלט ופלט: דנדריטים ואקסונים, בהתאמה1. במהלך הפיתוח, אקסונים מתרחבים תוך ניווט בסביבה מורכבת מדהימה כדי להגיע ליעדם. ניווט האקסון מונחה על ידי חרוט הצמיחה, מבנה חושי הממוקם בקצה האקסון המתפתח. חרוט הצמיחה אחראי על איתור רמזים סביבתיים ותרגומם לארגון מחדש מרחבי דינמי של השלד הציטוסקלטוןשלו 2,3. התגובות המורפו-מכניות המתקבלות מורות לחרוט הגדילה להתארך או לסגת מהרמז המפעיל, מה שמוביל לתמרוני אקסון ספציפיים.
ההבנה הנוכחית של הרחבת אקסון ודינמיקת חרוט גדילה נובעת ממחקרים המעריכים צמיחת אקסון על פני מצעים דו-ממדיים (דו-ממדיים) 2,4,5,6,7. מחקרים חלוציים אלה זיהו יחסי גומלין מתוחכמים בין אצטרובלים של גדילה למצעי גדילה וחשפו הבדלים בולטים התלויים במאפייני המצע כגון דבקות וקשיחות 8,9. בהנחיית תובנות אלה, הושערו רמזים סביבתיים חוץ-תאיים כדי להכתיב את צמיחת האקסון, כאשר שלד חרוט הצמיחה ביצע צמיחה זו 2,10,11,12. יש לציין כי נוירונים יכולים להרחיב אקסונים במצעים שאינם דביקים (למשל, פולי-ליזין, פולי-אורניתין)13. יתר על כן, קשיחות המצע יכולה להשפיע על קצב גדילת האקסון ללא תלות בקומפלקסים של דבקות תאים8. לפיכך, חקר דינמיקת חרוט גדילה במצעים דו-ממדיים בלבד אינו יכול להעריך במדויק את מאזן הכוחות הנובעים מהאינטראקציה של אצטרובלים של גדילה אקסונאלית עם סביבות תלת-ממדיות (תלת-ממדיות) רלוונטיות מבחינה פיזיולוגית, כגון אלה שנמצאו ב- vivo.
כדי להתגבר על המגבלות של המבחנים הדו-ממדיים, נחקרו דינמיקות של צמיחת אקסון וצמיחה של חרוטים במטריצות תלת-ממדיות 8,9. מטריצות אלה מציבות הקשר פיזיולוגי רב יותר, אך מאפשרות לחקור מנגנונים פנימיים של צמיחת אקסון. היא מאפשרת בדיקת חרוט גדילה באופן חד-תאי במגוון מצבים וטיפולים פרמקולוגיים9. בסביבות תלת-ממדיות כאלה, אקסונים הציגו דינמיקה ייחודית של שלד ציטוסקטלי וגדלו מהר יותר מאלו שנצפו בתאי עצב בתרבית דו-ממדית9. מחקרים אלגנטיים אלה הדגימו את השפעתו של ממד נוסף על הארגון מחדש של שלד חרוט הצמיחה, וכתוצאה מכך על התנהגותו.
למרות היתרונות לכאורה שמציגות מטריצות תלת-ממדיות על פני משטחים דו-ממדיים בתמיכה בהתפתחות עצבית דמוית-יליד ובצמיחת אקסון, הן עדיין פיגום סינתטי פשוט שאינו יכול לשקף את המורכבות של הדינמיקה שנצפתה ברקמת מערכת העצבים המרכזית (CNS). כאן, מסירת פלסמידי כתבים על ידי אקס רחם ובאלקטרופורציה של רחם שולבה עם תרבית פרוסות אורגנוטיפיות במוח והדמיה ברזולוציה סופר-רזולוציה חיה באתרה כדי לנתח דינמיקה של חרוט גדילה בהקשר פיזיולוגי. מתודולוגיה זו מאפשרת הדמיה של אקסונים מתפתחים תוך התנסות בתלת-ממדיות של סביבות in vivo ובמורכבות ההרכב הפיזיקוכימי שלהן. לבסוף, מתוארים נהלים ידידותיים למשתמש למדידת צמיחת אקסון ודינמיקת חרוט צמיחה באמצעות תוכנות מורשות וציבוריות נפוצות.
Protocol
ניסויים בבעלי חיים חייבים לעמוד בתקנות המוסדיות והפדרליות הרלוונטיות. בפרוטוקול זה נעשה שימוש בעכברות 15.5 ו-12.5 (E15.5 ו-E12.5) נקבה הרה מסוג C57BL/6JRj. הניסויים בוצעו בהתאם לחוק רווחת בעלי החיים של הסוכנות הסביבתית של צפון ריין-וסטפאליה (Landesamt für Natur, Umwelt und Verbraucherschutz (LANUV)).
1. הכנת פלסמידים להזרקה
- בודדו את הדנ"א באמצעות ערכת Maxiprep נטולת אנדוטוקסין בהתאם לפרוטוקול היצרן (ראו טבלת חומרים).
- מערבבים דנ"א נבחר בריכוז הרצוי (טבלה 1) ו-10% תמיסה ירוקה מהירה (ראו טבלת חומרים) כדי לדמיין את העברת תערובת הדנ"א לחדרי המוח.
הערה: פלסמידים ספציפיים שימשו לתיוג דליל של תאי העצב בקליפת המוח (איור 1A), למבני אקטין נימים (F-אקטין) בחרוט הגדילה (איור 1B), ולתיוג כפול של אצטרובלים גדילה בתוך אותה קליפת המוח (איור 1C). כל הפלסמידים (טבלה 1) המשמשים בפרוטוקול זה הופקדו באדג'ין (ראו טבלת חומרים). - הכן נימי זכוכית באמצעות מושך אלקטרודות נימי שנקבע לפי התוכנית הבאה: לחץ: 500, חום: 800, משיכה: 30, ומהירות: 40.
- טען 15 μL של דנ"א / תערובת ירוקה מהירה לתוך כל נימי זכוכית באמצעות קצות פיפטה של מטעין מיקרו.
הערה: ודא שלא נוצרות בועות. - אחסנו נימים ממולאים בדנ"א בצלחת של 10 ס"מ עם חתיכת חימר מידול בקוטר המנה. ניתן לטעון ולאחסן נימים בטמפרטורה של 4 מעלות צלזיוס יום לפני הניסוי. אטמו את הקצה האחורי של הנימים בסרט גמיש כדי למנוע ייבוש.
2. הכנת פתרונות
- הכינו את תמיסת המלח המחוספסת של Hank עם תוספת גלוקוז (HBSS-G).
- הוסיפו 0.5% ממלאי הסוכר של 20% לבקבוק של 1x HBSS. ערבבו היטב ואחסנו בטמפרטורה של 4 מעלות צלזיוס למשך עד שבועיים. עבור מיצוי העובר, תמיסת HBSS-G מבעבעת עם קרבוגן (95% O2 ו-5% CO2) באמצעות אבן מבעבעת זמן קצר לפני איסוף העוברים.
- פתרון מדיה פרוסה
- מכינים מדיית פרוסות טרייה המכילה נוירובאסל 1x, 5% סרום לסוסים, 5% סרום עגל עוברי, תוסף B27 1:50, תוסף L-גלוטמין 1:400, פניצילין-סטרפטומיצין 1:200, ותוסף נוירופאן-2 1:100 (בעמ' 7.3), בתנאים סטריליים (ראו טבלת חומרים).
- מכינים מנות 3 ס"מ עם 1 מ"ל של פרוסת מדיה כל אחת. מניחים באינקובטור בטמפרטורה של 35 מעלות צלזיוס עם 5% CO2 למשך שעה אחת לפחות לפני הניסוי כדי לאזן את ה-pH של המדיה באמצעות חילופי גזים.
הערה: שיווי משקל המדיה pH נגרם על ידי החמצת המדיה על ידי CO2 מהאינקובטור. ניתן לאחסן את מדיית פרוסות בטמפרטורה של 4 מעלות צלזיוס למשך שבוע אחד עד שבוע.
- תמיסת אגרוז נקודת התכה נמוכה (3%)
- שוקלים את הכמות הרצויה של אבקת אגרוז נקודת התכה נמוכה ומתמוססים בנפח מתאים של 1x HBSS-G בבקבוק זכוכית. יש צורך בכ-7 מ"ל של תמיסת אגרוז לכל מוח.
- מניחים את הבקבוק במיקרוגל למשך 2-3 דקות, עם הפקק ממוקם באופן רופף, ומנערים כל 10-20 שניות.
- לאחר שהאבקה התמוססה לחלוטין, הניחו את הבקבוק באמבטיית מים או באמבט חרוזים שנקבע ל-37 מעלות צלזיוס לפחות שעה אחת לפני הניסוי כדי לאפשר לאגרוז להתקרר.
הערה: מומלץ לחמם את האגרוז פעמיים מעל 15 דקות כדי להבטיח את אבקת האגרוז מומסת. זה חיוני להדבקה נכונה של אגרוז לרקמת המוח. יש להשתמש במדחום כדי למדוד את הטמפרטורה של תמיסת האגרוס תוך כדי הטבעת מוחות, ולוודא שהיא בין 37-40 מעלות צלזיוס. למוחות מבעלי חיים זקנים שונים יש קשיחות שונה. מומלץ לבדוק מגוון של ריכוזי אגרוז כדי למצוא הומוגניות בין רקמה לאגרוזה. - מכינים מלוחים עם מאגר פוספט עם 0.3% טריטון X-100 (PBS-T).
- הכן את המלוחה הבוקרת פוספט עם 0.2% נתרן אזיד (PBS-NaN3).
הערה: הפתרונות המתוארים בשלבים 2.4-2.5 מיועדים לשימוש בשלב האימונוהיסטוכימיה המאוחר יותר.
3. הכנת תחנת הניתוח
- נקו את תחנת הניתוח עם 70%-96% אתנול והניחו את שכבת הניתוח על משטח התחנה.
- לעקר את מכשירי הניתוח על ידי שטיפה עם 70%-96% אתנול, ולאחר מכן עיקור יבש בעיקור חרוזים חם.
- אלקטרודות פינצטה פלטינה נקיות (ראו טבלת חומרים) עם 70%-96% אתנול לפני שהן מתחברות למחולל הפולסים.
- החדירו נימי זכוכית בעלי דנ"א/מהיר מלא ירוק לתוך מחזיק הנימים. מיד לפני השימוש, נתקו בעדינות את קצה הנימים באמצעות מספריים עדינים וזרימת תמיסת הבדיקה בתוך צינור מיקרוצנטריפוגה של 1.5 מ"ל מלא במי מלח או מים שחוממו מראש.
הערה: איור 2A,B מראה הגדרת תחנת ניתוח וכלים המשמשים לאלקטרופורציה של אקס רחם (EUE) ולאלקטרופורציה של רחם (IUE). - עבור IUE, חימום תמיסת מלח ל-37 °C (84 °F) באמבט מים.
4. מיצוי עוברים
- מניחים את העכברה ההרה בתא משרה ההרדמה עם 5% איזופלורן עד שהעכבר מורדם עמוקות. אשר הרדמה על ידי היעדר רפלקס נסיגה מדוושה.
- מעבירים את העכבר לשכבת ניתוח ושומרים על איזופלורן ב-1.5%-2% דרך חרוט אף.
- יש למרוח משחה על שתי העיניים כדי למנוע ייבוש בקרנית.
- גילחו את בטנו של העכבר, ולאחר מכן השתמשו ב-70%-96% גזה ספוגה באתנול כדי להסיר שיער מגולח. נקו את האזור עם בטאדין.
- באמצעות מספריים כירורגיים קטנים וסטריליים, יש לבצע חתך עור באורך 2 ס"מ לאורך קו האמצע של הבטן, ולאחר מכן חתך שרירים של 1.5 ס"מ.
הערה: גודל החתך תלוי בגודל העובר. ואכן, עוברים גדולים יותר ידרשו חתך גדול יותר כדי להכיל את מיצוים. - חותכים חור באמצע הגזה רחב מספיק כדי להתאים לחתך העור (בקוטר של כ-2 ס"מ), משרים אותו במי מלח חמים ומניחים אותו סביב פתח הבטן.
- משכו את שתי קרני הרחם באמצעות ניצן כותנה ספוג במי מלח חמים או באמצעות מלקחיים, ותפסו בזהירות את הרווחים בין העוברים כדי למשוך אותם החוצה. הניחו את העוברים על גזה רטובה (איור 2C).
הערה: אפילו נזק קטן לכלי הדם ולנימים סביב קרני הרחם יגרום ככל הנראה לדימום רב. לכן, הימנעו מטיפול ישיר באזורים וסקולריים אלה בכל עת. - חותכים את שק הרחם ומסירים כל עובר (איור 2D).
- המתת חסד כל עובר מיד לאחר החילוץ באמצעות חתך אלכסוני יורד, מה שמבטיח התעלות מלאה של חוט השדרה (איור 2E).
- מניחים את העוברים בצלחת של 10 ס"מ המכילה HBSS-G על קרח.
הערה: עריפת ראשים של העובר נמנעת כדי למנוע דליפת תערובת דנ"א/ירוקה מהירה מהמוח ולהקל על מיקום קל של העובר במחזיק (ראו אלקטרופורציה של רחם לשעבר , שלב 5). - להקריב את האם מיד לאחר מיצוי העוברים על ידי ביצוע פריקה צווארית.
הערה: כאן, האם מורדמת תחת הרדמה כדי לחסוך ממנה כל כאב או סבל נוספים לאחר ההליך בהתאם לפרוטוקול שאושר על ידי חוק רווחת בעלי החיים של הסוכנות הסביבתית של צפון ריין-וסטפאליה (LANUV).
5. אלקטרופורציה של אקס רחם (EUE)
- הרימו עובר והניחו אותו במחזיק.
הערה: קצה פיפטה חתוך של 1 מ"ל המחובר לקצה של מגרד תאים משמש כמחזיק עובר. חיוני לשמור על זרועות של עוברים מחוץ לקצה במהלך ההליך כדי למנוע מהם להחליק לתוך הקצה (איור 2F-I). הקוטר של קצה הפיפטה ניתן להתאמה בקלות כדי להכיל עוברים בגדלים שונים. חותכים קצה שני באורך שבו קוטר הקצה תואם את גודל העובר ומשתמשים בו כתוספת מתאם למחזיק שהוזכר לעיל. - החדירו בזהירות דנ"א/נימי זכוכית מהירים מלאים בירוק דרך גולגולת העובר לתוך החדר הצדדי והזיקו 2-3 מיקרול של תערובת פלסמידי DNA (איור 1A,B; טבלה 1) לתוך כל חדר (איור 2F).
הערה: השתמש בתפרים הלמבדואידליים והסגיטליים כמדריך למיקום הזרקת הדנ"א. התפרים הלמבדואידליים והסגיטליים הם מפרקים סיביים המחברים את צלחת העצם של הגולגולת. הראשון מצטרף לעצם הקודקוד עם העצם העורפית, והאחרון מצטרף לשתי עצמות הקודקוד. - החזק את ראש העובר בין אלקטרודות פינצטה פלטינה בזווית המתאימה כדי לכוון לאזור המוח הרצוי (זווית של 60° במקרה זה), כאשר הקתודה פונה לאזור שאליו מיועדת העברת הדנ"א (איור 2G-H).
- יש למרוח חמישה פולסים ב-30 mV עם מרווח של 1 שניות ומשך של 50 אלפיות השנייה באמצעות מחולל פולסים של גלים מרובעים.
הערה: זכור שמוחות ב- EUE חווים שדה חשמלי יעיל יותר מאלו שב- IUE. לפיכך, בריכוז דנ"א נתון, EUE מביא ליעילות גבוהה יותר של העברת דנ"א מאשר IUE, וריכוזי הדנ"א צריכים להיות מותאמים בהתאם. - אם רוצים אלקטרופורציה דו-צדדית, חזרו על שלבים 5.3-5.4 כאשר הקתודה והאנודה משקפות את המיקום הקודם כדי להתמקד בקליפת המוח הקונטרה-צדדית.
הערה: מכיוון ששני החדרים הוזרקו להם דנ"א, קליפת המוח של שתי ההמיספרות הותקפה. - מניחים את העובר האלקטרופורציה בצלחת של 6 ס"מ המכילה HBSS-G קר כקרח. חזור על שלבים 5.1-5.6 עבור כל העוברים הנדרשים.
6. באלקטרופורציה של רחם (IUE)
- להזריק עכבר בהריון עם משכך כאבים; 50 μL של buprenorphine (0.1 מ"ג/ק"ג) (ראה טבלת חומרים) תת עורית, 20 דקות לפני ההליך.
- בצע שלבים 4.1-4.8 ממקטע מיצוי העובר.
הערה: הימנעו מהשארת עוברים חשופים שלא לצורך על ידי כיסוים בגאזה סטרילית ספוגה במי מלח חמים. - באמצעות קצות האצבעות, סובבו בעדינות את העובר בתוך הרחם עד לאיתור תפרים למבדואידיים וסגיטליים (איור 2J). החדירו בזהירות דנ"א/נימי זכוכית ירוקים מהירים דרך דופן הרחם וגולגולת העובר לתוך החדר הצדדי והזיקו 2-3 μL של תערובת פלסמיד DNA (איור 1A,C) לאחד החדרים או לשניהם לפי הצורך (איור 2K-L).
הערה: לחץ אצבעות מוגזם על קרני הרחם עלול להוביל לקריסת שק מי שפיר. - החזק את ראש העובר בין אלקטרודות פינצטה פלטינה בזווית המתאימה כדי לכוון את אזור המוח הרצוי (זווית של 60° במקרה זה), כאשר הקתודה פונה לאזור שאליו מיועדת העברת הדנ"א. הימנעו מלחיצות על הרחם מכיוון שהוא עלול לגרום לקריסת שק מי השפיר (איור 2M).
- יש למרוח חמישה פולסים ב-35 mV עם מרווח של 600 אלפיות השנייה ומשך של 50 אלפיות השנייה באמצעות מחולל פולסים של גלים מרובעים.
- אם שני החדרים הצדדיים הוזרקו, חזרו על שלבים 6.5-6.6 עם הקתודה והאנודה המשקפות את המיקום הקודם כדי להתמקד בקליפת המוח הקונטרה-צדדית.
- חזור על שלבים 6.3-6.6 עבור כל העוברים הנדרשים.
- לאחר שכל העוברים הנדרשים עברו אלקטרופורמה, השתמשו בניצן כותנה ספוג מלח כדי להחזיר בעדינות את קרני הרחם לתוך חלל הבטן.
הערה: הוספת תמיסת מלח לחלל הצפק תסייע לקרני הרחם להחליק בחזרה למקומם. - שרירי תפר וחתכים בעור באמצעות 5-0 חומר תפר. השתמשו במתוכי תפר כדי לאבטח את הפצע ולחטא את פצע התפר על ידי התזתו בבטאדין (איור 2N-P).
- הזריקו לעכבר 200 μL של 5% גלוקוז תת עורי.
- להזריק לעכבר אנטיביוטיקה; 50 μL של אנרופלוקסצין (5 מ"ג/ק"ג) תת עורית (ראו טבלת חומרים).
- הניחו את העכבר בחזרה בכלוב ההתאוששות ושמרו על חום באמצעות נורית התחממות אינפרה-אדומה רחוקה או כרית חימום למשך 20 דקות לפחות לאחר ההליך (איור 2Q).
- עקוב אחר העכבר מדי יום, והזריק מלוקסיקם לאחר ההליך להקלה על כאבים בהתאם להנחיות המוסדיות והפדרליות.
- חילוץ עוברים יומיים לאחר ההליך (כלומר, E17.5) לאחר שלב 4.
7. מיצוי המוח והטבעתו באגרוז
הערה: מומלץ לבצע את השלבים הבאים תחת מיקרוסקופ דיסקציה לדיוק טוב יותר. הימנעות מפגיעה במוח היא קריטית להצלחת ההליך.
- הגדירו כלי חילוץ בחלל עבודה סטרילי מתחת למכסה מנוע של דיסקציה (איור 3A).
- להפריד את ראש העובר משאר הגוף באמצעות מספריים דיסקציה.
- קבעו את הראש כפי שמוצג באיור 3C, ואז הסירו את העור והגולגולת על ידי חיתוך לאורך קו האמצע, החל מבסיס הראש לכיוון האף (איור 3D).
- מקלפים את העור והגולגולת לרוחב, ויוצרים מרווח גדול מספיק (כ-1 ס"מ) כדי שהמוח יוסר.
- כדי להסיר את המוח, החדירו את הקצה הסגור של מספריים של דיסקציה סטרילית, החל מתחת לפקעת חוש הריח הנעה לכיוון גזע המוח (איור 3E).
- חתכו את גזע המוח וחתכו את כל פיסות קרום המוח הרופפות סביב המוח (איור 3F).
הערה: קרום המוח הרופף גורם לעתים קרובות לפרוסות להישאר מחוברות לגוש האגרוז לאחר החיתוך, מה שמוביל לניתוק הרקמה מהאגרוז במהלך איסוף הפרוסה. - חזור על שלבים 7.1-7.6 עבור כל העוברים ושמור את המוחות על קרח (באופן אידיאלי לא יותר מ-30 דקות) עד לשלב ההטבעה.
הערה: השלבים הבאים 7.7.1-7.7.4 מתייחסים למיצוי המוח של מוחות E12.5.- בודדו את החלק העליון של הראש ממש מתחת לעין, כפי שמוצג באיור 3G.
- חתכו את העור והגולגולת על גבי גזע המוח, בהתאם לקו המקווקו כפי שמוצג באיור 3H, מבלי להסיר את גזע המוח.
- צרו חתך של 2 מ"מ בגולגולת העור בחלק האחורי של הראש, כפי שמוצג באיור 3I (ראו ציורים לבהירות).
הערה: חתך זה מספק נקודות אחיזה ראשוניות כדי לקלף את שכבות העור והגולגולת. בדרך כלל, הם מופיעים כשכבה אחת. גודל החתך הטיפוסי הוא 2 מ"מ, המתאים לאורך הקצה החותך של מספריים מיקרו קפיץ משומשים. - התחילו לקלף את שכבות העור-גולגולת על ידי אבטחת צד אחד של החתך ומשיכת הצד השני בזהירות. באותה הקפדה, סיימו על ידי קילוף בסיס הראש עד לשחרור המוח (איור 3J).
הערה: יש לעשות זאת בזהירות רבה, תוך התבוננות בכך שהמוח אינו נמשך לאורך שכבות הרקמה. צדדים חלופיים להסרת הרקמה המכסה את המוח.
- יוצקים אגרוז חם (בטמפרטורה של 37-40 מעלות צלזיוס) במנה של 3 ס"מ.
- הרימו את המוח באמצעות כפית מחוררת והסירו עודפי נוזלים על ידי דשדוש תחתית הכף כנגד נייר טישו יבש. מניחים את המוח בצלחת אגרוזה.
הערה: חיוני להסיר כמה שיותר נוזלים מרחבי המוח כדי לאפשר היצמדות טובה יותר של אגרוז לרקמה. - שים את המנה עם אגרוז נוזלי על קרח. בעזרת כף קטנה יותר, מערבבים אגרוז במשך 10 שניות לקירור אחיד. תמרנו את המוח לאמצע המנה. הניחו את המוח בצורה אופקית בצלחת עם הצד הגבי למעלה, והקפידו שהוא מכוסה לחלוטין באגרוס מכל הכיוונים (איור 3K).
הערה: מוחות ישקעו לעתים קרובות לתחתית המנה לאחר שהונחו באגרוס; להרים את המוח באמצעות כפית קטנה עד שנוצר פער של 1-2 מ"מ מתחת למוח. - חזור על שלבים 7.8-7.10 עבור כל המוחות.
- לאחר שהאגרוז עבר פולימריזציה, הוסיפו 500 μL של HBSS-G על גבי גוש האגרוז כדי למנוע ייבוש. לאחר מכן, מכסים את המנה בקרח.
הערה: שמור את הדגימה על קרח במשך 5 דקות לפני החתך כדי לאפשר לטמפרטורת המוח להגיע ל -4 מעלות צלזיוס.
8. תרבות פרוסות אורגנוטיפיות
הערה: נקו ויברטום ומשטחים מסביב עם 70%-96% אתנול כדי למנוע זיהום פרוסות. ההגדרה של תחנת העבודה של ויברטום (ראו טבלת חומרים) מוצגת באיור 3B.
- מלאו את מגש חיץ הרטט ב-HBSS-G קר ואת המגש החיצוני בקרח כדי לשמור על קור HBSS-G לאורך כל ההליך.
- ספק באופן רציף HBSS-G במגש החיץ עם קרבוגן באמצעות אבן מבעבעת.
- באמצעות להב טרי, בצע חתך גדול (~2 על 2 ס"מ) סביב המוח והסר גוש אגרוז המכיל את המוח, עם מספיק אגרוז מסביב כדי לחתוך את האגרוז לגוש מלבני קטן.
הערה: שלב זה מאפשר להתאים את זווית הבלוק כך שהציר הסגיטלי של המוח יהיה בניצב ללוח הוויברטום והציר הקורונלי יתיישר במקביל ללהב. השאירו כ-5 מ"מ של אגרוז בצד הגבי של המוח לטיפול קל בפרוסות. - מניחים טיפה קטנה של ממס-על ללא ממסים מהירים באמצע מחזיק הדגימה ומתפשטים לאזור שיכסה את החלק התחתון של גוש האגרוז.
- הרימו בעדינות את גוש האגרוס ויבשו את החלק התחתון על ידי קשקושים על נייר טישו. הניחו את הבלוק על האזור המודבק של מחזיק הדגימה, כשהצד הרוסטרלי של המוח למעלה. שים את מחזיק הדגימה על קרח ותן לדבק להתייבש במשך דקה אחת.
- לאחר שהדבק התייבש, הניחו את מחזיק הדגימה במגש החיץ.
- חותכים את המוח לפרוסות קורונליות בזווית של 15 מעלות.
הערה: עובי הפרוסות יכול להשתנות בהתאם ליישום. כאן, המוחות נפרסו בעובי של 150 מיקרומטר. הגדר את מהירות הרטט ל-1.0-1.5 מ"מ לשנייה לחיתוך עודפי אגרוז מלמעלה וקיצוץ נורות חוש הריח. הפחיתו את מהירות החיתוך ל-0.5 מ"מ לשנייה לאיסוף פרוסות קליפת המוח לצורך ניתוח. ניתן להשהות את רוב הוויברטומים כדי לאסוף כל פרוסה. אם איכות מופחתת של פרוסות או ניתוק של רקמה מאגרוז נחווים, הפחתת מהירות החיתוך או החלפת להב הוויברטום יכולים לעזור. - באמצעות מריתות נקיות, אספו פרוסות מוח והניחו אותן על קרום Polytetrafluoroethylene (PTFE), המשותק בצלחת בעלת קרקעית זכוכית בקוטר 35 מ"מ באמצעות פרפין (עד חמש פרוסות מוח/קרום) (איור 3L-M).
הערה: תקן את קרום ה- PTFE בתוך צלחת בעלת תחתית זכוכית של 35 מ"מ באמצעות שעווה. זה יייצב את הממברנה בעת הוספת מדיית תרבית הפרוסה וגם במהלך ההדמיה. - באמצעות פיפטה של 200 μL, יש להסיר את עודפי ה-HBSS-G מסביב לפרוסות שעל ממברנת ה-PTFE, ולהשאיר את הפרוסות יבשות למחצה.
- הוסף 500 μL של מדיית פרוסות (שחוממה מראש ל-35 מעלות צלזיוס) ישירות לחלל שמתחת לממברנת ה-PTFE.
הערה: לא חייבות להיווצר בועות מתחת לממברנה בעת הוספת המדיה. זה ישאיר פרוסות שלמות או חלקיות ללא חילופי מדיה. החלף 200 μL של מדיה כל יומיים בתרבית או לאחר כל הפעלת הדמיה. - דגירה של הפרוסות בטמפרטורה של 35 מעלות צלזיוס עם 5% CO2.
9. אימונוהיסטוכימיה
- קבעו פרוסות עם 1 מ"ל של 4% פרפורמלדהיד (PFA) - בתוספת 4% סוכרוז למנה. דגירה ב- RT למשך 30 דקות.
אזהרה: כשאתם מטפלים ב-PFA, לבשו מעיל מעבדה וכפפות. בצעו שלבי קיבוע מתחת למכסה מנוע כימי, והשליכו את פסולת ה-PFA בהתאם. - שטפו את הפרוסות פעמיים עם PBS של 300 μL למשך 5 דקות. מעבירים את הפרוסות לצלחת של 24 בארות.
הערה: ניתן להשהות את הניסוי בשלב זה. הוסף PBS-NaN3 לפרוסות ואחסן בטמפרטורה של 4 °C (74 °F). NaN3 היא תרכובת רעילה; כאשר מטפלים בתמיסות באמצעותו, לבשו מעיל מעבדה וכפפות. שלבים 9.3-9.10 יבוצעו בשייקר מסלולי. - מרווים את הפרוסות עם 300 μL של 0.1 M גליצין ב 4 °C (64 °F) לילה.
- שטפו את הגליצין עם PBS ב-RT 3x למשך 10 דקות.
- חלחל את הפרוסות עם 300 μL של PBS-T ב- RT למשך 2 שעות.
- יש לחסום שימוש בסרום עיזים של 10% ב-PBS-T ב-RT למשך שעתיים.
- הוסף 300 μL של נוגדנים ראשוניים (נוגדן אנטי-וימנטין בדילול של 1:200; ראה טבלת חומרים) מדולל בסרום עיזים של 10% בתמיסת PBS-T בטמפרטורה של 4 מעלות צלזיוס במהלך הלילה.
הערה: בשלבים 9.8-9.12, פרוסות היו מוגנות באור כדי למנוע אובדן פלואורסצנציה. - שטפו את הנוגדן הראשוני עם PBS ב-RT 3x למשך 20 דקות.
הערה: PBS שימש במקום PBS-T כדי לשטוף את Triton X-100. - הוסף 300 μL של נוגדן משני (או Alexa Fluor 488 או 647 בדילול של 1:400; ראה טבלת חומרים) ב- PBS ב- RT למשך 2 שעות.
הערה: DAPI מתווסף מיד לאחר הסרת הנוגדן המשני בדילול של 1:10,000 למשך 5 דקות. - שטפו את הנוגדן המשני עם PBS ב-RT 3x למשך 20 דקות. יש לשטוף במים מזוקקים 2x למשך דקה אחת.
- מעבירים את הפרוסות למגלשת זכוכית באמצעות מברשת עדינה, ולאחר מכן מייבשים בטמפרטורה של 30 מעלות צלזיוס למשך 20 דקות.
- הרכיבו את הפרוסות באמצעות מדיום הרכבה מימי. שמור את השקופיות ב- RT למשך הלילה כדי שמדיית ההרכבה תאצור.
10. רכישת הדמיה
הערה: ללא קשר לגישת העברת הדנ"א (IUE או EUE), פרוסות נותחו באותו טווח גילאי התפתחותי (E17.5-E18.5). IUE מאפשר לאבות עצביים להתחלק ולהתפתח במשך יומיים נוספים in vivo. EUE, לעומת זאת, מאפשר מעקב אחר אירועים התפתחותיים מוקדמים.
- הפעילו את חממת התאים והגדירו אותה ל-35 מעלות צלזיוס עם 5% CO2- באופן אידיאלי 4 שעות לפני ההדמיה - כדי לאפשר לרכיבי המיקרוסקופ להתיישב בטמפרטורה של 35 מעלות צלזיוס.
- להדמיה עמוקה של פרוסות, השתמש במטרות טבילה במים כדי להפחית את חוסר ההתאמה במקדם השבירה בין הרקמה לבין המטרה.
הערה: כאן נעשה שימוש במצב הדמיה ברזולוציה גבוהה במיוחד. הדמיה דרך קרום PTFE דורשת מטרה עם מרחק עבודה ארוך (~1 מ"מ). אם מטרה למרחק עבודה ארוך אינה זמינה, ניתן להעביר פרוסות למנה בעלת 8 תיבות זכוכית. כדי להעביר פרוסות, הוסיפו 1 מ"ל של מדיית פרוסה לחלק העליון של הממברנה, ולאחר מכן השתמשו במרית כדי להרים פרוסה ולהעביר אותה לבאר המכילה 200 μL של מדיה. יש להסיר את עודפי המדיה באמצעות קצה פיפטה של 1 מ"ל ולהשאיר את הפרוסות יבשות למחצה. - להדמיית גדילת אקסון, אתרו אזור בקליפת המוח עם צפיפות תאים נמוכה עד בינונית. להדמיית דינמיקה של חרוט גדילה, אתר חרוט גדילה באזור הביניים או באזור התת-חדרי של קליפת המוח.
- הגדר גודל z-stack בתוכנת עיבוד התמונה (ראה טבלת חומרים). לצמיחת אקסון בערימת z גדולה, קבעו גודל צעד של 2 מיקרומטר. עבור מדוכים גדילה בערימת z קטנה יותר, הגדר גודל צעד של 1 מיקרומטר.
הערה: תמיד לקחת בחשבון תנועה פוטנציאלית של חרוט הצמיחה והאקסון דרך מישורי x, y ו-z. אקסונים גדלים בקצב גבוה בהרבה בתרבויות אורגנוטיפיות מאשר בתרבויות חוץ גופיות . כאן, הספיקה ערימה של כ-80 מיקרומטרים כדי לדימוי צמיחת אקסון. עבור דינמיקה של חרוט גדילה, מחסנית z של ~ 6 מיקרומטר הייתה מספקת. - להדמיית צמיחת אקסון של נוירונים באזור גדול יותר, הגדירו סריקת אריחים.
- השתמש בהספק הלייזר הנמוך ביותר האפשרי כדי למזער את הסיכויים להלבנת קונוסים במהלך הרכישה.
- להדמיית צמיחת אקסון, רכשו הקפות זמן למשך 2 שעות במרווח של 5 דקות. להדמיית דינמיקת חרוט גדילה, רכשו הקפות זמן למשך 2-5 דקות עם מרווח של 2.5-3 שניות.
11. ניתוח נתונים
- מדוד את מהירות צמיחת האקסון באמצעות קימוגרפים
- פתח את קובץ התמונה בפיג'י14 באמצעות קובץ > פתח ובחר את התמונה.
- השג את היטל העוצמה המרבית של קיטועי הזמן באמצעות ערימות > תמונה > Z-Projection > הקרנה בעוצמה מרבית.
- עברו על קיטועי הזמן ואתרו אקסון הולך וגדל.
- לאחר איתור, ציירו קו דרך האקסון הגדל. התחילו מקצה האקסון בפריים הראשון, ועקבו אחר האקסון לאורך כל קיטועי הזמן.
- צור kymograph באמצעות התוסף KymoResliceWide.
- הגדר את קנה המידה של הקימוגרף על-ידי מעבר אל מאפייני > תמונה. הגדר את המרחק ב- μm ברוחב פיקסל והגדר את השעה ב- s או min ב - Pixel Height.
- עבור אל נתח את מדד >.
הערה: תינתן זווית ביחס לציר ה-x. - חשב את מהירות צמיחת האקסון על ידי החלפת הזווית במשוואה הבאה: SIN(RADIANS(θ))/COS(RADIANS(θ)) בגיליון אלקטרוני.
- מדוד את נפח חרוט הצמיחה באמצעות תוכנת ניתוח תמונה (ראה טבלת חומרים).
- פתח את קובץ התמונה בתוכנת ניתוח התמונות באמצעות קובץ > פתח ובחר את הקובץ המעניין.
- בחר באשף הוספת משטחים חדשים .
הערה: מקטע בפינה הימנית התחתונה יופיע עם שישה שלבים לעריכה ידנית. - בשלב 1 - תחת הגדרות אלגוריתם - בחר מקטע רק אזור עניין. בשלב 2, חתוך את המסגרת כך שתתאים לכל חרוט הצמיחה בכל המסגרות.
- שמור על סף לעוצמה מוחלטת בשלב 3, וודא שכל אזור חרוט הצמיחה נמצא בסף בשלב 4.
- בשלב 5, בחר מספר Voxels lmg = 1 תחת סוג מסנן.
הערה: בשלב האחרון, ניתן ליצור ערכות מדידה מרובות. כאן, רק מדידה אחת נוצרה עבור נפח. - בחר בלחצן בצע כדי לבצע את כל שלבי היצירה ולסיים את אשף הוספת משטחים חדשים.
- בכרטיסיה סטטיסטיקה בחלק העליון של חלון האשף, בחר ערכים ונפח ספציפיים תחת הכרטיסיה מפורט.
תוצאות
תוצאות מייצגות המתקבלות עם זרימת העבודה של השיטה המתוארת מוצגות. בהדגמה הנוכחית נעשה שימוש בעכברי E15.5, אם כי פרוטוקול זה ניתן להתאמה בקלות כמעט לכל הגילאים העובריים, החל מ-E11 ועד לסוף E17. בפרוטוקול זה, או אלקטרופורציה של רחם לשעבר (EUE; איור 2A, 2C-I) או באלקטרופורציה של רחם (IUE; איורים 2B,C ו-2J-Q) שימשו להעברת פלסמידים לתוך תאי העצב הקדמוניים המצפים את החדרים הצדדיים. אבות אבות אלה הם המקור לתאי עצב מקרינים קליפתיים עתידיים (CPN)15,16. תערובות פלסמיד הוכנו כדי להניע ביטוי דליל וספציפי לנוירון של דינמיקה ממוקדת ממברנה (Lyn)-mNeonGreen (איור 1A) או של LifeAct משופרת (E)GFP (איור 1B) כדי להעריך את ההתנהגות הכוללת ואת הדינמיקה של אקטין במדורי גדילה, בהתאמה. יתר על כן, תערובת פלסמידים שמטרתה לתייג נוירונים בודדים עם חלבון פלואורסצנטי ירוק (ZsGreen) (איור 1C) של טורבו(t)-RFP או zoanthus sp. (ZsGreen) (איור 1C). זה מקל על ניטור של התנהגות חרוט גדילה מתאי עצב שכנים עצמאיים.
כריתת מוח מעוברים אלקטרופוזיים היא צעד מכריע שיש לבצע בזהירות כדי להשיג פרוסות באיכות גבוהה, תוך שמירה על מבנה המוח המקומי. מכשירי דיסקציה וויברטום הוכנו מראש ועוקרו בקפידה אתנול (איור 3A,B). לאחר מכן, ראשי העוברים החשמליים נותחו בקפידה והמוחות הופקו. כאן מוצגת כריתה מייצגת של מוחות מהעוברים שעברו EUE ב-E15 (איור 3C-F) ו-E12.5 (איור 3G-J). מוחות עטופים מיד במטריצת אגרוז, פרוסים ומונחים על ממברנת PTFE בתוך צלחת זכוכית תחתונה לדגירה (איור 3K-M).
המצב הבריאותי של פרוסות המוח הוא נקודה משמעותית לשליטה כדי להבטיח תוצאות אמינות. בדיקה חזותית לכל זיהום בוצעה מדי יום. בנוסף, לאחר שהתרבית הושלמה, פרוסות המוח קבועות ונתונות לאימונוהיסטוכימיה. כאן,4′,6-diamidino-2-phenylindole (DAPI) שימש כדי לשלוט בארגון התאים הכולל ובכתמי וימנטין כדי לחשוף את ארגון גליה; במיוחד, פיגום גליה רדיאלי (RG). בדרך כלל, פרוסות מוח מתורבתות בהצלחה שמקורן ב-IUE או ב-EUE מראות התפלגות תאית תקינה כפי שהיא מתגלה על-ידי DAPI ומערך מאורגן במקצת של RG עם תהליכי יצירת קשר עם פיאלים בעלי אוריינטציה אפית17 (איור 4A,B בהתאמה). מדי פעם נצפות הפרעות בולטות בפיגומי RG בפרוסות מוח מתורבתות, במיוחד באלה שמקורן באלקטרופורציה של EUE (איור 4C). פרוסות מוח עם פיגום RG לא מאורגן במיוחד מראות נדידה עצבית לקויה וצמיחת אקסון פגומה (לא מוצגת). לפיכך, שליטה בפיגום RG היא שיטה קלה לאחר תרבית כדי למיין את הנתונים המתקבלים מפרוסות מוח אמינות.
פרוסות מוח שמקורן ב-IUE או ב-EUE עם תערובת פלסמידים המבטאת Lyn-mNeonGreen גורמת לסימון דומה של נוירונים דלילים. CPN פירמידאלי מייצג המבטא את Lyn-mNeonGreen ואת ההתנהגות הדינמית של חרוט הצמיחה שלו מוצג כדוגמה (איור 5A ווידאו משלים 1, למעלה משמאל). בנוסף, נוירונים סומנו באמצעות פלסמיד המבטא גשושית אקטין כדי לנתח את הדינמיקה של אקטין של אצטרובלים של גדילה אקסונאלית באתרם (איור 5B וסרטון משלים 1, משמאל למטה). ניסויים באתרם בוצעו גם עם עיצוב פלסמיד בעל ביטוי פלואורופור כפול של Cre/Dre (איור 1C ווידאו משלים 1, מימין). tRFP או ZsGreen fluorophores בפלסמיד זה יכולים להיות מופעלים באופן ספציפי ואינדיבידואלי על ידי רקומבינאזות של Dre או Cre, בהתאמה, בתאי עצב שכנים (איור 5C). מערך ניסיוני זה מאפשר ניתוח זה לצד זה של אצטרובלים גדילה מתאי עצב מבוקרים עם נוירונים מותאמים שכנים (כל אובדן או רווח נתון של תפקוד). זה עוקף את השונות הנובעת מהשימוש בפרוסות שונות לבדיקת תנאי בקרה וניסוי.
קימוגרפים שנוצרו מהסרט המוקלט נותחו, שמהם ניתן להשיג בקלות פרמטרי גדילה דינמיים כגון פעילות בולטת לאורך זמן ואורך גדילה (איור 6A). שימו לב שהתאמה פשוטה ברזולוציה הזמנית של קיטועי הזמן מאפשרת מדידה של מהירות התארכות האקסון במשך 2 שעות (איור 6A). יתר על כן, ניתן להשיג בקלות את השונות של נפח חרוט הצמיחה לאורך זמן - מדד לפעילות דינמית כללית של חרוט גדילה - במקרה זה באמצעות תוכנה מורשית (איור 6B ואיור 6E,F). זה יכול לשמש כדי להעריך את המהירות של הליכון אקטין ואת האיזון של filopodia / lamellipodia במהלך פעילות חקר חרוט גדילה.
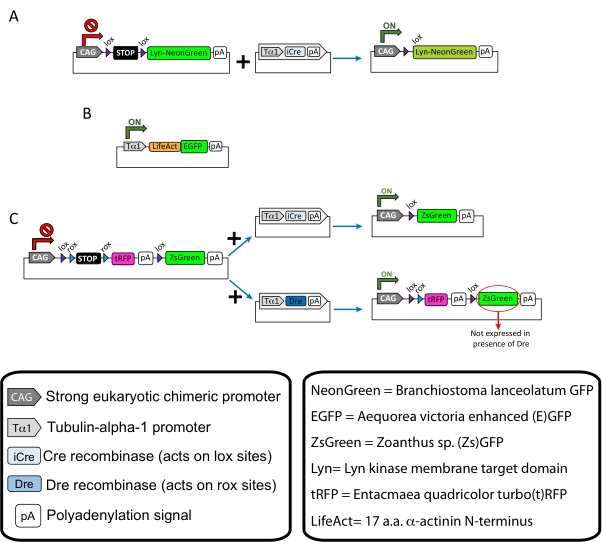
איור 1: סכמות של הפלסמידים המשמשים בפרוטוקול. (A) pCAG-lox-STOP-lox-Lyn-mNeonGreen. (B) p-Tub-alpha-1-LifeAct-GFP. (C) pCAG-lox-rox-rox-STOP-rox-tRFP-pA-lox-ZsGreen-pA. מידע רלוונטי לגבי רכיבי פלסמיד ומקורו של פלואורופור נמצא בקופסאות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
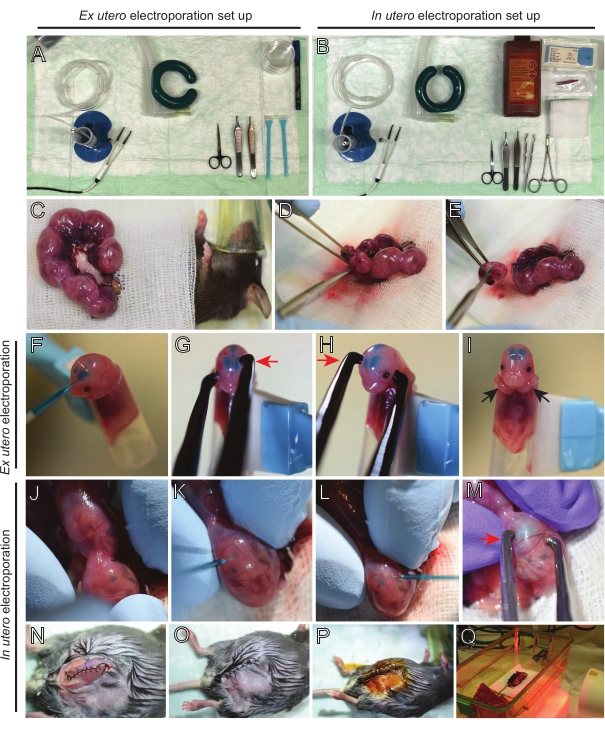
איור 2: זרימת עבודה של אקס רחם ובהתחשמלות ברחם של עכברי E15.5. (A) הקמת תחנת ניתוח לאלקטרופורציה של רחם לשעבר. (ב) הקמת תחנת ניתוח לאלקטרופורציה ברחם. (C) קרני רחם שנמשכו מחוץ לחלל הבטן של העכבר המרומם. (ד) מיצוי עובר משקע הרחם. (ה) הקרבת עוברים על ידי טרנסקציה מלאה של חוט השדרה באמצעות חתך אלכסוני; שים לב שעריפת ראשים נמנעה. (F) מיקום העובר במחזיק והזרקת תערובת דנ"א/ירוק מהיר לחדר הצדדי השמאלי. (ז,ח) מקם את ראש העובר בין אלקטרודות פינצטה פלטינה עם הקתודה (חץ אדום) מעל קליפת המוח בזווית של 60°. (I) מיקום זרועות העובר (חצים שחורים) מחוץ למחזיק כדי למנוע החלקה של העובר במהלך ההליך. (J) סיבוב העובר בתוך שק הרחם כדי לחשוף את הראש. (ק,ל) הזרקת דנ"א/תערובת ירוקה מהירה לחדרים הצדדיים של העובר דרך דופן הרחם. (M) למקם את ראש העובר בין אלקטרודות פינצטה פלטינה עם קתודה (חץ אדום) מעל קליפת המוח בזווית של 60°. (N) חתך שרירים תפור באמצעות תפר נעילת ריצה. (O) חתך עור תפור באמצעות תפר מופרע. (P) אבטחת הפצע באמצעות קליפסים כירורגיים וחיטוי באמצעות בטאדין. (Q) מיקום העכבר בכלוב ההתאוששות עם אור התחממות אינפרא אדום רחוק. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 3: מיצוי של מוחות E15.5 ו-E12.5 והליך תרבית פרוסות אורגנוטיפיות. (A) כלים המשמשים להליך מיצוי המוח. (B) הקמת תחנת תרבות אורגנוטיפית. (ג-ו) מיצוי מוח E15.5. (ג'י-ג') מיצוי מוח E12.5. קווים מנוקדים מדגישים את מיקום החתכים. חצים אדומים מצביעים על כיוון המשיכה על ידי מלקחיים. (K) הטמעת המוח בצלחת של 3 ס"מ המכילה אגרוז נמוך של 3%, ומשאירה מרווח אגרוז של 1-2 מ"מ מתחת למוח. (L) אוסף של פרוסת מוח של 150 מיקרומטר. (M) מיקום פרוסות המוח על קרום PTFE מוסיף משותק בצלחת של 35 מ"מ באמצעות סרט פרפין (חץ כחול). סימון כוכבים אדומים מציין איסוף פרוסות מוח נתון מוויברטום (L) והעברתו לממברנת PTFE (M). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
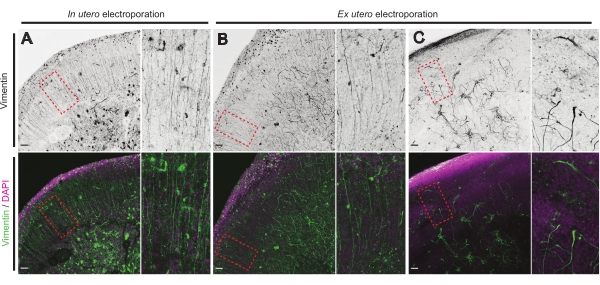
איור 4: מבנה תאי גליה רדיאליים שמורים בפרוסות אורגנוטיפיות בריאות. תמונות קונפוקליות של פרוסות מוח E17.5 החושפות מערך RG (וימנטין; ירוק) וארגון תאים כולל (DAPI; מגנטה) בעקבות IUE (A) ו- EUE (B,C). שים לב להפרעות החזקות במערך ה- RG שעשויות לנבוע מדי פעם מ- EUE (C). הגדלות מתאימות למסגרות המנוקדות באדום באיור הראשי: סרגלי קנה מידה, 10 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
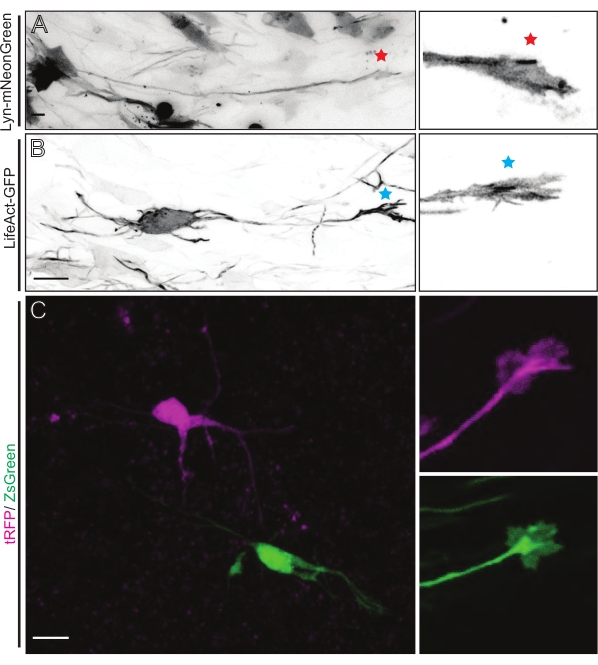
איור 5: הדמיה באתרה של דינמיקת חרוט הצמיחה בפרוסות אורגנוטיפיות חריפות. (א,ב) נוירונים ואצטרובלים הגדילה המתאימים שלהם מסומנים עם Lyn-mNeonGreen ו- LifeAct-GFP, בהתאמה. כוכב אדום המסמן חרוט גדילה של לין-mNeonGreen המבטא נוירון. כוכבית כחולה המסמנת חרוט גדילה של LifeAct-GFP המבטאת נוירון. (C) נוירונים שכנים המסומנים במערכת הפלסמיד הכפולה המכילה tRFP (magenta) ו-ZsGreen (ירוק) ומדובי הגדילה המתאימים להם. אצטרובלים צמיחה שצולמו (מימין) היו מחוץ למסגרת שנלכדה (משמאל), והתקבלו זמן קצר לאחר שרכשו את קונוס הצמיחה; סרגלי קנה מידה, 5 μm. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
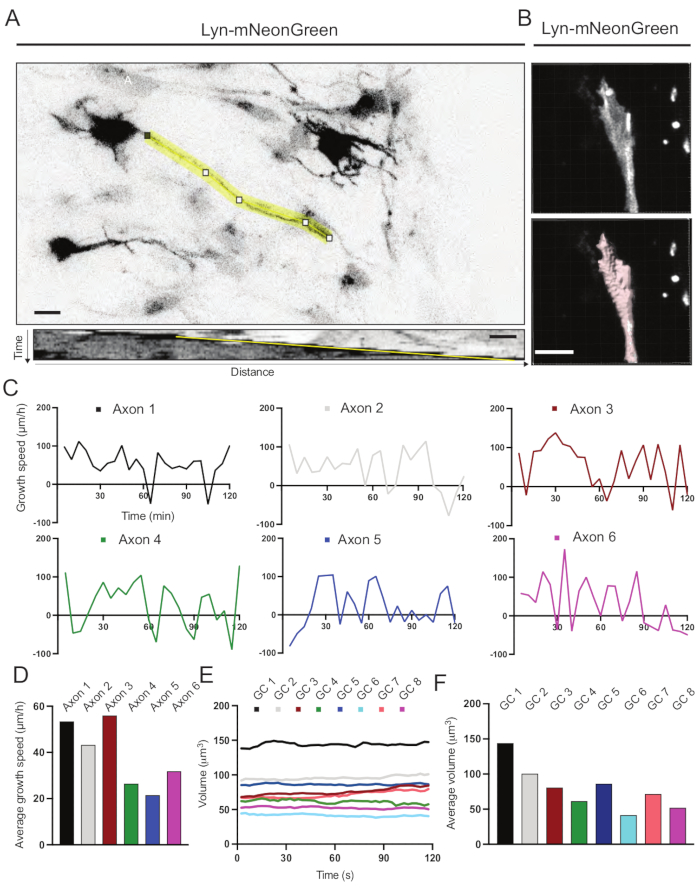
איור 6: ניתוח של מהירות גדילת אקסון ונפח חרוט גדילה. (B) שחזור של וידאו z-stack של חרוט גדילה באמצעות תוכנת ניתוח התמונה (למעלה) ואותו חרוט גדילה המודגש באמצעות כלי מדידת המשטחים (להלן). (C) גרפים המראים שינויים במהירות הגדילה לאורך זמן עבור מספר אקסונים. (D) מהירות הצמיחה הממוצעת של אקסונים מכמתת ב-(C). (E) גרף המציג את השינויים בנפח חרוט הצמיחה לאורך זמן. (ו) הנפח הממוצע של אצטרובלים גדלים בכימות ב-(E); סרגל קנה מידה, 5 μm. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
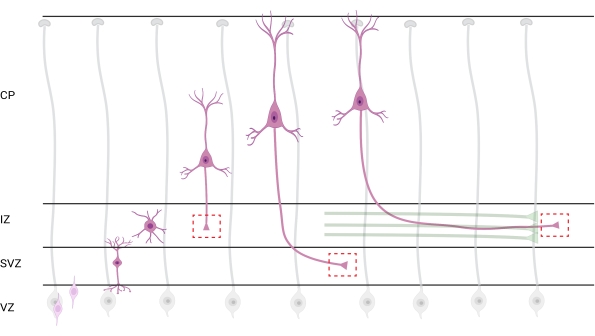
איור 7: נדידה רדיאלית וקיטוב עצבי של נוירונים בקליפת המוח הפירמידלית. דיאגרמה הממחישה את התפתחותם של נוירונים בקליפת המוח הפירמידלית (ורודה) הנודדים באופן רדיאלי מאזור החדר הנבטי (VZ) לעבר פני השטח של פיה. מונחה על ידי תהליכי גליה רדיאליים (אפור), נוירונים מקוטבים נודדים יוצרים תהליך מוביל, דנדריט עתידי ותהליך נגרר, אקסון עתידי, שממשיכים להתרחב כלפי מטה לכיוון אזור הביניים (IZ). קופסאות אדומות מקווקו מייצגות את האזורים בקליפת המוח שבהם צולמו אצטרובלים של גדילה. באופן ספציפי ב- IZ, אזור תת-חדרי (SVZ), או צרורות אקסון מצטרפים (ירוק). האיור נוצר באמצעות כלי מבוסס אינטרנט, BioRender.com. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
| פלסמיד | ריכוז (מיקרוגרם/מיקרול) | שימוש מיועד |
| pCAG-lox-STOP-LOX-Lyn-mNeonGreen | 0.25 | תיוג של חלבון ממוקד ממברנה (Lyn) |
| + | + | |
| p-Tub-alpha-1-iCre | 0.08 | |
| p-Tub-alpha-1-LifeAct-GFP | 0.125 | סימון אקטין נימה (F-אקטין) במדוכים של גדילה |
| pCAG-lox-rox-rox-STOP-rox-tRFP-lox-Lyn-ZsGreen | 1 | תיוג עצמאי של שתי אוכלוסיות של נוירונים שכנים |
| + | + | |
| p-Tub-alpha-1-iCre | 0.004 | |
| + | + | |
| p-Tub-alpha-1-Dre | 0.2 |
טבלה 1: רשימת הפלסמידים המשמשים בפרוטוקול. שם, ריכוז ושימוש מכוון בכל פלסמיד מנוצל.
סרטון משלים 1: הדמיה באתרה של דינמיקת חרוט הצמיחה בפרוסות אורגנוטיפיות חריפות. דינמיקה של אצטרובלים לצמיחה המסומנים ב-Lyn-mNeonGreen (למעלה משמאל) וב-LifeAct-GFP (משמאל למטה). אצטרובלים גדילה שכנים מסומנים באופן דיפרנציאלי עם מערכת הפלסמיד הכפולה המכילה tRFP (מגנטה; מימין למעלה) ו-ZsGreen (ירוק; מימין למטה). מרווח הדמיה, 2.5 שניות. סרגלי קנה מידה, 5 μm. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
האופן שבו אצטרובלים של גדילה חשים ומגיבים לסביבתם כדי לתאם הרחבה והכוונה בו-זמנית של אקסון עדיין נתון לוויכוח 3,18. מחקרים חלוציים במצעים דו-ממדיים סיפקו הצצה למנגנונים המולקולריים הבסיסיים היוצרים את הכוחות המניעים את דינמיקת חרוט הצמיחה במהלך היווצרות אקסון, צמיחה וניווט 2,10,11,12,19. לאחרונה, מחקרים במטריצות תלת-ממדיות חשפו כמה השפעה יש למימד שלישי בהתנהגות של חרוט הצמיחה וכתוצאה מכך בצמיחת אקסון 8,9. עם זאת, המנגנונים המורכבים המנחים את דינמיקת חרוט הצמיחה in vivo עדיין צריכים להיבדק ביסודיות.
הכנת תרביות פרוסות אורגנוטיפיות ממוחות IUE או EUE נמצאת בשימוש נרחב ומתועדת היטב. זה הפך לסטנדרט זהב המאפשר למדענים לקבל תובנות על ההתפתחות וההתנהגות של נוירונים ברקמת המוחהחיה 20,21. ואכן, טכניקה זו נוצלה בהצלחה בשילוב עם טכניקות הדמיה שונות ברזולוציה גבוהה כדי לדמיין תהליכים מולקולריים ספציפיים ואירועים מורפולוגיים באתרם. מחקרים כאלה כוללים, בין היתר, היווצרות אקסון והרחבה19,22, נדידה עצבית בקליפת המוח 19,22,23,24, דינמיקה של סנטרוזומים 25,26, דינמיקה של מיקרוטובול27, כמו גם הדינמיקה התפקודית של תאים טרום-תאיים ופוסט-סינפטיים28,29.
פרוטוקול זה מטפל בפער בנויירוביולוגיה הניסויית, ומדמיין את דינמיקת חרוט הגדילה של התפתחות נוירונים בקליפת המוח באתרם, בתרביות פרוסות מוח חריפות ex vivo , ובכלים לניתוח הנתונים המתקבלים.
תרביות פרוסות מוח חריפות נוצלו כדי לקבוע פרוטוקול זה מכיוון שהן (1) עם תרגול כלשהו, קלות ליצירה; (2) להציג מערכת נגישה לחקר אצטרובלים גדילתיים המוטמעים בסביבה מעין פיזיולוגית מלאה, אך שקופים מספיק כדי לאפשר הדמיה של תאים חיים ברזולוציה גבוהה; (3) ניתן להרחיב לשימושו עם מספר עצום של קווי עכבר מהונדסים; (4) בשילוב עם IUE או EUE, מספקים פוטנציאל כמעט בלתי מוגבל לספק כלים מולקולריים להערכת הביצועים של אצטרובלים ואקסונים של גדילה in vivo תחת משטרי אובדן/רווח של תפקוד, יחד עם כתבים פלואורסצנטיים ובדיקות שלד ציטוסקלטון.
מתודולוגיה זו תוארה בהקשר של EUE ו- IUE. למרות שעדיין מדובר בשיטה אמינה ביותר, EUE הביאה לעלייה בשכיחות של פרוסות מוח שהראו רשת RG לא מאורגנת בהשוואה לאלה שהתקבלו עם IUE כשיטת אספקה (איור 4C). הפרעות במערך RG משפיעות מאוד על הנדידה העצבית ועל דפוס התארכות האקסון30,31. אלה הם פרמטרים מרכזיים המנבאים היכן למצוא אקסונים לניתוח בזמן נתון ואת סוג הסביבה שהם מנווטים בה. פרוסות מוח עם רשת RG משובשת באופן משמעותי בדרך כלל פוגעות בריבוד נוירונים בקליפת המוח. זה, בתורו, מייצר אקסונים עם מסלולים כאוטיים. לכן, מומלץ מאוד לשלוט בשלמות המבנית של רשת RG. באופן מעניין, שלמות מבנית ירודה מתואמת עם גיל מוגבר של המוח העוברי. ואכן, השפעות כאלה בעוברי E12.5-E13.5 צעירים יותר בדרך כלל לא נצפו19.
הפרוטוקול הנוכחי הוא יסודי ופשוט. עם זאת, ישנם כמה צעדים קריטיים שבהם יש לנקוט בזהירות ובתשומת לב מיוחדת כדי להשיג תוצאות אופטימליות. אלה צוינו במפורש בפרוטוקול וכוללים (1) כוונון כמות הדנ"א המשמשת באלקטרופורציה כדי לקבל תיוג דליל; (2) הימנעות מנזק במהלך מיצוי המוח; (3) שליטה בטמפרטורת האגרוז במהלך מעטפת המוח; (4) פתרון בעיות באחוזים האידיאליים של אגרוז עבור מוחות בגיל נתון; ו-(5) בחירה של פלואורופורים, שהניסיון שלהם עוקב אחריהם. במהלך אופטימיזציה של הפרוטוקול, נבדקו הביצועים של מספר פלואורופורים בהדמיית תאים חיים באתרם. גרסאות GFP מונומריות EGFP ו-NeonGreen להכנת הפלסמידים המתויגים של LifeAct ו-Lyn נבחרו לפרוטוקול זה (איור 5A,B). בנוסף, גרסת ה-RFP mScarlet נבדקה ונמצאה מתאימה מאוד למערך זה (הנתונים לא מוצגים). כמו כן נבדקו tRFP (דימר) ו-ZsGreen (טטרמר) (איור 5C ווידאו משלים 1, מימין). פלואורופורים סופר-בהירים אלה המתקפלים במהירות מומלצים כאשר השיטה דורשת יצירת אותות פלואורסצנטיים מהירים לאחר מסירת DNA.
פרקטיקה נפוצה בשימוש בתרביות פרוסות היא שימוש בפרוסות ממוחות שונים כדי לבחון שליטה ומצבי ניסוי. זה מייצג מקור אינהרנטי של שונות לא רצויה. כאן נעשה שימוש במערכת ביטוי המאפשרת שינוי בלתי תלוי של תאי עצב שכנים וביטוי של כתבים לזיהוי. שימו לב שבהדגמה זו (איור 5C), לא היו הבדלים בין תאי עצב המבטאים אף אחד מהפלואורופורים. עם זאת, כדוגמה, תערובת פלסמידים כזו בשילוב עם קו עכברים מהונדס בעל גן רגיש ל-Cre יתויגו עם נוירוני tRFP (רגישים ל-Dre) שנשארו כסוג פראי. לעומת זאת, ה-ZsGreen (גם הוא רגיש ל-Cre) יתייג את הנוירונים הרקומבינציה. לפיכך, אצטרובלים של שני הגנוטיפים השונים, וככל הנראה גם פנוטיפים, יכולים להיחקר זה לצד זה בו זמנית באותה פרוסת מוח.
לוקליזציה של אקסונים ומדוכים צמיחה לניתוח היא שיקול חשוב. נוירונים בקליפת המוח מקוטבים בזמן שהם נודדים באופן רדיאלי מאזור החדר (VZ) לעבר הצלחת בקליפת המוח (CP). במהלך תהליך זה, נוירונים יוצרים תהליך מוביל (דנדריט עתידי) ותהליך נגרר שיהפוך לאקסון, ובסופו של דבר יצטרף לאקסונים חלוציים באזור הביניים (IZ), ויקים דרכי אקסון32. לכן, כדי ללכוד חרוטים של גדילה אקסונאלית, ההדמיה נעשתה על סיבים אקסונאליים ב-IZ, כולל אקסונים היוצאים מה-CP ואקסונים שנוצרו מוקדם שכבר קשורים לחבילות אקסונליות; או בסופו של דבר, בסיבים שחוצים את ה-IZ ומתרחבים מתחתיו (איור 7).
פרוטוקול זה מאפשר לבצע הדמיה ברזולוציה גבוהה במיוחד של נוירונים בתוך פרוסות אורגנוטיפיות. מבחינה היסטורית, פיזור אור היה בעיה משמעותית שעמדה בפני הדמיה בעת הדמיה של דגימות עבות. במהלך שני העשורים האחרונים, התקדמות נרחבת בטכנולוגיות אופטיות אפשרה הדמיה של דגימות עבות. כאן, מטרה למרחק עבודה ארוך שימשה כדי לדמיין מבנים קטנים יותר טוב יותר, כגון אצטרובלים צמיחה. באופן בלתי נמנע, פרוטוקול זה אינו לוכד אירועים מפורטים יותר כגון זרימת אקטין מדרדרת או דינמיקה של מיקרוטובול. המטרה למרחק עבודה ארוך, המחייבת צמצם נומרי נמוך יותר (NA), שומרת על מידע מפרוסות עבות. עם זאת, ניתן היה גם להתאים את הפרוטוקול הזה לשימוש עם מטרות של מרחק עבודה קצר יותר. זה דרש העברה חלקה של פרוסות לתבשיל עם תחתית זכוכית כדי לשמור על שלמות המבנה. עם זאת, שימוש בשיטה זו הביא להישרדות קצרה יותר - ~ 15 שעות - עקב אובדן חילופי גזים (נתונים שלא הוצגו). שלא כמו תרבויות דו-ממדיות, אצטרובלים של גדילה בתלת-ממד תופסים נפח גדול יותר ודורשים פיצוי תנועה-תוצר בציר z. כדי להגדיל את היכולת לצלם אירועים מפורטים, יש להשתמש בטכנולוגיה קונפוקלית מודרנית. לכן, מומלץ להשתמש במנוע z-stack בסריקה מהירה, כגון z-Galvo הזמין במיקרוסקופים קונפוקליים רגישים ביותר33.
יש לציין כי פרוטוקול זה מציג שלוש מגבלות עיקריות. ראשית, לעתים קרובות מאתגר לשלוט ברמות הביטוי/מספר התאים המבטאים של כל פלסמיד נתון in vivo. זה מציג שונות בין כל הפרוסות גם כאשר שומרים על אותו ריכוז פלסמיד. לכן, הבחירה של האלמנטים הרגולטוריים בווקטורי הביטוי המשמשים חייבת להיות קבועה מראש בזהירות. שנית, הדמיה של אירועים מפורטים באמצעות תוספות ממברנה אינה אפשרית כיום. ניתן להתגבר על מגבלה שנייה זו עם העדכונים המתודולוגיים שהוצעו בפסקה הקודמת. לבסוף, אצטרובלים גדילה רגישים מאוד לאור ויכולים להפוך במהירות לפומבינציה. לכן, הדמיה תכופה של אצטרובלים גדילה, במשך 5 דקות בלבד באמצעות מיקרוסקופים לסריקת לייזר, יכולה לעתים קרובות למוטט את אצטרובל הצמיחה. בהקשר זה, ניתן להתאים התקדמות חדשה במכשירים שנוצרו במיקרוסקופיה של יריעות אור להדמיה ארוכת טווח של פרוסות המוח34.
פרוטוקולים כאלה צפויים לפתוח אפיקי מחקר חדשים, ולאפשר הבנה טובה יותר של מה שנדרש כדי שחרוט גדילה יקרא ויגיב לעבר סביבת in vivo מורכבת, וחשוב מכך, כדי לפענח את המכניקה של משחק הגומלין המתוחכם הזה.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
ברצוננו להודות למריה יוג'ניה ברניס על צילום הנהלים. אנו מודים גם לאמילי ברנסייד, אמילי הנדלי, ת'ורבן פיטרלה, מקס שלסקי וסינה שטרן על שקראו את כתב היד ודנו בו. אנו אסירי תודה לעוזרות הטכניות הבולטות שלנו, ג'סיקה גונייה, בלנקה רנדל ואנה-טואן פאם. אנו מכירים בתמיכה החשובה של מתקן מיקרוסקופ האור של DZNE ומתקן בעלי החיים. עבודה זו נתמכה על ידי Deutsche Forschungsgesellschaft (DFG), הקרן הבינלאומית למחקר בפרפלגיה (IRP) וכנפיים לחיים (עד F.B). F.B. הוא חבר באשכול המצוינות ImmunoSensation2, SFBs 1089 ו- 1158, והוא חתן פרס רוג'ר דה ספולברך.
Materials
| Name | Company | Catalog Number | Comments |
| Adson Forceps | Fine Science Tools | 11006-12 | |
| Alexa Fluor 488 | Invitrogen | A21202 | Goat Anti-Mouse |
| Alexa Fluor 647 | Invitrogen | A21236 | Goat Anti-Mouse |
| Anti-Vimentin antibody | sigma-Aldrich | V2258-.2ML | Monoclonal mouse, clone LN-6, ascites fluid |
| B27 supplement | ThermoFisher Scientific | 17504044 | |
| Betadine | B. Braun | 3864154 | |
| Biozym Sieve GP Agarose | Biozyme | 850080 | |
| Braunol, Sprühflasche | B. Braun | 3864073 | |
| Buprenorphine (Temgesic) | GEHE Pharma | 345928 | |
| DAPI | sigma-Aldrich | D9542 | |
| DMZ unevirsal electrode puller | Zeitz | NA | |
| Electric razor | Andes | NA | ProClip UltraEdge Super 2-Speed model |
| Enrofloxacin (Baytril) | Bayer | 3543238 | 2,5% (wt/vol) |
| Eppendorf microloader pipette tips | FischerScientific | 10289651 | |
| Fast Green FCF | Sigma-Aldrich | F7252-5G | Dye content ≥ 85 % |
| Fetal Bovine Serum | ThermoFisher Scientific | 10500064 | |
| Fiji 2.1.0 | NIH | NA | https://imagej.net/software/fiji/downloads |
| Fine Scissors | Fine Science Tools | 14058-09 | ToughCut/Straight/9cm |
| FluoroDish Cell Culture Dish | World Precision Instruments | FD5040-100 | |
| Fluoromount Aqueous Mounting Medium | sigma-Aldrich | F4680-25ML | |
| Glucose | MedPex | 3705391 | 5% |
| GlutaMAX Supplement | ThermoFisher Scientific | 35050061 | |
| Glycine | Sigma-Aldrich | G8898 | |
| HBSS | Life Technologies | 14025092 | calcium, magnesium, no phenol red |
| Horse serum | Pan-Biotech | P30-0711 | |
| Imaris 9.7.2 | Bitplane | NA | https://imaris.oxinst.com/products/imaris-for-neuroscientists |
| Isoflurane | Virbac | NA | |
| Isotonic saline solution | B. Braun | 8609261 | 0.90% |
| Leica VT1200 S vibratome | Leica | 14048142066 | |
| LSM 880 with Airyscan | Zeiss | NA | |
| Metacam | Venusberg Apotheke | 8890217 | 5 mg/ml |
| Mice | Janvier Labs | NA | C57BL/6JRj |
| Micro-Adson Forceps | Fine Science Tools | 11018-12 | |
| Micropipette Storage Jar | World Precision Instruments | E210 | 16.16.27 |
| Microsoft Excel | Microsoft | NA | https://www.microsoft.com/en-us/microsoft-365/p/excel/cfq7ttc0k7dx?activetab=pivot:overviewtab |
| Millicell Cell Culture Insert | EMD Millipore | PICM0RG50 | 30 mm, hydrophilic PTFE, 0.4 µm |
| Moria Perforated Spoons | Fine Science Tools | 10370-18 | |
| Moria Spoon | Fine Science Tools | 10321-08 | |
| Neurobasal Medium, minus phenol red | ThermoFisher Scientific | 12348017 | |
| Neuropan-2 supplement | Pan-Biotech | P07-11010 | |
| Normal goat serum | Abcam | ab138478 | |
| Olsen-Hegar Needle Holder with Scissors | Fine Science Tools | 12002-12 | |
| p-Tub-alpha-1-Dre | Addgene | 133925 | |
| p-Tub-alpha-1-iCre | Addgene | 133924 | |
| p-Tub-alpha-1-LifeAct-GFP | Addgene | 175437 | |
| Parafilm | VWR | 52858-000 | |
| Paraformaldehyde | sigma-Aldrich | P6148 | |
| PBS | Sigma-Aldrich | P3813-10PAK | |
| pCAG-lox-rox-STOP-rox-tRFP-lox-Lyn-ZsGreen | Addgene | 175438 | |
| pCAG-lox-STOP-lox-Lyn-mNeonGreen | Addgene | 175257 | |
| Penicillin-Streptomycin | ThermoFisher Scientific | 15140122 | |
| PicoNozzle Kit v2 | World Precision Instruments | 5430-ALL | |
| Platinum Tweezertrodes | Harvard Apparatus | 45-0487 | 1 mm / 3 mm |
| QIAGEN Maxi kit | QIAGEN | 12162 | |
| Reflex wound closure Clip | World Precision Instruments | 500344-10 | 7 mm |
| Sekundenkleber Pattex Mini Trio | Lyreco | 4722659 | |
| Square wave electroporation system ECM830 | Harvard Apparatus | W3 45-0052 | |
| Sterile gauze | Braun Askina | 9031216 | |
| Sterile lubricant eye ointment | Bayer Vital | PZN1578675 | |
| Sterile surgical gloves | Sempermed | 14C0451 | |
| Sucrose | Roth | 4621.2 | |
| Supramid 5-0 surgical silk sutures | B. Braun | NA | |
| Thin-wall glass capillaries | World Precision Instruments | TW100-4 | |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Vannas spring scissors | Fine Science Tools | 15000-03 | |
| µ-Slide 8 Well Glass Bottom | Ibidi | 80827 |
References
- Schelski, M., Bradke, F. Neuronal polarization: From spatiotemporal signaling to cytoskeletal dynamics. Molecular and Cellular Neurosciences. 84, 11-28 (2017).
- Lowery, L. A., Van Vactor, D. The trip of the tip: understanding the growth cone machinery. Nature Reviews: Molecular Cell Biology. 10 (5), 332-343 (2009).
- Stoeckli, E. T. Understanding axon guidance: are we nearly there yet. Development. 145 (10), (2018).
- Bradke, F., Dotti, C. G. The role of local actin instability in axon formation. Science. 283 (5409), 1931-1934 (1999).
- Neukirchen, D., Bradke, F. Cytoplasmic linker proteins regulate neuronal polarization through microtubule and growth cone dynamics. Journal of Neuroscience. 31 (4), 1528-1538 (2011).
- Witte, H., Bradke, F. The role of the cytoskeleton during neuronal polarization. Current Opinion in Neurobiology. 18 (5), 479-487 (2008).
- Witte, H., Neukirchen, D., Bradke, F. Microtubule stabilization specifies initial neuronal polarization. Journal of Cell Biology. 180 (3), 619-632 (2008).
- Nichol, R. H., Catlett, T. S., Onesto, M. M., Hollender, D., Gomez, T. M. Environmental elasticity regulates cell-type specific RHOA signaling and neuritogenesis of human neurons. Stem Cell Reports. 13 (6), 1006-1021 (2019).
- Santos, T. E., et al. Axon growth of CNS neurons in three dimensions is amoeboid and independent of adhesions. Cell Reports. 32 (3), 107907(2020).
- Mitchison, T., Kirschner, M. Cytoskeletal dynamics and nerve growth. Neuron. 1 (9), 761-772 (1988).
- Lin, C. H., Thompson, C. A., Forscher, P. Cytoskeletal reorganization underlying growth cone motility. Current Opinion in Neurobiology. 4 (5), 640-647 (1994).
- Myers, J. P., Gomez, T. M. Focal adhesion kinase promotes integrin adhesion dynamics necessary for chemotropic turning of nerve growth cones. Journal of Neuroscience. 31 (38), 13585-13595 (2011).
- Turney, S. G., et al. Nerve growth factor stimulates axon outgrowth through negative regulation of growth cone actomyosin restraint of microtubule advance. Molecular Biology of the Cell. 27 (3), 500-517 (2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Noctor, S. C., Flint, A. C., Weissman, T. A., Dammerman, R. S., Kriegstein, A. R. Neurons derived from radial glial cells establish radial units in neocortex. Nature. 409 (6821), 714-720 (2001).
- Noctor, S. C., Martinez-Cerdeno, V., Ivic, L., Kriegstein, A. R. Cortical neurons arise in symmetric and asymmetric division zones and migrate through specific phases. Nature Neuroscience. 7 (2), 136-144 (2004).
- Ferent, J., Zaidi, D., Francis, F. Extracellular control of radial glia proliferation and scaffolding during cortical development and pathology. Frontiers in Cell and Developmental Biology. 8, 578341(2020).
- Dent, E. W., Gupton, S. L., Gertler, F. B. The growth cone cytoskeleton in axon outgrowth and guidance. Cold Spring Harbor Perspectives in Biology. 3 (3), (2011).
- Dupraz, S., et al. RhoA controls axon extension independent of specification in the developing brain. Current Biology. 29 (22), 3874-3886 (2019).
- Azzarelli, R., Oleari, R., Lettieri, A., Andre, V., Cariboni, A. In vitro, ex vivo and in vivo techniques to study neuronal migration in the developing cerebral cortex. Brain Sciences. 7 (5), (2017).
- Humpel, C. Organotypic brain slice cultures: A review. Neuroscience. 305, 86-98 (2015).
- Namba, T., et al. Pioneering axons regulate neuronal polarization in the developing cerebral cortex. Neuron. 81 (4), 814-829 (2014).
- Shah, B., et al. Rap1 GTPases are master regulators of neural cell polarity in the developing neocortex. Cerebral Cortex. 27 (2), 1253-1269 (2017).
- Wiegreffe, C., Feldmann, S., Gaessler, S., Britsch, S. Time-lapse confocal imaging of migrating neurons in organotypic slice culture of embryonic mouse brain using in utero electroporation. Journal of Visualized Experiments: JoVE. (125), (2017).
- de Anda, F. C., Meletis, K., Ge, X., Rei, D., Tsai, L. H. Centrosome motility is essential for initial axon formation in the neocortex. Journal of Neuroscience. 30 (31), 10391-10406 (2010).
- Sakakibara, A., et al. Dynamics of centrosome translocation and microtubule organization in neocortical neurons during distinct modes of polarization. Cerebral Cortex. 24 (5), 1301-1310 (2014).
- Schatzle, P., Kapitein, L. C., Hoogenraad, C. C. Live imaging of microtubule dynamics in organotypic hippocampal slice cultures. Methods in Cell Biology. 131, 107-126 (2016).
- Qu, X., Kumar, A., Bartolini, F. Live imaging of microtubule dynamics at excitatory presynaptic boutons in primary hippocampal neurons and acute hippocampal slices. STAR Protocols. 2 (1), 100342(2021).
- Tonnesen, J., Katona, G., Rozsa, B., Nagerl, U. V. Spine neck plasticity regulates compartmentalization of synapses. Nature Neuroscience. 17 (5), 678-685 (2014).
- Buchsbaum, I. Y., Cappello, S. Neuronal migration in the CNS during development and disease: insights from in vivo and in vitro models. Development. 146 (1), (2019).
- Rigby, M. J., Gomez, T. M., Puglielli, L. Glial cell-axonal growth cone interactions in neurodevelopment and regeneration. Frontiers in Neuroscience. 14, 203(2020).
- Barnes, A. P., Polleux, F. Establishment of axon-dendrite polarity in developing neurons. Annual Review of Neuroscience. 32, 347-381 (2009).
- Multiphoton Microscope Leica TCS SP8 MP. Microsystems. , Available from: http://www.leica-microsystems.com/products/confocal-microscopes/p/leica-tcs-sp8-sted-one/ (2021).
- ZEISS Lattice Lightsheet 7. Zeiss. , Available from: http://www.zeiss.com/microscopy/int/products/imaging-systems/lattice-lightsheet-7.html (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved