Method Article
その場で 急性 エクスビボ 胚性脳スライス培養における軸索成長および成長円錐ダイナミクスの可視化
要約
このプロトコルは、 その場で 軸索の成長および成長円錐ダイナミクスを研究するための簡単で堅牢な方法を実証する。 これは、生体外で 生理学的に関連する急性脳スライスを調製する方法を説明し、ユーザーフレンドリーな分析パイプラインを提供します。
要約
ニューロンの発達の間、軸索は皮質環境をナビゲートして最終目的地に到達し、シナプス接続を確立する。成長円錐 - 軸索を発達させる遠位先端に位置する感覚構造 - は、このプロセスを実行します。成長円錐の構造とダイナミクスを研究することは、軸索の発達と、神経回路を形成することを可能にする周囲の中枢神経系(CNS)との相互作用を理解するために不可欠です。これは、基礎研究や前臨床の文脈で損傷後に軸索を神経回路に再統合する方法を考案する際に不可欠です。これまでのところ、成長円錐ダイナミクスの一般的な理解は、主に2次元(2D)で培養されたニューロンの研究に基づいています。成長円錐構造ダイナミクスと刺激に対する応答に関する現在の知識にとって間違いなく基本的なものですが、2D研究は、無傷のCNS組織においてニューロン成長円錐体が遭遇する生理学的3次元(3D)環境を誤って表現しています。より最近では、コラーゲンゲルがこれらの制限のいくつかを克服するために使用され、3Dでのニューロン発達の調査が可能になりました。しかし、合成2Dおよび3D環境の両方に、CNS組織内のシグナル伝達手がかりがなく、発達中の軸索の伸長および経路探索を指示する。このプロトコルは、発達中の軸索が生理学的に関連する物理的および化学的手がかりに遭遇する有機型脳スライスを使用して軸索および成長円錐を研究するための方法を提供する。このプロトコルは、子宮 内 エレクトロポレーションと 子宮外 エレクトロポレーションを組み合わせて蛍光レポーターをまばらに配信し、超解像顕微鏡とともに、軸索と成長円錐のダイナミクスを その場で視覚化するための方法論的パイプラインを提示します。さらに、長期および生細胞画像化データの分析の詳細なツールキット記述が含まれる。
概要
ニューロンは、神経系における基本的な計算単位を表す高度に分極した細胞である。それらは、入力部位と出力部位の区画化に依存する情報(樹状突起および軸索、それぞれ1)を受信し、放出する。開発中、軸索は、信じられないほど複雑な環境をナビゲートしながら、目的地に到達しながら拡張します。軸索ナビゲーションは、発達中の軸索の先端に位置する感覚構造である成長円錐によって導かれる。成長円錐は、環境の手がかりを検出し、それらをその細胞骨格の動的空間再編成に変換する役割を担っています2,3。結果として生じる形態力学的反応は、成長円錐に誘発合図から伸縮するように指示し、特定の軸索操作をもたらす。
軸索伸長および成長円錐ダイナミクスの現在の理解は、2次元(2D)基質2、4、5、6、7にわたる軸索成長を評価する研究に由来する。これらの先駆的な研究は、成長円錐と成長基質との間の洗練された相互作用を同定し、接着性および剛性などの基質特性に依存する顕著な違いを明らかにした8,9。これらの洞察に導かれて、細胞外環境手がかりが軸索成長を指示する仮説が立てられ、成長円錐細胞骨格がこの成長を実行する2、10、11、12。注目すべきことに、ニューロンは、非接着性基質(例えば、ポリリジン、ポリオルニチン)中の軸索を伸長させることができる13。さらに、基質剛性は、細胞接着複合体8とは無関係に軸索増殖速度に影響を与え得る。したがって、2D基板における成長円錐ダイナミクスを研究するだけでは、軸索成長円錐と生理学的に関連する3次元(3D)環境(生体内に見られるような)との相互作用から生じる力のバランスを正確にモデル化することはできません。
2Dアッセイの限界を克服するために、軸索成長および成長円錐ダイナミクスが3D行列8、9において研究されてきた。これらのマトリックスは、より生理学的文脈をもたらすが、軸索成長の細胞内因性メカニズムを研究することを可能にする。これは、様々な条件および薬理学的処置における単一細胞様式での成長円錐検査を可能にする9。このような3D環境において、軸索は明確な細胞骨格ダイナミクスを示し、2D培養ニューロンで観察されたものよりも速く成長した9。これらの優雅な研究は、成長円錐体細胞骨格の再編成、ひいてはその挙動に対する余分な次元の影響を実証した。
ネイティブ様のニューロンの発達および軸索成長をサポートする上で、2D表面上の3Dマトリックスによって提示される明らかな利点にもかかわらず、それらは、中枢神経系(CNS)組織で観察されるダイナミクスの複雑さを反映することができない単純化された合成足場のままである。ここで、 ex utero および in utero electroporationによるレポータープラスミドの送達を、脳器官型スライス培養および in situ ライブ超解像画像と組み合わせて、生理学的文脈における成長円錐ダイナミクスを分析する。この方法論は、 生体内 環境の3次元性とその物理化学的組成の複雑さを経験しながら、発達中の軸索の視覚化を可能にする。最後に、一般的にライセンスされ、一般に入手可能なソフトウェアを使用して軸索の成長および成長円錐のダイナミクスを測定するためのユーザーフレンドリーな手順について説明します。
プロトコル
動物実験は、関連する機関および連邦規制に準拠している必要があります。胚発生日15.5および12.5(E15.5およびE12.5)の妊娠雌性C57BL/6JRjマウスをこのプロトコールで使用した。実験は、北ライン=ヴェストファーレン州環境庁の動物福祉法(Landesamt für Natur, Umwelt und Verbraucherschutz (LANUV))に従って行った。
1. 注射用プラスミドの調製
- エンドトキシンフリーのマキシプレップキットを使用して、メーカーのプロトコールに従ってDNAを単離します( 材料表を参照)。
- 選択したDNAを所望の濃度で混合し(表1)、10%ファストグリーン溶液( 材料表を参照)を混合して、脳心室へのDNA混合物の送達を視覚化する。
注:皮質ニューロンの疎標識(図1A)、成長円錐内の糸状アクチン(F-アクチン)構造(図1B)、および同じ皮質内の成長円錐の二重標識(図1C)に特異的プラスミドを使用しました。このプロトコールで使用されるすべてのプラスミド(表1)は、Addgeneに寄託されています(材料表を参照)。 - 以下のプログラムに従ってキャピラリー電極プーラーセットを使用してガラスキャピラリーを準備します:圧力:500、熱:800、プル:30、および速度:40。
- マイクロローダーピペットチップを使用して、15 μLのDNA/ファストグリーンミックスを各ガラスキャピラリーにロードします。
メモ: 泡が形成されていないことを確認します。 - DNAで満たされた毛細血管を10cmの皿に保管し、皿の直径全体にモデリング粘土片を入れます。毛細血管は、実験の前日に4°Cで装填し、保存することができる。毛細血管の後端を可撓性フィルムで密封し、乾燥を防ぎます。
2. 溶液の調製
- グルコースを添加したハンクス緩衝塩溶液(HBSS-G)を調製する。
- 20%グルコースストックの0.5%を1x HBSSのボトルに加える。よく混ぜ合わせ、4°Cで最大2週間保存してください。胚抽出のために、胚採取の直前にバブリングストーンを用いてカルボーゲン(95%O2および5%CO2)を含むバブルHBSS−G溶液を調製した。
- スライスメディアソリューション
- Neurobasal 1x、5%ウマ血清、5%胎児ウシ血清、B27サプリメント1:50、L-グルタミンサプリメント1:400、ペニシリン-ストレプトマイシン1:200、およびNeuropan-2サプリメント1:100(pH=7.3)を含む新鮮なスライス培地を滅菌条件下で調製する( 材料表を参照)。
- それぞれ1mLのスライスメディアを含む3cmの皿を準備する。実験前に5%CO2 とともに35°Cのインキュベーター内に少なくとも1時間置き、ガス交換によって培地のpHを平衡化する。
注:培地pH平衡化は、インキュベーターからのCO2 による培地の酸性化によって引き起こされる。スライスメディアは、4 °C で最大 1 週間保存できます。
- 低融点アガロース溶液(3%)
- 所望の量の低融点アガロース粉末を秤量し、ガラス瓶中の1x HBSS-Gの適切な体積に溶解する。脳あたり約7mLのアガロース溶液が必要です。
- キャップをゆるく置いた状態で、ボトルを電子レンジに2〜3分間置き、10〜20秒ごとに振る。
- 粉末が完全に溶解したら、実験の少なくとも1時間前に37°Cに設定したウォーターバスまたはビーズバスにボトルを置き、アガロースを冷却します。
注:アガロース粉末が溶解していることを確認するために、アガロースを15分間で2回加熱することをお勧めします。これは、脳組織へのアガロースの適切な接着に不可欠です。温度計を使用して、脳を埋め込んでアガロース溶液の温度を測定し、37〜40°Cであることを確認する必要があります。 異なる年齢の動物の脳は異なる剛性を持っています。組織とアガロースの間の均質性を見つけるために、アガロース濃度の範囲をテストすることをお勧めします。 - リン酸緩衝生理食塩水を0.3%トリトンX-100(PBS-T)で調製する。
- 0.2%アジ化ナトリウム(PBS-NaN3)でリン酸緩衝生理食塩水を調製する。
注:ステップ2.4〜2.5で説明された溶液は、後の免疫組織化学ステップで使用するためのものである。
3. 手術ステーションの準備
- 手術ステーションを70%〜96%のエタノールで清掃し、ステーション表面に手術下敷きを置きます。
- 70%〜96%エタノールですすぎ、続いてホットビーズ滅菌器で乾式滅菌することによって手術器具を滅菌する。
- パルス発生器に接続する前に、白金ピンセット電極( 材料表を参照)を70%〜96%エタノールで洗浄します。
- DNA/ファストグリーン充填ガラスキャピラリーをキャピラリーホルダーに挿入します。使用直前には、細かいハサミで毛細血管先端を軽くはがし、予め温めた生理食塩水または水で満たされた1.5mLの微量遠心管内で試験液を流してください。
注:図2A,Bは、元子宮エレクトロポレーション(EUE)および子宮エレクトロポレーション(IUE)に使用される手術ステーションのセットアップとツールを示しています。 - IUEの場合、生理食塩水を水浴中で37°Cにウォームアップする。
4. 胚摘出
- マウスが深く麻酔されるまで、妊娠中のマウスを5%イソフルランで麻酔誘導チャンバーに入れる。ペダル離脱反射の不在による麻酔を確認する。
- マウスを操作下敷きに移し、ノーズコーンを通してイソフルランを1.5%〜2%に維持する。
- 角膜乾燥を防ぐために両目に軟膏を塗布する。
- マウスの腹部を剃り、70%〜96%エタノール浸漬ガーゼを使用して剃毛した毛を取り除きます。ベタジンでその領域をきれいにしてください。
- 滅菌された小さな外科用はさみを使用して、腹部の正中線に沿って2cmの皮膚切開を行い、続いて1.5cmの筋肉切開を行う。
注:切開サイズは胚サイズに依存する。実際、より大きな胚は、それらの抽出に対応するためにより大きな切開を必要とするであろう。 - ガーゼの中央に、皮膚の切開部(直径約2cm)に収まるように十分な幅の穴を切り、温かい生理食塩水で浸し、腹部開口部の周りに置きます。
- 暖かい生理食塩水に浸した綿棒または鉗子を使用して両方の子宮角を引き出し、胚の間のスペースを慎重につかんで引き出します。湿ったガーゼの上に胚を置く(図2C)。
注:子宮角の周りの血管や毛細血管に小さな損傷を与えても、多量の出血につながる可能性があります。したがって、これらの血管性領域の直接的な取り扱いは常に避けてください。 - 子宮袋を切り開き、各胚を取り除きます(図2D)。
- 抽出直後に各胚を下降対角線切断 を介して 安楽死させ、完全な脊髄切断を確実にする(図2E)。
- 胚を氷上のHBSS-Gを含む10cmの皿に入れる。
注:胚の斬首は、脳からのDNA/Fast Green混合物の漏れを防ぎ、ホルダー内の胚の容易な位置決めを容易にするために回避される( 元子宮 エレクトロポレーション、ステップ5を参照)。 - 子宮頸部脱臼を行うことで胚の抽出直後に母親を屠殺する。
注:ここでは、母親は、北ライン・ヴェストファーレン州環境庁(LANUV)の動物福祉法によって承認されたプロトコルに従って、処置後の痛みや苦しみから救うために麻酔下で安楽死させられます。
5. 元子宮 エレクトロポレーション(EUE)
- 胚を拾い上げ、ホルダーに入れます。
注:細胞スクレーパーの端に取り付けられたカットされた1mLピペットチップが胚ホルダーとして使用されます。胚の腕を先端に滑り込ませないように、手順中は先端の外側に保持することが不可欠です(図2F-I)。ピペットチップの直径は、様々なサイズの胚を収容するために容易に調整可能である。先端の直径が胚のサイズと一致する長さで2番目の先端を切断し、上記のホルダーへのアダプターインサートとして使用します。 - DNA/Fast Greenで満たされたガラス毛細血管を胚の頭蓋骨を通して側脳室に慎重に挿入し、2〜3μLのDNAプラスミドミックスを注入する(図1A、B;表1)に各心室(図2F)を入れた。
注:ランドイド縫合糸と矢状縫合糸をDNA注射の場所のガイドとして使用してください。ランドイドおよび矢状縫合糸は、頭蓋骨の骨板をつなぐ線維性関節である。前者は頭頂骨と後頭骨を結合し、後者は2つの頭頂骨を結合する。 - 胚の頭を白金ピンセット電極の間に適切な角度で保持し、所望の脳領域(この場合は60°角度)を標的にし、陰極はDNA転写が意図される領域を向く(図2G-H)。
- 方形波パルス発生器を用いて、30mVで1秒間隔、持続時間50msで5パルスを印加する。
注:EUEの脳はIUEの脳よりも効果的な電場を経験することに留意してください。したがって、所定のDNA濃度では、EUEはIUEよりもDNA転写の効率が高く、DNA濃度はそれに応じて調整する必要があります。 - 両側エレクトロポレーションが必要な場合は、カソードとアノードが対側皮質をターゲットにするために前の位置をミラーリングして、ステップ5.3〜5.4を繰り返します。
注:両方の心室にDNAが注入されたので、両方の半球の皮質が標的とされた。 - エレクトロポレーションされた胚を、氷冷HBSS-Gを含む6cmの皿に入れる。必要なすべての胚について、手順5.1~5.6を繰り返します。
6. 子宮内 エレクトロポレーション(IUE)
- 妊娠中のマウスに鎮痛剤を注射する。50 μLのブプレノルフィン(0.1 mg/kg)( 材料表を参照)皮下、処置の20分前。
- 胚抽出セクションから手順4.1〜4.8を実行します。
注:胚を不必要に露出させないように、温かい生理食塩水に浸した滅菌ガーゼで覆ってください。 - 指先を使用して、ラムドイド縫合糸と矢状縫合糸が見つかるまで、子宮内で胚を静かに回転させます(図2J)。DNA/Fast Greenガラス毛細血管を子宮壁と胚の頭蓋骨を通して側脳室に慎重に挿入し、必要に応じて2~3μLのDNAプラスミドミックス(図1A、C)を一方または両方の心室に注入します(図2K-L)。
注:子宮の角に過度の指の圧力は羊膜袋の崩壊につながる可能性があります。 - 胚の頭を白金ピンセット電極の間に適切な角度で保持し、所望の脳領域(この場合は60°角度)を標的にし、陰極はDNA移植が意図される領域を向く。子宮を圧迫することは羊膜袋の崩壊を引き起こす可能性があるため、避けてください(図2M)。
- 方形波パルス発生器を用いて、35mVで600ms間隔、持続時間50msで5パルスを印加します。
- 両方の側脳室が注入された場合は、カソードとアノードが対側皮質を標的とする前の位置をミラーリングして、ステップ6.5〜6.6を繰り返します。
- 必要なすべての胚について、手順6.3~6.6を繰り返します。
- 必要な胚がすべてエレクトロポレーションされたら、生理食塩水に浸した綿棒を使用して、子宮の角を腹腔内に静かに戻します。
注:腹腔に生理食塩水を添加すると、子宮の角が所定の位置にスライドするのに役立ちます。 - 5-0縫合材料を用いて筋肉および皮膚切開部を縫合する。縫合クリップを使用して創傷を固定し、ベタジンを噴霧して縫合糸創傷を消毒する(図2N-P)。
- マウスに200μLの5%グルコースを皮下に注射する。
- 抗生物質をマウスに注射する;皮下に50μLのエンロフロキサシン(5mg / kg)を投与する( 材料表を参照)。
- マウスを回収ケージに戻し、遠赤外線加温灯または加熱パッドを使用して、手順後少なくとも20分間暖かさを維持します(図2Q)。
- マウスを毎日監視し、施設および連邦のガイドラインに従って疼痛緩和のための手順の後にメロキシカムを注射する。
- 手順の2日後(すなわち、E17.5)に胚を抽出し、ステップ4に従う。
7. 脳の抽出とアガロースへの埋め込み
注:精度を向上させるために、解剖顕微鏡下で次の手順を実行することをお勧めします。脳への損傷を避けることは、手順の成功にとって重要です。
- 解剖フードの下の滅菌作業スペースに抽出ツールを設置します(図3A)。
- 解剖はさみを使用して胚の頭を体の他の部分から分離します。
- 図 3Cに示すように頭を固定し、頭部の付け根から鼻に向かって正中線に沿って切断して皮膚と頭蓋骨を取り除きます(図3D)。
- 皮膚と頭蓋骨を横方向に剥がし、脳を切除するのに十分な大きさの隙間(〜1cm)を作ります。
- 脳を除去するには、滅菌解剖ハサミの閉じた先端を挿入し、嗅球の下から始めて脳幹に向かって移動する(図3E)。
- 脳幹を切り取り、脳の周りの髄膜の緩い部分をトリミングします(図3F)。
注:緩い髄膜は、切断後にスライスがアガロースブロックに付着したままになることが多く、スライス収集中にアガロースから組織が剥離することにつながる。 - すべての胚についてステップ7.1〜7.6を繰り返し、埋め込みステップまで脳を氷上に保ちます(理想的には30分以内)。
注: 次の手順 7.7.1-7.7.4 は、E12.5 脳の脳抽出を参照しています。- 図 3G に示すように、頭頂部を目のすぐ下に分離します。
- 脳幹を除去せずに、 図3Hに示すように破線に沿って、脳幹の上に皮膚および頭蓋骨を切断する。
- 図3Iに示すように、頭の後ろに2mmの皮膚頭蓋骨切開を行います(わかりやすくするために図面を参照)。
注:この切開部は、皮膚と頭蓋骨の層を剥がすための最初の把持点を提供します。通常、それらは1つの層として外れます。典型的な切開サイズは2mmであり、使用されるマイクロスプリングハサミの刃先の長さに対応する。 - 切開部の片側を固定し、もう片方を慎重に引っ張ることによって、皮膚 - 頭蓋骨層を剥がし始めます。同様の注意を払って、脳を解放するまで頭部の基部を剥がして仕上げる(図3J)。
注:これは、脳が組織層に沿って引っ張られていないことを観察しながら、細心の注意を払って行う必要があります。脳を覆う組織を除去するための代替側面。
- 温かいアガロース(37〜40°C)を3cmの皿に注ぐ。
- 穴あきスプーンを使って脳を拾い上げ、スプーンの底を乾いたティッシュペーパーに叩きつけて余分な液体を取り除きます。脳をアガロース皿に入れます。
注:組織へのアガロースのより良い接着を可能にするために、脳の周囲からできるだけ多くの液体を除去することが不可欠です。 - 液体アガロースの入った皿を氷の上に置きます。小さなスプーンを使って、アガロースを10秒間混ぜて冷却します。脳を皿の真ん中まで操縦する。背側を上にして脳を皿に水平に置き、あらゆる方向からアガロースで完全に覆われていることを確認します(図3K)。
注:脳は、一度アガロースに入れられると、しばしば皿の底に沈むでしょう。脳の下に1〜2mmの隙間が形成されるまで、小さなスプーンを使用して脳を持ち上げます。 - すべての脳について、手順7.8~7.10を繰り返します。
- アガロースが重合したら、乾燥を防ぐためにアガロースブロックの上に500μLのHBSS-Gを加えます。それから、皿を氷で覆います。
注:脳の温度が4°Cに達するように、切断する前にサンプルを氷の上に5分間保管してください。
8. 有機型スライス培養
注:スライス汚染を避けるために、70%〜96%のエタノールでビブラトームとその周辺表面をきれいにしてください。ビブラートームワークステーションのセットアップ( 材料表を参照)を 図3Bに示します。
- ビブラートームバッファートレイに冷たいHBSS-Gを、外側のトレイに氷を充填して、手順全体を通してHBSS-Gを冷たく保ちます。
- バッファートレイ内のHBSS-Gに、バブリングストーンを使用してカーボーゲンを連続的に供給します。
- 新鮮な刃を使って、脳の周りを大きく切り取り(〜2 x 2 cm)、脳を含むアガロースのブロックを取り除き、アガロースを小さな長方形のブロックにトリミングするのに十分なアガロースを取り除きます。
注:このステップでは、脳の矢状軸がビブラトームプレートに対して垂直になり、冠状軸がブレードに平行に揃うようにブロックの角度を調整できます。スライスの取り扱いを容易にするために、脳の背側に約5mmのアガロースを残します。 - 試料ホルダーの中央に粘着性の速い無溶剤スーパーグルーの小さな滴を置き、アガロースブロックの底部を覆う領域に広げます。
- アガロースブロックをそっと拾い上げ、ティッシュペーパーを軽く叩いて底を乾かします。脳の吻側を上にして、標本ホルダーの接着領域にブロックを置きます。試料ホルダーを氷の上に置き、接着剤を1分間乾燥させる。
- 接着剤が乾燥したら、試料ホルダーをバッファートレイに入れます。
- 脳をコロナスライスで15°の角度で切断します。
メモ:スライスの厚さは、用途によって異なる場合があります。ここで、脳を150μmの厚さでスライスした。ビブラトーム速度を1.0〜1.5 mm/sに設定して、余分なアガロースを上にトリミングし、嗅球をトリミングします。切断速度を0.5mm/sに下げて、分析用の皮質スライスを収集します。ほとんどの振動子は、各スライスを収集するために一時停止することができます。スライスの品質の低下やアガロースからの組織の剥離が経験された場合は、切断速度を低下させるか、ビブラトームブレードを交換することが役立ちます。 - きれいなヘラを使用して、脳スライスを収集し、パラフィン(最大5つの脳スライス/メンブレン)を使用して35mmのガラス底皿に固定化したポリテトラフルオロエチレン(PTFE)メンブレンの上に置きます(図3L-M)。
メモ: PTFE メンブレンをワックスを使用して 35 mm のガラス底皿の内側に固定します。これにより、スライス培養培地を添加するとき、およびイメージング中に膜が安定化されます。 - 200 μL のピペットを使用して、PTFE 膜上のスライスの周囲から余分な HBSS-G を除去し、スライスを半乾燥のままにします。
- 500 μLのスライス培地(35°Cに予備加温)をPTFE膜の下の空間に直接加える。
注:媒体を追加するときに膜の下に気泡を形成してはなりません。これにより、全体または部分的なスライスがメディア交換されずに残ります。培養中またはイメージングセッションのたびに、200 μLの培地を交換してください。 - スライスを5%CO2と共に35°Cでインキュベートする。
9. 免疫組織化学
- 1皿あたり4%スクロースを添加した1mLの4%パラホルムアルデヒド(PFA)でスライスを修正します。RTで30分間インキュベートする。
警告: PFA を取り扱うときは、白衣と手袋を着用してください。薬品フードの下で固定工程を行い、PFA廃棄物を適切に処分する。 - スライスを300 μL PBSで5分間2回洗浄する。スライスを24ウェルプレートに移す。
注: この段階で実験を一時停止できます。PBS-NaN3 をスライスに加え、4°Cで保存する。 NaN3は 有毒な化合物である。それを使って溶液を扱うときは、ラボコートと手袋を着用してください。ステップ9.3-9.10は軌道シェーカーで実行される。 - スライスを300 μLの0.1 Mグリシンで4°Cで一晩クエンチする。
- グリシンをPBSでRT 3xで10分間洗い流します。
- スライスを300 μLのPBS-TでRTで2時間透過処理する。
- RTでPBS-T中の10%ヤギ血清を用いて2時間ブロックする。
- 10%ヤギ血清で希釈した300 μLの一次抗体(1:200の希釈液での抗ビメンチン抗体; 材料表を参照)をPBS-T溶液に4°Cで一晩加える。
メモ: 手順 9.8 ~ 9.12 では、蛍光の損失を防ぐためにスライスを光で保護しました。 - 一次抗体をPBSでRT 3xで20分間洗浄する。
注:トリトンX-100を洗い流すためにPBS-Tの代わりにPBSが使用されました。 - 300 μLの二次抗体(Alexa Fluor 488または647のいずれかを1:400の希釈で; 材料表を参照)をRTでPBSに2時間加える。
注:DAPIは、二次抗体を除去した直後に1:10,000の希釈で5分間添加される。 - 二次抗体をPBSでRT 3xで20分間洗浄する。蒸留水2倍で1分間洗浄する。
- スライスを細いブラシを用いてスライドガラスに移し、次いで30°Cで20分間乾燥させた。
- 水性マウント媒体を用いてスライスをマウントする。スライドをRTに一晩保管して、マウントメディアをキュレーションします。
10. 画像取得
注:DNA送達アプローチ(IUEまたはEUE)にかかわらず、スライスは同じ発達年齢範囲(E17.5〜E18.5)で分析された。IUEは、ニューロン前駆細胞が インビボでさらに2日間分裂して発達することを可能にする。一方、EUEは、初期の発達事象の追跡を可能にする。
- チャンバーインキュベーターの電源を入れ、5%CO2で35°Cに設定し、理想的にはイメージングの4時間前に顕微鏡コンポーネントを35°Cで平衡化させます。
- スライスを深くイメージングするには、水浸漬対物レンズを使用して、組織と対物レンズの間の屈折率の不一致を低減します。
注:ここでは、超解像イメージングモードが使用されました。PTFE膜を介したイメージングには、長い作動距離(〜1mm)の対物レンズが必要です。長い作動距離の目標が利用できない場合、スライスは8ウェルのガラス底の皿に移すことができます。スライスを転写するには、1 mL のスライス培地を膜の上部に加え、ヘラを使用してスライスを持ち上げ、200 μL の培地を含むウェルに移します。1 mL ピペットチップを使用して余分な培地を除去し、スライスを半乾燥させます。 - 軸索の成長をイメージングするために、低〜中程度の細胞密度を有する皮質の領域を見つける。成長円錐ダイナミクスを画像化するために、皮質の中間ゾーンまたは脳室下ゾーンに成長円錐の位置を特定する。
- 画像処理ソフトウェアで Z スタックのサイズを定義します( 材料表を参照)。大きなzスタックでの軸索成長のために、ステップサイズを2μmに設定する。より小さい Z スタック内の成長円錐の場合、ステップ サイズを 1 μm に設定します。
注: X、Y、および z 平面を通る成長円錐と軸索の潜在的な移動を常に考慮してください。軸索は、 in vitro 培養よりも有機型培養においてはるかに高い速度で増殖する。ここでは、軸索の成長を画像化するには80μm前後のzスタックで十分であった。成長円錐ダイナミクスの場合、約6μmのzスタックが適切であった。 - より広い領域のニューロンの軸索成長を画像化するために、タイルスキャンを定義する。
- 可能な限り低いレーザー出力を使用して、取得中に成長コーンが漂白する可能性を最小限に抑えます。
- 軸索の成長をイメージングするには、5 分の間隔で 2 時間のタイムラプスを取得します。成長円錐ダイナミクスをイメージングするには、2.5〜3秒の間隔で2〜5分間のタイムラプスを取得します。
11. データ分析
- キモグラフを使用して軸索成長の速度を測定する
- フィジー14 で画像ファイルを開き 、[ファイルを開く]>して 画像を選択します。
- 画像>スタック>Z投影>最大強度投影を使用して、タイムラプスの最大強度投影を取得します。
- タイムラプスを通過し、成長している軸索を見つけます。
- 見つかったら、成長している軸索に線を引きます。最初のフレームの軸索の先端から始めて、タイムラプス全体を通して軸索をたどります。
- プラグイン KymoResliceWideを使用してキモグラフを生成します。
- キーモグラフのスケールを設定するには、[ 画像>プロパティ]に移動します。ピクセル幅で距離を μm 単位で設定し、 ピクセルの高さで時間をsまたは分で設定します。
- 分析>測定に進みます。
注: x 軸に対する角度が与えられます。 - 軸索の成長速度を計算するには、角度をスプレッドシートの SIN(RADIANS(θ))/COS(RADIANS(θ)) の式に代入します。
- 画像解析ソフトウェアを使用して成長円錐の体積を測定し ます(材料表を参照)。
- 画像解析ソフトウェアで「ファイルを開く」で画像 ファイルを開き、 目的のファイル>選択します。
- 「 新規サーフェスの追加」 ウィザードを選択します。
メモ: 左下隅のセクションが表示され、手動編集の 6 つの手順が表示されます。 - 手順 1 の [アルゴリズム設定] で 、[対象領域のみをセグメント化] を選択します。ステップ 2 では、すべてのフレームの成長円錐全体に収まるようにフレームをトリミングします。
- 手順 3 でしきい値を [絶対強度] に保ち、手順 4 で成長円錐領域全体がしきい値になっていることを確認します。
- ステップ 5 で、[フィルターの種類] で [ボクセル数 lmg = 1] を選択します。
メモ: 最後のステップでは、複数の測定セットを作成できます。ここでは、体積に対して作成された測定値は 1 つだけでした。 - 「 実行」(Execute ) ボタンを選択してすべての作成ステップを実行し、 新規サーフェスの追加ウィザードを終了します。
- ウィザード・ウィンドウの上部にある「統計」タブで、「詳細」タブの下にある「特定の値とボリューム」を選択します。
結果
記載された方法ワークフローで得られた代表的な結果が示されている。E15.5マウスが本実証で使用されたが、このプロトコルはE11からE17後期までの事実上すべての胚年齢に容易に適応可能である。このプロトコルでは、子宮外エレクトロポレーション(EUE;図2A、2C−I)または子宮エレクトロポレーション(IUE;図2B、C、および2J−Q)を用いて、プラスミドを側脳室を裏打ちする前駆ニューロンに送達した。これらの前駆細胞は、将来の皮質突出ニューロン(CPN)の源である15,16。膜標的(Lyn)-mNeonGreen(図1A)またはLifeAct増強(E)GFP(図1B)のいずれかのまばらなニューロン特異的発現を駆動するようにプラスミドミックスを調製し、それぞれ成長円錐における全体的な挙動およびアクチンダイナミクスを評価した。さらに、個々のニューロンをturbo(t)-RFPまたはzoanthus sp.(Zs)緑色蛍光タンパク質(ZsGreen)のいずれかで標識することを目的としたプラスミドミックス(図1C)が含まれていた。これにより、独立した隣接ニューロンからの成長円錐行動のモニタリングが容易になる。
エレクトロポレーションされた胚からの脳解剖は、天然の脳構造を維持しながら、高品質のスライスを得るために慎重に行う必要がある重要なステップです。解剖器具およびビブラトームを予め調製し、注意深くエタノール滅菌した(図3A、B)。次に、エレクトロポレーションされた胚の頭部を注意深く解剖し、脳を抽出した。ここでは、E15(図3C-F)およびE12.5(図3G-J)でEUEを受けた胚からの脳の代表的な解剖が示されている。脳を直ちにアガロースマトリックスに包み、スライスし、インキュベーションのために底ガラス皿内のPTFE膜インサート上に置かれる(図3K-M)。
脳スライスの健康状態は、信頼性の高い結果を保証するための制御にとって重要なポイントです。汚染がないか目視検査を毎日実施した。さらに、培養が確定したら、脳スライスを固定し、免疫組織化学に供する。ここで、4',6-ジアミジノ-2-フェニルインドール(DAPI)を用いて、グリア組織を明らかにするために、全体的な細胞組織およびビメンチン染色を制御した。特に、放射状グリア(RG)足場。典型的には、IUEまたはEUEのいずれかに由来する首尾よく培養された脳スライスは、DAPIおよび頂端配向した孔鞘接触プロセス17 を有するRGの幾分組織化された配列によって明らかにされるように、正常な細胞分布を示す(それぞれ図4A、B)。時折、培養脳スライスにおけるRG足場の顕著な障害が、特にEUEエレクトロポレーションに由来するものにおいて観察される(図4C)。極端に組織化されていないRG足場を有する脳スライスは、ニューロン遊走障害および軸索成長の欠陥を示す(図示せず)。したがって、RG足場を制御することは、信頼性の高い脳スライスから得られたデータをソートするための簡単な後培養方法です。
Lyn-mNeonGreen発現プラスミドミックスを用いたIUEまたはEUEのいずれかに由来する脳スライスは、同様のまばらなニューロン標識をもたらす。Lyn-mNeonGreen とその成長円錐の動的挙動を表す代表的なピラミッド型 CPN を例として示します (図 5A および 補足ビデオ 1、 左上)。さらに、ニューロンをアクチンプローブを発現するプラスミドを用いて標識し、その場で軸索成長円錐のアクチン動態を分析し た (図5B および 補足ビデオ1、 左下)。また、デュアルCre/Dre蛍光色素発現プラスミド設計を用いて in situ 実験も実施しました(図1C および 補足ビデオ1、右)。このプラスミド中のtRFPまたはZsGreen蛍光色素は、隣接するニューロンにおいて、それぞれDreまたはCreリコンビナーゼのいずれかによって特異的かつ個別に活性化され得る(図5C)。この実験ラインアップは、隣接する修飾ニューロン(任意の所与の機能の損失または利得)を有する対照ニューロンからの成長円錐の並列分析を可能にする。これにより、異なるスライスを使用して制御条件と実験条件をテストすることから生じる変動性が回避されます。
記録した動画から生成されたキモグラフを解析し、そこから経時的な突出活動や成長長などの動的成長パラメータを容易に求めることができます(図6A)。なお、タイムラプスの時間分解能を簡易に調整することで、軸索伸長速度を2時間測定できる(図6A)。さらに、成長円錐体積の経時変化(一般的な成長円錐動的活動の尺度)は、この場合、ライセンスされたソフトウェアを使用して容易に得ることができる(図6Bおよび図6E,F)。これは、アクチントレッドミリングの速度および成長円錐探索活動中のフィロポディア/ラメリポディアのバランスを評価するために使用することができる。
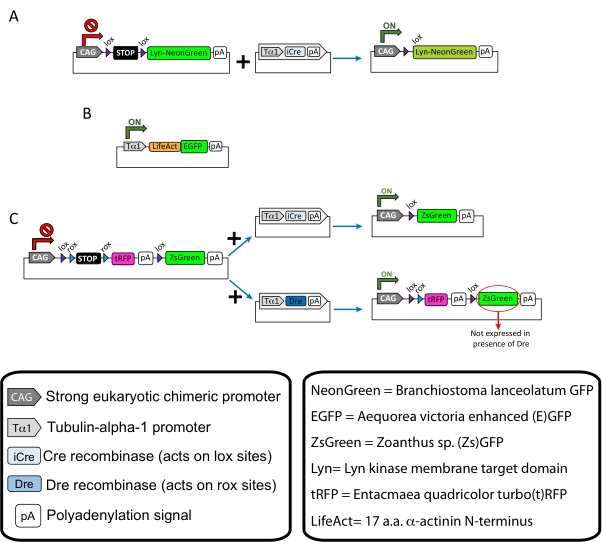
図1:プロトコルで使用されたプラスミドのスキーム。 (A)pCAG-lox-STOP-lox-Lyn-mNeonGreen.(B) p-Tub-α-1-LifeAct-GFP.(C) pCAG-lox-rox-STOP-rox-tRFP-pA-lox-ZsGreen-pA.プラスミド成分と蛍光色素分子の起源に関する関連情報は、ボックスに記載されています。 この図の拡大版を表示するには、ここをクリックしてください。
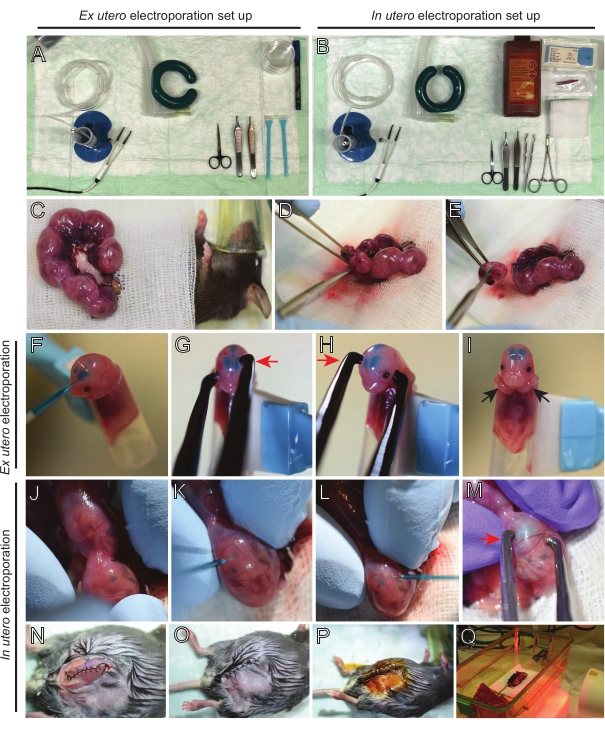
図2:E15.5マウスの子宮外および子宮内エレクトロポレーションのワークフロー。 (A)子宮外エレクトロポレーションのための手術ステーションの設置。(B)子宮内エレクトロポレーションのための手術ステーションの設置。(c)麻酔マウスの腹腔の外側に引き出された子宮角。(D)子宮袋からの胚の抽出。(e)対角線切開を介した完全な脊髄切断による胚屠殺;斬首は避けられたことに注意してください。(F)胚をホルダーに入れ、DNA/ファストグリーン混合液を左側脳室に注入する。(G,H)胚の頭を白金ピンセット電極の間に配置して、陰極(赤い矢印)を皮質の上に60°の角度で配置します。(I)胚の腕(黒い矢印)をホルダーの外側に配置し、処置中の胚の滑りを防止する。(J)子宮袋内の胚を回転させて頭を露出させる。(K、L)子宮壁を通って胚の側脳室へのDNA/ファストグリーン混合物の注入。(M)胚の頭を白金ピンセット電極の間に、陰極(赤い矢印)を皮質の上に60°の角度で配置する。(n)ランニングロック縫合糸を介して筋肉切開を縫合する。(O)中断された縫合糸を介して皮膚切開を縫合する。(P)外科的創傷クリップを用いた創傷の固定及びベタジンを用いた消毒。(Q)遠赤外線加温光による回収ケージへのマウスの配置。この図の拡大版を表示するには、ここをクリックしてください。

図3:E15.5およびE12.5脳の抽出および器官型スライス培養手順。 (A)脳の抽出手順に使用するツール。(B)有機型培養ステーションの設置(C-F)E15.5脳の抽出。(ジージー)E12.5脳の抽出。点線は切開部の位置を強調する。赤い矢印は鉗子で引っ張る方向を指しています。(K)3%の低融点アガロースを含む3cm皿に脳を埋め込み、脳の下に1〜2mmのアガロース間隔の隙間を残す。(L)150μmの脳スライスの収集。(m)パラフィン膜を用いた35mmディッシュに固定化したPTFE膜インサート上の脳スライスの配置(青矢印)。赤い星印は、ビブラートーム(L)からの所与の脳スライス収集およびPTFE膜へのその移動(M)を示す。この図の拡大版を表示するには、ここをクリックしてください。
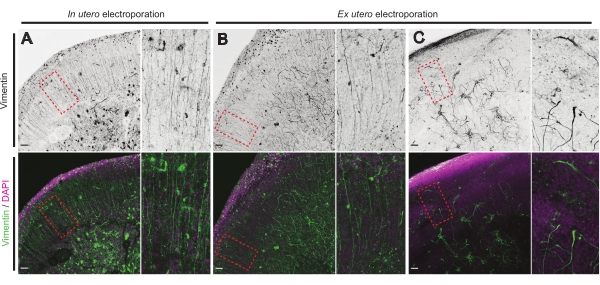
図4:健康な有機型スライスにおける保存された放射状グリア細胞構造。 IUE(A)およびEUE(B,C)に続くRGアレイ(ビメンチン;緑色)および全細胞組織(DAPI;マゼンタ)を明らかにするE17.5脳スライスの共焦点画像。RGアレイの強い外乱は、EUE(C)によって時折生じる可能性があることに注意してください。倍率は、メイン図の赤い点線のフレーム(スケールバー、10 μm)に対応しています。 この図の拡大版を表示するには、ここをクリックしてください。
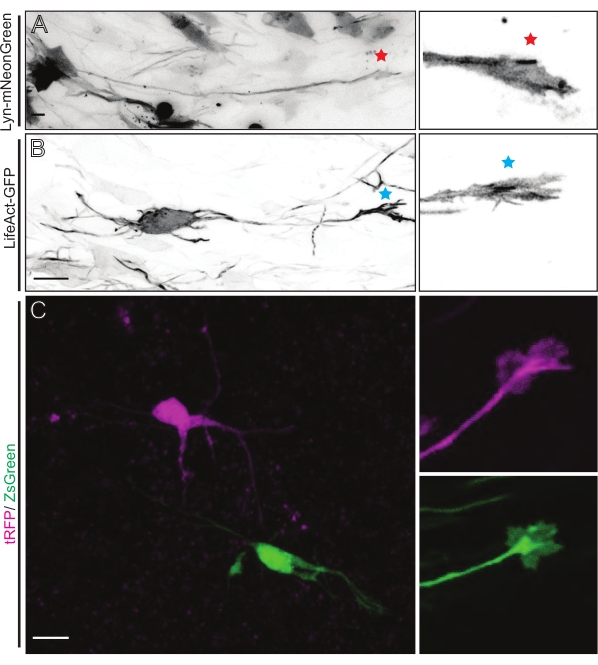
図5:急性有機型スライスにおける成長円錐ダイナミクスの in situ 可視化。 (A,B)ニューロンおよびそれらに対応する成長円錐形は、それぞれLyn-mNeonGreenおよびLifeAct-GFPで標識されている。リン-mNeonGreen発現ニューロンの成長円錐を示す赤い星。LifeAct-GFP発現ニューロンの成長円錐を示す青色のアスタリスク。(C)tRFP(マゼンタ)およびZsGreen(緑色)ならびにそれらに対応する成長円錐を含む二重プラスミド系で標識された隣接ニューロン。画像化された成長円錐形(右)は、キャプチャされたフレームの外側(左)であり、成長円錐タイムラプスを取得した直後に得られた。スケール バー、5 μm。 この図の拡大版を表示するには、ここをクリックしてください。
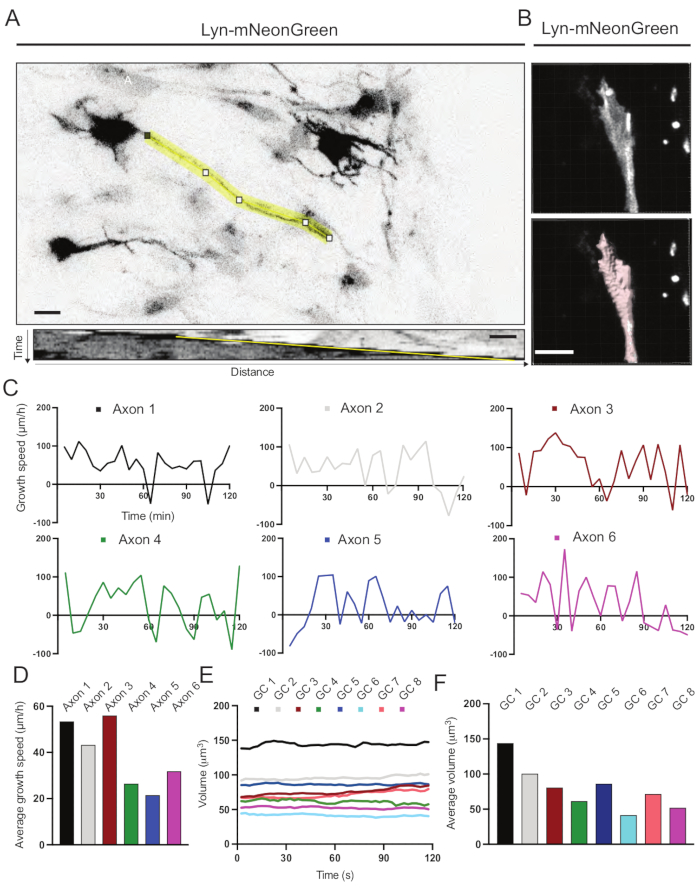
図6:軸索成長速度と成長円錐体積の分析 (A)ImageJを用いて生成されたLyn-mNeonGreen(上)およびそれに対応するキモグラフ(下)を発現するニューロン上の軸索トレース。(B)画像解析ソフトを用いた成長円錐のzスタック映像の再構成(上図)と、表面計測ツールでハイライト表示した同じ成長円錐(下図)。(c)いくつかの軸索について経時的な成長速度の変化を示すグラフ。(d)(C)において軸索の平均成長速度を定量化する。(e)経時的な成長円錐体積の変化を示すグラフ。(F)成長円錐の平均体積は、(E)において定量化される;スケール バー、5 μm。 この図の拡大版を表示するには、ここをクリックしてください。
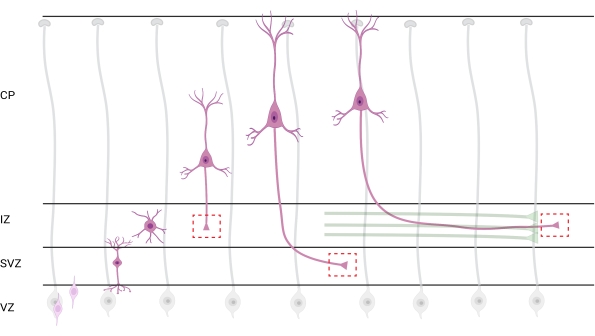
図7:錐体皮質ニューロンの放射状移動とニューロン分極 発達している錐体皮質ニューロン(ピンク色)が胚室室帯(VZ)からぴあ表面に向かって放射状に移動する様子を示す図である。放射状グリアプロセス(灰色)に導かれて、分極ニューロンの移行は、中間ゾーン(IZ)に向かって下方に延び続ける先行プロセス、将来の樹状突起、および後続プロセス、将来の軸索を確立する。破線の赤いボックスは、成長円錐が画像化された皮質領域を表す。具体的にはIZ、脳室下帯(SVZ)、または結合軸索束(緑色)である。このイラストは、Web ベースのツール BioRender.com を使用して作成されました。 この図の拡大版を表示するには、ここをクリックしてください。
| プラスミド | 濃度(μg/μL) | 使用目的 |
| pCAG-lox-STOP-lox-Lyn-mNeonGreen | 0.25 | 膜標的タンパク質(Lyn)の標識 |
| + | + | |
| p-Tub-α-1-iCre | 0.08 | |
| p-浴槽-アルファ-1-ライフアクト-GFP | 0.125 | 成長円錐における糸状アクチン(F-アクチン)標識 |
| pCAG-lox-rox-STOP-rox-tRFP-lox-Lyn-ZsGreen | 1 | 隣接するニューロンの2つの集団の独立した標識 |
| + | + | |
| p-Tub-α-1-iCre | 0.004 | |
| + | + | |
| p-浴槽-アルファ-1-ドレ | 0.2 |
表1:プロトコルで使用したプラスミドのリスト。 各利用プラスミドの名称、濃度、及び使用目的。
補足ビデオ1:急性器官型スライスにおける成長円錐ダイナミクスのin situ可視化。 Lyn-mNeonGreen(左上)とLifeAct-GFP(左下)でラベル付けされた成長円錐のダイナミクス。隣接する成長円錐体は、tRFP(マゼンタ、右上)およびZsGreen(緑色、右下)を含む二重プラスミド系で差動的に標識される。イメージング間隔、2.5秒スケール バー、5 μm。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
成長円錐体が周囲の環境をどのように感知し、反応して軸索の伸長とガイダンスを同時に調整するかは、まだ議論の余地があります3,18。2D基板における先駆的な研究は、軸索形成、外生、およびナビゲーション中に成長円錐ダイナミクスを駆動する力を生成する基本的な分子メカニズムを垣間見ることができた2,10,11,12,19。より最近では、3D行列の研究は、3次元が成長円錐の挙動、ひいては軸索の成長にどれほどの影響を与えるかを明らかにした8,9。それにもかかわらず、インビボでの成長円錐ダイナミクスを指示する複雑なメカニズムは、まだ徹底的に検討されていない。
IUEまたはEUE脳からの有機型スライス培養物の調製は広く利用されており、十分に文書化されている。これは、科学者が生きている脳組織におけるニューロンの発達と行動についての洞察を得ることを可能にする黄金の標準となっています20,21。実際、この技術は、その場で特定の分子プロセスおよび形態学的事象を視覚化するために、様々な高解像度イメージング技術と組み合わせて首尾よく利用されている。このような研究には、軸索形成および伸長19、22、皮質ニューロン遊走19、22、23、24、セントロソームダイナミクス25、26、微小管ダイナミクス27、ならびにシナプス前部およびシナプス前部28、29の機能的ダイナミクスが含まれる。
このプロトコルは、実験的神経生物学におけるギャップに対処し、 その場で皮質ニューロンを発達させる成長円錐ダイナミクス、 ex vivo 急性脳スライス培養物、および得られたデータを分析するためのツールを視覚化する。
急性脳スライス培養物は、(1)いくつかの実践では、生成が容易であるため、このプロトコルを確立するために利用された。(2)準生理学的環境に埋め込まれた成長円錐を研究するためのアクセス可能なシステムを提示するが、高解像度の生細胞イメージングを可能にするのに十分透明である。(3)無数のトランスジェニックマウス系統と共にその使用のために拡張することができる;(4)IUEまたはEUEのいずれかと組み合わせることで、蛍光レポーターおよび細胞骨格プローブとともに、機能レジームの喪失/獲得下でのインビボでの成長円錐および軸索の性能を評価するための分子ツールを提供する事実上無限の可能性を提供する。
この方法論は、EUEとIUEの両方の文脈で記述された。依然として信頼性の高い方法であるが、EUEは、送達方法としてIUEを用いて得られたものと比較して、無秩序なRGネットワークを示す脳スライスの発生率の増加をもたらした(図4C)。RGアレイにおける外乱は、ニューロン遊走および軸索伸長のパターン30、31に強く影響する。これらは、特定の時点で分析用の軸索を見つける場所と、それらがナビゲートしている環境の種類を予測する重要なパラメータです。著しく破壊されたRGネットワークを有する脳スライスは、典型的には、皮質ニューロン層別形成の障害を有する。これは、順番に、混沌とした軌道を持つ軸索を生成します。したがって、RGネットワークの構造的完全性を制御することを強くお勧めします。興味深いことに、構造的完全性の低さは、胚性脳の年齢の増加と相関する。実際、若いE12.5-E13.5胚においてそのような効果は典型的には観察されなかった19。
現在のプロトコルは徹底的かつ単純です。それにもかかわらず、最適な結果を得るために特別な注意と注意を払わなければならないいくつかの重要なステップがあります。これらはプロトコルに明示的に記載されており、(1)エレクトロポレーションで使用されるDNAの量を調整してまばらな標識を得ることを含む。(2)脳の抽出中の損傷を避ける;(3)脳ケーシング中のアガロースの温度を制御する工程;(4)所定の年齢の脳に対するアガロースの理想的な割合をトラブルシューティングする。(5)蛍光色素の選択、その経験は以下の通りである。プロトコルの最適化中に、生細胞in situイメージングにおける いくつかの蛍光色素の性能が試験されました。LifeActタグ付きプラスミドおよびLynタグ付きプラスミドの調製のための単量体GFP変異体EGFPおよびNeonGreenを、このプロトコールについて選択した(図5A、B)。さらに、RFPバリアントmScarletがテストされ、このセットアップに非常に適していることが判明しました(データは示されていません)。多量体tRFP(二量体)およびZsGreen(四量体)(図5C および 補足ビデオ1、 右)も試験した。これらの高速フォールディング超高輝度蛍光色素分子は、DNA送達後に迅速な蛍光シグナル生成が必要な場合に推奨されます。
スライス培養を使用する際の一般的な方法は、異なる脳からのスライスを利用して、制御および実験条件をテストすることです。これは、望ましくない変動性の固有の原因を表します。ここでは、同定のために隣接するニューロンおよびレポーターの発現の独立した改変を可能にする発現系を用いた。なお、このデモンストレーション(図5C)では、いずれの蛍光色素分子を発現するニューロン間に差異はなかった。しかしながら、一例として、Cre感受性遺伝子を保有するトランスジェニックマウス系統と組み合わせたこのようなプラスミドミックスは、野生型として残ったtRFP(Dre感受性)ニューロンで標識するであろう。対照的に、ZsGreen(またCre感受性)は、組換えニューロンにラベルを付けます。したがって、2つの異なる遺伝子型の成長円錐形、そしておそらく表現型も、同じ脳スライス内で同時に並べて研究することができた。
分析のための軸索および成長円錐の局在化は重要な考慮事項である。皮質ニューロンは、心室帯(VZ)から皮質板(CP)に向かって放射状に移動しながら分極する。このプロセスの間、ニューロンは、軸索となる先行プロセス(将来の樹状突起)および後続プロセスを形成し、最終的に中間ゾーン(IZ)における先駆的な軸索を結合し、軸索管32を確立する。したがって、軸索成長円錐体を捕捉するために、CPから出る軸索および軸索束に既に関連する早期に生成された軸索を含む、IZ内の軸索線維についてイメージングが行われた。または最終的には、IZを横切ってその下に延びる繊維で(図7)。
このプロトコルは、有機型スライス内のニューロンの超解像イメージングを実行することを実現可能にする。歴史的に、光散乱は厚い試料をイメージングする際に直面する大きな問題でした。過去20年間、光学技術の広範な進歩により、厚い試料のイメージングが可能になりました。ここでは、成長円錐などの小さな構造をよりよく視覚化するために、長い作動距離対物レンズを使用しました。必然的に、このプロトコルは、逆行性アクチン流または微小管ダイナミクスなどのより詳細な事象を捕捉しない。長い作動距離対物レンズは、より低い開口数(NA)を必要とし、厚いスライスからの情報を保持します。しかし、このプロトコルを作動距離の短縮を目的として使用するために適合させることも可能であった。これには、構造的完全性を維持するために、スライスをガラス底の皿にスムーズに移す必要がありました。しかし、この方法を使用すると、ガス交換の喪失により、生存期間が短くなり、〜15時間が短縮されました(データは示されていません)。2D カルチャとは異なり、3D の成長円錐はより大きな体積を占め、Z 軸での動き - アーチファクト補正を必要とします。詳細な事象を画像化する能力を高めるためには、現代の共焦点技術を利用する必要があります。したがって、高感度共焦点顕微鏡33で利用可能なz−Galvoのような高速走査zスタックモータを使用することが推奨される。
注目すべきは、このプロトコルには 3 つの主な制限があります。第1に、任意のプラスミドの発現レベル/発現細胞数を インビボで制御することはしばしば困難である。これにより、同じプラスミド濃度を維持した場合でも、すべてのスライス間にばらつきが生じます。したがって、使用する発現ベクターにおける調節エレメントの選択は、注意して予め決められていなければならない。第二に、メンブレンインサートを用いて詳細な事象を画像化することは、現在実現不可能である。この第2の制限は、前の段落で提案された方法論的更新によって克服することができる。最後に、成長円錐は非常に感光性があり、すぐに光漂白される可能性があります。したがって、成長円錐の頻繁な画像化は、レーザー走査顕微鏡を用いてわずか5分間、成長円錐を崩壊させることが多い。これに関して、生成された装置のライトシート顕微鏡における新たな進歩は、脳スライス34の長期画像化に適合させることができる。
このようなプロトコルは、新しい研究の道を開き、成長円錐が複雑な in vivo 環境を読み取って反応するために必要なものをよりよく理解できるようにし、さらに重要なことに、この洗練された相互作用のメカニズムを解明することが想定されています。
開示事項
著者らは開示するものは何もありません。
謝辞
手順を撮影してくれたマリア・エウジェニア・ベルニスに感謝します。また、原稿を読んで議論してくれたエミリー・バーンサイド、エミリー・ハンドリー、ソーベン・ピエトララ、マックス・シェルスキー、シーナ・スターンにも感謝します。私たちは、優れた技術アシスタントであるジェシカ・ゴニエ、ブランカ・ランデル、アン・トゥアン・ファムに感謝しています。我々は、DZNEの光学顕微鏡施設及び動物施設の貴重な支援を認識する。この研究は、Deutsche Forschungsgesellschaft(DFG)、International Foundation for Research in Paraplegia(IRP)、Wings for Life(F.B)の支援を受けました。F.B.は、エクセレンスクラスターImmunoSensation2、SFBs1089および1158のメンバーであり、Roger De Spoelberch Prizeを受賞しています。
資料
| Name | Company | Catalog Number | Comments |
| Adson Forceps | Fine Science Tools | 11006-12 | |
| Alexa Fluor 488 | Invitrogen | A21202 | Goat Anti-Mouse |
| Alexa Fluor 647 | Invitrogen | A21236 | Goat Anti-Mouse |
| Anti-Vimentin antibody | sigma-Aldrich | V2258-.2ML | Monoclonal mouse, clone LN-6, ascites fluid |
| B27 supplement | ThermoFisher Scientific | 17504044 | |
| Betadine | B. Braun | 3864154 | |
| Biozym Sieve GP Agarose | Biozyme | 850080 | |
| Braunol, Sprühflasche | B. Braun | 3864073 | |
| Buprenorphine (Temgesic) | GEHE Pharma | 345928 | |
| DAPI | sigma-Aldrich | D9542 | |
| DMZ unevirsal electrode puller | Zeitz | NA | |
| Electric razor | Andes | NA | ProClip UltraEdge Super 2-Speed model |
| Enrofloxacin (Baytril) | Bayer | 3543238 | 2,5% (wt/vol) |
| Eppendorf microloader pipette tips | FischerScientific | 10289651 | |
| Fast Green FCF | Sigma-Aldrich | F7252-5G | Dye content ≥ 85 % |
| Fetal Bovine Serum | ThermoFisher Scientific | 10500064 | |
| Fiji 2.1.0 | NIH | NA | https://imagej.net/software/fiji/downloads |
| Fine Scissors | Fine Science Tools | 14058-09 | ToughCut/Straight/9cm |
| FluoroDish Cell Culture Dish | World Precision Instruments | FD5040-100 | |
| Fluoromount Aqueous Mounting Medium | sigma-Aldrich | F4680-25ML | |
| Glucose | MedPex | 3705391 | 5% |
| GlutaMAX Supplement | ThermoFisher Scientific | 35050061 | |
| Glycine | Sigma-Aldrich | G8898 | |
| HBSS | Life Technologies | 14025092 | calcium, magnesium, no phenol red |
| Horse serum | Pan-Biotech | P30-0711 | |
| Imaris 9.7.2 | Bitplane | NA | https://imaris.oxinst.com/products/imaris-for-neuroscientists |
| Isoflurane | Virbac | NA | |
| Isotonic saline solution | B. Braun | 8609261 | 0.90% |
| Leica VT1200 S vibratome | Leica | 14048142066 | |
| LSM 880 with Airyscan | Zeiss | NA | |
| Metacam | Venusberg Apotheke | 8890217 | 5 mg/ml |
| Mice | Janvier Labs | NA | C57BL/6JRj |
| Micro-Adson Forceps | Fine Science Tools | 11018-12 | |
| Micropipette Storage Jar | World Precision Instruments | E210 | 16.16.27 |
| Microsoft Excel | Microsoft | NA | https://www.microsoft.com/en-us/microsoft-365/p/excel/cfq7ttc0k7dx?activetab=pivot:overviewtab |
| Millicell Cell Culture Insert | EMD Millipore | PICM0RG50 | 30 mm, hydrophilic PTFE, 0.4 µm |
| Moria Perforated Spoons | Fine Science Tools | 10370-18 | |
| Moria Spoon | Fine Science Tools | 10321-08 | |
| Neurobasal Medium, minus phenol red | ThermoFisher Scientific | 12348017 | |
| Neuropan-2 supplement | Pan-Biotech | P07-11010 | |
| Normal goat serum | Abcam | ab138478 | |
| Olsen-Hegar Needle Holder with Scissors | Fine Science Tools | 12002-12 | |
| p-Tub-alpha-1-Dre | Addgene | 133925 | |
| p-Tub-alpha-1-iCre | Addgene | 133924 | |
| p-Tub-alpha-1-LifeAct-GFP | Addgene | 175437 | |
| Parafilm | VWR | 52858-000 | |
| Paraformaldehyde | sigma-Aldrich | P6148 | |
| PBS | Sigma-Aldrich | P3813-10PAK | |
| pCAG-lox-rox-STOP-rox-tRFP-lox-Lyn-ZsGreen | Addgene | 175438 | |
| pCAG-lox-STOP-lox-Lyn-mNeonGreen | Addgene | 175257 | |
| Penicillin-Streptomycin | ThermoFisher Scientific | 15140122 | |
| PicoNozzle Kit v2 | World Precision Instruments | 5430-ALL | |
| Platinum Tweezertrodes | Harvard Apparatus | 45-0487 | 1 mm / 3 mm |
| QIAGEN Maxi kit | QIAGEN | 12162 | |
| Reflex wound closure Clip | World Precision Instruments | 500344-10 | 7 mm |
| Sekundenkleber Pattex Mini Trio | Lyreco | 4722659 | |
| Square wave electroporation system ECM830 | Harvard Apparatus | W3 45-0052 | |
| Sterile gauze | Braun Askina | 9031216 | |
| Sterile lubricant eye ointment | Bayer Vital | PZN1578675 | |
| Sterile surgical gloves | Sempermed | 14C0451 | |
| Sucrose | Roth | 4621.2 | |
| Supramid 5-0 surgical silk sutures | B. Braun | NA | |
| Thin-wall glass capillaries | World Precision Instruments | TW100-4 | |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Vannas spring scissors | Fine Science Tools | 15000-03 | |
| µ-Slide 8 Well Glass Bottom | Ibidi | 80827 |
参考文献
- Schelski, M., Bradke, F. Neuronal polarization: From spatiotemporal signaling to cytoskeletal dynamics. Molecular and Cellular Neurosciences. 84, 11-28 (2017).
- Lowery, L. A., Van Vactor, D. The trip of the tip: understanding the growth cone machinery. Nature Reviews: Molecular Cell Biology. 10 (5), 332-343 (2009).
- Stoeckli, E. T. Understanding axon guidance: are we nearly there yet. Development. 145 (10), (2018).
- Bradke, F., Dotti, C. G. The role of local actin instability in axon formation. Science. 283 (5409), 1931-1934 (1999).
- Neukirchen, D., Bradke, F. Cytoplasmic linker proteins regulate neuronal polarization through microtubule and growth cone dynamics. Journal of Neuroscience. 31 (4), 1528-1538 (2011).
- Witte, H., Bradke, F. The role of the cytoskeleton during neuronal polarization. Current Opinion in Neurobiology. 18 (5), 479-487 (2008).
- Witte, H., Neukirchen, D., Bradke, F. Microtubule stabilization specifies initial neuronal polarization. Journal of Cell Biology. 180 (3), 619-632 (2008).
- Nichol, R. H., Catlett, T. S., Onesto, M. M., Hollender, D., Gomez, T. M. Environmental elasticity regulates cell-type specific RHOA signaling and neuritogenesis of human neurons. Stem Cell Reports. 13 (6), 1006-1021 (2019).
- Santos, T. E., et al. Axon growth of CNS neurons in three dimensions is amoeboid and independent of adhesions. Cell Reports. 32 (3), 107907(2020).
- Mitchison, T., Kirschner, M. Cytoskeletal dynamics and nerve growth. Neuron. 1 (9), 761-772 (1988).
- Lin, C. H., Thompson, C. A., Forscher, P. Cytoskeletal reorganization underlying growth cone motility. Current Opinion in Neurobiology. 4 (5), 640-647 (1994).
- Myers, J. P., Gomez, T. M. Focal adhesion kinase promotes integrin adhesion dynamics necessary for chemotropic turning of nerve growth cones. Journal of Neuroscience. 31 (38), 13585-13595 (2011).
- Turney, S. G., et al. Nerve growth factor stimulates axon outgrowth through negative regulation of growth cone actomyosin restraint of microtubule advance. Molecular Biology of the Cell. 27 (3), 500-517 (2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Noctor, S. C., Flint, A. C., Weissman, T. A., Dammerman, R. S., Kriegstein, A. R. Neurons derived from radial glial cells establish radial units in neocortex. Nature. 409 (6821), 714-720 (2001).
- Noctor, S. C., Martinez-Cerdeno, V., Ivic, L., Kriegstein, A. R. Cortical neurons arise in symmetric and asymmetric division zones and migrate through specific phases. Nature Neuroscience. 7 (2), 136-144 (2004).
- Ferent, J., Zaidi, D., Francis, F. Extracellular control of radial glia proliferation and scaffolding during cortical development and pathology. Frontiers in Cell and Developmental Biology. 8, 578341(2020).
- Dent, E. W., Gupton, S. L., Gertler, F. B. The growth cone cytoskeleton in axon outgrowth and guidance. Cold Spring Harbor Perspectives in Biology. 3 (3), (2011).
- Dupraz, S., et al. RhoA controls axon extension independent of specification in the developing brain. Current Biology. 29 (22), 3874-3886 (2019).
- Azzarelli, R., Oleari, R., Lettieri, A., Andre, V., Cariboni, A. In vitro, ex vivo and in vivo techniques to study neuronal migration in the developing cerebral cortex. Brain Sciences. 7 (5), (2017).
- Humpel, C. Organotypic brain slice cultures: A review. Neuroscience. 305, 86-98 (2015).
- Namba, T., et al. Pioneering axons regulate neuronal polarization in the developing cerebral cortex. Neuron. 81 (4), 814-829 (2014).
- Shah, B., et al. Rap1 GTPases are master regulators of neural cell polarity in the developing neocortex. Cerebral Cortex. 27 (2), 1253-1269 (2017).
- Wiegreffe, C., Feldmann, S., Gaessler, S., Britsch, S. Time-lapse confocal imaging of migrating neurons in organotypic slice culture of embryonic mouse brain using in utero electroporation. Journal of Visualized Experiments: JoVE. (125), (2017).
- de Anda, F. C., Meletis, K., Ge, X., Rei, D., Tsai, L. H. Centrosome motility is essential for initial axon formation in the neocortex. Journal of Neuroscience. 30 (31), 10391-10406 (2010).
- Sakakibara, A., et al. Dynamics of centrosome translocation and microtubule organization in neocortical neurons during distinct modes of polarization. Cerebral Cortex. 24 (5), 1301-1310 (2014).
- Schatzle, P., Kapitein, L. C., Hoogenraad, C. C. Live imaging of microtubule dynamics in organotypic hippocampal slice cultures. Methods in Cell Biology. 131, 107-126 (2016).
- Qu, X., Kumar, A., Bartolini, F. Live imaging of microtubule dynamics at excitatory presynaptic boutons in primary hippocampal neurons and acute hippocampal slices. STAR Protocols. 2 (1), 100342(2021).
- Tonnesen, J., Katona, G., Rozsa, B., Nagerl, U. V. Spine neck plasticity regulates compartmentalization of synapses. Nature Neuroscience. 17 (5), 678-685 (2014).
- Buchsbaum, I. Y., Cappello, S. Neuronal migration in the CNS during development and disease: insights from in vivo and in vitro models. Development. 146 (1), (2019).
- Rigby, M. J., Gomez, T. M., Puglielli, L. Glial cell-axonal growth cone interactions in neurodevelopment and regeneration. Frontiers in Neuroscience. 14, 203(2020).
- Barnes, A. P., Polleux, F. Establishment of axon-dendrite polarity in developing neurons. Annual Review of Neuroscience. 32, 347-381 (2009).
- Multiphoton Microscope Leica TCS SP8 MP. Microsystems. , Available from: http://www.leica-microsystems.com/products/confocal-microscopes/p/leica-tcs-sp8-sted-one/ (2021).
- ZEISS Lattice Lightsheet 7. Zeiss. , Available from: http://www.zeiss.com/microscopy/int/products/imaging-systems/lattice-lightsheet-7.html (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved