Method Article
Yerinde Akut Ex Vivo Embriyonik Beyin Dilimi Kültürlerinde Akson Büyümesi ve Büyüme Koni Dinamiğinin Görselleştirilmesi
Bu Makalede
Özet
Bu protokol, in situ akson büyümesi ve büyüme konisi dinamiklerini incelemek için basit ve sağlam bir yöntem göstermektedir. Fizyolojik olarak ilgili akut beyin dilimlerinin ex vivo olarak nasıl hazırlanacağını açıklar ve kullanıcı dostu bir analiz boru hattı sağlar.
Özet
Nöronal gelişim sırasında, aksonlar nihai hedeflerine ulaşmak ve sinaptik bağlantılar kurmak için kortikal ortamda gezinirler. Büyüme konileri - gelişmekte olan aksonların distal uçlarında bulunan duyusal yapılar - bu süreci yürütür. Büyüme konisinin yapısını ve dinamiklerini incelemek, aksonal gelişimi ve sinir devreleri oluşturmasını sağlayan çevredeki merkezi sinir sistemi (CNS) ile etkileşimleri anlamak için çok önemlidir. Bu, temel araştırmalarda ve klinik öncesi bağlamlarda yaralanmayı takiben aksonları nöral devrelere yeniden entegre etmek için yöntemler tasarlarken esastır. Şimdiye kadar, büyüme konisi dinamiklerinin genel anlayışı öncelikle iki boyutta (2D) kültürlenmiş nöronların çalışmalarına dayanmaktadır. Kuşkusuz büyüme konisi yapısal dinamikleri ve uyaranlara verilen yanıt hakkındaki mevcut bilgi için temel olmasına rağmen, 2D çalışmalar, bozulmamış CNS dokusunda nöronal büyüme konilerinin karşılaştığı fizyolojik üç boyutlu (3D) ortamı yanlış temsil etmektedir. Daha yakın zamanlarda, bu sınırlamaların bazılarının üstesinden gelmek için kollajen jelleri kullanıldı ve 3D'de nöronal gelişimin araştırılmasını sağladı. Bununla birlikte, hem sentetik 2D hem de 3D ortamlar, CNS dokusu içinde, gelişmekte olan aksonların genişlemesini ve yol bulmasını yönlendiren sinyal ipuçlarından yoksundur. Bu protokol, gelişmekte olan aksonların fizyolojik olarak ilgili fiziksel ve kimyasal ipuçlarıyla karşılaştığı organotipik beyin dilimlerini kullanarak aksonları ve büyüme konilerini incelemek için bir yöntem sağlar. Süper çözünürlüklü mikroskopi ile birlikte floresan muhabirleri seyrek olarak sunmak için ince ayarlı in utero ve ex utero elektroporasyonu birleştirerek, bu protokol akson ve büyüme konisi dinamiklerinin in situ olarak görselleştirilmesi için metodolojik bir boru hattı sunar. Ayrıca, uzun vadeli ve canlı hücre görüntüleme verilerinin analizinin ayrıntılı bir araç seti açıklaması dahil edilmiştir.
Giriş
Nöronlar, sinir sistemindeki temel hesaplama birimini temsil eden oldukça polarize hücrelerdir. Giriş ve çıkış bölgelerinin bölümlere ayrılmasına dayanan bilgileri alırlar ve yayarlar: sırasıyla dendritler ve aksonlar1. Geliştirme sırasında, aksonlar hedeflerine ulaşmak için inanılmaz karmaşık bir ortamda gezinirken uzanır. Akson navigasyonu, gelişmekte olan aksonun ucunda bulunan duyusal bir yapı olan büyüme konisi tarafından yönlendirilir. Büyüme konisi, çevresel ipuçlarını tespit etmekten ve bunları sitoiskelet 2,3'ün dinamik mekansal yeniden düzenlenmesine çevirmekten sorumludur. Ortaya çıkan morfo-mekanik reaksiyonlar, büyüme konisine tetikleyici ipucundan uzamasını veya geri çekilmesini söyler ve bu da spesifik akson manevralarına yol açar.
Akson uzantısı ve büyüme konisi dinamiklerinin mevcut anlayışı, iki boyutlu (2D) substratlar 2,4,5,6,7 üzerinde akson büyümesini değerlendiren çalışmalardan kaynaklanmaktadır. Bu öncü çalışmalar, büyüme konileri ve büyüme substratları arasındaki sofistike etkileşimi tanımladı ve yapışkanlık ve sertlik gibi substrat özelliklerine bağlı çarpıcı farklılıklar ortaya koydu 8,9. Bu içgörülerin öncülüğünde, hücre dışı çevresel ipuçlarının akson büyümesini dikte ettiği varsayılmıştır, büyüme konisi sitoiskeletibu büyümeyi 2,10,11,12 gerçekleştirmiştir. Özellikle, nöronlar yapışkan olmayan substratlardaki aksonları uzatabilir (örneğin, poli-lizin, poli-ornitin)13. Ayrıca, substrat sertliği, hücre yapışkan komplekslerinden bağımsız olarak akson büyüme hızını etkileyebilir8. Bu nedenle, yalnızca 2B substratlardaki büyüme konisi dinamiklerini incelemek, aksonal büyüme konilerinin in vivo bulunanlar gibi fizyolojik olarak ilgili üç boyutlu (3B) ortamlarla etkileşiminden kaynaklanan kuvvetler dengesini doğru bir şekilde modelleyemez.
2D tahlillerin sınırlamalarının üstesinden gelmek için, akson büyümesi ve büyüme konisi dinamikleri 3D matrisler 8,9'da incelenmiştir. Bu matrisler daha fazla fizyolojik bağlam oluşturur, ancak akson büyümesinin hücre içi mekanizmalarının incelenmesine izin verir. Çeşitli koşullarda ve farmakolojik tedavilerde tek hücreli bir şekilde büyüme konisi muayenesine olanak sağlar9. Bu tür 3D ortamlarda, aksonlar farklı sitoiskelet dinamikleri sergiledi ve 2D kültürlü nöronlarda gözlemlenenlerden daha hızlı büyüdü9. Bu zarif çalışmalar, büyüme konisi sitoiskeletinin yeniden düzenlenmesi ve dolayısıyla davranışı üzerinde ekstra bir boyutun etkisini göstermiştir.
3D matrislerin 2D yüzeyler üzerinde yerli benzeri nöronal gelişimi ve akson büyümesini desteklemede sunduğu belirgin avantajlara rağmen, merkezi sinir sistemi (CNS) dokusunda gözlenen dinamiklerin karmaşıklığını yansıtamayan basitleştirilmiş sentetik bir iskele olmaya devam etmektedir. Burada, ex utero ve in utero elektroporasyon ile muhabir plazmidlerinin verilmesi, fizyolojik bir bağlamda büyüme konisi dinamiklerini analiz etmek için beyin organotipik dilim kültürü ve in situ canlı süper çözünürlüklü görüntüleme ile birleştirildi. Bu metodoloji, in vivo ortamların 3 boyutluluğunu ve fizikokimyasal bileşiminin karmaşıklığını deneyimlerken gelişmekte olan aksonların görselleştirilmesine izin verir. Son olarak, yaygın lisanslı ve halka açık yazılımlar kullanarak akson büyümesini ve büyüme konisi dinamiklerini ölçmek için kullanıcı dostu prosedürler açıklanmaktadır.
Protokol
Hayvan deneyleri ilgili kurumsal ve federal düzenlemelere uygun olmalıdır. Bu protokolde embriyonik gün 15.5 ve 12.5 (E15.5 ve E12.5) gebe dişi C57BL/6JRj fareler kullanıldı. Deneyler, Kuzey Ren-Vestfalya Devlet Çevre Ajansı (Landesamt für Natur, Umwelt und Verbraucherschutz (LANUV)) Hayvan Refahı Yasası uyarınca gerçekleştirilmiştir.
1. Plazmidlerin enjeksiyon için hazırlanması
- Endotoksin içermeyen Maxiprep kitini kullanarak DNA'yı üreticinin protokolüne göre izole edin (bkz.
- DNA karışımının beyin ventriküllerine verilmesini görselleştirmek için seçilen DNA'yı istenen konsantrasyonda (Tablo 1) ve% 10 Hızlı Yeşil çözeltide ( Malzeme Tablosuna bakınız) karıştırın.
NOT: Kortikal nöronların seyrek etiketlenmesi (Şekil 1A), büyüme konisindeki filamentli aktin (F-aktin) yapıları (Şekil 1B) ve aynı korteks içindeki büyüme konilerinin çift etiketlenmesi için spesifik plazmidler kullanılmıştır (Şekil 1C). Bu protokolde kullanılan tüm plazmidler (Tablo 1) Addgene'de biriktirilmiştir (bakınız Malzeme Tablosu). - Aşağıdaki programa göre bir kılcal elektrot çektirici seti kullanarak cam kılcal damarlar hazırlayın: basınç: 500, ısı: 800, çekme: 30 ve hız: 40.
- Mikro yükleyici pipet uçlarını kullanarak her cam kılcal damara 15 μL DNA/Hızlı Yeşil karışımı yükleyin.
NOT: Kabarcık oluşmadığından emin olun. - DNA dolu kılcal damarları, kabın çapı boyunca bir parça modelleme kili ile 10 cm'lik bir kapta saklayın. Kılcal damarlar, deneyden bir gün önce 4 ° C'de yüklenebilir ve saklanabilir. Kurumayı önlemek için kılcal damarın arka ucunu esnek filmle kapatın.
2. Çözeltilerin hazırlanması
- Hank'in glikoz (HBSS-G) ile desteklenmiş Tamponlanmış Tuz Çözeltisini hazırlayın.
- 1x HBSS'lik bir şişeye% 20 glikoz stoğunun% 0.5'ini ekleyin. İyice karıştırın ve 4 ° C'de 2 haftaya kadar saklayın. Embriyo ekstraksiyonu için, embriyo toplanmasından kısa bir süre önce köpüren taş kullanarak karbojenli kabarcık HBSS-G çözeltisi (% 95O 2 ve% 5 CO2).
- Dilimleme ortamı çözümü
- Steril koşullar altında Nörobazal 1x,% 5 at serumu,% 5 fetal buzağı serumu,% 5 fetal buzağı serumu, B27 takviyesi 1:50, L-glutamin takviyesi 1:400, penisilin-streptomisin 1:200 ve Neuropan-2 takviyesi 1:100 (pH = 7.3'te) içeren taze dilim ortamı hazırlayın (bkz.
- Her biri 1 mL dilim ortamı ile 3 cm'lik yemekler hazırlayın. Ortamın pH'ını gaz değişimi yoluyla dengelemek için deneyden önce deneyden önce en az 1 saat boyunca% 5 CO2 ile 35 ° C'de inkübatöre yerleştirin.
NOT: Ortam pH dengesi, inkübatörden CO2 tarafından ortamın asitleştirilmesinden kaynaklanır. Dilim ortamı 4 °C'de 1 haftaya kadar saklanabilir.
- Düşük erime noktalı agaroz çözeltisi (%3)
- İstenilen miktarda düşük erime noktalı agaroz tozunu tartın ve bir cam şişede uygun miktarda 1x HBSS-G içinde çözün. Beyin başına yaklaşık 7 mL agaroz çözeltisine ihtiyaç vardır.
- Şişeyi, kapağı gevşek bir şekilde yerleştirilmiş şekilde 2-3 dakika boyunca bir mikrodalga fırına yerleştirin ve her 10-20 saniyede bir çalkalayın.
- Toz tamamen çözündükten sonra, agarozun soğumasını sağlamak için şişeyi deneyden en az 1 saat önce 37 ° C'ye ayarlanmış bir su banyosuna veya boncuk banyosuna yerleştirin.
NOT: Agaroz tozunun çözünmesini sağlamak için agarozun 15 dakika boyunca iki kez ısıtılması önerilir. Bu, agarozun beyin dokusuna uygun şekilde yapışması için çok önemlidir. Beyinleri gömerken agaroz çözeltisinin sıcaklığını ölçmek için bir termometre kullanılmalı ve 37-40 ° C arasında olduğundan emin olunmalıdır. Farklı yaşlı hayvanların beyinleri farklı sertliklere sahiptir. Doku ve agaroz arasındaki homojenliği bulmak için bir dizi agaroz konsantrasyonunun test edilmesi önerilir. - % 0.3 Triton X-100 (PBS-T) ile fosfat tamponlu salin hazırlayın.
- % 0.2 sodyum azid (PBS-NaN3) ile fosfat tamponlu salin hazırlayın.
NOT: Adım 2.4-2.5'te açıklanan çözeltiler, daha sonraki immünohistokimya adımında kullanılmak içindir.
3. Ameliyat istasyonunun hazırlanması
- Ameliyat istasyonunu %70-%96 etanol ile temizleyin ve operasyon altlığını istasyon yüzeyine yerleştirin.
- Ameliyat aletlerini% 70-96 etanol ile durulayarak sterilize edin, ardından sıcak boncuk sterilizatöründe kuru sterilizasyon yapın.
- Darbe jeneratörüne bağlanmadan önce platin cımbız elektrotlarını (Malzeme Tablosuna bakınız) %70-%96 etanol ile temizleyin.
- Kılcal tutucuya DNA/Hızlı Yeşil dolgulu cam kılcal damar yerleştirin. Kullanmadan hemen önce, ince makas kullanarak kılcal ucu yavaşça kırın ve önceden ısıtılmış tuzlu su veya suyla doldurulmuş 1,5 mL'lik bir mikrosantrifüj tüpü içindeki çözelti akışını test edin.
NOT: Şekil 2A,B'de ex utero elektroporasyon (EUE) ve in utero elektroporasyon (İEÜ) için kullanılan cerrahi istasyon kurulumu ve aletler gösterilmektedir. - İEÜ için, bir su banyosunda 37 ° C'ye kadar tuzlu su çözeltisini ısıtın.
4. Embriyo ekstraksiyonu
- Hamile fareyi, fare derinlemesine anestezi altına alınana kadar% 5 izofluran ile anestezi indükleyici odasına yerleştirin. Pedal çekilme refleksinin yokluğunda anesteziyi onaylayın.
- Fareyi bir operasyon altlığına aktarın ve bir burun konisi aracılığıyla% 1.5 -% 2 oranında izofluranı koruyun.
- Kornea kurumasını önlemek için her iki göze de merhem uygulayın.
- Farenin karnını tıraş edin ve daha sonra traş edilmiş saçları çıkarmak için% 70-96 etanol ile ıslatılmış gazlı bez kullanın. Alanı betadin ile temizleyin.
- Steril küçük cerrahi makas kullanarak, karın orta hattı boyunca 2 cm'lik bir cilt kesisi yapın, ardından 1,5 cm'lik bir kas kesisi yapın.
NOT: Kesi büyüklüğü embriyo büyüklüğüne bağlıdır. Gerçekten de, daha büyük embriyolar, ekstraksiyonlarını sağlamak için daha büyük bir kesi gerektirecektir. - Gazlı bezin ortasında, cilt insizyonuna (~ 2 cm çapında) sığacak kadar geniş bir delik açın, ılık salinle ıslatın ve karın açıklığının etrafına yerleştirin.
- Her iki uterus boynuzunu da ılık saline batırılmış bir pamuk tomurcuğu kullanarak veya forseps kullanarak çıkarın, embriyolar arasındaki boşlukları dikkatlice tutarak dışarı çekin. Embriyoları ıslak gazlı bez üzerine yerleştirin (Şekil 2C).
NOT: Rahim boynuzlarının etrafındaki kan damarlarına ve kılcal damarlara küçük bir hasar bile muhtemelen bol miktarda kanamaya neden olacaktır. Bu nedenle, bu vaskülarize alanların her zaman doğrudan kullanılmasından kaçının. - Rahim çuvalını kesin ve her embriyoyu çıkarın (Şekil 2D).
- Her embriyoyu ekstraksiyondan hemen sonra azalan diyagonal bir kesim yoluyla ötenazi yaparak, tam omurilik transeksiyonu sağlar (Şekil 2E).
- Embriyoları buz üzerine HBSS-G içeren 10 cm'lik bir kaba koyun.
NOT: DNA/Hızlı Yeşil karışımın beyinden sızmasını önlemek ve tutucuda kolay embriyo konumlandırmasını kolaylaştırmak için embriyonun kafasının kesilmesinden kaçınılır (bkz. ex utero elektroporasyon, adım 5). - Servikal çıkık yaparak embriyoların çıkarılmasından hemen sonra anneyi feda edin.
NOT: Burada, anne, Kuzey Ren-Vestfalya Eyaleti Çevre Ajansı (LANUV) Hayvan Refahı Yasası tarafından onaylanan protokole uygun olarak, işlem sonrası ağrı veya ıstıraptan kaçınmak için anestezi altında ötenazi yapılır.
5. Ex utero elektroporasyon (EUE)
- Bir embriyo alın ve tutucuya yerleştirin.
NOT: Bir hücre kazıyıcının ucuna tutturulmuş kesilmiş 1 mL pipet ucu embriyo tutucu olarak kullanılır. İşlem sırasında embriyoların kollarının ucun dışında tutulması, ucun içine kaymalarını önlemek için gereklidir (Şekil 2F-I). Pipet ucunun çapı, çeşitli boyutlardaki embriyoları barındıracak şekilde kolayca ayarlanabilir. Ucun çapının embriyo boyutuyla eşleştiği uzunlukta ikinci bir ucu kesin ve yukarıda belirtilen tutucuya adaptör eki olarak kullanın. - DNA / Hızlı Yeşil dolgulu cam kılcal damarı embriyonun kafatasından lateral ventriküle dikkatlice yerleştirin ve 2-3 μL DNA plazmid karışımı enjekte edin (Şekil 1A, B; Tablo 1) her ventrikülün içine (Şekil 2F).
NOT: DNA enjeksiyonunun yeri için bir kılavuz olarak lambdoidal ve sagital sütürleri kullanın. Lambdoidal ve sagital sütürler, kafatasının kemik plakasını birbirine bağlayan fibröz eklemlerdir. İlki parietal kemiği oksipital kemikle birleştirir ve ikincisi iki parietal kemiği birleştirir. - İstenilen beyin bölgesini hedeflemek için embriyonun başını platin cımbız elektrotları arasında uygun açıda tutun (bu durumda 60 ° açı), katot DNA transferinin amaçlandığı alana bakacak şekilde (Şekil 2G-H).
- Bir kare dalga darbe üreteci kullanarak 30 mV'de 1 s aralıklarla ve 50 ms süreyle beş darbe uygulayın.
NOT: EUE'deki beyinlerin İEÜ'dekilerden daha etkili bir elektrik alanı yaşadığını unutmayın. Bu nedenle, belirli bir DNA konsantrasyonunda, EUE, İEÜ'den daha yüksek DNA transferi verimliliği ile sonuçlanır ve DNA konsantrasyonlarının buna göre ayarlanması gerekir. - İki taraflı elektroporasyon isteniyorsa, kontralateral korteksi hedeflemek için önceki pozisyonu yansıtan katot ve anot ile 5.3-5.4 adımlarını tekrarlayın.
NOT: Her iki ventriküle DNA enjekte edildiğinden, her iki yarımkürenin korteksleri hedeflendi. - Elektroporatörlü embriyoyu buz gibi soğuk HBSS-G içeren 6 cm'lik bir kaba yerleştirin. Gerekli tüm embriyolar için 5.1-5.6 arasındaki adımları tekrarlayın.
6. In utero elektroporasyon (İEÜ)
- Hamile fareyi analjezik ile enjekte edin; İşlemden 20 dakika önce deri altından 50 μL buprenorfin (0.1 mg/kg) (bakınız Malzeme Tablosu).
- Embriyo ekstraksiyonu bölümünden 4.1-4.8 arasındaki adımları uygulayın.
NOT: Embriyoları ılık saline batırılmış steril gazlı bezle kaplayarak gereksiz yere açıkta bırakmaktan kaçının. - Parmak uçlarını kullanarak, lambdoidal ve sagital sütürler yerleştirilene kadar embriyoyu uterusun içinde yavaşça döndürün (Şekil 2J). DNA/Hızlı Yeşil cam kılcal damarı uterus duvarından ve embriyonun kafatasından lateral ventriküle dikkatlice yerleştirin ve 2-3 μL DNA plazmid karışımını (Şekil 1A,C) istenildiği gibi bir veya iki ventriküle enjekte edin (Şekil 2K-L).
NOT: Rahim boynuzlarına aşırı parmak baskısı amniyotik çuval çökmesine neden olabilir. - İstenilen beyin bölgesini hedeflemek için embriyonun başını platin cımbız elektrotları arasında uygun açıda tutun (bu durumda 60 ° açı), katot DNA transferinin amaçlandığı alana bakar. Amniyotik çuvalın çökmesine neden olabileceğinden uterusu sıkmaktan kaçının (Şekil 2M).
- Bir kare dalga darbe üreteci kullanarak 35 mV'de 600 ms aralıklarla ve 50 ms süreyle beş darbe uygulayın.
- Her iki lateral ventrikül de enjekte edilmişse, kontralateral korteksi hedeflemek için önceki pozisyonu yansıtan katot ve anot ile 6.5-6.6 adımlarını tekrarlayın.
- Gerekli tüm embriyolar için 6.3-6.6 arasındaki adımları tekrarlayın.
- Gerekli tüm embriyolar elektroporasyondan sonra, uterus boynuzlarını karın boşluğunun içine nazikçe geri yerleştirmek için tuzlu suyla ıslatılmış bir pamuk tomurcuğu kullanın.
NOT: Periton boşluğuna tuzlu su çözeltisinin eklenmesi, uterus boynuzlarının tekrar pozisyona kaymasına yardımcı olacaktır. - 5-0 dikiş malzemesi kullanılarak kas ve cilt kesileri dikilir. Yarayı sabitlemek için dikiş klipsleri kullanın ve sütür yarasını betadin ile püskürterek dezenfekte edin (Şekil 2N-P).
- Fareye deri altından 200 μL% 5 glikoz enjekte edin.
- Fareye bir antibiyotik enjekte edin; Deri altından 50 μL Enrofloksasin (5 mg/kg) (bakınız Malzeme Tablosu).
- Fareyi kurtarma kafesine geri yerleştirin ve prosedürden sonra en az 20 dakika boyunca uzak kızılötesi bir ısıtma ışığı veya ısıtma yastığı kullanarak sıcaklığı koruyun (Şekil 2Q).
- Fareyi günlük olarak izleyin ve kurumsal ve federal yönergeleri izleyerek ağrı kesici prosedürden sonra meloksikam enjekte edin.
- 4. adımı izleyerek işlemden 2 gün sonra (yani, E17.5) embriyoları çıkarın.
7. Beyin ekstraksiyonu ve agaroza gömülmesi
NOT: Daha iyi hassasiyet için aşağıdaki adımların diseksiyon mikroskobu altında uygulanması önerilir. Beyne zarar vermekten kaçınmak, prosedürün başarısı için kritik öneme sahiptir.
- Ekstraksiyon aletlerini, diseksiyon davlumbazının altındaki steril bir çalışma alanına yerleştirin (Şekil 3A).
- Diseksiyon makası kullanarak bir embriyonun başını vücudun geri kalanından ayırın.
- Kafayı Şekil 3C'de gösterildiği gibi sabitleyin ve ardından başın tabanından buruna doğru başlayarak orta hat boyunca keserek cildi ve kafatasını çıkarın (Şekil 3D).
- Cildi ve kafatasını yanal olarak soyun, beynin eksize edilmesi için yeterince büyük bir boşluk (~ 1 cm) açın.
- Beyni çıkarmak için, steril diseksiyon makaslarının kapalı ucunu, beyin sapına doğru hareket eden koku alma ampulünün altından başlayarak yerleştirin (Şekil 3E).
- Beyin sapını kesin ve beynin etrafındaki gevşek meninks parçalarını kesin (Şekil 3F).
NOT: Gevşek meninksler genellikle dilimlerin kesildikten sonra agaroz bloğuna bağlı kalmasına neden olur ve bu da dilim toplama sırasında agarozdan dokunun ayrılmasına neden olur. - Tüm embriyolar için 7.1-7.6 adımlarını tekrarlayın ve gömme adımına kadar beyinleri buz üzerinde tutun (ideal olarak 30 dakikadan fazla olmamalıdır).
NOT: Aşağıdaki adımlar 7.7.1-7.7.4, E12.5 beyinlerinin beyin ekstraksiyonunu ifade eder.- Başın üst kısmını, Şekil 3G'de gösterildiği gibi gözün hemen altında izole edin.
- Beyin sapının üstündeki cildi ve kafatasını kesin, beyin sapını çıkarmadan Şekil 3H'de gösterildiği gibi kesikli çizgiyi takip edin.
- Şekil 3I'de gösterildiği gibi başın arkasında 2 mm'lik bir deri-kafatası kesisi yapın (netlik için çizimlere bakın).
NOT: Bu kesi, deri ve kafatası katmanlarını soymak için ilk kavrama noktalarını sağlar. Tipik olarak, tek bir katman olarak ortaya çıkarlar. Tipik kesi boyutu, kullanılan mikro yaylı makasın kesme kenarının uzunluğuna karşılık gelen 2 mm'dir. - Kesinin bir tarafını sabitleyerek ve diğerini dikkatlice çekerek deri-kafatası tabakalarını soymaya başlayın. Aynı özenle, beyni serbest bırakana kadar başın tabanını soyarak sonlandırın (Şekil 3J).
NOT: Bu, beynin doku katmanları boyunca çekilmediğini gözlemleyerek büyük bir dikkatle yapılmalıdır. Beyni kaplayan dokuyu çıkarmak için alternatif taraflar.
- 3 cm'lik bir tabağa ılık agaroz (37-40 ° C'de) dökün.
- Delikli bir kaşık kullanarak beyni toplayın ve kaşığın altını kuru mendil kağıdına batırarak fazla sıvıyı çıkarın. Beyni agaroz kabına yerleştirin.
NOT: Agarozun dokuya daha iyi yapışmasını sağlamak için beynin etrafından mümkün olduğunca fazla sıvının çıkarılması önemlidir. - Kabı sıvı agarozlu buzun üzerine koyun. Daha küçük bir kaşık kullanarak, eşit soğutma için agarozu 10 s karıştırın. Beyni yemeğin ortasına doğru manevra yapın. Beyni yatay olarak tabağa sırt tarafı yukarı bakacak şekilde yerleştirin ve her yönden tamamen agaroz ile kaplandığından emin olun (Şekil 3K).
NOT: Beyinler genellikle agaroza yerleştirildikten sonra yemeğin dibine batar; Beynin altında 1-2 mm'lik bir boşluk oluşana kadar küçük bir kaşık kullanarak beyni kaldırın. - Tüm beyinler için 7.8-7.10 arasındaki adımları tekrarlayın.
- Agaroz polimerize olduktan sonra, kurumayı önlemek için agaroz bloğunun üzerine 500 μL HBSS-G ekleyin. Ardından, tabağı buzla örtün.
NOT: Beyin sıcaklığının 4 ° C'ye ulaşmasını sağlamak için kesitlemeden önce numuneyi 5 dakika buz üzerinde tutun.
8. Organotipik dilim kültürü
NOT: Dilim kontaminasyonunu önlemek için vibratomu ve çevresindeki yüzeyleri %70-%96 etanol ile temizleyin. Vibratom iş istasyonunun kurulumu (bkz. Malzeme Tablosu) Şekil 3B'de gösterilmiştir.
- İşlem boyunca HBSS-G'yi soğuk tutmak için vibratom tampon tepsisini soğuk HBSS-G ve dış tepsiyi buzla doldurun.
- HBSS-G'yi tampon tepsisine sürekli olarak köpüren bir taş kullanarak karbojenle besleyin.
- Taze bir bıçak kullanarak, beynin etrafında büyük bir kesim (~ 2 x 2 cm) yapın ve agarozu küçük bir dikdörtgen bloğa kesmek için yeterli çevreleyen agaroz ile beyni içeren bir agaroz bloğunu çıkarın.
NOT: Bu adım, bloğun açısını, beynin sagital ekseni vibratom plakasına dik olacak ve koronal eksen bıçağa paralel olarak hizalanacak şekilde ayarlamaya izin verir. Dilimlerin kolay kullanımı için beynin sırt tarafında yaklaşık 5 mm agaroz bırakın. - Numune tutucunun ortasına küçük bir damla hızlı yapışkanlı solventsiz süper yapıştırıcı yerleştirin ve agaroz bloğunun tabanını kaplayacak bir alana yayın.
- Agaroz bloğunu yavaşça alın ve kağıt mendile vurarak tabanı kurutun. Bloğu, beynin rostral tarafı yukarı bakacak şekilde numune tutucunun yapıştırılmış alanına yerleştirin. Numune tutucuyu buz üzerine koyun ve tutkalın 1 dakika kurumasını bekleyin.
- Tutkal kuruduktan sonra, numune tutucuyu tampon tepsisine yerleştirin.
- Beyni koronal dilimler halinde 15°'lik bir açıyla kesin.
NOT: Dilimlerin kalınlığı uygulamaya bağlı olarak değişebilir. Burada, beyinler 150 μm kalınlığında dilimlendi. Üstteki fazla agarozu kırpmak ve koku alma ampullerini kırpmak için vibratom hızını 1.0-1.5 mm / s'ye ayarlayın. Analiz amacıyla kortikal dilimleri toplamak için kesme hızını 0,5 mm/sn'ye düşürün. Çoğu vibratom, her dilimi toplamak için duraklatılabilir. Dilimlerin kalitesinin düşmesi veya dokunun agarozdan ayrılması yaşanırsa, kesme hızının azaltılması veya vibratom bıçağının değiştirilmesi yardımcı olabilir. - Temiz spatula kullanarak, beyin dilimlerini toplayın ve bunları parafin (beş beyin dilimine / zara kadar) kullanılarak 35 mm'lik cam tabanlı bir kapta hareketsiz hale getirilmiş Politetrafloroetilen (PTFE) membrana yerleştirin (Şekil 3L-M).
NOT: PTFE membranını balmumu kullanarak 35 mm'lik cam tabanlı bir kabın içine sabitleyin. Bu, dilim kültürü ortamını eklerken ve ayrıca görüntüleme sırasında membranı stabilize edecektir. - 200 μL'lik bir pipet kullanarak, PTFE membranındaki dilimlerin etrafındaki fazla HBSS-G'yi çıkarın ve dilimleri yarı kuru bırakın.
- Doğrudan PTFE membranının altındaki boşluğa 500 μL dilim ortamı (önceden ısıtılmış 35 °C'ye kadar) ekleyin.
NOT: Ortam eklenirken membranın altında kabarcıklar oluşmamalıdır. Bu, medya değişimi olmadan tam veya kısmi dilimler bırakacaktır. Kültürde her 2 günde bir veya her görüntüleme seansından sonra 200 μL medyayı değiştirin. - Dilimleri %5 CO 2 ile 35 °C'deinkübe edin.
9. İmmünohistokimya
- Dilimleri, 1 mL% 4 paraformaldehit (PFA) ile sabitleyin - çanak başına% 4 sakkaroz ile desteklenir. RT'de 30 dakika boyunca inkübe edin.
DİKKAT: PFA ile çalışırken, laboratuvar önlüğü ve eldiven giyin. Sabitleme adımlarını kimyasal bir başlık altında gerçekleştirin ve PFA atıklarını uygun şekilde bertaraf edin. - Dilimleri 5 dakika boyunca 300 μL PBS ile iki kez yıkayın. Dilimleri 24 delikli bir plakaya aktarın.
NOT: Deney bu aşamada duraklatılabilir. PBS-NaN3'ü dilimlere ekleyin ve 4 °C'de saklayın. NaN3 toksik bir bileşiktir; Çözeltileri onunla birlikte kullanırken, bir laboratuvar önlüğü ve eldiven giyin. Adım 9.3-9.10 yörüngesel çalkalayıcıda gerçekleştirilmelidir. - Dilimleri gece boyunca 4 °C'de 300 μL 0,1 M glisin ile söndürün.
- RT 3x'te PBS ile glisini 10 dakika boyunca yıkayın.
- RT'de 300 μL PBS-T ile dilimleri 2 saat boyunca geçirgenleştirin.
- RT'de PBS-T'de 2 saat boyunca% 10 keçi serumu kullanarak bloke edin.
- Bir gecede 4 °C'de PBS-T çözeltisinde% 10 keçi serumunda seyreltilmiş 300 μL birincil antikor (1:200 seyreltmede anti-vimentin antikoru; Malzeme Tablosuna bakınız) ekleyin.
NOT: Adım 9.8-9.12'de, floresan kaybını önlemek için dilimler ışık korumalı hale getirilmiştir. - Birincil antikoru PBS ile RT 3x'te 20 dakika boyunca yıkayın.
NOT: Triton X-100'ü yıkamak için PBS-T yerine PBS kullanılmıştır. - RT'de PBS'ye 2 saat boyunca 300 μL ikincil antikor (1:400 seyreltmede Alexa Fluor 488 veya 647; Malzeme Tablosuna bakınız) ekleyin.
NOT: DAPI, sekonder antikorun çıkarılmasından hemen sonra 5 dakika boyunca 1:10.000 seyreltmeyle eklenir. - Sekonder antikoru PBS ile RT 3x'te 20 dakika boyunca yıkayın. Damıtılmış su ile 1 dakika boyunca 2x yıkayın.
- İnce bir fırça kullanarak dilimleri cam bir slayda aktarın ve ardından 20 dakika boyunca 30 °C'de kurutun.
- Dilimleri sulu bir montaj ortamı kullanarak monte edin. Montaj ortamının küratörlüğünü yapması için slaytları gece boyunca RT'de tutun.
10. Görüntüleme edinimi
NOT: DNA doğum yaklaşımından bağımsız olarak (İEÜ veya EUE), dilimler aynı gelişimsel yaş aralığında (E17.5-E18.5) analiz edildi. İEÜ, nöronal progenitörlerin in vivo olarak iki gün daha bölünmesine ve gelişmesine izin verir. Öte yandan EUE, erken gelişimsel olayların izlenmesine izin verir.
- Hazne inkübatörünü açın ve mikroskop bileşenlerinin 35 ° C'de dengelenmesini sağlamak için% 5 CO2 ile 35 ° C'ye ayarlayın - görüntülemeden ideal olarak 4 saat önce.
- Dilimlerin derin görüntülenmesi için, doku ile hedef arasındaki kırılma indisindeki uyumsuzluğu azaltmak için suya daldırma hedeflerini kullanın.
NOT: Burada süper çözünürlüklü görüntüleme modu kullanılmıştır. PTFE membran üzerinden görüntüleme, uzun çalışma mesafesine (~ 1 mm) sahip bir hedef gerektirir. Uzun bir çalışma mesafesi hedefi mevcut değilse, dilimler 8 delikli cam tabanlı bir kaba aktarılabilir. Dilimleri aktarmak için, membranın üstüne 1 mL dilim ortamı ekleyin ve ardından bir dilimi kaldırmak ve 200 μL ortam içeren bir kuyuya aktarmak için bir spatula kullanın. Fazla malzemeyi 1 mL'lik pipet ucu kullanarak çıkarın ve dilimleri yarı kuru bırakın. - Akson büyümesini görüntülemek için, korteksin düşük ila orta hücre yoğunluğuna sahip bir bölgesini bulun. Büyüme konisi dinamiklerini görüntülemek için, korteksin ara bölgesinde veya subventriküler bölgesinde bir büyüme konisi bulun.
- Görüntü işleme yazılımında bir z-yığını boyutu tanımlayın (bkz. Büyük bir z-yığınında akson büyümesi için, 2 μm'lik bir adım boyutu ayarlayın. Daha küçük bir z-yığınındaki büyüme konileri için, 1 μm'lik bir adım boyutu ayarlayın.
NOT: Her zaman büyüme konisinin ve aksonun x, y ve z düzlemleri boyunca potansiyel hareketini hesaba katın. Aksonlar organotipik kültürlerde in vitro kültürlerden çok daha yüksek oranda büyür. Burada, akson büyümesini görüntülemek için yaklaşık 80 μm'lik bir z-yığını yeterliydi. Büyüme konisi dinamikleri için, ~ 6 μm'lik bir z-yığını yeterliydi. - Daha geniş bir alanda nöronların akson büyümesini görüntülemek için, bir karo taraması tanımlayın.
- Edinme sırasında büyüme konilerinin ağartılma olasılığını en aza indirmek için mümkün olan en düşük lazer gücünü kullanın.
- Akson büyümesini görüntülemek için, 5 dakika arayla 2 saat boyunca hızlandırılmış çekimler elde edin. Büyüme konisi dinamiklerini görüntülemek için, 2,5-3 s aralıklarla 2-5 dakika boyunca hızlandırılmış çekimler elde edin.
11. Veri analizi
- Kimografileri kullanarak akson büyümesinin hızını ölçün
- Görüntü dosyasını Fiji14'te Dosya > Aç'tan açın ve görüntüyü seçin.
- Zaman atlamalı çekimin maksimum yoğunluk projeksiyonunu Görüntü > Yığınları > Z-Projeksiyonu > Maksimum Yoğunluk Projeksiyonu ile elde edin.
- Hızlandırılmış çekimden geçin ve büyüyen bir akson bulun.
- Bulunduktan sonra, büyüyen akson boyunca bir çizgi çizin. İlk karede aksonun ucundan başlayın ve tüm zaman atlaması boyunca aksonu takip edin.
- KymoResliceWide eklentisini kullanarak bir kymograph oluşturun.
- Image > Properties'e giderek kymograph'ın ölçeğini ayarlayın. Piksel Genişliği'nde mesafeyi μm cinsinden ayarlayın ve Piksel Yüksekliği'nde süreyi s veya dk olarak ayarlayın.
- Analiz > Ölçü'ye gidin.
NOT: X eksenine göre bir açı verilecektir. - Aşağıdaki denklemdeki açıyı değiştirerek akson büyümesinin hızını hesaplayın: Bir elektronik tabloda SIN(RADIANS(θ)) /COS(RADIANS(θ) ).
- Bir görüntü analiz yazılımı kullanarak büyüme konisinin hacmini ölçün (bkz.
- Görüntü dosyasını görüntü analiz yazılımında Dosya > Aç aracılığıyla açın ve ilgilendiğiniz dosyayı seçin.
- Yeni Yüzeyler Ekleme sihirbazını seçin.
NOT: Sol alt köşede, manuel düzenleme için altı adımlı bir bölüm görünecektir. - 1. adımda - Algoritma Ayarları altında - Yalnızca İlgilenilen Bir Bölgeyi Segmente Et'i seçin. 2. adımda, tüm büyüme konisini tüm çerçevelere sığdırmak için çerçeveyi kırpın.
- 3. adımda Mutlak Yoğunluk eşiğini koruyun ve adım 4'te tüm büyüme konisi bölgesinin eşik olduğundan emin olun.
- 5. adımda, Filtre Türü altında Voksel Sayısı lmg = 1'i seçin.
NOT: Son adımda, birden fazla ölçüm grubu oluşturulabilir. Burada, hacim için yalnızca bir ölçüm oluşturuldu. - Tüm oluşturma adımlarını gerçekleştirmek ve Yeni Yüzeyler Ekleme Sihirbazı'nı sonlandırmak için Yürüt düğmesini seçin.
- Sihirbaz penceresinin en üstündeki İstatistikler sekmesinde, Ayrıntılı sekmesinin altındaki Belirli Değerler ve Birim'i seçin.
Sonuçlar
Açıklanan yöntem iş akışıyla elde edilen temsili sonuçlar gösterilir. Bu gösterimde E15.5 fareleri kullanılmıştır, ancak bu protokol E11'den geç E17'ye kadar değişen hemen hemen tüm embriyonik yaşlara kolayca uyarlanabilir. Bu protokolde, ex utero elektroporasyon (EUE; Şekil 2A, 2C-I) veya in utero elektroporasyon (İEÜ; Şekil 2B, C ve 2J-Q), lateral ventrikülleri kaplayan progenitör nöronlara plazmidler vermek için kullanıldı. Bu progenitörler gelecekteki kortikal projeksiyon nöronlarının (CPN) kaynağıdır15,16. Plazmid karışımları, büyüme konilerindeki genel davranışı ve aktin dinamiklerini değerlendirmek için sırasıyla membran hedefli (Lyn)-mNeonGreen (Şekil 1A) veya LifeAct-enhanced (E) GFP'nin (Şekil 1B) seyrek nörona özgü ekspresyonunu sürmek için hazırlanmıştır. Ayrıca, bireysel nöronları turbo (t) -RFP veya zoanthus sp. (Zs) yeşil floresan proteini (ZsGreen) (Şekil 1C) ile etiketlemeyi amaçlayan bir plazmid karışımı dahil edilmiştir. Bu, bağımsız komşu nöronlardan büyüme konisi davranışının izlenmesini kolaylaştırır.
Elektroporated embriyolardan beyin diseksiyonu, doğal beyin yapısını koruyarak yüksek kaliteli dilimler elde etmek için dikkatlice yapılması gereken çok önemli bir adımdır. Diseksiyon aletleri ve vibratomlar önceden hazırlanmış ve dikkatli bir şekilde etanol sterilize edilmiştir (Şekil 3A,B). Daha sonra, elektroporate embriyoların kafaları dikkatlice diseke edildi ve beyinler çıkarıldı. Burada, EUE'ye tabi tutulan embriyolardan beyinlerin E15 (Şekil 3C-F) ve E12.5'te (Şekil 3G-J) temsili diseksiyonu gösterilmiştir. Beyinler hemen bir agaroz matrisi içine alınır, dilimlenir ve inkübasyon için alttan cam bir tabak içindeki PTFE membran eklerine yerleştirilir (Şekil 3K-M).
Beyin dilimlerinin sağlık durumu, güvenilir sonuçlar elde etmek için kontrol için önemli bir noktadır. Herhangi bir kontaminasyon için günlük olarak görsel bir inceleme yapıldı. Ek olarak, kültür tamamlandıktan sonra, beyin dilimleri sabitlenir ve immünohistokimyaya tabi tutulur. Burada, genel hücresel organizasyonu kontrol etmek için 4′,6-diamidino-2-fenilindol (DAPI) ve glial organizasyonu ortaya çıkarmak için vimentin boyama kullanıldı; özellikle, radyal glia (RG) iskelesi. Tipik olarak, İEÜ veya EUE'den türetilen başarılı kültürlenmiş beyin dilimleri, DAPI tarafından ortaya konduğu gibi normal hücresel dağılımı ve apikal yönelimli pial temas süreçleri17 ile biraz organize bir RG dizisi gösterir (sırasıyla Şekil 4A, B). Bazen, kültürlü beyin dilimlerindeki RG iskelesinde, özellikle EUE elektroporasyonundan türetilenlerde belirgin bozukluklar gözlenir (Şekil 4C). Son derece dağınık RG iskelesi olan beyin dilimleri, bozulmuş nöronal migrasyon ve kusurlu akson büyümesini gösterir (gösterilmemiştir). Bu nedenle, RG iskelesini kontrol etmek, güvenilir beyin dilimlerinden elde edilen verileri sıralamak için kolay bir kültür sonrası yöntemdir.
Lyn-mNeonGreen eksprese eden plazmid karışımı ile IUE veya EUE'den türetilen beyin dilimleri, benzer seyrek nöron etiketlemesine neden olur. Lyn-mNeonGreen'i ve büyüme konisinin dinamik davranışını ifade eden temsili bir piramidal CPN örnek olarak gösterilmiştir (Şekil 5A ve Ek Video 1, sol üstte). Ek olarak, nöronlar, aksonal büyüme konilerinin aktin dinamiklerini in situ olarak analiz etmek için bir aktin probu ifade eden bir plazmid kullanılarak etiketlendi (Şekil 5B ve Ek Video 1, sol altta). In situ deneyler ayrıca çift Cre / Dre florofor eksprese eden plazmid tasarımı ile gerçekleştirildi (Şekil 1C ve Ek Video 1, sağda). Bu plazmiddeki tRFP veya ZsGreen floroforları, komşu nöronlarda sırasıyla Dre veya Cre rekombinazları tarafından spesifik ve bireysel olarak aktive edilebilir (Şekil 5C). Bu deneysel diziliş, komşu modifiye nöronlarla kontrol nöronlarından (herhangi bir işlev kaybı veya kazancı) büyüme konilerinin yan yana analizine izin verir. Bu, kontrol ve deney koşullarını test etmek için farklı dilimlerin kullanılmasından kaynaklanan değişkenliği ortadan kaldırır.
Kaydedilen filmden üretilen kimograflar, zaman içinde çıkıntılı aktivite ve büyüme uzunluğu gibi dinamik büyüme parametrelerinin kolayca elde edilebileceği analiz edilmiştir (Şekil 6A). Hızlandırılmış çekimin zamansal çözünürlüğündeki basit bir ayarlamanın, 2 saat boyunca akson uzama hızının ölçülmesine izin verdiğini unutmayın (Şekil 6A). Ayrıca, büyüme konisi hacminin zaman içindeki değişimi - genel büyüme konisi dinamik aktivitesinin bir ölçüsü - bu durumda lisanslı yazılımlarla kolayca elde edilebilir (Şekil 6B ve Şekil 6E, F). Bu, aktin koşu bandının hızını ve büyüme konisi keşif aktivitesi sırasında filopodia / lamellipodia dengesini değerlendirmek için kullanılabilir.
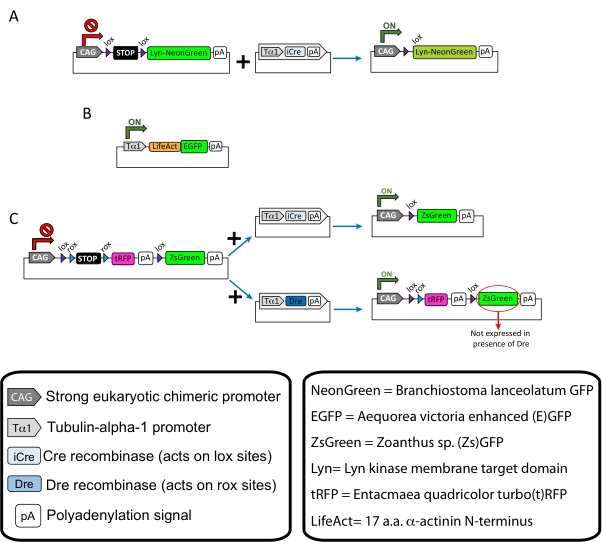
Resim 1: Protokolde kullanılan plazmidlerin şemaları . (A) pCAG-lox-STOP-lox-Lyn-mNeonGreen. (B) p-Tub-alpha-1-LifeAct-GFP. (C) pCAG-lox-rox-STOP-rox-tRFP-pA-lox-ZsGreen-pA. Plazmid bileşenleri ve floroforun kökeni ile ilgili bilgiler kutularda bulunur. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
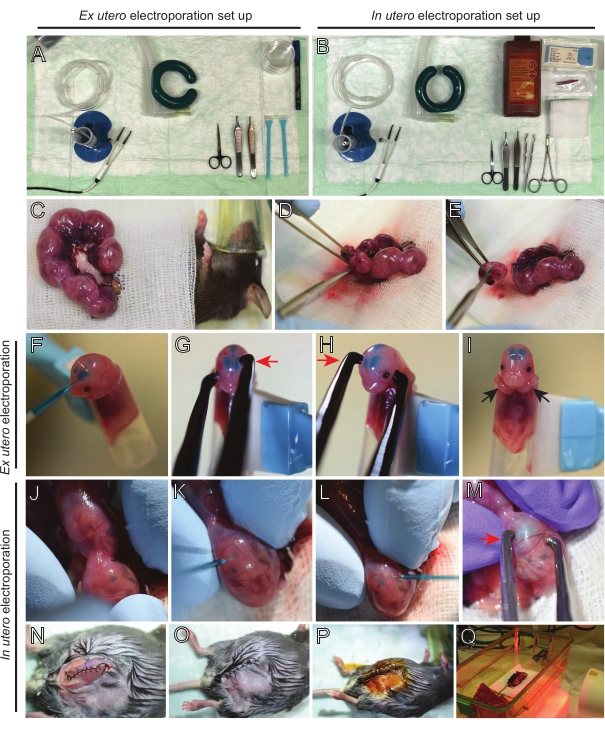
Şekil 2: E15.5 farelerin ex utero ve in utero elektroporasyonunun iş akışı. (A) Ex utero elektroporasyon için ameliyat istasyonunun kurulması. (B) In utero elektroporasyon için ameliyat istasyonunun kurulması. (C) Anestezi uygulanan farenin karın boşluğunun dışına çekilen uterus boynuzları. (D) Rahim çuvalından embriyonun çıkarılması. (E) Diyagonal bir kesi yoluyla tam omurilik transeksiyonu ile embriyo kurban edilmesi; kafa kesmenin önlendiğini unutmayın. (F) Embriyonun tutucuya yerleştirilmesi ve sol lateral ventriküle DNA/Hızlı Yeşil karışımı enjekte edilmesi. (G,H) Embriyonun kafasını platin cımbız elektrotlar arasına katot (kırmızı ok) ile korteks üzerinde 60° açıyla yerleştirin. (I) İşlem sırasında embriyonun kaymasını önlemek için embriyonun kollarının (siyah oklar) tutucunun dışına yerleştirilmesi. (J) Kafayı açığa çıkarmak için embriyonun uterus çuvalı içinde dönmesi. (K,L) DNA/Hızlı Yeşil karışımının uterus duvarından embriyonun lateral ventriküllerine enjekte edilmesi. (M) Embriyonun kafasını platin cımbız elektrotlar arasında korteks üzerinde 60° açıyla bir katot (kırmızı ok) ile konumlandırın. (N) Koşu kilitleme dikişi ile dikişli kas kesisi. (O) Kesilen bir dikiş yoluyla dikişli cilt kesisi. (P) Cerrahi yara klipsleri kullanılarak yaranın sabitlenmesi ve betadin kullanılarak dezenfeksiyon. (Q) Farenin uzak kızılötesi ısınma ışığı ile kurtarma kafesine yerleştirilmesi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 3: E15.5 ve E12.5 beyinlerinin çıkarılması ve organotipik dilim kültürü prosedürü. (A) Beyin ekstraksiyon prosedürü için kullanılan araçlar. (B) Organotipik kültür istasyonunun kurulması. (C-F) E15.5 beyninin çıkarılması. (G-J) E12.5 beyninin çıkarılması. Noktalı çizgiler insizyonların yerini vurgular. Kırmızı oklar forseps tarafından çekilme yönünü işaret ediyor. (K) Beyni %3 düşük erimiş agaroz içeren 3 cm'lik bir kaba gömerek beynin altında 1-2 mm'lik bir agaroz aralığı boşluğu bırakır. (L) 150 μm beyin diliminin toplanması. (M) Beyin dilimlerinin, parafin film (mavi ok) kullanılarak 35 mm'lik bir kapta hareketsiz hale getirilmiş PTFE membran eklerine yerleştirilmesi. Kırmızı yıldız işareti, vibratomdan (L) belirli bir beyin dilimi koleksiyonunu ve PTFE membranına (M) transferini gösterir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
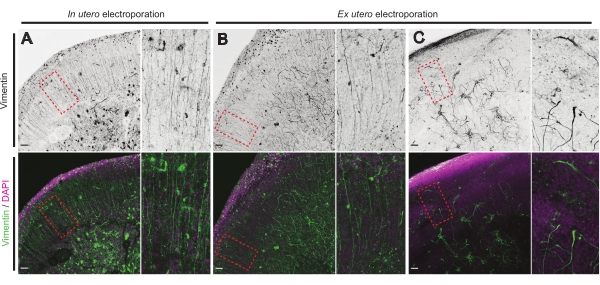
Şekil 4: Sağlıklı organotipik dilimlerde korunmuş radyal glial hücre yapısı. E17.5 beyin dilimlerinin konfokal görüntüleri, İEÜ (A) ve EUE (B,C) sonrasında RG dizisini (vimentin; yeşil) ve genel hücre organizasyonunu (DAPI; macenta) ortaya koymaktadır. RG dizisinde zaman zaman EUE (C) 'den kaynaklanabilecek güçlü bozulmalara dikkat edin. Büyütmeler, ana şekildeki kırmızı noktalı çerçevelere karşılık gelir: ölçek çubukları, 10 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
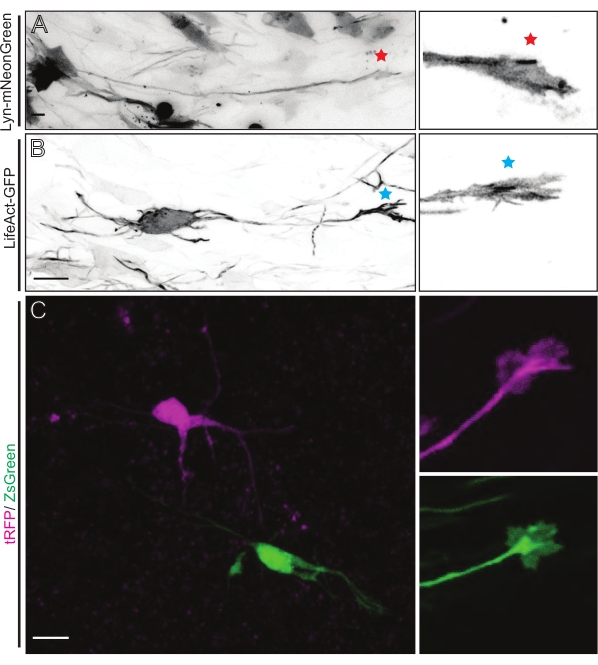
Şekil 5: Akut organotipik dilimlerde büyüme konisi dinamiklerinin yerinde görselleştirilmesi. (A,B) Nöronlar ve bunlara karşılık gelen büyüme konileri sırasıyla Lyn-mNeonGreen ve LifeAct-GFP ile etiketlenmiştir. Lyn-mNeonGreen'in büyüme konisini işaretleyen kırmızı yıldız, nöronu ifade eder. Nöronu ifade eden LifeAct-GFP'nin büyüme konisini gösteren mavi yıldız işareti. (C) tRFP (macenta) ve ZsGreen (yeşil) içeren çift plazmid sistemi ile etiketlenmiş komşu nöronlar ve bunlara karşılık gelen büyüme konileri. Görüntülenen büyüme konileri (sağda), yakalanan çerçevenin (solda) dışındaydı ve büyüme konisi zaman atlamalı olarak elde edildikten kısa bir süre sonra elde edildi; ölçek çubukları, 5 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
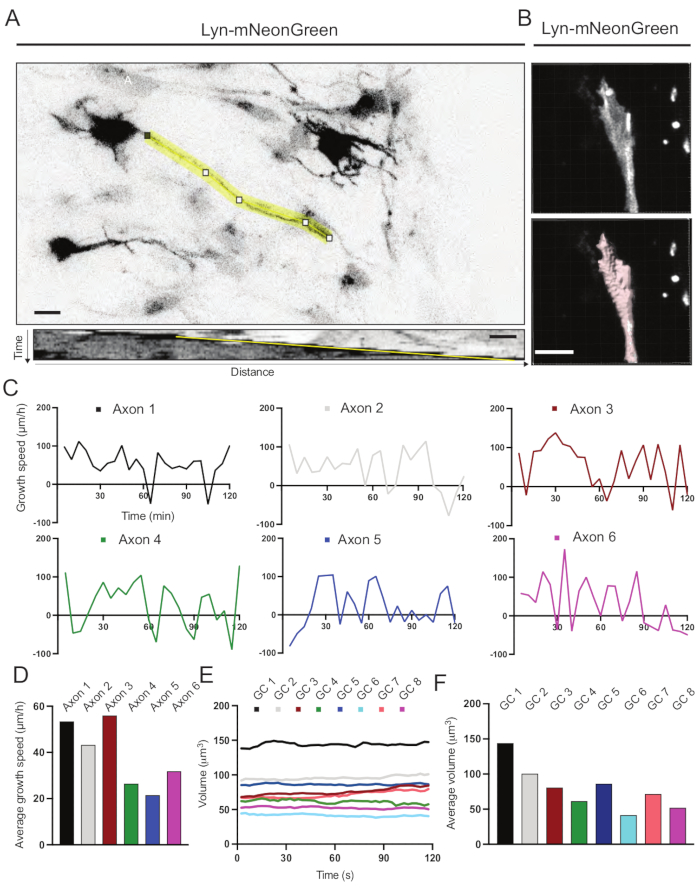
Şekil 6: Akson büyüme hızının ve büyüme konisi hacminin analizi . (A) ImageJ kullanılarak oluşturulan Lyn-mNeonGreen'i (üstte) ve buna karşılık gelen kimografı (aşağıda) ifade eden bir nöron üzerinde akson izleme. (B) Görüntü analiz yazılımı (üstte) kullanılarak büyüme konisinin z-yığın videosunun ve yüzeyler ölçüm aracı (aşağıda) kullanılarak vurgulanan aynı büyüme konisinin yeniden yapılandırılması. (C) Birkaç akson için zaman içinde büyüme hızındaki değişiklikleri gösteren grafikler. (D) Aksonların ortalama büyüme hızı (C) cinsinden ölçülür. (E) Büyüme konisi hacmindeki zaman içindeki değişiklikleri gösteren grafik. (F) Büyüme konilerinin ortalama hacmi (E) cinsinden ölçülür; ölçek çubuğu, 5 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
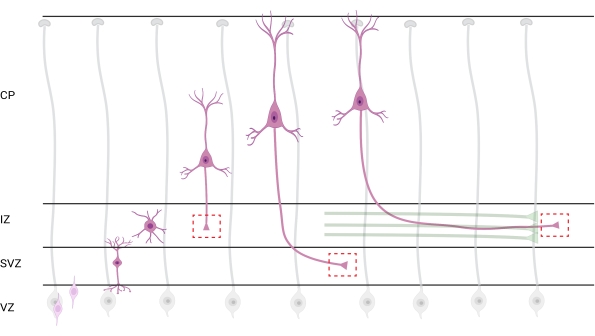
Şekil 7: Radyal migrasyon ve piramidal kortikal nöronların nöronal polarizasyonu. Germinal ventrikül bölgesinden (VZ) pia yüzeyine doğru radyal olarak göç eden piramidal kortikal nöronların (pembe) gelişimini gösteren diyagram. Radyal glia süreçleri (gri) tarafından yönlendirilen göç eden polarize nöronlar, ara bölgeye (IZ) doğru aşağı doğru uzanmaya devam eden öncü bir süreç, gelecekteki dendrit ve takip eden süreç, gelecekteki akson oluşturur. Kesikli kırmızı kutular, büyüme konilerinin görüntülendiği kortikal alanları temsil eder. Özellikle IZ, subventriküler bölge (SVZ) veya akson demetlerinin birleştirilmesinde (yeşil). Çizim, BioRender.com web tabanlı bir araçla oluşturulmuştur. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
| Plasmid | Konsantrasyon (μg/μL) | Kullanım amacı |
| pCAG-lox-STOP-lox-Lyn-mNeonYeşil | 0.25 | Membran hedefli proteinin (Lyn) etiketlenmesi |
| + | + | |
| p-Küvet-alfa-1-iCre | 0.08 | |
| p-Küvet-alfa-1-LifeAct-GFP | 0.125 | Büyüme konilerinde filamentli aktin (F-aktin) etiketleme |
| pCAG-lox-rox-STOP-rox-tRFP-lox-Lyn-ZsYeşil | 1 | Komşu nöronların iki popülasyonunun bağımsız etiketlenmesi |
| + | + | |
| p-Küvet-alfa-1-iCre | 0.004 | |
| + | + | |
| p-Küvet-alfa-1-Dre | 0.2 |
Tablo 1: Protokolde kullanılan plazmidlerin listesi. Kullanılan her plazmidin adı, konsantrasyonu ve kullanım amacı.
Ek Video 1: Akut organotipik dilimlerde büyüme konisi dinamiklerinin yerinde görselleştirilmesi. Lyn-mNeonGreen (sol üstte) ve LifeAct-GFP (sol altta) ile etiketlenmiş büyüme konilerinin dinamikleri. Komşu büyüme konileri, tRFP (macenta; sağ üstte) ve ZsGreen (yeşil; sağ altta) içeren çift plazmid sistemi ile farklı şekilde etiketlenmiştir. Görüntüleme aralığı, 2,5 s. Ölçek çubukları, 5 μm. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Büyüme konilerinin eşzamanlı akson genişletme ve yönlendirmeyi koordine etmek için çevrelerini nasıl algıladıkları ve tepki verdikleri hala bir tartışma konusudur 3,18. 2D substratlardaki öncü çalışmalar, akson oluşumu, büyüme ve navigasyon 2,10,11,12,19 sırasında büyüme konisi dinamiklerini yönlendiren kuvvetleri üreten temel moleküler mekanizmalara bir bakış sağlamıştır. Daha yakın zamanlarda, 3D matrislerde yapılan çalışmalar, üçüncü bir boyutun büyüme konisinin davranışında ve dolayısıyla akson büyümesinde ne kadar etkisi olduğunu ortaya koymuştur 8,9. Bununla birlikte, in vivo büyüme konisi dinamiklerini öğreten karmaşık mekanizmalar iyice incelenmeye devam etmektedir.
İEÜ veya EUE beyinlerinden organotipik dilim kültürlerinin hazırlanması yaygın olarak kullanılmakta ve iyi belgelenmektedir. Bilim adamlarının canlı beyin dokusundaki nöronların gelişimi ve davranışları hakkında fikir edinmelerini sağlayan altın bir standart haline gelmiştir20,21. Gerçekten de, bu teknik, spesifik moleküler süreçleri ve morfolojik olayları in situ olarak görselleştirmek için çeşitli yüksek çözünürlüklü görüntüleme teknikleriyle kombinasyon halinde başarıyla kullanılmıştır. Bu tür çalışmalar, akson oluşumu ve uzantısı 19,22, kortikal nöronal migrasyon 19,22,23,24, sentrozom dinamikleri 25,26, mikrotübül dinamikleri27 ve ayrıca sinaptik öncesi ve sonrası bölmelerin fonksiyonel dinamikleri 28,29'u içerir, ancak bunlarla sınırlı değildir.
Bu protokol, deneysel nörobiyolojideki bir boşluğu ele alarak, in situ kortikal nöronların gelişiminin büyüme konisi dinamiklerini, in vivo akut beyin dilimi kültürlerini ve elde edilen verileri analiz etme araçlarını görselleştirmektedir.
Bu protokolü oluşturmak için akut beyin dilimi kültürleri kullanılmıştır, çünkü (1) bazı uygulamalarla üretilmesi kolaydır; (2) yarı-tamamen fizyolojik bir ortama gömülmüş, ancak yüksek çözünürlüklü canlı hücre görüntülemeye izin verecek kadar şeffaf olan büyüme konilerini incelemek için erişilebilir bir sistem sunmak; (3) sayısız transgenik fare çizgisi ile kullanımı için genişletilebilir; (4) İEÜ veya EUE ile birleştiğinde, floresan muhabirler ve sitoiskelet probları ile birlikte, fonksiyon kaybı / kazancı rejimleri altında büyüme konilerinin ve aksonlarının performansını in vivo olarak değerlendirmek için moleküler araçlar sunmak için neredeyse sınırsız potansiyel sağlar.
Bu metodoloji hem EUE hem de İEÜ bağlamında tanımlanmıştır. EUE, halen oldukça güvenilir bir yöntem olmasına rağmen, dağılmış bir RG ağı gösteren beyin dilimlerinin insidansı, bir dağıtım yöntemi olarak İEÜ ile elde edilenlere kıyasla artmıştır (Şekil 4C). RG dizisindeki bozukluklar nöronal göçü ve akson uzama paternini güçlü bir şekilde etkiler30,31. Bunlar, belirli bir zamanda analiz için aksonların nerede bulunacağını ve gezindikleri ortamın türünü tahmin eden temel parametrelerdir. Önemli ölçüde bozulmuş bir RG ağına sahip beyin dilimleri tipik olarak kortikal nöron tabakalaşmasını bozmuştur. Bu da, kaotik yörüngelere sahip aksonlar üretir. Bu nedenle, RG ağının yapısal bütünlüğünü kontrol etmeniz şiddetle tavsiye edilir. İlginçtir ki, zayıf yapısal bütünlük, embriyonik beynin artan yaşı ile ilişkilidir. Gerçekten de, genç E12.5-E13.5 embriyolarında bu tür etkiler tipik olarak gözlenmemiştir19.
Mevcut protokol kapsamlı ve basittir. Bununla birlikte, optimal sonuçlar elde etmek için özel dikkat ve dikkat gösterilmesi gereken birkaç kritik adım vardır. Bunlar protokolde açıkça belirtilmiştir ve (1) seyrek etiketleme elde etmek için elektroporasyonda kullanılan DNA miktarının ayarlanmasını; (2) beyinlerin çıkarılması sırasında hasardan kaçınmak; (3) beyin muhafazası sırasında agarozun sıcaklığını kontrol etmek; (4) belirli bir yaştaki beyinler için ideal agaroz yüzdesini gidermek; ve (5) deneyimi takip eden floroforların seçimi. Protokol optimizasyonu sırasında, canlı hücreli in situ görüntülemede birkaç floroforun performansı test edildi. Bu protokol için LifeAct ve Lyn etiketli plazmidlerin hazırlanması için monomerik GFP varyantları EGFP ve NeonGreen seçildi (Şekil 5A, B). Ek olarak, RFP varyantı mScarlet test edildi ve bu kurulum için oldukça uygun bulundu (veriler gösterilmedi). Multimerik tRFP (dimer) ve ZsGreen (tetramer) (Şekil 5C ve Ek Video 1, sağda) da test edildi. Bu hızlı katlanan süper parlak floroforlar, yöntem DNA dağıtımından sonra hızlı floresan sinyal üretimi gerektirdiğinde önerilir.
Dilim kültürlerini kullanmada yaygın bir uygulama, kontrol ve deneysel koşulları test etmek için farklı beyinlerden dilimler kullanmaktır. Bu, istenmeyen değişkenliğin doğal bir kaynağını temsil eder. Burada, komşu nöronların ve muhabirlerin kimlik tespiti için ifadelerinin bağımsız olarak değiştirilmesini sağlayan bir ifade sistemi kullanılmıştır. Bu gösterimde (Şekil 5C), floroforlardan herhangi birini ifade eden nöronlar arasında hiçbir fark olmadığını unutmayın. Bununla birlikte, örnek olarak, Cre'ye duyarlı bir geni barındıran transgenik bir fare çizgisi ile birleştirilen böyle bir plazmid karışımı, vahşi tip olarak kalan tRFP (Dre-duyarlı) nöronlarla etiketlenecektir. Buna karşılık, ZsGreen (aynı zamanda Cre-sensitif) rekombine nöronları etiketleyecektir. Bu nedenle, iki farklı genotipin büyüme konileri ve muhtemelen aynı zamanda fenotipler, aynı beyin diliminde aynı anda yan yana incelenebilir.
Aksonların ve büyüme konilerinin analiz için lokalizasyonu önemli bir husustur. Kortikal nöronlar, ventriküler bölgeden (VZ) kortikal plakaya (CP) doğru radyal olarak göç ederken polarize olurlar. Bu işlem sırasında, nöronlar öncü bir süreç (gelecekteki bir dendrit) ve akson haline gelecek bir takip süreci oluşturur, sonunda ara bölgedeki (IZ) öncü aksonlara katılarak akson yollarıoluşturur 32. Bu nedenle, aksonal büyüme konilerini yakalamak için, CP'den çıkan aksonlar ve zaten aksonal demetlerle ilişkili erken üretilen aksonlar da dahil olmak üzere IZ'deki aksonal lifler üzerinde görüntüleme yapıldı; veya nihayetinde, IZ'yi enine eden ve altına uzanan liflerde (Şekil 7).
Bu protokol, organotipik dilimler içindeki nöronların süper çözünürlüklü görüntülenmesini mümkün kılar. Tarihsel olarak, ışık saçılması, kalın örnekleri görüntülerken karşılaşılan önemli bir sorundu. Son yirmi yılda, optik teknolojilerdeki kapsamlı ilerlemeler, kalın örneklerin görüntülenmesini mümkün kılmıştır. Burada, büyüme konileri gibi daha küçük yapıları daha iyi görselleştirmek için uzun bir çalışma mesafesi hedefi kullanılmıştır. Kaçınılmaz olarak, bu protokol retrograd aktin akışı veya mikrotübül dinamikleri gibi daha ayrıntılı olayları yakalamaz. Daha düşük bir Sayısal Diyafram (NA) gerektiren uzun çalışma mesafesi hedefi, kalın dilimlerden gelen bilgileri korur. Bununla birlikte, bu protokolü daha kısa çalışma mesafesi hedefleriyle kullanmak için uyarlamak da mümkündü. Bu, yapısal bütünlüğü korumak için dilimlerin cam tabanlı bir kaba düzgün bir şekilde aktarılmasını gerektiriyordu. Bununla birlikte, bu yöntemin kullanılması, gaz değişimi kaybı nedeniyle daha kısa sağkalımla sonuçlandı - ~ 15 saat - (veriler gösterilmemiştir). 2B kültürlerin aksine, 3B'deki büyüme konileri daha büyük bir hacme sahiptir ve z ekseninde hareket-artefakt telafisi gerektirir. Ayrıntılı olayları görüntüleme yeteneğini artırmak için, modern konfokal teknoloji kullanılmalıdır. Bu nedenle, yüksek hassasiyetli konfokal mikroskoplarda bulunan z-Galvo gibi hızlı tarama yapan bir z-stack motorunun kullanılması önerilir33.
Not olarak, bu protokol üç ana sınırlama sunar. İlk olarak, herhangi bir plazmidin ekspresyon seviyelerini / eksprese eden hücrelerin sayısını in vivo olarak kontrol etmek genellikle zordur. Bu, aynı plazmid konsantrasyonunu korurken bile tüm dilimler arasında değişkenlik sağlar. Bu nedenle, kullanılan ifade vektörlerindeki düzenleyici unsurların seçimi dikkatle önceden belirlenmelidir. İkincisi, membran uçları kullanarak ayrıntılı olayların görüntülenmesi şu anda mümkün değildir. Bu ikinci sınırlama, önceki paragrafta önerilen metodolojik güncellemelerle aşılabilir. Son olarak, büyüme konileri ışığa duyarlıdır ve hızla fotobeyazlatılabilir. Bu nedenle, büyüme konilerinin sık sık görüntülenmesi, lazer tarama mikroskopları kullanılarak 5 dakika kadar kısa bir süre boyunca genellikle büyüme konilerini çökertebilir. Bu bağlamda, ışık tabakası mikroskobu ile üretilen cihazlardaki yeni ilerleme, beyin dilimlerinin uzun süreli görüntülenmesi için uyarlanabilir34.
Bunun gibi protokollerin, yeni araştırma yolları açması, bir büyüme konisinin karmaşık bir in vivo ortama doğru okuması ve tepki vermesi için ne gerektiğini daha iyi anlamasını ve daha da önemlisi, bu sofistike etkileşimin mekaniğini çözmesini sağlamak öngörülmektedir.
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Maria Eugenia Bernis'e prosedürleri fotoğrafladığı için teşekkür ederiz. Ayrıca Emily Burnside, Emily Handley, Thorben Pietralla, Max Schelski ve Sina Stern'e el yazmasını okudukları ve tartıştıkları için teşekkür ederiz. Olağanüstü teknik asistanlarımız Jessica Gonyer, Blanca Randel ve Anh-Tuan Pham'a minnettarız. DZNE'nin ışık mikroskobu tesisinin ve hayvan tesisinin değerli desteğini kabul ediyoruz. Bu çalışma Deutsche Forschungsgesellschaft (DFG), Uluslararası Parapleji Araştırma Vakfı (IRP) ve Yaşam için Kanatlar (F.B) tarafından desteklenmiştir. F.B., ImmunoSensation2, SFB 1089 ve 1158 mükemmellik kümesinin bir üyesidir ve Roger De Spoelberch Ödülü'nün sahibidir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Adson Forceps | Fine Science Tools | 11006-12 | |
| Alexa Fluor 488 | Invitrogen | A21202 | Goat Anti-Mouse |
| Alexa Fluor 647 | Invitrogen | A21236 | Goat Anti-Mouse |
| Anti-Vimentin antibody | sigma-Aldrich | V2258-.2ML | Monoclonal mouse, clone LN-6, ascites fluid |
| B27 supplement | ThermoFisher Scientific | 17504044 | |
| Betadine | B. Braun | 3864154 | |
| Biozym Sieve GP Agarose | Biozyme | 850080 | |
| Braunol, Sprühflasche | B. Braun | 3864073 | |
| Buprenorphine (Temgesic) | GEHE Pharma | 345928 | |
| DAPI | sigma-Aldrich | D9542 | |
| DMZ unevirsal electrode puller | Zeitz | NA | |
| Electric razor | Andes | NA | ProClip UltraEdge Super 2-Speed model |
| Enrofloxacin (Baytril) | Bayer | 3543238 | 2,5% (wt/vol) |
| Eppendorf microloader pipette tips | FischerScientific | 10289651 | |
| Fast Green FCF | Sigma-Aldrich | F7252-5G | Dye content ≥ 85 % |
| Fetal Bovine Serum | ThermoFisher Scientific | 10500064 | |
| Fiji 2.1.0 | NIH | NA | https://imagej.net/software/fiji/downloads |
| Fine Scissors | Fine Science Tools | 14058-09 | ToughCut/Straight/9cm |
| FluoroDish Cell Culture Dish | World Precision Instruments | FD5040-100 | |
| Fluoromount Aqueous Mounting Medium | sigma-Aldrich | F4680-25ML | |
| Glucose | MedPex | 3705391 | 5% |
| GlutaMAX Supplement | ThermoFisher Scientific | 35050061 | |
| Glycine | Sigma-Aldrich | G8898 | |
| HBSS | Life Technologies | 14025092 | calcium, magnesium, no phenol red |
| Horse serum | Pan-Biotech | P30-0711 | |
| Imaris 9.7.2 | Bitplane | NA | https://imaris.oxinst.com/products/imaris-for-neuroscientists |
| Isoflurane | Virbac | NA | |
| Isotonic saline solution | B. Braun | 8609261 | 0.90% |
| Leica VT1200 S vibratome | Leica | 14048142066 | |
| LSM 880 with Airyscan | Zeiss | NA | |
| Metacam | Venusberg Apotheke | 8890217 | 5 mg/ml |
| Mice | Janvier Labs | NA | C57BL/6JRj |
| Micro-Adson Forceps | Fine Science Tools | 11018-12 | |
| Micropipette Storage Jar | World Precision Instruments | E210 | 16.16.27 |
| Microsoft Excel | Microsoft | NA | https://www.microsoft.com/en-us/microsoft-365/p/excel/cfq7ttc0k7dx?activetab=pivot:overviewtab |
| Millicell Cell Culture Insert | EMD Millipore | PICM0RG50 | 30 mm, hydrophilic PTFE, 0.4 µm |
| Moria Perforated Spoons | Fine Science Tools | 10370-18 | |
| Moria Spoon | Fine Science Tools | 10321-08 | |
| Neurobasal Medium, minus phenol red | ThermoFisher Scientific | 12348017 | |
| Neuropan-2 supplement | Pan-Biotech | P07-11010 | |
| Normal goat serum | Abcam | ab138478 | |
| Olsen-Hegar Needle Holder with Scissors | Fine Science Tools | 12002-12 | |
| p-Tub-alpha-1-Dre | Addgene | 133925 | |
| p-Tub-alpha-1-iCre | Addgene | 133924 | |
| p-Tub-alpha-1-LifeAct-GFP | Addgene | 175437 | |
| Parafilm | VWR | 52858-000 | |
| Paraformaldehyde | sigma-Aldrich | P6148 | |
| PBS | Sigma-Aldrich | P3813-10PAK | |
| pCAG-lox-rox-STOP-rox-tRFP-lox-Lyn-ZsGreen | Addgene | 175438 | |
| pCAG-lox-STOP-lox-Lyn-mNeonGreen | Addgene | 175257 | |
| Penicillin-Streptomycin | ThermoFisher Scientific | 15140122 | |
| PicoNozzle Kit v2 | World Precision Instruments | 5430-ALL | |
| Platinum Tweezertrodes | Harvard Apparatus | 45-0487 | 1 mm / 3 mm |
| QIAGEN Maxi kit | QIAGEN | 12162 | |
| Reflex wound closure Clip | World Precision Instruments | 500344-10 | 7 mm |
| Sekundenkleber Pattex Mini Trio | Lyreco | 4722659 | |
| Square wave electroporation system ECM830 | Harvard Apparatus | W3 45-0052 | |
| Sterile gauze | Braun Askina | 9031216 | |
| Sterile lubricant eye ointment | Bayer Vital | PZN1578675 | |
| Sterile surgical gloves | Sempermed | 14C0451 | |
| Sucrose | Roth | 4621.2 | |
| Supramid 5-0 surgical silk sutures | B. Braun | NA | |
| Thin-wall glass capillaries | World Precision Instruments | TW100-4 | |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Vannas spring scissors | Fine Science Tools | 15000-03 | |
| µ-Slide 8 Well Glass Bottom | Ibidi | 80827 |
Referanslar
- Schelski, M., Bradke, F. Neuronal polarization: From spatiotemporal signaling to cytoskeletal dynamics. Molecular and Cellular Neurosciences. 84, 11-28 (2017).
- Lowery, L. A., Van Vactor, D. The trip of the tip: understanding the growth cone machinery. Nature Reviews: Molecular Cell Biology. 10 (5), 332-343 (2009).
- Stoeckli, E. T. Understanding axon guidance: are we nearly there yet. Development. 145 (10), (2018).
- Bradke, F., Dotti, C. G. The role of local actin instability in axon formation. Science. 283 (5409), 1931-1934 (1999).
- Neukirchen, D., Bradke, F. Cytoplasmic linker proteins regulate neuronal polarization through microtubule and growth cone dynamics. Journal of Neuroscience. 31 (4), 1528-1538 (2011).
- Witte, H., Bradke, F. The role of the cytoskeleton during neuronal polarization. Current Opinion in Neurobiology. 18 (5), 479-487 (2008).
- Witte, H., Neukirchen, D., Bradke, F. Microtubule stabilization specifies initial neuronal polarization. Journal of Cell Biology. 180 (3), 619-632 (2008).
- Nichol, R. H., Catlett, T. S., Onesto, M. M., Hollender, D., Gomez, T. M. Environmental elasticity regulates cell-type specific RHOA signaling and neuritogenesis of human neurons. Stem Cell Reports. 13 (6), 1006-1021 (2019).
- Santos, T. E., et al. Axon growth of CNS neurons in three dimensions is amoeboid and independent of adhesions. Cell Reports. 32 (3), 107907(2020).
- Mitchison, T., Kirschner, M. Cytoskeletal dynamics and nerve growth. Neuron. 1 (9), 761-772 (1988).
- Lin, C. H., Thompson, C. A., Forscher, P. Cytoskeletal reorganization underlying growth cone motility. Current Opinion in Neurobiology. 4 (5), 640-647 (1994).
- Myers, J. P., Gomez, T. M. Focal adhesion kinase promotes integrin adhesion dynamics necessary for chemotropic turning of nerve growth cones. Journal of Neuroscience. 31 (38), 13585-13595 (2011).
- Turney, S. G., et al. Nerve growth factor stimulates axon outgrowth through negative regulation of growth cone actomyosin restraint of microtubule advance. Molecular Biology of the Cell. 27 (3), 500-517 (2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Noctor, S. C., Flint, A. C., Weissman, T. A., Dammerman, R. S., Kriegstein, A. R. Neurons derived from radial glial cells establish radial units in neocortex. Nature. 409 (6821), 714-720 (2001).
- Noctor, S. C., Martinez-Cerdeno, V., Ivic, L., Kriegstein, A. R. Cortical neurons arise in symmetric and asymmetric division zones and migrate through specific phases. Nature Neuroscience. 7 (2), 136-144 (2004).
- Ferent, J., Zaidi, D., Francis, F. Extracellular control of radial glia proliferation and scaffolding during cortical development and pathology. Frontiers in Cell and Developmental Biology. 8, 578341(2020).
- Dent, E. W., Gupton, S. L., Gertler, F. B. The growth cone cytoskeleton in axon outgrowth and guidance. Cold Spring Harbor Perspectives in Biology. 3 (3), (2011).
- Dupraz, S., et al. RhoA controls axon extension independent of specification in the developing brain. Current Biology. 29 (22), 3874-3886 (2019).
- Azzarelli, R., Oleari, R., Lettieri, A., Andre, V., Cariboni, A. In vitro, ex vivo and in vivo techniques to study neuronal migration in the developing cerebral cortex. Brain Sciences. 7 (5), (2017).
- Humpel, C. Organotypic brain slice cultures: A review. Neuroscience. 305, 86-98 (2015).
- Namba, T., et al. Pioneering axons regulate neuronal polarization in the developing cerebral cortex. Neuron. 81 (4), 814-829 (2014).
- Shah, B., et al. Rap1 GTPases are master regulators of neural cell polarity in the developing neocortex. Cerebral Cortex. 27 (2), 1253-1269 (2017).
- Wiegreffe, C., Feldmann, S., Gaessler, S., Britsch, S. Time-lapse confocal imaging of migrating neurons in organotypic slice culture of embryonic mouse brain using in utero electroporation. Journal of Visualized Experiments: JoVE. (125), (2017).
- de Anda, F. C., Meletis, K., Ge, X., Rei, D., Tsai, L. H. Centrosome motility is essential for initial axon formation in the neocortex. Journal of Neuroscience. 30 (31), 10391-10406 (2010).
- Sakakibara, A., et al. Dynamics of centrosome translocation and microtubule organization in neocortical neurons during distinct modes of polarization. Cerebral Cortex. 24 (5), 1301-1310 (2014).
- Schatzle, P., Kapitein, L. C., Hoogenraad, C. C. Live imaging of microtubule dynamics in organotypic hippocampal slice cultures. Methods in Cell Biology. 131, 107-126 (2016).
- Qu, X., Kumar, A., Bartolini, F. Live imaging of microtubule dynamics at excitatory presynaptic boutons in primary hippocampal neurons and acute hippocampal slices. STAR Protocols. 2 (1), 100342(2021).
- Tonnesen, J., Katona, G., Rozsa, B., Nagerl, U. V. Spine neck plasticity regulates compartmentalization of synapses. Nature Neuroscience. 17 (5), 678-685 (2014).
- Buchsbaum, I. Y., Cappello, S. Neuronal migration in the CNS during development and disease: insights from in vivo and in vitro models. Development. 146 (1), (2019).
- Rigby, M. J., Gomez, T. M., Puglielli, L. Glial cell-axonal growth cone interactions in neurodevelopment and regeneration. Frontiers in Neuroscience. 14, 203(2020).
- Barnes, A. P., Polleux, F. Establishment of axon-dendrite polarity in developing neurons. Annual Review of Neuroscience. 32, 347-381 (2009).
- Multiphoton Microscope Leica TCS SP8 MP. Microsystems. , Available from: http://www.leica-microsystems.com/products/confocal-microscopes/p/leica-tcs-sp8-sted-one/ (2021).
- ZEISS Lattice Lightsheet 7. Zeiss. , Available from: http://www.zeiss.com/microscopy/int/products/imaging-systems/lattice-lightsheet-7.html (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır