Method Article
In situ Visualização da Dinâmica do Cone de Crescimento e Crescimento do Axon em Culturas agudas de fatias de cérebro embrionário ex vivo
Neste Artigo
Resumo
Este protocolo demonstra um método simples e robusto para estudar na dinâmica do cone de crescimento e crescimento do axônio. Ele descreve como preparar ex vivo fisiologicamente relevantes fatias cerebrais agudas e fornece um pipeline de análise amigável.
Resumo
Durante o desenvolvimento neuronal, os axônios navegam pelo ambiente cortical para chegar aos seus destinos finais e estabelecer conexões sinápticas. Cones de crescimento - as estruturas sensoriais localizadas nas pontas distais do desenvolvimento de axônios - executam esse processo. Estudar a estrutura e a dinâmica do cone de crescimento é crucial para entender o desenvolvimento axonal e as interações com o sistema nervoso central circundante (SNC) que lhe permitem formar circuitos neurais. Isso é essencial ao elaborar métodos para reintegrar axônios em circuitos neurais após lesões em pesquisas fundamentais e contextos pré-clínicos. Até agora, a compreensão geral da dinâmica do cone de crescimento é baseada principalmente em estudos de neurônios cultivados em duas dimensões (2D). Embora, sem dúvida, fundamental para o conhecimento atual da dinâmica estrutural do cone de crescimento e da resposta a estímulos, estudos 2D deturpam o ambiente fisiológico tridimensional (3D) encontrado por cones de crescimento neuronal no tecido CNS intacto. Mais recentemente, os géis de colágeno foram empregados para superar algumas dessas limitações, permitindo a investigação do desenvolvimento neuronal em 3D. No entanto, tanto os ambientes sintéticos 2D quanto os 3D carecem de sinalização dentro do tecido CNS, que direcionam a extensão e o pathfinding de axônios em desenvolvimento. Este protocolo fornece um método para estudar axônios e cones de crescimento usando fatias cerebrais organotípicas, onde os axônios em desenvolvimento encontram pistas físicas e químicas fisiologicamente relevantes. Ao combinar afinação na eletroporação uterópica e ex utero para entregar repórteres fluorescentes e pouco, juntamente com microscopia de super resolução, este protocolo apresenta um pipeline metodológico para a visualização da dinâmica do axônio e do cone de crescimento in situ. Além disso, uma descrição detalhada do kit de ferramentas da análise de dados de imagem de células vivas e de longo prazo está incluída.
Introdução
Os neurônios são células altamente polarizadas que representam a unidade computacional básica no sistema nervoso. Eles recebem e emitem informações que dependem da compartimentação dos locais de entrada e saída: dendritos e axônios, respectivamente1. Durante o desenvolvimento, os axônios se estendem enquanto navegam em um ambiente complexo incrível para chegar ao seu destino. A navegação axon é guiada pelo cone de crescimento, uma estrutura sensorial localizada na ponta do axônio em desenvolvimento. O cone de crescimento é responsável por detectar pistas ambientais e traduzi-las na reorganização espacial dinâmica de seu citoesqueleto 2,3. As reações morfom mecânicas resultantes instruem o cone de crescimento a estender ou retrair-se da deixa de acionamento, levando a manobras específicas de axônio.
O entendimento atual da dinâmica da extensão do axônio e do cone de crescimento decorre de estudos que avaliam o crescimento do axônio em relação aos substratos bidimensionais (2D) 2,4,5,6,7. Esses estudos pioneiros identificaram uma interação sofisticada entre cones de crescimento e substratos de crescimento e revelaram diferenças marcantes dependentes de características de substrato, como adesivo e rigidez 8,9. Liderados por esses insights, as pistas ambientais extracelulares foram hipóteses para ditar o crescimento do axônio, com o citoesqueleto de cone de crescimento executando esse crescimento 2,10,11,12. Notavelmente, os neurônios podem estender axônios em substratos não adesivos (por exemplo, poli-lysina, poli-ornitina)13. Além disso, a rigidez do substrato pode influenciar a taxa de crescimento do axônio independente dos complexos adesivoscelulares 8. Assim, estudar a dinâmica do cone de crescimento em substratos 2D sozinhos não pode modelar com precisão o equilíbrio de forças que surgem da interação de cones de crescimento axonal com ambientes tridimensionais (3D) fisiologicamente relevantes, como os encontrados in vivo.
Para superar as limitações dos ensaios 2D, o crescimento do axônio e a dinâmica do cone de crescimento têm sido estudados em matrizes 3D 8,9. Essas matrizes representam um contexto mais fisiológico, mas permitem estudar mecanismos intrínsecos de crescimento de axônio. Permite o exame do cone de crescimento de forma unicelular em uma variedade de condições e tratamentos farmacológicos9. Em tais ambientes 3D, os axônios apresentaram dinâmicas citoesqueléticos distintas e cresceram mais rápido do que os observados nos neurônios 2Dcultivados 9. Esses estudos elegantes demonstraram a influência de uma dimensão extra na reorganização do citoesqueleto do cone de crescimento e, consequentemente, no seu comportamento.
Apesar das vantagens aparentes apresentadas pelas matrizes 3D sobre superfícies 2D no suporte ao desenvolvimento neuronal nativo e ao crescimento do axônio, elas continuam sendo um andaime sintético simplificado que não pode refletir a complexidade da dinâmica observada no tecido do sistema nervoso central (SNC). Aqui, a entrega de plasmídeos repórteres pelo ex utero e na eletroporação uteral foi combinada com a cultura de fatia organotípica cerebral e imagens de super-resolução ao vivo in situ para analisar a dinâmica do cone de crescimento dentro de um contexto fisiológico. Essa metodologia permite a visualização do desenvolvimento de axônios ao experimentar a tridimensionalidade dos ambientes in vivo e a complexidade de sua composição físico-química. Por fim, são descritos procedimentos fáceis de usar para medir a dinâmica do cone de crescimento e crescimento do axônio usando softwares comumente licenciados e disponíveis publicamente.
Protocolo
Os experimentos em animais devem estar em conformidade com as normas institucionais e federais pertinentes. Neste protocolo foram utilizados camundongos gestantes C57BL/6JRj gestantes C57BL/6JRj. Os experimentos foram realizados de acordo com a Lei de Bem-Estar Animal da Agência Estadual de Meio Ambiente de Rhein-Westphalia do Norte (Landesamt für Natur, Umwelt und Verbraucherschutz (LANUV).
1. Preparação de plasmídeos para injeção
- Isole o DNA usando o kit Maxiprep sem endotoxinas de acordo com o protocolo do fabricante (ver Tabela de Materiais).
- Misture o DNA selecionado na concentração desejada (Tabela 1) e a solução 10% Verde Rápido (ver Tabela de Materiais) para visualizar a entrega da mistura de DNA em ventrículos cerebrais.
NOTA: Foram utilizados plasmídeos específicos para rotulagem esparsa dos neurônios corticais (Figura 1A), estruturas de atointina filamentosa (F-actin) no cone de crescimento (Figura 1B) e rotulagem dupla dos cones de crescimento dentro do mesmo córtex (Figura 1C). Todos os plasmídeos (Tabela 1) utilizados neste protocolo foram depositados em Addgene (ver Tabela de Materiais). - Prepare os capilares de vidro usando um conjunto de puxador de eletrodo capilar conforme o seguinte programa: pressão: 500, calor: 800, puxão: 30 e velocidade: 40.
- Carregue 15 μL de DNA/Fast Green misture em cada capilar de vidro usando pontas de pipeta de micro carregadeira.
NOTA: Certifique-se de que não há bolhas. - Armazene capilares cheios de DNA em um prato de 10 cm com um pedaço de argila modeladora em todo o diâmetro do prato. Os capilares podem ser carregados e armazenados a 4 °C um dia antes do experimento. Sele a parte de trás do capilar com filme flexível para evitar a secagem.
2. Preparação de soluções
- Prepare a solução de sal tampão da Hank-suplementada com glicose (HBSS-G).
- Adicione 0,5% de 20% de glicose a uma garrafa de 1x HBSS. Misture bem e armazene a 4 °C por até 2 semanas. Para a extração do embrião, bolha hbss-g solução com carbogen (95% O2 e 5% CO2) usando pedra borbulhante pouco antes da coleta de embriões.
- Solução de mídia fatia
- Prepare a mídia de fatia fresca contendo Neurobásal 1x, 5% serum de cavalo, 5% soro fetal, suplemento B27 1:50, suplemento L-glutamina 1:400, penicilina-estreptomicina 1:200, e suplemento neuropan-2 1:100 (no pH = 7,3), sob condições estéreis (ver Tabela de Materiais).
- Prepare pratos de 3 cm com 1 mL de massa fatia cada. Coloque na incubadora a 35 °C com 5% de CO2 por pelo menos 1 h antes do experimento para equilibrar o pH da mídia através da troca de gás.
NOTA: O equilíbrio do pH da mídia é causado pela acidificação da mídia pelo CO2 da incubadora. A mídia de fatias pode ser armazenada a 4 °C por até 1 semana.
- Solução de ponto de fusão baixa (3%)
- Pese a quantidade desejada de baixo ponto de fusão em pó de ágarose e dissolva em um volume apropriado de 1x HBSS-G em uma garrafa de vidro. Aproximadamente 7 mL de solução agarose por cérebro é necessário.
- Coloque a garrafa em um micro-ondas por 2-3 minutos, com a tampa colocada livremente, e agite a cada 10-20 s.
- Uma vez que o pó tenha completamente dissolvido, coloque a garrafa em um banho de água ou banho de contas definido para 37 °C pelo menos 1 h antes do experimento para permitir que a agarose esfrie.
NOTA: Recomenda-se aquecer a agarose duas vezes ao longo de 15 minutos para garantir que o pó de agarose seja dissolvido. Isso é crucial para a adequada adesão da agarose ao tecido cerebral. Um termômetro deve ser usado para medir a temperatura da solução agarose enquanto incorpora cérebros, certificando-se de que está entre 37-40 °C. Cérebros de diferentes animais idosos têm rigidez diferente. Recomenda-se testar uma série de concentrações de agarose para encontrar a homogeneidade entre tecido e agarose. - Prepare salina tamponada fosfato com 0,3% Triton X-100 (PBS-T).
- Prepare salina tamponada fosfato com azida de sódio de 0,2% (PBS-NaN3).
NOTA: As soluções descritas nas etapas 2.4-2.5 são para uso na etapa de imunohistoquímica posterior.
3. Preparação da estação de cirurgia
- Limpe a estação de cirurgia com 70%-96% de etanol e coloque a operação na superfície da estação.
- Esterilize os instrumentos cirúrgicos enxaguando com 70%-96% de etanol, seguido de esterilização a seco em um esterilizador de contas quentes.
- Eletrodos de pinça de platina limpa (ver Tabela de Materiais) com 70%-96% de etanol antes de se conectar ao gerador de pulso.
- Insira um capilar de vidro cheio de DNA/Fast Green no suporte capilar. Imediatamente antes do uso, quebre suavemente a ponta capilar usando uma tesoura fina e teste o fluxo da solução dentro de um tubo de microcentrifus de 1,5 mL cheio de soro fisiológico pré-aquecido ou água.
NOTA: Figura 2A,B mostram configuração da estação de cirurgia e ferramentas utilizadas para eletroporação ex utero (EUE) e na eletroporação uteral (IUE). - Para iUE, aqueça solução salina a 37 °C em banho-maria.
4. Extração de embriões
- Coloque o rato grávida na câmara indutora da anestesia com 5% de isoflurano até que o rato esteja profundamente anestesiado. Confirme a anestesia pela ausência de reflexo de retirada do pedal.
- Transfira o mouse para uma operação e mantenha a isoflurane em 1,5%-2% através de um cone de nariz.
- Aplique pomada em ambos os olhos para evitar a secagem da córnea.
- Raspe o abdômen do rato e use gaze encharcada de etanol de 70%-96% para remover o cabelo raspado. Limpe a área com betadina.
- Utilizando uma pequena tesoura cirúrgica estéril, faça uma incisão de pele de 2 cm ao longo da linha média abdominal, seguida de uma incisão muscular de 1,5 cm.
NOTA: O tamanho da incisão depende do tamanho do embrião. De fato, embriões maiores exigirão uma incisão maior para acomodar sua extração. - Corte um orifício no meio da gaze suficientemente largo para caber a incisão da pele (~2 cm de diâmetro), mergulhe-a com soro fisiológico quente e coloque-a ao redor da abertura abdominal.
- Retire ambos os chifres uterinos usando um broto de algodão encharcado em soro fisiológico quente ou usando fórceps, cuidadosamente agarrando os espaços entre os embriões para retirá-los. Coloque embriões na gaze molhada (Figura 2C).
NOTA: Mesmo um pequeno dano aos vasos sanguíneos e capilares ao redor dos chifres uterinos provavelmente resultará em sangramento profuso. Portanto, evite o manuseio direto dessas áreas vascularizadas o tempo todo. - Abra o saco uterino e remova cada embrião (Figura 2D).
- Eutanize cada embrião imediatamente após a extração através de um corte diagonal descendente, garantindo a transecção completa da medula espinhal (Figura 2E).
- Coloque os embriões em um prato de 10 cm contendo HBSS-G no gelo.
NOTA: A decapitação do embrião é evitada para evitar vazamento de DNA/Fast Green do cérebro e facilitar o posicionamento fácil do embrião no suporte (ver ex eletroporação uteróvia , passo 5). - Sacrifique a mãe imediatamente após a extração de embriões realizando luxação cervical.
NOTA: Aqui, a mãe é eutanizada sob anestesia para poupá-la de qualquer outra dor pós-procedimento ou sofrimento em conformidade com o protocolo aprovado pela Lei de Bem-Estar Animal da Agência Estadual de Meio Ambiente de Rhein-Vestfália do Norte (LANUV).
5. Ex utero eletroporação (EUE)
- Pegue um embrião e coloque-o no suporte.
NOTA: Uma ponta de pipeta de 1 mL cortada presa à extremidade de um raspador de células é usada como suporte de embrião. É essencial manter braços de embriões fora da ponta durante o procedimento para evitar que deslizem para a ponta (Figura 2F-I). O diâmetro da ponta da pipeta é facilmente ajustável para acomodar embriões de vários tamanhos. Corte uma segunda ponta de comprimento onde o diâmetro da ponta corresponda ao tamanho do embrião e use-o como uma inserção adaptador ao suporte mencionado acima. - Insira cuidadosamente DNA/Capilar de vidro cheio de verde rápido através do crânio do embrião no ventrículo lateral e injete 2-3 μL de mistura plasmida de DNA (Figura 1A,B; Tabela 1) em cada ventrículo (Figura 2F).
NOTA: Use as suturas lambdoidal e sagital como guia para a localização da injeção de DNA. As suturas lambdoidal e sagital são articulações fibrosas que ligam a placa óssea do crânio. O primeiro junta o osso parietal com o osso occipital, e o segundo se junta aos dois ossos parietal. - Segure a cabeça do embrião entre eletrodos de pinça de platina no ângulo apropriado para atingir a área cerebral desejada (ângulo de 60° neste caso), com o cátodo voltado para a área onde se destina a transferência de DNA (Figura 2G-H).
- Aplique cinco pulsos a 30 mV com um intervalo de 1 s e uma duração de 50 ms usando um gerador de pulso de onda quadrada.
NOTA: Tenha em mente que os cérebros no EUE experimentam um campo elétrico mais eficaz do que os da IUE. Assim, em uma dada concentração de DNA, o EUE resulta em maior eficiência da transferência de DNA do que a IUE, e as concentrações de DNA precisam ser ajustadas em conformidade. - Se desejar a eletroporação bilateral, repita as etapas 5.3-5.4 com o cátodo e o ânodo espelhando a posição anterior para atingir o córtex contralateral.
NOTA: Como ambos os ventrículos foram injetados com DNA, cortices de ambos os hemisférios foram alvos. - Coloque o embrião eletroporado em um prato de 6 cm contendo HBSS-G gelado. Repita as etapas 5.1-5.6 para todos os embriões necessários.
6. Na eletroporação uterótera (IUE)
- Injetar camundongo grávida com analgésico; 50 μL de buprenorfina (0,1 mg/kg) (ver Tabela de Materiais) subcutânea, 20 min antes do procedimento.
- Realizar as etapas 4.1-4.8 da seção de extração de embriões.
NOTA: Evite deixar embriões expostos desnecessariamente cobrindo-os com gaze estéril encharcada em soro fisiológico quente. - Com as pontas dos dedos, gire suavemente o embrião dentro do útero até que as suturas lambdoidal e sagital estejam localizadas (Figura 2J). Insira cuidadosamente DNA/Vidro Verde Rápido capilar através da parede uterina e crânio de embrião no ventrículo lateral e injete 2-3 μL de mistura plasmida de DNA (Figura 1A,C) em um ou ambos os ventrículos conforme desejado (Figura 2K-L).
NOTA: A pressão excessiva dos dedos nos chifres uterinos pode levar ao colapso do saco amniótico. - Segure a cabeça do embrião entre eletrodos de pinça de platina no ângulo apropriado para atingir a área cerebral desejada (ângulo de 60° neste caso), com o cátodo voltado para a área onde a transferência de DNA é pretendida. Evite apertar o útero, pois pode causar o colapso do saco amniótico (Figura 2M).
- Aplique cinco pulsos a 35 mV com um intervalo de 600 ms e uma duração de 50 ms usando um gerador de pulso de onda quadrada.
- Se ambos os ventrículos laterais foram injetados, repita as etapas 6.5-6.6 com o cátodo e o ânodo espelhando a posição anterior para atingir o córtex contralateral.
- Repita as etapas 6.3-6.6 para todos os embriões necessários.
- Uma vez que todos os embriões necessários tenham sido eletroporados, use um broto de algodão encharcado de soro fisiológico para colocar chifres uterinos de volta dentro da cavidade abdominal suavemente.
NOTA: A adição de solução salina na cavidade peritoneal ajudará os chifres uterinos a voltarem à posição. - Inisões musculares e de pele sutura usando material de sutura 5-0. Use clipes de sutura para fixar a ferida e desinfetar a ferida da sutura pulverizando-a com betadina (Figura 2N-P).
- Injete o mouse com 200 μL de 5% de glicose subcutânea.
- Injete um antibiótico no rato; 50 μL de Enrofloxacina (5 mg/kg) subcutânea (ver Tabela de Materiais).
- Coloque o mouse de volta na gaiola de recuperação e mantenha o calor usando uma luz de aquecimento ou almofada de aquecimento por pelo menos 20 minutos após o procedimento (Figura 2Q).
- Monitore o rato diariamente e injete meloxicam após o procedimento para alívio da dor seguindo diretrizes institucionais e federais.
- Extrair embriões 2 dias após o procedimento (ou seja, E17,5) seguindo a etapa 4.
7. Extração cerebral e incorporação em agarose
NOTA: Recomenda-se realizar as seguintes etapas sob um microscópio de dissecção para melhor precisão. Evitar danos ao cérebro é fundamental para o sucesso do procedimento.
- Configure ferramentas de extração em um espaço de trabalho estéril sob uma capa de dissecção (Figura 3A).
- Separe a cabeça de um embrião do resto do corpo usando uma tesoura de dissecção.
- Fixar a cabeça como mostrado na Figura 3C e, em seguida, remover a pele e o crânio cortando ao longo da linha média, começando da base da cabeça em direção ao nariz (Figura 3D).
- Descasque a pele e o crânio lateralmente, fazendo uma lacuna grande o suficiente (~1 cm) para que o cérebro seja extirpado.
- Para remover o cérebro, insira a ponta fechada da tesoura de dissecção estéril, começando sob a lâmpada olfativa movendo-se em direção ao tronco cerebral (Figura 3E).
- Corte o tronco cerebral e corte quaisquer pedaços soltos de meninges ao redor do cérebro (Figura 3F).
NOTA: Meninges soltas muitas vezes fazem com que as fatias permaneçam presas ao bloco de agarose após o corte, levando ao descolamento do tecido da agarose durante a coleta de fatias. - Repita os passos 7.1-7.6 para todos os embriões e mantenha os cérebros no gelo (idealmente não mais do que 30 minutos) até o passo de incorporação.
NOTA: As seguintes etapas 7.7.1-7.7.4 referem-se à extração cerebral de cérebros E12.5.- Isole a parte superior da cabeça logo abaixo do olho, como mostrado na Figura 3G.
- Corte a pele e o crânio em cima do tronco cerebral, seguindo a linha tracejada como mostrado na Figura 3H, sem remover o tronco cerebral.
- Faça uma incisão de 2 mm na parte de trás da cabeça, como mostrado na Figura 3I (ver desenhos para clareza).
NOTA: Esta incisão fornece pontos de agarramento iniciais para descascar as camadas da pele e do crânio. Normalmente, eles saem como uma camada. O tamanho típico da incisão é de 2 mm, correspondendo ao comprimento da borda de corte da tesoura de micro mola usada. - Comece a descascar camadas de crânio de pele, protegendo um lado da incisão e puxando o outro cuidadosamente. Com o mesmo cuidado, finalize descascando a base da cabeça até libertar o cérebro (Figura 3J).
NOTA: Isso deve ser feito com muito cuidado, observando que o cérebro não está sendo puxado ao longo das camadas teciduais. Lados alternativos para remover o tecido que cobre o cérebro.
- Despeje agarose quente (a 37-40 °C) em um prato de 3 cm.
- Pegue o cérebro usando uma colher perfurada e remova o excesso de líquido, esfregando o fundo da colher contra papel de tecido seco. Coloque o cérebro em um prato de agarose.
NOTA: É essencial remover o máximo de líquido possível ao redor do cérebro para permitir uma melhor adesão da ágarose ao tecido. - Coloque o prato com líquido agarose no gelo. Usando uma colher menor, misture a agarose por 10 s para mesmo resfriamento. Manobrar o cérebro para o meio do prato. Coloque o cérebro horizontalmente no prato com o lado dorsal para cima, garantindo que ele esteja completamente coberto com agarose de todas as direções (Figura 3K).
NOTA: Os cérebros muitas vezes afundarão no fundo do prato uma vez colocados em agarose; levantar o cérebro usando uma colher pequena até que uma lacuna de 1-2 mm sob o cérebro seja estabelecida. - Repita os passos 7.8-7.10 para todos os cérebros.
- Uma vez que a agarose tenha polimerizado, adicione 500 μL de HBSS-G em cima do bloco de agarose para evitar a secagem. Em seguida, cubra o prato com gelo.
NOTA: Mantenha a amostra no gelo por 5 minutos antes da seção para permitir que a temperatura cerebral atinja 4 °C.
8. Cultura de fatia organotípica
NOTA: Vibratome limpo e superfícies circundantes com 70%-96% de etanol para evitar contaminação de fatias. A configuração da estação de trabalho vibratome (ver Tabela de Materiais) é mostrada na Figura 3B.
- Encha a bandeja de tampão vibratome com HBSS-G frio e a bandeja externa com gelo para manter o HBSS-G frio durante todo o procedimento.
- Forneça continuamente HBSS-G na bandeja de tampão com carbogen usando uma pedra borbulhante.
- Usando uma lâmina fresca, faça um corte grande (~2 x 2 cm) ao redor do cérebro e remova um bloco de agarose contendo o cérebro, com agarose ao redor suficiente para aparar a agarose em um pequeno bloco retângulo.
NOTA: Esta etapa permite ajustar o ângulo do bloco para que o eixo sagital do cérebro seja perpendicular à placa vibratome e o eixo coronal se alinhe paralelo à lâmina. Deixe cerca de 5 mm de agarose no lado dorsal do cérebro para facilitar o manuseio das fatias. - Coloque uma pequena gota de supercola livre de solventes de adesivo rápido no meio do suporte do espécime e espalhe para uma área que cobrirá a parte inferior do bloco de agarose.
- Pegue suavemente o bloco de agarose e seque o fundo, esfregando contra papel de tecido. Coloque o bloco na área colada do suporte do espécime, com o lado rostral do cérebro para cima. Coloque o suporte do espécime no gelo e deixe a cola secar por 1 min.
- Uma vez que a cola tenha secado, coloque o suporte do espécime na bandeja de tampão.
- Corte o cérebro em fatias coronais em um ângulo de 15°.
NOTA: A espessura das fatias pode variar dependendo da aplicação. Aqui, os cérebros foram cortados a uma espessura de 150 μm. Ajuste a velocidade do vibratome para 1,0-1,5 mm/s para aparar o excesso de agarose em cima e aparar lâmpadas olfativas. Reduza a velocidade de corte para 0,5 mm/s para coletar fatias corticais para análise. A maioria dos vibratomes pode ser pausada para coletar cada fatia. Se for experimentada a qualidade reduzida das fatias ou o desapego do tecido da ágarose, reduzir a velocidade de corte ou substituir a lâmina vibratome pode ajudar. - Usando espátulas limpas, colete fatias cerebrais e coloque-as na membrana Politetrafluoroetileno (PTFE), imobilizada em um prato com fundo de vidro de 35 mm usando parafina (até cinco fatias cerebrais/membrana) (Figura 3L-M).
NOTA: Fixar a membrana PTFE dentro de um prato com fundo de vidro de 35 mm usando cera. Isso estabilizará a membrana ao adicionar a mídia de cultura de fatias e também durante a imagem. - Usando uma pipeta de 200 μL, remova o excesso de HBSS-G ao redor das fatias na membrana PTFE, deixando as fatias semi-secas.
- Adicione 500 μL de mídia fatia (pré-aquecida a 35 °C) diretamente ao espaço sob a membrana PTFE.
NOTA: Nenhuma bolha deve se formar sob a membrana ao adicionar a mídia. Isso deixará fatias inteiras ou parciais sem troca de mídia. Substitua 200 μL de mídia a cada 2 dias na cultura ou após cada sessão de imagem. - Incubar as fatias a 35 °C com 5% de CO2.
9. Imunohistoquímica
- Fixar fatias com 1 mL de 4% de paraformaldeído (PFA) -complementado com 4% de sacarose por prato. Incubar na RT por 30 minutos.
ATENÇÃO: Ao manusear pfa, use um jaleco e luvas. Realize etapas de fixação sob um capô químico e descarte adequadamente os resíduos de PFA. - Lave as fatias duas vezes com 300 μL PBS por 5 min. Transfira as fatias para uma placa de 24 poços.
NOTA: O experimento pode ser pausado nesta fase. Adicione PBS-NaN3 às fatias e armazene a 4 °C. NaN3 é um composto tóxico; ao manusear soluções com ele, use um jaleco e luvas. As etapas 9.3-9.10 devem ser realizadas em um agitador orbital. - Sacie as fatias com 300 μL de 0,1 M de glicecina a 4 °C durante a noite.
- Lave a glicina com PBS em RT 3x por 10 min.
- Permeabilise as fatias com 300 μL de PBS-T na RT por 2 h.
- Bloqueie usando 10% de soro de cabra em PBS-T no RT por 2 h.
- Adicionar 300 μL de anticorpo primário (anticorpo anti-vimentina a uma diluição de 1:200; ver Tabela de Materiais) diluído em 10% de soro de cabra na solução PBS-T a 4 °C durante a noite.
NOTA: Nas etapas 9.8-9.12, as fatias eram protegidas pela luz para evitar a perda de fluorescência. - Lave o anticorpo primário com PBS em RT 3x por 20 min.
NOTA: O PBS foi usado em vez de PBS-T para lavar o Triton X-100. - Adicione 300 μL de anticorpo secundário (alexa Fluor 488 ou 647 a uma diluição de 1:400; ver Tabela de Materiais) em PBS na RT por 2 h.
NOTA: O DAPI é adicionado imediatamente após a remoção do anticorpo secundário a uma diluição de 1:10.000 por 5 min. - Lave o anticorpo secundário com PBS em RT 3x por 20 min. Lave com água destilada 2x por 1 min.
- Transfira as fatias para um escorregador de vidro usando uma escova fina e, em seguida, seque a 30 °C por 20 min.
- Monte as fatias usando um meio de montagem aquoso. Mantenha os slides no RT durante a noite para que a mídia de montagem faça a curadoria.
10. Aquisição de imagens
NOTA: Independentemente da abordagem de entrega de DNA (IUE ou EUE), as fatias foram analisadas na mesma faixa etária de desenvolvimento (E17,5-E18,5). A IUE permite que os progenitores neuronais dividam e se desenvolvam por mais dois dias in vivo. A EUE, por outro lado, permite o acompanhamento de eventos de desenvolvimento precoce.
- Ligue a incubadora da câmara e coloque-a a 35 °C com 5% de CO2-idealmente 4 h antes da imagem - para permitir que os componentes do microscópio se equilibrem a 35 °C.
- Para imagens profundas de fatias, use objetivos de imersão em água para reduzir a incompatibilidade no índice de refração entre o tecido e o objetivo.
NOTA: Aqui, foi utilizado o modo de imagem de super resolução. A imagem através da membrana PTFE requer um objetivo com uma longa distância de trabalho (~1 mm). Se um objetivo de longa distância de trabalho não estiver disponível, as fatias podem ser transferidas para um prato com fundo de vidro de 8 poços. Para transferir fatias, adicione 1 mL de massa fatiada na parte superior da membrana e, em seguida, use uma espátula para levantar uma fatia e transfira para um poço contendo 200 μL de mídia. Remova o excesso de mídia usando uma ponta de pipeta de 1 mL deixando as fatias semi-secas. - Para o crescimento do axônio por imagem, localize uma região do córtex com densidade celular de baixa a média. Para a dinâmica do cone de crescimento de imagem, localize um cone de crescimento na zona intermediária do córtex ou zona subventricular.
- Defina um tamanho de pilha de z no software de processamento de imagens (ver Tabela de Materiais). Para o crescimento do axônio em uma grande pilha z, defina um tamanho de passo de 2 μm. Para cones de crescimento em uma pilha z menor, defina um tamanho de passo de 1 μm.
NOTA: Sempre conta com o movimento potencial do cone de crescimento e do axônio através dos planos x, y e z. Axônios crescem a uma taxa muito maior em culturas organotípicas do que em culturas in vitro . Aqui, uma pilha de z de cerca de 80 μm para o crescimento do axônio de imagem foi suficiente. Para a dinâmica do cone de crescimento, uma pilha de z de ~6 μm foi adequada. - Para o crescimento do axônio de imagem de neurônios em uma área maior, defina uma tomografia.
- Use a menor potência laser possível para minimizar as chances de branqueamento de cones de crescimento durante a aquisição.
- Para o crescimento do axônio por imagem, adquira lapsos de tempo por 2h com um intervalo de 5 minutos. Para a dinâmica do cone de crescimento de imagens, adquira lapsos de tempo por 2-5 min com um intervalo de 2,5-3 s.
11. Análise de dados
- Meça a velocidade de crescimento do axônio usando kymographs
- Abra o arquivo de imagem em Fiji14 através do Arquivo > Abra e selecione a imagem.
- Obtenha a projeção de intensidade máxima do lapso de tempo através do Image > Stacks > Z-Projection > Projeção Máxima de Intensidade.
- Passe pelo lapso de tempo e localize um axônio em crescimento.
- Uma vez localizado, desenhe uma linha através do axônio em crescimento. Comece pela ponta do axônio no primeiro quadro e siga o axônio durante todo o lapso de tempo.
- Gere um kymograph usando o plugin KymoResliceWide.
- Defina a escala do kymograph indo para Image > Properties. Defina a distância em μm na Largura do Pixel e ajuste o tempo em s ou min na Altura do Pixel.
- Vá analisar > Medida.
NOTA: Será dado um ângulo relativo ao eixo x. - Calcule a velocidade do crescimento do axônio substituindo o ângulo na seguinte equação: SIN(RADIANS(φ))/COS(RADIANS(φ)) em uma planilha.
- Meça o volume do cone de crescimento usando um software de análise de imagem (ver Tabela de Materiais).
- Abra o arquivo de imagem no software de análise de imagens através do Arquivo > Abra e selecione o arquivo de interesse.
- Selecione o assistente Adicionar novas superfícies .
NOTA: Uma seção no canto inferior esquerdo aparecerá com seis passos para edição manual. - Na etapa 1 -em Configurações de algoritmos- selecione Segmento Apenas Uma região de interesse. Na etapa 2, corte o quadro para encaixar todo o cone de crescimento em todos os quadros.
- Mantenha o limiar para intensidade absoluta na etapa 3, e garanta que toda a região do cone de crescimento seja limiar na etapa 4.
- Na etapa 5, selecione Número de Voxels lmg = 1 em Tipo de Filtro.
NOTA: Na última etapa, vários conjuntos de medição podem ser criados. Aqui, apenas uma medição foi criada para volume. - Selecione o botão Executar para executar todas as etapas de criação e finalizá-lo com o Assistente adicionar novas superfícies.
- Na guia Estatísticas na parte superior da janela assistente, selecione Valores e Volumes Específicos na guia Detalhado.
Resultados
Os resultados representativos obtidos com o fluxo de trabalho do método descrito são mostrados. Os camundongos E15.5 foram usados na presente demonstração, embora este protocolo seja facilmente adaptável a praticamente todas as idades embrionárias que variam de E11 ao E17 tardio. Neste protocolo, seja ex eletroporação do útero (EUE; Figura 2A, 2C-I) ou em eletroporação uterórica (IUE; As figuras 2B,C e 2J-Q) foram utilizadas para entregar plasmídeos nos neurônios progenitores que revestem os ventrículos laterais. Esses progenitores são a fonte de futuros neurônios de projeção cortical (CPN)15,16. As misturas plasmóides foram preparadas para conduzir a expressão esparsa específica dos neurônios de ambos os membros da membrana (Lyn)-mNeonGreen (Figura 1A) ou do LifeAct (E)GFP (Figura 1B) para avaliar o comportamento geral e a dinâmica da actina em cones de crescimento, respectivamente. Além disso, foi incluído um mix de plasmídeos destinado a rotular neurônios individuais com proteína fluorescente verde (ZsGreen) (Figura 1C) turbo(t)-RFP ou zoanthus sp. (Zs) (Figura 1C). Isso facilita o monitoramento do comportamento do cone de crescimento a partir de neurônios vizinhos independentes.
A dissecção cerebral de embriões eletroporados é um passo crucial que precisa ser cuidadosamente realizado para obter fatias de alta qualidade, preservando a estrutura cerebral nativa. Os instrumentos de dissecção e vibratome foram preparados de antemão e cuidadosamente esterilizados por etanol (Figura 3A,B). Em seguida, as cabeças dos embriões eletroporados foram cuidadosamente dissecadas e os cérebros foram extraídos. Aqui, são mostradas dissecção representativa dos cérebros dos embriões submetidos ao EUE em E15 (Figura 3C-F) e E12,5 (Figura 3G-J). Os cérebros são imediatamente envoltos em uma matriz de agarose, fatiado e colocado em pastilhas de membrana PTFE dentro de uma placa de vidro inferior para incubação (Figura 3K-M).
O estado de saúde das fatias cerebrais é um ponto significativo para o controle para garantir resultados confiáveis. Uma inspeção visual para qualquer contaminação foi realizada diariamente. Além disso, uma vez que a cultura foi finalizada, as fatias cerebrais são fixas e submetidas à imunohistoquímica. Aqui, 4′,6-diamidino-2-fenildole (DAPI) foi usado para controlar a organização celular global e a coloração de vimentina para revelar a organização gliana; particularmente, andaime radial glia (RG). Normalmente, fatias cerebrais cultivadas com sucesso derivadas da IUE ou eue mostram distribuição celular normal, como revelado pelo DAPI e uma matriz um tanto organizada de RG com processos de contato de pial afeticamente orientados17 (Figura 4A,B, respectivamente). Ocasionalmente, são observadas perturbações acentuadas nos andaimes RG em fatias cerebrais cultivadas, especialmente naqueles derivados da eletroporação eue (Figura 4C). As fatias cerebrais com andaime RG extremamente desorganizado mostram migração neuronal prejudicada e crescimento de axônio defeituoso (não mostrado). Portanto, controlar o andaime RG é um método fácil pós-cultura para classificar os dados obtidos a partir de fatias cerebrais confiáveis.
As fatias cerebrais derivadas da IUE ou da EUE com a mistura plasmida expressa lyn-mNeonGreen resultam em rotulagem de neurônios esparsos semelhantes. Um CPN piramidário representativo expressando Lyn-mNeonGreen e o comportamento dinâmico de seu cone de crescimento é mostrado como um exemplo (Figura 5A e Vídeo Suplementar 1, superior esquerdo). Além disso, os neurônios foram rotulados usando um plasmid expressando uma sonda actina para analisar a dinâmica actina de cones de crescimento axonal in situ (Figura 5B e Vídeo Suplementar 1, inferior esquerdo). Os experimentos in situ também foram realizados com um design plasmídeo expresso de fluoróforo dual-Cre/Dre (Figura 1C e Vídeo Suplementar 1, à direita). fluoroforos tRFP ou ZsGreen neste plasmídeo podem ser especificamente e individualmente ativados por recombinases dre ou cre, respectivamente, em neurônios vizinhos (Figura 5C). Esta formação experimental permite a análise lado a lado dos cones de crescimento de neurônios de controle com neurônios modificados vizinhos (qualquer perda ou ganho de função). Isso contorna a variabilidade decorrente do uso de diferentes fatias para testar o controle e as condições experimentais.
Foram analisados os kymógrafos gerados a partir do filme gravado, dos quais parâmetros dinâmicos de crescimento, como atividade strusiva ao longo do tempo e comprimento de crescimento, podem ser facilmente obtidos (Figura 6A). Observe que um simples ajuste na resolução temporal do lapso de tempo permite a medição da velocidade de alongamento do axônio por 2 h (Figura 6A). Além disso, a variação do volume de cone de crescimento ao longo do tempo - uma medida da atividade dinâmica do cone de crescimento geral - pode ser facilmente obtida, neste caso com software licenciado (Figura 6B e Figura 6E,F). Isso pode ser usado para avaliar a velocidade da esteira actin e o equilíbrio de filopodia/lamellipodia durante a atividade de exploração do cone de crescimento.
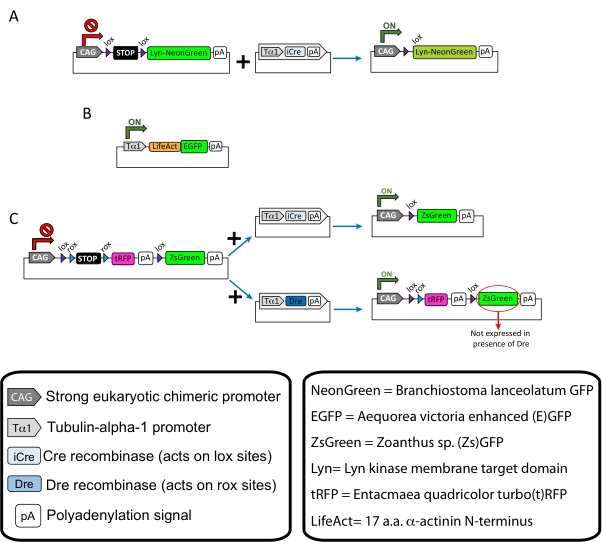
Figura 1: Esquemas dos plasmídeos usados no protocolo. (A) pCAG-lox-STOP-lox-Lyn-mNeonGreen. (B) p-Tub-alfa-1-LifeAct-GFP. (C) pCAG-lox-rox-STOP-rox-tRFP-pA-lox-ZsGreen-pA. Informações relevantes sobre componentes plasmídeos e a origem do fluoróforo são encontradas nas caixas. Clique aqui para ver uma versão maior desta figura.
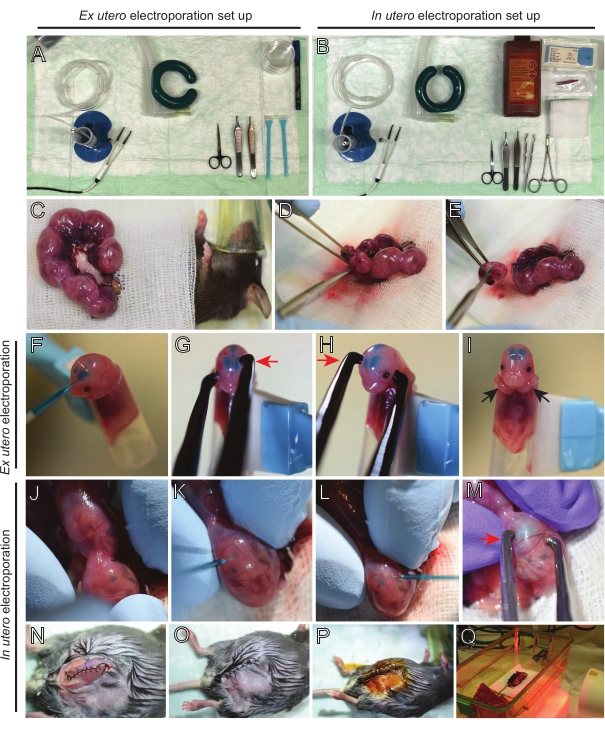
Figura 2: Fluxo de trabalho de ex utero e em eletroporação utericana de camundongos E15,5. (A) Montar a estação de cirurgia para eletroporação ex utero. (B) Configuração da estação de cirurgia para eletroporação uteral. (C) Chifres uterinos puxados para fora da cavidade abdominal do rato anestesiado. (D) Extração de um embrião do saco uterino. (E) Sacrifício embrionário por transeção completa da medula espinhal por meio de incisão diagonal; note que a decapitação foi evitada. (F) Colocação de embrião no suporte e injetada com DNA/mistura verde rápida no ventrículo lateral esquerdo. (G,H) Posicione a cabeça do embrião entre eletrodos de pinça de platina com o cátodo (seta vermelha) sobre o córtex em um ângulo de 60°. (I) Colocação dos braços do embrião (setas pretas) fora do suporte para evitar o deslizamento do embrião durante o procedimento. (J) Rotação do embrião dentro do saco uterino para expor a cabeça. (K,L) Injeção de DNA/mistura verde rápida nos ventrículos laterais do embrião através da parede uterina. (M) Posicione a cabeça do embrião entre eletrodos de pinça de platina com um cátodo (seta vermelha) sobre o córtex em um ângulo de 60°. (N) Incisão muscular suturada através da sutura de travamento de funcionamento. (O) Incisão de pele suturada através de uma sutura interrompida. (P) Fixação da ferida usando clipes cirúrgicos de ferida e desinfecção usando betadina. (Q) Colocação do mouse na gaiola de recuperação com luz de aquecimento infravermelho distante. Clique aqui para ver uma versão maior desta figura.

Figura 3: Extração de cérebros E15.5 e E12,5 e procedimento de cultura de fatia organotípica. (A) Ferramentas utilizadas para o procedimento de extração cerebral. (B) Criada na estação de cultura organotípica. (C-F) Extração do cérebro E15.5. (G-J) Extração do cérebro E12.5. Linhas pontilhadas destacam a localização das incisões. Flechas vermelhas estão apontando a direção de puxar por fórceps. (K) Incorporar o cérebro em uma antena de 3 cm contendo 3% de baixa agarose de derretimento, deixando uma lacuna de espaçamento de 1-2 mm de agarose sob o cérebro. (L) Coleção de fatia cerebral de 150 μm. (M) Colocação de fatias cerebrais em pastilhas de membrana PTFE imobilizadas em um prato de 35 mm usando filme de parafina (seta azul). A marcação da estrela vermelha indica uma determinada coleção de fatias cerebrais do vibratome (L) e sua transferência para a membrana PTFE (M). Clique aqui para ver uma versão maior desta figura.
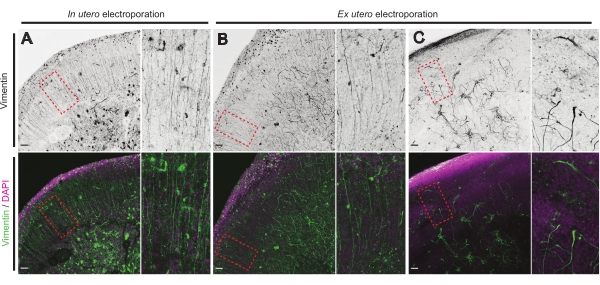
Figura 4: Estrutura de células gliais radiais conservadas em fatias organotípicas saudáveis. Imagens confocal de fatias cerebrais E17.5 revelando matriz RG (vimentina; verde) e organização celular global (DAPI; magenta) seguindo IUE (A) e EUE (B,C). Observe os fortes distúrbios na matriz RG que podem ocasionalmente resultar de EUE (C). As ampliações correspondem aos quadros pontilhados vermelhos na figura principal: barras de escala, 10 μm. Por favor clique aqui para ver uma versão maior desta figura.
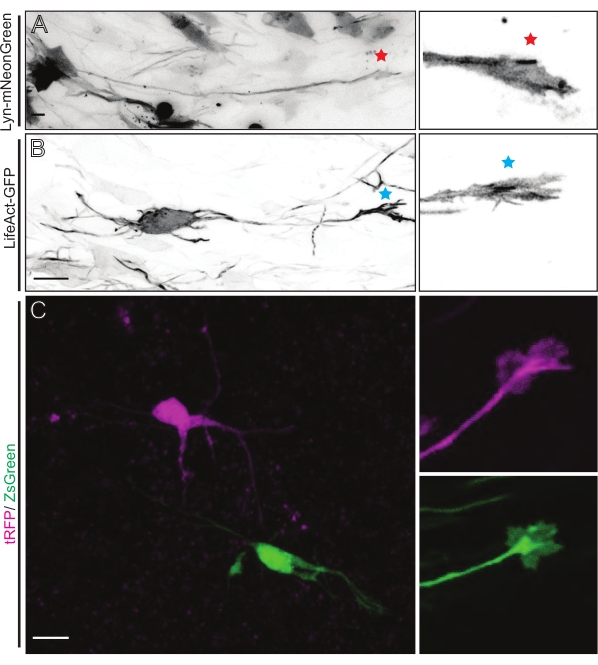
Figura 5: Visualização in situ da dinâmica do cone de crescimento em fatias organotipópicas agudas. (A,B) Neurônios e seus cones de crescimento correspondentes rotulados com Lyn-mNeonGreen e LifeAct-GFP, respectivamente. Estrela vermelha marcando o cone de crescimento de Lyn-mNeonGreen expressando neurônio. Asterisco azul marcando cone de crescimento do lifeact-GFP expressando neurônio. (C) Neurônios vizinhos rotulados com o sistema plasmídeo duplo contendo tRFP (magenta) e ZsGreen (verde) e seus cones de crescimento correspondentes. Cones de crescimento imageados (à direita) estavam fora do quadro capturado (esquerda), obtidos logo após a aquisição do lapso de tempo do cone de crescimento; barras de escala, 5 μm. Por favor, clique aqui para ver uma versão maior desta figura.
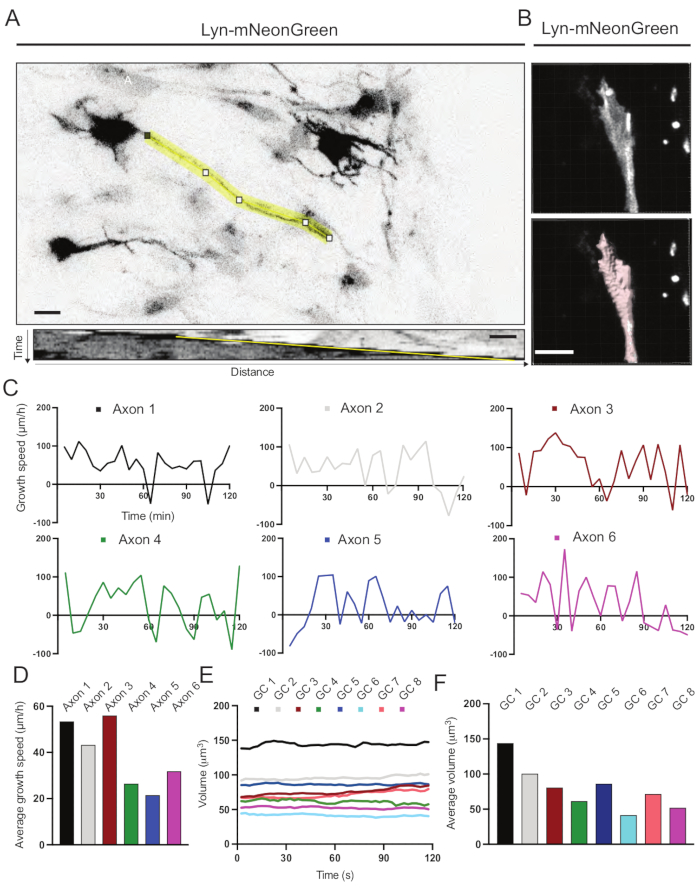
Figura 6: Análise da velocidade de crescimento do axônio e do volume do cone de crescimento. (A) Traçado de Axon em um neurônio expressando Lyn-mNeonGreen (topo) e seu kymograph correspondente (abaixo) gerados usando ImageJ. (B) Reconstrução do vídeo z-stack de cone de crescimento usando o software de análise de imagem (topo) e o mesmo cone de crescimento destacado usando a ferramenta de medição de superfícies (abaixo). (C) Gráficos que mostram mudanças na velocidade de crescimento ao longo do tempo para vários axônios. (D) A velocidade média de crescimento dos axônios é quantificada em (C). (E) Gráfico mostrando as alterações no volume do cone de crescimento ao longo do tempo. (F) O volume médio de cones de crescimento é quantificado em (E); barra de escala, 5 μm. Por favor, clique aqui para ver uma versão maior desta figura.
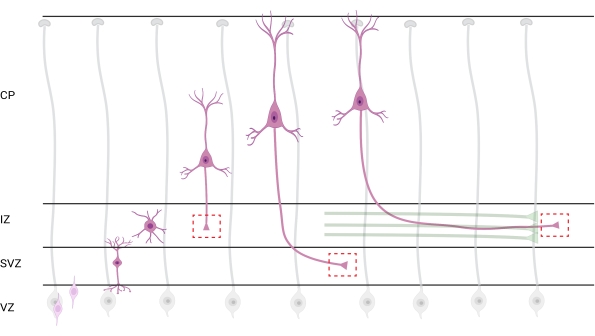
Figura 7: Migração radial e polarização neuronal de neurônios cortical piramimais. Diagrama ilustrando o desenvolvimento de neurônios cortical piramifecionais (rosa) migrando radialmente da zona ventricular germinal (VZ) em direção à superfície pia. Guiados por processos radiais de glia (cinza), neurônios polarizados migratórios estabelecem um processo de liderança, dendrito futuro e processo de trailing, futuro axônio, que continuam a se estender para baixo em direção à zona intermediária (IZ). As caixas vermelhas tracejadas representam as áreas corticais onde os cones de crescimento foram imageados. Especificamente no IZ, zona subventricular (SVZ) ou juntando pacotes de axônio (verde). A ilustração foi criada com uma ferramenta baseada na Web, BioRender.com. Clique aqui para ver uma versão maior desta figura.
| Plasmídeo | Concentração (μg/μL) | Uso pretendido |
| pCAG-lox-STOP-lox-Lyn-mNeonGreen | 0.25 | Rotulagem de proteína direcionada à membrana (Lyn) |
| + | + | |
| p-Tub-alfa-1-iCre | 0.08 | |
| p-Tub-alfa-1-LifeAct-GFP | 0.125 | Rotulagem de fisomostos (F-actin) em cones de crescimento |
| pCAG-lox-rox-STOP-rox-tRFP-lox-Lyn-ZsGreen | 1 | Rotulagem independente de duas populações de neurônios vizinhos |
| + | + | |
| p-Tub-alfa-1-iCre | 0.004 | |
| + | + | |
| p-Tub-alfa-1-Dre | 0.2 |
Tabela 1: Lista de plasmídeos usados no Protocolo. Nome, concentração e uso pretendido de cada plasmídeo utilizado.
Vídeo suplementar 1: Visualização in situ da dinâmica do cone de crescimento em fatias organotipópicas agudas. Dinâmica dos cones de crescimento rotulados com Lyn-mNeonGreen (canto superior esquerdo) e LifeAct-GFP (inferior esquerdo). Os cones de crescimento vizinhos são rotulados diferencialmente com o sistema plasmídeo duplo contendo tRFP (magenta; superior direito) e ZsGreen (verde; inferior direito). Intervalo de imagem, 2,5 s. Barras de escala, 5 μm. Por favor, clique aqui para baixar este Arquivo.
Discussão
Como os cones de crescimento sentem e reagem ao seu ambiente circundante para coordenar a extensão e orientação simultânea do axônio ainda é uma questão de debate 3,18. Estudos pioneiros em substratos 2D forneceram um vislumbre dos mecanismos moleculares fundamentais que geram as forças que impulsionam a dinâmica do cone de crescimento durante a formação do axônio, o crescimento e a navegação 2,10,11,12,19. Mais recentemente, estudos em matrizes 3D revelaram quanta influência uma terceira dimensão tem no comportamento do cone de crescimento e, consequentemente, no crescimento do axônio 8,9. No entanto, os mecanismos intrincados que instruem a dinâmica do cone de crescimento in vivo continuam a ser minuciosamente examinados.
A preparação de culturas de fatias organotipas de cérebros IUE ou EUE é amplamente utilizada e bem documentada. Tornou-se um padrão dourado que permite aos cientistas obter insights sobre o desenvolvimento e comportamento dos neurônios no tecido cerebral vivo 20,21. De fato, esta técnica tem sido utilizada com sucesso em combinação com várias técnicas de imagem de alta resolução para visualizar processos moleculares específicos e eventos morfológicos in situ. Tais estudos incluem, mas não se limitam à formação de axônio e extensão19,22, migração neuronal cortical 19,22,23,24, dinâmica centrosome25,26, dinâmica microtúbula27, bem como a dinâmica funcional dos compartimentos pré e postssináspicos28,29.
Este protocolo aborda uma lacuna na neurobiologia experimental, visualizando a dinâmica do cone de crescimento do desenvolvimento de neurônios corticais in situ, nas culturas de fatias cerebrais agudas ex vivo e nas ferramentas para analisar os dados obtidos.
Culturas agudas de fatias cerebrais foram utilizadas para estabelecer esse protocolo porque elas (1) com alguma prática, são fáceis de gerar; (2) apresentar um sistema acessível para estudar cones de crescimento incorporados em um ambiente quase totalmente fisiológico, mas transparente o suficiente para permitir imagens de células vivas de alta resolução; (3) pode ser expandido para seu uso com uma miríade de linhas de camundongos transgênicos; (4) combinado com iUE ou EUE, fornecem potencial praticamente ilimitado para fornecer ferramentas moleculares para avaliar o desempenho de cones de crescimento e axônios in vivo sob perda/ganho de regimes de função, juntamente com repórteres fluorescentes e sondas de citoesqueleto.
Essa metodologia foi descrita no contexto tanto da UEE quanto da IUE. Embora ainda seja um método altamente confiável, o EUE resultou em uma incidência crescente de fatias cerebrais mostrando uma rede RG desorganizada em comparação com aquelas obtidas com iUE como método de entrega (Figura 4C). Distúrbios na matriz RG afetam fortemente a migração neuronal e o padrão de alongamento do axônio 30,31. Estes são parâmetros-chave que predizem onde encontrar axônios para análise em um determinado momento e o tipo de ambiente que eles estão navegando. Fatias cerebrais com uma rede RG significativamente interrompida normalmente têm prejudicado a estratificação do neurônio cortical. Isso, por sua vez, produz axônios com trajetórias caóticas. Portanto, é fortemente recomendável controlar a integridade estrutural da rede RG. Curiosamente, a má integridade estrutural se correlaciona com o aumento da idade do cérebro embrionário. De fato, tais efeitos nos embriões E12.5-E13,5 mais jovens normalmente não foram observados19.
O presente protocolo é minucioso e simples. No entanto, existem algumas etapas críticas em que é preciso ter cuidado e atenção especiais para obter resultados ideais. Estes foram expressamente observados no protocolo e incluem (1) afinar a quantidade de DNA usada na eletroporação para obter rotulagem esparsa; (2) evitar danos durante a extração de cérebros; (3) controlar a temperatura da agarose durante o invólucro cerebral; (4) solução de problemas para a porcentagem ideal de agarose para cérebros de uma determinada idade; e (5) seleção de fluoroforos, a experiência da qual se segue. Durante a otimização do protocolo, foi testado o desempenho de vários fluoroforos em células vivas em imagens in situ. As variantes monoméricas GFP EGFP e NeonGreen para a preparação dos plasmídeos marcados por LifeAct e Lyn foram escolhidas para este protocolo (Figura 5A,B). Além disso, a variante MScarlet da variante RFP foi testada e encontrada altamente adequada para esta configuração (dados não mostrados). TRFP multimédico (dimer) e ZsGreen (tetramer) (Figura 5C e Vídeo Suplementar 1, à direita) também foram testados. Estes fluoroforos super brilhantes dobráveis são recomendados quando o método requer uma rápida geração de sinal fluorescente após a entrega do DNA.
Uma prática comum no uso de culturas de fatias é utilizar fatias de diferentes cérebros para testar o controle e condições experimentais. Isso representa uma fonte inerente de variabilidade indesejada. Aqui, utilizou-se um sistema de expressão que permite modificação independente dos neurônios vizinhos e a expressão dos repórteres para identificação. Note-se que nesta demonstração (Figura 5C), não houve diferenças entre os neurônios que expressam qualquer um dos fluoroforos. No entanto, como exemplo, tal mistura plasmida combinada com uma linha de rato transgênico que abriga um gene sensível à Cre rotulará com neurônios tRFP (sensíveis a Dre) que permaneceram como tipo selvagem. Em contraste, o ZsGreen (também sensível ao Cre) rotulará os neurônios recombinados. Assim, cones de crescimento dos dois genótipos diferentes, e provavelmente também fenótipos, poderiam ser estudados lado a lado simultaneamente na mesma fatia cerebral.
A localização de axônios e cones de crescimento para análise é uma consideração importante. Os neurônios corticais polarizam-se enquanto migram radialmente da zona ventricular (VZ) em direção à placa cortical (CP). Durante esse processo, os neurônios formam um processo de liderança (um dendrite futuro) e um processo de trailing que se tornará o axônio, eventualmente unindo axônios pioneiros na zona intermediária (IZ), estabelecendo os setores axônio32. Portanto, para capturar cones de crescimento axonal, a imagem foi feita em fibras axonanas no IZ, incluindo axônios saindo do CP e axônios gerados precocemente já associados a feixes axonais; ou eventualmente, em fibras que transversam o IZ e se estendem abaixo dela (Figura 7).
Este protocolo torna viável realizar imagens de super resolução de neurônios dentro de fatias organotipas. Historicamente, a dispersão de luz era um problema significativo enfrentado quando a imagem de espécimes espessos. Nas últimas duas décadas, amplos avanços em tecnologias ópticas tornaram possível a imagem de espécimes espessos. Aqui, um objetivo de longa distância de trabalho foi utilizado para visualizar melhor estruturas menores, como cones de crescimento. Inevitavelmente, este protocolo não captura eventos mais detalhados, como fluxo de actina retrógrada ou dinâmica de microtúbulos. O objetivo de longa distância de trabalho, que requer uma abertura numérica inferior (NA), preserva informações de fatias grossas. No entanto, também foi possível adaptar este protocolo para uso com objetivos de menor distância de trabalho. Isso exigiu uma transferência suave de fatias para um prato com fundo de vidro para preservar a integridade estrutural. No entanto, o uso deste método resultou em uma sobrevida mais curta - ~15 h - devido à perda de troca de gás (dados não mostrados). Ao contrário das culturas 2D, os cones de crescimento em 3D ocupam um volume maior e requerem compensação de artefatos de movimento no eixo z. Para aumentar a capacidade de imagem de eventos detalhados, a tecnologia confocal moderna deve ser utilizada. Portanto, recomenda-se usar um motor z-stack de varredura rápida, como o z-Galvo disponível em microscópios confocal altamente sensíveis33.
Note-se que este protocolo apresenta três limitações principais. Em primeiro lugar, muitas vezes é desafiador controlar níveis de expressão/número de células expressas de qualquer plasmídeo in vivo. Isso introduz a variabilidade entre todas as fatias, mesmo mantendo a mesma concentração plasmida. Portanto, a seleção dos elementos regulatórios na expressão vetores utilizados deve ser predeterminada com cuidado. Em segundo lugar, eventos detalhados de imagem usando pastilhas de membrana atualmente não são viáveis. Essa segunda limitação pode ser superada com as atualizações metodológicas propostas no parágrafo anterior. Por fim, os cones de crescimento são altamente fotosensíveis e podem rapidamente se tornar fotobleachados. Portanto, imagens frequentes dos cones de crescimento, por apenas 5 minutos usando microscópios de varredura a laser podem frequentemente colapsar os cones de crescimento. Nesse sentido, um novo avanço nos dispositivos gerados por microscopia de folha de luz pode ser adaptado para imagens de longo prazo das fatiascerebrais 34.
Protocolos desse tipo são imaginados para abrir novos caminhos de pesquisa, permitindo uma melhor compreensão do que é preciso para um cone de crescimento ler e reagir em direção a um ambiente in vivo complexo e, mais importante, desvendar a mecânica dessa sofisticada interação.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Gostaríamos de agradecer a Maria Eugenia Bernis por fotografar os procedimentos. Agradecemos também a Emily Burnside, Emily Handley, Thorben Pietralla, Max Schelski e Sina Stern por lerem e discutirem o manuscrito. Somos gratos às nossas excelentes assistentes técnicas, Jessica Gonyer, Blanca Randel e Anh-Tuan Pham. Reconhecemos o valioso apoio das instalações de microscópio leve e instalações de animais da DZNE. Este trabalho foi apoiado pela Deutsche Forschungsgesellschaft (DFG), a Fundação Internacional para a Pesquisa em Paraplegia (IRP) e as Asas pela Vida (para F.B). F.B. é membro do cluster de excelência ImmunoSensation2, os SFBs 1089 e 1158, e é um dos ganhadores do Prêmio Roger De Spoelberch.
Materiais
| Name | Company | Catalog Number | Comments |
| Adson Forceps | Fine Science Tools | 11006-12 | |
| Alexa Fluor 488 | Invitrogen | A21202 | Goat Anti-Mouse |
| Alexa Fluor 647 | Invitrogen | A21236 | Goat Anti-Mouse |
| Anti-Vimentin antibody | sigma-Aldrich | V2258-.2ML | Monoclonal mouse, clone LN-6, ascites fluid |
| B27 supplement | ThermoFisher Scientific | 17504044 | |
| Betadine | B. Braun | 3864154 | |
| Biozym Sieve GP Agarose | Biozyme | 850080 | |
| Braunol, Sprühflasche | B. Braun | 3864073 | |
| Buprenorphine (Temgesic) | GEHE Pharma | 345928 | |
| DAPI | sigma-Aldrich | D9542 | |
| DMZ unevirsal electrode puller | Zeitz | NA | |
| Electric razor | Andes | NA | ProClip UltraEdge Super 2-Speed model |
| Enrofloxacin (Baytril) | Bayer | 3543238 | 2,5% (wt/vol) |
| Eppendorf microloader pipette tips | FischerScientific | 10289651 | |
| Fast Green FCF | Sigma-Aldrich | F7252-5G | Dye content ≥ 85 % |
| Fetal Bovine Serum | ThermoFisher Scientific | 10500064 | |
| Fiji 2.1.0 | NIH | NA | https://imagej.net/software/fiji/downloads |
| Fine Scissors | Fine Science Tools | 14058-09 | ToughCut/Straight/9cm |
| FluoroDish Cell Culture Dish | World Precision Instruments | FD5040-100 | |
| Fluoromount Aqueous Mounting Medium | sigma-Aldrich | F4680-25ML | |
| Glucose | MedPex | 3705391 | 5% |
| GlutaMAX Supplement | ThermoFisher Scientific | 35050061 | |
| Glycine | Sigma-Aldrich | G8898 | |
| HBSS | Life Technologies | 14025092 | calcium, magnesium, no phenol red |
| Horse serum | Pan-Biotech | P30-0711 | |
| Imaris 9.7.2 | Bitplane | NA | https://imaris.oxinst.com/products/imaris-for-neuroscientists |
| Isoflurane | Virbac | NA | |
| Isotonic saline solution | B. Braun | 8609261 | 0.90% |
| Leica VT1200 S vibratome | Leica | 14048142066 | |
| LSM 880 with Airyscan | Zeiss | NA | |
| Metacam | Venusberg Apotheke | 8890217 | 5 mg/ml |
| Mice | Janvier Labs | NA | C57BL/6JRj |
| Micro-Adson Forceps | Fine Science Tools | 11018-12 | |
| Micropipette Storage Jar | World Precision Instruments | E210 | 16.16.27 |
| Microsoft Excel | Microsoft | NA | https://www.microsoft.com/en-us/microsoft-365/p/excel/cfq7ttc0k7dx?activetab=pivot:overviewtab |
| Millicell Cell Culture Insert | EMD Millipore | PICM0RG50 | 30 mm, hydrophilic PTFE, 0.4 µm |
| Moria Perforated Spoons | Fine Science Tools | 10370-18 | |
| Moria Spoon | Fine Science Tools | 10321-08 | |
| Neurobasal Medium, minus phenol red | ThermoFisher Scientific | 12348017 | |
| Neuropan-2 supplement | Pan-Biotech | P07-11010 | |
| Normal goat serum | Abcam | ab138478 | |
| Olsen-Hegar Needle Holder with Scissors | Fine Science Tools | 12002-12 | |
| p-Tub-alpha-1-Dre | Addgene | 133925 | |
| p-Tub-alpha-1-iCre | Addgene | 133924 | |
| p-Tub-alpha-1-LifeAct-GFP | Addgene | 175437 | |
| Parafilm | VWR | 52858-000 | |
| Paraformaldehyde | sigma-Aldrich | P6148 | |
| PBS | Sigma-Aldrich | P3813-10PAK | |
| pCAG-lox-rox-STOP-rox-tRFP-lox-Lyn-ZsGreen | Addgene | 175438 | |
| pCAG-lox-STOP-lox-Lyn-mNeonGreen | Addgene | 175257 | |
| Penicillin-Streptomycin | ThermoFisher Scientific | 15140122 | |
| PicoNozzle Kit v2 | World Precision Instruments | 5430-ALL | |
| Platinum Tweezertrodes | Harvard Apparatus | 45-0487 | 1 mm / 3 mm |
| QIAGEN Maxi kit | QIAGEN | 12162 | |
| Reflex wound closure Clip | World Precision Instruments | 500344-10 | 7 mm |
| Sekundenkleber Pattex Mini Trio | Lyreco | 4722659 | |
| Square wave electroporation system ECM830 | Harvard Apparatus | W3 45-0052 | |
| Sterile gauze | Braun Askina | 9031216 | |
| Sterile lubricant eye ointment | Bayer Vital | PZN1578675 | |
| Sterile surgical gloves | Sempermed | 14C0451 | |
| Sucrose | Roth | 4621.2 | |
| Supramid 5-0 surgical silk sutures | B. Braun | NA | |
| Thin-wall glass capillaries | World Precision Instruments | TW100-4 | |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Vannas spring scissors | Fine Science Tools | 15000-03 | |
| µ-Slide 8 Well Glass Bottom | Ibidi | 80827 |
Referências
- Schelski, M., Bradke, F. Neuronal polarization: From spatiotemporal signaling to cytoskeletal dynamics. Molecular and Cellular Neurosciences. 84, 11-28 (2017).
- Lowery, L. A., Van Vactor, D. The trip of the tip: understanding the growth cone machinery. Nature Reviews: Molecular Cell Biology. 10 (5), 332-343 (2009).
- Stoeckli, E. T. Understanding axon guidance: are we nearly there yet. Development. 145 (10), (2018).
- Bradke, F., Dotti, C. G. The role of local actin instability in axon formation. Science. 283 (5409), 1931-1934 (1999).
- Neukirchen, D., Bradke, F. Cytoplasmic linker proteins regulate neuronal polarization through microtubule and growth cone dynamics. Journal of Neuroscience. 31 (4), 1528-1538 (2011).
- Witte, H., Bradke, F. The role of the cytoskeleton during neuronal polarization. Current Opinion in Neurobiology. 18 (5), 479-487 (2008).
- Witte, H., Neukirchen, D., Bradke, F. Microtubule stabilization specifies initial neuronal polarization. Journal of Cell Biology. 180 (3), 619-632 (2008).
- Nichol, R. H., Catlett, T. S., Onesto, M. M., Hollender, D., Gomez, T. M. Environmental elasticity regulates cell-type specific RHOA signaling and neuritogenesis of human neurons. Stem Cell Reports. 13 (6), 1006-1021 (2019).
- Santos, T. E., et al. Axon growth of CNS neurons in three dimensions is amoeboid and independent of adhesions. Cell Reports. 32 (3), 107907(2020).
- Mitchison, T., Kirschner, M. Cytoskeletal dynamics and nerve growth. Neuron. 1 (9), 761-772 (1988).
- Lin, C. H., Thompson, C. A., Forscher, P. Cytoskeletal reorganization underlying growth cone motility. Current Opinion in Neurobiology. 4 (5), 640-647 (1994).
- Myers, J. P., Gomez, T. M. Focal adhesion kinase promotes integrin adhesion dynamics necessary for chemotropic turning of nerve growth cones. Journal of Neuroscience. 31 (38), 13585-13595 (2011).
- Turney, S. G., et al. Nerve growth factor stimulates axon outgrowth through negative regulation of growth cone actomyosin restraint of microtubule advance. Molecular Biology of the Cell. 27 (3), 500-517 (2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Noctor, S. C., Flint, A. C., Weissman, T. A., Dammerman, R. S., Kriegstein, A. R. Neurons derived from radial glial cells establish radial units in neocortex. Nature. 409 (6821), 714-720 (2001).
- Noctor, S. C., Martinez-Cerdeno, V., Ivic, L., Kriegstein, A. R. Cortical neurons arise in symmetric and asymmetric division zones and migrate through specific phases. Nature Neuroscience. 7 (2), 136-144 (2004).
- Ferent, J., Zaidi, D., Francis, F. Extracellular control of radial glia proliferation and scaffolding during cortical development and pathology. Frontiers in Cell and Developmental Biology. 8, 578341(2020).
- Dent, E. W., Gupton, S. L., Gertler, F. B. The growth cone cytoskeleton in axon outgrowth and guidance. Cold Spring Harbor Perspectives in Biology. 3 (3), (2011).
- Dupraz, S., et al. RhoA controls axon extension independent of specification in the developing brain. Current Biology. 29 (22), 3874-3886 (2019).
- Azzarelli, R., Oleari, R., Lettieri, A., Andre, V., Cariboni, A. In vitro, ex vivo and in vivo techniques to study neuronal migration in the developing cerebral cortex. Brain Sciences. 7 (5), (2017).
- Humpel, C. Organotypic brain slice cultures: A review. Neuroscience. 305, 86-98 (2015).
- Namba, T., et al. Pioneering axons regulate neuronal polarization in the developing cerebral cortex. Neuron. 81 (4), 814-829 (2014).
- Shah, B., et al. Rap1 GTPases are master regulators of neural cell polarity in the developing neocortex. Cerebral Cortex. 27 (2), 1253-1269 (2017).
- Wiegreffe, C., Feldmann, S., Gaessler, S., Britsch, S. Time-lapse confocal imaging of migrating neurons in organotypic slice culture of embryonic mouse brain using in utero electroporation. Journal of Visualized Experiments: JoVE. (125), (2017).
- de Anda, F. C., Meletis, K., Ge, X., Rei, D., Tsai, L. H. Centrosome motility is essential for initial axon formation in the neocortex. Journal of Neuroscience. 30 (31), 10391-10406 (2010).
- Sakakibara, A., et al. Dynamics of centrosome translocation and microtubule organization in neocortical neurons during distinct modes of polarization. Cerebral Cortex. 24 (5), 1301-1310 (2014).
- Schatzle, P., Kapitein, L. C., Hoogenraad, C. C. Live imaging of microtubule dynamics in organotypic hippocampal slice cultures. Methods in Cell Biology. 131, 107-126 (2016).
- Qu, X., Kumar, A., Bartolini, F. Live imaging of microtubule dynamics at excitatory presynaptic boutons in primary hippocampal neurons and acute hippocampal slices. STAR Protocols. 2 (1), 100342(2021).
- Tonnesen, J., Katona, G., Rozsa, B., Nagerl, U. V. Spine neck plasticity regulates compartmentalization of synapses. Nature Neuroscience. 17 (5), 678-685 (2014).
- Buchsbaum, I. Y., Cappello, S. Neuronal migration in the CNS during development and disease: insights from in vivo and in vitro models. Development. 146 (1), (2019).
- Rigby, M. J., Gomez, T. M., Puglielli, L. Glial cell-axonal growth cone interactions in neurodevelopment and regeneration. Frontiers in Neuroscience. 14, 203(2020).
- Barnes, A. P., Polleux, F. Establishment of axon-dendrite polarity in developing neurons. Annual Review of Neuroscience. 32, 347-381 (2009).
- Multiphoton Microscope Leica TCS SP8 MP. Microsystems. , Available from: http://www.leica-microsystems.com/products/confocal-microscopes/p/leica-tcs-sp8-sted-one/ (2021).
- ZEISS Lattice Lightsheet 7. Zeiss. , Available from: http://www.zeiss.com/microscopy/int/products/imaging-systems/lattice-lightsheet-7.html (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados