Method Article
시투에서 Axon Growth and Growth Cone Dynamics in Acute Ex Vivo Embryonic Brain Slice Cultures 시각화
요약
이 프로토콜은 현장 축삭 성장 및 성장 원뿔 역학 을 연구하는 간단하고 강력한 방법을 보여줍니다. 생체외 생리학적으로 관련된 급성 뇌 조각을 준비하는 방법을 설명하고 사용자 친화적인 분석 파이프라인을 제공합니다.
초록
뉴런 발달 동안, 축삭은 피질 환경을 탐색하여 최종 목적지에 도달하고 시냅스 연결을 설정합니다. 성장 원뿔 - 축삭 발달의 원위 끝에 위치한 감각 구조 -이 과정을 실행합니다. 성장 원뿔의 구조와 역학을 연구하는 것은 축삭 발달과 신경 회로를 형성 할 수있는 주변 중추 신경계 (CNS)와의 상호 작용을 이해하는 데 중요합니다. 이것은 근본적인 연구 및 전임상 적 맥락에서 부상을 입은 후 축삭을 신경 회로에 재통합하는 방법을 고안 할 때 필수적입니다. 지금까지 성장 원뿔 역학에 대한 일반적인 이해는 주로 2 차원 (2D)으로 배양 된 뉴런에 대한 연구에 기반을두고 있습니다. 의심 할 여지없이 성장 원뿔 구조 역학 및 자극에 대한 반응에 대한 현재의 지식에 근본적이지만, 2D 연구는 손상되지 않은 CNS 조직에서 신경 성장 원뿔에 의해 마주 치는 생리적 3 차원 (3D) 환경을 잘못 나타냅니다. 최근에는 콜라겐 젤이 이러한 한계 중 일부를 극복하기 위해 사용되어 3D에서 신경 발달을 조사 할 수있었습니다. 그러나 합성 2D 및 3D 환경 모두 CNS 조직 내에서 신호 전달 신호가 부족하여 축삭 현상의 확장 및 경로 찾기를 지시합니다. 이 프로토콜은 유기형 뇌 조각을 사용하여 축삭과 성장 원뿔을 연구하는 방법을 제공하며, 축삭 발달은 생리 학적으로 관련된 물리적 및 화학적 단서를 만난다. utero 및 ex utero electroporation에서 미세 조정되어 초분해능 현미경과 함께 형광 리포터를 드물게 전달함으로써이 프로토콜은 축삭 및 성장 원뿔 역학의 시각화를위한 방법론 적 파이프 라인을 제시합니다. 또한, 장기 및 라이브 셀 이미징 데이터의 분석에 대한 상세한 툴킷 설명이 포함되어 있습니다.
서문
뉴런은 신경계의 기본 계산 단위를 나타내는 고도로 양극화 된 세포입니다. 그들은 입력 및 출력 부위의 구획화에 의존하는 정보를 수신하고 방출합니다 : 수상 돌기와 축삭, 각각1. 개발 중에 축삭은 목적지에 도달하기 위해 믿을 수 없을 정도로 복잡한 환경을 탐색하면서 확장됩니다. 축삭 네비게이션은 발달 축삭의 끝에 위치한 감각 구조 인 성장 원뿔에 의해 안내됩니다. 성장 원뿔은 환경 신호를 감지하고 세포 골격 2,3의 역동적 인 공간 재구성으로 변환하는 역할을합니다. 생성 된 형태 - 기계적 반응은 성장 원뿔이 트리거링 큐에서 연장되거나 후퇴하도록 지시하여 특정 축삭 기동으로 이어집니다.
축삭 확장 및 성장 원뿔 역학에 대한 현재의 이해는 2 차원 (2D) 기질 2,4,5,6,7에 대한 축삭 성장을 평가하는 연구에서 비롯됩니다. 이러한 선구적인 연구는 성장 원뿔과 성장 기질 사이의 정교한 상호 작용을 확인하고 접착성 및 강성과 같은 기질 특성에 의존하는 현저한 차이를 밝혀 냈습니다 8,9. 이러한 통찰력에 의해 주도 된 세포 외 환경 단서는 축삭 성장을 지시하는 가설을 세웠으며, 성장 원뿔 세포 골격은이 성장을실행하는 2,10,11,12. 주목할 만하게, 뉴런은 비접착성 기질(예를 들어, 폴리리신, 폴리오르니틴)13에서 축삭돌기를 연장할 수 있다. 더욱이, 기질 강성은 세포 접착제 복합체(8)와 무관하게 축삭 성장 속도에 영향을 미칠 수 있다. 따라서 2D 기질에서 성장 원뿔 역학을 연구하는 것만으로는 축삭 성장 원뿔과 생체에서 발견되는 것과 같은 생리 학적으로 관련된 3D (3D) 환경의 상호 작용으로 인해 발생하는 힘의 균형을 정확하게 모델링 할 수 없습니다.
2D 분석의 한계를 극복하기 위해, 축삭 성장 및 성장 원뿔 역학은 3D 행렬 8,9에서 연구되었다. 이러한 매트릭스는 더 많은 생리적 맥락을 제시하지만 축삭 성장의 세포 내재적 메커니즘을 연구 할 수 있습니다. 그것은 다양한 조건 및 약리학 적 치료법에서 단일 세포 방식으로 성장 콘 검사를 가능하게합니다9. 이러한 3D 환경에서 축삭은 뚜렷한 세포골격 역학을 나타내며 2D 배양 뉴런9에서 관찰된 것보다 빠르게 성장했습니다. 이 우아한 연구는 성장 원뿔 세포 골격의 재구성과 결과적으로 그 행동에 대한 추가 차원의 영향을 입증했습니다.
3D 매트릭스가 2D 표면에 비해 네이티브 유사 뉴런 발달 및 축삭 성장을 지원하는 명백한 이점에도 불구하고 중추 신경계 (CNS) 조직에서 관찰 된 역학의 복잡성을 반영 할 수없는 단순화 된 합성 스캐폴드로 남아 있습니다. 여기서, 전자궁 및 자궁 전기천공 에 의한 리포터 플라스미드의 전달은 뇌 유기형 슬라이스 배양 및 계내 살아있는 초분해능 영상화와 결합하여 생리학적 맥락 내에서 성장 원뿔 역학을 분석하였다. 이 방법론은 생체 내 환경의 3 차원성과 물리 화학적 구성의 복잡성을 경험하면서 축삭 발달을 시각화 할 수있게합니다. 마지막으로, 일반적으로 라이센스가 부여되고 공개적으로 사용 가능한 소프트웨어를 사용하여 축삭 성장 및 성장 원뿔 역학을 측정하기위한 사용자 친화적 인 절차가 설명됩니다.
프로토콜
동물 실험은 관련 기관 및 연방 규정을 준수해야합니다. 배아 15.5일째 및 12.5 (E15.5 및 E12.5) 임신한 암컷 C57BL/6JRj 마우스를 이 프로토콜에 사용하였다. 실험은 North Rhein-Westphalia State Environmental Agency (Landesamt für Natur, Umwelt und Verbraucherschutz (LANUV))의 동물 복지법에 따라 수행되었다.
1. 주사용 플라스미드의 제조
- 제조업체의 프로토콜에 따라 내독소가 없는 Maxiprep 키트를 사용하여 DNA를 분리 합니다(재료 표 참조).
- 선택된 DNA를 원하는 농도(표 1)와 10% Fast Green 용액( 물질 표 참조)으로 혼합하여 DNA 혼합물이 뇌실로 전달되는 것을 시각화합니다.
참고: 특정 플라스미드는 피질 뉴런의 희소 표지(도 1A), 성장 원뿔의 필라멘트 액틴(F-actin) 구조(도 1B), 및 동일한 피질 내의 성장 원뿔의 이중 표지(도 1C)에 사용되었다. 이 프로토콜에 사용된 모든 플라스미드(표 1)는 Addgene에 증착되었다(표 재료 참조). - 다음 프로그램에 따라 모세관 전극 풀러 세트를 사용하여 유리 모세 혈관을 준비하십시오 : 압력 : 500, 열 : 800, 당김 : 30 및 속도 : 40.
- 마이크로 로더 피펫 팁을 사용하여 15μL의 DNA/Fast Green 믹스를 각 유리 모세관에 로드합니다.
참고: 거품이 형성되지 않았는지 확인하십시오. - DNA로 채워진 모세혈관을 접시 직경에 걸쳐 모델링 점토 조각이 있는 10cm 접시에 보관하십시오. 모세관은 실험 전날 4°C에서 로딩 및 저장될 수 있다. 건조를 방지하기 위해 모세관의 뒤쪽 끝을 유연한 필름으로 밀봉하십시오.
2. 용액의 제조
- 포도당(HBSS-G)으로 보충된 행크의 완충 소금 용액을 준비하십시오.
- 20 % 포도당 스톡의 0.5 %를 1x HBSS 병에 넣으십시오. 잘 섞어서 4°C에서 최대 2주 동안 보관한다. 배아 추출을 위해, 배아 수집 직전에 버블링 스톤을 사용하여 카르보겐 (95% O2 및 5%CO2)을 갖는 HBSS-G 용액을 버블링한다.
- 슬라이스 미디어 솔루션
- 멸균 조건 하에서 Neurobasal 1x, 5% 말 혈청, 5% 태아 송아지 혈청, B27 보충제 1:50, L-글루타민 보충제 1:400, 페니실린-스트렙토마이신 1:200 및 뉴로팬-2 보충제 1:100(pH = 7.3에서)을 포함하는 신선한 슬라이스 배지를 준비 합니다(물질 표 참조).
- 각각 1mL의 슬라이스 배지로 3cm 접시를 준비하십시오. 실험 전에 적어도 1 h 동안 5%CO2 로 35°C에서 인큐베이터에 두어 가스 교환을 통해 매질의 pH를 평형화시킨다.
주: 매질 pH 평형화는 인큐베이터로부터의CO2 에 의한 매질의 산성화에 의해 야기된다. 슬라이스 매체는 최대 1주 동안 4°C에서 저장될 수 있다.
- 저융점 아가로스 용액(3%)
- 원하는 양의 저융점 아가로스 분말을 계량하고 유리 병에 적절한 부피의 1x HBSS-G를 용해시킨다. 뇌 당 약 7 mL의 아가로스 용액이 필요합니다.
- 뚜껑을 느슨하게 놓은 상태에서 병을 전자 레인지에 2-3 분 동안 놓고 10-20 초마다 흔들어주십시오.
- 분말이 완전히 용해되면, 병을 실험 최소 1 시간 전에 37°C로 설정된 수조 또는 비드 배쓰에 놓아 아가로오스가 식힐 수 있도록 한다.
참고 : 아가로스 분말이 용해되도록 아가로스를 15 분 동안 두 번 가열하는 것이 좋습니다. 이것은 뇌 조직에 대한 아가로스의 적절한 접착에 중요합니다. 온도계는 뇌를 내장하는 동안 아가로스 용액의 온도를 측정하여 37-40 ° C 사이인지 확인해야합니다. 다른 노인 동물의 두뇌는 다른 강성을 가지고 있습니다. 조직과 아가로스 사이의 균질을 찾기 위해 다양한 아가로스 농도를 테스트하는 것이 좋습니다. - 인산완충식염수를 0.3% 트리톤 X-100(PBS-T)으로 제조하였다.
- 인산완충식염수를 0.2% 아지드나트륨(PBS-NaN3)으로 제조하였다.
참고: 단계 2.4-2.5에 기술된 솔루션은 이후 면역조직화학 단계에서 사용하기 위한 것이다.
3. 수술소의 준비
- 70 % -96 % 에탄올로 수술실을 청소하고 수술 밑받이를 역 표면에 놓습니다.
- 70 % -96 % 에탄올로 헹구어 수술 도구를 멸균 한 다음 뜨거운 비드 살균기에서 건조 살균하십시오.
- 펄스 발생기에 연결하기 전에 백금 핀셋 전극 ( 재료 표 참조)을 70 % -96 % 에탄올로 청소하십시오.
- DNA/Fast Green으로 채워진 유리 모세관을 모세관 홀더에 삽입합니다. 사용 직전에 미세한 가위를 사용하여 모세관 팁을 부드럽게 떼어내고 미리 가온된 식염수 또는 물로 채워진 1.5 mL 마이크로 원심분리 튜브 내부에서 테스트 용액을 흘립니다.
참고 : 그림 2A, B는 수술 스테이션 설정 및 전 utero electroporation (EUE) 및 utero electroporation (IUE)에 사용되는 도구를 보여줍니다. - IUE의 경우, 식염수 용액을 수조에서 37°C로 예열한다.
4. 배아 추출
- 임신한 마우스를 마우스가 깊이 마취될 때까지 5% 이소플루란으로 마취 유도제 챔버에 놓는다. 페달 금단 반사의 부재로 마취를 확인하십시오.
- 마우스를 수술 언더레이로 옮기고 코 콘을 통해 이소플루란을 1.5 % -2 %로 유지하십시오.
- 각막 건조를 방지하기 위해 양쪽 눈에 연고를 바르십시오.
- 마우스의 복부를 면도 한 다음 70 % -96 % 에탄올에 담근 거즈를 사용하여 면도 된 머리카락을 제거하십시오. 베타 딘으로 지역을 청소하십시오.
- 멸균 된 작은 외과 용 가위를 사용하여 복부 중간 선을 따라 2cm 피부를 절개하고 1.5cm 근육 절개를 만듭니다.
참고: 절개 크기는 배아 크기에 따라 다릅니다. 실제로, 더 큰 배아는 그들의 추출을 수용하기 위해 더 큰 절개가 필요할 것이다. - 거즈 중앙에 구멍을 뚫어 피부 절개 (직경 ~ 2cm)에 맞게 충분히 넓게 자르고 따뜻한 식염수로 담그고 복부 개구부 주위에 놓습니다.
- 따뜻한 식염수에 담근 면봉이나 포셉을 사용하여 두 자궁 뿔을 꺼내 배아 사이의 공간을 조심스럽게 잡아 당겨 꺼냅니다. 젖은 거즈에 배아를 놓습니다(그림 2C).
참고 : 자궁 뿔 주변의 혈관과 모세 혈관에 작은 손상조차도 출혈이 심할 수 있습니다. 따라서 항상 이러한 혈관 형성 부위를 직접 다루지 마십시오. - 자궁 자루를 자르고 각 배아를 제거하십시오 (그림 2D).
- 내림차순 대각선 절단을 통해 추출 직후에 각 배아를 안락사시켜 완전한 척수 횡단을 보장합니다 (그림 2E).
- 배아를 얼음 위에 HBSS-G가 들어있는 10cm 접시에 넣으십시오.
참고 : 배아를 참수하는 것은 DNA / Fast Green 혼합물이 뇌에서 누출되는 것을 방지하고 홀더에서 배아 위치를 쉽게 잡을 수 있도록 피합니다 ( ex utero electroporation, 5 단계 참조). - 자궁 경부 탈구를 수행하여 배아 추출 직후에 어머니를 희생하십시오.
참고 : 여기서 어머니는 노스 라인-웨스트 팔리아 주 환경청 (LANUV)의 동물 복지법에 의해 승인 된 프로토콜에 따라 더 이상의 시술 후 통증이나 고통으로부터 구하기 위해 마취하에 안락사됩니다.
5. 엑스 utero 전기 천공 (EUE)
- 배아를 집어 들고 홀더에 넣으십시오.
참고: 세포 스크레이퍼의 끝에 부착된 절단된 1mL 피펫 팁이 배아 홀더로 사용됩니다. 배아가 팁으로 미끄러지지 않도록 절차 중에 배아의 팔을 팁 바깥에 두는 것이 중요합니다 (그림 2F-I). 피펫 팁의 직경은 다양한 크기의 배아를 수용하기 위해 쉽게 조정할 수 있습니다. 팁의 직경이 배아 크기와 일치하는 길이로 두 번째 팁을 자르고 위에서 언급 한 홀더에 어댑터 삽입물로 사용하십시오. - 배아의 두개골을 통해 DNA/Fast Green으로 채워진 유리 모세관을 측심실에 조심스럽게 삽입하고 2-3μL의 DNA 플라스미드 믹스를 주입합니다(그림 1A,B; [표 1)을 각 심실에 넣는다(도 2F).
참고 : lambdoidal 및 시상 봉합사를 DNA 주사 위치에 대한 지침으로 사용하십시오. lambdoidal 및 시상 봉합사는 두개골의 뼈 판을 연결하는 섬유질 관절입니다. 전자는 정수리 뼈와 후두부 뼈를 결합하고, 후자는 두 정수리 뼈를 결합합니다. - 백금 핀셋 전극 사이에 배아의 머리를 적절한 각도로 잡고 원하는 뇌 영역(이 경우 60° 각도)을 목표로 하고, 음극은 DNA 전달이 의도된 영역을 향하게 합니다(그림 2G-H).
- 구형파 펄스 발생기를 사용하여 간격 1초, 지속 시간 50ms로 30mV에서 5개의 펄스를 적용합니다.
참고 : EUE의 두뇌는 IUE의 뇌보다 더 효과적인 전기장을 경험한다는 것을 명심하십시오. 따라서 주어진 DNA 농도에서 EUE는 IUE보다 DNA 전달 효율이 높으며 그에 따라 DNA 농도를 조정해야합니다. - 양측 전기천공이 필요한 경우, 캐소드 및 애노드가 대측성 피질을 표적으로 하기 위해 이전 위치를 미러링하여 5.3-5.4단계를 반복한다.
참고 : 두 심실에 DNA가 주입 되었기 때문에 두 반구의 피질이 표적이되었습니다. - 전기천공된 배아를 얼음처럼 차가운 HBSS-G가 들어있는 6cm 접시에 넣습니다. 필요한 모든 배아에 대해 5.1-5.6단계를 반복합니다.
6. utero electroporation (IUE)에서
- 임신 한 마우스에 진통제를 주사하십시오. 50 μL의 부프레노르핀 (0.1 mg/kg) ( 물자의 표 참조)을 피하로, 절차 20 분 전에.
- 배아 추출 섹션에서 단계 4.1-4.8을 수행하십시오.
참고 : 따뜻한 식염수에 담근 멸균 거즈로 배아를 덮음으로써 배아가 불필요하게 노출되지 않도록하십시오. - 손가락 끝을 사용하여 람도이드와 시상 봉합사가 위치할 때까지 자궁 내부의 배아를 부드럽게 회전시킵니다(그림 2J). 자궁벽과 배아의 두개골을 통해 DNA/Fast Green 유리 모세관을 측심실에 조심스럽게 삽입하고 2-3μL의 DNA 플라스미드 믹스(그림 1A,C)를 원하는 대로 하나 또는 양쪽 심실에 주입합니다(그림 2K-L).
참고 : 자궁 뿔에 과도한 손가락 압력이 가해지면 양수 자루가 붕괴 될 수 있습니다. - 백금 핀셋 전극 사이에 배아의 머리를 적절한 각도로 잡고 원하는 뇌 영역 (이 경우 60 ° 각도)을 목표로하고 음극은 DNA 전달이 의도 된 영역을 향하게하십시오. 양수 자루가 붕괴 될 수 있으므로 자궁을 압박하지 마십시오 (그림 2M).
- 구형파 펄스 발생기를 사용하여 간격 600ms, 지속 시간 50ms로 35mV에서 5개의 펄스를 적용합니다.
- 양쪽 심실이 모두 주입 된 경우, 대측성 피질을 표적으로 삼기 위해 음극과 양극을 이전 위치를 미러링하여 6.5-6.6 단계를 반복하십시오.
- 필요한 모든 배아에 대해 6.3-6.6단계를 반복합니다.
- 필요한 모든 배아가 전기 천공되면 식염수에 적신 면봉을 사용하여 자궁 뿔을 복강 안쪽에 부드럽게 놓습니다.
참고 : 복강에 식염수를 첨가하면 자궁 뿔이 다시 제자리로 미끄러지는 데 도움이됩니다. - 5-0 봉합사 재료를 사용하여 근육과 피부 절개를 봉합합니다. 봉합사 클립을 사용하여 상처를 고정하고 상처 봉합사를 베타딘으로 분무하여 소독하십시오 (그림 2N-P).
- 마우스에 5% 글루코스 200 μL를 피하 주사한다.
- 마우스에 항생제를 주입하십시오. 50 μL의 Enrofloxacin (5 mg/kg)을 피하로 피하로 섭취 합니다(자료표 참조).
- 마우스를 복구 케이지에 다시 넣고 시술 후 최소 20분 동안 원적외선 온열 조명 또는 가열 패드를 사용하여 온기를 유지합니다(그림 2Q).
- 마우스를 매일 모니터하고 기관 및 연방 지침에 따라 통증 완화를위한 절차 후에 멜록시캄을 주사하십시오.
- 단계 4에 이어 시술 2일 후(즉, E17.5) 배아를 추출한다.
7. 뇌 추출 및 아가로스에 내장
참고: 더 나은 정밀도를 위해 해부 현미경으로 다음 단계를 수행하는 것이 좋습니다. 뇌 손상을 피하는 것은 절차의 성공을 위해 중요합니다.
- 해부 후드 아래의 멸균 작업 공간에 추출 도구를 설치합니다(그림 3A).
- 해부 가위를 사용하여 배아의 머리를 신체의 나머지 부분과 분리하십시오.
- 그림 3C와 같이 머리를 고정한 다음, 머리의 바닥에서 코쪽으로 시작하여 중간선을 따라 절단하여 피부와 두개골을 제거한다(도 3D).
- 피부와 두개골을 옆으로 벗겨서 뇌가 절제되기에 충분한 간격 (~ 1cm)을 만듭니다.
- 뇌를 제거하려면 후각 전구 아래에서 시작하여 뇌 줄기쪽으로 이동하는 멸균 해부 가위의 닫힌 끝을 삽입하십시오 (그림 3E).
- 뇌 줄기를 잘라내고 뇌 주위의 느슨한 수막 조각을 다듬습니다(그림 3F).
참고: 느슨한 수막은 절단 후 조각이 아가로스 블록에 부착 된 상태로 유지되어 슬라이스 수집 중에 아가로스에서 조직을 분리하는 경우가 많습니다. - 모든 배아에 대해 7.1-7.6 단계를 반복하고 임베딩 단계까지 뇌를 얼음 위에 유지하십시오 (이상적으로는 30 분 이상).
참고: 다음 단계 7.7.1-7.7.4는 E12.5 뇌의 뇌 추출을 나타냅니다.- 그림 3G와 같이 눈 바로 아래에 있는 머리 꼭대기를 분리합니다.
- 뇌간을 제거하지 않고 그림 3H와 같이 점선을 따라 뇌간을 위쪽으로 잘라냅니다.
- 그림 3I와 같이 머리 뒤쪽에 2mm 피부 두개골 절개를 만듭니다 (명확성을 위해 도면 참조).
참고: 이 절개는 피부와 두개골의 층을 벗겨내는 초기 그립 포인트를 제공합니다. 일반적으로 그들은 하나의 레이어로 나옵니다. 일반적인 절개 크기는 2mm이며, 사용 된 마이크로 스프링 가위의 절삭 날의 길이에 해당합니다. - 절개의 한쪽을 고정하고 다른 쪽을 조심스럽게 당겨 피부 - 두개골 층을 벗겨 내기 시작하십시오. 같은 주의를 기울여 뇌를 풀어줄 때까지 머리 밑바닥을 벗겨서 마무리하십시오(그림 3J).
참고 : 이것은 뇌가 조직 층을 따라 당겨지지 않는다는 것을 관찰하면서 세심한주의를 기울여야합니다. 뇌를 덮고 있는 조직을 제거하기 위해 측면이 번갈아 가며 활동한다.
- 따뜻한 아가로스 (37-40 ° C에서)를 3cm 접시에 붓습니다.
- 구멍이 뚫린 숟가락을 사용하여 뇌를 집어 들고 마른 티슈 페이퍼에 숟가락의 바닥을 닦아 과도한 액체를 제거하십시오. 뇌를 아가로스 접시에 넣으십시오.
참고 : 아가로오스가 조직에 더 잘 부착 될 수 있도록 가능한 한 많은 액체를 뇌 주위에서 제거하는 것이 중요합니다. - 얼음 위에 액체 아가로스가있는 접시를 넣으십시오. 더 작은 숟가락을 사용하여 아가로스를 10 초 동안 섞어서 냉각시킵니다. 접시의 중앙에 뇌를 기동. 뇌를 등쪽을 위로 향하게 하여 접시에 수평으로 놓고 모든 방향에서 아가로오스로 완전히 덮여 있는지 확인합니다(그림 3K).
참고 : 두뇌는 종종 아가로스에 놓인 접시의 바닥으로 가라 앉습니다. 뇌 아래 1-2mm의 틈이 생길 때까지 작은 숟가락으로 뇌를 들어 올립니다. - 모든 두뇌에 대해 7.8-7.10 단계를 반복하십시오.
- 일단 아가로스가 중합되면, 건조를 방지하기 위해 아가로스 블록 위에 500μL의 HBSS-G를 첨가한다. 그런 다음 접시를 얼음으로 덮으십시오.
참고: 뇌 온도가 4°C에 도달할 수 있도록 절개하기 전에 샘플을 얼음 위에 5분 동안 보관하십시오.
8. 유기형 슬라이스 문화
참고: 슬라이스 오염을 피하기 위해 70%-96% 에탄올로 비브라톰과 주변 표면을 청소하십시오. vibratome 워크스테이션의 설정( 재료 표 참조)은 그림 3B에 나와 있습니다.
- 비브라톰 버퍼 트레이를 차가운 HBSS-G로 채우고 외부 트레이를 얼음으로 채워 시술 내내 HBSS-G를 차갑게 유지하십시오.
- 버블링 스톤을 사용하여 버퍼 트레이에 HBSS-G를 카보겐으로 지속적으로 공급합니다.
- 신선한 칼날을 사용하여 뇌 주위에 큰 컷 (~ 2 x 2cm)을 만들고 뇌가 들어있는 아가로스 블록을 제거하고 아가로스를 작은 사각형 블록으로 트리밍하기에 충분한 주변 아가로스를 제거하십시오.
참고: 이 단계를 통해 블록의 각도를 조정하여 뇌의 시상 축이 비브라톰 플레이트에 수직이고 코로나 축이 블레이드에 평행하게 정렬되도록 할 수 있습니다. 조각의 쉬운 취급을 위해 뇌의 등쪽 쪽에 약 5mm의 아가로스를 남겨 두십시오. - 시편 홀더의 중앙에 빠른 접착 용제가없는 수퍼 접착제의 작은 방울을 놓고 아가로스 블록의 바닥을 덮을 영역으로 퍼뜨립니다.
- 부드럽게 아가로스 블록을 집어 들고 티슈 페이퍼에 닦아 바닥을 말립니다. 표본 홀더의 접착 된 영역에 블록을 놓고 뇌의 로스트랄 쪽을 위로 올려 놓습니다. 시편 홀더를 얼음 위에 놓고 접착제를 1 분 동안 말리십시오.
- 접착제가 건조되면 시편 홀더를 버퍼 트레이에 놓습니다.
- 15 ° 각도로 코로나 조각으로 뇌를 자릅니다.
참고: 슬라이스의 두께는 용도에 따라 달라질 수 있습니다. 여기서, 뇌는 150 μm의 두께로 슬라이스되었다. 비브라톰 속도를 1.0-1.5mm/s로 설정하여 과도한 아가로스를 위에서 트리밍하고 후각 전구를 트리밍합니다. 분석을 위해 피질 조각을 수집하기 위해 절삭 속도를 0.5mm/s로 줄입니다. 대부분의 진동은 각 슬라이스를 수집하기 위해 일시 중지 할 수 있습니다. 조각의 품질 저하 또는 아가로스에서 조직의 분리가 발생하는 경우, 절단 속도를 줄이거나 비브라톰 블레이드를 교체하는 것이 도움이 될 수 있습니다. - 깨끗한 주걱을 사용하여 뇌 조각을 모아 폴리테트라플루오로에틸렌(PTFE) 멤브레인 위에 올려놓고 파라핀(최대 5개의 뇌 조각/멤브레인)을 사용하여 35mm 유리 바닥 접시에 고정시킵니다(그림 3L-M).
참고: PTFE 멤브레인을 왁스를 사용하여 35mm 유리 바닥 접시 안에 고정하십시오. 이것은 슬라이스 배양 배지를 첨가할 때 그리고 또한 이미징 동안 멤브레인을 안정화시킬 것이다. - 200 μL 피펫을 사용하여, PTFE 멤브레인 상의 슬라이스 주위에서 과량의 HBSS-G를 제거하고, 슬라이스를 반건조시킨다.
- 500 μL의 슬라이스 여포(35°C로 예열)를 PTFE 멤브레인 아래의 공간에 직접 첨가한다.
참고: 미디어를 추가할 때 멤브레인 아래에 거품이 형성되지 않아야 합니다. 이렇게 하면 전체 또는 부분 조각이 미디어 교환없이 남습니다. 배양 2일마다 또는 모든 이미징 세션 후에 200μL의 배지를 교체하십시오. - 슬라이스를 5%CO2와 함께 35°C에서 인큐베이션한다.
9. 면역조직화학
- 접시 당 4 % 수크로오스가 보충 된 4 % 파라 포름 알데히드 (PFA) 1 mL로 조각을 고정하십시오. RT에서 30분 동안 인큐베이션한다.
주의: PFA를 취급할 때는 실험실 코트와 장갑을 착용하십시오. 화학 후드 아래에서 고정 단계를 수행하고 PFA 폐기물을 적절하게 처리하십시오. - 슬라이스를 5분 동안 300 μL PBS로 두 번 세척한다. 조각을 24웰 플레이트로 옮깁니다.
참고: 이 단계에서 실험을 일시 중지할 수 있습니다. PBS-NaN3을 슬라이스에 첨가하고 4°C에서 저장한다. NaN3는 독성 화합물이고; 그것으로 해결책을 다룰 때, 실험실 코트와 장갑을 착용하십시오. 단계 9.3-9.10은 오비탈 쉐이커에서 수행될 수 있다. - 슬라이스를 4°C에서 하룻밤 동안 0.1 M 글리신의 300 μL로 켄칭한다.
- 글리신을 RT 3x에서 PBS로 10분 동안 씻어내십시오.
- 슬라이스를 2시간 동안 RT에서 300 μL의 PBS-T로 투과시킨다.
- 2시간 동안 RT에서 PBS-T 중의 10% 염소 혈청을 사용하여 차단한다.
- 하룻밤 동안 4°C에서 PBS-T 용액 중의 10% 염소 혈청에 희석된 300 μL의 일차 항체 (1:200의 희석에서 항-비멘틴 항체; 물질의 표 참조)를 첨가한다.
참고: 9.8-9.12 단계에서 슬라이스는 형광 손실을 방지하기 위해 빛으로 보호되었습니다. - 일차 항체를 20분 동안 RT 3x에서 PBS로 세척한다.
참고: 트리톤 X-100을 세척하기 위해 PBS-T 대신 PBS를 사용하였다. - 300 μL의 이차 항체 (1:400의 희석에서 알렉사 플루오르 488 또는 647; 물질의 표 참조)를 RT에서 PBS에 2시간 동안 첨가한다.
참고: DAPI는 5분 동안 1:10,000의 희석으로 이차 항체를 제거한 직후에 첨가된다. - 이차 항체를 20분 동안 RT 3x에서 PBS로 세척한다. 증류수 2x로 1분 동안 씻으십시오.
- 슬라이스를 미세한 브러시를 사용하여 유리 슬라이드로 옮기고, 30°C에서 20분 동안 건조시킨다.
- 수성 장착 매체를 사용하여 슬라이스를 장착하십시오. 장착 미디어가 큐레이팅할 수 있도록 슬라이드를 RT에 밤새 보관하십시오.
10. 이미징 획득
참고: DNA 전달 접근법(IUE 또는 EUE)에 관계없이, 단편은 동일한 발달 연령 범위(E17.5-E18.5)에서 분석되었다. IUE는 신경 선조가 생체 내에서 이틀 더 분열하고 발달 할 수있게합니다. 반면에 EUE는 초기 발달 사건을 추적 할 수 있습니다.
- 챔버 인큐베이터를 켜고 이미징 전에 5%CO2-이상적으로 4시간으로 35°C로 설정하여 현미경 부품이 35°C에서 평형을 이룰 수 있도록 합니다.
- 조각의 깊은 이미징을 위해, 조직과 목표 사이의 굴절률의 불일치를 줄이기 위해 침수 목표를 사용하십시오.
참고: 여기서는 초해상도 이미징 모드가 사용되었습니다. PTFE 멤브레인을 통한 이미징은 긴 작동 거리 (~ 1mm)의 목표를 필요로합니다. 긴 작동 거리 목표를 사용할 수 없는 경우, 슬라이스는 8웰 유리 바닥 접시로 옮겨질 수 있습니다. 슬라이스를 옮기려면 슬라이스 미디어 1mL를 멤브레인 상단에 첨가한 다음 주걱을 사용하여 슬라이스를 들어 올려 200μL의 배지가 들어있는 웰로 옮깁니다. 슬라이스를 반건조시킨 채로 남겨둔 1 mL 피펫 팁을 사용하여 과량의 배지를 제거한다. - 축삭 성장을 이미징하려면 중간 세포 밀도가 낮은 피질 영역을 찾습니다. 성장 원뿔 역학을 이미징하려면 피질의 중간 영역 또는 심실 하부 영역에서 성장 원뿔을 찾으십시오.
- 이미지 처리 소프트웨어에서 z-스택 크기를 정의합니다( 재질 표 참조). 큰 z-스택에서 축삭 성장을 위해서는 스텝 크기를 2μm로 설정하십시오. 더 작은 z-스택에서 원뿔을 성장시키려면 스텝 크기를 1μm로 설정하십시오.
참고: x, y 및 z 평면을 통한 성장 원뿔과 축삭의 잠재적 이동을 항상 고려하십시오. 축삭은 시험관내 배양물보다 유기형 배양에서 훨씬 더 높은 비율로 성장한다. 여기서, 화상 축삭 성장에 약 80 μm의 z-스택이 충분하였다. 성장 콘 역학의 경우, ~6 μm의 z-스택이 적절하였다. - 더 큰 영역에서 뉴런의 축삭 성장을 이미징하려면 타일 스캔을 정의하십시오.
- 획득 중에 성장 원뿔을 표백 할 가능성을 최소화하기 위해 가능한 가장 낮은 레이저 전력을 사용하십시오.
- 축삭 성장을 이미징하려면 5분 간격으로 2시간 동안 타임랩스를 획득합니다. 이미징 성장 원뿔 역학의 경우, 2.5-3 초 간격으로 2-5 분 동안 시간 경과를 획득하십시오.
11. 데이터 분석
- kymographs를 사용하여 축삭 성장 속도 측정
- 피지14 에서 파일 > 열기 를 통해 이미지 파일을 열고 이미지를 선택하십시오.
- 이미지 > 스택 > Z-프로젝션 > 최대 강도 투영을 통해 타임랩스의 최대 강도 프로젝션을 구합니다.
- 타임랩스를 통과하여 성장하는 축삭을 찾습니다.
- 일단 위치하면, 성장하는 축삭을 통해 선을 그립니다. 첫 번째 프레임의 축삭 끝에서 시작하여 전체 타임랩스를 통해 축삭을 따라갑니다.
- 플러그인 KymoResliceWide를 사용하여 kymograph를 생성하십시오.
- 이미지 > 속성으로 이동하여 키모그래프의 배율을 설정합니다. 거리를 픽셀 너비에서 μm 단위로 설정하고 픽셀 높이에서 시간을 s 또는 min으로 설정합니다.
- 측정 분석으로 이동>니다.
참고: x축을 기준으로 한 각도가 제공됩니다. - 스프레드시트에서 각도를 다음 방정식으로 대입하여 축삭 성장 속도를 계산합니다: 스프레드시트에서 SIN(RADIANS(θ))/COS(RADIANS(θ) ).
- 이미지 분석 소프트웨어를 사용하여 성장 원뿔의 부피를 측정 하십시오 (재료 표 참조).
- File > Open을 통해 이미지 분석 소프트웨어에서 이미지 파일을 열고 관심있는 파일을 선택하십시오.
- 새 서피스 추가 마법사를 선택합니다.
참고: 왼쪽 아래 모서리에 있는 섹션이 수동 편집을 위한 여섯 단계로 나타납니다. - 1 단계에서 알고리즘 설정 에서 관심 영역만 세그먼트를 선택합니다. 2단계에서 전체 성장 원뿔을 모든 프레임에 맞게 프레임을 자릅니다.
- 단계 3에서 절대 강도 로 임계치를 유지하고, 단계 4에서 전체 성장 원뿔 영역이 임계치가 되도록 한다.
- 5단계에서 필터 유형에서 복셀 수 lmg = 1을 선택합니다.
참고: 마지막 단계에서는 여러 측정 세트를 만들 수 있습니다. 여기서는 볼륨에 대해 하나의 측정값만 생성되었습니다. - 실행 단추를 선택하여 모든 생성 단계를 수행하고 새 서피스 추가 마법사를 종료합니다.
- 마법사 창 위쪽에 있는 통계 탭에서 세부 정보 탭에서 특정 값 및 볼륨을 선택합니다.
결과
설명된 방법 워크플로우로 얻은 대표적인 결과가 표시됩니다. E15.5 마우스가 본 시연에 사용되었지만, 이 프로토콜은 E11에서 E17 후반까지 거의 모든 배아 연령에 쉽게 적응할 수 있다. 이 프로토콜에서, 엑테로 전기천공(EUE; 도 2A, 2C-I) 또는 우테로 전기천공(IUE; 도 2B, C, 및 2J-Q)는 측심실을 감싸는 전구 뉴런 내로 플라스미드를 전달하는데 사용되었다. 이 선조는 미래의 피질 투영 뉴런 (CPN)15,16의 원천입니다. 플라스미드 믹스는 성장 원뿔에서의 전반적인 거동 및 액틴 역학을 각각 평가하기 위해 막 표적화 (Lyn)-mNeonGreen (도 1A) 또는 LifeAct-enhanced (E)GFP (도 1B) 중 어느 하나의 희소 뉴런 특이적 발현을 유도하기 위해 제조되었다. 또한, 개별 뉴런을 터보(t)-RFP 또는 조안투스 sp.(Zs) 녹색 형광 단백질(ZsGreen)(도 1C)로 표지하기 위한 플라스미드 믹스가 포함되었다. 이것은 독립적 인 이웃 뉴런으로부터의 성장 원뿔 행동의 모니터링을 용이하게합니다.
전기 천공 된 배아로부터의 뇌 해부는 고품질의 조각을 얻기 위해 신중하게 수행되어야하는 중요한 단계이며 네이티브 뇌 구조를 보존합니다. 해부 기구 및 비브라톰을 미리 준비하고 조심스럽게 에탄올 멸균하였다(도 3A,B). 다음으로, 전기 천공 된 배아의 머리를 조심스럽게 해부하고 뇌를 추출했습니다. 여기에서, E15 (도 3C-F) 및 E12.5 (도 3G-J)에서 EUE를 실시한 배아로부터의 뇌의 대표적인 해부가 도시되어 있다. 뇌는 즉시 아가로스 매트릭스에 싸여 슬라이스하고, 배양을 위해 바닥 유리 접시 내의 PTFE 멤브레인 인서트에 배치됩니다 (그림 3K-M).
뇌 조각의 건강 상태는 신뢰할 수있는 결과를 보장하기 위해 통제를위한 중요한 포인트입니다. 모든 오염에 대한 육안 검사가 매일 수행되었습니다. 또한, 일단 배양이 마무리되면, 뇌 조각은 고정되고 면역조직화학을 실시한다. 여기서, 4',6-디아미디노-2-페닐인돌(DAPI)을 사용하여 전체 세포 조직 및 비멘틴 염색을 조절하여 신경교 조직을 드러냈다; 특히, 방사형 글리아교(RG) 스캐폴드. 전형적으로, IUE 또는 EUE로부터 유래된 성공적으로 배양된 뇌 절편은 DAPI 및 정점 지향된 피알-접촉 과정(17 )을 갖는 RG의 다소 조직화된 어레이에 의해 밝혀진 바와 같이 정상적인 세포 분포를 나타낸다(각각 도 4A, B). 때때로, 배양된 뇌 절편에서 RG 스캐폴딩에서 현저한 교란이 관찰되며, 특히 EUE 전기천공으로부터 유래된 것들에서 관찰된다(도 4C). 극도로 혼란스러운 RG 스캐폴드를 가진 뇌 조각은 손상된 신경 이동 및 결함이있는 축삭 성장 (도시되지 않음)을 보여줍니다. 따라서, RG 스캐폴드를 제어하는 것은 신뢰할 수 있는 뇌 조각으로부터 얻은 데이터를 정렬하는 쉬운 사후 배양 방법이다.
Lyn-mNeonGreen-발현 플라스미드 믹스를 갖는 IUE 또는 EUE로부터 유래된 뇌 조각은 유사한 희소 뉴런 표지를 초래한다. Lyn-mNeonGreen과 그의 성장 원뿔의 동적 거동을 발현하는 대표적인 피라미드형 CPN이 예로서 도시되어 있다(도 5A 및 보충 비디오 1, 왼쪽 상단). 또한, 뉴런은 액틴 프로브를 발현하는 플라스미드를 사용하여 표지하여 축삭 성장 원뿔의 액틴 역학을 분석 하였다 (도 5B 및 보충 비디오 1, 왼쪽 하단). 계내 실험은 또한 이중 Cre/Dre 형광단-발현 플라스미드 설계로 수행되었다(도 1C 및 보충 비디오 1, 오른쪽). 이 플라스미드 내의 tRFP 또는 ZsGreen 형광단은 이웃 뉴런에서 각각 Dre 또는 Cre 재조합효소에 의해 특이적으로 그리고 개별적으로 활성화될 수 있다(도 5C). 이 실험 라인업은 이웃 변형 뉴런 (주어진 기능 손실 또는 이득)이있는 제어 뉴런의 성장 원뿔을 나란히 분석 할 수있게합니다. 이것은 제어 및 실험 조건을 테스트하기 위해 다른 슬라이스를 사용함으로써 발생하는 변동성을 회피합니다.
기록된 동영상으로부터 생성된 키모그래프를 분석하였고, 이로부터 시간에 따른 돌출 활성 및 성장 길이와 같은 동적 성장 파라미터를 쉽게 얻을 수 있다(도 6A). 타임랩스의 시간적 분해능을 간단히 조정하면 2시간 동안 축삭 신장 속도를 측정할 수 있습니다(그림 6A). 더욱이, 시간에 따른 성장 원뿔 부피의 변화-일반적인 성장 콘 동적 활성의 척도-허가된 소프트웨어를 사용하여, 이 경우 용이하게 수득될 수 있다(도 6B 및 도 6E, F). 이것은 액틴 디딜 방아의 속도와 성장 원뿔 탐험 활동 중 filopodia / lamellipodia의 균형을 평가하는 데 사용할 수 있습니다.
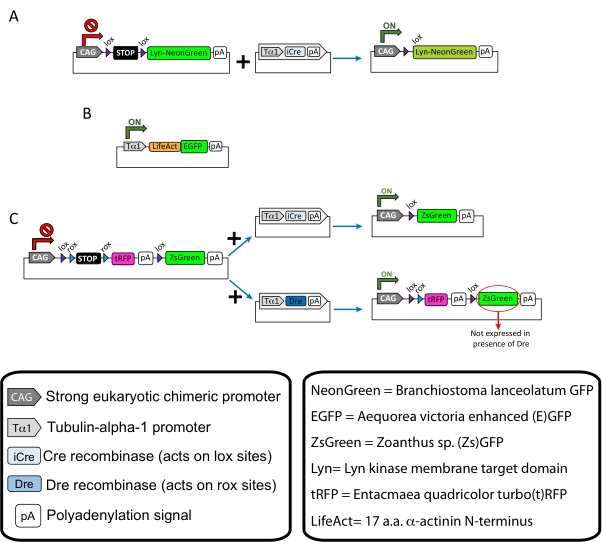
도 1: 프로토콜에 사용된 플라스미드의 스킴 . (A) pCAG-lox-STOP-lox-Lyn-mNeonGreen. (B) p-Tub-alpha-1-LifeAct-GFP. (C) pCAG-lox-rox-STOP-rox-tRFP-pA-lox-ZsGreen-pA. 플라스미드 성분 및 형광단의 기원에 관한 관련 정보는 박스에서 발견된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
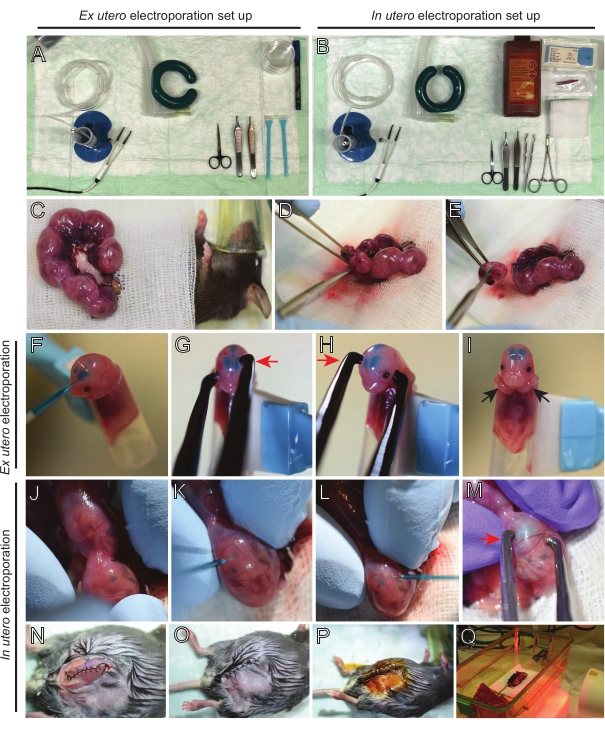
그림 2: E15.5 마우스의 ex utero 및 utero electroporation의 워크플로우. (A) 전 utero 전기 천공을위한 수술소의 설치. (B) utero electroporation 에 있는 수술소의 설치. (C) 마취된 마우스의 복강 밖으로 당겨진 자궁 뿔. (D) 자궁 자루에서 배아의 추출. (e) 대각선 절개를 통한 완전한 척수 횡단에 의한 배아 희생; 참수는 피했다. (F) 홀더에 배아를 배치하고 DNA / Fast Green 혼합물을 좌측 심실에 주입합니다. (G, H) 배아의 머리를 백금 핀셋 전극 사이에 놓고 음극 (빨간색 화살표)을 피질 위에 60 ° 각도로 놓습니다. (I) 절차 중 배아의 미끄러짐을 방지하기 위해 배아의 팔 (검은 화살표)을 홀더 외부에 배치합니다. (J) 머리를 노출시키기 위해 자궁 자루 내부의 배아의 회전. (케이, L) DNA / Fast Green 혼합물을 자궁 벽을 통해 배아의 측심실에 주입합니다. (M) 배아의 머리를 백금 핀셋 전극 사이에 놓고 음극(빨간색 화살표)을 피질 위에 60° 각도로 놓습니다. (N) 달리기 잠금 봉합사 를 통해 봉합 된 근육 절개. (O) 중단된 봉합사를 통해 피부 절개를 봉합한다. (p) 수술 상처 클립을 사용하여 상처의 확보 및 베타 딘을 사용하여 소독. (Q) 원적외선 온난광으로 회복 케이지에 마우스를 배치합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3 : E15.5 및 E12.5 뇌의 추출 및 유기형 슬라이스 배양 절차. (A) 뇌 추출 절차에 사용되는 도구. (B) 유기형 배양소의 설치. (C-F) E15.5 뇌의 추출. (G-J) E12.5 뇌의 추출. 점선은 절개 위치를 강조 표시합니다. 빨간색 화살표는 집게로 당기는 방향을 가리 킵니다. (K) 3% 저용융 아가로스를 함유하는 3cm 접시에 뇌를 임베딩하고, 뇌 아래에 1-2mm 아가로스 간격 간격을 남긴다. (L) 150 μm 뇌 슬라이스의 수집. (M) 파라핀 필름 (파란색 화살표)을 사용하여 35mm 접시에 고정화 된 PTFE 막 인서트에 뇌 조각을 배치합니다. 빨간색 별 표시는 비브라톰(L)에서 주어진 뇌 조각 수집과 PTFE 막(M)으로의 전달을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
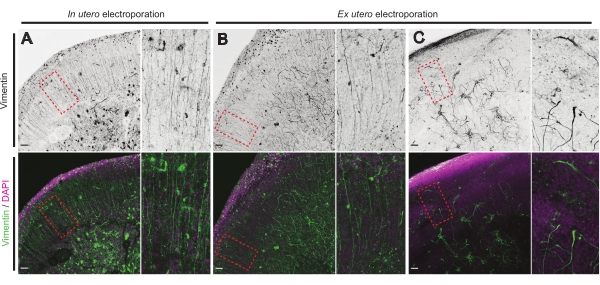
그림 4: 건강한 유기형 슬라이스에서 보존된 방사상 신경교세포 구조. E17.5 뇌 조각의 공초점 이미지는 IUE (A) 및 EUE (B, C)에 이어 RG 배열 (vimentin; 녹색)과 전체 세포 조직 (DAPI; 자홍색)을 나타냅니다. RG 어레이에서 때때로 EUE(C)로 인해 발생할 수 있는 강한 교란에 유의하십시오. 배율은 주 그림의 빨간색 점선 프레임(배율 막대, 10μm)에 해당합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
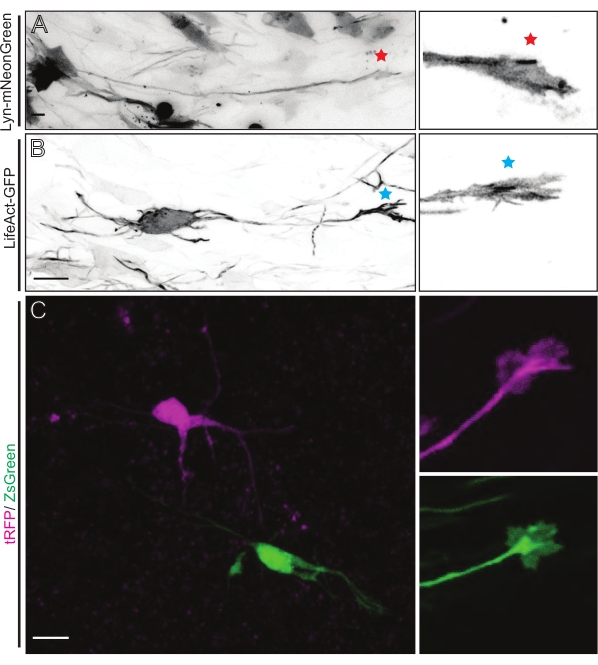
그림 5: 급성 유기형 슬라이스에서 성장 원뿔 역학의 현장 시각화. (A, B) 뉴런과 그에 상응하는 성장 원뿔은 각각 Lyn-mNeonGreen 및 LifeAct-GFP로 표지되어 있습니다. Lyn-mNeonGreen의 레드 스타 마킹 성장 원뿔은 뉴런을 발현합니다. 블루 별표 표시 성장 원뿔 LifeAct-GFP 발현 뉴런. (c) tRFP (마젠타) 및 ZsGreen (녹색) 및 이들의 상응하는 성장 원뿔을 함유하는 이중 플라스미드 시스템으로 표지된 이웃 뉴런. 영상화된 성장 원뿔(오른쪽)은 캡처된 프레임 밖(왼쪽)이었고, 성장 콘을 획득한 직후에 획득된 시간-경과; 배율 막대, 5 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
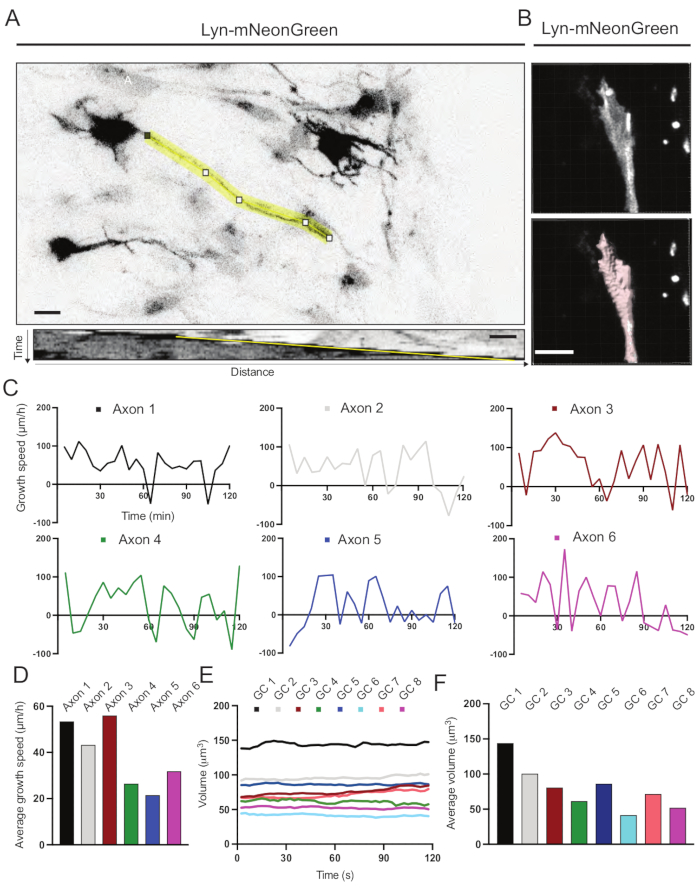
도 6: 축삭 성장 속도 및 성장 원뿔 부피의 분석. (A) ImageJ를 사용하여 생성된 Lyn-mNeonGreen을 발현하는 뉴런에 대한 축삭 추적(상단) 및 그에 상응하는 키모그래프(아래). (B) 이미지 분석 소프트웨어를 이용한 성장 원뿔의 z-스택 비디오의 재구성 (상단) 및 표면 측정 도구를 사용하여 강조 표시된 동일한 성장 원뿔 (아래). (C) 여러 축삭에 대한 시간에 따른 성장 속도의 변화를 보여주는 그래프. (d) 축삭돌기의 평균 성장 속도는 (C)에서 정량화된다. (e) 시간에 따른 원뿔 부피의 성장 부피의 변화를 보여주는 그래프. (f) 성장 원뿔의 평균 부피는 (E)에서 정량화되고; 스케일 바, 5 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
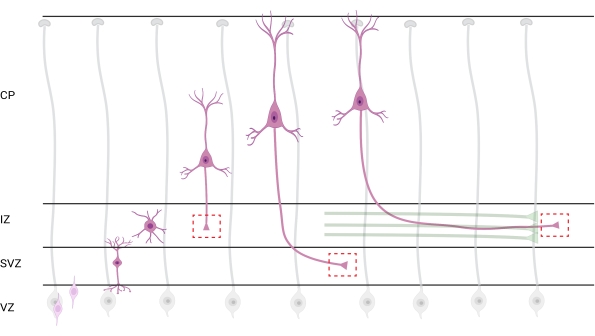
그림 7: 피라미드 피질 뉴런의 방사상 이동 및 신경 분극. 발아 심실 영역(VZ)에서 피아 표면쪽으로 방사상으로 이동하는 피라미드형 피질 뉴런(분홍색)의 발달을 보여주는 다이어그램. 방사형 신경교 과정 (회색)에 의해 유도되고, 편광 된 뉴런을 이동시키는 것은 중간 영역 (IZ)을 향해 아래쪽으로 계속 확장되는 선도적 인 과정, 미래의 덴드라이트 및 후행 과정 인 미래 축삭을 확립합니다. 파선 된 빨간색 상자는 성장 원뿔이 이미지화 된 피질 영역을 나타냅니다. 특히 IZ, 심실 하부 영역 (SVZ) 또는 결합 축삭 번들 (녹색)에서. 이 그림은 웹 기반 도구 BioRender.com 을 사용하여 작성되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 플라스 미드 | 농도(μg/μL) | 사용 목적 |
| pCAG-lox-STOP-lox-Lyn-mNeonGreen | 0.25 | 막 표적 단백질 (Lyn)의 라벨링 |
| + | + | |
| p-욕조-알파-1-iCre | 0.08 | |
| p-Tub-alpha-1-LifeAct-GFP | 0.125 | 성장 원뿔에 필라멘트 액틴 (F-actin) 라벨링 |
| pCAG-lox-rox-STOP-rox-tRFP-lox-Lyn-ZsGreen | 1 | 이웃 뉴런의 두 집단에 대한 독립적 인 라벨링 |
| + | + | |
| p-욕조-알파-1-iCre | 0.004 | |
| + | + | |
| p-욕조-알파-1-드레 | 0.2 |
표 1: 프로토콜에 사용된 플라스미드의 목록. 각각의 활용된 플라스미드의 이름, 농도 및 의도된 용도.
보충 비디오 1 : 급성 유기형 조각에서 성장 원뿔 역학의 현장 시각화. Lyn-mNeonGreen (왼쪽 위)과 LifeAct-GFP (왼쪽 아래)로 표시된 성장 원뿔의 역학. 이웃하는 성장 원뿔은 tRFP (마젠타; 오른쪽 상단) 및 ZsGreen (녹색; 오른쪽 하단)을 함유하는 이중 플라스미드 시스템으로 차별적으로 표지된다. 이미징 간격, 2.5초. 스케일 바, 5 μm. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
성장 원뿔이 어떻게 주변 환경을 감지하고 반응하여 동시 축삭 확장과 지침을 조정하는지는 여전히 논쟁의 문제입니다 3,18. 2D 기질에 대한 선구적인 연구는 축삭 형성, 성장 및 탐색 2,10,11,12,19 동안 성장 원뿔 역학을 유도하는 힘을 생성하는 근본적인 분자 메커니즘을 엿볼 수있었습니다. 보다 최근에, 3D 행렬에 대한 연구는 3차원이 성장 원뿔의 거동과 결과적으로 축삭 성장 8,9에 얼마나 많은 영향을 미치는지 밝혀냈다. 그럼에도 불구하고, 생체 내에서 성장 콘 역학을 지시하는 복잡한 메커니즘은 철저히 조사되어야 한다.
IUE 또는 EUE 뇌로부터의 유기형 슬라이스 배양물의 제조는 널리 활용되고 잘 문서화되어 있다. 그것은 과학자들이 살아있는 뇌 조직20,21에서 뉴런의 발달과 행동에 대한 통찰력을 얻을 수있게 해주는 황금 표준이되었습니다. 실제로이 기술은 다양한 고해상도 이미징 기술과 함께 성공적으로 활용되어 특정 분자 과정 및 형태 학적 사건을 현장에서 시각화했습니다. 이러한 연구들은 축삭 형성 및 연장 19,22, 피질 뉴 런 이동19,22,23,24, 센트로솜 역학 25,26, 미세소관 역학(27), 뿐만 아니라 시냅스 전후 구획(28,29)의 기능적 역학을 포함하나 이에 제한되지는 않는다.
이 프로토콜은 실험 신경 생물학의 격차를 해결하고, 현장에서 피질 뉴런을 개발하는 성장 원뿔 역학을 시각화하고, 생체 외 급성 뇌 슬라이스 배양 및 얻은 데이터를 분석하는 도구를 시각화합니다.
급성 뇌 슬라이스 배양은 (1) 일부 연습을 통해 생성하기 쉽기 때문에이 프로토콜을 확립하기 위해 활용되었습니다. (2) 고해상도 라이브 셀 이미징을 허용할만큼 충분히 투명하면서도 준 생리적 환경에 매립 된 성장 원뿔을 연구 할 수있는 접근 가능한 시스템을 제시한다. (3) 무수한 트랜스제닉 마우스 라인과의 사용을 위해 확장될 수 있고; (4) IUE 또는 EUE와 결합하여 형광 리포터 및 세포 골격 프로브와 함께 기능 체계의 손실 / 이득 하에서 생체 내에서 성장 원뿔 및 축삭 돌기의 성능을 평가하는 분자 도구를 제공 할 수있는 거의 무한한 잠재력을 제공합니다.
이 방법론은 EUE와 IUE의 맥락에서 설명되었습니다. 여전히 매우 신뢰할 수 있는 방법이지만, EUE는 전달 방법으로 IUE로 얻은 것에 비해 무질서한 RG 네트워크를 나타내는 뇌 절편의 발생률이 증가하였다(도 4C). RG 어레이의 교란은 뉴런 이동과 축삭 신장패턴 30,31에 강하게 영향을 미칩니다. 이들은 주어진 시간에 분석을 위해 축삭을 찾을 위치와 탐색하는 환경의 유형을 예측하는 주요 매개 변수입니다. RG 네트워크가 크게 파괴 된 뇌 조각은 일반적으로 피질 뉴런 층화가 손상됩니다. 이것은 차례로 혼란스러운 궤적을 가진 축삭을 생성합니다. 따라서 RG 네트워크의 구조적 무결성을 제어하는 것이 좋습니다. 흥미롭게도, 열악한 구조적 완전성은 배아 뇌의 나이 증가와 관련이 있습니다. 실제로, 젊은 E12.5-E13.5 배아에서 그러한 효과는 전형적으로 관찰되지 않았다19.
현재 프로토콜은 철저하고 간단합니다. 그럼에도 불구하고 최적의 결과를 얻기 위해 특별한주의와주의를 기울여야하는 몇 가지 중요한 단계가 있습니다. 이들은 프로토콜에서 명백하게 언급되었으며, (1) 희소 표지를 얻기 위해 전기천공에 사용되는 DNA의 양을 튜닝하는 것을 포함한다; (2) 뇌의 추출 동안 손상을 피하기; (3) 뇌 케이싱 동안 아가로스의 온도를 조절하는 단계; (4) 주어진 나이의 두뇌에 대한 아가로스의 이상적인 비율을 해결하는 단계; (5) 형광단의 선택, 그 경험은 다음과 같습니다. 프로토콜 최적화 동안, 계내 이미징에서 살아있는 세포에서 여러 형광단의 성능을 시험하였다. 단량체성 GFP 변이체는 LifeAct- 및 Lyn-태깅된 플라스미드의 제조를 위해 EGFP 및 NeonGreen-태깅된 플라스미드를 이 프로토콜에 대해 선택하였다(도 5A,B). 또한, RFP 변이체 mScarlet을 테스트하고 이 설정에 매우 적합한 것으로 나타났습니다(데이터는 표시되지 않음). 다량체 tRFP (이량체) 및 ZsGreen (사량체) (도 5C 및 보충 비디오 1, 오른쪽)을 또한 시험하였다. 이러한 빠른 폴딩 초휘 형광단은 DNA 전달 후 신속한 형광 신호 생성이 필요한 경우에 권장됩니다.
슬라이스 배양을 사용하는 일반적인 관행은 다른 두뇌의 조각을 사용하여 제어 및 실험 조건을 테스트하는 것입니다. 이것은 원치 않는 변동성의 고유 한 원인을 나타냅니다. 여기서, 동종 뉴런과 리포터의 발현을 독립적으로 변형시켜 동정할 수 있는 발현 시스템이 사용되었다. 이 시연에서(도 5C), 형광단 중 어느 하나를 발현하는 뉴런 사이에는 차이가 없었다. 그러나, 일례로서, Cre 민감성 유전자를 보유하는 트랜스제닉 마우스 라인과 결합된 이러한 플라스미드 믹스는 야생형으로 남아있는 tRFP(Dre-sensitive) 뉴런으로 표지될 것이다. 대조적으로, ZsGreen (또한 Cre-sensitive)은 재결합 된 뉴런을 라벨링합니다. 따라서 두 개의 서로 다른 유전자형의 성장 원뿔과 표현형도 동일한 뇌 조각에서 동시에 나란히 연구 될 수 있습니다.
분석을 위해 축삭과 성장 원뿔의 국소화는 중요한 고려 사항입니다. 피질 뉴런은 심실 영역 (VZ)에서 피질 플레이트 (CP)쪽으로 방사상으로 이동하면서 편광됩니다. 이 과정 동안, 뉴런은 선도적 인 과정 (미래의 덴드라이트)과 축삭이 될 후행 과정을 형성하고, 결국 중간 영역 (IZ)에서 선구적인 축삭에 합류하여 축삭 관 (32)을 확립합니다. 따라서, 축삭 성장 원뿔을 포획하기 위해, CP를 빠져나가는 축삭 및 축삭 다발과 이미 연관된 초기 생성 축삭을 포함하는 IZ의 축삭 섬유에 대한 이미징이 수행되었다; 또는 결국, IZ를 횡단하고 그 아래로 확장되는 섬유에서(그림 7).
이 프로토콜은 유기형 슬라이스 내에서 뉴런의 초해상도 이미징을 수행하는 것을 가능하게 합니다. 역사적으로 광산란은 두꺼운 표본을 이미징 할 때 직면 한 중요한 문제였습니다. 지난 이십 년 동안 광학 기술의 광범위한 발전으로 두꺼운 시편의 이미징이 가능해졌습니다. 여기에서는 성장 원뿔과 같은 작은 구조물을 더 잘 시각화하기 위해 긴 작동 거리 목표를 사용했습니다. 불가피하게,이 프로토콜은 역행 액틴 흐름 또는 미세 소관 역학과 같은보다 상세한 이벤트를 캡처하지 않습니다. 더 낮은 NA(Numerical Aperture)를 필요로 하는 긴 작동 거리 목표는 두꺼운 조각의 정보를 보존합니다. 그러나 더 짧은 작업 거리의 목표와 함께 사용하도록 이 프로토콜을 조정할 수도 있었습니다. 이를 위해서는 구조적 무결성을 유지하기 위해 조각을 유리 바닥 접시로 부드럽게 옮겨야했습니다. 그러나이 방법을 사용하면 가스 교환 손실로 인해 생존율 ~ 15 시간이 단축되었습니다 (데이터는 표시되지 않음). 2D 문화권과 달리 3D의 성장 원뿔은 더 큰 부피를 차지하며 z축에서 이동 아티팩트 보정이 필요합니다. 상세한 사건을 이미지화하는 능력을 높이려면 현대 공초점 기술을 활용해야합니다. 따라서, 고감도 공초점 현미경(33)에서 이용가능한 z-Galvo와 같은 고속 스캐닝 z-스택 모터를 사용하는 것이 좋다.
참고로, 이 프로토콜은 세 가지 주요 제한 사항을 제시합니다. 첫째, 생체내에서 임의의 주어진 플라스미드의 발현 수준/발현 세포의 수를 조절하는 것은 종종 도전적이다. 이것은 동일한 플라스미드 농도를 유지하는 경우에도 모든 슬라이스 사이의 가변성을 도입한다. 따라서, 사용된 발현 벡터에서 조절 요소의 선택은 주의해서 미리 결정되어야 한다. 둘째, 멤브레인 인서트를 사용하여 상세한 이벤트를 이미징하는 것은 현재 실현 가능하지 않습니다. 이 두 번째 제한은 이전 단락에서 제안 된 방법 론적 업데이트로 극복 될 수 있습니다. 마지막으로, 성장 원뿔은 매우 감광성이며 빠르게 광표백 될 수 있습니다. 따라서 레이저 스캐닝 현미경을 사용하여 5 분 동안 성장 원뿔을 자주 이미징하면 종종 성장 원뿔이 붕괴 될 수 있습니다. 이와 관련하여, 광시트 현미경 생성 장치의 새로운 발전은 뇌 슬라이스(34)의 장기 이미징을 위해 적응될 수 있다.
이와 같은 프로토콜은 새로운 연구 길을 열어 성장 원뿔이 복잡한 생체 내 환경을 향해 읽고 반응하는 데 필요한 것을 더 잘 이해할 수있게하고, 더 중요한 것은이 정교한 상호 작용의 메커니즘을 풀기 위해 구상됩니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
절차를 촬영해 주신 Maria Eugenia Bernis에게 감사드립니다. 또한 원고를 읽고 토론해 주신 Emily Burnside, Emily Handley, Thorben Pietralla, Max Schelski, Sina Stern에게도 감사드립니다. 우리는 뛰어난 기술 조수, 제시카 고니어, 블랑카 랜델, 안투안 팜에게 감사드립니다. 우리는 DZNE의 광학 현미경 시설 및 동물 시설의 귀중한 지원을 인정합니다. 이 연구는 Deutsche Forschungsgesellschaft (DFG), International Foundation for Research in Paraplegia (IRP) 및 Wings for Life (F.B)의 지원을 받았습니다. F.B.는 우수 클러스터 ImmunoSensation2, SFB 1089 및 1158의 회원이며 Roger De Spoelberch Prize를 수상했습니다.
자료
| Name | Company | Catalog Number | Comments |
| Adson Forceps | Fine Science Tools | 11006-12 | |
| Alexa Fluor 488 | Invitrogen | A21202 | Goat Anti-Mouse |
| Alexa Fluor 647 | Invitrogen | A21236 | Goat Anti-Mouse |
| Anti-Vimentin antibody | sigma-Aldrich | V2258-.2ML | Monoclonal mouse, clone LN-6, ascites fluid |
| B27 supplement | ThermoFisher Scientific | 17504044 | |
| Betadine | B. Braun | 3864154 | |
| Biozym Sieve GP Agarose | Biozyme | 850080 | |
| Braunol, Sprühflasche | B. Braun | 3864073 | |
| Buprenorphine (Temgesic) | GEHE Pharma | 345928 | |
| DAPI | sigma-Aldrich | D9542 | |
| DMZ unevirsal electrode puller | Zeitz | NA | |
| Electric razor | Andes | NA | ProClip UltraEdge Super 2-Speed model |
| Enrofloxacin (Baytril) | Bayer | 3543238 | 2,5% (wt/vol) |
| Eppendorf microloader pipette tips | FischerScientific | 10289651 | |
| Fast Green FCF | Sigma-Aldrich | F7252-5G | Dye content ≥ 85 % |
| Fetal Bovine Serum | ThermoFisher Scientific | 10500064 | |
| Fiji 2.1.0 | NIH | NA | https://imagej.net/software/fiji/downloads |
| Fine Scissors | Fine Science Tools | 14058-09 | ToughCut/Straight/9cm |
| FluoroDish Cell Culture Dish | World Precision Instruments | FD5040-100 | |
| Fluoromount Aqueous Mounting Medium | sigma-Aldrich | F4680-25ML | |
| Glucose | MedPex | 3705391 | 5% |
| GlutaMAX Supplement | ThermoFisher Scientific | 35050061 | |
| Glycine | Sigma-Aldrich | G8898 | |
| HBSS | Life Technologies | 14025092 | calcium, magnesium, no phenol red |
| Horse serum | Pan-Biotech | P30-0711 | |
| Imaris 9.7.2 | Bitplane | NA | https://imaris.oxinst.com/products/imaris-for-neuroscientists |
| Isoflurane | Virbac | NA | |
| Isotonic saline solution | B. Braun | 8609261 | 0.90% |
| Leica VT1200 S vibratome | Leica | 14048142066 | |
| LSM 880 with Airyscan | Zeiss | NA | |
| Metacam | Venusberg Apotheke | 8890217 | 5 mg/ml |
| Mice | Janvier Labs | NA | C57BL/6JRj |
| Micro-Adson Forceps | Fine Science Tools | 11018-12 | |
| Micropipette Storage Jar | World Precision Instruments | E210 | 16.16.27 |
| Microsoft Excel | Microsoft | NA | https://www.microsoft.com/en-us/microsoft-365/p/excel/cfq7ttc0k7dx?activetab=pivot:overviewtab |
| Millicell Cell Culture Insert | EMD Millipore | PICM0RG50 | 30 mm, hydrophilic PTFE, 0.4 µm |
| Moria Perforated Spoons | Fine Science Tools | 10370-18 | |
| Moria Spoon | Fine Science Tools | 10321-08 | |
| Neurobasal Medium, minus phenol red | ThermoFisher Scientific | 12348017 | |
| Neuropan-2 supplement | Pan-Biotech | P07-11010 | |
| Normal goat serum | Abcam | ab138478 | |
| Olsen-Hegar Needle Holder with Scissors | Fine Science Tools | 12002-12 | |
| p-Tub-alpha-1-Dre | Addgene | 133925 | |
| p-Tub-alpha-1-iCre | Addgene | 133924 | |
| p-Tub-alpha-1-LifeAct-GFP | Addgene | 175437 | |
| Parafilm | VWR | 52858-000 | |
| Paraformaldehyde | sigma-Aldrich | P6148 | |
| PBS | Sigma-Aldrich | P3813-10PAK | |
| pCAG-lox-rox-STOP-rox-tRFP-lox-Lyn-ZsGreen | Addgene | 175438 | |
| pCAG-lox-STOP-lox-Lyn-mNeonGreen | Addgene | 175257 | |
| Penicillin-Streptomycin | ThermoFisher Scientific | 15140122 | |
| PicoNozzle Kit v2 | World Precision Instruments | 5430-ALL | |
| Platinum Tweezertrodes | Harvard Apparatus | 45-0487 | 1 mm / 3 mm |
| QIAGEN Maxi kit | QIAGEN | 12162 | |
| Reflex wound closure Clip | World Precision Instruments | 500344-10 | 7 mm |
| Sekundenkleber Pattex Mini Trio | Lyreco | 4722659 | |
| Square wave electroporation system ECM830 | Harvard Apparatus | W3 45-0052 | |
| Sterile gauze | Braun Askina | 9031216 | |
| Sterile lubricant eye ointment | Bayer Vital | PZN1578675 | |
| Sterile surgical gloves | Sempermed | 14C0451 | |
| Sucrose | Roth | 4621.2 | |
| Supramid 5-0 surgical silk sutures | B. Braun | NA | |
| Thin-wall glass capillaries | World Precision Instruments | TW100-4 | |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Vannas spring scissors | Fine Science Tools | 15000-03 | |
| µ-Slide 8 Well Glass Bottom | Ibidi | 80827 |
참고문헌
- Schelski, M., Bradke, F. Neuronal polarization: From spatiotemporal signaling to cytoskeletal dynamics. Molecular and Cellular Neurosciences. 84, 11-28 (2017).
- Lowery, L. A., Van Vactor, D. The trip of the tip: understanding the growth cone machinery. Nature Reviews: Molecular Cell Biology. 10 (5), 332-343 (2009).
- Stoeckli, E. T. Understanding axon guidance: are we nearly there yet. Development. 145 (10), (2018).
- Bradke, F., Dotti, C. G. The role of local actin instability in axon formation. Science. 283 (5409), 1931-1934 (1999).
- Neukirchen, D., Bradke, F. Cytoplasmic linker proteins regulate neuronal polarization through microtubule and growth cone dynamics. Journal of Neuroscience. 31 (4), 1528-1538 (2011).
- Witte, H., Bradke, F. The role of the cytoskeleton during neuronal polarization. Current Opinion in Neurobiology. 18 (5), 479-487 (2008).
- Witte, H., Neukirchen, D., Bradke, F. Microtubule stabilization specifies initial neuronal polarization. Journal of Cell Biology. 180 (3), 619-632 (2008).
- Nichol, R. H., Catlett, T. S., Onesto, M. M., Hollender, D., Gomez, T. M. Environmental elasticity regulates cell-type specific RHOA signaling and neuritogenesis of human neurons. Stem Cell Reports. 13 (6), 1006-1021 (2019).
- Santos, T. E., et al. Axon growth of CNS neurons in three dimensions is amoeboid and independent of adhesions. Cell Reports. 32 (3), 107907(2020).
- Mitchison, T., Kirschner, M. Cytoskeletal dynamics and nerve growth. Neuron. 1 (9), 761-772 (1988).
- Lin, C. H., Thompson, C. A., Forscher, P. Cytoskeletal reorganization underlying growth cone motility. Current Opinion in Neurobiology. 4 (5), 640-647 (1994).
- Myers, J. P., Gomez, T. M. Focal adhesion kinase promotes integrin adhesion dynamics necessary for chemotropic turning of nerve growth cones. Journal of Neuroscience. 31 (38), 13585-13595 (2011).
- Turney, S. G., et al. Nerve growth factor stimulates axon outgrowth through negative regulation of growth cone actomyosin restraint of microtubule advance. Molecular Biology of the Cell. 27 (3), 500-517 (2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Noctor, S. C., Flint, A. C., Weissman, T. A., Dammerman, R. S., Kriegstein, A. R. Neurons derived from radial glial cells establish radial units in neocortex. Nature. 409 (6821), 714-720 (2001).
- Noctor, S. C., Martinez-Cerdeno, V., Ivic, L., Kriegstein, A. R. Cortical neurons arise in symmetric and asymmetric division zones and migrate through specific phases. Nature Neuroscience. 7 (2), 136-144 (2004).
- Ferent, J., Zaidi, D., Francis, F. Extracellular control of radial glia proliferation and scaffolding during cortical development and pathology. Frontiers in Cell and Developmental Biology. 8, 578341(2020).
- Dent, E. W., Gupton, S. L., Gertler, F. B. The growth cone cytoskeleton in axon outgrowth and guidance. Cold Spring Harbor Perspectives in Biology. 3 (3), (2011).
- Dupraz, S., et al. RhoA controls axon extension independent of specification in the developing brain. Current Biology. 29 (22), 3874-3886 (2019).
- Azzarelli, R., Oleari, R., Lettieri, A., Andre, V., Cariboni, A. In vitro, ex vivo and in vivo techniques to study neuronal migration in the developing cerebral cortex. Brain Sciences. 7 (5), (2017).
- Humpel, C. Organotypic brain slice cultures: A review. Neuroscience. 305, 86-98 (2015).
- Namba, T., et al. Pioneering axons regulate neuronal polarization in the developing cerebral cortex. Neuron. 81 (4), 814-829 (2014).
- Shah, B., et al. Rap1 GTPases are master regulators of neural cell polarity in the developing neocortex. Cerebral Cortex. 27 (2), 1253-1269 (2017).
- Wiegreffe, C., Feldmann, S., Gaessler, S., Britsch, S. Time-lapse confocal imaging of migrating neurons in organotypic slice culture of embryonic mouse brain using in utero electroporation. Journal of Visualized Experiments: JoVE. (125), (2017).
- de Anda, F. C., Meletis, K., Ge, X., Rei, D., Tsai, L. H. Centrosome motility is essential for initial axon formation in the neocortex. Journal of Neuroscience. 30 (31), 10391-10406 (2010).
- Sakakibara, A., et al. Dynamics of centrosome translocation and microtubule organization in neocortical neurons during distinct modes of polarization. Cerebral Cortex. 24 (5), 1301-1310 (2014).
- Schatzle, P., Kapitein, L. C., Hoogenraad, C. C. Live imaging of microtubule dynamics in organotypic hippocampal slice cultures. Methods in Cell Biology. 131, 107-126 (2016).
- Qu, X., Kumar, A., Bartolini, F. Live imaging of microtubule dynamics at excitatory presynaptic boutons in primary hippocampal neurons and acute hippocampal slices. STAR Protocols. 2 (1), 100342(2021).
- Tonnesen, J., Katona, G., Rozsa, B., Nagerl, U. V. Spine neck plasticity regulates compartmentalization of synapses. Nature Neuroscience. 17 (5), 678-685 (2014).
- Buchsbaum, I. Y., Cappello, S. Neuronal migration in the CNS during development and disease: insights from in vivo and in vitro models. Development. 146 (1), (2019).
- Rigby, M. J., Gomez, T. M., Puglielli, L. Glial cell-axonal growth cone interactions in neurodevelopment and regeneration. Frontiers in Neuroscience. 14, 203(2020).
- Barnes, A. P., Polleux, F. Establishment of axon-dendrite polarity in developing neurons. Annual Review of Neuroscience. 32, 347-381 (2009).
- Multiphoton Microscope Leica TCS SP8 MP. Microsystems. , Available from: http://www.leica-microsystems.com/products/confocal-microscopes/p/leica-tcs-sp8-sted-one/ (2021).
- ZEISS Lattice Lightsheet 7. Zeiss. , Available from: http://www.zeiss.com/microscopy/int/products/imaging-systems/lattice-lightsheet-7.html (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유