Method Article
הכנת צמחים חד-סומיטיים מעוברי דג הזברה
In This Article
Summary
אנו מציגים פרוטוקול לבידוד סומיטים בודדים מעוברי דג זברה, שניתן לעקוב אחר הדינמיקה שלו בתרבית במשך מספר שעות על ידי מיקרוסקופ זמן-lapse פלואורסצנטי, ובכך לספק מתודולוגיה לכימות שינויים בצורת קנה מידה של רקמה ברזולוציה של תא בודד.
Abstract
ציר הגוף של עוברי בעלי חוליות מחולק מעת לעת ליחידות רב-תאיות תלת-ממדיות הנקראות סומיטים. בעוד שתנודות גנטיות ודפוסים מולקולריים קובעים את סולם האורך הראשוני של הסומיטים, תהליכים מכניים היו מעורבים בקביעת גודלם וצורתם הסופיים. כדי להבין טוב יותר את תכונות החומר הפנימיות של סומיטים, פותחה שיטה לתרבית אקספלנט סומיט יחיד מעוברי דג זברה. סומיטים בודדים מבודדים על ידי הסרת עור העוברים, ולאחר מכן הסרת חלמון וכריתה רציפה של רקמות שכנות. באמצעות עוברים טרנסגניים ניתן לראות את התפלגות המבנים התת-תאיים השונים על ידי מיקרוסקופ זמן-lapse פלואורסצנטי. ניתן לעקוב אחר הדינמיקה של סומיטים שהושתלו במשך מספר שעות, ובכך לספק מסגרת ניסויית לחקר שינויי צורה בקנה מידה של רקמה ברזולוציה של תא בודד. גישה זו מאפשרת מניפולציה מכנית ישירה של סומיטים, ומאפשרת דיסקציה של תכונות החומר של הרקמה. לבסוף, ניתן להרחיב בקלות את הטכניקה המתוארת כאן לשתילת רקמות אחרות כגון הנוטוכורד, הצלחת העצבית ומזודרם הצלחת הרוחבית.
Introduction
חלק גדול ממערכת השרירים והשלד הבוגרים של בעלי חוליות יוצא מסומיטים עובריים, הנוצרים באופן מחזורי וקצבי לאורך ציר הגוף של העוברים 1,2. סומיטים הם יחידות רב-תאיות תלת מימדיות (תלת מימדיות) המורכבות בדרך כלל מליבה פנימית של תאים מזנכימליים ושכבת אפיתל היקפית המוקפת במטריצה חוץ-תאית עשירה בפיברונקטין3. המורפולוגיה של הסומיטים, כלומר גודלם וצורתם, נקבעת בחלקה על ידי שעון הפילוח ותבניות מולקולריות במורד הזרם. עם זאת, במהלך העשור האחרון, התברר כי רמזים וכוחות מכניים ממלאים תפקיד גם בוויסות שעון הסגמנטציה4, בנוסף להקלה על היווצרות סומיטים 5,6,7, והבטחת דיוק מוגבר של אורכי הסומיט לאחר היווצרות סומיט ראשונית8.
ניתן ללמוד מכניקת רקמות ישירות in vivo עם זמינות של כלים חדשים9, עם זאת, כדי לקבל תמונה מלאה העומדת בבסיס התהליכים הפיזיקליים, יש ללמוד בו זמנית את תכונות החומר הפנימיות של רקמות. הפרוטוקול המתואר כאן מספק גישה פשוטה להכנת סומיטים בודדים, שניתן לחקור את תכונותיהם הפיזיקליות מקשקשי התא לרקמה בבידוד מהעובר. בעוד שקיימים מספר פרוטוקולים להכנת אקספלנטים בשלבי התפתחות דומים 10,11,12,13,14, למיטב ידיעתנו, זהו הפרוטוקול הראשון המתאר בידוד של סומיטים בודדים. הפרוטוקול פשוט ליישום ודורש רק ציוד בסיסי הזמין ברוב מעבדות דג הזברה שעובדות עם עוברים.
כדי לסייע בהתגרות בתפקיד המכניקה בהיווצרות סומיטים מורפולוגית, פותחה שיטה לגידול אקספלנט סינגל-סומיט מעוברי דג זברה, שניתן להשתמש בו כדי לחקור את תכונות החומר הפנימיות של סומיטים.
Protocol
פרוטוקול זה כולל שימוש בעוברי בעלי חוליות חיים מתחת ליום אחד לאחר ההפריה. כל הניסויים בוצעו באמצעות עוברים שמקורם בבוגרים שהזדווגו באופן חופשי, ולכן הם מכוסים תחת רישיון הניסויים הכללי בבעלי חיים של EPFL שניתן על ידי השירות לקונסומציה ועניינים וטרינרים של קנטון וו - שוויץ (מספר הרשאה VD-H23).
1. לפני נתיחה
- השג עוברים מהכלאה של קווים טרנסגניים הטרוזיגוטיים של עניין. לשתילת שניים עד שלושה סומיטים, בדרך כלל יש צורך בכמה עוברים. בפרוטוקול זה, עובר אחד שימש לשתילת סומיט אחד.
- הכן מאגר E3 1x משני מלאי 50x: מלאי 1 מכיל 0.458 מ"מ Na2HPO4, 0.042 מ"מ KH2PO4, 4.084 מ"מ NaCl, 0.128 מ"מ KCl ומלאי 2 מכיל 0.33 מ"מ CaCl2, 0.33 מ"מ MgSO4. הכן 500 מ"ל של מאגר 1x E3 על ידי ערבוב של 480 מ"ל מים מזוקקים עם 10 מ"ל כל אחד משני מלאי ה-50x.
- אם מנתחים באותו יום, מגדלים עוברים ב-25 מ"ל של מדיום E3 בצלחת פטרי ב-33 מעלות צלזיוס עד לשלב שלושת-סומיט. אם מנתחים למחרת בבוקר, יש לגדל עוברים במדיום E3 בטמפרטורה של 28 מעלות צלזיוס עד לשלב המגן לפני ההעברה ל-19 מעלות צלזיוס לדגירת לילה.
- לזיהוי שלב המגן או שלבי הסומיט השונים, השתמש בסטריאומיקרוסקופ מעבדה סטנדרטי עם טווח הגדלה מתכוונן בין 0.67x ל-4.5x בקירוב.
- הרכיבו כלים וריאגנטים הדרושים לדיסקציה.
- מדיום L-15 של אליקוט לייבוביץ בשפופרות של 50 מ"ל ומאחסנים במקרר. אנו ממליצים להשתמש באותו אליקוט מהמקרר למשך שני סיבובים לכל היותר.
- הכן 50 מ"ל של 2% אגרוז במדיום L-15 באמצעות מערבל מגנטי ושמירה על הטמפרטורה על 85 מעלות צלזיוס. לאחר המסה, יש לאחסן את התמיסה בטמפרטורת החדר.
- הכן 25 מ"ל של אגרוז נמס נמוך של 2% במדיום L-15 על ידי שימוש במערבל מגנטי ושמירה על הטמפרטורה על 85 מעלות צלזיוס. לאחר המסה, יש לשים את התמיסה בצינורות של 1.5 מ"ל ולאחסן בטמפרטורה של 4 מעלות צלזיוס. זה ישמש להכנת תא ההדמיה.
- יוצקים 2% אגרוז מותך לצלחת פטרי 20 מ"מ עד למילוי שליש מעומק המנה ומניחים לתמיסת האגרוז להתמצק. נתיחות יבוצעו בצלחות פטרי אלה. מכינים מראש את מנות הפטרי בציפוי אגרוז ומאחסנים בחום של 4 מעלות צלזיוס.
- הרכיבו את הכלים הבאים: פיפטת פסטר להעברת עוברים, זוג מלקחיים להסרת עוברים, זוג מלקחיים עדינים להסרת עור עוברים, סכין מיקרו לביצוע חתכים בעוברים, פיפטת זכוכית מלוטשת באש להעברת צמחים לתא הדמיה.
- עקרו את פיפטת הזכוכית ב-100% אתנול למשך 15 דקות ושטפו פעמיים על ידי פיפטינג של 5 מ"ל של L-15 בינוני למעלה ולמטה.
- הכן כלי ריסים על ידי הדבקת ריס או שיער מהגבה לנימים מזכוכית.
- השתמש בסטריאוסקופ פלואורסצנטי עם טווח הגדלה מתכוונן בין 0.63x ל-6.3x בערך ומסנני GFP ו-RFP סטנדרטיים כדי למיין עוברים טרנסגניים חיוביים ולהעביר לצלחת פטרי נפרדת עם מדיום E3.
2. הכנת אקספלנט סומיט יחיד
- העבירו 2 או 3 עוברים לכלי מצופה אגרוז (עשוי בשלב 1.5.4) מלא ב-10 מ"ל של מדיום L-15. ודא שהמנה יחד עם מדיום L-15 מחוממת מראש ב-28 מעלות צלזיוס באינקובטור למשך 30 דקות לפני העברת העוברים.
- לפרק בזהירות (איור 1 A,B) עובר עם זוג מלקחיים. החזק את הכוריון עם אחד המלקחיים והשתמש במלקחיים השני כדי לצבוט ולמשוך את הכוריון קרוב למקום שבו ממוקם המלקחיים הראשונים.
- חזור על שלב זה פעם נוספת כדי לפתוח את הכוריון לרווחה ולאחר מכן ניתן לדחוף את העובר בעדינות החוצה. ודא שהעובר אינו ניזוק או נלחץ במהלך הדכוריון.
- כוונו את העובר על צדו הצדדי והחזיקו בעור בין הראש לזנב של העובר בעזרת אחד המלקחיים העדינים. השתמש במלקחיים העדינים השני כדי לצבוט את העור קרוב למקום שבו המלקחיים הראשונים עדיין ממוקמים.
- הרחיקו את שני המלקחיים זה מזה, תוך כדי אחיזה בעור, וכך נוצר פתח גדול. שחררו את אחד המלקחיים מהעור והזיזו אותו קרוב למקום שבו מוחזק המלקחיים השני וחזרו על תהליך הסרת העור עד להסרת העור באזורים היוצרים סומיטים.
הערה: זה קריטי להסיר לחלוטין את העור המקיף את הסומיטים שישתלו, אחרת יהיה קשה לבצע דיסקציות עדינות יותר בשלבים המאוחרים יותר של הפרוטוקול. - השתמשו בסכין מיקרו כדי לגרד את החלמון (איור 1C - השתלו עם הסרת העור וגירוד החלמון) ובצעו סדרה של חתכים באופן הבא:
- חתכו את העובר כשהחתך הראשון קדמי לסומיט המורפולוגי הראשון בעובר והשני נחתך אחורי לסומיט שנוצר לאחרונה (איור 1D). חתכו פעם נוספת את החלק האחורי והקדמי של הסומיטים המעניינים (איור 1E).
- השתמש בסכין המיקרו כדי לגרד את כל החלמון שנותר מהאזורים המושתלים של העובר. נסה להסיר כמה שיותר מהחלמון כדי להפחית את האפשרות של צמחים להידבק לסכין המיקרו. אם זה קורה, השתמש בכלי ריסים כדי להזיז את האקספלנט בחזרה לתמיסה תוך שמירה על סכין המיקרו שקועה במדיום.
- מקמו את האקספלנט בגב וצרו פרוסה לאורך הציר האנטרופוסטריורי דרך הנוטוכורד, קרוב לסומיטים בצד אחד (איור 1F,G).
- קח את האקספלנט ללא הנוטוכורד וחתוך דרך המזודרם של הצלחת הצדדית (LPM) קרוב לסומיטים.
הערה: ניתן להחליף שלב זה עם השלב הקודם, כלומר, הוא עובד באותה מידה כדי לחתוך תחילה את ה-LPM ואחריו לחתוך דרך הנוטוכורד.
- בחרו את הסומיט לשתילה וצרו שתי פרוסות אחוריות וקדמיות לסומיט בהתאמה (איור 1H).
- לבסוף, סובבו את הסומיט ב-90 מעלות באמצעות כלי הריסים כדי לדמיין את הצלחת העצבית שעדיין מחוברת לסומיט. צרו פרוסה בין הסומיט לצלחת העצבית, וכך שחררו סומיט בודד (איור 1I).
הערה: ניתן להסיר את הצלחת העצבית גם מיד לאחר שלב 2.6.4, כלומר לאחר הסרת הנוטוכורד וה-LPM ולפני ניתוח סומיט מסומיטים שכנים.
3. הדמיית אקספלנטים סינגל-סומיטים
הערה: כאן, מתואר ההליך להדמיית צמחי סומיט בודדים באמצעות מיקרוסקופ גיליון אור חד-תצוגתי. כחלופה, ניתן לצלם את הסומיטים הבודדים שהושתלו גם במיקרוסקופ קונפוקלי, הזמין יותר או אפילו במיקרוסקופ רחב שדה אם מעוניינים אך ורק לעקוב אחר המורפולוגיה הכוללת של אקספלנטים.
- הכן תא הדמיה באופן הבא:
- מלאו מזרק של 1 מ"ל בתכשיר גומי סיליקון. חותכים קצה פיפטה של 200 מיקרוליטר במרחק של כ-1 ס"מ מהפה ומכניסים את המזרק לקצה הפיפטה.
- עטפו ידנית את מחזיק הממברנה ברצועת ממברנה אתילן פרופילן פלואור (FEP) חתוכה מראש (איור 2A-C) וקבעו את תא ההדמיה על מחזיק הממברנה, המתאימים היטב זה לזה (איור 2D).
- הוסף תכשיר גומי סיליקון לאורך הצומת של החדר והקרום וייבש אותו למשך הלילה, מה שמאפשר לקרום להיצמד לתא. הסר את מחזיק הממברנה שעה אחת לפני ניסוי האקספלנט.
- מחממים אליקוט המכיל 0.5 מ"ל של 2% אגרוז נמס נמוך העשוי ממדיום L-15 בטמפרטורה של 75 מעלות צלזיוס למשך 10 דקות. הוסף 160 מיקרוליטר מהאגרוז המחומם בעל ההיתוך הנמוך למרכז החדר והניח תבנית הדמיה באגרוז (איור 2E,F) והחזק אותו זקוף עד שהאגרוז מתמצק.
- מוסיפים עוד 160 מיקרוליטר של אגרוז מחומם נמס נמוך לשני קצוות התבנית ומעבירים את כל היחידה ל-4 מעלות צלזיוס למשך 30 דקות.
- הוסף לתא 600 מיקרוליטר של מדיום L-15 והסר את התבנית מהתא בעזרת מלקחיים. המתן עד שהתא עם מדיום L-15 יחזור לטמפרטורת החדר.
- העבירו את הסומיט המושתל עם פיפטה מזכוכית מלוטשת על ידי פיפטינג לתא ההדמיה והשתמשו בכלי ריסים כדי למקם את האקספלנט במרכז החדר.
- יישר את לייזרי ההדמיה לפי הוראות היצרן והעביר בזהירות את תא ההדמיה למיקרוסקופ המצויד בתא דגירה כדי לשמור על האקספלנטים ב-28 מעלות צלזיוס.
- בצע סיבוב שני של יישור לייזר עם אזורי עניין מהקו הטרנסגני, ואחריו הגדרת מחסנית ה-z הרצויה, מרווח הזמן ומשך הזמן להדמיית זמן-lapse. לניסוי זה, רכשו 70 פרוסות z עם מרווח של 2 מיקרומטר ומרווח מסגרת של 2 דקות.
- בצע הדמיית גיליון אור דו-צבעוני (איור 1J) של האקספלנטים עם לייזרים של 561 ננומטר (10% עוצמת לייזר, חשיפה של 100 אלפיות השנייה) ו-488 ננומטר (10% עוצמת לייזר, חשיפה של 100 אלפיות השנייה). בפרוטוקול זה, האות נאסף עם יעד NA של 25x/1.1 ודרך מסנני פס של 561/25 ננומטר ו-525/50-25 בהתאמה על מצלמת sCMOS.
תוצאות
אקספלנטים מאפשרים לכמת שינויי צורה בקנה מידה גדול בתלת מימד. כדי להמחיש זאת, שתלנו סומיט ארבעה (N = 3) מעוברי דג זברה מוקדמים שהתקבלו מהכלאה בין Utr::mCherry (Tg(actb2:mCherry-Hsa.UTRN); e119Tg) ו-H2B::GFP (Tg(h2az2a:h2az2a-GFP); kca6Tg) קווים הטרוזיגוטיים. אוטרופין הוא חלבון קושר אקטין, וקו Utr::mCherry מראה את התפלגות מבני האקטין החוטים. טרנסגן זה שימש כאן כסמן לקווי מתאר של תאים. H2B::GFP הוא היסטון מתויג פלואורסצנטי וכתוצאה מכך מסמן את התפלגות הכרומטין, ומספק תיאור יעיל של מיקום וצורת הגרעין, כמו גם דמויות מיטוטיות המדגישות את חלוקת התא.
הערכנו את הצלחת פרוטוקול האקספלנט במהלך ההדמיה. ראינו כי בסומיט שניזוק במהלך דיסקציה שלמות רקמת הסומיט נפגעת, כאשר תאים רבים מתנתקים ויוצאים מהסומיט המושתל ו/או תאים רבים מתים, מה שניתן להבחין בנוכחות גרעינים מקוטעים בתעלה הגרעינית. אקספלנטים מוצלחים נשארו בריאים במשך 4-6 שעות, ולאחר מכן נצפו שינויים בשלמות הסומיט עם תאים שהתנתקו מהאקספלנט ומתים.
בתעלת האוטרופין, ביצענו סגמנטציה ידנית של אקספלנטים ב-MATLAB (R2018b) על פרוסות z במרווחים כל 10 מיקרומטר. פיתחנו ב-MATLAB אלגוריתם מותאם אישית לסגמנטציה, הזמין להורדה בחינם (https://github.com/sundar07/SomSeg). באלגוריתם, ניתן להגדיר את הקובץ, המסגרת ופרוסת ה-z שיש לפלח, ואחריהם הנחיית משתמש, המאפשרת ציור ידני של מתאר סביב אזור העניין. זה חזר על עצמו עבור פרוסות z מרובות ושורטט, שהראו עיגול כלפי מעלה של צמחים לאורך זמן בתלת-ממד (איור 3A). בנוסף, התקבל גם מידע משלים על צורת הרקמה באמצעות התעלה הגרעינית. לשם כך, השתמשנו ב-Mastodon (גרסה 1.0.0-beta-19, https://github.com/mastodon-sc/mastodon), תוסף FIJI15 , כדי להשיג מיקומי מרכז גרעינים באמצעות זיהוי נקודתי. תחילה המרנו את קבצי ה-tif מהמיקרוסקופ לפורמט xml/hdf5 בפיג'י, ולאחר מכן נפתח פרויקט חדש באמצעות התוסף Mastodon. בתוסף בחרנו באפשרות זיהוי נקודתי, שם הגדרנו אזור עניין שכיסה את האקספלנט והשתמשנו בהבדל של גלאי גאוס בקוטר של 5 מיקרומטר ומקדם איכות של 25 לזיהוי כתמים. לאחר מכן העברנו את מיקומי מרכז הגרעינים ל-MATLAB והשתמשנו בפונקציה מובנית (convhull) כדי להשיג גוף קמור (איור 3B), שאפיין את הגיאומטריה של האקספלנט. זה הראה באופן דומה עיגול של צמחים לאורך זמן (איור 3B). נתוני הגרעינים מאפשרים בנוסף לכמת את תנועות התאים על ידי מעקב בתלת מימד ושינוי במספר התאים לאורך זמן. מצד שני, תעלת האוטרופין מאפשרת כימות של שינויים בצורות התאים ככל שהצמחים הופכים עגולים יותר. יחד, פרמטרים אלה הם בעלי ערך לאפיון תכונות החומר הפנימיות של סומיטים, מה שמסייע בפיתוח תיאורים פיזיים יעילים של שינויי צורה בקנה מידה של רקמות.
אקספלנטים מאפשרים גם לאפיין מתחי מגע עם רקמות שכנות בצורה כמותית. כדי להמחיש זאת, בודדנו ידנית שני סומיטים ומיקמנו אותם בסמיכות וצפינו בדינמיקה שלהם (N = 2). בניסוי זה, לא היה מעקב אחר כיוון הסומיטים ביחס לצירי הגוף in vivo . מעניין שעם הזמן, הסומיטים המושתלים נדבקו זה לזה לאורך משטח אחד, בעוד שהמשטחים החופשיים, כלומר אזורים הרחק מאתר המגע, התעגלו כלפי מעלה (איור 4). זה מצביע על כך שכוחות הדבקה מתגברים על מתחים הנוצרים על ידי מתח פנים באתרי מגע באקספלנטים. ניתן לאפיין זאת עוד יותר על ידי מעקב אחר שינויי צורה כמתואר לעיל ועל ידי כימות זוויות המגע בין שתי הרקמות לאורך זמן בתלת מימד. לפיכך, האקספלנטים מספקים מערכת אטרקטיבית לכימות כוחות מתחרים בפעולה המובילים לצורות רקמה ספציפיות, שאת השלכותיה ניתן לחקור לאחר מכן in vivo.
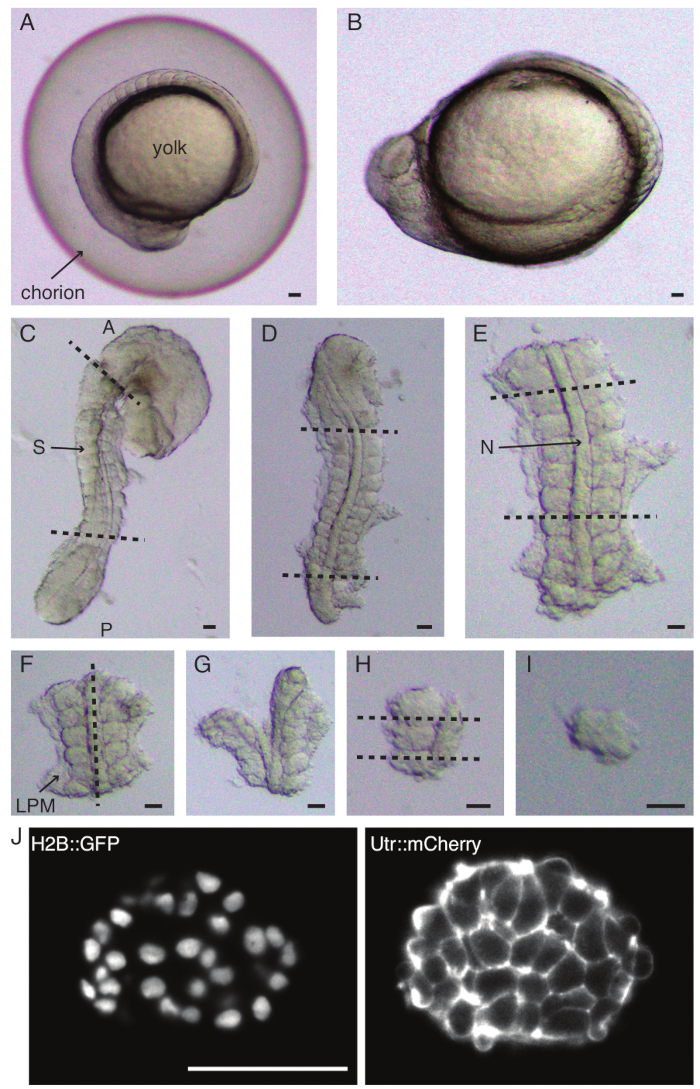
איור 1: הכנת אקספלנטים חד-סומיטיים. עובר דג הזברה (A) עובר תחילה דה-כוריון (B), ולאחר מכן הסרת העור והחלמון (C). לאחר מכן נבחר אזור המכיל סומיט בעובר על ידי הסרת שאר הרקמות (D, E). אזורים סביב הסומיט המעניין מוסרים לאחר מכן באופן סדרתי (F-H) כדי לבודד בסופו של דבר סומיט בודד (I), ולאחר מכן הדמיית זמן-lapse באמצעות מיקרוסקופ גיליון אור (חתך z אמצעי של סומיט מוצג כאן) (J). קיצורים: S = סומיט; N = notochord; LPM = מזודרם צלחת לרוחב; A = קדמי; P = אחורי. קווים מקווקווים מציינים עמדות חיתוך. סרגל קנה מידה = 50 מיקרומטר בכל הפאנלים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
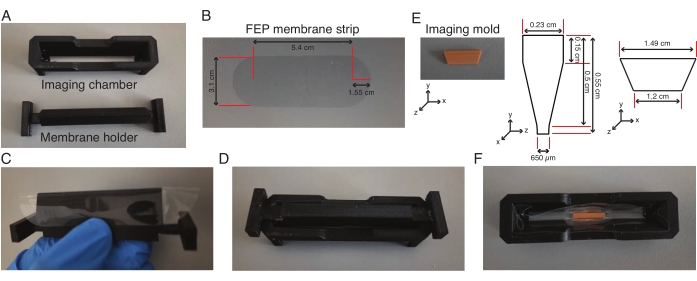
איור 2: הרכבה של תא הדמיה של גיליון אור. (A-D) פס ממברנה FEP (מידות ב-(B)) נכרך סביב מחזיק הממברנה, מותקן על תא ההדמיה והממברנה מודבקת לתא ההדמיה. (ה-ו) למחרת, מחזיק הממברנה מוסר ותבנית הדמיה (מידות ב-(E)) מונחת במרכז תא ההדמיה באגרוז נמס נמוך. היחידה כולה נשמרת בטמפרטורה של 4 מעלות צלזיוס למשך 30 דקות, ולאחר מכן מסירים את התבנית ומשתמשים בתא עם השוקת להדמיית צמחים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
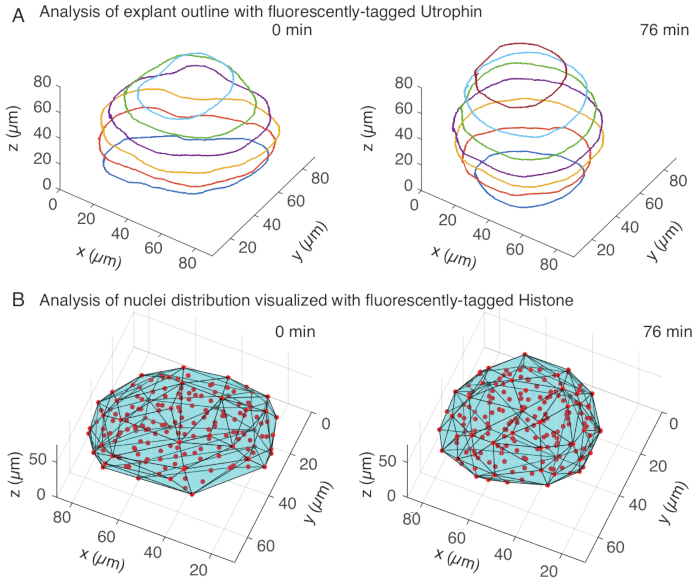
איור 3: ניתוח תלת-ממדי של צורות רקמות. (A) קווי המתאר של התאים הודגמו עם אוטרופין מתויג פלואורסצנטי (Utr::mCherry) וגרעינים הודגמו עם היסטון מתויג פלואורסצנטי (H2B::GFP). קווי המתאר של האקספלנט חולקו ידנית בעומקים מרובים באמצעות MATLAB ומוצגים כאן. (B) גרעינים (אדומים) זוהו באותו צמח באמצעות Mastodon, תוסף FIJI, ונחשפו לגוף קמור (ציאן), שמודיע על הגיאומטריה של האקספלנט. הערות עיגול של אקספלנטים ניכר בשני הניתוחים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
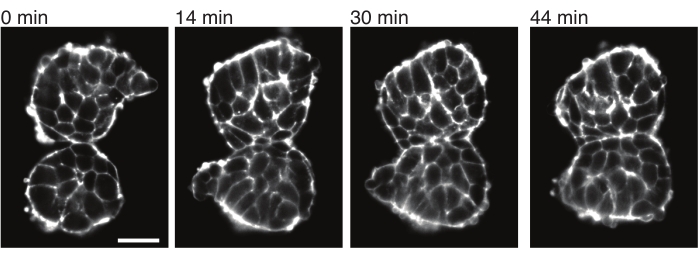
איור 4: סומיטים שהושתלו נצמדים זה לזה. שני סומיטים שבודדו מעוברים והוצבו ידנית בסמיכות נוטים להיצמד לאורך זמן (N = 2). פרוסות z מרובות עם מרווח מסגרת של 2 דקות נרכשו באמצעות מיקרוסקופ גיליון אור וחלקים אמצעיים של סומיטים מנקודות זמן נבחרות מוצגים כאן. קווי המתאר של התאים הודגמו עם אוטרופין מתויג פלואורסצנטי (Utr::mCherry). סרגל קנה מידה = 25 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
תחום הסומיטוגנזיס נשלט על ידי מחקרים על תפקידו של שעון הסגמנטציה בקביעת אורכי המקטעים במהלך התפתחות העובר. עם זאת, חשוב לא פחות לקחת בחשבון את תפקידה של מכניקת הרקמות בקביעת מורפולוגיות סומיט סופיות. הפרוטוקול המתואר כאן מאפשר השתלה של סומיטים בודדים, שניתן לחקור את תכונותיהם הפיזיקליות המהותיות בבידוד מהעובר. עם זאת, ההכנה הידנית מגבילה את מספר הסומיטים המוכנים בדרך כלל לארבעה עד שישה בכל סשן הדמיה. מכיוון שהפרוטוקול כולל חיתוכים עדינים זהירים של מספר רקמות בעוברים ללא שימוש באנזימים כלשהם כדי להקל על הסרת הרקמות, ייתכן שיידרשו מספר שבועות של תרגול כדי לשלוט בתהליך הדיסקציה. בידינו השלבים הקריטיים בפרוטוקול כוללים הסרה זהירה של עור וחלמון מהצמחים, מה שמונע מהאקספלנטים בשלבים שונים של הפרוטוקול להיצמד לכלים בהם נעשה שימוש, מה שבתורו מאפשר דיסקציה קלה יותר להסיר באופן סדרתי רקמות סביב סומיט.
ניתן לעצור את פרוטוקול הדיסקציה בשלבי ביניים כדי להשיג סומיטים המחוברים רק לאחת מהרקמות הסובבות או כדי להשיג אקספלנטים של קבוצות סומיטים. זה מספק שיטה רבת עוצמה להפשיט רקמות באופן סדרתי ולחקור את ההשפעה של רקמות שכנות בהקלת שינויי צורה בסומיטים, או ברקמות השכנות. מצד שני, באמצעות פרוטוקול זה, ניתן לאפשר לרקמות בודדות שהושתלו להיצמד ולהתארגן באופן מכני, כפי שמודגם על ידי הצבת שני סומיטים שהושתלו בסמיכות.
צמחים שהוכנו בשיטה זו אינם דורשים מרכיבים נוספים במאגר או אילוצים כדי להבטיח הישרדות לפרקי זמן של עד מספר שעות. עם זאת, ניתן לדמיין גידול שלהם בהידרוג'לים ומעקב אחר הדינמיקה שלהם בנוכחות אילוצים חיצוניים, שיכולים לשמש מודל למתחי המגע שסומיטים נתקלים בהם in vivo. יתר על כן, אקספלנטים מאפשרים לחקור ישירות את תכונות החומר שלהם באמצעות מיקרוסקופ כוח אטומי, שאיבת פיפטה, או על ידי שימוש בכלים מיקרו-רובוטיים16. לבסוף, אנו מצפים שניתן יהיה להתאים שיטה זו בקלות לתרבית ולחקר רקמות התפתחותיות אחרות בשלבים דומים כגון הנוטוכורד, הצלחת העצבית והמזודרם של הצלחת הרוחבית.
Disclosures
המחברים מצהירים שאין ניגודי אינטרסים.
Acknowledgements
אנו מודים לחברי מעבדת אוטס על ההערות על הפרוטוקול ועל מתקן הדגים של בית הספר הפוליטכני הפדרלי של לוזאן (EPFL). בפרט, אנו מודים ללורל אן רודה על עצות חשובות להסרת עור וחלמון בפרוטוקול הדיסקציה; אריאן ברקובסקי ראמה על בניית צינור יעיל לעיבוד מערכי נתונים של גיליונות קלים באמצעות מסטודון; ז'אן-איב טינבז על בניית תוכנת הקוד הפתוח Mastodon; מרקו פופוביץ' על טיפים לניתוח נתונים; קלואי ג'וליווט, גיום ולנטין ופלוריאן לאנג על התמיכה הנרחבת במתקן הדגים; פטר סטרנד ואנדריאה בוני על בניית מיקרוסקופ יריעות אור ועל טיפים להדמיית יריעות אור. עבודה זו נתמכה על ידי EPFL ו-S.R.N. נתמכה על ידי מלגת פוסט-דוקטורט של תוכנית מדעי הגבול האנושי לטווח ארוך (LT000078/2016).
Materials
| Name | Company | Catalog Number | Comments |
| Agarose | Sigma | 9012-36-6 | For coating bottom of petri dishes |
| Agarose, low gelling temperature | Sigma | 39346-81-1 | For preparing Viventis imaging chamber |
| Camera | Andor | Andor Zyla 4.2 Plus | For image acquisition in the light-sheet microscope |
| Detection objective | Nikon | Nikon CFI75 Apo LWD 25x/1.1 NA | For imaging explants |
| FEP membrane strip | Lohmann Technologies UK Ltd | Dupont FEP Fluorocarbon film, 200A | For preparing Viventis imaging chamber |
| Fine forceps | Dumont | Dumont 5SF 11252-00 | For removal of skin of embryos |
| Forceps | Dumont | Dumont 55 | For dechorionating embryos |
| Leibovitz's L-15 medium | Gibco | 21083-027 | Explant culture medium |
| Light-sheet microscope | Viventis | LS1 live | For imaging explants |
| Micro knife | Fine Science Tools | 10318-14 | For making incisions in embryos |
| Silicone rubber formulation | Wacker Chemie AG | Silpuran 4200 | For preparing Viventis imaging chamber |
References
- Oates, A. C., Morelli, L. G., Ares, S. Patterning embryos with oscillations: structure, function and dynamics of the vertebrate segmentation clock. Development. 139 (4), Cambridge, England. 625-639 (2012).
- Pourquié, O. Segmentation of the vertebrate spine: From clock to scoliosis. Cell. 145 (5), 650-663 (2011).
- Naganathan, S. R., Oates, A. C. Patterning and mechanics of somite boundaries in zebrafish embryos. Seminars in Cell & Developmental Biology. 107, 170-178 (2020).
- Hubaud, A., Regev, I., Mahadevan, L., Pourquié, O. Excitable Dynamics and Yap-Dependent Mechanical Cues Drive the Segmentation Clock. Cell. 171 (3), 668-682 (2017).
- Dias, A. S., de Almeida, I., Belmonte, J. M., Glazier, J. A., Stern, C. D. Somites without a clock. Science. 343 (6172), New York, N.Y. 791-795 (2014).
- Nelemans, B. K. A., Schmitz, M., Tahir, H., Merks, R. M., Smit, T. H. Somite Division and New Boundary Formation by Mechanical Strain. iScience. 23 (4), 100976(2020).
- Grima, R., Schnell, S. Can tissue surface tension drive somite formation. Developmental Biology. 307 (2), 248-257 (2007).
- Naganathan, S. R., Popovic, M., Oates, A. C. Left–right symmetry of zebrafish embryos requires somite surface tension. Nature. 605, 516-521 (2022).
- Campàs, O. A toolbox to explore the mechanics of living embryonic tissues. Seminars in Cell & Developmental Biology. 55, 119-130 (2016).
- Langenberg, T., Brand, M., Cooper, M. S. Imaging brain development and organogenesis in zebrafish using immobilized embryonic explants. Developmental Dynamics: An Official Publication of The American Association of Anatomists. 228 (3), 464-474 (2003).
- Henry, C. A., Poage, C. T., McCarthy, M. B., Campos-Ortega, J., Cooper, M. S. Regionally autonomous segmentation within zebrafish presomitic mesoderm. Zebrafish. 2 (1), 7-18 (2005).
- Picker, A., Roellig, D., Pourquié, O., Oates, A. C., Brand, M. Tissue micromanipulation in zebrafish embryos. Methods in Molecular Biology. 546, Clifton, N.J. 153-172 (2009).
- Manning, A. J., Kimelman, D. Tbx16 and Msgn1 are required to establish directional cell migration of zebrafish mesodermal progenitors. Developmental Biology. 406 (2), 172-185 (2015).
- Simsek, M. F., Özbudak, E. M. A 3-D Tail Explant Culture to Study Vertebrate Segmentation in Zebrafish. Journal of Visualized Experiments:JoVE. (172), e61981(2021).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Özkale, B., et al. Modular soft robotic microdevices for dexterous biomanipulation. Lab on a Chip. 19 (5), 778-788 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved