Method Article
Приготовление односомитных эксплантов из эмбрионов данио-рерио
В этой статье
Резюме
Мы представляем протокол выделения одиночных сомитов из эмбрионов рыбок данио, динамику которого можно отслеживать в культуре в течение нескольких часов с помощью флуоресцентной покадровой микроскопии, что обеспечивает методологию количественной оценки изменений формы в масштабе ткани с разрешением одной клетки.
Аннотация
Ось тела эмбрионов позвоночных периодически подразделяется на трехмерные многоклеточные единицы, называемые сомитами. В то время как генетические колебания и молекулярные предпосылки определяют начальную длину сомитов, механические процессы участвуют в определении их окончательного размера и формы. Чтобы лучше понять внутренние свойства сомитов, был разработан метод культивирования одного сомитового экспланта из эмбрионов рыбок данио. Одиночные сомиты выделяют путем предварительного удаления кожи эмбрионов с последующим удалением желтка и последовательным иссечением соседних тканей. Используя трансгенные эмбрионы, распределение различных субклеточных структур можно наблюдать с помощью флуоресцентной покадровой микроскопии. Динамику эксплантированных сомитов можно отслеживать в течение нескольких часов, что обеспечивает экспериментальную основу для изучения изменений формы в масштабе ткани с разрешением для одной клетки. Этот подход позволяет проводить прямые механические манипуляции с сомитами, что позволяет препарировать свойства материала ткани. Наконец, описанный здесь метод может быть легко расширен для эксплантации других тканей, таких как хорда, нервная пластинка и мезодерма латеральной пластины.
Введение
Большая часть опорно-двигательного аппарата взрослого человека позвоночных происходит из эмбриональных сомитов, которые формируются периодическим и ритмичным образом вдоль оси тела эмбрионов 1,2. Сомиты представляют собой трехмерные (3D) многоклеточные единицы, обычно состоящие из внутреннего ядра мезенхимальных клеток и периферического эпителиального слоя, окруженного богатым фибронектином внеклеточным матриксом3. Морфология сомитов, т.е. их размер и форма, частично определяется часами сегментации и нисходящими молекулярными предварительными паттернами. Тем не менее, в течение последнего десятилетия выяснилось, что механические сигналы и силы также играют роль в регулировании часов сегментации4, в дополнение к облегчению образования сомитов 5,6,7 и обеспечению повышенной точности длины сомитов после первоначального образованиясомитов 8.
Механика тканей может быть изучена непосредственно in vivo с появлениемновых инструментов9, однако для получения полной картины, лежащей в основе физических процессов, необходимо одновременно изучать внутренние материальные свойства тканей. Описанный здесь протокол обеспечивает простой подход к получению одиночных сомитов, физические свойства которых от клеточного до тканевого масштаба могут быть изучены изолированно от эмбриона. Несмотря на то, что существует несколько протоколов для получения эксплантов на сходных стадиях развития 10,11,12,13,14, насколько нам известно, это первый протокол, описывающий выделение одиночных сомитов. Протокол прост в реализации и требует только базового оборудования, доступного в большинстве лабораторий рыбок данио, работающих с эмбрионами.
Чтобы помочь в выяснении роли механики в морфологическом образовании сомитов, был разработан метод культивирования одного сомитового экспланта из эмбрионов рыбок данио-рерио, который может быть использован для исследования внутренних материальных свойств сомитов.
протокол
Этот протокол предполагает использование живых эмбрионов позвоночных в возрасте до 1 дня после оплодотворения. Все эксперименты проводились с использованием эмбрионов, полученных от свободно спаривающихся взрослых особей, и, таким образом, подпадают под действие общей лицензии на эксперименты на животных EPFL, выданной Службой по вопросам консультирования и ветеринарных дел кантона Во - Швейцария (номер разрешения VD-H23).
1. Перед вскрытием
- Получение эмбрионов от скрещивания гетерозиготных трансгенных линий, представляющих интерес. Для эксплантации двух-трех сомитов обычно требуется всего несколько эмбрионов. В этом протоколе для эксплантации одного сомита использовался один эмбрион.
- Приготовьте 1x E3 буфер из двух 50x запасов: запас 1 содержит 0,458 мМ Na2HPO4, 0,042 мМ KH2PO4, 4,084 мМ NaCl, 0,128 мМ KCl и запас 2 содержит 0,33 мМ CaCl2, 0,33 мМ MgSO4. Приготовьте 500 мл 1x E3 буфера, смешав 480 мл дистиллированной воды с 10 мл каждого из двух 50x запасов.
- При вскрытии в тот же день эмбрионы должны быть выращены в 25 мл среды Е3 в чашке Петри при температуре 33 °C до стадии трех сомитов. При вскрытии на следующее утро выращивайте эмбрионы в среде E3 при температуре 28 °C до стадии защитного слоя, а затем переведите их на 19 °C для ночной инкубации.
- Для идентификации защитного предметного столика или различных сомитных стадий используйте стандартный лабораторный стереомикроскоп с регулируемым диапазоном увеличения от примерно 0,67x до 4,5x.
- Соберите инструменты и реагенты, необходимые для вскрытия.
- Аликвот Лейбовиц Л-15 средний в тюбиках по 50 мл и хранить в холодильнике. Мы рекомендуем использовать одну и ту же аликвоту из холодильника максимум для двух раундов.
- Приготовьте 50 мл 2% агарозы в среде L-15 с помощью магнитной мешалки и поддерживая температуру на уровне 85 °C. После растворения храните раствор при комнатной температуре.
- Приготовьте 25 мл 2% легкоплавкой агарозы в среде L-15 с помощью магнитной мешалки и поддерживая температуру на уровне 85 °C. После растворения растворите раствор в пробирках объемом 1,5 мл и храните при температуре 4 °C. Это будет использовано для подготовки камеры визуализации.
- Налейте расплавленный 2% агарозы в чашку Петри диаметром 20 мм до заполнения одной трети глубины чашки и дайте раствору агарозы застыть. В этих чашках Петри будут проводиться вскрытия. Заранее приготовьте чашки Петри с агарозным покрытием и храните при температуре 4 °C.
- Соберите следующие инструменты: пастеровскую пипетку для переноса эмбрионов, пару щипцов для дехорионизации эмбрионов, пару тонких щипцов для удаления кожи эмбрионов, микронож для выполнения разрезов у эмбрионов, стеклянную пипетку с огненной полировкой для переноса эксплантов в камеру визуализации.
- Простерилизуйте стеклянную пипетку в 100% этаноле в течение 15 минут и дважды промойте пипетированием 5 мл среды L-15 вверх и вниз.
- Приготовьте инструмент для ресниц, приклеив ресницу или волосок от брови к стеклянному капилляру.
- Используйте флуоресцентный стереоскоп с регулируемым диапазоном увеличения примерно от 0,63x до 6,3x и стандартные фильтры GFP и RFP для сортировки положительных трансгенных эмбрионов и переноса в отдельную чашку Петри со средой E3.
2. Препарат из одного сомитного экспланта
- Перенесите 2 или 3 эмбриона в чашку, покрытую агарозой (изготовленную на шаге 1.5.4), наполненную 10 мл среды L-15. Перед переносом эмбрионов блюдо вместе со средой L-15 предварительно подогреть до 28 °C в инкубаторе в течение 30 минут.
- Осторожно дехорионатизируйте (рисунок 1 А,В) эмбрион с помощью пары щипцов. Удерживайте хорион одним из щипцов и с помощью вторых щипцов зажмите и потяните хорион рядом с тем местом, где расположен первый щипец.
- Повторите этот шаг еще раз, чтобы широко открыть хорион, после чего эмбрион можно аккуратно вытолкнуть. Следите за тем, чтобы эмбрион не был поврежден или сдавлен во время дехорионации.
- Расположите эмбрион на боковой стороне и прижмитесь к коже между головой и хвостом эмбриона с помощью одного из тонких щипцов. Используйте вторые тонкие щипцы, чтобы ущипнуть кожу рядом с тем местом, где все еще расположены первые щипцы.
- Отодвиньте два щипца друг от друга, при этом держась за кожу, создав таким образом большое отверстие. Освободите один из щипцов от кожи и переместите его ближе к месту, где удерживаются вторые щипцы, и повторяйте процесс удаления кожи до тех пор, пока кожа не будет удалена в сомитообразующих областях.
ПРИМЕЧАНИЕ: Очень важно полностью удалить кожу вокруг сомитов, которые будут эксплантированы, в противном случае становится трудно проводить более тонкие вскрытия на более поздних этапах протокола. - С помощью микроножа соскребите желток (Рисунок 1C - эксплантация со снятой кожицей и соскобленным желтком) и сделайте ряд надрезов следующим образом:
- Разрежьте зародыш так, чтобы первый разрез находился перед первым морфологическим сомитом в зародыше, а второй разрез — позади самого последнего сформированного сомита (рис. 1D). Разрежьте еще раз сзади и спереди от сомитов, представляющих интерес (рис. 1E).
- С помощью микроножа соскребите оставшийся желток с эксплантированных участков эмбриона. Постарайтесь удалить как можно больше желтка, чтобы уменьшить вероятность прилипания эксплантов к микроножу. Если это произойдет, используйте инструмент для ресниц, чтобы переместить эксплант обратно в раствор, сохраняя при этом микронож погруженным в среду.
- Расположите эксплант дорсально и сделайте срез вдоль переднезадней оси через хорду, рядом с сомитами с одной стороны (рис. 1F, G).
- Возьмите эксплант без хорды и разрежьте латеральную пластину мезодермы (ЛПМ) близко к сомитам.
ПРИМЕЧАНИЕ: Этот шаг можно поменять местами с предыдущим, т.е. он одинаково хорошо работает, если сначала разрезать LPM, а затем разрезать хорду.
- Выберите сомит, который нужно выделить, и сделайте два среза сзади и спереди от сомита соответственно (Рисунок 1H).
- Наконец, поверните сомит на 90° с помощью инструмента «Ресницы», чтобы визуализировать нейронную пластину, все еще прикрепленную к сомиту. Сделайте разрез между сомитом и нервной пластинкой, тем самым высвобождая один сомит (Рисунок 1I).
ПРИМЕЧАНИЕ: Нервная пластинка также может быть удалена сразу после шага 2.6.4, т.е. после удаления хорды и LPM и перед отделением сомита от соседних сомитов.
3. Визуализация односомитных эксплантов
ПРИМЕЧАНИЕ: Здесь описана процедура получения изображений одиночных сомитных эксплантов с помощью однонаправленного светового микроскопа. В качестве альтернативы, эксплантированные одиночные сомиты также могут быть визуализированы в конфокальный микроскоп, который более широко доступен, или даже в широкопольный микроскоп, если их интересует исключительно общая морфология эксплантов.
- Подготовьте камеру для визуализации следующим образом:
- Наполните шприц объемом 1 мл составом из силиконового каучука. Отрежьте наконечник пипетки объемом 200 мкл примерно на 1 см от рта и вставьте шприц в наконечник пипетки.
- Вручную оберните держатель мембраны предварительно вырезанной полоской мембраны из фторированного этиленпропилена (FEP) (рисунок 2A-C) и закрепите камеру визуализации на держателе мембраны, которые плотно прилегают друг к другу (рисунок 2D).
- Добавьте состав силиконового каучука по месту пересечения камеры и мембраны и высушите его в течение ночи, что позволит мембране прилипнуть к камере. Снимите держатель мембраны за 1 час до эксперимента с эксплантом.
- Нагрейте аликвоту, содержащую 0,5 мл 2% легкоплавкой агарозы, приготовленной из среды L-15, при температуре 75 °C в течение 10 минут. Добавьте 160 мкл нагретой низкоплавкой агарозы в центр камеры и поместите в агарозу форму для визуализации (рис. 2E, F) и держите ее вертикально, пока агароза не застынет.
- Добавьте еще 160 мкл нагретой легкоплавкой агарозы к двум концам формы и перенесите весь агрегат при температуре 4 °C на 30 минут.
- Добавьте в камеру 600 мкл среды L-15 и удалите форму из камеры с помощью щипцов. Дождитесь, пока камера со средой L-15 вернется к комнатной температуре.
- Перенесите эксплантированный сомит пипеткой из полированного стекла с помощью пипетирования в камеру визуализации и с помощью инструмента для ресниц расположите эксплант в центре камеры.
- Выровняйте лазеры визуализации в соответствии с инструкциями производителя и осторожно перенесите камеру визуализации в микроскоп, оборудованный инкубационной камерой, чтобы поддерживать температуру эксплантов при температуре 28 °C.
- Выполните второй раунд лазерного выравнивания с областями интереса из трансгенной линии, после чего настройте желаемый z-стек, временной интервал и продолжительность для покадровой визуализации. Для этого эксперимента необходимо получить 70 z-срезов с шагом 2 мкм и интервалом кадра 2 мин.
- Выполните двухцветную визуализацию на световом листе (рис. 1J) эксплантов с лазерами с длиной волны 561 нм (10% мощности лазера, 100 мс экспозиции) и 488 нм (10% мощности лазера, экспозиция 100 мс). В этом протоколе сигнал собирался с помощью объектива 25x/1.1 NA и через полосовые фильтры 561/25 нм и 525/50-25 соответственно на камеру sCMOS.
Результаты
Экспланты позволяют количественно оценить крупномасштабные изменения формы в 3D. Чтобы проиллюстрировать это, мы эксплантировали сомит четыре (N = 3) из ранних эмбрионов данио-рерио, полученных от скрещивания гетерозиготных линий Utr::mCherry (Tg::mCherry-Hsa.UTRN); e119Tg) и H2B::GFP (Tg(h2az2a:h2az2a-GFP); kca6Tg). Утрофин является актин-связывающим белком, и линия Utr::mCherry показывает распределение нитевидных актиновых структур. Этот трансген был использован здесь в качестве маркера для контуров клеток. H2B::GFP представляет собой флуоресцентно помеченный гистон и, следовательно, отмечает распределение хроматина, обеспечивая эффективное описание расположения и формы ядра, а также митотические фигуры, которые выделяют деление клеток.
Мы оценили успешность протокола экспланта во время визуализации. Мы наблюдали, что у сомита, поврежденного во время вскрытия, либо нарушается целостность ткани сомита, при этом многие клетки диссоциируют и выдавливаются из эксплантированного сомита, и/или многие клетки погибают, что можно отметить по наличию фрагментированных ядер в ядерном канале. Успешные экспланты оставались здоровыми в течение 4-6 ч, после чего наблюдались изменения в целостности сомитов, клетки диссоциировались от экспланта и погибали.
В канале утрофина мы проводили ручную сегментацию эксплантов в MATLAB (R2018b) на z-срезах с интервалом каждые 10 мкм. Мы разработали пользовательский алгоритм в MATLAB для сегментации, который находится в свободном доступе для скачивания (https://github.com/sundar07/SomSeg). В алгоритме можно задать файл, кадр и z-срез, которые необходимо сегментировать, после чего пользователю будет предложено вручную нарисовать контур вокруг интересующей области. Это было повторено для нескольких z-срезов и построено на графике, который показал округление эксплантов с течением времени в 3D (рис. 3A). Кроме того, была получена дополнительная информация о форме тканей с помощью ядерного канала. Для этого мы использовали Mastodon (версия 1.0.0-beta-19, https://github.com/mastodon-sc/mastodon), плагин FIJI15 , для получения положений центроидов ядер с помощью обнаружения пятен. Сначала мы конвертировали файлы tif из микроскопа в формат xml/hdf5 в FIJI, после чего был открыт новый проект с помощью плагина Mastodon. В плагине мы выбрали опцию детектирования пятен, где определили область интереса, которая покрывает эксплант, и использовали разницу гауссова детектора диаметром 5 мкм и добротностью 25 для детектирования пятен. Затем мы перенесли положения центроидов ядер в MATLAB и использовали встроенную функцию (convhull) для получения выпуклой оболочки (рис. 3B), которая характеризовала геометрию экспланта. Это также показало округление эксплантов с течением времени (рисунок 3B). Данные ядер также позволяют количественно оценить движения клеток путем отслеживания в 3D и изменения количества клеток с течением времени. С другой стороны, утрофиновый канал позволяет количественно оценить изменения в форме клеток по мере того, как экспланты становятся более круглыми. В совокупности эти параметры важны для характеристики внутренних свойств материала сомитов, что помогает в разработке эффективных физических описаний изменений формы в масштабе ткани.
Экспланты также позволяют количественно охарактеризовать контактные напряжения с соседними тканями. Чтобы проиллюстрировать это, мы вручную выделили два сомита, поместили их в непосредственной близости друг от друга и наблюдали за их динамикой (N = 2). Для этого эксперимента ориентация сомитов по отношению к осям тела in vivo не отслеживалась. Интересно, что со временем эксплантированные сомиты прилипли друг к другу вдоль одной поверхности, в то время как свободные поверхности, т.е. области, удаленные от места контакта, округлялись вверх (рис. 4). Это говорит о том, что адгезионные силы преодолевают напряжения, создаваемые поверхностным натяжением в местах контакта в эксплантах. Это может быть дополнительно охарактеризовано последующими изменениями формы, как описано выше, и количественной оценкой углов контакта между двумя тканями с течением времени в 3D. Таким образом, экспланты обеспечивают привлекательную систему для количественной оценки конкурирующих сил в действии, которые приводят к определенным формам тканей, последствия которых затем могут быть изучены in vivo.
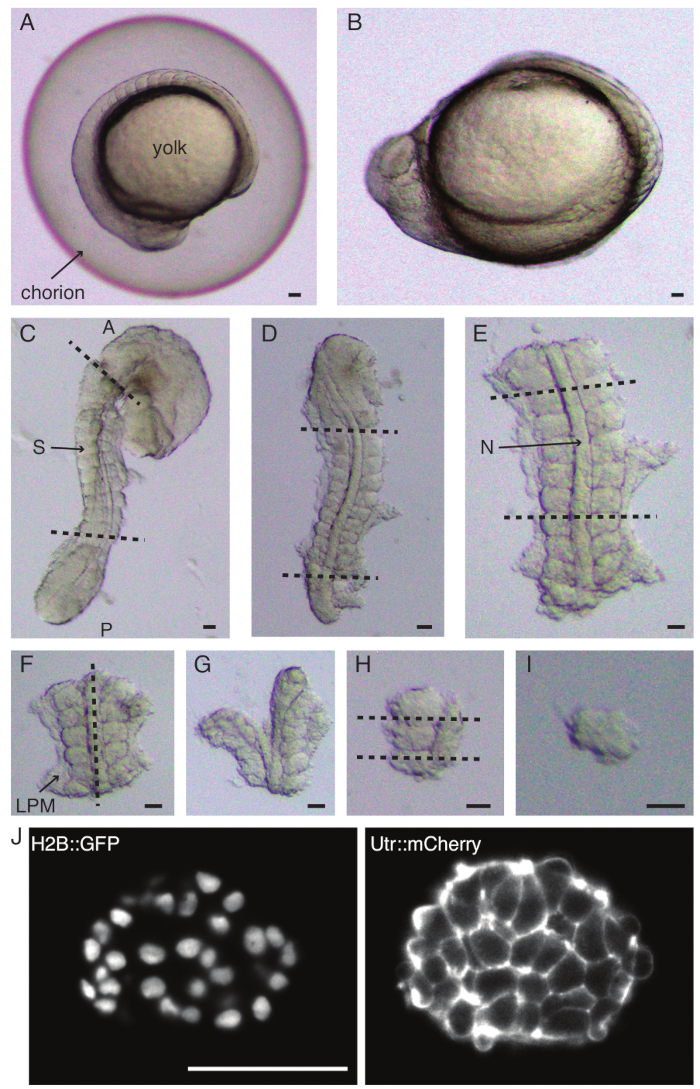
Рисунок 1: Приготовление односомитных эксплантов. Эмбрион данио-рерио (А) сначала дехорионизируется (В), после чего удаляется кожа и желток (С). Затем выбирается сомитосодержащая область эмбриона путем удаления остальных тканей (D, E). Затем последовательно удаляются области вокруг представляющего интерес сомита (F-H), чтобы в конечном итоге выделить один сомит (I), после чего проводится покадровая визуализация с использованием светового микроскопа (средний z-срез сомита показан здесь) (J). Сокращения: S = сомит; N = хорда; LPM = мезодерма латеральной пластины; A = передний; P = задний. Пунктирными линиями обозначены места резания. Масштабная линейка = 50 μм на всех панелях. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
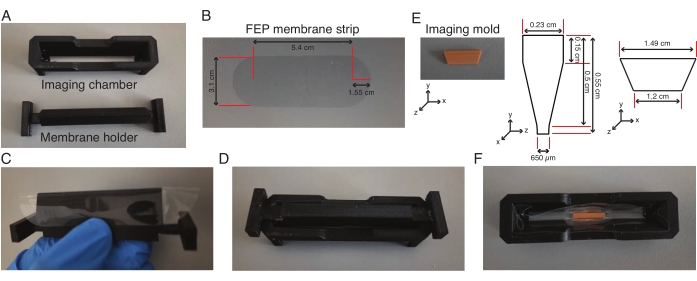
Рисунок 2: Сборка светолистовой камеры для визуализации. (A-D) Полоса мембраны FEP (размеры указаны в пункте (B)) оборачивается вокруг держателя мембраны, устанавливается на камеру визуализации, и мембрана приклеивается к камере визуализации. (Э-Ж) На следующий день держатель мембраны снимается, и форма для визуализации (размеры указаны в (E)) помещается в центр камеры визуализации из низкоплавкой агарозы. Вся установка выдерживается при температуре 4 °C в течение 30 минут, после чего форма удаляется, а камера с желобом используется для визуализации эксплантов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
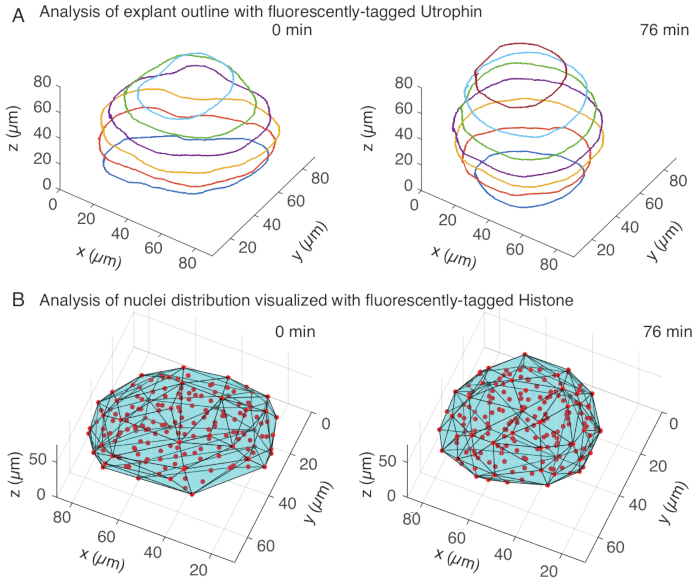
Рисунок 3: 3D-анализ форм тканей. (A) Контуры клеток визуализировали с помощью флуоресцентно меченного утрофина (Utr::mCherry), а ядра визуализировали с помощью флуоресцентно меченного гистона (H2B::GFP). Контуры экспланта были вручную сегментированы на нескольких глубинах с помощью MATLAB и показаны здесь. (B) Ядра (красные) были обнаружены в том же экспланте с помощью Mastodon, плагина FIJI, и подвергнуты воздействию выпуклой оболочки (голубой), которая информирует о геометрии экспланта. Обратите внимание, что округление эксплантов очевидно в обоих анализах. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
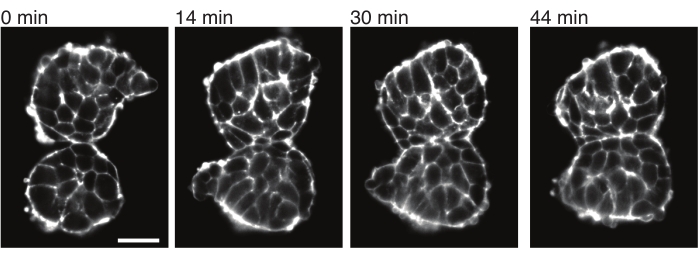
Рисунок 4: Эксплантированные сомиты прилипают друг к другу. Два сомита, выделенные из эмбрионов и вручную помещенные в непосредственной близости, имеют тенденцию к склеиванию с течением времени (N = 2). С помощью светового листового микроскопа были получены множественные z-срезы с интервалом кадров 2 минуты, а средние срезы сомитов из выбранных временных точек показаны здесь. Контуры клеток визуализировали с помощью флуоресцентно меченного утрофина (Utr::mCherry). Масштабная линейка = 25 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
В области сомитогенеза преобладали исследования роли часов сегментации в определении длины сегментов во время развития эмбриона. Тем не менее, не менее важно учитывать роль механики тканей в определении окончательной морфологии сомитов. Описанный здесь протокол позволяет эксплантировать одиночные сомиты, внутренние физические свойства которых могут быть изучены изолированно от эмбриона. Тем не менее, ручная подготовка ограничивает количество сомитов, которые обычно готовятся, до четырех-шести за сеанс визуализации. Поскольку протокол включает в себя тщательное тонкое рассечение нескольких тканей у эмбрионов без использования каких-либо ферментов для облегчения удаления тканей, может потребоваться несколько недель практики, чтобы освоить процесс вскрытия. В наших руках важнейшие этапы протокола включают в себя тщательное удаление кожи и желтка из эксплантов, что предотвращает прилипание эксплантов на разных этапах протокола к используемым инструментам, что, в свою очередь, позволяет легче проводить вскрытия для последовательного удаления тканей, окружающих сомит.
Протокол диссекции может быть остановлен на промежуточных этапах для получения сомитов, прикрепленных только к одной из окружающих тканей, или для получения эксплантов групп сомитов. Это обеспечивает мощный метод последовательного вскрытия тканей и изучения влияния соседних тканей на облегчение изменения формы сомитов или соседних тканей. С другой стороны, используя этот протокол, отдельные эксплантированные ткани могут слипаться и механически самоорганизовываться, как это демонстрируется путем размещения двух эксплантированных сомитов в непосредственной близости.
Экспланты, приготовленные этим методом, не требуют добавления ингредиентов в буфер или ограничений, чтобы обеспечить выживание в течение периодов времени до нескольких часов. Тем не менее, можно представить себе их культивирование в гидрогелях и отслеживание их динамики в присутствии внешних ограничений, которые могут служить моделью контактных напряжений, с которыми сомиты сталкиваются in vivo. Кроме того, экспланты позволяют напрямую исследовать свойства их материала с помощью атомно-силовой микроскопии, аспирации пипеток или с помощью микророботизированных инструментов16. Наконец, мы ожидаем, что этот метод может быть легко адаптирован для культивирования и изучения других тканей развития на аналогичных стадиях, таких как хорда, нервная пластинка и мезодерма латеральной пластины.
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих интересов.
Благодарности
Мы благодарим сотрудников лаборатории Оутса за комментарии к протоколу и рыбному хозяйству Федеральной политехнической школы Лозанны (EPFL). В частности, мы выражаем признательность Лорел Энн Роде за ценные советы по удалению кожи и желтка в протоколе вскрытия; Арианна Берковски Рама за создание эффективного конвейера для обработки наборов данных легких листов через Mastodon; Жан-Ив Тиневез за создание программного обеспечения Mastodon с открытым исходным кодом; Марко Поповичу за советы по анализу данных; Хлое Жолливе, Гийому Валентину и Флориану Лангу за всестороннюю поддержку в рыбном хозяйстве; Петру Стрнаду и Андреа Бони за создание светового микроскопа и советы по визуализации световых листов. Эта работа была поддержана EPFL, а S.R.N. была поддержана стипендией для постдокторантов Long-Term Human Frontier Science Program (LT000078/2016).
Материалы
| Name | Company | Catalog Number | Comments |
| Agarose | Sigma | 9012-36-6 | For coating bottom of petri dishes |
| Agarose, low gelling temperature | Sigma | 39346-81-1 | For preparing Viventis imaging chamber |
| Camera | Andor | Andor Zyla 4.2 Plus | For image acquisition in the light-sheet microscope |
| Detection objective | Nikon | Nikon CFI75 Apo LWD 25x/1.1 NA | For imaging explants |
| FEP membrane strip | Lohmann Technologies UK Ltd | Dupont FEP Fluorocarbon film, 200A | For preparing Viventis imaging chamber |
| Fine forceps | Dumont | Dumont 5SF 11252-00 | For removal of skin of embryos |
| Forceps | Dumont | Dumont 55 | For dechorionating embryos |
| Leibovitz's L-15 medium | Gibco | 21083-027 | Explant culture medium |
| Light-sheet microscope | Viventis | LS1 live | For imaging explants |
| Micro knife | Fine Science Tools | 10318-14 | For making incisions in embryos |
| Silicone rubber formulation | Wacker Chemie AG | Silpuran 4200 | For preparing Viventis imaging chamber |
Ссылки
- Oates, A. C., Morelli, L. G., Ares, S. Patterning embryos with oscillations: structure, function and dynamics of the vertebrate segmentation clock. Development. 139 (4), Cambridge, England. 625-639 (2012).
- Pourquié, O. Segmentation of the vertebrate spine: From clock to scoliosis. Cell. 145 (5), 650-663 (2011).
- Naganathan, S. R., Oates, A. C. Patterning and mechanics of somite boundaries in zebrafish embryos. Seminars in Cell & Developmental Biology. 107, 170-178 (2020).
- Hubaud, A., Regev, I., Mahadevan, L., Pourquié, O. Excitable Dynamics and Yap-Dependent Mechanical Cues Drive the Segmentation Clock. Cell. 171 (3), 668-682 (2017).
- Dias, A. S., de Almeida, I., Belmonte, J. M., Glazier, J. A., Stern, C. D. Somites without a clock. Science. 343 (6172), New York, N.Y. 791-795 (2014).
- Nelemans, B. K. A., Schmitz, M., Tahir, H., Merks, R. M., Smit, T. H. Somite Division and New Boundary Formation by Mechanical Strain. iScience. 23 (4), 100976(2020).
- Grima, R., Schnell, S. Can tissue surface tension drive somite formation. Developmental Biology. 307 (2), 248-257 (2007).
- Naganathan, S. R., Popovic, M., Oates, A. C. Left–right symmetry of zebrafish embryos requires somite surface tension. Nature. 605, 516-521 (2022).
- Campàs, O. A toolbox to explore the mechanics of living embryonic tissues. Seminars in Cell & Developmental Biology. 55, 119-130 (2016).
- Langenberg, T., Brand, M., Cooper, M. S. Imaging brain development and organogenesis in zebrafish using immobilized embryonic explants. Developmental Dynamics: An Official Publication of The American Association of Anatomists. 228 (3), 464-474 (2003).
- Henry, C. A., Poage, C. T., McCarthy, M. B., Campos-Ortega, J., Cooper, M. S. Regionally autonomous segmentation within zebrafish presomitic mesoderm. Zebrafish. 2 (1), 7-18 (2005).
- Picker, A., Roellig, D., Pourquié, O., Oates, A. C., Brand, M. Tissue micromanipulation in zebrafish embryos. Methods in Molecular Biology. 546, Clifton, N.J. 153-172 (2009).
- Manning, A. J., Kimelman, D. Tbx16 and Msgn1 are required to establish directional cell migration of zebrafish mesodermal progenitors. Developmental Biology. 406 (2), 172-185 (2015).
- Simsek, M. F., Özbudak, E. M. A 3-D Tail Explant Culture to Study Vertebrate Segmentation in Zebrafish. Journal of Visualized Experiments:JoVE. (172), e61981(2021).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Özkale, B., et al. Modular soft robotic microdevices for dexterous biomanipulation. Lab on a Chip. 19 (5), 778-788 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены