Method Article
Zebra Balığı Embriyolarından Tek Somit Eksplantlarının Hazırlanması
Bu Makalede
Özet
Zebra balığı embriyolarından tek somitleri izole etmek için bir protokol sunuyoruz, dinamikleri floresan hızlandırılmış mikroskopi ile kültürde birkaç saat boyunca takip edilebilir, böylece tek hücre çözünürlüğünde doku ölçeğindeki şekil değişikliklerini ölçmek için bir metodoloji sağlıyoruz.
Özet
Omurgalı embriyolarının vücut ekseni periyodik olarak somit adı verilen 3D çok hücreli birimlere bölünür. Genetik salınımlar ve moleküler ön modeller, somitlerin ilk uzunluk ölçeğini belirlerken, mekanik süreçler, nihai boyutlarının ve şekillerinin belirlenmesinde rol oynamıştır. Somitlerin içsel malzeme özelliklerini daha iyi anlamak için, zebra balığı embriyolarından tek somit eksplantını kültürlemek için bir yöntem geliştirilmiştir. Tek somitler, önce embriyoların derisinin çıkarılması, ardından yumurta sarısının çıkarılması ve komşu dokuların sıralı eksizyonu ile izole edilir. Transgenik embriyolar kullanılarak, çeşitli hücre altı yapıların dağılımı floresan hızlandırılmış mikroskopi ile gözlemlenebilir. Ekilen somitlerin dinamikleri birkaç saat boyunca takip edilebilir, böylece tek hücre çözünürlüğünde doku ölçeğinde şekil değişikliklerini incelemek için deneysel bir çerçeve sağlar. Bu yaklaşım, somitlerin doğrudan mekanik manipülasyonunu mümkün kılar ve dokunun malzeme özelliklerinin diseksiyonuna izin verir. Son olarak, burada özetlenen teknik, notokord, nöral plaka ve lateral plaka mezodermi gibi diğer dokuların çıkarılması için kolayca genişletilebilir.
Giriş
Omurgalı yetişkin kas-iskelet sisteminin çoğu, embriyoların vücut ekseni boyunca periyodik ve ritmik bir şekilde oluşan embriyonik somitlerden ortaya çıkar 1,2. Somitler, tipik olarak mezenkimal hücrelerin bir iç çekirdeğinden ve fibronektin açısından zengin bir hücre dışı matris3 ile çevrili bir periferik epitel tabakasından oluşan üç boyutlu (3D) çok hücreli birimlerdir. Somitlerin morfolojisi, yani boyutları ve şekilleri, kısmen segmentasyon saati ve aşağı akış moleküler ön modelleri tarafından belirlenir. Bununla birlikte, son on yılda, mekanik ipuçlarının ve kuvvetlerin, somit oluşumunu 5,6,7 kolaylaştırmanın ve ilk somitoluşumunu 8 takiben somit uzunluklarının artan hassasiyetini sağlamanın yanı sıra, segmentasyon saatinin4 düzenlenmesinde de rol oynadığı ortaya çıkmıştır.
Doku mekaniği, yeni araçların9 mevcudiyeti ile doğrudan in vivo olarak incelenebilir, ancak fiziksel süreçlerin altında yatan tam bir resim elde etmek için, dokuların içsel malzeme özelliklerinin aynı anda incelenmesi gerekir. Burada tarif edilen protokol, hücreselden doku ölçeklerine kadar fiziksel özellikleri embriyodan izole olarak incelenebilen tek somitlerin hazırlanması için basit bir yaklaşım sağlar. Benzer gelişim aşamalarında 10,11,12,13,14 eksplantların hazırlanması için çeşitli protokoller mevcut olsa da, bildiğimiz kadarıyla, bu, tek somitlerin izolasyonunu tanımlayan ilk protokoldür. Protokolün uygulanması kolaydır ve yalnızca embriyolarla çalışan çoğu zebra balığı laboratuvarında bulunan temel ekipmanı gerektirir.
Morfolojik somit oluşumunda mekaniğin rolünü ayırmaya yardımcı olmak için, zebra balığı embriyolarından tek somit eksplantını kültürlemek için bir yöntem geliştirilmiştir, bu da somitlerin içsel malzeme özelliklerini araştırmak için kullanılabilir.
Protokol
Bu protokol, döllenmeden 1 gün sonra daha genç canlı omurgalı embriyolarının kullanılmasını içerir. Tüm deneyler, serbestçe çiftleşen yetişkinlerden elde edilen embriyolar kullanılarak gerçekleştirilmiştir ve bu nedenle, İsviçre'nin Vaud kantonunun Service de la Consommation et des Affaires Vétérinaires (yetki numarası VD-H23) tarafından verilen EPFL'nin genel hayvan deneyi lisansı kapsamındadır.
1. Diseksiyondan önce
- Heterozigot transgenik ilgi hatlarının bir çaprazından embriyolar elde edin. İki ila üç somitin ekilmesi için tipik olarak sadece birkaç embriyoya ihtiyaç vardır. Bu protokolde, bir somit eksplant için bir embriyo kullanıldı.
- İki adet 50x stoktan 1x E3 tamponu hazırlayın: stok 1 0.458 mM Na2HPO4, 0.042 mM KH2PO4, 4.084 mM NaCl, 0.128 mM KCl içerir ve stok 2 0.33 mM CaCl2, 0.33 mM MgSO4 içerir. 480 mL damıtılmış suyu iki 50x stoğun her biri 10 mL ile karıştırarak 500 mL 1x E3 tamponu hazırlayın.
- Aynı gün diseksiyon yapılıyorsa, embriyoları bir Petri kabında 33 ° C'de 25 mL E3 ortamında üç somit aşamasına kadar yükseltin. Ertesi sabah diseksiyon yapıyorsanız, gece boyunca inkübasyon için 19 ° C'ye aktarmadan önce embriyoları E3 ortamında 28 ° C'de kalkan aşamasına kadar yükseltin.
- Kalkan aşamasını veya farklı somit aşamalarını tanımlamak için, yaklaşık 0.67x ila 4.5x arasında ayarlanabilir büyütme aralığına sahip standart bir laboratuvar stereomikroskobu kullanın.
- Diseksiyon için gerekli aletleri ve reaktifleri birleştirin.
- Aliquot Leibovitz'in L-15 ortamını 50 mL'lik tüplerde saklayın ve buzdolabında saklayın. Buzdolabından çıkan aynı alikotu en fazla iki tur kullanmanızı öneririz.
- Manyetik bir karıştırıcı kullanarak ve sıcaklığı 85 °C'de tutarak L-15 ortamında 50 mL %2 agaroz hazırlayın. Çözündükten sonra çözeltiyi oda sıcaklığında saklayın.
- Manyetik bir karıştırıcı kullanarak ve sıcaklığı 85 °C'de tutarak L-15 ortamında 25 mL %2 düşük erime noktalı agaroz hazırlayın. Çözündükten sonra, çözeltiyi 1.5 mL'lik tüplerde ayırın ve 4 ° C'de saklayın. Bu, görüntüleme odasını hazırlamak için kullanılacaktır.
- Erimiş %2'lik agarozu, kabın derinliğinin üçte biri dolana kadar 20 mm'lik bir Petri kabına dökün ve agaroz çözeltisinin katılaşmasına izin verin. Bu Petri kaplarında diseksiyon yapılacaktır. Agaroz kaplamalı Petri kaplarını önceden hazırlayın ve 4 °C'de saklayın.
- Aşağıdaki aletleri bir araya getirin: Embriyoların transferi için pasteur pipeti, embriyoların dekoryonlanması için bir çift forseps, embriyoların derisinin çıkarılması için bir çift ince forseps, embriyolarda kesi yapmak için bir mikro bıçak, eksplantları görüntüleme odasına aktarmak için ateşle parlatılmış cam pipet.
- Cam pipeti %100 etanolde 15 dakika sterilize edin ve 5 mL L-15 ortamını yukarı ve aşağı pipetleyerek iki kez durulayın.
- Kaştan bir cam kılcal damara bir kirpik veya saç yapıştırarak bir kirpik aleti hazırlayın.
- Pozitif transgenik embriyoları sıralamak ve E3 ortamlı ayrı bir Petri kabına aktarmak için yaklaşık 0,63x ila 6,3x arasında ayarlanabilir büyütme aralığına sahip bir floresan stereoskop ve standart GFP ve RFP filtreleri kullanın.
2. Tek somit eksplant hazırlığı
- 2 veya 3 embriyoyu 10 mL L-15 ortamı ile doldurulmuş agaroz kaplı bir tabağa (adım 1.5.4'te yapılmıştır) aktarın. Embriyoları transfer etmeden önce çanağın L-15 ortamı ile birlikte bir inkübatörde 30 dakika boyunca 28 ° C'de önceden ısıtıldığından emin olun.
- Bir çift forseps ile bir embriyoyu dikkatlice dekoryonlayın (Şekil 1 A,B). Koryonu forsepslerden biriyle tutun ve ikinci forsepsleri kullanarak koryonu birinci forsepsin yerleştirildiği yere yakın bir yere sıkıştırın ve çekin.
- Koryonu geniş bir şekilde açmak için bu adımı bir kez daha tekrarlayın, ardından embriyo nazikçe dışarı itilebilir. Dekoryonasyon sırasında embriyonun hasar görmediğinden veya sıkılmadığından emin olun.
- Embriyoyu yan tarafına yönlendirin ve ince forsepslerden biriyle embriyonun başı ve kuyruğu arasındaki cilde tutunun. İlk forsepsin hala konumlandırıldığı yere yakın cildi sıkıştırmak için ikinci ince forsepsleri kullanın.
- Cilde tutunurken iki forseps'i birbirinden uzaklaştırın, böylece büyük bir açıklık oluşturun. Forsepslerden birini ciltten serbest bırakın ve ikinci forsepsin tutulduğu yere yaklaştırın ve somit oluşturan bölgelerde cilt çıkarılana kadar cilt çıkarma işlemini tekrarlayın.
NOT: Ekilecek somitleri çevreleyen derinin tamamen çıkarılması çok önemlidir, aksi takdirde protokolün sonraki adımlarında daha ince diseksiyonlar yapmak zorlaşır. - Yumurta sarısını sıyırmak için bir mikro bıçak kullanın (Şekil 1C - derisi çıkarılmış ve sarısı kazınmış olarak eksplant) ve aşağıdaki gibi bir dizi kesi yapın:
- İlk kesilen embriyodaki ilk morfolojik somitin önünde ve ikinci kesilen en son oluşan somitin arkasında olacak şekilde embriyoyu dilimleyin (Şekil 1D). İlgilenilen somitlere bir kez daha posterior ve anterior dilimleyin (Şekil 1E).
- Embriyonun ekilen bölgelerinden kalan yumurta sarısını kazımak için mikro bıçağı kullanın. Eksplantların mikro bıçağa yapışma olasılığını azaltmak için mümkün olduğunca yumurta sarısını çıkarmaya çalışın. Böyle bir durumda, mikro bıçağı ortama daldırılmış halde tutarken eksplantı solüsyona geri döndürmek için bir kirpik aleti kullanın.
- Eksplantı dorsal olarak konumlandırın ve notokord boyunca anteroposterior eksen boyunca bir taraftaki somitlere yakın bir dilim yapın (Şekil 1F,G).
- Eksplantı notokord olmadan alın ve somitlere yakın yan plaka mezoderminden (LPM) dilimleyin.
NOT: Bu adım, önceki adımla değiştirilebilir, yani önce LPM'yi dilimlemek ve ardından notokorddan dilimlemek için eşit derecede iyi çalışır.
- Ekilecek somiti seçin ve sırasıyla somitin önünde ve arkasında iki dilim yapın (Şekil 1H).
- Son olarak, hala somite bağlı olan nöral plakayı görselleştirmek için kirpik aletini kullanarak somiti 90° döndürün. Somolit ve nöral plaka arasında bir dilim yapın, böylece tek bir somit serbest bırakın (Şekil 1I).
NOT: Nöral plaka, adım 2.6.4'ten hemen sonra, yani notokord ve LPM'nin çıkarılmasından sonra ve komşu somitlerden bir somit diseke edilmeden önce de çıkarılabilir.
3. Tek somit eksplantların görüntülenmesi
NOT: Burada, tek görünümlü bir ışık tabakası mikroskobu kullanılarak tek somit eksplantların görüntülenmesi prosedürü açıklanmaktadır. Alternatif olarak, ekilen tek somitler, daha yaygın olarak bulunan bir konfokal mikroskopta veya hatta yalnızca eksplantların genel morfolojisini takip etmekle ilgileniyorsa geniş alanlı bir mikroskopta da görüntülenebilir.
- Aşağıdaki gibi bir görüntüleme odası hazırlayın:
- 1 mL'lik bir şırıngayı silikon kauçuk formülasyonu ile doldurun. 200 μL'lik bir pipet ucunu ağızdan yaklaşık 1 cm uzakta kesin ve şırıngayı pipet ucuna yerleştirin.
- Membran tutucuyu önceden kesilmiş bir florlu etilen propilen (FEP) membran şeridi (Şekil 2A-C) ile manuel olarak sarın ve görüntüleme odasını birbirine sıkıca oturan membran tutucuya sabitleyin (Şekil 2D).
- Hazne ile zarın kesişimi boyunca silikon kauçuk formülasyonu ekleyin ve gece boyunca kurutun, bu da zarın hazneye yapışmasını sağlar. Eksplant deneyinden 1 saat önce membran tutucuyu çıkarın.
- L-15 besiyeri ile yapılan 0.5 mL %2 düşük erime noktalı agaroz içeren bir alikotu 75 ° C'de 10 dakika ısıtın. Odanın ortasına 160 μL ısıtılmış düşük erime noktalı agaroz ekleyin ve agarozun içine bir görüntüleme kalıbı yerleştirin (Şekil 2E,F) ve agaroz katılaşana kadar dik tutun.
- Kalıbın iki ucuna 160 μL daha ısıtılmış, düşük erime noktalı agaroz ekleyin ve tüm üniteyi 30 dakika boyunca 4 °C'ye aktarın.
- Hazneye 600 μL L-15 besiyeri ekleyin ve kalıbı bir forseps ile hazneden çıkarın. L-15 ortamlı oda sıcaklığına dönene kadar bekleyin.
- Ekilen somiti cilalı bir cam pipet ile pipetleyerek görüntüleme odasına aktarın ve eksplantı haznenin ortasına yerleştirmek için bir kirpik aleti kullanın.
- Görüntüleme lazerlerini üreticinin talimatlarına göre hizalayın ve eksplantları 28 °C'de tutmak için görüntüleme odasını bir inkübasyon odası ile donatılmış mikroskoba dikkatlice aktarın.
- Transgenik çizgiden ilgilenilen bölgelerle ikinci bir lazer hizalama turu gerçekleştirin, ardından hızlandırılmış görüntüleme için istenen z-yığınını, zaman aralığını ve süreyi ayarlayın. Bu deney için, 2 μm aralıklı ve 2 dakikalık bir çerçeve aralığına sahip 70 z dilimi elde edin.
- 561 nm (%10 lazer gücü, 100 ms pozlama) ve 488 nm lazerler (%10 lazer gücü, 100 ms pozlama) ile eksplantların çift renkli ışıklı levha görüntülemesini (Şekil 1J) gerçekleştirin. Bu protokolde sinyal, 25x/1.1 NA objektif ve sırasıyla 561/25 nm ve 525/50-25 bant geçiren filtreler aracılığıyla bir sCMOS kameraya toplandı.
Sonuçlar
Eksplantlar, büyük ölçekli şekil değişikliklerinin 3D olarak ölçülmesine izin verir. Bunu göstermek için, Utr::mCherry (Tg(actb2:mCherry-Hsa.UTRN); e119Tg) ve H2B::GFP (Tg(h2az2a:h2az2a-GFP); kca6Tg) heterozigot çizgileri arasındaki çaprazlamadan elde edilen erken zebra balığı embriyolarından somit dört (N = 3) çıkardık. Utrofin, aktin bağlayıcı bir proteindir ve Utr::mCherry çizgisi, filamentli aktin yapılarının dağılımını gösterir. Bu transgen burada hücre ana hatları için bir belirteç olarak kullanıldı. H2B::GFP, floresan etiketli bir histondur ve sonuç olarak kromatinin dağılımını işaretler, nükleer konum ve şeklin etkili bir tanımını ve ayrıca hücre bölünmesini vurgulayan mitotik figürleri sağlar.
Görüntüleme sırasında eksplant protokolünün başarısını değerlendirdik. Diseksiyon sırasında hasar gören bir somitte, somit dokusunun bütünlüğünün tehlikeye girdiğini, birçok hücrenin eksplantedilen somitten ayrılıp ekstrüzyon yaptığını ve/veya birçok hücrenin öldüğünü gözlemledik, bu da nükleer kanalda parçalanmış çekirdeklerin varlığı ile not edilebilir. Başarılı eksplantlar 4-6 saat boyunca sağlıklı kaldı, daha sonra eksplanttan ayrılan ve ölen hücrelerle somit bütünlüğünde değişiklikler gözlendi.
Ütrofin kanalında, her 10 μm'de aralıklı z-dilimleri üzerinde MATLAB'da (R2018b) eksplantların manuel segmentasyonunu gerçekleştirdik. MATLAB'da segmentasyon için ücretsiz olarak indirilebilen özel bir algoritma geliştirdik (https://github.com/sundar07/SomSeg). Algoritmada, bölümlere ayrılacak dosya, çerçeve ve z-dilimi ayarlanabilir, ardından ilgilenilen bölge etrafında bir anahattın manuel olarak çizilmesine izin veren bir kullanıcı istemi gelebilir. Bu, birden fazla z-dilimi için tekrarlandı ve çizildi, bu da zaman içinde eksplantların 3D olarak yuvarlandığını gösterdi (Şekil 3A). Ek olarak, nükleer kanal kullanılarak doku şekli hakkında tamamlayıcı bilgiler de elde edildi. Bunun için, nokta algılama yoluyla çekirdek merkezi konumları elde etmek için bir FIJI 15 eklentisi olan Mastodon'u (sürüm1.0.0-beta-19 , https://github.com/mastodon-sc/mastodon) kullandık. Önce tif dosyalarını mikroskoptan FIJI'de xml/hdf5 formatına dönüştürdük, ardından Mastodon eklentisi kullanılarak yeni bir proje açıldı. Eklentide, eksplantı kapsayan bir ilgi alanı tanımladığımız ve lekeleri tespit etmek için 5 μm çapında ve 25 kalite faktörü olan Gauss dedektörünün farkını kullandığımız nokta algılama seçeneğini seçtik. Daha sonra çekirdek merkez konumlarını MATLAB'a aktardık ve dışbükey bir gövde elde etmek için yerleşik bir fonksiyon (convhull) kullandık (Şekil 3B), bu da eksplantın geometrisini karakterize etti. Bu, benzer şekilde eksplantların zaman içinde yuvarlanmasını gösterdi (Şekil 3B). Çekirdek verileri ayrıca, 3D olarak izleyerek ve zaman içinde hücre sayısındaki bir değişikliği izleyerek hücre hareketlerinin ölçülmesine olanak tanır. Öte yandan, ütrofin kanalı, eksplantlar daha yuvarlak hale geldikçe hücre şekillerindeki değişikliklerin nicelleştirilmesine izin verir. Birlikte, bu parametreler, doku ölçeğinde şekil değişikliklerinin etkili fiziksel tanımlarının geliştirilmesine yardımcı olan somitlerin içsel malzeme özelliklerini karakterize etmek için değerlidir.
Eksplantlar ayrıca komşu dokularla temas streslerinin kantitatif bir şekilde karakterize edilmesine izin verir. Bunu göstermek için, iki somiti manuel olarak izole ettik ve onları yakın yere yerleştirdik ve dinamiklerini gözlemledik (N = 2). Bu deney için, somitlerin in vivo vücut eksenlerine göre oryantasyonu izlenmedi. İlginç bir şekilde, zamanla, ekilen somitler bir yüzey boyunca birbirine yapışırken, serbest yüzeyler, yani temas bölgesinden uzak bölgeler yuvarlanır (Şekil 4). Bu, yapışma kuvvetlerinin, eksplantlardaki temas bölgelerinde yüzey gerilimi tarafından üretilen gerilmelerin üstesinden geldiğini göstermektedir. Bu, yukarıda açıklandığı gibi şekil değişikliklerini takip ederek ve zaman içinde iki doku arasındaki temas açılarını 3D olarak ölçerek daha da karakterize edilebilir. Bu nedenle, eksplantlar, etkileri daha sonra in vivo olarak araştırılabilen belirli doku şekillerine yol açan eylemdeki rekabet kuvvetlerini ölçmek için çekici bir sistem sağlar.
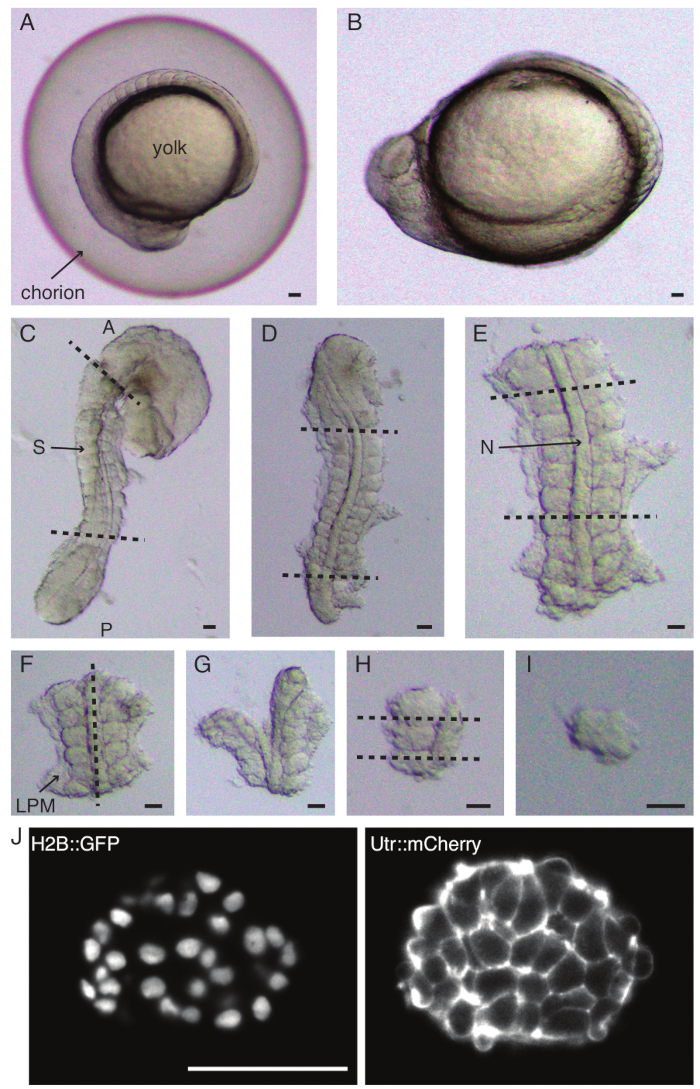
Şekil 1: Tek somit eksplantların hazırlanması. Zebra balığı embriyosu (A) önce dekoryona edilir (B), ardından deri ve yumurta sarısı çıkarılır (C). Embriyonun somit içeren bölgesi daha sonra geri kalan dokuların (D, E) çıkarılmasıyla seçilir. İlgilenilen somitin etrafındaki bölgeler daha sonra tek bir somiti (I) izole etmek için seri olarak çıkarılır (FH), ardından bir ışık tabakası mikroskobu (burada gösterilen somitin orta z kesiti) kullanılarak hızlandırılmış görüntüleme yapılır (J). Kısaltmalar: S = somit; N = notokord; LPM = yanal plaka mezodermi; A = ön; P = arka. Kesikli çizgiler kesim konumlarını gösterir. Ölçek çubuğu = tüm panellerde 50 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
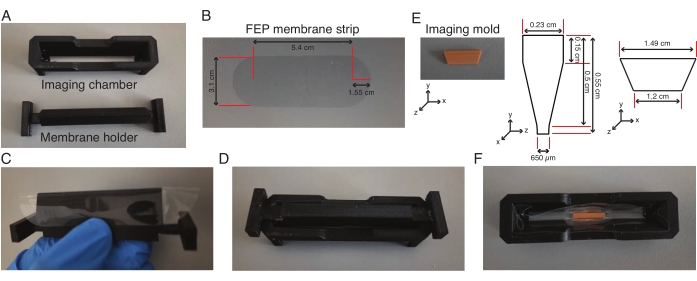
Şekil 2: Işık tabakası görüntüleme odasının montajı. (A-D) Bir FEP membran şeridi ((B)'deki boyutlar) membran tutucunun etrafına sarılır, görüntüleme odasına takılır ve membran görüntüleme odasına yapıştırılır. (E-F) Ertesi gün, membran tutucu çıkarılır ve düşük erime noktalı agarozda görüntüleme odasının merkezine bir görüntüleme kalıbı ((E) cinsinden boyutlar) yerleştirilir. Tüm ünite 30 dakika boyunca 4 ° C'de tutulur, ardından kalıp çıkarılır ve oluklu hazne eksplantları görüntülemek için kullanılır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
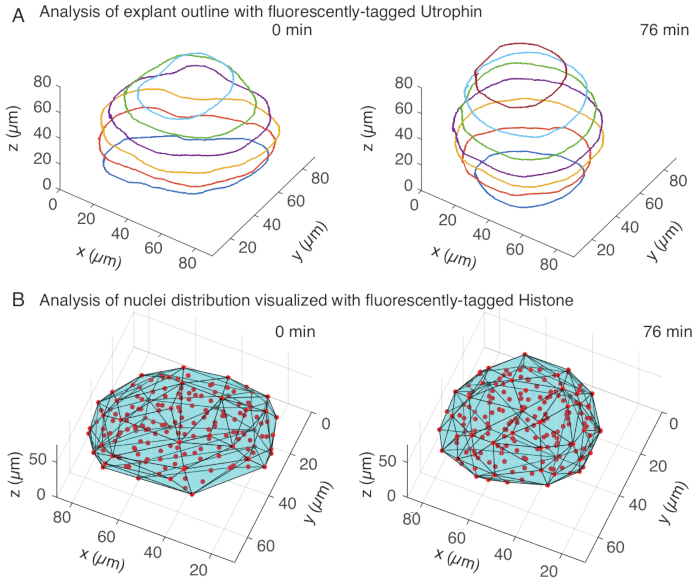
Şekil 3: Doku şekillerinin 3 boyutlu analizi. (A) Hücre ana hatları floresan etiketli utrofin (Utr::mCherry) ile görselleştirildi ve çekirdekler floresan etiketli histon (H2B::GFP) ile görselleştirildi. Eksplantın ana hatları, MATLAB kullanılarak birden fazla derinlikte manuel olarak bölümlere ayrıldı ve burada gösterildi. (B) Çekirdekler (kırmızı), bir FIJI eklentisi olan Mastodon kullanılarak aynı eksplantta tespit edildi ve eksplantın geometrisi hakkında bilgi veren dışbükey bir gövdeye (camgöbeği) tabi tutuldu. Not: Eksplantların yuvarlanması her iki analizde de belirgindir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
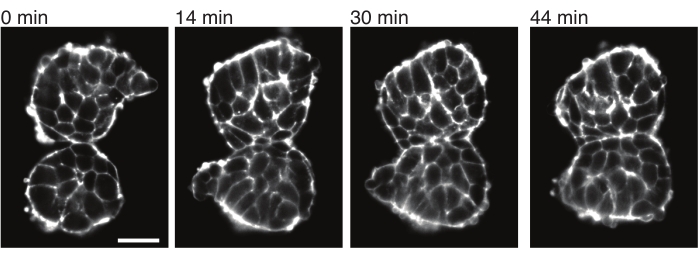
Şekil 4: Ekilen somitler birbirine yapışır. Embriyolardan izole edilen ve manuel olarak yakın yerleştirilen iki somit zamanla yapışma eğilimindedir (N = 2). Bir ışık tabakası mikroskobu kullanılarak 2 dakikalık bir çerçeve aralığına sahip çoklu z-dilimleri elde edildi ve seçilen zaman noktalarından somitlerin orta bölümleri burada gösterildi. Hücre ana hatları, floresan etiketli Utrophin (Utr::mCherry) ile görselleştirildi. Ölçek çubuğu = 25 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Somitogenez alanına, embriyo gelişimi sırasında segment uzunluklarını belirlemede segmentasyon saatinin rolü üzerine yapılan çalışmalar hakim olmuştur. Bununla birlikte, nihai somit morfolojilerinin belirlenmesinde doku mekaniğinin rolünü dikkate almak da aynı derecede önemlidir. Burada tarif edilen protokol, içsel fiziksel özellikleri embriyodan izole olarak incelenebilen tek somitlerin ekilmesine izin verir. Bununla birlikte, manuel hazırlık, tipik olarak hazırlanan somit sayısını görüntüleme seansı başına dört ila altı ile sınırlar. Protokol, doku çıkarılmasını kolaylaştırmak için herhangi bir enzim kullanılmadan embriyolardaki birkaç dokunun dikkatli ince diseksiyonlarını içerdiğinden, diseksiyon işlemine hakim olmak birkaç haftalık uygulama gerektirebilir. Elimizde, protokoldeki kritik adımlar, protokolün farklı aşamalarındaki eksplantların kullanılan aletlere yapışmasını önleyen ve bu da bir somiti çevreleyen dokuların seri olarak çıkarılması için daha kolay diseksiyonları mümkün kılan eksplantlardan deri ve yumurta sarısının dikkatli bir şekilde çıkarılmasını içerir.
Diseksiyon protokolü, çevre dokulardan sadece birine bağlı somitler elde etmek veya somit gruplarının eksplantlarını elde etmek için ara adımlarda durdurulabilir. Bu, dokuları seri olarak soymak ve komşu dokuların somitlerde veya komşu dokularda şekil değişikliklerini kolaylaştırmadaki etkisini incelemek için güçlü bir yöntem sağlar. Öte yandan, bu protokolü kullanarak, ekilen iki somitin birbirine yakın yerleştirilmesiyle gösterildiği gibi, tek tek ekilen dokuların yapışmasına ve mekanik olarak kendi kendini organize etmesine izin verilebilir.
Bu yöntemle hazırlanan eksplantlar, birkaç saate kadar süreler boyunca hayatta kalmayı sağlamak için tamponda herhangi bir ilave bileşen veya kısıtlama gerektirmez. Bununla birlikte, onları hidrojellerde kültürlemek ve dış kısıtlamaların varlığında dinamiklerini takip etmek tasavvur edilebilir, bu da somitlerin in vivo olarak karşılaştığı temas stresleri için bir model olarak hizmet edebilir. Ayrıca, eksplantlar, atomik kuvvet mikroskobu, pipet aspirasyonu veya mikro-robotik aletler kullanılarak malzeme özelliklerinin doğrudan araştırılmasına izin verir16. Son olarak, bu yöntemin notokord, nöral plaka ve lateral plaka mezodermi gibi benzer aşamalardaki diğer gelişimsel dokuların kültürlenmesine ve incelenmesine kolayca uyarlanabileceğini umuyoruz.
Açıklamalar
Yazarlar hiçbir rekabet çıkarı beyan etmezler.
Teşekkürler
École Polytechnique Fédérale de Lausanne'ın (EPFL) protokol ve balık tesisi hakkındaki yorumları için Oates laboratuvarı üyelerine teşekkür ederiz. Özellikle, diseksiyon protokolünde cilt ve yumurta sarısının giderilmesi ile ilgili değerli ipuçları için Laurel Ann Rohde'ye teşekkür ederiz; Arianne Bercowsky Rama, Mastodon aracılığıyla ışık sayfası veri setlerini işlemek için verimli bir boru hattı oluşturduğu için; Jean-Yves Tinevez, açık kaynaklı Mastodon yazılımını oluşturmak için; Veri analizine ilişkin ipuçları için Marko Popović; Balık tesisindeki kapsamlı destek için Chloé Jollivet, Guillaume Valentin ve Florian Lang; Petr Strnad ve Andrea Boni, ışık tabakası mikroskobunu inşa ettikleri ve ışık tabakası görüntüleme hakkında ipuçları için. Bu çalışma EPFL tarafından desteklenmiştir ve SRN, Uzun Vadeli İnsan Sınırı Bilim Programı doktora sonrası bursu (LT000078/2016) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Agarose | Sigma | 9012-36-6 | For coating bottom of petri dishes |
| Agarose, low gelling temperature | Sigma | 39346-81-1 | For preparing Viventis imaging chamber |
| Camera | Andor | Andor Zyla 4.2 Plus | For image acquisition in the light-sheet microscope |
| Detection objective | Nikon | Nikon CFI75 Apo LWD 25x/1.1 NA | For imaging explants |
| FEP membrane strip | Lohmann Technologies UK Ltd | Dupont FEP Fluorocarbon film, 200A | For preparing Viventis imaging chamber |
| Fine forceps | Dumont | Dumont 5SF 11252-00 | For removal of skin of embryos |
| Forceps | Dumont | Dumont 55 | For dechorionating embryos |
| Leibovitz's L-15 medium | Gibco | 21083-027 | Explant culture medium |
| Light-sheet microscope | Viventis | LS1 live | For imaging explants |
| Micro knife | Fine Science Tools | 10318-14 | For making incisions in embryos |
| Silicone rubber formulation | Wacker Chemie AG | Silpuran 4200 | For preparing Viventis imaging chamber |
Referanslar
- Oates, A. C., Morelli, L. G., Ares, S. Patterning embryos with oscillations: structure, function and dynamics of the vertebrate segmentation clock. Development. 139 (4), Cambridge, England. 625-639 (2012).
- Pourquié, O. Segmentation of the vertebrate spine: From clock to scoliosis. Cell. 145 (5), 650-663 (2011).
- Naganathan, S. R., Oates, A. C. Patterning and mechanics of somite boundaries in zebrafish embryos. Seminars in Cell & Developmental Biology. 107, 170-178 (2020).
- Hubaud, A., Regev, I., Mahadevan, L., Pourquié, O. Excitable Dynamics and Yap-Dependent Mechanical Cues Drive the Segmentation Clock. Cell. 171 (3), 668-682 (2017).
- Dias, A. S., de Almeida, I., Belmonte, J. M., Glazier, J. A., Stern, C. D. Somites without a clock. Science. 343 (6172), New York, N.Y. 791-795 (2014).
- Nelemans, B. K. A., Schmitz, M., Tahir, H., Merks, R. M., Smit, T. H. Somite Division and New Boundary Formation by Mechanical Strain. iScience. 23 (4), 100976(2020).
- Grima, R., Schnell, S. Can tissue surface tension drive somite formation. Developmental Biology. 307 (2), 248-257 (2007).
- Naganathan, S. R., Popovic, M., Oates, A. C. Left–right symmetry of zebrafish embryos requires somite surface tension. Nature. 605, 516-521 (2022).
- Campàs, O. A toolbox to explore the mechanics of living embryonic tissues. Seminars in Cell & Developmental Biology. 55, 119-130 (2016).
- Langenberg, T., Brand, M., Cooper, M. S. Imaging brain development and organogenesis in zebrafish using immobilized embryonic explants. Developmental Dynamics: An Official Publication of The American Association of Anatomists. 228 (3), 464-474 (2003).
- Henry, C. A., Poage, C. T., McCarthy, M. B., Campos-Ortega, J., Cooper, M. S. Regionally autonomous segmentation within zebrafish presomitic mesoderm. Zebrafish. 2 (1), 7-18 (2005).
- Picker, A., Roellig, D., Pourquié, O., Oates, A. C., Brand, M. Tissue micromanipulation in zebrafish embryos. Methods in Molecular Biology. 546, Clifton, N.J. 153-172 (2009).
- Manning, A. J., Kimelman, D. Tbx16 and Msgn1 are required to establish directional cell migration of zebrafish mesodermal progenitors. Developmental Biology. 406 (2), 172-185 (2015).
- Simsek, M. F., Özbudak, E. M. A 3-D Tail Explant Culture to Study Vertebrate Segmentation in Zebrafish. Journal of Visualized Experiments:JoVE. (172), e61981(2021).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Özkale, B., et al. Modular soft robotic microdevices for dexterous biomanipulation. Lab on a Chip. 19 (5), 778-788 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır