A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שיטה שלב אחר שלב לזיהוי נוגדנים מנטרלים נגד AAV באמצעות בדיקה מבוססת תאים צבעוניים
In This Article
Summary
תהליך עבודה מקיף של פרוטוקול מעבדה וניתוח מתוארים לבדיקה מהירה, חסכונית ופשוטה המבוססת על תאים צבעוניים כדי לזהות אלמנטים מנטרלים מול AAV6.
Abstract
וירוסים הקשורים אדנו רקומביננטי (rAAV) הוכיחו להיות וקטור בטוח ומוצלח להעברת חומר גנטי לטיפול במצבים בריאותיים שונים הן במעבדה והן במרפאה. עם זאת, נוגדנים מנטרלים קיימים (NAbs) נגד קפסידי AAV מהווים אתגר מתמשך לניהול מוצלח של טיפולים גנטיים הן במודלים ניסיוניים של בעלי חיים גדולים והן באוכלוסיות אנושיות. סינון ראשוני עבור חסינות מארח נגד AAV יש צורך להבטיח את היעילות של טיפולים גנטיים מבוססי AAV הן ככלי מחקר והן כסוכן טיפולי בר קיימא מבחינה קלינית. פרוטוקול זה מתאר בדיקת אין ויטרו צבעונית כדי לזהות גורמים מנטרלים מול סרוטיפ AAV 6 (AAV6). הבדיקה מנצלת את התגובה בין AAV קידוד גן פוספטאז אלקליין (AP) כתב ואת המצע שלה NBT / BCIP, אשר מייצר כתם סגול מסיס לכימות על שילוב.
בפרוטוקול זה, דגימות סרום משולבות עם AAV המביע AP ודגר כדי לאפשר פעילות נטרול פוטנציאלית להתרחש. תערובת סרום וירוס מתווסף לאחר מכן לתאים כדי לאפשר transduction ויראלי של כל AAVs שלא נוטרלו. מצע NBT/ BCIP מתווסף ועובר תגובה כרומוגנית, המתאימה לפעילות טרנסדוקציה ויראלית ונטרול. חלקו היחסי של האזור הצבעוני הוא כמות באמצעות כלי תוכנה חופשית כדי ליצור titers מנטרל. בדיקה זו מציגה מתאם חיובי חזק בין צבע לריכוז ויראלי. הערכת דגימות סרום מכבשים לפני ואחרי מתן AAV6 רקומביננטי הובילה לעלייה דרמטית בנטרול הפעילות (עלייה של פי 125 עד >10,000). הבדיקה הפגינה רגישות נאותה לזיהוי פעילות מנטרלת בדילול סרום >1:32,000. בדיקה זו מספקת שיטה פשוטה, מהירה וחסכונית לזיהוי NAbs נגד AAVs.
Introduction
וירוסים הקשורים אדנו (AAV) משמשים יותר ויותר וקטורים להעברת טיפולים גנטיים לטיפולים משפטיים עבור מצבים בריאותיים שונים המשפיעים על הלב וכלי הדם, הריאות, מחזור הדם, העין, ומערכות העצבים המרכזיות1,2,3,4,5. הפופולריות של וקטורים AAV כפלטפורמה מובילה לטיפול גנטי נובעת מפרופיל הבטיחות החיובי שלהם, ביטוי טרנסג'ן לטווח ארוך, וטרופיזם רחב היקף ספציפי לרקמות1,6. תוצאות מוצלחות במחקרים בבעלי חיים סללו את הדרך ליותר מחמישים ניסויים קליניים של טיפול גנטי AAV שהגיעו בהצלחה לנקודות הקצה של היעילות שלהם7, כמו גם את שחרורו של התרופה הראשונה לטיפול גנטי AAV הזמינה מסחרית שאושרה על ידי מינהל המזון והתרופות האמריקאי8. בעקבות ההצלחות הראשוניות, AAV המשיכה לצבור תאוצה במגזרי המחקר הבסיסיים והקליניים כווקטור בחירה וכיום היא היחידה בטיפול הגנטי של vivo שאושר לשימוש קליני בארה"ב ובאירופה9. עם זאת, נוכחותם של נוגדנים מנטרלים קיימים (NAbs) נגד קפסידים וקטוריים של AAV נותרה מכשול הן למחקר הפרה-קליני והן ליעילות הניסויים הקליניים. NAbs נמצאים הן באוכלוסיות אנושיות נאיביות והן באוכלוסיות בעלי חיים ומעכבים את העברת הגנים בעקבות ניהול vivo של וקטור AAV1. AAV seropositivity הוא קריטריון בלעדיה עבור רוב הניסויים בריפוי גנטי, ולכן סינון ראשוני עבור חסינות מארח הוא קריטי הן במעבדה והן במרפאה. הקמת בדיקה שיכולה לזהות את נוכחותם של NAbs נגד AAV היא צעד חיוני בצנרת של כל פרויקט מחקר מבוסס טיפול גנטי AAV. דו"ח זה מתמקד AAV6 אשר כבר עניין לחוקרים בשל transduction יעיל וסלקטיבי שלה שריר מפוספס (שריר הלב והשלד)1,10,10,11,12. ריפוי גנטי נחשב אסטרטגיה מבטיחה למיקוד הלב כי קשה למקד באופן ספציפי את הלב ללא הליכי לב פתוח פולשניים.
נטרול פעילות נקבע בדרך כלל באמצעות או אין ויטרו מבוסס תא או in vivo transduction עיכוב בדיקה. In vivo בדיקות NAb כוללות בדרך כלל מתן סרום מנושא ניסוי (למשל, אדם או בעל חיים גדול) לעכברים, ואחריו AAV עם גן עיתונאי, ואחריו בדיקות לביטוי של הגן העיתונאי או אנטיגן מתאים. בדיקות במבחנה לקבוע NAb titers על ידי דגירה סרום או פלזמה מבעל חיים אנושי או גדול בדילולים סדרתיים עם AAV רקומביננטי (rAAV) המבטא גן עיתונאי. תאים נגועים בתערובת הסרום/ וירוס, ואת המידה שבה ביטוי הגנים הכתב הוא מוערך לעומת פקדים. בדיקות הפריה חוץ גופית נמצאות בשימוש נרחב להקרנת NAb בשל העלות הנמוכה יחסית שלהן, מהירות הבדיקות ויכולת גדולה יותר לתקנון ולאימות13,14 בהשוואה לבדיקות vivo. בבדיקות vivo מדווחים לעתים קרובות יש רגישות רבה יותר 15,16, אבל אותה טענה הועלתה לגבי בדיקות במבחנה 14,17.
עד כה, אין ויטרו NAb assays השתמשו בעיקר אור (לוציפראז) כגן הכתב כדי לזהות נטרול. למרות שלשיטה מבוססת אור יש ערך בהקשרים רבים, בדיקת NAb צבעונית/כרומוגנית עשויה להיות יתרון בנסיבות מסוימות. בדיקות צבעוניות להערכת נטרול הועסקו בהצלחה עבור וירוסים אחרים כגון שפעת ואדנווירוס18,19. האטרקטיביות שלהם נובעת מהפשטות שלהם, העלות הנמוכה יותר, והדרישה למנגנוני מעבדה וכלים יומיומיים בלבד20. בדיקות NAb המשתמשות בגן עיתונאי מבוסס זוהר דורשות ערכות מצע יקרות, לומינומטר ותוכנה מתאימה לניתוח21. בדיקה צבעונית זו יש את היתרון של רק צורך מיקרוסקופ אור ומצע זול מאוד. דיווח על הרגישות של בדיקות צבע לעומת זוהרות הניב תוצאות סותרות. מחקר אחד הציע בדיקות ELISA מבוססות אור להציג רגישות רבה יותר ושחזור דומה לבדיקות צבע22, בעוד אחר מצא צבע מבוסס ELISA בדיקות להעניק רגישות רבה יותר23. כאן, פרוטוקול מפורט עבור בדיקת במבחנה NAb נגד AAV המשתמש בתגובה הכרומוגנית בין AAV קידוד פוספטאז אלקליין (AP) גן כתב טטרזוליום כחול ניטרו /5-bromo-4-כלורו-3-indolyl פוספט (NBT / BCIP) מסופק. פרוטוקול שלב אחר שלב זה פותח בהתבסס על דו"ח קודם שהשתמש בגן עיתונאי hPLAP (פוספטאז אלקליין שליה אנושית) (AAV6-hPLAP) כדי לזהות נטרול פעילות נגד AAV24. בדיקה זו היא חסכונית, חסכונית בזמן, קלה להתקנה, ודורשת מיומנויות טכניות מינימליות, ציוד מעבדה ורגנטים. יתר על כן, הפשטות של בדיקה זו נותנת לו את הפוטנציאל להיות ממוטב עבור יישומים רחבים על פני סוגים שונים של תאים, רקמות, או סרוטיפים ויראליים.
Protocol
כל ההיבטים של טיפול בבעלי חיים וניסויים נערכו בעקבות הנחיות מכון פלורי למדעי המוח ובריאות הנפש והקוד האוסטרלי לטיפול ושימוש בבעלי חיים למטרות מדעיות לאחר התייחסות25. מרינו ewes בן 1.5-3 שנים שימשו למחקר. סקירה סכמטית של פרוטוקול הבדיקה מסופקת באיור 1.
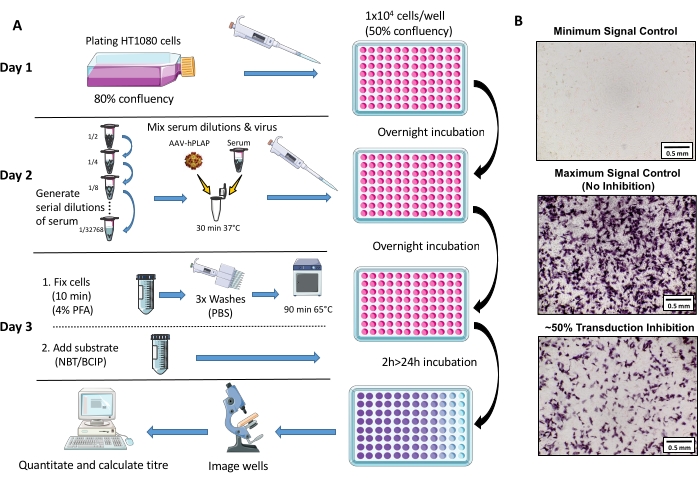
איור 1: דיאגרמה סכמטית של פרוטוקול בדיקת NAb. (א) ייצוג חזותי של בדיקת NAb הממחישה את השלבים העיקריים הכרוכים בפרוטוקול בן שלושת הימים. בקצרה, תאים גדלים מצופים בן לילה. למחרת, דילול סדרתי של סרום מוכנים, דגירה עם AAV, ולאחר מכן דגירה עם התאים לילה. למחרת, תאים קבועים, נשטפים, דוגרים, משולבים עם המצע, ומדגרים שוב, ואחריו הדמיה וכמות. (B) תמונות מייצגות של בקרת אות מינימלית (עיכוב AAV מלא), בקרת אות מקסימלית (ללא עיכוב), ודגימת סרום ביצית עם כ-50% עיכוב אות. סרגל קנה מידה = 0.5 מ"מ. נא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
1. הכנה ראשונית
- להערכה בכבשים: לאסוף דם בצינורות מפעיל קריש מ"ל מפריד סרום 8 מ"ל (ראה טבלת חומרים), להשאיר את דגימת הדם בטמפרטורת החדר (RT) במשך 20-30 דקות, ולאחר מכן לסובב למטה ב 2,100 x g במשך 15 דקות. הסופר-נרטיב הברור שנוצר בחלק העליון של הצינורות הוא סרום. Aliquot את השלב מימית ברור לתוך צינורות microcentrifuge ולאחסן ב -80 °C (80 °F).
הערה: הסרום בטמפרטורה של -80 °C נשאר יציב במשך ~ 5 שנים. דם נאסף מן הווריד התרדמה באמצעות מחט 16 G (קצה מנותק) ומזרק מבעלי חיים מודעים. - מחממים סרום בקר עוברי (FBS) מחממים אותו באמבט מים בטמפרטורה של 56 מעלות צלזיוס למשך 30 דקות ומסתובבים לסירוגין. ליתר דיוק, הניחו מדחום בבקבוק שני המכיל נפח מים שווה ערך והוסיפו אותו לאמבטיית החום באותו זמן כמו בקבוק ה- FBS. התחל תזמון כאשר המדחום מגיע 56 °C (56 °F).
- השתמש בטכניקה אספטית מתאימה ובתרגול תרבית תאים עבור כל השלבים הבאים שבוצעו במכסה המנוע של תרבית התאים26,27. יש לרסס 70% אתנול על כל החפצים ועל מכסה המנוע לפני השימוש ולנקות עם 1% נתרן היפוכלוריט בסיום.
- הפוך את מדיום הנשר המותאם (DMEM) של Dulbecco על ידי שילוב של גלוקוז גבוה (4.5 גרם / ליטר) DMEM (89%) עם FBS מושבת בחום (10%) וסטרפטומיצין פניצילין (1%). לשלב ולסנן באמצעות מערכת סינון ואקום סטרילית (גודל נקבוביות 0.22 מיקרומטר, קרום פוליאתרסלפפון) (ראה טבלת חומרים). יש לאחסן DMEM מלא עטוף בנייר כסף בטמפרטורה של 4 °C (60 °F).
- צור תאי HT1080 (ראה טבלת חומרים) ומעבר בבקבוק מרובע בגודל 75 ס"מ2 כמתואר בהפניה28. צור מלאי קפוא מרובה של תאים. אין להשתמש בתאים לאחר 20 קטעים, שכן מעבר נוסף עשוי להשפיע על תוצאות הבדיקה.
2. יום 1 - ציפוי תאים
- מעבר תאי HT1080 כאשר הם מגיעים ~ 80% מפגש.
- DMEM מלא מראש (מוכן בשלב 1.4), 0.05% טריפסין-EDTA, ו 1x תמיסת מלח חוצצת פוספט (PBS) עד 37 °C (37 °C (37 °F) באמבט מים. הסר את מדיום הצמיחה מתאים שעברו באמצעות מערכת שאיפה.
הערה: כל השאיפה בפרוטוקול זה משתמשת במערכת ואקום עם צינור המחובר לפיפטה סרולוגית סטרילית של 5 מ"ל. - לשטוף את התאים ב 10 מ"ל של טרום מחומם (37 °C) 1x PBS ו trypsinize תאים במשך 3-4 דקות ב 4 מ"ל של טרום מחומם 0.05% טריפסין-EDTA לנתק את התאים מן הבקבוק.
- להשבית את הטריפסין על ידי הוספת 6 מ"ל של DMEM מלא שחומם מראש ופיפטה התאים לתוך צינור 50 מ"ל. חשב את המספר והריכוז של תאים קיימא באמצעות hemocytometer ואת שיטת אי הכללה כחול טריפאן29.
- לדלל את התאים לריכוז של 1 x 105 תאים / מ"ל ב DMEM מלא שחומם מראש. זרע 100 μL של תאים / גם לתוך לוחות ברורים 96-well שטוח תחתית (1 x 104 תאים לבאר). לדגור על הצלחת ב 37 °C (5 °F), 5% דו תחמוצת הפחמן (CO2) לילה עבור 16-22 שעות.
3. יום 2 - הדבקת התאים
- הסר צלחת / s מן האינקובטור ולהשתמש מיקרוסקופ אור כדי לאשר כי תאים מפוזרים באופן שווה בתוך הבארות וכי המפגש הוא ~ 50%. אם תאים אינם בטווח של 45%-55% מפגש, חזור על פרוטוקול 'יום 1' והתאם את ריכוז התא ההתחלתי בהתאם.
- צור דילול סדרתי של דגימות סרום של עניין בצינורות microcentrifuge 1.5 מ"ל באמצעות DMEM מלא שחומם מראש כמו דילול. טבלה 1 מדגימה את היצירה של מפל דילול עבור דוגמאות משולשות.
- כדי לבצע את הבדיקה בשלושה עותקים, הכן 7.5 x 106 גנומים וקטוריים (vg)/μL של פתרון עבודה של AAV6-hPLAP (ראה טבלת חומרים) על-ידי דילול פתרון מלאי וירוסים ב- 1x PBS.
- הוסף 66 μL של 7.5 x 106 vg / μL וירוס עובד פתרון לכל צינור המכיל 264 μL של סרום / דילול מדיה (330 μL של נפח הכולל / דילול, ראה טבלה 1).
הערה: זוהי בדיקה חזקה שאינה דורשת תנאי תרבות מושלמים. עם זאת, כדי לחשב במדויק ולהבטיח שכל ריצת בדיקה אמינה, יש צורך לכלול את הדברים הבאים: (1) בקרת וירוס ומדיה בלבד, (2) בקרת מדיה בלבד, ו-(3) דגימת בקרה חיובית של NAb על כל הלוחות באותם תנאי ניסוי. הנפח המתואר (330 μL) מהווה דגימות משולשות +10% מתערובת הסרום והוירוסים. ביצוע שכפולים מומלץ מאוד לקביעה מדויקת של נטרול פעילות.
- מערבבים את דילול הנגיף/סרום על ידי צנרת ומניחים את הצינורות המכילים את תערובות הנגיף / סרום בחממה ב 37 °C (57 °F), 5% CO2 במשך 30 דקות כדי לאפשר נטרול פוטנציאלי להתרחש.
- Pipette 100 μL של תערובת וירוס / סרום לכל באר על צלחת 96-well המכיל 1 x 104 תאים / טוב עבור כל דילול.
הערה: זה ייצור ריכוז ויראלי סופי של וירוסים 15k / ריבוי תאים של זיהום (MOI) בכל באר. טבלה 2 מספקת פריסת לוח מדגם לדוגמה של 96 באר לדוגמה להערכת דוגמאות לדילול של 1/512. - עוטפים את הצלחת המכילה תאים, סרום ו-AAV-hPLAP בנייר כסף ומניחים באינקובטור ב-37°C, 5% CO2 במהלך הלילה למשך 16-24 שעות כדי לאפשר כניסת AAV לתאים.
| תווית מדורגת דילול | דילול | 3 x מדגם (240 μL) + 10% נפח מאגר (24 μL) | יחס סרום:מדיה |
| דילול 1 (D1) | 1/2 | 264 μL סרום 264 μL מדיה | 50:50 |
| דילול 2 (D2) | 1/4 | 264 μL D1 + 264 μL מדיה | 25:75 |
| דילול 3 (D3) | 1/8 | 264 μL D2 +264μL מדיה | 12.5:87.5 |
| דילול 4 (D4) | 1/16 | 264 μL D3 +264 μL מדיה | 6.25:93.75 |
| דילול 5 (D5) | 1/32 | 264 μL D4 +264 μL מדיה | 3.13:96.87 |
| דילול 6 (D6) | 1/64 | 264 μL D5 +264 μL מדיה | 1.56:98.44 |
| דילול 7 (D7) | 1/128 | 264 μL D5 +264 μL מדיה | 0.78:99.22 |
| דילול 8 (D8) | 1/256 | 264 μL D5 +264 μL מדיה | 0.39:99.61 |
| דילול 9 (D9) | 1/512 | 264 μL D7 + 264 μL מדיה | 0.2:99.8 |
| דילול 10 (D10) | 1/2048 | 132 μL D8 + 396 μL מדיה | 0.05:99.95 |
| דילול 11 (D11) | 1/8192 | 132 μL D9 + 396 μL מדיה | 0.01:99.99 |
| דילול 12 (D12) | 1/32768 | 132 μL D10 + 396 μL מדיה | 0.003:99.997 |
טבלה 1: כמויות של סרום ודילול נדרשים כדי ליצור דילול סדרתי של סרום בשלושה עותקים.
| דגימת סרום מס' 1 | דגימת סרום מס' 2 | דגימת סרום מס' 3 | מונו AB (mAB), פקדים ודגימות נוספות | |||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
| A | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 50 ננוגרם של MAb | 50 ננוגרם של MAb | 50 ננוגרם של MAb |
| B | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 5 ננוגרם MAb | 5 ננוגרם MAb | 5 ננוגרם MAb |
| C | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 0.5 ng MAb | 0.5 ng MAb | 0.5 ng MAb |
| D | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | MO (-C) | MO (-C) | MO (-C) |
| E | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | VO (+C) | VO (+C) | VO (+C) |
| F | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | דוגמה מס' 1 1/512 | דוגמה מס' 1 1/512 | דוגמה מס' 1 1/512 |
| G | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | מדגם מס' 2 1/512 | מדגם מס' 2 1/512 | מדגם מס' 2 1/512 |
| H | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | מדגם מס' 3 1/512 | מדגם מס' 3 1/512 | מדגם מס' 3 1/512 |
טבלה 2: פריסת צלחת דוגמה של 96 באר להערכת דגימות סרום נאיביות בדילולים הנעים בין 1/2 ל-1/512. דילולים גבוהים יותר משולבים בבדיקה אם מעריכים מדגם הידוע כחיובי עבור AAV NAbs (דגימות לאחר מתן ניהול) או אם נדרש טיטר גבוה יותר. MO (-C): בקרת מדיה בלבד. VO (+C): שליטה בווירוסים ומדיה בלבד. mAb: נוגדן חד שבטי נגד AAV (שליטה חיובית NAb).
4. יום 3 - תיקון והוספת מצע לתאים
- מחממים מראש aliquot של 1x PBS עד 37 °C (~ 25 מ"ל / 96 -צלחת היטב). צלחת מגניבה ונפרדת של PBS (כ-25 מ"ל/96-well) ו-H2O מזוקק כפול (DDW, כ-25 מ"ל/96-well plate) עד 4 °C (4 °F). להמיס גלולה של BCIP / NBT (ראה טבלת חומרים) ב 10 מ"ל של DDW בצינור צנטריפוגה חרוטי 50 מ"ל על ידי מערבולת (10 מ"ל מספיק עבור 2 x 96 לוחות באר).
- שאפו את המדיה מהבארות של צלחת 96 באר באמצעות פיפטה סרולוגית או דומה מחובר למערכת שאיפה מבוססת יניקה או ואקום מכסה המנוע אדים. מניחים בעדינות את קצה הפיפטה הסרולוגית לתוך הבאר ומסירים את המדיה תוך זהירות שלא לשבש את התאים הדבוקים.
- הוסף 50 μL של RT 4% PFA לכל באר באמצעות פיפטה. לעטוף את הצלחת בנייר כסף ולהשאיר אותו ב RT במשך 10 דקות כדי לתקן את התאים.
אזהרה: Paraformaldehyde (PFA) הוא מסרטן סביר והוא רעיל מקשר עור או עין או שאיפה. יש לטפל במכסה המנוע של אדים עם ציוד מגן אישי מתאים ומסכת פנים. הפוך טרי 4% PFA מדולל PBS (~ 7 מ"ל נדרש לכל צלחת 96-well).
- הוסף 50 μL של RT 4% PFA לכל באר באמצעות פיפטה. לעטוף את הצלחת בנייר כסף ולהשאיר אותו ב RT במשך 10 דקות כדי לתקן את התאים.
- לשטוף ולשאוף את התאים עם 200 μL של RT 1x PBS. חזור על שלב זה פעמיים.
הערה: פיפטה רב-ערוצית היא אפשרות יעילה לשלבי הצנרת. - Pipette 200 μL של PBS שחומם מראש לתוך כל באר, לעטוף את הצלחת בנייר כסף ודגור ב 65 °C (65 °F) במשך 90 דקות כדי denature פעילות פוספטאז אלקליין אנדוגני30.
- שאיפה בארות ולשטוף תאים עם 200 μL של קור (4 °C )) PBS. לשאוף שוב, לשטוף ב 200 μl של DDW קר, ולשאוף שוב.
- פיפטה 50 μL של BCIP / NBT מומס (מוכן בשלב 4.1) לתוך כל באר.
- עוטפים את הצלחת בנייר כסף ודגורים ב-RT למשך 2-24 שעות.
הערה: להיות עקבי עם זמן הדגירה בין ריצות; גמישות הזמן מאפשרת למשתמשים לצלם בארות ביום 3 או למחרת. - באמצעות מצלמת מיקרוסקופ אור, צלם תמונות של כל באר באמצעות עדשה אובייקטיבית של 4x, מה שמבטיח שאותה חשיפה, איזון לבן והגדרות אור ישמשו באופן עקבי עבור כל הבדיקות המבוצעות.
- מקם כל באר באופן זהה וודא ששולי הבאר אינם נראים בתמונות. שמור תמונות בתבנית TIF או דומה.
הערה: הגדרות ספציפיות ישתנו בין מיקרוסקופים, אך הכמות תהיה היעילה ביותר אם תאורת הרקע גבוהה ועקבית בכל הבארות (איור 1B).
- מקם כל באר באופן זהה וודא ששולי הבאר אינם נראים בתמונות. שמור תמונות בתבנית TIF או דומה.
5. כמות לקביעת הפעילות המנטרלת באמצעות ImageJ
- הורד והתקן את התוכנה הזמינה באופן חופשי "ImageJ" (ראה טבלת חומרים).
- פתחו את התמונה לניתוח ב-ImageJ על-ידי בחירה באפשרות 'קובץ > פתוח' (איור 2).
- בשעת שימוש בתמונות צבעוניות, המר לגווני אפור על-ידי בחירה באפשרות 'תמונה' > 'אות' > 8 סיביות.
- לחץ על תמונה > התאם סף >. התאם את הסף עד שכל האזורים הצבעוניים ייצבעו באדום, אך הרקע לא. עם הוספת NBT / BCIP, המוצר הצבעוני יופקד באזור סביב התאים המבטאים hPLAP.
הערה: מומלץ להשתמש באותה הגדרת סף עבור כל התמונות שצולמו באותה צלחת. - לחץ על נתח > הגדר מדידות וסמן את תיבות הסימון אזור, הגבל לסף, שבר שטח והצג תוויות ולחץ על אישור.
- כדי לקבוע את קריאת האות (אחוז הצבע) של באר נתונה, לחץ על נתח > למדוד. העמודה '% אזור' בחלון המוקפץ מציגה את קריאת האות.
- בצע כמות עבור כל העותקים המשוכפלים לדוגמה. אל תכלול בארות מזוהמות, בארות המציגות התפלגות תאים לא אחידה, או בארות המשתנות בצפיפות התא או בתאורה.
הערה: ראה איור משלים 1 לקבלת דוגמאות של בארות שיש לשקול להחרגה. בדרך כלל, 3-4 בארות עשויות לדרוש הרחקה מצלחת של 96 בארות. איור 2 מספק ייצוג חזותי של תהליך הכמויות באמצעות ImageJ.
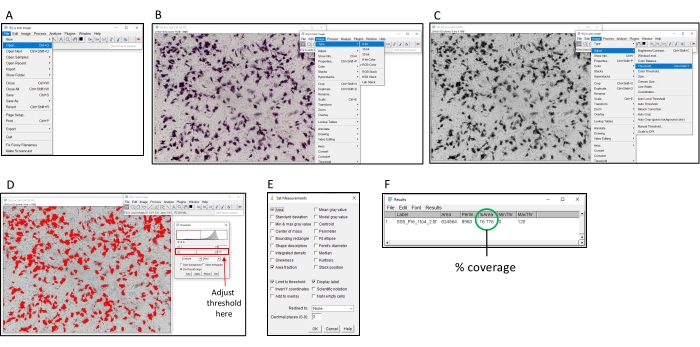
איור 2: שלבים לקביעת צביעת אחוזים באמצעות תוכנת ImageJ. (א) פתח את התמונה לניתוח באמצעות תוכנת ImageJ. (B) המר את התמונה לגווני אפור של 8 סיביות. (ג) פתח את חלון הסף. (D) התאם את הסף המרבי כך שכל האזורים הצבעוניים מכוסים, אך אזור הרקע אינו (סף זה צריך להיות עקבי על-פני לוח שלם). (ה) בחר את תיבת הטיפות 'ניתוח', לחץ על 'הגדר מדידות' וסמן 'אזור', 'שבר שטח', 'סף הגבלה' ו'תווית תצוגה', ולחץ על 'אישור'. (ו) לחץ על 'מדידה' כדי למדוד את האזור המקורה. האזור %מציין את חלקה היחסי של התמונה שנצבעה. לאחר מכן ניתן להשתמש באפשרות זו עם דוגמאות הבקרה כדי לקבוע את טיטר TI50 . לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
6. קביעת עיכוב טרנסדוקציה (TI50) טיטר
- קבע את הקריאה הממוצעת ממשכפלים (באמצעות השלבים המתוארים בשלב 5) עבור הפריטים הבאים: (1) פקד מדיה בלבד (קריאת אות בסיסית). (2) וירוס + בקרת מדיה בלבד (קריאת אותות מקסימלית). (3) וירוס + דגימות סרום של עניין.
- חשב את אחוז העיכוב באמצעות הנוסחה הבאה:
100 - [(בדיקת קריאת אות מדגם מדגם (וירוס + מדגם סרום של עניין) - קריאת אות בסיסית (בקרת מדיה בלבד)) / (קריאת אות מקסימלית (מדיה ווירוס בלבד) - קריאת אות בסיסית) x 100] = % עיכוב Transduction13. - חשב את עיכוב התמרת % מכל השכפולים של כל דילול עבור כל הדגימות באמצעות הנוסחה ב- 6.2. לקבוע את עיכוב transduction הממוצע בין העתקים טכניים עבור כל דילול עבור כל הדגימות והפקדים.
- חשב את 50% עיכוב transduction עיכוב titer (TI50 titer) של מדגם של עניין על ידי קביעת הדילול הנמוך ביותר של המדגם המניב 50% או יותר עיכוב transduction של פעילות hPLAP. לדוגמה, אם דילול של 1/8 של מדגם יש יותר מ 50% עיכוב transduction בהתבסס על החישוב שבוצע ב 6.2 (ודילול 1/4 לא), לדווח על Titer TI50 כמו 1/8.
7. קביעת חלקיקי AAV מנוטרלים
- חשב את מספר חלקיקי AAV מנוטרלים לכל μL של סרום עבור מדגם נתון על ידי שימוש בנוסחה הבאה:
((MOI x ספירת תאים/טוב) / (נפח של סרום / גורם דילול של TI50 titer)) / 2 = חלקיקי AAV מנוטרלים / μL של סרום9.
הערה: חלוקה ב- 2 חשבונות עבור TI50 המודד 50% מהחלקיקים המנוטרלים. עבור מדגם שנותן TI50 titer של 1/4 (25% סרום, 75% דילול) שבו הבדיקה השתמשה 80 μL של סרום לא מדולל MOI של 15k מצופה על 1 x 104 תאים, החישוב הבא ישמש: ((15000 x 10000) / (80/4)) / 2 = 3.75x106 חלקיקים מנוטרלים / μL של סרום.
תוצאות
בדיקת Transduction כדי לקבוע את המינון הנגיפי האופטימלי לכיסוי צלחת
תאי HT1080, קו תאי פיברוסרקומה מבוסס היטב, נבחרו לבדיקה זו. ריכוז של 1 x 104 HT1080 תאים / היטב סיפק ~ 50% מפגש תאים בכל באר של צלחת 96-well. כדי לקבוע את הריכוז הנגיפי האופטימלי עבור הבדיקה, rAAV קידוד hPLAP (פוספטאז אלקליין שליה אנו...
Discussion
דו"ח זה מתאר בדיקה צבעונית המעריכת את מידת נטרול AAV במדגם סרום נתון על ידי הערכת תגובה כרומוגנית המתאימה למידת התמרת הנגיף במבחנה. פיתוח הפרוטוקול התבסס על התגובה הכרומוגנית הידועה בין האנזים פוספטאז אלקליין לבין NBT/BCIP, אשר נעשה בו שימוש נרחב ככלי מכתים לאיתור מטרות חלבון ביישומים כגו...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
מחקר זה מומן על ידי מענק פרויקט המועצה הלאומית לבריאות ולמחקר רפואי ל- JRM ו- CJT (ID 1163732) ובחלקו על ידי תוכנית התמיכה בתשתיות תפעוליות של ממשלת ויקטוריה. SB נתמך על ידי מכון בייקר לב וסוכרת משותף-מלגת הדוקטורט של אוניברסיטת לה טרובה. KLW נתמכת על ידי קרן Shine On ומלגת מנהיג עתידית מקרן הלב הלאומית של אוסטרליה (ID 102539). JRM נתמך על ידי מלגת מחקר בכירה של המועצה הלאומית לבריאות ולמחקר רפואי (ID 1078985).
Materials
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin/EDTA | Gibco | 25300-054 | |
| 50 mL conical centrifuge tube | Falcon | 14-432-22 | Or equivalent |
| 75 cm2 square flasks | Falcon | 353136 | Or equivalent |
| 96 well flat bottomed plate | Falcon | 353072 | |
| AAV6-CMV-hPLAP Vector | Muscle Research & Therapeutics Lab (University of Melbourne, Australia) AAV6-CMV-hPLAP can be provided upon request. | ||
| Aluminium foil | |||
| Anti-AAV6 (intact particle) mouse monoclonal antibody, (ADK6) | PROGEN | 610159 | Positive control monoclonal antibody |
| BCIP/NBT | SIGMAFAST | B5655 | |
| Cell and tissue culture safety cabinet | |||
| Electronic Pipette | 5 & 10 mL stripette inserts | ||
| Fetal Bovine Serum | Gibco | 10099-141 | |
| Haemocytometer | |||
| High glucose Dulbecco's Modified Eagle Medium (DMEM) | Gibco | 11965118 | |
| HT1080 cells | ATCC | ||
| ImageJ Software | Freely available: https://imagej.nih.gov/ij/download.html | ||
| Incubator | 37 °C, 5% CO2 | ||
| Light microscope with camera | Capable of taking photos with a 4x objective lens | ||
| Oven | For a 65 °C incubation | ||
| Paraformaldehyde | MERCK | 30525-89-4 | |
| Penicillin Streptomycin | Gibco | 15140-122 | |
| Phosphate buffered saline | |||
| Pipettes and tips | 20 μL, 200 μL & 1 mL single pipettes and tips & 200 μL multichannel pipette | ||
| Stericup quick release filter | Millipore | S2GPU10RE | Used for combining media reagents |
| Trypan blue solution | Sigma-Aldrich | T8154 | |
| VACUETTE TUBE 8 ml CAT Serum Separator Clot Activator | Greiner BIO-ONE | 455071 | Used for serum collection & processing from sheep |
| Water bath |
References
- Bass-Stringer, S., et al. Adeno-associated virus gene therapy: Translational progress and future prospects in the treatment of heart failure. Heart, Lung and Circulation. 27 (11), 1285-1300 (2018).
- Casey, G. A., Papp, K. M., MacDonald, I. M. Ocular gene therapy with adeno-associated virus vectors: current outlook for patients and researchers. Journal of Ophthalmic and Vision Research. 15 (3), 396-399 (2020).
- Lykken, E. A., Shyng, C., Edwards, R. J., Rozenberg, A., Gray, S. J. Recent progress and considerations for AAV gene therapies targeting the central nervous system. Journal of Neurodevelopmental Disorders. 10 (1), 16 (2018).
- Guggino, W. B., Cebotaru, L. Adeno-Associated Virus (AAV) gene therapy for cystic fibrosis: Current barriers and recent developments. Expert Opinion on Biological Therapy. 17 (10), 1265-1273 (2017).
- Perrin, G. Q., Herzog, R. W., Markusic, D. M. Update on clinical gene therapy for hemophilia. Blood. 133 (5), 407-414 (2019).
- Wang, D., Tai, P. W. L., Gao, G. Adeno-associated virus vector as a platform for gene therapy delivery. Nature Reviews Drug Discovery. 18 (5), 358-378 (2019).
- Kuzmin, D. A., et al. The clinical landscape for AAV gene therapies. Nature Reviews Drug Discovery. 20 (3), 173-174 (2021).
- Russell, S., et al. Efficacy and safety of voretigene neparvovec (AAV2-hRPE65v2) in patients with RPE65-mediated inherited retinal dystrophy: A randomised, controlled, open-label, phase 3 trial. Lancet. 390 (10097), 849-860 (2017).
- Weber, T. Anti-AAV Antibodies in AAV gene therapy: Current challenges and possible solutions. Frontiers in Immunology. 12, 658399 (2021).
- Weeks, K. L., et al. Phosphoinositide 3-kinase p110alpha is a master regulator of exercise-induced cardioprotection and PI3K gene therapy rescues cardiac dysfunction. Circulation: Heart Failure. 5 (4), 523-534 (2012).
- Gregorevic, P., et al. Systemic delivery of genes to striated muscles using adeno-associated viral vectors. Nature Medicine. 10 (8), 828-834 (2004).
- Bernardo, B. C., et al. Gene delivery of medium chain acyl-coenzyme A dehydrogenase induces physiological cardiac hypertrophy and protects against pathological remodelling. Clinical Science (London). 132 (3), 381-397 (2018).
- Meliani, A., et al. Determination of anti-adeno-associated virus vector neutralizing antibody titer with an in vitro reporter system. Human Gene Therapy Methods. 26 (2), 45-53 (2015).
- Falese, L., et al. Strategy to detect pre-existing immunity to AAV gene therapy. Gene Therapy. 24 (12), 768-778 (2017).
- Wang, D., et al. Adeno-Associated virus neutralizing antibodies in large animals and their impact on brain intraparenchymal gene transfer. Molecular Therapy - Methods & Clinical Development. 11, 65-72 (2018).
- Wang, M., et al. Prediction of adeno-associated virus neutralizing antibody activity for clinical application. Gene Therapy. 22 (12), 984-992 (2015).
- Kruzik, A., et al. Detection of biologically relevant low-titer neutralizing antibodies against adeno-associated virus require sensitive in vitro assays. Human Gene Therapy Methods. 30 (2), 35-43 (2019).
- Lehtoranta, L., Villberg, A., Santanen, R., Ziegler, T. A novel, colorimetric neutralization assay for measuring antibodies to influenza viruses. Journal of Virological Methods. 159 (2), 271-276 (2009).
- Johnston, P. B., Grayston, J. T., Loosli, C. G. Adenovirus neutralizing antibody determination by colorimetric assay. Proceedings of the Society for Experimental Biology and Medicine. 94 (2), 338-343 (1957).
- Xiaoli Zhu, T. G. . Nano-Inspired Biosensors for Protein Assay with Clinical Applications. , 237-264 (2019).
- Jungmann, A., Muller, O., Rapti, K. Cell-based measurement of neutralizing antibodies against adeno-associated virus (AAV). Methods in Molecular Biology. 1521, 109-126 (2017).
- Samineni, S., et al. Optimization, comparison, and application of colorimetric vs. chemiluminescence based indirect sandwich ELISA for measurement of human IL-23. Journal of Immunoassay and Immunochemistry. 27 (2), 183-193 (2006).
- Siddiqui, J., Remick, D. G. Improved sensitivity of colorimetric compared to chemiluminescence ELISAs for cytokine assays. Journal of Immunoassay and Immunochemistry. 24 (3), 273-283 (2003).
- Arnett, A. L., Garikipati, D., Wang, Z., Tapscott, S., Chamberlain, J. S. Immune responses to rAAV6: The Influence of canine parvovirus vaccination and neonatal administration of viral vector. Frontiers in Microbiology. 2, 220 (2011).
- Australian code for the care and use of animals for scientific purposes. National Health and Medical Research Council Available from: https://www.nhmrc.gov.au/about-us/publications/australian-code-care-and-use-animals-scientific-purposes (2013)
- Coecke, S., et al. Guidance on good cell culture practice. A report of the second ECVAM task force on good cell culture practice. Alternatives to Laboratory Animals. 33 (3), 261-287 (2005).
- Journal of Visualized Experiments. General Laboratory Techniques. Journal of Visualized Experiments Database. , (2018).
- AAV-HT1080 Cells. Stratagene Available from: https://www.chem-agilent.com/pdf/strata/240109.pdf (2003)
- Strober, W. Trypan blue exclusion test of cell viability. Current Protocols in Immunology. 111 (3), 1-3 (2015).
- Bieber, S., et al. Extracorporeal delivery of rAAV with metabolic exchange and oxygenation. Scientific Reports. 3, 1538 (2013).
- Winbanks, C. E., Beyer, C., Qian, H., Gregorevic, P. Transduction of skeletal muscles with common reporter genes can promote muscle fiber degeneration and inflammation. PLoS One. 7 (12), 51627 (2012).
- Thomas, C. J., et al. Evidence that the MEK/ERK but not the PI3K/Akt pathway is required for protection from myocardial ischemia-reperfusion injury by 3',4'-dihydroxyflavonol. European Journal of Pharmacology. 758, 53-59 (2015).
- Barger, A., et al. Use of alkaline phosphatase staining to differentiate canine osteosarcoma from other vimentin-positive tumors. Veterinary Pathology. 42 (2), 161-165 (2005).
- Gregorevic, P., et al. Evaluation of vascular delivery methodologies to enhance rAAV6-mediated gene transfer to canine striated musculature. Molecular Therapy. 17 (8), 1427-1433 (2009).
- Sharma, A., Ghosh, A., Hansen, E. T., Newman, J. M., Mohan, R. R. Transduction efficiency of AAV 2/6, 2/8 and 2/9 vectors for delivering genes in human corneal fibroblasts. Brain Research Bulletin. 81 (2-3), 273-278 (2010).
- Smejkal, G. B., Kaul, C. A. Stability of nitroblue tetrazolium-based alkaline phosphatase substrates. Journal of Histochemistry & Cytochemistry. 49 (9), 1189-1190 (2001).
- Falese, L., et al. Strategy to detect pre-existing immunity to AAV gene therapy. Gene Therapy. 24 (12), 768-778 (2017).
- Orlowski, A., et al. Successful transduction with AAV Vectors after selective depletion of anti-aav antibodies by immunoadsorption. Molecular Therapy - Methods & Clinical Development. 16, 192-203 (2020).
- Goossens, K., et al. Differential microRNA expression analysis in blastocysts by whole mount in situ hybridization and reverse transcription quantitative polymerase chain reaction on laser capture microdissection samples. Analytical Biochemistry. 423 (1), 93-101 (2012).
- Entrican, G., Wattegedera, S. R., Griffiths, D. J. Exploiting ovine immunology to improve the relevance of biomedical models. Molecular Immunology. 66 (1), 68-77 (2015).
- Walters, E. M., Prather, R. S. Advancing swine models for human health and diseases. Molecular Medicine. 110 (3), 212-215 (2013).
- Rapti, K., et al. Neutralizing antibodies against AAV serotypes 1, 2, 6, and 9 in sera of commonly used animal models. Molecular Therapy. 20 (1), 73-83 (2012).
- Tellez, J., et al. Characterization of naturally-occurring humoral immunity to AAV in sheep. PLoS One. 8 (9), 75142 (2013).
- Gupta, S., et al. Recommendations for the validation of cell-based assays used for the detection of neutralizing antibody immune responses elicited against biological therapeutics. Journal of Pharmaceutical and Biomedical Analysis. 55 (5), 878-888 (2011).
- Gupta, S., et al. Recommendations for the design, optimization, and qualification of cell-based assays used for the detection of neutralizing antibody responses elicited to biological therapeutics. Journal of Immunological Methods. 321 (1-2), 1-18 (2007).
- Shankar, G., et al. Recommendations for the validation of immunoassays used for detection of host antibodies against biotechnology products. Journal of Pharmaceutical and Biomedical Analysis. 48 (5), 1267-1281 (2008).
- U.S. Department of Health and Human Services Food and Drug Administration. Center for Drug Evaluation and Research (CDER). Immunogenicity Testing of Therapeutic Protein Products — Developing and Validating Assays for Anti-Drug Antibody Detection. U.S. Department of Health and Human Services Food and Drug Administration. , (2019).
- Baatartsogt, N., et al. A sensitive and reproducible cell-based assay via secNanoLuc to detect neutralizing antibody against adeno-associated virus vector capsid. Molecular Therapy - Methods & Clinical Development. 22, 162-171 (2021).
- Watano, R., Ohmori, T., Hishikawa, S., Sakata, A., Mizukami, H. Utility of micro mini pigs for evaluating liver-mediated gene expression in the presence of neutralizing antibody against vector capsid. Gene Therapy. 27 (9), 427-434 (2020).
- Majowicz, A., et al. Therapeutic hFIX activity achieved after single AAV5-hFIX treatment in Hemophilia B patients and NHPs with pre-existing anti-AAV5 NABs. Molecular Therapy - Methods & Clinical Development. 14, 27-36 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved