È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un metodo passo-passo per rilevare gli anticorpi neutralizzanti contro l'AAV utilizzando un test colorimetrico basato su cellule
In questo articolo
Riepilogo
Un protocollo di laboratorio completo e un flusso di lavoro di analisi sono descritti per un test colorimetrico basato su cellule rapido, economico e semplice per rilevare elementi neutralizzanti rispetto ad AAV6.
Abstract
I virus adeno-associati ricombinanti (rAAV) hanno dimostrato di essere un vettore sicuro e di successo per il trasferimento di materiale genetico per il trattamento di varie condizioni di salute sia in laboratorio che in clinica. Tuttavia, gli anticorpi neutralizzanti preesistenti (NAbs) contro i capsidi AAV rappresentano una sfida continua per la somministrazione di successo delle terapie geniche sia in modelli sperimentali su grandi animali che in popolazioni umane. Lo screening preliminare per l'immunità dell'ospite contro l'AAV è necessario per garantire l'efficacia delle terapie geniche basate su AAV sia come strumento di ricerca che come agente terapeutico clinicamente valido. Questo protocollo descrive un test colorimetrico in vitro per rilevare fattori neutralizzanti contro il sierotipo 6 AAV (AAV6). Il test utilizza la reazione tra un AAV che codifica per un gene reporter della fosfatasi alcalina (AP) e il suo substrato NBT / BCIP, che genera una macchia viola quantificabile insolubile sulla combinazione.
In questo protocollo, i campioni di siero sono combinati con un AP che esprime AAV e incubati per consentire il verificarsi di una potenziale attività neutralizzante. La miscela di siero virale viene successivamente aggiunta alle cellule per consentire la trasduzione virale di eventuali AAV che non sono stati neutralizzati. Il substrato NBT/BCIP viene aggiunto e subisce una reazione cromogenica, corrispondente alla trasduzione virale e all'attività neutralizzante. La proporzione di area colorata viene quantificata utilizzando uno strumento software libero per generare titoli neutralizzanti. Questo test mostra una forte correlazione positiva tra colorazione e concentrazione virale. La valutazione di campioni di siero di pecora prima e dopo la somministrazione di un AAV6 ricombinante ha portato ad un drammatico aumento dell'attività neutralizzante (da 125 a >10.000 volte). Il test ha mostrato un'adeguata sensibilità per rilevare l'attività neutralizzante in >1:32.000 diluizioni sieriche. Questo test fornisce un metodo semplice, rapido ed economico per rilevare nAbs contro AAV.
Introduzione
I virus adeno-associati (AAV) sono sempre più utilizzati come vettori per la somministrazione di terapie geniche a trattamenti sperimentali per varie condizioni di salute che hanno un impatto sul sistema cardiovascolare, polmonare, circolatorio, oculare e nervoso centrale1,2,3,4,5. La popolarità dei vettori AAV come piattaforma leader nella terapia genica deriva dal loro profilo di sicurezza positivo, dall'espressione transgenica a lungo termine e dai trofismi tessuto-specifici ad ampio raggio1,6. I risultati positivi negli studi sugli animali hanno spianato la strada a oltre cinquanta studi clinici di terapia genica AAV che hanno raggiunto con successo i loro endpoint di efficacia7, nonché al rilascio del primo farmaco per la terapia genica AAV disponibile in commercio approvato dalla Food and Drug Administration degli Stati Uniti8. Dopo i successi iniziali, AAV ha continuato a guadagnare terreno nei settori della ricerca di base e clinica come vettore di scelta ed è attualmente l'unica terapia genica in vivo approvata per uso clinico negli Stati Uniti e in Europa9. Tuttavia, la presenza di anticorpi neutralizzanti preesistenti (NAbs) contro i capsidi vettori AAV rimane un ostacolo sia alla ricerca preclinica che all'efficacia degli studi clinici. I NAb sono presenti sia in popolazioni naïve umane che animali e inibiscono la trasduzione genica a seguito della somministrazione in vivo di un vettore AAV1. La sieropositività AAV è un criterio di esclusione per la maggior parte degli studi di terapia genica e pertanto lo screening preliminare per l'immunità dell'ospite è cruciale sia in laboratorio che in clinica. Stabilire un test in grado di rilevare la presenza di NAbs contro AAV è un passo essenziale nella pipeline di qualsiasi progetto di ricerca basato sulla terapia genica AAV. Questo rapporto si concentra su AAV6 che è stato di interesse per i ricercatori grazie alla sua trasduzione efficiente e selettiva nel muscolo striato (cuore e muscolo scheletrico)1,10,11,12. La terapia genica è considerata una strategia promettente per il targeting del cuore perché è difficile indirizzare specificamente il cuore senza procedure invasive a cuore aperto.
L'attività neutralizzante viene solitamente determinata utilizzando un test di inibizione della trasduzione in vitro o in vivo basato su cellule. In vivo I saggi NAb di solito comportano la somministrazione di siero da un soggetto del test (ad esempio, umano o animale di grandi dimensioni) nei topi, seguito da un AAV con un gene reporter, seguito da test per l'espressione del gene reporter o dell'antigene corrispondente. I saggi in vitro determinano i titoli di NAb incubando siero o plasma da un essere umano o da un grande animale in diluizioni seriali con un AAV ricombinante (rAAV) che esprime un gene reporter. Le cellule sono infettate dalla miscela siero/virus e la misura in cui l'espressione genica reporter è inibita viene valutata rispetto ai controlli. I saggi in vitro sono ampiamente utilizzati per lo screening NAb a causa del loro costo relativamente inferiore, della rapidità nei test e della maggiore capacità di standardizzazione e convalida13,14 rispetto ai saggi in vivo. I saggi in vivo sono spesso segnalati per avere una maggiore sensibilità15,16, ma la stessa affermazione è stata fatta per quanto riguarda i saggi in vitro14,17.
Ad oggi, i saggi NAb in vitro hanno utilizzato principalmente la luminescenza (luciferasi) come gene reporter per rilevare la neutralizzazione. Sebbene un metodo basato sulla luce abbia meriti in molti contesti, un test NAb colorimetrico / cromogenico può essere vantaggioso in alcune circostanze. Saggi colorimetrici per valutare la neutralizzazione sono stati impiegati con successo per altri virus come l'influenza e l'adenovirus18,19. La loro attrattiva deriva dalla loro semplicità, dal costo inferiore e dalla necessità di utilizzare solo apparecchiature e strumenti di laboratorio di uso quotidiano20. I saggi NAb che utilizzano un gene reporter basato sulla luminescenza richiedono costosi kit di substrato, un luminometro e un software corrispondente per l'analisi21. Questo test colorimetrico ha il vantaggio di richiedere solo un microscopio ottico e un substrato molto economico. La segnalazione della sensibilità dei saggi colorimetrici rispetto a quelli luminescenti ha prodotto risultati contrastanti. Uno studio ha suggerito che i saggi ELISA basati sulla luminescenza mostrano una maggiore sensibilità e una riproducibilità comparabile ai saggi colorimetrici22, mentre un altro ha scoperto che i saggi ELISA basati sulla colorimetria conferiscono una maggiore sensibilità23. Qui, viene fornito un protocollo dettagliato per un test NAb in vitro contro AAV che utilizza la reazione cromogenica tra un AAV che codifica per un gene reporter della fosfatasi alcalina (AP) e un substrato nitro blu tetrazolio /5-bromo-4-cloro-3-indolil fosfato (NBT / BCIP). Questo protocollo passo-passo è stato sviluppato sulla base di un precedente rapporto che utilizzava un gene reporter hPLAP (fosfatasi alcalina placentare umana) (AAV6-hPLAP) per rilevare l'attività neutralizzante contro AAV24. Questo test è conveniente, efficiente in termini di tempo, facile da configurare e richiede competenze tecniche minime, attrezzature di laboratorio e reagenti. Inoltre, la semplicità di questo test gli conferisce il potenziale per essere ottimizzato per ampie applicazioni su diversi tipi di cellule, tessuti o sierotipi virali.
Protocollo
Tutti gli aspetti della cura e della sperimentazione degli animali sono stati condotti seguendo le linee guida del Florey Institute of Neuroscience and Mental Health e il Codice australiano per la cura e l'uso degli animali a fini scientifici seguendo Reference25. Per lo studio sono state utilizzate pecore Merino di 1,5-3 anni. Una panoramica schematica del protocollo di analisi è fornita nella Figura 1.
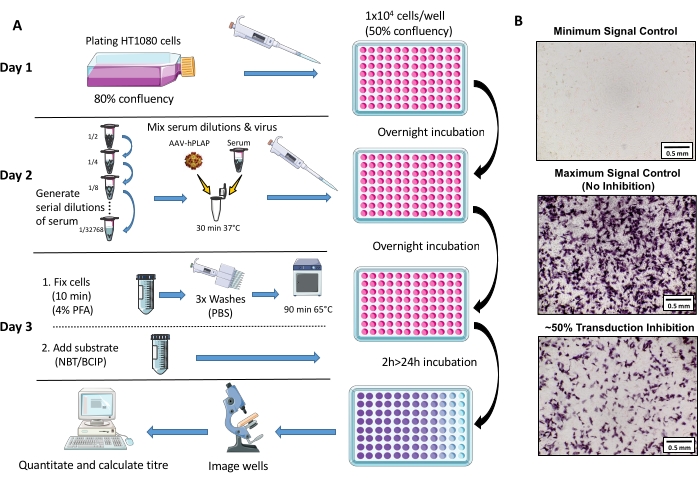
Figura 1: Diagramma schematico del protocollo di analisi NAb. (A) Rappresentazione visiva del test NAb che illustra i passaggi primari coinvolti nel protocollo di tre giorni. In breve, le cellule vengono coltivate e placcate durante la notte. Il giorno seguente, vengono preparate diluizioni seriali di siero, incubate con AAV e quindi incubate con le cellule durante la notte. Il giorno successivo, le cellule vengono fissate, lavate, incubate, combinate con il substrato e incubate di nuovo, seguite da imaging e quantificazione. (B) Immagini rappresentative di un controllo minimo del segnale (inibizione AAV completa), un controllo massimo del segnale (nessuna inibizione) e un campione di siero ovino con inibizione del segnale ~ 50%. Barra della scala = 0,5 mm. Fare clic qui per visualizzare una versione più grande di questa figura.
1. Preparazione iniziale
- Per la valutazione negli ovini: raccogliere il sangue in provette di attivazione del coagulo separatore di siero da 8 ml (vedere Tabella dei materiali), lasciare il campione di sangue a temperatura ambiente (RT) per 20-30 minuti e successivamente ruotare a 2.100 x g per 15 minuti. Il surnatante chiaro che si forma nella parte superiore dei tubi è il siero. Aliquotare la fase acquosa limpida in tubi di microcentrifuga e conservare a -80 °C.
NOTA: Il siero a -80 °C rimane stabile per ~5 anni. Il sangue è stato raccolto dalla vena carotidea usando un ago da 16 G (punta tagliata) e una siringa da animali coscienti. - Il calore inattiva il siero bovino fetale (FBS) mettendolo a bagnomaria a 56 °C per 30 minuti e ruotando in modo intermittente. Per precisione, posizionare un termometro in una seconda bottiglia contenente un volume equivalente di acqua e aggiungerlo al bagno di calore contemporaneamente alla bottiglia FBS. Iniziare la temporizzazione quando il termometro raggiunge i 56 °C.
- Impiegare una corretta tecnica asettica e pratica di coltura cellulare per tutte le fasi successive eseguite nella cappa di coltura cellulare26,27. Spruzzare il 70% di etanolo su tutti gli oggetti e sul cappuccio prima dell'uso e pulire con ipoclorito di sodio all'1% al termine.
- Completa il Modified Eagle Medium (DMEM) di Dulbecco combinando glucosio alto (4,5 g / L) DMEM (89%) con FBS inattivato dal calore (10%) e penicillina streptomicina (1%). Combinare e filtrare utilizzando un sistema di filtrazione sottovuoto sterile (dimensione dei pori di 0,22 μm, membrana di polietersolfone) (vedere Tabella dei materiali). Conservare il DMEM completo avvolto in un foglio a 4 °C.
- Stabilire celle HT1080 (vedere Tabella dei materiali) e passare in un pallone quadrato di 75 cm2 come descritto in Riferimento28. Crea più scorte congelate di cellule. Non utilizzare cellule dopo 20 passaggi poiché un ulteriore passaggio può influenzare i risultati del test.
2. Giorno 1 - Placcatura delle cellule
- Passaggio delle cellule HT1080 quando raggiungono ~ 80% di confluenza.
- DMEM completo preriscaldato (preparato nella fase 1.4), 0,05% di tripsina-EDTA e 1x soluzione salina tamponata con fosfato (PBS) a 37 °C a bagnomaria. Rimuovere il mezzo di crescita dalle cellule passate utilizzando un sistema di aspirazione.
NOTA: Tutte le aspirazioni in questo protocollo utilizzano un sistema di vuoto con un tubo collegato a una pipetta sierologica sterile da 5 ml. - Lavare le cellule in 10 mL di PBS preriscaldato (37 °C) e tripsinizzare le cellule per 3-4 minuti in 4 mL di tripsina-EDTA preriscaldata allo 0,05% per staccare le cellule dal pallone.
- Inattivare la tripsina aggiungendo 6 mL di DMEM completo preriscaldato e pipettare le cellule in un tubo da 50 ml. Calcolare il numero e la concentrazione di cellule vitali utilizzando un emocitometro e il metodo di esclusione blu del tripano29.
- Diluire le cellule ad una concentrazione di 1 x 105 cellule/mL in DMEM completo preriscaldato. Semina 100 μL di cellule / pozzo in piastre chiare a fondo piatto a 96 pozzetti (1 x 104 cellule per pozzetto). Incubare la piastra a 37 °C, 5% di anidride carbonica (CO2) durante la notte per 16-22 ore.
3. Giorno 2 - Infettare le cellule
- Rimuovere le piastre dall'incubatore e utilizzare un microscopio ottico per confermare che le cellule sono uniformemente disperse all'interno dei pozzetti e che la confluenza è ~ 50%. Se le cellule non rientrano in un intervallo di confluenza del 45%-55%, ripetere il protocollo "Giorno 1" e regolare di conseguenza la concentrazione cellulare iniziale.
- Generare diluizioni seriali dei campioni di siero di interesse in tubi microcentrifuga da 1,5 ml utilizzando DMEM completo preriscaldato come diluente. La Tabella 1 mostra la generazione di una cascata di diluizione per campioni di triplice copia.
- Per eseguire il test in triplice copia, preparare un genoma vettoriale (vg)/μL di 7,5 x 106 genomi vettoriali (vg)/μL di soluzione di lavoro di AAV6-hPLAP (vedi Tabella dei materiali) diluendo una soluzione madre di virus in 1x PBS.
- Aggiungere 66 μL della soluzione di lavoro virale 7,5 x 106 vg/μL a ciascun tubo contenente 264 μL di diluizione siero/mezzo (330 μL di volume/diluizione totale, vedere Tabella 1).
NOTA: questo è un test robusto che non richiede condizioni di coltura perfette. Tuttavia, per quantificare con precisione e garantire che ogni esecuzione del test sia affidabile, è necessario includere quanto segue: (1) un controllo solo virus e media, (2) un controllo solo media e (3) un campione di controllo NAb positivo su tutte le piastre nelle stesse condizioni sperimentali. Il volume descritto (330 μL) rappresenta per i campioni di triplice copia +10% della miscela di siero e virus. L'esecuzione di repliche è altamente raccomandata per la determinazione accurata dell'attività di neutralizzazione.
- Mescolare le diluizioni virus/siero mediante pipettaggio e posizionare le provette contenenti le miscele virus/siero in un incubatore a 37 °C, 5% CO2 per 30 minuti per consentire la potenziale neutralizzazione.
- Pipettare 100 μL della miscela virus/siero per ogni pozzetto sulla piastra a 96 pozzetti contenente 1 x 104 cellule/pozzetto per ogni diluizione.
NOTA: Questo genererà una concentrazione virale finale di 15k virus / molteplicità cellulare di infezione (MOI) in ciascun pozzo. La tabella 2 fornisce un esempio di layout della piastra campione a 96 pozzetti per valutare i campioni a una diluizione 1/512. - Avvolgere la piastra a 96 pozzetti contenente cellule, siero e AAV-hPLAP in un foglio e metterla in un incubatore a 37 ° C, 5% CO2 durante la notte per 16-24 ore per consentire l'ingresso di AAV nelle cellule.
| Etichetta a cascata di diluizione | Diluizione | 3 x campione (240 μL) + 10% di volume tampone (24 μL) | Rapporto tra siero:media |
| Diluizione 1 (D1) | 1/2 | 264 μL siero 264 μL mezzi | 50:50 |
| Diluizione 2 (D2) | 1/4 | 264 μL D1 + 264 μL di fluidi | 25:75 |
| Diluizione 3 (D3) | 1/8 | 264 μL D2 +264μL fluido | 12.5:87.5 |
| Diluizione 4 (D4) | 1/16 | 264 μL D3 +264 μL di fluidi | 6.25:93.75 |
| Diluizione 5 (D5) | 1/32 | 264 μL D4 +264 μL di fluidi | 3.13:96.87 |
| Diluizione 6 (D6) | 1/64 | 264 μL D5 +264 μL di fluidi | 1.56:98.44 |
| Diluizione 7 (D7) | 1/128 | 264 μL D5 +264 μL di fluidi | 0.78:99.22 |
| Diluizione 8 (D8) | 1/256 | 264 μL D5 +264 μL di fluidi | 0.39:99.61 |
| Diluizione 9 (D9) | 1/512 | 264 μL D7 + 264 μL di mezzi | 0.2:99.8 |
| Diluizione 10 (D10) | 1/2048 | 132 μL D8 + 396 μL di fluidi | 0.05:99.95 |
| Diluizione 11 (D11) | 1/8192 | 132 μL D9 + 396 μL di fluidi | 0.01:99.99 |
| Diluizione 12 (D12) | 1/32768 | 132 μL D10 + 396 μL di fluidi | 0.003:99.997 |
Tabella 1: Volumi di siero e diluente necessari per generare diluizioni seriali di siero in triplice copia.
| Esempio di siero #1 | Esempio di siero #2 | Esempio di siero #3 | Mono AB (mAB), controlli e campioni extra | |||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
| Un | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 50 ng MAb | 50 ng MAb | 50 ng MAb |
| B | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 5 ng MAb | 5 ng MAb | 5 ng MAb |
| C | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 0,5 ng MAb | 0,5 ng MAb | 0,5 ng MAb |
| D | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | MO (-C) | MO (-C) | MO (-C) |
| E | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | VO (+C) | VO (+C) | VO (+C) |
| F | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | Esempio #1 1/512 | Esempio #1 1/512 | Esempio #1 1/512 |
| G | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | Esempio #2 1/512 | Esempio #2 1/512 | Esempio #2 1/512 |
| H | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | Esempio #3 1/512 | Esempio #3 1/512 | Esempio #3 1/512 |
Tabella 2: Esempio di layout della piastra a 96 pozzetti per la valutazione di campioni di siero naïve in diluizioni comprese tra 1/2 e 1/512. Diluizioni più elevate sono incorporate nel test se si valuta un campione noto per essere positivo per AAV NAbs (campioni post-somministrazione) o se è richiesto un titolo più elevato. MO (-C): controllo solo multimediale. VO (+C): controllo solo di virus e supporti. mAb: Anticorpo monoclonale contro AAV (controllo positivo NAb).
4. Giorno 3 - Fissaggio e aggiunta di substrato alle cellule
- Preriscaldare un'aliquota da 1x PBS a 37 °C (~25 mL/piastra a 96 pozzetti). Aliquote separate fredde di PBS (~25 mL/piastra a 96 pozzetti) e H2O a doppio distillato (DDW, piastra da ~25 mL/96 pozzetti) a 4 °C. Sciogliere un pellet di BCIP/NBT (vedi Tabella dei materiali) in 10 mL di DDW in un tubo centrifugo conico da 50 mL mediante vortice (10 mL sono sufficienti per 2 x 96 piastre di pozzo).
- Aspirare il fluido dai pozzetti della piastra a 96 pozzetti utilizzando una pipetta sierologica o simile collegata a un sistema di aspirazione basato sull'aspirazione o a un vuoto della cappa aspirante. Posizionare delicatamente la punta della pipetta sierologica nel pozzetto e rimuovere il supporto facendo attenzione a non interrompere le cellule aderenti.
- Aggiungere 50 μL di RT 4% PFA a ciascun pozzo utilizzando una pipetta. Avvolgere la piastra in un foglio e lasciarla a RT per 10 minuti per fissare le cellule.
ATTENZIONE: La paraformaldeide (PFA) è un probabile cancerogeno ed è tossica per contatto con la pelle o gli occhi o per inalazione. Maniglia in una cappa aspirante con adeguati dispositivi di protezione individuale e una maschera facciale. Produrre PFA fresco al 4% diluito in PBS (~ 7 ml richiesti per piastra da 96 pozzetti).
- Aggiungere 50 μL di RT 4% PFA a ciascun pozzo utilizzando una pipetta. Avvolgere la piastra in un foglio e lasciarla a RT per 10 minuti per fissare le cellule.
- Lavare e aspirare le celle con 200 μL di RT 1x PBS. Ripetere questo passaggio due volte.
NOTA: una pipetta multicanale è un'opzione efficiente per le fasi di pipettaggio. - Pipettare 200 μL di PBS preriscaldato in ciascun pozzetto, avvolgere la piastra in un foglio e incubare a 65 °C per 90 minuti per denaturare l'attività endogena della fosfatasi alcalina30.
- Aspirare pozzi e celle di lavaggio con 200 μL di PBS freddo (4 °C). Aspirare di nuovo, lavare in 200 μl di DDW freddo e aspirare di nuovo.
- Pipettare 50 μL del BCIP/NBT disciolto (preparato al punto 4.1) in ciascun pozzetto.
- Avvolgere la piastra in un foglio e incubare a RT per 2-24 ore.
NOTA: essere coerenti con il tempo di incubazione tra le esecuzioni; la flessibilità temporale consente agli utenti di fotografare i pozzi il giorno 3 o il giorno successivo. - Utilizzando una fotocamera al microscopio ottico, scattare foto di ciascun pozzo utilizzando un obiettivo 4x, garantendo la stessa esposizione, il bilanciamento del bianco e le impostazioni della luce vengono utilizzati in modo coerente per tutti i test eseguiti.
- Posiziona ciascun pozzetto in modo identico e assicurati che i bordi del pozzo non siano visibili nelle foto. Salva le foto in formato TIF o simile.
NOTA: le impostazioni specifiche variano tra i microscopi, ma la quantificazione sarà più efficace se l'illuminazione di fondo è elevata e coerente in tutti i pozzetti (Figura 1B).
- Posiziona ciascun pozzetto in modo identico e assicurati che i bordi del pozzo non siano visibili nelle foto. Salva le foto in formato TIF o simile.
5. Quantificazione per determinare l'attività di neutralizzazione utilizzando ImageJ
- Scarica e installa il software disponibile gratuitamente "ImageJ" (vedi Tabella dei materiali).
- Aprire l'immagine da analizzare in ImageJ selezionando File > Apri (Figura 2).
- Se utilizzate immagini colorate, convertitele in scala di grigi selezionando Immagine > Tipo > 8 bit.
- Clicca su Immagine > Regola > Soglia. Regolare la soglia fino a quando tutte le aree colorate sono colorate in rosso, ma lo sfondo non lo è. Dopo l'aggiunta di NBT / BCIP, il prodotto colorato si depositerà nell'area intorno alle cellule che esprimono hPLAP.
NOTA: si consiglia di utilizzare la stessa impostazione di soglia per tutte le immagini acquisite sulla stessa piastra. - Fare clic su Analizza > Imposta misurazioni e selezionare le caselle di controllo Area, Limita a soglia, Frazione di area e Visualizza etichetta e fare clic su OK.
- Per determinare la lettura del segnale (percentuale di colorazione) di un dato pozzo, fare clic su Analizza > Misura. La colonna '% Area' della finestra pop-up visualizza la lettura del segnale.
- Eseguire la quantificazione per tutte le repliche di campioni. Escludere eventuali pozzi contaminati, pozzi che mostrano una distribuzione cellulare irregolare o pozzi che variano in densità cellulare o illuminazione.
NOTA: vedere la Figura 1 supplementare per esempi di pozzi che devono essere considerati per l'esclusione. In genere, 3-4 pozzi possono richiedere l'esclusione da una piastra da 96 pozzetti. La Figura 2 fornisce una rappresentazione visiva del processo di quantificazione utilizzando ImageJ.
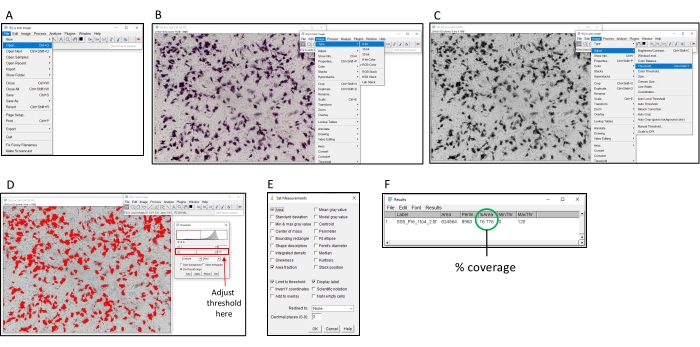
Figura 2: Passaggi per determinare la colorazione percentuale utilizzando il software ImageJ. (A) Aprire l'immagine da analizzare con il software ImageJ. (B) Convertire l'immagine in scala di grigi a 8 bit. (C) Aprire la finestra di soglia. (D) Regolare la soglia massima in modo che tutte le aree colorate siano coperte, ma l'area di sfondo non lo è (questa soglia dovrebbe essere coerente su un'intera piastra). (E) Seleziona il dropbox "Analizza", fai clic su "Imposta misurazioni" e seleziona "Area", "Frazione di area", "Soglia limite" e "Etichetta di visualizzazione" e fai clic su "OK". (F) Fare clic su "Misura" per misurare l'area coperta. L'area % indica la proporzione dell'immagine che è stata colorata. Questo può quindi essere utilizzato con i campioni di controllo per determinare il titolo TI50 . Fare clic qui per visualizzare una versione più grande di questa figura.
6. Determinazione del titolo di inibizione della trasduzione (TI50)
- Determinare la lettura media dalle repliche (utilizzando i passaggi descritti nel passaggio 5) per quanto segue: (1) Controllo solo multimediale (lettura del segnale di base). (2) Controllo solo virus + media (lettura massima del segnale). (3) Virus + campioni di siero di interesse.
- Calcola la percentuale di inibizione usando la seguente formula:
100 - [(Test sample signal readout (virus + serum sample of interest) - baseline signal readout (media only control)) / (maximum signal readout (media and virus only) - baseline signal readout) x 100] = % Trasduzione inhibition13. - Calcolare l'inibizione % della trasduzione da tutte le repliche di ciascuna diluizione per tutti i campioni utilizzando la formula di cui al punto 6.2. Determinare l'inibizione media della trasduzione tra le repliche tecniche per ogni diluizione per tutti i campioni e i controlli.
- Calcolare il titolo di inibizione della trasduzione al 50% (titolo TI50 ) di un campione di interesse determinando la diluizione più bassa del campione che produce il 50% o superiore di inibizione della trasduzione dell'attività hPLAP. ad esempio, se una diluizione di 1/8 di un campione ha un'inibizione della trasduzione superiore al 50% in base al calcolo eseguito in 6.2 (e una diluizione di 1/4 no), riportare il titolo TI50 come 1/8.
7. Determinazione delle particelle AAV neutralizzate
- Calcolare il numero di particelle AAV neutralizzate per μL di siero per un dato campione utilizzando la seguente formula:
((MOI x conteggio cellulare/pozzo) / (volume di siero / fattore di diluizione del titolo TI50 )) / 2 = particelle AAV neutralizzate / μL di siero9.
NOTA: Dividendo per 2 si ottiene il TI50 che misura il 50% delle particelle neutralizzate. Per un campione che fornisce un titolo TI50 di 1/4 (25% siero, 75% diluente) in cui il test ha utilizzato 80 μL di siero non diluito e un MOI di 15k placcato su 1 x 104 cellule, verrebbe utilizzato il seguente calcolo: ((15000 x 10000) / (80/4)) / 2 = 3,75x106 particelle neutralizzate / μL di siero.
Risultati
Saggio di trasduzione per stabilire il dosaggio virale ottimale per la copertura delle piastre
Le cellule HT1080, una linea di cellule di fibrosarcoma ben consolidata, sono state selezionate per questo test. Una concentrazione di 1 x 104 cellule HT1080 / pozzo ha fornito ~ 50% di confluenza cellulare in ciascun pozzetto di una piastra a 96 pozzetti. Per determinare la concentrazione virale ottimale per il test, un rAAV che codifica per un gene reporter hPLAP (fosfatasi alcalina placentare u...
Discussione
Questo rapporto descrive un saggio colorimetrico che valuta l'entità della neutralizzazione AAV in un dato campione di siero valutando una reazione cromogenica corrispondente al grado di trasduzione virale in vitro. Lo sviluppo del protocollo si è basato sulla nota reazione cromogenica tra l'enzima fosfatasi alcalina e NBT/BCIP, che è stato ampiamente utilizzato come strumento di colorazione per la rilevazione di bersagli proteici in applicazioni come l'immunoistochimica e come strumento reporter per la valut...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo studio è stato finanziato da un National Health and Medical Research Council Project Grant a JRM e CJT (ID 1163732) e in parte dal programma di supporto alle infrastrutture operative del governo vittoriano. SB è supportato da una borsa di studio congiunta Baker Heart and Diabetes Institute-La Trobe University Doctoral. KLW è supportato da The Shine On Foundation e da una Future Leader Fellowship della National Heart Foundation of Australia (ID 102539). JRM è supportato da una borsa di ricerca senior del National Health and Medical Research Council (ID 1078985).
Materiali
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin/EDTA | Gibco | 25300-054 | |
| 50 mL conical centrifuge tube | Falcon | 14-432-22 | Or equivalent |
| 75 cm2 square flasks | Falcon | 353136 | Or equivalent |
| 96 well flat bottomed plate | Falcon | 353072 | |
| AAV6-CMV-hPLAP Vector | Muscle Research & Therapeutics Lab (University of Melbourne, Australia) AAV6-CMV-hPLAP can be provided upon request. | ||
| Aluminium foil | |||
| Anti-AAV6 (intact particle) mouse monoclonal antibody, (ADK6) | PROGEN | 610159 | Positive control monoclonal antibody |
| BCIP/NBT | SIGMAFAST | B5655 | |
| Cell and tissue culture safety cabinet | |||
| Electronic Pipette | 5 & 10 mL stripette inserts | ||
| Fetal Bovine Serum | Gibco | 10099-141 | |
| Haemocytometer | |||
| High glucose Dulbecco's Modified Eagle Medium (DMEM) | Gibco | 11965118 | |
| HT1080 cells | ATCC | ||
| ImageJ Software | Freely available: https://imagej.nih.gov/ij/download.html | ||
| Incubator | 37 °C, 5% CO2 | ||
| Light microscope with camera | Capable of taking photos with a 4x objective lens | ||
| Oven | For a 65 °C incubation | ||
| Paraformaldehyde | MERCK | 30525-89-4 | |
| Penicillin Streptomycin | Gibco | 15140-122 | |
| Phosphate buffered saline | |||
| Pipettes and tips | 20 μL, 200 μL & 1 mL single pipettes and tips & 200 μL multichannel pipette | ||
| Stericup quick release filter | Millipore | S2GPU10RE | Used for combining media reagents |
| Trypan blue solution | Sigma-Aldrich | T8154 | |
| VACUETTE TUBE 8 ml CAT Serum Separator Clot Activator | Greiner BIO-ONE | 455071 | Used for serum collection & processing from sheep |
| Water bath |
Riferimenti
- Bass-Stringer, S., et al. Adeno-associated virus gene therapy: Translational progress and future prospects in the treatment of heart failure. Heart, Lung and Circulation. 27 (11), 1285-1300 (2018).
- Casey, G. A., Papp, K. M., MacDonald, I. M. Ocular gene therapy with adeno-associated virus vectors: current outlook for patients and researchers. Journal of Ophthalmic and Vision Research. 15 (3), 396-399 (2020).
- Lykken, E. A., Shyng, C., Edwards, R. J., Rozenberg, A., Gray, S. J. Recent progress and considerations for AAV gene therapies targeting the central nervous system. Journal of Neurodevelopmental Disorders. 10 (1), 16 (2018).
- Guggino, W. B., Cebotaru, L. Adeno-Associated Virus (AAV) gene therapy for cystic fibrosis: Current barriers and recent developments. Expert Opinion on Biological Therapy. 17 (10), 1265-1273 (2017).
- Perrin, G. Q., Herzog, R. W., Markusic, D. M. Update on clinical gene therapy for hemophilia. Blood. 133 (5), 407-414 (2019).
- Wang, D., Tai, P. W. L., Gao, G. Adeno-associated virus vector as a platform for gene therapy delivery. Nature Reviews Drug Discovery. 18 (5), 358-378 (2019).
- Kuzmin, D. A., et al. The clinical landscape for AAV gene therapies. Nature Reviews Drug Discovery. 20 (3), 173-174 (2021).
- Russell, S., et al. Efficacy and safety of voretigene neparvovec (AAV2-hRPE65v2) in patients with RPE65-mediated inherited retinal dystrophy: A randomised, controlled, open-label, phase 3 trial. Lancet. 390 (10097), 849-860 (2017).
- Weber, T. Anti-AAV Antibodies in AAV gene therapy: Current challenges and possible solutions. Frontiers in Immunology. 12, 658399 (2021).
- Weeks, K. L., et al. Phosphoinositide 3-kinase p110alpha is a master regulator of exercise-induced cardioprotection and PI3K gene therapy rescues cardiac dysfunction. Circulation: Heart Failure. 5 (4), 523-534 (2012).
- Gregorevic, P., et al. Systemic delivery of genes to striated muscles using adeno-associated viral vectors. Nature Medicine. 10 (8), 828-834 (2004).
- Bernardo, B. C., et al. Gene delivery of medium chain acyl-coenzyme A dehydrogenase induces physiological cardiac hypertrophy and protects against pathological remodelling. Clinical Science (London). 132 (3), 381-397 (2018).
- Meliani, A., et al. Determination of anti-adeno-associated virus vector neutralizing antibody titer with an in vitro reporter system. Human Gene Therapy Methods. 26 (2), 45-53 (2015).
- Falese, L., et al. Strategy to detect pre-existing immunity to AAV gene therapy. Gene Therapy. 24 (12), 768-778 (2017).
- Wang, D., et al. Adeno-Associated virus neutralizing antibodies in large animals and their impact on brain intraparenchymal gene transfer. Molecular Therapy - Methods & Clinical Development. 11, 65-72 (2018).
- Wang, M., et al. Prediction of adeno-associated virus neutralizing antibody activity for clinical application. Gene Therapy. 22 (12), 984-992 (2015).
- Kruzik, A., et al. Detection of biologically relevant low-titer neutralizing antibodies against adeno-associated virus require sensitive in vitro assays. Human Gene Therapy Methods. 30 (2), 35-43 (2019).
- Lehtoranta, L., Villberg, A., Santanen, R., Ziegler, T. A novel, colorimetric neutralization assay for measuring antibodies to influenza viruses. Journal of Virological Methods. 159 (2), 271-276 (2009).
- Johnston, P. B., Grayston, J. T., Loosli, C. G. Adenovirus neutralizing antibody determination by colorimetric assay. Proceedings of the Society for Experimental Biology and Medicine. 94 (2), 338-343 (1957).
- Xiaoli Zhu, T. G. . Nano-Inspired Biosensors for Protein Assay with Clinical Applications. , 237-264 (2019).
- Jungmann, A., Muller, O., Rapti, K. Cell-based measurement of neutralizing antibodies against adeno-associated virus (AAV). Methods in Molecular Biology. 1521, 109-126 (2017).
- Samineni, S., et al. Optimization, comparison, and application of colorimetric vs. chemiluminescence based indirect sandwich ELISA for measurement of human IL-23. Journal of Immunoassay and Immunochemistry. 27 (2), 183-193 (2006).
- Siddiqui, J., Remick, D. G. Improved sensitivity of colorimetric compared to chemiluminescence ELISAs for cytokine assays. Journal of Immunoassay and Immunochemistry. 24 (3), 273-283 (2003).
- Arnett, A. L., Garikipati, D., Wang, Z., Tapscott, S., Chamberlain, J. S. Immune responses to rAAV6: The Influence of canine parvovirus vaccination and neonatal administration of viral vector. Frontiers in Microbiology. 2, 220 (2011).
- Australian code for the care and use of animals for scientific purposes. National Health and Medical Research Council Available from: https://www.nhmrc.gov.au/about-us/publications/australian-code-care-and-use-animals-scientific-purposes (2013)
- Coecke, S., et al. Guidance on good cell culture practice. A report of the second ECVAM task force on good cell culture practice. Alternatives to Laboratory Animals. 33 (3), 261-287 (2005).
- Journal of Visualized Experiments. General Laboratory Techniques. Journal of Visualized Experiments Database. , (2018).
- AAV-HT1080 Cells. Stratagene Available from: https://www.chem-agilent.com/pdf/strata/240109.pdf (2003)
- Strober, W. Trypan blue exclusion test of cell viability. Current Protocols in Immunology. 111 (3), 1-3 (2015).
- Bieber, S., et al. Extracorporeal delivery of rAAV with metabolic exchange and oxygenation. Scientific Reports. 3, 1538 (2013).
- Winbanks, C. E., Beyer, C., Qian, H., Gregorevic, P. Transduction of skeletal muscles with common reporter genes can promote muscle fiber degeneration and inflammation. PLoS One. 7 (12), 51627 (2012).
- Thomas, C. J., et al. Evidence that the MEK/ERK but not the PI3K/Akt pathway is required for protection from myocardial ischemia-reperfusion injury by 3',4'-dihydroxyflavonol. European Journal of Pharmacology. 758, 53-59 (2015).
- Barger, A., et al. Use of alkaline phosphatase staining to differentiate canine osteosarcoma from other vimentin-positive tumors. Veterinary Pathology. 42 (2), 161-165 (2005).
- Gregorevic, P., et al. Evaluation of vascular delivery methodologies to enhance rAAV6-mediated gene transfer to canine striated musculature. Molecular Therapy. 17 (8), 1427-1433 (2009).
- Sharma, A., Ghosh, A., Hansen, E. T., Newman, J. M., Mohan, R. R. Transduction efficiency of AAV 2/6, 2/8 and 2/9 vectors for delivering genes in human corneal fibroblasts. Brain Research Bulletin. 81 (2-3), 273-278 (2010).
- Smejkal, G. B., Kaul, C. A. Stability of nitroblue tetrazolium-based alkaline phosphatase substrates. Journal of Histochemistry & Cytochemistry. 49 (9), 1189-1190 (2001).
- Falese, L., et al. Strategy to detect pre-existing immunity to AAV gene therapy. Gene Therapy. 24 (12), 768-778 (2017).
- Orlowski, A., et al. Successful transduction with AAV Vectors after selective depletion of anti-aav antibodies by immunoadsorption. Molecular Therapy - Methods & Clinical Development. 16, 192-203 (2020).
- Goossens, K., et al. Differential microRNA expression analysis in blastocysts by whole mount in situ hybridization and reverse transcription quantitative polymerase chain reaction on laser capture microdissection samples. Analytical Biochemistry. 423 (1), 93-101 (2012).
- Entrican, G., Wattegedera, S. R., Griffiths, D. J. Exploiting ovine immunology to improve the relevance of biomedical models. Molecular Immunology. 66 (1), 68-77 (2015).
- Walters, E. M., Prather, R. S. Advancing swine models for human health and diseases. Molecular Medicine. 110 (3), 212-215 (2013).
- Rapti, K., et al. Neutralizing antibodies against AAV serotypes 1, 2, 6, and 9 in sera of commonly used animal models. Molecular Therapy. 20 (1), 73-83 (2012).
- Tellez, J., et al. Characterization of naturally-occurring humoral immunity to AAV in sheep. PLoS One. 8 (9), 75142 (2013).
- Gupta, S., et al. Recommendations for the validation of cell-based assays used for the detection of neutralizing antibody immune responses elicited against biological therapeutics. Journal of Pharmaceutical and Biomedical Analysis. 55 (5), 878-888 (2011).
- Gupta, S., et al. Recommendations for the design, optimization, and qualification of cell-based assays used for the detection of neutralizing antibody responses elicited to biological therapeutics. Journal of Immunological Methods. 321 (1-2), 1-18 (2007).
- Shankar, G., et al. Recommendations for the validation of immunoassays used for detection of host antibodies against biotechnology products. Journal of Pharmaceutical and Biomedical Analysis. 48 (5), 1267-1281 (2008).
- U.S. Department of Health and Human Services Food and Drug Administration. Center for Drug Evaluation and Research (CDER). Immunogenicity Testing of Therapeutic Protein Products — Developing and Validating Assays for Anti-Drug Antibody Detection. U.S. Department of Health and Human Services Food and Drug Administration. , (2019).
- Baatartsogt, N., et al. A sensitive and reproducible cell-based assay via secNanoLuc to detect neutralizing antibody against adeno-associated virus vector capsid. Molecular Therapy - Methods & Clinical Development. 22, 162-171 (2021).
- Watano, R., Ohmori, T., Hishikawa, S., Sakata, A., Mizukami, H. Utility of micro mini pigs for evaluating liver-mediated gene expression in the presence of neutralizing antibody against vector capsid. Gene Therapy. 27 (9), 427-434 (2020).
- Majowicz, A., et al. Therapeutic hFIX activity achieved after single AAV5-hFIX treatment in Hemophilia B patients and NHPs with pre-existing anti-AAV5 NABs. Molecular Therapy - Methods & Clinical Development. 14, 27-36 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon