このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
比色細胞ベースのアッセイを用いてAAVに対する中和抗体を検出するためのステップバイステップ法
要約
AAV6に対する中和元素を検出するための、迅速で費用対効果が高く、簡単な比色細胞ベースのアッセイについて、包括的なラボプロトコルと分析ワークフローが説明されています。
要約
組換えアデノ随伴ウイルス(rAAV)は、実験室と診療所の両方でさまざまな健康状態を治療するために遺伝物質を転写するための安全で成功したベクターであることが証明されています。しかし、AAVカプシドに対する既存の中和抗体(NAbs)は、大型動物実験モデルとヒト集団の両方で遺伝子治療を成功裏に投与するための継続的な課題を提起する。AAVに対する宿主免疫の予備スクリーニングは、AAVベースの遺伝子治療が研究ツールとして、また臨床的に実行可能な治療薬としての有効性を確保するために必要です。このプロトコールは、AAV血清型6(AAV6)に対する中和因子を検出するための 比色インビトロ アッセイを記載する。このアッセイは、アルカリホスファターゼ(AP)レポーター遺伝子をコードするAAVとその基質NBT/BCIPとの間の反応を利用し、組み合わせると不溶性の定量可能な紫色の染色を生成する。
このプロトコールでは、血清サンプルをAPを発現するAAVと組み合わせ、潜在的な中和活性が起こるようにインキュベートする。ウイルス血清混合物は、その後、中和されていない任意のAAVのウイルス形質導入を可能にするために細胞に添加される。NBT/BCIP基質が添加され、ウイルス形質導入および中和活性に対応する発色反応を受ける。着色された領域の割合は、中和力価を生成するためにフリーソフトウェアツールを使用して定量化される。このアッセイは、着色とウイルス濃度との間に強い正の相関を示す。組換えAAV6の投与前後のヒツジ由来の血清サンプルの評価は、中和活性の劇的な増加(125〜>10,000倍の増加)をもたらした。アッセイは、>1:32,000血清希釈液中の中和活性を検出するのに十分な感度を示した。このアッセイは、AAVに対してNAbsを検出するための簡単で迅速で費用対効果の高い方法を提供します。
概要
アデノ随伴ウイルス(AAV)は、心臓血管系、肺系、循環器系、眼系、および中枢神経系に影響を与えるさまざまな健康状態の試験的治療への遺伝子治療を提供するためのベクターとしてますます使用されています1,2,3,4,5。主要な遺伝子治療プラットフォームとしてのAAVベクターの人気は、その肯定的な安全性プロファイル、長期的な導入遺伝子発現、および広範囲の組織特異的指向性に由来しています1,6。動物実験での成功の結果は、有効性エンドポイント7に成功した50以上のAAV遺伝子治療臨床試験への道を開き、米国食品医薬品局によって承認された最初の市販のAAV遺伝子治療薬のリリース8。最初の成功の後、AAVは選択ベクターとして基礎研究および臨床研究分野で牽引力を得続けており、現在、米国とヨーロッパで臨床使用が承認された唯一のin vivo遺伝子治療です9。それにもかかわらず、AAVベクターカプシドに対する既存の中和抗体(NAbs)の存在は、前臨床研究および臨床試験の有効性の両方にとって依然として障害である。NAbは、ナイーブなヒトおよび動物集団の両方に存在し、AAVベクター1のインビボ投与後の遺伝子導入を阻害する。AAV血清陽性は、ほとんどの遺伝子治療試験の除外基準であるため、宿主免疫の予備スクリーニングは、実験室と診療所の両方で非常に重要です。AAVに対するNAbsの存在を検出できるアッセイを確立することは、AAV遺伝子治療ベースの研究プロジェクトのパイプラインにおいて不可欠なステップです。このレポートは、横紋筋(心臓および骨格筋)における効率的かつ選択的な形質導入のために研究者にとって興味深いAAV6に焦点を当てています1,10,11,12。遺伝子治療は、侵襲的な開心処置なしに心臓を特異的に標的とすることは困難であるため、心臓を標的とするための有望な戦略と考えられている。
中和活性は、通常、細胞ベースのインビトロまたはインビボ形質導入阻害アッセイのいずれかを用いて決定される。インビボでNAbアッセイは、通常、試験対象(例えば、ヒトまたは大型動物)からの血清をマウスに投与し、続いてレポーター遺伝子を有するAAVを投与し、続いてレポーター遺伝子または対応する抗原の発現について試験することを含む。インビトロアッセイは、レポーター遺伝子を発現する組換えAAV(rAAV)と共に段階希釈下でヒトまたは大型動物由来の血清または血漿をインキュベートすることによってNAb力価を決定する。細胞を血清/ウイルス混合物に感染させ、対照と比較してレポーター遺伝子発現が阻害される程度を評価する。インビトロアッセイは、インビボアッセイと比較して、比較的低コスト、試験の迅速性、標準化および検証の能力が高いため、NAbスクリーニングに広く使用されています13,14。インビボアッセイはしばしばより高い感度を有すると報告されている15,16が、インビトロアッセイに関しても同じ主張がなされている14,17。
今日まで、インビトロNAbアッセイは、中和を検出するためのレポーター遺伝子として発光(ルシフェラーゼ)を主に使用してきた。光ベースの方法は多くの文脈においてメリットを有するが、比色法/発色性NAbアッセイは状況によっては有利であり得る。中和を評価するための比色アッセイは、インフルエンザやアデノウイルスなどの他のウイルスについても成功裏に採用されています18,19。その魅力は、そのシンプルさ、低コスト、そして日常的な実験装置とツールのみの要件に由来しています20。発光ベースのレポーター遺伝子を使用するNAbアッセイには、高価な基質キット、ルミノメーター、および分析用の対応するソフトウェアが必要です21。この比色アッセイは、光学顕微鏡と非常に安価な基質のみを必要とするという利点を有する。比色アッセイと発光アッセイの感度の報告は、相反する結果をもたらしました。ある研究では、発光ベースのELISAアッセイは比色アッセイと比較してより高い感度と同等の再現性を示すことが示唆され22、別の研究では比色ベースのELISAアッセイがより高い感度を付与することが示唆されました23。ここでは、アルカリホスファターゼ(AP)レポーター遺伝子をコードするAAVとニトロブルーテトラゾリウム/5-ブロモ-4-クロロ-3-インドリルホスフェート(NBT/BCIP)基質との間の発色反応を利用するAAVに対するインビトロNAbアッセイのための詳細なプロトコールが提供される。このステップバイステッププロトコルは、hPLAP(ヒト胎盤アルカリホスファターゼ)レポーター遺伝子(AAV6-hPLAP)を利用してAAV24に対する中和活性を検出した以前の報告に基づいて開発されました。このアッセイは、費用対効果が高く、時間効率が高く、セットアップが簡単で、最小限の技術スキル、実験装置、および試薬を必要とします。さらに、このアッセイの単純さは、異なるタイプの細胞、組織、またはウイルス血清型にわたる幅広い用途に最適化される可能性を与えます。
プロトコル
動物の世話と実験のあらゆる側面は、Florey Institute of Neuroscience and Mental Healthのガイドラインと、参考文献25に続く科学的目的のための動物の世話と使用のためのオーストラリア規範に従って実施されました。1.5-3歳のメリノ・ウエイズが研究に使用された。アッセイプロトコルの概略概要を 図1に示します。
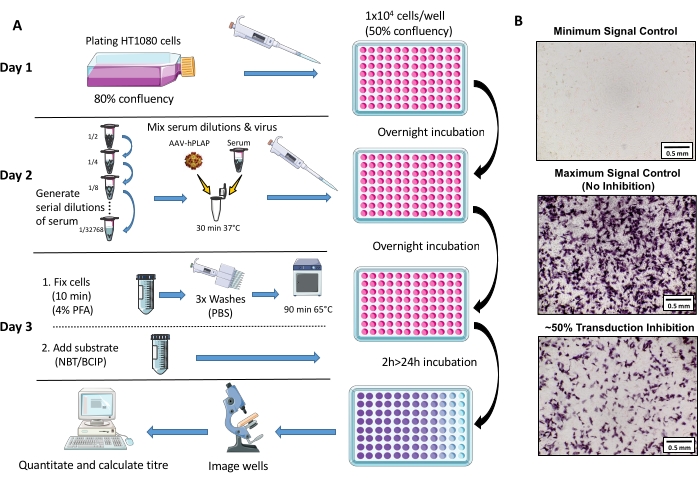
図1:NAbアッセイプロトコルの概略図。 (A)3日間のプロトコールに関与する主要なステップを示すNAbアッセイの視覚的表現。簡単に言えば、細胞を増殖させ、一晩で播種する。翌日、血清の段階希釈液を調製し、AAVと共にインキュベートし、次いで細胞と共に一晩インキュベートする。翌日、細胞を固定し、洗浄し、インキュベートし、基質と合わせ、再度インキュベートし、続いてイメージングおよび定量を行った。(b)最小シグナル制御(完全AAV阻害)、最大シグナル制御(阻害なし)、および〜50%シグナル阻害を有するウツジ血清サンプルの代表画像。スケール バー = 0.5 mm。この図の拡大版を表示するには、ここをクリックしてください。
1. 初期準備
- ヒツジの評価のために:8mL血清分離血餅活性化管( 材料表を参照)に血液を採取し、血液サンプルを室温(RT)で20〜30分間放置し、続いて2,100 x g で15分間スピンダウンする。チューブの上部に形成される透明な上清は血清です。透明な水相を微量遠心チューブにアリコートし、-80°Cで保存した。
注:-80°Cでの血清は、〜5年間安定しています。意識のある動物から16G針(先端カットオフ)およびシリンジを用いて頸動脈静脈から血液を採取した。 - ウシ胎児血清(FBS)を56°Cの水浴に30分間入れて熱失活させ、断続的に旋回させます。精度を上げるには、等量の水を入れた2番目のボトルに温度計を入れ、FBSボトルと同時にヒートバスに追加します。温度計が56°Cに達したらタイミングを開始します。
- 細胞培養フード26,27で実行される後続のすべてのステップについて、適切な無菌技術および細胞培養実践を採用する。使用前にすべての物体とフードに70%エタノールをスプレーし、完了時に1%次亜塩素酸ナトリウムで清掃してください。
- 高グルコース(4.5g / L)DMEM(89%)と熱不活化FBS(10%)およびペニシリンストレプトマイシン(1%)を組み合わせることにより、ダルベッコの改変イーグル培地(DMEM)を完成させます。滅菌真空ろ過システム(孔径0.22 μm、ポリエーテルスルホン膜)を使用して組み合わせ、ろ過 します(材料表を参照)。ホイルで包んだ完全なDMEMを4°Cで保管する。
- HT1080細胞を樹立し( 材料表を参照)、参考文献28 に記載されているように75cm2の正方形フラスコで継代する。細胞の複数の凍結ストックを作成します。20継代後の細胞は、さらなる継代がアッセイ結果に影響を与える可能性があるため、使用しないでください。
2. 1日目 - 細胞のめっき
- HT1080細胞が〜80%のコンフルエントに達したときに継代する。
- 完全DMEM(ステップ1.4で調製)、0.05%トリプシン-EDTA、および1xリン酸緩衝生理食塩水(PBS)をウォーターバス中で37°Cに予め加温した。吸引システムを用いて継代細胞から増殖培地を除去する。
注:このプロトコルのすべての吸引は、滅菌5mL血清学的ピペットに取り付けられたチューブを備えた真空システムを使用します。 - 予め加温した(37°C)1x PBSの10mLで細胞を洗浄し、予め加温した0.05%トリプシン-EDTAの4mL中で細胞を3〜4分間トリプシン処理して、フラスコから細胞を剥離した。
- 予め加温した完全DMEMを6mL加えてトリプシンを不活性化し、細胞を50mLチューブにピペットで打ち込む。血球計数器およびトリパンブルー排除法29を用いて生細胞の数および濃度を計算する。
- 予め加温した完全DMEM中で細胞を1 x 105 細胞/mLの濃度に希釈する。100 μL の細胞/ウェルを透明な 96 ウェル平底プレート (1 ウェルあたり 1 x 104 細胞) にシードします。プレートを37°C、5%二酸化炭素(CO2)で一晩16〜22時間インキュベートする。
3. 2日目 - 細胞に感染する
- インキュベーターからプレート/秒を取り出し、光学顕微鏡を使用して、細胞がウェル内に均一に分散していること、およびコンフルエント度が〜50%であることを確認します。細胞が45%〜55%のコンフルエント性の範囲内にない場合は、「Day 1」プロトコルを繰り返し、それに応じて初期細胞濃度を調整します。
- 予め加温した完全DMEMを希釈剤として使用して、目的の血清サンプルの段階希釈物を1.5mL微量遠心チューブで生成する。 表1は 、3連サンプルに対する希釈カスケードの生成を示す。
- アッセイを3連で行うには、ウイルスストック溶液を1x PBSで希釈することにより、AAV6-hPLAPの作用溶液(材料表を参照)の7.5 x 106ベクターゲノム(vg)/ μLを調製する。
- 264 μL の血清/培地希釈液を含む各チューブに 66 μL の 7.5 x 106 vg/μL ウイルス作業液を追加します (総容量/希釈液の 330 μL 、 表 1 を参照)。
注:これは、完全な培養条件を必要としない堅牢なアッセイです。ただし、各アッセイの実行を正確に定量し、信頼性を確保するためには、(1)ウイルスおよび培地のみのコントロール、(2)培地のみのコントロール、および(3)同じ実験条件下ですべてのプレート上のNAb陽性コントロールサンプルを含める必要があります。記載された体積(330μL)は、血清およびウイルス混合物の+10%の三連サンプルを占める。中和活性を正確に決定するためには、反復の実行を強くお勧めします。
- ウイルス/血清希釈液をピペッティングで混合し、ウイルス/血清混合液を含むチューブを37°C、5%CO2 のインキュベーターに30分間置き、潜在的な中和が起こるようにします。
- ウイルス/血清混合物100 μLを、希釈ごとに1 x 104 細胞/ウェルを含む96ウェルプレート上の各ウェルにピペットします。
注: これにより、各ウェルで 15,000 個のウイルス/細胞感染多重度 (MOI) の最終ウイルス濃度が生成されます。 表2 は、サンプルを1/512希釈まで評価するためのサンプルサンプルプレートレイアウトの例を提供する。 - 細胞、血清、およびAAV-hPLAPを含む96ウェルプレートをホイルで包み、37°C、5%CO2 のインキュベーターに16〜24時間一晩入れて、AAVが細胞内に侵入できるようにします。
| 希釈カスケードラベル | 希釈 | 3 x サンプル (240 μL) + 10% バッファー容量 (24 μL) | 血清の比率:培地 |
| 希釈 1 (D1) | 1/2 | 264 μL 血清 264 μL 培地 | 50:50 |
| 希釈 2 (D2) | 1/4 | 264 μL D1 + 264 μL 培地 | 25:75 |
| 希釈 3 (D3) | 1/8 | 264 μL D2 +264μL 培地 | 12.5:87.5 |
| 希釈 4 (D4) | 1/16 | 264 μL D3 +264 μL 培地 | 6.25:93.75 |
| 希釈 5 (D5) | 1/32 | 264 μL D4 +264 μL 培地 | 3.13:96.87 |
| 希釈 6 (D6) | 1/64 | 264 μL D5 +264 μL 培地 | 1.56:98.44 |
| 希釈 7 (D7) | 1/128 | 264 μL D5 +264 μL 培地 | 0.78:99.22 |
| 希釈 8 (D8) | 1/256 | 264 μL D5 +264 μL 培地 | 0.39:99.61 |
| 希釈 9 (D9) | 1/512 | 264 μL D7 + 264 μL 培地 | 0.2:99.8 |
| 希釈 10 (D10) | 1/2048 | 132 μL D8 + 396 μL 培地 | 0.05:99.95 |
| 希釈 11 (D11) | 1/8192 | 132 μL D9 + 396 μL 培地 | 0.01:99.99 |
| 希釈 12 (D12) | 1/32768 | 132 μL D10 + 396 μL 培地 | 0.003:99.997 |
表1:血清の連続希釈を3連で生成するのに必要な血清および希釈剤の量。
| 血清サンプル#1 | 血清サンプル#2 | 血清サンプル #3 | モノラルAB(mAB)、コントロールおよび追加サンプル | |||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
| ある | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 50 ng MAb | 50 ng MAb | 50 ng MAb |
| B | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 5 ng MAb | 5 ng MAb | 5 ng MAb |
| C | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 0.5 ng MAb | 0.5 ng MAb | 0.5 ng MAb |
| D | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | MO (-C) | MO (-C) | MO (-C) |
| E | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | VO (+C) | VO (+C) | VO (+C) |
| F | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | サンプル#1 1/512 | サンプル#1 1/512 | サンプル#1 1/512 |
| G | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | サンプル #2 1/512 | サンプル #2 1/512 | サンプル #2 1/512 |
| H | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | サンプル#3 1/512 | サンプル#3 1/512 | サンプル#3 1/512 |
表2:1/2〜1/512の範囲の希釈液中のナイーブ血清サンプルを評価するための実施例96ウェルプレートレイアウト。AAV NAbsに対して陽性であることが知られているサンプル(投与後サンプル)を評価する場合、またはより高い力価が必要な場合、より高い希釈がアッセイに組み込まれる。MO (-C): メディアのみのコントロール。VO (+C): ウイルスとメディアのみを制御します。mAb:AAVに対するモノクローナル抗体(NAb陽性対照)。
4. 3日目 - 細胞への基質の固定と添加
- 1x PBSのアリコートを37°C(〜25mL/96ウェルプレート)に予備温温する。PBS(〜25mL/96ウェルプレート)および二重蒸留H2O(重水素減少水、〜25mL/96ウェルプレート)の別々のアリコートを4°Cに冷却する。 ボルテックス処理により、50 mL 円錐遠心管内の 10 mL 重水素減少水に BCIP/NBT のペレット ( 材料表を参照) を溶解します (2 x 96 ウェルプレートには 10 mL で十分です)。
- 吸引ベースの吸引システムまたはヒュームフード真空に取り付けられた血清学的ピペットまたは類似のものを使用して、96ウェルプレートのウェルから培地を吸引する。血清学的ピペットの先端をウェルにそっと入れ、接着した細胞を乱さないように注意しながら培地を取り除きます。
- ピペットを用いて50 μLのRT 4% PFAを各ウェルに加える。プレートをホイルで包み、RTで10分間放置してセルを固定します。
警告:パラホルムアルデヒド(PFA)は発癌物質の可能性があり、皮膚やアイコンタクト、吸入によって有毒です。ヒュームフードに適切な個人用保護具とフェイスマスクでハンドルをはめてください。PBSで希釈した新鮮な4%PFAを作ります(96ウェルプレートあたり約7mLが必要)。
- ピペットを用いて50 μLのRT 4% PFAを各ウェルに加える。プレートをホイルで包み、RTで10分間放置してセルを固定します。
- 細胞を洗浄し、200 μLのRT 1x PBSで吸引する。この手順を 2 回繰り返します。
注: マルチチャンネルピペットは、ピペッティングステップの効率的なオプションです。 - 各ウェルに予め加温したPBSのピペット200 μLを、プレートをホイルで包み、65°Cで90分間インキュベートして、内因性アルカリホスファターゼ活性30を変性させた。
- ウェルを吸引し、200 μLの冷たい(4°C)PBSで細胞を洗浄する。再度吸引し、200μlの冷たい重水素減少水で洗浄し、再度吸引する。
- 溶解したBCIP/NBT(ステップ4.1で調製)のピペット50 μLを各ウェルに入れます。
- プレートをホイルで包み、RTで2〜24時間インキュベートする。
注: 実行間のインキュベーション時間に一貫性を持たせてください。時間の柔軟性により、ユーザーは3日目または翌日に井戸を撮影することができます。 - 光学顕微鏡カメラを使用して、4倍の対物レンズを使用して各ウェルの写真を撮影し、実施されるすべてのアッセイで同じ露出、ホワイトバランス、および光設定が一貫して使用されるようにします。
- 各ウェルを同じ位置に配置し、ウェルの端が写真に見えないようにします。写真をTIF形式などで保存します。
注:特定の設定は顕微鏡によって異なりますが、バックグラウンド照明が高く、ウェル全体で一貫している場合、定量が最も効果的です(図1B)。
- 各ウェルを同じ位置に配置し、ウェルの端が写真に見えないようにします。写真をTIF形式などで保存します。
5. ImageJを用いた中和活性を求める定量
- 無料で入手できるソフトウェア「ImageJ」をダウンロードしてインストールします( 資料表参照)。
- ImageJで解析する画像を開くには、[ ファイルを開く]> 選択します(図2)。
- カラー画像を使用する場合は、「画像」 >「種類」>「8 ビット」を選択してグレースケールに変換します。
- 画像をクリックして しきい値>調整>ます。すべての色付きの領域が赤で色付けされるまでしきい値を調整しますが、背景は赤で色付けされません。NBT/BCIPを添加すると、着色された生成物がhPLAPを発現する細胞の周囲に沈着する。
メモ: 同じプレートでキャプチャされたすべての画像に同じしきい値設定を使用することをお勧めします。 - 「分析」>「測定値の設定」をクリックし、「面積」、「しきい値に制限」、「面積分率」、および「ラベルの表示」チェックボックスにチェックを入れ、「OK」をクリックします。
- 特定のウェルの信号読み取り値(着色の割合)を決定するには、「 分析>測定」をクリックします。ポップアップウィンドウの「%エリア」列には、信号の読み取り値が表示されます。
- すべてのサンプル反復に対して定量を実行します。汚染されたウェル、不均一な細胞分布を示すウェル、または細胞密度または照明が変化するウェルを除外する。
注: 除外を検討する必要がある井戸の例については、 補足図 1 を参照してください。典型的には、3〜4ウェルは、96ウェルプレートからの排除を必要とし得る。 図2は 、ImageJを用いた定量プロセスを視覚的に表現したものである。
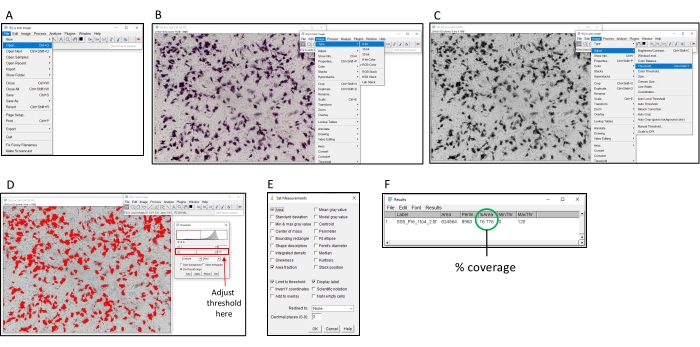
図2:ImageJソフトウェアを使用して着色率を決定する手順。 (A) 解析する画像をImageJソフトウェアで開きます。(B) 画像を 8 ビットのグレースケールに変換します。(C) しきい値ウィンドウを開きます。(D) 最大しきい値を調整して、すべての色付きの領域がカバーされるようにしますが、背景領域はカバーされません (このしきい値はプレート全体で一貫している必要があります)。(E)「分析」ドロップボックスを選択し、「測定値の設定」をクリックして、「面積」、「面積分率」、「限界しきい値」、「表示ラベル」にチェックマークを付け、「OK」をクリックします。(F)「測定」をクリックして、カバーされた領域を測定します。% 領域は、色付けされた画像の割合を示します。次いで、これを対照サンプルと共に使用して、TI50 力価を決定することができる。 この図の拡大版を表示するには、ここをクリックしてください。
6. 形質導入阻害(TI50)力価の判定
- (1)メディアのみの制御(ベースライン信号の読み取り)について、(ステップ5で説明した手順を使用して)反復からの平均読み出しを決定します。(2)ウイルス+メディアのみ制御(最大信号読み取り値)。(3)目的のウイルス+血清サンプル。
- 次の式を使用して阻害の割合を計算します。
100-[(試験サンプルシグナル読み出し(ウイルス+目的の血清サンプル)-ベースラインシグナル読み出し(培地のみコントロール))/(最大シグナル読み出し(培地およびウイルスのみ)-ベースラインシグナル読み出し)×100]=%形質導入阻害13。 - 6.2の式を用いて、すべてのサンプルについて各希釈の全反復から%形質導入阻害を計算する。すべてのサンプルおよび対照について各希釈についての技術的反復間の平均形質導入阻害を決定する。
- hPLAP活性の50%以上の形質導入阻害をもたらすサンプルの最低希釈率を決定することによって、目的のサンプルの50%形質導入阻害力価( TI50力価)を計算する。例えば、サンプルの1/8希釈が6.2で行った計算に基づいて50%を超える形質導入阻害を有する場合(および1/4希釈でそうでない場合)、TI50 力価を1/8として報告する。
中和AAV粒子の定量
- 以下の式を用いて、所与のサンプルの血清のμL当たりの中和AAV粒子の数を計算する:
((MOIx細胞数/ウェル)/(血清の体積/TI50 力価の希釈因子))/2=中和AAV粒子/血清9のμL。
注:2で割ると、中和粒子の50%を測定するTI50が占められます。アッセイが80 μLの希釈されていない血清と1 x 104細胞に播種された15kのMOIを使用した1/4(25%血清、75%希釈剤)のTI50力価を与えるサンプルの場合、次の計算が使用されます:((15000 x 10000)/(80/4))/ 2 = 3.75x106中和粒子/ μLの血清。
結果
プレートカバレッジに最適なウイルス投与量を確立するための形質導入アッセイ
十分に確立された線維肉腫細胞株であるHT1080細胞を、このアッセイのために選択した。1 x 104 HT1080細胞/ウェルの濃度は、96ウェルプレートの各ウェルにおいて〜50%の細胞コンフルエント性を提供しました。アッセイに最適なウイルス濃度を決定するために、hPLAP(ヒト胎盤アルカリホスファ...
ディスカッション
この報告は、インビトロウイルス形質導入の程度に対応する発色反応を評価することによって、所与の血清サンプル中のAAV中和の程度を評価する比色アッセイを記載する。このプロトコールの開発は、免疫組織化学などの用途におけるタンパク質標的検出のための染色ツールとして、またウイルス形質導入を評価するためのレポーターツールとして広く利用されてきた酵素アルカリホ?...
開示事項
著者らは開示するものは何もありません。
謝辞
この研究は、JRMとCJT(ID 1163732)への国家保健医療研究評議会プロジェクト助成金と、ビクトリア州政府の運用インフラ支援プログラムによって部分的に資金提供されました。SBは、共同ベーカーハートと糖尿病研究所 - ラトローブ大学博士奨学金によってサポートされています。KLWは、シャイン・オン・ファウンデーションとオーストラリア国立心臓財団(ID 102539)のフューチャー・リーダー・フェローシップの支援を受けています。JRMは、国立衛生医学研究評議会上級研究員(ID 1078985)の支援を受けています。
資料
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin/EDTA | Gibco | 25300-054 | |
| 50 mL conical centrifuge tube | Falcon | 14-432-22 | Or equivalent |
| 75 cm2 square flasks | Falcon | 353136 | Or equivalent |
| 96 well flat bottomed plate | Falcon | 353072 | |
| AAV6-CMV-hPLAP Vector | Muscle Research & Therapeutics Lab (University of Melbourne, Australia) AAV6-CMV-hPLAP can be provided upon request. | ||
| Aluminium foil | |||
| Anti-AAV6 (intact particle) mouse monoclonal antibody, (ADK6) | PROGEN | 610159 | Positive control monoclonal antibody |
| BCIP/NBT | SIGMAFAST | B5655 | |
| Cell and tissue culture safety cabinet | |||
| Electronic Pipette | 5 & 10 mL stripette inserts | ||
| Fetal Bovine Serum | Gibco | 10099-141 | |
| Haemocytometer | |||
| High glucose Dulbecco's Modified Eagle Medium (DMEM) | Gibco | 11965118 | |
| HT1080 cells | ATCC | ||
| ImageJ Software | Freely available: https://imagej.nih.gov/ij/download.html | ||
| Incubator | 37 °C, 5% CO2 | ||
| Light microscope with camera | Capable of taking photos with a 4x objective lens | ||
| Oven | For a 65 °C incubation | ||
| Paraformaldehyde | MERCK | 30525-89-4 | |
| Penicillin Streptomycin | Gibco | 15140-122 | |
| Phosphate buffered saline | |||
| Pipettes and tips | 20 μL, 200 μL & 1 mL single pipettes and tips & 200 μL multichannel pipette | ||
| Stericup quick release filter | Millipore | S2GPU10RE | Used for combining media reagents |
| Trypan blue solution | Sigma-Aldrich | T8154 | |
| VACUETTE TUBE 8 ml CAT Serum Separator Clot Activator | Greiner BIO-ONE | 455071 | Used for serum collection & processing from sheep |
| Water bath |
参考文献
- Bass-Stringer, S., et al. Adeno-associated virus gene therapy: Translational progress and future prospects in the treatment of heart failure. Heart, Lung and Circulation. 27 (11), 1285-1300 (2018).
- Casey, G. A., Papp, K. M., MacDonald, I. M. Ocular gene therapy with adeno-associated virus vectors: current outlook for patients and researchers. Journal of Ophthalmic and Vision Research. 15 (3), 396-399 (2020).
- Lykken, E. A., Shyng, C., Edwards, R. J., Rozenberg, A., Gray, S. J. Recent progress and considerations for AAV gene therapies targeting the central nervous system. Journal of Neurodevelopmental Disorders. 10 (1), 16 (2018).
- Guggino, W. B., Cebotaru, L. Adeno-Associated Virus (AAV) gene therapy for cystic fibrosis: Current barriers and recent developments. Expert Opinion on Biological Therapy. 17 (10), 1265-1273 (2017).
- Perrin, G. Q., Herzog, R. W., Markusic, D. M. Update on clinical gene therapy for hemophilia. Blood. 133 (5), 407-414 (2019).
- Wang, D., Tai, P. W. L., Gao, G. Adeno-associated virus vector as a platform for gene therapy delivery. Nature Reviews Drug Discovery. 18 (5), 358-378 (2019).
- Kuzmin, D. A., et al. The clinical landscape for AAV gene therapies. Nature Reviews Drug Discovery. 20 (3), 173-174 (2021).
- Russell, S., et al. Efficacy and safety of voretigene neparvovec (AAV2-hRPE65v2) in patients with RPE65-mediated inherited retinal dystrophy: A randomised, controlled, open-label, phase 3 trial. Lancet. 390 (10097), 849-860 (2017).
- Weber, T. Anti-AAV Antibodies in AAV gene therapy: Current challenges and possible solutions. Frontiers in Immunology. 12, 658399 (2021).
- Weeks, K. L., et al. Phosphoinositide 3-kinase p110alpha is a master regulator of exercise-induced cardioprotection and PI3K gene therapy rescues cardiac dysfunction. Circulation: Heart Failure. 5 (4), 523-534 (2012).
- Gregorevic, P., et al. Systemic delivery of genes to striated muscles using adeno-associated viral vectors. Nature Medicine. 10 (8), 828-834 (2004).
- Bernardo, B. C., et al. Gene delivery of medium chain acyl-coenzyme A dehydrogenase induces physiological cardiac hypertrophy and protects against pathological remodelling. Clinical Science (London). 132 (3), 381-397 (2018).
- Meliani, A., et al. Determination of anti-adeno-associated virus vector neutralizing antibody titer with an in vitro reporter system. Human Gene Therapy Methods. 26 (2), 45-53 (2015).
- Falese, L., et al. Strategy to detect pre-existing immunity to AAV gene therapy. Gene Therapy. 24 (12), 768-778 (2017).
- Wang, D., et al. Adeno-Associated virus neutralizing antibodies in large animals and their impact on brain intraparenchymal gene transfer. Molecular Therapy - Methods & Clinical Development. 11, 65-72 (2018).
- Wang, M., et al. Prediction of adeno-associated virus neutralizing antibody activity for clinical application. Gene Therapy. 22 (12), 984-992 (2015).
- Kruzik, A., et al. Detection of biologically relevant low-titer neutralizing antibodies against adeno-associated virus require sensitive in vitro assays. Human Gene Therapy Methods. 30 (2), 35-43 (2019).
- Lehtoranta, L., Villberg, A., Santanen, R., Ziegler, T. A novel, colorimetric neutralization assay for measuring antibodies to influenza viruses. Journal of Virological Methods. 159 (2), 271-276 (2009).
- Johnston, P. B., Grayston, J. T., Loosli, C. G. Adenovirus neutralizing antibody determination by colorimetric assay. Proceedings of the Society for Experimental Biology and Medicine. 94 (2), 338-343 (1957).
- Xiaoli Zhu, T. G. . Nano-Inspired Biosensors for Protein Assay with Clinical Applications. , 237-264 (2019).
- Jungmann, A., Muller, O., Rapti, K. Cell-based measurement of neutralizing antibodies against adeno-associated virus (AAV). Methods in Molecular Biology. 1521, 109-126 (2017).
- Samineni, S., et al. Optimization, comparison, and application of colorimetric vs. chemiluminescence based indirect sandwich ELISA for measurement of human IL-23. Journal of Immunoassay and Immunochemistry. 27 (2), 183-193 (2006).
- Siddiqui, J., Remick, D. G. Improved sensitivity of colorimetric compared to chemiluminescence ELISAs for cytokine assays. Journal of Immunoassay and Immunochemistry. 24 (3), 273-283 (2003).
- Arnett, A. L., Garikipati, D., Wang, Z., Tapscott, S., Chamberlain, J. S. Immune responses to rAAV6: The Influence of canine parvovirus vaccination and neonatal administration of viral vector. Frontiers in Microbiology. 2, 220 (2011).
- Australian code for the care and use of animals for scientific purposes. National Health and Medical Research Council Available from: https://www.nhmrc.gov.au/about-us/publications/australian-code-care-and-use-animals-scientific-purposes (2013)
- Coecke, S., et al. Guidance on good cell culture practice. A report of the second ECVAM task force on good cell culture practice. Alternatives to Laboratory Animals. 33 (3), 261-287 (2005).
- Journal of Visualized Experiments. General Laboratory Techniques. Journal of Visualized Experiments Database. , (2018).
- AAV-HT1080 Cells. Stratagene Available from: https://www.chem-agilent.com/pdf/strata/240109.pdf (2003)
- Strober, W. Trypan blue exclusion test of cell viability. Current Protocols in Immunology. 111 (3), 1-3 (2015).
- Bieber, S., et al. Extracorporeal delivery of rAAV with metabolic exchange and oxygenation. Scientific Reports. 3, 1538 (2013).
- Winbanks, C. E., Beyer, C., Qian, H., Gregorevic, P. Transduction of skeletal muscles with common reporter genes can promote muscle fiber degeneration and inflammation. PLoS One. 7 (12), 51627 (2012).
- Thomas, C. J., et al. Evidence that the MEK/ERK but not the PI3K/Akt pathway is required for protection from myocardial ischemia-reperfusion injury by 3',4'-dihydroxyflavonol. European Journal of Pharmacology. 758, 53-59 (2015).
- Barger, A., et al. Use of alkaline phosphatase staining to differentiate canine osteosarcoma from other vimentin-positive tumors. Veterinary Pathology. 42 (2), 161-165 (2005).
- Gregorevic, P., et al. Evaluation of vascular delivery methodologies to enhance rAAV6-mediated gene transfer to canine striated musculature. Molecular Therapy. 17 (8), 1427-1433 (2009).
- Sharma, A., Ghosh, A., Hansen, E. T., Newman, J. M., Mohan, R. R. Transduction efficiency of AAV 2/6, 2/8 and 2/9 vectors for delivering genes in human corneal fibroblasts. Brain Research Bulletin. 81 (2-3), 273-278 (2010).
- Smejkal, G. B., Kaul, C. A. Stability of nitroblue tetrazolium-based alkaline phosphatase substrates. Journal of Histochemistry & Cytochemistry. 49 (9), 1189-1190 (2001).
- Falese, L., et al. Strategy to detect pre-existing immunity to AAV gene therapy. Gene Therapy. 24 (12), 768-778 (2017).
- Orlowski, A., et al. Successful transduction with AAV Vectors after selective depletion of anti-aav antibodies by immunoadsorption. Molecular Therapy - Methods & Clinical Development. 16, 192-203 (2020).
- Goossens, K., et al. Differential microRNA expression analysis in blastocysts by whole mount in situ hybridization and reverse transcription quantitative polymerase chain reaction on laser capture microdissection samples. Analytical Biochemistry. 423 (1), 93-101 (2012).
- Entrican, G., Wattegedera, S. R., Griffiths, D. J. Exploiting ovine immunology to improve the relevance of biomedical models. Molecular Immunology. 66 (1), 68-77 (2015).
- Walters, E. M., Prather, R. S. Advancing swine models for human health and diseases. Molecular Medicine. 110 (3), 212-215 (2013).
- Rapti, K., et al. Neutralizing antibodies against AAV serotypes 1, 2, 6, and 9 in sera of commonly used animal models. Molecular Therapy. 20 (1), 73-83 (2012).
- Tellez, J., et al. Characterization of naturally-occurring humoral immunity to AAV in sheep. PLoS One. 8 (9), 75142 (2013).
- Gupta, S., et al. Recommendations for the validation of cell-based assays used for the detection of neutralizing antibody immune responses elicited against biological therapeutics. Journal of Pharmaceutical and Biomedical Analysis. 55 (5), 878-888 (2011).
- Gupta, S., et al. Recommendations for the design, optimization, and qualification of cell-based assays used for the detection of neutralizing antibody responses elicited to biological therapeutics. Journal of Immunological Methods. 321 (1-2), 1-18 (2007).
- Shankar, G., et al. Recommendations for the validation of immunoassays used for detection of host antibodies against biotechnology products. Journal of Pharmaceutical and Biomedical Analysis. 48 (5), 1267-1281 (2008).
- U.S. Department of Health and Human Services Food and Drug Administration. Center for Drug Evaluation and Research (CDER). Immunogenicity Testing of Therapeutic Protein Products — Developing and Validating Assays for Anti-Drug Antibody Detection. U.S. Department of Health and Human Services Food and Drug Administration. , (2019).
- Baatartsogt, N., et al. A sensitive and reproducible cell-based assay via secNanoLuc to detect neutralizing antibody against adeno-associated virus vector capsid. Molecular Therapy - Methods & Clinical Development. 22, 162-171 (2021).
- Watano, R., Ohmori, T., Hishikawa, S., Sakata, A., Mizukami, H. Utility of micro mini pigs for evaluating liver-mediated gene expression in the presence of neutralizing antibody against vector capsid. Gene Therapy. 27 (9), 427-434 (2020).
- Majowicz, A., et al. Therapeutic hFIX activity achieved after single AAV5-hFIX treatment in Hemophilia B patients and NHPs with pre-existing anti-AAV5 NABs. Molecular Therapy - Methods & Clinical Development. 14, 27-36 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved