Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Пошаговый метод обнаружения нейтрализующих антител против AAV с использованием колориметрического клеточного анализа
В этой статье
Резюме
Описан комплексный лабораторный протокол и рабочий процесс анализа для быстрого, экономически эффективного и простого колориметрического анализа на основе клеток для обнаружения нейтрализующих элементов против AAV6.
Аннотация
Рекомбинантные аденоассоциированные вирусы (rAAV) оказались безопасным и успешным вектором для передачи генетического материала для лечения различных состояний здоровья как в лаборатории, так и в клинике. Тем не менее, ранее существовавшие нейтрализующие антитела (NAbs) против капсидов AAV представляют собой постоянную проблему для успешного введения генной терапии как в экспериментальных моделях крупных животных, так и в человеческих популяциях. Предварительный скрининг на иммунитет хозяина против AAV необходим для обеспечения эффективности генной терапии на основе AAV как исследовательского инструмента, так и в качестве клинически жизнеспособного терапевтического агента. Этот протокол описывает колориметрический анализ in vitro для обнаружения нейтрализующих факторов против серотипа AAV 6 (AAV6). Анализ использует реакцию между AAV, кодирующим ген-репортер щелочной фосфатазы (AP), и его субстратом NBT / BCIP, который генерирует нерастворимое количественно оцениваемое фиолетовое пятно при комбинации.
В этом протоколе образцы сыворотки объединяются с AAV-экспрессирующим AP и инкубируются, чтобы обеспечить потенциальную нейтрализующую активность. Смесь вирусной сыворотки впоследствии добавляется к клеткам, чтобы обеспечить вирусную трансдукцию любых AAV, которые не были нейтрализованы. Субстрат NBT/BCIP добавляется и подвергается хромогенной реакции, соответствующей вирусной трансдукции и нейтрализующей активности. Доля окрашенной площади количественно измеряется с помощью инструмента свободного программного обеспечения для генерации нейтрализующих титров. Этот анализ показывает сильную положительную корреляцию между окраской и концентрацией вируса. Оценка образцов сыворотки крови овец до и после введения рекомбинантного AAV6 привела к резкому увеличению нейтрализующей активности (увеличение в 125->10 000 раз). Анализ показал адекватную чувствительность для выявления нейтрализующей активности в >1:32 000 сывороточных разведений. Этот анализ обеспечивает простой, быстрый и экономически эффективный метод обнаружения NAb против AAV.
Введение
Аденоассоциированные вирусы (AAV) все чаще используются в качестве векторов для доставки генной терапии для пробного лечения различных состояний здоровья, которые влияют на сердечно-сосудистую, легочную, кровеносную, глазную и центральную нервную системы1,2,3,4,5. Популярность векторов AAV в качестве ведущей платформы генной терапии обусловлена их положительным профилем безопасности, долгосрочной экспрессией трансгенов и широким спектром тканеспецифических тропизмов1,6. Успешные результаты в исследованиях на животных проложили путь для более чем пятидесяти клинических испытаний генной терапии AAV, которые успешно достигли своих конечных точек эффективности7, а также выпуск первого коммерчески доступного препарата генной терапии AAV, одобренного Управлением по контролю за продуктами и лекарствами США8. После первоначальных успехов AAV продолжает набирать обороты в секторах фундаментальных и клинических исследований в качестве вектора выбора и в настоящее время является единственной генной терапией in vivo, одобренной для клинического использования в США и Европе9. Тем не менее, наличие ранее существовавших нейтрализующих антител (NAbs) против капсидов вектора AAV остается препятствием как для доклинических исследований, так и для эффективности клинических испытаний. NAb присутствуют как в наивных популяциях людей, так и в популяциях животных и ингибируют трансдукцию генов после введения in vivo вектора AAV1. Серопозитивность AAV является критерием исключения для большинства испытаний генной терапии, и поэтому предварительный скрининг на иммунитет хозяина имеет решающее значение как в лаборатории, так и в клинике. Создание анализа, который может обнаружить присутствие NAb против AAV, является важным шагом в рамках любого исследовательского проекта на основе генной терапии AAV. В этом отчете основное внимание уделяется AAV6, который представляет интерес для исследователей из-за его эффективной и селективной трансдукции в поперечно-полосатых мышцах (сердце и скелетные мышцы) 1,10,11,12. Генная терапия считается многообещающей стратегией для нацеливания на сердце, потому что трудно конкретно нацелиться на сердце без инвазивных процедур на открытом сердце.
Нейтрализующую активность обычно определяют с помощью клеточного анализа ингибирования трансдукции in vitro или in vivo. In vivo Анализы NAb обычно включают введение сыворотки от испытуемого (например, человека или крупного животного) мышам, за которым следует AAV с репортерным геном, с последующим тестированием экспрессии репортерного гена или соответствующего антигена. Анализы in vitro определяют титры NAb путем инкубации сыворотки или плазмы человека или крупного животного в серийных разведениях рекомбинантным AAV (rAAV), который экспрессирует репортерный ген. Клетки инфицируются смесью сыворотки и вируса, и степень, в которой экспрессия репортерного гена ингибируется, оценивается по сравнению с контрольной группой. Анализы in vitro широко используются для скрининга NAb из-за их сравнительно более низкой стоимости, быстроты тестирования и большей способности к стандартизации и валидации13,14 по сравнению с анализами in vivo. Часто сообщается, что анализы in vivo обладают большей чувствительностью15,16, но то же самое утверждение было сделано в отношении анализов in vitro14,17.
На сегодняшний день анализы in vitro NAb в основном используют люминесценцию (люциферазу) в качестве гена-репортера для обнаружения нейтрализации. Хотя метод, основанный на свете, имеет свои достоинства во многих контекстах, колориметрический/хромогенный анализ NAb может быть полезным в некоторых обстоятельствах. Колориметрические анализы для оценки нейтрализации были успешно использованы для других вирусов, таких как грипп и аденовирус18,19. Их привлекательность проистекает из их простоты, более низкой стоимости и потребности только в повседневной лабораторной аппаратуре и инструментах20. Анализы NAb, в которых используется репортерный ген на основе люминесценции, требуют дорогостоящих наборов субстратов, люминометра и соответствующего программного обеспечения для анализа21. Этот колориметрический анализ имеет то преимущество, что требует только светового микроскопа и очень дешевой подложки. Отчетность о чувствительности колориметрических и люминесцентных анализов дала противоречивые результаты. Одно исследование показало, что анализы ИФА на основе люминесценции демонстрируют большую чувствительность и сопоставимую воспроизводимость с колориметрическими анализами22, в то время как другое обнаружило, что анализы ИФА на основе колориметрии придают большую чувствительность23. Здесь представлен подробный протокол для анализа in vitro NAb против AAV, который использует хромогенную реакцию между AAV, кодирующим ген-репортер щелочной фосфатазы (AP), и нитро-синим тетразолием / 5-бром-4-хлор-3-индолилфосфатным (NBT / BCIP) субстратом. Этот пошаговый протокол был разработан на основе предыдущего отчета, в котором использовался ген-репортер hPLAP (человеческая плацентарная щелочная фосфатаза) (AAV6-hPLAP) для обнаружения нейтрализующей активности против AAV24. Этот анализ является экономически эффективным, эффективным по времени, простым в настройке и требует минимальных технических навыков, лабораторного оборудования и реагентов. Кроме того, простота этого анализа дает ему возможность быть оптимизированным для широкого применения в различных типах клеток, тканей или вирусных серотипов.
протокол
Все аспекты ухода за животными и экспериментов проводились в соответствии с руководящими принципами Института неврологии и психического здоровья Флори и Австралийским кодексом по уходу за животными и их использованию в научных целях после ссылки25. Для исследования использовались 1,5-3-летние мериносовые овцы. Схематический обзор протокола анализа приведен на рисунке 1.
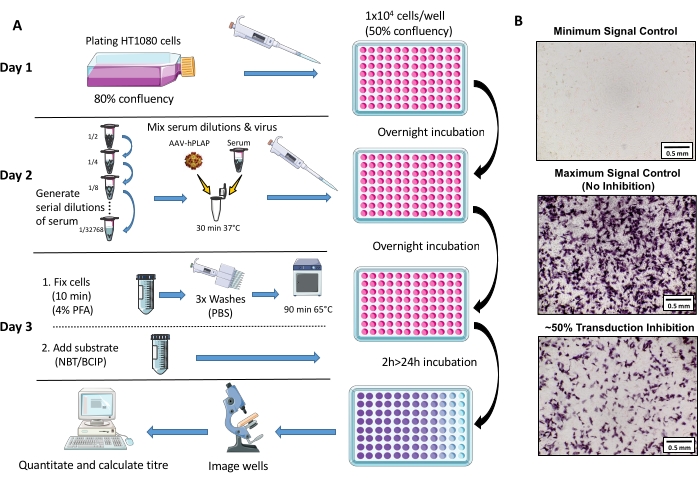
Рисунок 1: Принципиальная схема протокола анализа NAb. (A) Визуальное представление анализа NAb, иллюстрирующее основные шаги, участвующие в трехдневном протоколе. Короче говоря, клетки выращиваются и покрываются в течение ночи. На следующий день готовят серийные разведения сыворотки, инкубируют с ААВ, а затем инкубируют с клетками на ночь. На следующий день клетки фиксируют, промывают, инкубируют, объединяют с субстратом и снова инкубируют, после чего проводится визуализация и количественное определение. (B) Репрезентативные изображения минимального контроля сигнала (полное ингибирование AAV), максимального контроля сигнала (отсутствие ингибирования) и образца овечьей сыворотки с ингибированием сигнала ~50%. Шкала = 0,5 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
1. Начальная подготовка
- Для оценки у овец: собрать кровь в 8 мл сывороточного сгустка активатора (см. Таблицу материалов), оставить образец крови при комнатной температуре (РТ) на 20-30 мин, а затем раскрутить вниз при 2 100 х г в течение 15 мин. Прозрачным супернатантом, который образуется в верхней части трубок, является сыворотка. Аликвотируют прозрачную водную фазу в микроцентрифужные трубки и хранят при -80 °C.
ПРИМЕЧАНИЕ: Сыворотка при -80 °C остается стабильной в течение ~ 5 лет. Кровь собирали из сонной вены с помощью иглы 16 Г (отсечка кончика) и шприца у сознательных животных. - Нагревайте инактивацию фетальной бычьей сыворотки (FBS), помещая ее на водяную баню при 56 °C в течение 30 мин и периодически закручивайте. Для точности поместите термометр во вторую бутылку, содержащую эквивалентный объем воды, и добавьте его в тепловую ванну одновременно с бутылкой FBS. Начало тайминга, когда термометр достигнет 56 °C.
- Используйте надлежащую асептическую технику и практику клеточной культуры для всех последующих этапов, выполняемых в клеточной культуре 26,27. Распылите 70% этанола на все предметы и вытяжку перед использованием и очистите 1% гипохлорита натрия по завершении.
- Сделайте полную модифицированную орлиную среду Dulbecco (DMEM), сочетая высокий уровень глюкозы (4,5 г / л) DMEM (89%) с термоинактивированным FBS (10%) и пенициллиновым стрептомицином (1%). Комбинируйте и фильтруйте с помощью стерильной вакуумной системы фильтрации (размер пор 0,22 мкм, полиэфирсульфоновая мембрана) (см. Таблицу материалов). Хранить полный DMEM, завернутый в фольгу при температуре 4 °C.
- Установите ячейки HT1080 (см. Таблицу материалов) и пройдите в квадратную колбу размером 75 см2 , как описано в Reference28. Создайте несколько замороженных запасов клеток. Не используйте клетки после 20 проходов, так как дальнейшее прохождение может повлиять на результаты анализа.
2. День 1 - Покрытие ячеек
- Прохождение клеток HT1080 при достижении ими ~80% конфлюзии.
- Предварительно нагрейте полный DMEM (приготовленный на стадии 1.4), 0,05% трипсина-ЭДТА и 1x фосфат-буферного физиологического раствора (PBS) до 37 °C на водяной бане. Удалите питательную среду из пассированных клеток с помощью аспирационной системы.
ПРИМЕЧАНИЕ: Все аспирации в этом протоколе используют вакуумную систему с трубкой, прикрепленной к стерильной серологической пипетке объемом 5 мл. - Промыть клетки в 10 мл предварительно подогретого (37 °C) 1x PBS и трипсинизировать клетки в течение 3-4 мин в 4 мл предварительно подогретого 0,05% трипсина-ЭДТА для отделения клеток от колбы.
- Инактивируют трипсин, добавляя 6 мл предварительно нагретого полного DMEM и пипетку клеток в трубку объемом 50 мл. Рассчитайте количество и концентрацию жизнеспособных клеток с помощью гемоцитометра и метода исключения трипан-синего29.
- Разбавляют клетки до концентрации 1 х 105 клеток/мл в предварительно подогретом полном ДМЭМ. Посейте 100 мкл клеток/лунку в прозрачные 96-луночные плоскодонные пластины (1 x 104 ячейки на лунку). Инкубируют пластину при 37 °C, 5% углекислого газа (CO2) в течение 16-22 ч.
3. День 2 - Заражение клеток
- Извлеките пластину (пластины) из инкубатора и используйте световой микроскоп, чтобы подтвердить, что клетки равномерно распределены в лунках и что слияние составляет ~ 50%. Если клетки не находятся в диапазоне 45%-55% слияния, повторите протокол «День 1» и соответствующим образом скорректируйте начальную концентрацию клеток.
- Генерировать последовательные разведения интересующих образцов сыворотки в микроцентрифужных трубках объемом 1,5 мл, используя предварительно нагретый полный DMEM в качестве разбавителя. В таблице 1 показано формирование каскада разбавления для трехкратных образцов.
- Для выполнения анализа в трех экземплярах подготовьте 7,5 х 106 векторных геномов (vg)/мкл рабочего раствора AAV6-hPLAP (см. Таблицу материалов) путем разбавления раствора вирусного запаса в 1x PBS.
- Добавьте 66 мкл рабочего раствора вируса 7,5 х 106 вг/мкл в каждую пробирку, содержащую 264 мкл разбавления сыворотки/среды (330 мкл общего объема/разбавления, см. таблицу 1).
ПРИМЕЧАНИЕ: Это надежный анализ, который не требует идеальных условий культивирования. Однако для точного количественного определения и обеспечения надежности каждого прогона анализа необходимо включить следующее: (1) контроль только вируса и среды, (2) контроль только среды и (3) контроль NAb положительный контрольный образец на всех пластинах в одинаковых экспериментальных условиях. Описанный объем (330 мкл) приходится на трипликатные образцы +10% сыворотки и вирусной смеси. Выполнение реплик настоятельно рекомендуется для точного определения нейтрализующей активности.
- Смешайте разбавления вирус/сыворотка путем пипетирования и поместите пробирки, содержащие смеси вирус/сыворотка, в инкубатор при 37 °C, 5% CO2 в течение 30 мин, чтобы обеспечить потенциальную нейтрализацию.
- Пипетка 100 мкл смеси вирус/сыворотка в каждую лунку на 96-луночной пластине, содержащей 1 х 104 клетки/лунку для каждого разведения.
ПРИМЕЧАНИЕ: Это создаст окончательную вирусную концентрацию 15k вирусов / клеточной множественности инфекции (MOI) в каждой скважине. В таблице 2 приведен пример схемы пробоотборной пластины из 96 скважин для оценки проб до разбавления 1/512. - Оберните 96-луночную пластину, содержащую клетки, сыворотку и AAV-hPLAP, в фольгу и поместите в инкубатор при 37 °C, 5% CO2 на ночь в течение 16-24 ч, чтобы обеспечить проникновение AAV в клетки.
| Этикетка каскада разбавления | Разбавление | 3 образца (240 мкл) + 10% объема буфера (24 мкл) | Соотношение сыворотка:среда |
| Разбавление 1 (D1) | 1/2 | 264 мкл сыворотки 264 мкл среды | 50:50 |
| Разбавление 2 (D2) | 1/4 | 264 мкл D1 + 264 мкл носителя | 25:75 |
| Разбавление 3 (D3) | 1/8 | 264 мкл D2 +264мкл носителя | 12.5:87.5 |
| Разбавление 4 (D4) | 1/16 | 264 мкл D3 +264 мкл носителя | 6.25:93.75 |
| Разбавление 5 (D5) | 1/32 | 264 мкл D4 +264 мкл носителя | 3.13:96.87 |
| Разбавление 6 (D6) | 1/64 | 264 мкл D5 +264 мкл носителя | 1.56:98.44 |
| Разбавление 7 (D7) | 1/128 | 264 мкл D5 +264 мкл носителя | 0.78:99.22 |
| Разбавление 8 (D8) | 1/256 | 264 мкл D5 +264 мкл носителя | 0.39:99.61 |
| Разбавление 9 (D9) | 1/512 | 264 мкл D7 + 264 мкл носителя | 0.2:99.8 |
| Разбавление 10 (D10) | 1/2048 | 132 мкл D8 + 396 мкл носителя | 0.05:99.95 |
| Разбавление 11 (D11) | 1/8192 | 132 мкл D9 + 396 мкл носителя | 0.01:99.99 |
| Разбавление 12 (D12) | 1/32768 | 132 мкл D10 + 396 мкл носителя | 0.003:99.997 |
Таблица 1: Объемы сыворотки и разбавителя, необходимые для получения последовательных разведений сыворотки в трех экземплярах.
| Образец сыворотки No1 | Образец сыворотки No2 | Образец сыворотки No3 | Mono AB (mAB), элементы управления и дополнительные образцы | |||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
| A | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 50 нг Маб | 50 нг Маб | 50 нг Маб |
| B | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 5 нг Мб | 5 нг Мб | 5 нг Мб |
| C | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 0,5 нг Мб | 0,5 нг Мб | 0,5 нг Мб |
| D | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | МО (-С) | МО (-С) | МО (-С) |
| E | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | VO (+C) | VO (+C) | VO (+C) |
| F | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | Образец #1 1/512 | Образец #1 1/512 | Образец #1 1/512 |
| G | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | Образец #2 1/512 | Образец #2 1/512 | Образец #2 1/512 |
| H | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | Образец #3 1/512 | Образец #3 1/512 | Образец #3 1/512 |
Таблица 2: Пример схемы 96-луночной пластины для оценки наивных образцов сыворотки в разведении от 1/2 до 1/512. Более высокие разведения включаются в анализ, если оценка образца, как известно, является положительной для AAV NAbs (образцы после введения) или если требуется более высокий титр. MO (-C): Управление только для носителей. VO (+C): Контроль только вирусов и носителей. mAb: Моноклональное антитело против AAV (NAb-положительный контроль).
4. День 3 - Фиксация и добавление субстрата к клеткам
- Предварительно разогрейте аликвоту от 1x PBS до 37 °C (~25 мл/96-луночная плита). Охладите отдельные аликвоты PBS (~25 мл/96-луночная пластина) и двойной дистилляции H2O (DDW, ~25 мл/96-луночная плита) до 4 °C. Растворить гранулу BCIP/NBT (см. Таблицу материалов) в 10 мл DDW в конической центрифужной трубе объемом 50 мл путем вихря (10 мл достаточно для 2 х 96 плит скважины).
- Аспирируйте среду из скважин 96-луночной пластины с помощью серологической пипетки или аналогичной, прикрепленной к аспирационной системе на основе всасывания или вакууму вытяжного капота. Аккуратно поместите кончик серологической пипетки в колодец и удалите среду, соблюдая осторожность, чтобы не нарушить прилипшие клетки.
- Добавьте 50 мкл RT 4% PFA в каждую скважину с помощью пипетки. Заверните пластину в фольгу и оставьте ее в RT на 10 минут, чтобы зафиксировать клетки.
ВНИМАНИЕ: Параформальдегид (PFA) является вероятным канцерогеном и токсичен от контакта с кожей или глаз или вдыхания. Ручка в вытяжном шкафу с надлежащими средствами индивидуальной защиты, а также лицевой маской. Сделайте свежий 4% PFA, разбавленный в PBS (~ 7 мл требуется на 96-луночную пластину).
- Добавьте 50 мкл RT 4% PFA в каждую скважину с помощью пипетки. Заверните пластину в фольгу и оставьте ее в RT на 10 минут, чтобы зафиксировать клетки.
- Промыть и аспирировать клетки 200 мкл RT 1x PBS. Повторите этот шаг дважды.
ПРИМЕЧАНИЕ: Многоканальная пипетка является эффективным вариантом для этапов дозирования. - Пипетку 200 мкл предварительно нагретого ПБС в каждую лунку, заворачивают пластину в фольгу и инкубируют при 65 °С в течение 90 мин для денатурации эндогенной щелочной активности фосфатазы30.
- Аспирируйте колодцы и промывные ячейки с 200 мкл холодного (4 °C) PBS. Аспирировать снова, промыть в 200 мкл холодного DDW и снова аспирировать.
- Пипетка 50 мкл растворенного BCIP/NBT (приготовленного на стадии 4.1) в каждую лунку.
- Заверните пластину в фольгу и высиживайте при РТ в течение 2-24 ч.
ПРИМЕЧАНИЕ: Соблюдайте время инкубации между прогонами; гибкость времени позволяет пользователям фотографировать скважины либо на 3-й день, либо на следующий день. - Используя камеру светового микроскопа, фотографируйте каждую скважину с помощью объектива 4x, гарантируя, что одинаковая экспозиция, балансировка белого и настройки освещения используются последовательно для всех выполненных анализов.
- Расположите каждую скважину одинаково и убедитесь, что края скважины не видны на фотографиях. Сохраняйте фотографии в формате TIF или аналогичном.
ПРИМЕЧАНИЕ: Конкретные настройки будут варьироваться в зависимости от микроскопа, но количественное определение будет наиболее эффективным, если фоновое освещение является высоким и последовательным во всех скважинах (рисунок 1B).
- Расположите каждую скважину одинаково и убедитесь, что края скважины не видны на фотографиях. Сохраняйте фотографии в формате TIF или аналогичном.
5. Количественная оценка для определения нейтрализующей активности с помощью ImageJ
- Скачайте и установите свободно доступное программное обеспечение "ImageJ" (см. Таблицу материалов).
- Откройте изображение для анализа в ImageJ, выбрав Файл > Открыть (рисунок 2).
- При использовании цветных изображений преобразуйте их в оттенки серого, выбрав «Изображение > «Тип > 8 бит».
- Нажмите на Изображение > Настроить порог >. Отрегулируйте пороговое значение до тех пор, пока все цветные области не будут окрашены в красный цвет, а фон — нет. После добавления NBT / BCIP цветной продукт будет откладываться в области вокруг клеток, экспрессирующих hPLAP.
ПРИМЕЧАНИЕ: Рекомендуется использовать одну и ту же настройку порога для всех изображений, снятых на одной пластине. - Нажмите «Анализировать > установить измерения», установите флажки «Площадь», «Предел порога», «Доля площади» и «Отображать метку» и нажмите «ОК».
- Чтобы определить показания сигнала (процент окраски) данной скважины, нажмите « Анализировать > измерение». В столбце «% площади» всплывающего окна отображается показание сигнала.
- Выполните количественное определение для всех реплик образцов. Исключите любые загрязненные скважины, скважины с неравномерным распределением ячеек или скважины, различающиеся по плотности ячеек или освещению.
ПРИМЕЧАНИЕ: См. дополнительный рисунок 1 для примеров скважин, которые следует рассматривать на предмет исключения. Как правило, 3-4 скважины могут потребовать исключения из 96-луночной плиты. На рисунке 2 представлено визуальное представление процесса количественного определения с помощью ImageJ.
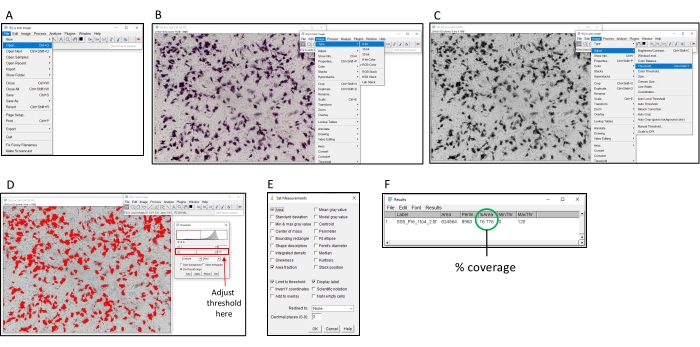
Рисунок 2: Шаги для определения процентной окраски с помощью программного обеспечения ImageJ. (A) Откройте изображение для анализа с помощью программного обеспечения ImageJ. (B) Преобразуйте изображение в 8-битные оттенки серого. (C) Откройте пороговое окно. (D) Отрегулируйте максимальное пороговое значение таким образом, чтобы все цветные области были покрыты, а фоновая область — нет (это пороговое значение должно быть одинаковым на всей пластине). (E) Выберите dropbox «Анализировать», нажмите «Установить измерения» и установите «Площадь», «Доля площади», «Предельный порог» и «Метка дисплея», а затем нажмите «ОК». (F) Нажмите «Измерить», чтобы измерить площадь покрытия. Область % указывает на пропорцию цветного изображения. Затем его можно использовать с контрольными образцами для определения титра TI50 . Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
6. Определение титра ингибирования трансдукции (TI50)
- Определите среднее считывание из реплик (используя шаги, описанные в шаге 5) для следующего: (1) Управление только носителем (базовое считывание сигнала). (2) Контроль только вирус + носитель (максимальное считывание сигнала). (3) Вирус + образцы сыворотки, представляющие интерес.
- Рассчитайте процент торможения по следующей формуле:
100 - [(Считывание сигнала тестового образца (интересующий вирус + образец сыворотки) - базовое считывание сигнала (контроль только на носителе)) / (максимальное считывание сигнала (только носители и вирусы) - базовое считывание сигнала) x 100] = % ингибирование трансдукции13. - Рассчитайте % ингибирования трансдукции от всех реплик каждого разбавления для всех образцов, используя формулу в 6.2. Определите среднее ингибирование трансдукции между техническими репликами для каждого разбавления для всех образцов и контрольных групп.
- Рассчитайте титр ингибирования трансдукции 50% (титр TI50 ) интересующей выборки путем определения наименьшего разбавления образца, которое дает 50% или более ингибирование трансдукции активности hPLAP. например, если разбавление образца на 1/8 имеет более 50% ингибирования трансдукции на основе расчета, выполненного в 6,2 (а разбавление 1/4 не превышает), сообщите титр TI50 как 1/8.
7. Определение нейтрализованных частиц AAV
- Рассчитайте количество нейтрализованных частиц AAV на мкл сыворотки для данного образца, используя следующую формулу:
((MOI x количество клеток/лунка) / (объем сыворотки / коэффициент разбавления титра TI50 )) / 2 = нейтрализованные частицы AAV / мкл сыворотки9.
ПРИМЕЧАНИЕ: Деление на 2 учитывает TI50, измеряющее 50% нейтрализованных частиц. Для образца, который дает титр TI50 1/4 (25% сыворотки, 75% разбавителя), в котором в анализе используется 80 мкл неразбавленной сыворотки и MOI 15k, нанесенный на 1 x 104 клетки, будет использоваться следующий расчет: ((15000 x 10000) / (80/4)) / 2 = 3,75x106 нейтрализованных частиц / мкл сыворотки.
Результаты
Трансдукционный анализ для установления оптимальной вирусной дозировки для покрытия пластин
Для этого анализа были отобраны клетки HT1080, хорошо зарекомендовавшая себя клеточная линия фибросаркомы. Концентрация 1 х 104 HT1080 клеток/лунка обеспечивала ~50% клеточного слияни...
Обсуждение
В этом отчете описывается колориметрический анализ, который оценивает степень нейтрализации AAV в данном образце сыворотки путем оценки хромогенной реакции, соответствующей степени вирусной трансдукции in vitro. Разработка протокола была основана на известной хромогенной реакции м?...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Это исследование финансировалось грантом Национального совета по здравоохранению и медицинским исследованиям JRM и CJT (ID 1163732) и частично Программой поддержки оперативной инфраструктуры правительства Виктории. SB поддерживается совместной докторской стипендией Института сердца и диабета Бейкера и Университета Ла Троуб. KLW поддерживается Фондом «Сияние» и стипендией «Будущий лидер» от Национального фонда сердца Австралии (ID 102539). JRM поддерживается Старшим научным сотрудником Национального совета по здравоохранению и медицинским исследованиям (ID 1078985).
Материалы
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin/EDTA | Gibco | 25300-054 | |
| 50 mL conical centrifuge tube | Falcon | 14-432-22 | Or equivalent |
| 75 cm2 square flasks | Falcon | 353136 | Or equivalent |
| 96 well flat bottomed plate | Falcon | 353072 | |
| AAV6-CMV-hPLAP Vector | Muscle Research & Therapeutics Lab (University of Melbourne, Australia) AAV6-CMV-hPLAP can be provided upon request. | ||
| Aluminium foil | |||
| Anti-AAV6 (intact particle) mouse monoclonal antibody, (ADK6) | PROGEN | 610159 | Positive control monoclonal antibody |
| BCIP/NBT | SIGMAFAST | B5655 | |
| Cell and tissue culture safety cabinet | |||
| Electronic Pipette | 5 & 10 mL stripette inserts | ||
| Fetal Bovine Serum | Gibco | 10099-141 | |
| Haemocytometer | |||
| High glucose Dulbecco's Modified Eagle Medium (DMEM) | Gibco | 11965118 | |
| HT1080 cells | ATCC | ||
| ImageJ Software | Freely available: https://imagej.nih.gov/ij/download.html | ||
| Incubator | 37 °C, 5% CO2 | ||
| Light microscope with camera | Capable of taking photos with a 4x objective lens | ||
| Oven | For a 65 °C incubation | ||
| Paraformaldehyde | MERCK | 30525-89-4 | |
| Penicillin Streptomycin | Gibco | 15140-122 | |
| Phosphate buffered saline | |||
| Pipettes and tips | 20 μL, 200 μL & 1 mL single pipettes and tips & 200 μL multichannel pipette | ||
| Stericup quick release filter | Millipore | S2GPU10RE | Used for combining media reagents |
| Trypan blue solution | Sigma-Aldrich | T8154 | |
| VACUETTE TUBE 8 ml CAT Serum Separator Clot Activator | Greiner BIO-ONE | 455071 | Used for serum collection & processing from sheep |
| Water bath |
Ссылки
- Bass-Stringer, S., et al. Adeno-associated virus gene therapy: Translational progress and future prospects in the treatment of heart failure. Heart, Lung and Circulation. 27 (11), 1285-1300 (2018).
- Casey, G. A., Papp, K. M., MacDonald, I. M. Ocular gene therapy with adeno-associated virus vectors: current outlook for patients and researchers. Journal of Ophthalmic and Vision Research. 15 (3), 396-399 (2020).
- Lykken, E. A., Shyng, C., Edwards, R. J., Rozenberg, A., Gray, S. J. Recent progress and considerations for AAV gene therapies targeting the central nervous system. Journal of Neurodevelopmental Disorders. 10 (1), 16 (2018).
- Guggino, W. B., Cebotaru, L. Adeno-Associated Virus (AAV) gene therapy for cystic fibrosis: Current barriers and recent developments. Expert Opinion on Biological Therapy. 17 (10), 1265-1273 (2017).
- Perrin, G. Q., Herzog, R. W., Markusic, D. M. Update on clinical gene therapy for hemophilia. Blood. 133 (5), 407-414 (2019).
- Wang, D., Tai, P. W. L., Gao, G. Adeno-associated virus vector as a platform for gene therapy delivery. Nature Reviews Drug Discovery. 18 (5), 358-378 (2019).
- Kuzmin, D. A., et al. The clinical landscape for AAV gene therapies. Nature Reviews Drug Discovery. 20 (3), 173-174 (2021).
- Russell, S., et al. Efficacy and safety of voretigene neparvovec (AAV2-hRPE65v2) in patients with RPE65-mediated inherited retinal dystrophy: A randomised, controlled, open-label, phase 3 trial. Lancet. 390 (10097), 849-860 (2017).
- Weber, T. Anti-AAV Antibodies in AAV gene therapy: Current challenges and possible solutions. Frontiers in Immunology. 12, 658399 (2021).
- Weeks, K. L., et al. Phosphoinositide 3-kinase p110alpha is a master regulator of exercise-induced cardioprotection and PI3K gene therapy rescues cardiac dysfunction. Circulation: Heart Failure. 5 (4), 523-534 (2012).
- Gregorevic, P., et al. Systemic delivery of genes to striated muscles using adeno-associated viral vectors. Nature Medicine. 10 (8), 828-834 (2004).
- Bernardo, B. C., et al. Gene delivery of medium chain acyl-coenzyme A dehydrogenase induces physiological cardiac hypertrophy and protects against pathological remodelling. Clinical Science (London). 132 (3), 381-397 (2018).
- Meliani, A., et al. Determination of anti-adeno-associated virus vector neutralizing antibody titer with an in vitro reporter system. Human Gene Therapy Methods. 26 (2), 45-53 (2015).
- Falese, L., et al. Strategy to detect pre-existing immunity to AAV gene therapy. Gene Therapy. 24 (12), 768-778 (2017).
- Wang, D., et al. Adeno-Associated virus neutralizing antibodies in large animals and their impact on brain intraparenchymal gene transfer. Molecular Therapy - Methods & Clinical Development. 11, 65-72 (2018).
- Wang, M., et al. Prediction of adeno-associated virus neutralizing antibody activity for clinical application. Gene Therapy. 22 (12), 984-992 (2015).
- Kruzik, A., et al. Detection of biologically relevant low-titer neutralizing antibodies against adeno-associated virus require sensitive in vitro assays. Human Gene Therapy Methods. 30 (2), 35-43 (2019).
- Lehtoranta, L., Villberg, A., Santanen, R., Ziegler, T. A novel, colorimetric neutralization assay for measuring antibodies to influenza viruses. Journal of Virological Methods. 159 (2), 271-276 (2009).
- Johnston, P. B., Grayston, J. T., Loosli, C. G. Adenovirus neutralizing antibody determination by colorimetric assay. Proceedings of the Society for Experimental Biology and Medicine. 94 (2), 338-343 (1957).
- Xiaoli Zhu, T. G. . Nano-Inspired Biosensors for Protein Assay with Clinical Applications. , 237-264 (2019).
- Jungmann, A., Muller, O., Rapti, K. Cell-based measurement of neutralizing antibodies against adeno-associated virus (AAV). Methods in Molecular Biology. 1521, 109-126 (2017).
- Samineni, S., et al. Optimization, comparison, and application of colorimetric vs. chemiluminescence based indirect sandwich ELISA for measurement of human IL-23. Journal of Immunoassay and Immunochemistry. 27 (2), 183-193 (2006).
- Siddiqui, J., Remick, D. G. Improved sensitivity of colorimetric compared to chemiluminescence ELISAs for cytokine assays. Journal of Immunoassay and Immunochemistry. 24 (3), 273-283 (2003).
- Arnett, A. L., Garikipati, D., Wang, Z., Tapscott, S., Chamberlain, J. S. Immune responses to rAAV6: The Influence of canine parvovirus vaccination and neonatal administration of viral vector. Frontiers in Microbiology. 2, 220 (2011).
- Australian code for the care and use of animals for scientific purposes. National Health and Medical Research Council Available from: https://www.nhmrc.gov.au/about-us/publications/australian-code-care-and-use-animals-scientific-purposes (2013)
- Coecke, S., et al. Guidance on good cell culture practice. A report of the second ECVAM task force on good cell culture practice. Alternatives to Laboratory Animals. 33 (3), 261-287 (2005).
- Journal of Visualized Experiments. General Laboratory Techniques. Journal of Visualized Experiments Database. , (2018).
- AAV-HT1080 Cells. Stratagene Available from: https://www.chem-agilent.com/pdf/strata/240109.pdf (2003)
- Strober, W. Trypan blue exclusion test of cell viability. Current Protocols in Immunology. 111 (3), 1-3 (2015).
- Bieber, S., et al. Extracorporeal delivery of rAAV with metabolic exchange and oxygenation. Scientific Reports. 3, 1538 (2013).
- Winbanks, C. E., Beyer, C., Qian, H., Gregorevic, P. Transduction of skeletal muscles with common reporter genes can promote muscle fiber degeneration and inflammation. PLoS One. 7 (12), 51627 (2012).
- Thomas, C. J., et al. Evidence that the MEK/ERK but not the PI3K/Akt pathway is required for protection from myocardial ischemia-reperfusion injury by 3',4'-dihydroxyflavonol. European Journal of Pharmacology. 758, 53-59 (2015).
- Barger, A., et al. Use of alkaline phosphatase staining to differentiate canine osteosarcoma from other vimentin-positive tumors. Veterinary Pathology. 42 (2), 161-165 (2005).
- Gregorevic, P., et al. Evaluation of vascular delivery methodologies to enhance rAAV6-mediated gene transfer to canine striated musculature. Molecular Therapy. 17 (8), 1427-1433 (2009).
- Sharma, A., Ghosh, A., Hansen, E. T., Newman, J. M., Mohan, R. R. Transduction efficiency of AAV 2/6, 2/8 and 2/9 vectors for delivering genes in human corneal fibroblasts. Brain Research Bulletin. 81 (2-3), 273-278 (2010).
- Smejkal, G. B., Kaul, C. A. Stability of nitroblue tetrazolium-based alkaline phosphatase substrates. Journal of Histochemistry & Cytochemistry. 49 (9), 1189-1190 (2001).
- Falese, L., et al. Strategy to detect pre-existing immunity to AAV gene therapy. Gene Therapy. 24 (12), 768-778 (2017).
- Orlowski, A., et al. Successful transduction with AAV Vectors after selective depletion of anti-aav antibodies by immunoadsorption. Molecular Therapy - Methods & Clinical Development. 16, 192-203 (2020).
- Goossens, K., et al. Differential microRNA expression analysis in blastocysts by whole mount in situ hybridization and reverse transcription quantitative polymerase chain reaction on laser capture microdissection samples. Analytical Biochemistry. 423 (1), 93-101 (2012).
- Entrican, G., Wattegedera, S. R., Griffiths, D. J. Exploiting ovine immunology to improve the relevance of biomedical models. Molecular Immunology. 66 (1), 68-77 (2015).
- Walters, E. M., Prather, R. S. Advancing swine models for human health and diseases. Molecular Medicine. 110 (3), 212-215 (2013).
- Rapti, K., et al. Neutralizing antibodies against AAV serotypes 1, 2, 6, and 9 in sera of commonly used animal models. Molecular Therapy. 20 (1), 73-83 (2012).
- Tellez, J., et al. Characterization of naturally-occurring humoral immunity to AAV in sheep. PLoS One. 8 (9), 75142 (2013).
- Gupta, S., et al. Recommendations for the validation of cell-based assays used for the detection of neutralizing antibody immune responses elicited against biological therapeutics. Journal of Pharmaceutical and Biomedical Analysis. 55 (5), 878-888 (2011).
- Gupta, S., et al. Recommendations for the design, optimization, and qualification of cell-based assays used for the detection of neutralizing antibody responses elicited to biological therapeutics. Journal of Immunological Methods. 321 (1-2), 1-18 (2007).
- Shankar, G., et al. Recommendations for the validation of immunoassays used for detection of host antibodies against biotechnology products. Journal of Pharmaceutical and Biomedical Analysis. 48 (5), 1267-1281 (2008).
- U.S. Department of Health and Human Services Food and Drug Administration. Center for Drug Evaluation and Research (CDER). Immunogenicity Testing of Therapeutic Protein Products — Developing and Validating Assays for Anti-Drug Antibody Detection. U.S. Department of Health and Human Services Food and Drug Administration. , (2019).
- Baatartsogt, N., et al. A sensitive and reproducible cell-based assay via secNanoLuc to detect neutralizing antibody against adeno-associated virus vector capsid. Molecular Therapy - Methods & Clinical Development. 22, 162-171 (2021).
- Watano, R., Ohmori, T., Hishikawa, S., Sakata, A., Mizukami, H. Utility of micro mini pigs for evaluating liver-mediated gene expression in the presence of neutralizing antibody against vector capsid. Gene Therapy. 27 (9), 427-434 (2020).
- Majowicz, A., et al. Therapeutic hFIX activity achieved after single AAV5-hFIX treatment in Hemophilia B patients and NHPs with pre-existing anti-AAV5 NABs. Molecular Therapy - Methods & Clinical Development. 14, 27-36 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены