需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用基于比色细胞的测定法检测针对 AAV 的中和抗体的分步方法
摘要
介绍了全面的实验室实验方案和分析工作流程,用于快速、经济高效且直接的基于细胞的比色测定,以检测针对 AAV6 的中和元素。
摘要
重组腺相关病毒(rAAV)已被证明是转移遗传物质以治疗实验室和临床各种健康状况的安全和成功的载体。然而,预先存在的针对AAV衣壳的中和抗体(NAbs)对在大型动物实验模型和人类群体中成功施用基因疗法构成了持续的挑战。对宿主对AAV的免疫力进行初步筛查是必要的,以确保基于AAV的基因疗法作为研究工具和临床上可行的治疗剂的有效性。该协议描述了一种比色 体外 测定,以检测针对AAV血清型6(AAV6)的中和因子。该测定利用编码碱性磷酸酶(AP)报告基因的AAV与其底物NBT / BCIP之间的反应,其组合产生不溶性可量化的紫色染色剂。
在该协议中,将血清样品与表达AAV的AP结合并孵育以允许潜在的中和活性发生。随后将病毒血清混合物添加到细胞中,以允许任何未中和的AAV的病毒转导。加入NBT / BCIP底物并进行显色反应,对应于病毒转导和中和活性。使用免费软件工具定量着色区域的比例,以产生中和滴度。该测定显示着色与病毒浓度之间具有很强的正相关关系。在给予重组AAV6之前和之后对绵羊血清样本的评估导致中和活性急剧增加(增加125至>10,000倍)。该测定显示出足够的灵敏度,可以检测>1:32,000血清稀释液中的中和活性。该测定提供了一种简单、快速且经济高效的方法来检测针对 AAV 的 NAb。
引言
腺相关病毒(AAV)越来越多地被用作将基因疗法递送到影响心血管,肺,循环,眼部和中枢神经系统的各种健康状况的试验治疗的载体1,2,3,4,5。AAV载体作为领先的基因治疗平台的受欢迎程度源于其积极的安全性,长期转基因表达和广泛的组织特异性倾向1,6。动物研究的成功结果为五十多项AAV基因治疗临床试验铺平了道路,这些临床试验已成功达到其疗效终点7,以及美国食品和药物管理局批准的首个市售AAV基因治疗药物的发布8。继最初的成功之后,AAV作为首选载体继续在基础和临床研究领域获得牵引力,并且是目前美国和欧洲唯一批准用于临床的体内基因疗法9。尽管如此,预先存在的针对AAV载体衣壳的中和抗体(NAbs)的存在仍然是临床前研究和临床试验疗效的障碍。NAbs存在于幼稚的人类和动物种群中,并在体内施用AAV载体1后抑制基因转导。AAV血清阳性是大多数基因治疗试验的排除标准,因此宿主免疫的初步筛查在实验室和临床中都至关重要。建立一种可以检测NAbs对AAV存在的测定是任何基于AAV基因治疗的研究项目管道中必不可少的一步。本报告重点介绍AAV6,由于其在横纹肌(心脏和骨骼肌)中的高效和选择性转导,研究人员一直对AAV6感兴趣1,10,11,12。基因治疗被认为是一种针对心脏的有前途的策略,因为如果没有侵入性的心脏直视手术,很难专门针对心脏。
中和活性通常使用基于细胞的体外或体内转导抑制测定法测定。体内 NAb测定通常涉及将来自测试对象(例如,人类或大型动物)的血清施用于小鼠体内,然后使用具有报告基因的AAV,然后测试报告基因或相应抗原的表达。体外检测通过将来自人类或大型动物的血清或血浆与表达报告基因的重组 AAV (rAAV) 以连续稀释液培养来确定 NAb 滴度。细胞被血清/病毒混合物感染,并与对照组相比,评估报告基因表达被抑制的程度。体外检测广泛用于NAb筛选,因为与体内测定相比,其成本相对较低,测试速度快,标准化和验证能力更强13,14。据报道,体内测定通常具有更高的灵敏度15,16,但对体外测定也提出了相同的要求14,17。
迄今为止, 体外 NAb测定主要使用发光(荧光素酶)作为报告基因来检测中和。尽管基于光的方法在许多情况下都有其优点,但在某些情况下,比色/显色NAb测定可能是有利的。用于评估中和的比色法已成功用于其他病毒,如流感和腺病毒18,19。它们的吸引力源于其简单性,低成本以及对日常实验室仪器和工具的要求20。使用基于发光的报告基因的NAb检测需要昂贵的底物试剂盒、光度计和相应的软件进行分析21。这种比色测定的优点是只需要光学显微镜和非常便宜的底物。比色法与发光法的灵敏度报告产生了相互矛盾的结果。一项研究表明,基于发光的 ELISA 检测方法与比色法相比具有更高的灵敏度和可比的再现性22,而另一项研究表明,基于比色法的 ELISA 检测可赋予更高的灵敏度23。这里,提供了针对AAV 的体外 NAb测定的详细方案,该方案利用编码碱性磷酸酶(AP)报告基因的AAV与硝基蓝色四唑/5-溴-4-氯-3-吲哚基磷酸(NBT / BCIP)底物之间的显色反应。该分步方案是根据先前的一份报告开发的,该报告利用hPLAP(人胎盘碱性磷酸酶)报告基因(AAV6-hPLAP)来检测针对AAV24的中和活性。该测定具有成本效益,具有时效性,易于设置,并且需要最少的技术技能,实验室设备和试剂。此外,这种测定的简单性使其有可能针对不同类型的细胞,组织或病毒血清型的广泛应用进行优化。
研究方案
动物护理和实验的各个方面都是按照弗洛里神经科学和心理健康研究所的指导方针和澳大利亚科学目的动物护理和使用守则进行的,遵循参考文献25。1.5-3岁的美丽诺母羊用于研究。 图1提供了测定方案的示意图。
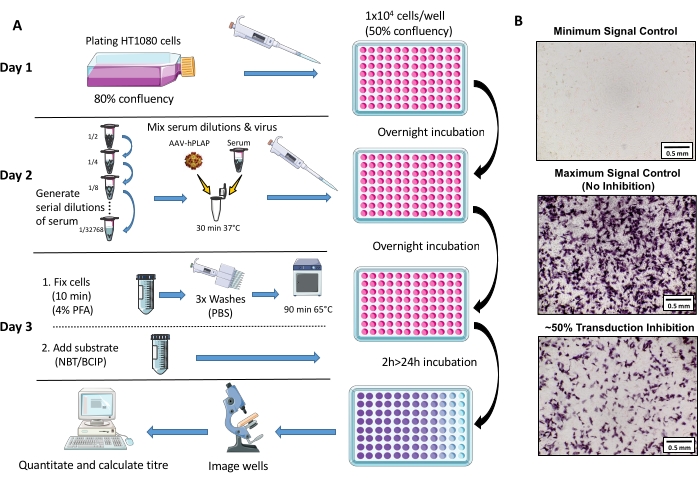
图1:NAb测定方案的示意图。 (A)NAb测定的可视化表示,说明了三天方案中涉及的主要步骤。简而言之,细胞生长并接种过夜。第二天,制备连续稀释的血清,与AAV一起孵育,然后与细胞一起孵育过夜。第二天,将细胞固定,洗涤,孵育,与底物结合,然后再次孵育,然后进行成像和定量。(B)最小信号对照(完全AAV抑制),最大信号对照(无抑制)和具有〜50%信号抑制的绵羊血清样品的代表性图像。比例尺 = 0.5 mm。 请单击此处查看此图的放大版本。
1. 初步准备
- 对于绵羊的评估:将血液收集在8mL血清分离器凝块激活管中(见 材料表),将血液样品在室温(RT)下放置20-30分钟,然后以2,100× g 旋转15分钟。在试管顶部形成的透明上清液是血清。将清澈的水相等分到微量离心管中并储存在-80°C。
注意:血清在-80°C下保持稳定约5年。使用16 G针头(尖端切断)和来自有意识的动物的注射器从颈动脉静脉收集血液。 - 通过将胎儿牛血清(FBS)置于56°C的水浴中30分钟并间歇性旋转,将其加热灭活。为了精确起见,将温度计放在装有等量水的第二个瓶子中,然后与FBS瓶同时将其添加到热浴中。当温度计达到56°C时开始计时。
- 在细胞培养罩中执行的所有后续步骤均采用适当的无菌技术和细胞培养实践26,27。使用前在所有物体和罩子上喷洒70%乙醇,完成后用1%次氯酸钠清洁。
- 通过将高葡萄糖(4.5 g / L)DMEM(89%)与热灭活FBS(10%)和青霉素链霉素(1%)相结合,制成完整的Dulbecco改性鹰培养基(DMEM)。使用无菌真空过滤系统(孔径为0.22μm,聚醚砜膜)组合并过滤(见 材料表)。将包裹在铝箔中的完整DMEM储存在4°C。
- 建立HT1080细胞(见 材料表)并在75 cm 2 方形烧瓶中传代,如参考文献28中所述。创建多个冷冻细胞库。20次传代后不要使用细胞,因为进一步的传代可能会影响测定结果。
2. 第 1 天 - 细胞电镀
- 当HT1080细胞达到~80%汇合度时,传代HT1080细胞。
- 在水浴中预热完全DMEM(在步骤1.4中制备),0.05%胰蛋白酶EDTA和1x磷酸盐缓冲盐水(PBS)至37°C。使用抽吸系统从传代细胞中取出生长培养基。
注意:本方案中的所有抽吸均使用真空系统,真空系统将试管连接到无菌 5 mL 血清学移液器上。 - 在10mL预热(37°C)1x PBS中洗涤细胞,并在4mL预热的0.05%胰蛋白酶-EDTA中胰蛋白酶消化细胞3-4分钟,以将细胞从烧瓶中分离出来。
- 通过加入6mL预热的完整DMEM并将细胞移液到50mL管中来灭活胰蛋白酶。使用血细胞计数器和台盼蓝排除法计算活细胞的数量和浓度29。
- 将细胞稀释至预热的完整DMEM中的浓度为1×105 个细胞/ mL。将100μL细胞/孔接种到透明的96孔平底板中(每孔1×10 4 个细胞)。将板在37°C,5%二氧化碳(CO2)下孵育16-22小时过夜。
3. 第2天 - 感染细胞
- 从培养箱中取出板,并使用光学显微镜确认细胞均匀分散在孔内并且汇合度约为50%。如果细胞不在45%-55%汇合范围内,重复"第1天"方案并相应地调整初始细胞浓度。
- 使用预热的完整DMEM作为稀释剂,在1.5mL微量离心管中生成目标血清样品的连续稀释液。 表1 显示了一式三份样品的稀释级联反应的生成。
- 为了一式三份进行测定,通过将病毒储备溶液稀释在1x PBS中来制备AAV6-hPLAP工作溶液的7.5 x 106 载体基因组(vg)/ μL(见 材料表)。
- 将66μL的7.5×106 vg/μL病毒工作溶液加入到含有264μL血清/培养基稀释液(总体积/稀释度的330μL,见 表1)的每个管中。
注意:这是一种可靠的检测方法,不需要完美的培养条件。然而,为了准确定量并确保每次测定运行可靠,有必要包括以下内容:(1)仅病毒和培养基对照,(2)仅培养基对照,以及(3)在相同实验条件下所有板上的NAb阳性对照样品。所述体积(330μL)占血清和病毒混合物的一式三份样品+10%。强烈建议进行重复,以准确测定中和活性。
- 通过移液混合病毒/血清稀释液,并将含有病毒/血清混合物的试管置于37°C,5%CO 2 的培养箱中30分钟,以允许可能发生中和。
- 将100μL病毒/血清混合物移液到96孔板上的每个孔中,每次稀释含有1×10 4 个细胞/孔。
注意:这将在每个孔中产生15k病毒/细胞感染多重性(MOI)的最终病毒浓度。 表2 提供了一个示例96孔样品板布局,用于评估样品到1/512稀释度。 - 将含有细胞,血清和AAV-hPLAP的96孔板包裹在铝箔中,并置于37°C,5%CO 2 过夜的培养箱中16-24小时,以使AAV进入细胞。
| 稀释级联标签 | 稀释 | 3 x 样品 (240 μL) + 10% 缓冲液体积 (24 μL) | 血清:培养基的比例 |
| 稀释度 1 (D1) | 1/2 | 264 μL 血清 264 μL 培养基 | 50:50 |
| 稀释 2 (D2) | 1/4 | 264 μL D1 + 264 μL 培养基 | 25:75 |
| 稀释 3 (D3) | 1/8 | 264 μL D2 +264μL 培养基 | 12.5:87.5 |
| 稀释 4 (D4) | 1/16 | 264 μL D3 +264 μL 培养基 | 6.25:93.75 |
| 稀释 5 (D5) | 1/32 | 264 μL D4 +264 μL 培养基 | 3.13:96.87 |
| 稀释度 6 (D6) | 1/64 | 264 μL D5 +264 μL 培养基 | 1.56:98.44 |
| 稀释 7 (D7) | 1/128 | 264 μL D5 +264 μL 培养基 | 0.78:99.22 |
| 稀释度 8 (D8) | 1/256 | 264 μL D5 +264 μL 培养基 | 0.39:99.61 |
| 稀释 9 (D9) | 1/512 | 264 μL D7 + 264 μL 培养基 | 0.2:99.8 |
| 稀释 10 (D10) | 1/2048 | 132 μL D8 + 396 μL 培养基 | 0.05:99.95 |
| 稀释度 11 (D11) | 1/8192 | 132 μL D9 + 396 μL 培养基 | 0.01:99.99 |
| 稀释 12 (D12) | 1/32768 | 132 μL D10 + 396 μL 培养基 | 0.003:99.997 |
表1:生成一式三份的连续血清稀释液所需的血清和稀释剂的体积。
| 血清样本 #1 | 血清样本 #2 | 血清样本 #3 | 单色 AB (mAB)、对照和额外样品 | |||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
| 一个 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 50 纳克单克隆抗体 | 50 纳克单克隆抗体 | 50 纳克单克隆抗体 |
| B | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 5 纳克单克隆抗体 | 5 纳克单克隆抗体 | 5 纳克单克隆抗体 |
| C | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 0.5 纳克单克隆抗体 | 0.5 纳克单克隆抗体 | 0.5 纳克单克隆抗体 |
| D | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 钼 (-C) | 钼 (-C) | 钼 (-C) |
| E | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | VO (+C) | VO (+C) | VO (+C) |
| F | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 样本 #1 1/512 | 样本 #1 1/512 | 样本 #1 1/512 |
| G | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 样本 #2 1/512 | 样本 #2 1/512 | 样本 #2 1/512 |
| H | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 样本 #3 1/512 | 样本 #3 1/512 | 样本 #3 1/512 |
表2:示例96孔板布局,用于评估稀释度范围为1/2至1/512的朴素血清样品。如果评估已知AAV NAbs阳性的样品(给药后样品)或需要更高的滴度,则将较高的稀释度掺入测定中。MO (-C):仅媒体控制。VO (+C):仅控制病毒和介质。mAb:抗 AAV 的单克隆抗体(NAb 阳性对照)。
4. 第3天 - 固定底物并将其添加到细胞中
- 将等分试样1x PBS预热至37°C(〜25 mL / 96孔板)。将PBS(~25 mL/ 96孔板)和双蒸馏H2 O(DDW,〜25 mL / 96孔板)的单独等分试样冷却至4°C。 通过涡旋将BCIP / NBT的沉淀(见 材料表)溶解在50 mL锥形离心管中的10mL DDW中(10mL足以用于2 x 96孔板)。
- 使用血清学移液器或类似连接到基于吸力的抽吸系统或通风橱真空的类似物从96孔板的孔中吸出介质。轻轻地将血清学移液器的尖端放入孔中,并取出培养基,注意不要破坏粘附的细胞。
- 使用移液器向每个孔中加入50μLRT 4%PFA。将板包裹在铝箔中,并将其置于室温下10分钟以固定细胞。
注意:多聚甲醛(PFA)是一种可能的致癌物质,对皮肤或眼睛接触或吸入有毒。在通风橱中处理,并配有适当的个人防护装备和口罩。将新鲜的4%PFA稀释在PBS中(每96孔板需要约7 mL)。
- 使用移液器向每个孔中加入50μLRT 4%PFA。将板包裹在铝箔中,并将其置于室温下10分钟以固定细胞。
- 用200μL室1x PBS洗涤和吸出细胞。重复此步骤两次。
注意:多通道移液器是移液步骤的有效选择。 - 将200μL预热的PBS移液到每个孔中,将板包裹在铝箔中并在65°C下孵育90分钟,以使内源性碱性磷酸酶活性变性30。
- 吸出孔并用200μL冷(4°C)PBS洗涤细胞。再次吸出,在200μl冷的DDW中洗涤,然后再次吸出。
- 将50μL溶解的BCIP / NBT(在步骤4.1中制备)移入每个孔中。
- 将板包裹在铝箔中,并在室温下孵育2-24小时。
注意:与运行之间的孵育时间一致;时间灵活性允许用户在第3天或第二天拍摄油井。 - 使用光学显微镜相机,使用4倍物镜拍摄每个孔的照片,确保对所有进行的测定使用相同的曝光,白平衡和光设置。
- 以相同的方式放置每口井,并确保油井的边缘在照片中不可见。以TIF格式或类似格式保存照片。
注意:显微镜之间的具体设置会有所不同,但如果整个孔的背景照明很高且一致,则定量将最有效(图1B)。
- 以相同的方式放置每口井,并确保油井的边缘在照片中不可见。以TIF格式或类似格式保存照片。
5. 定量,使用ImageJ确定中和活性
- 下载并安装免费软件"ImageJ"(见 材料表)。
- 通过选择 "文件"> 打开"在 ImageJ 中打开要分析的图像(图 2)。
- 如果使用彩色图像,请通过选择" 图像>类型> 8 位"转换为灰度。
- 单击 图像>调整>阈值。调整阈值,直到所有彩色区域都显示为红色,但背景不为红色。添加NBT / BCIP后,有色产物将沉积在表达hPLAP的细胞周围的区域。
注意:建议对在同一板上捕获的所有图像使用相同的阈值设置。 - 单击 分析>设置测量值 ,勾选 面积、 阈值限制、 面积分数和 显示标签 复选框,然后单击 确定。
- 要确定给定孔的信号读数(着色百分比),请单击" 分析>测量"。弹出窗口的"%面积"列显示信号读数。
- 对所有样品重复进行定量。排除任何受污染的孔,显示不均匀的细胞分布的孔,或细胞密度或照明变化的孔。
注:有关应考虑排除的油井示例,请参见 补充图1 。通常,3-4孔可能需要从96孔板中排除。 图2 提供了使用ImageJ的定量过程的可视化表示。
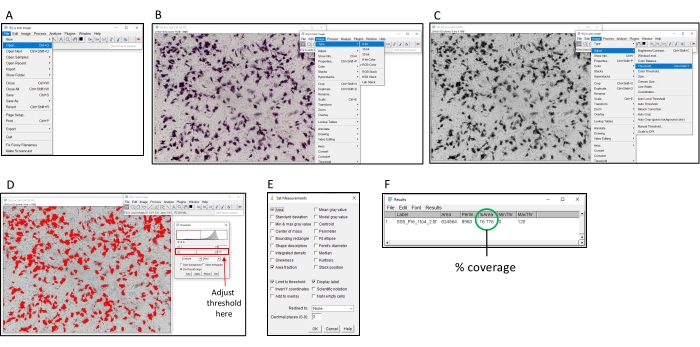
图 2:使用 ImageJ 软件确定着色百分比的步骤。 (A)打开图像,用ImageJ软件进行分析。(B) 将图像转换为 8 位灰度。(C) 打开阈值窗口。(D)调整最大阈值,使所有彩色区域都被覆盖,但背景区域不是(此阈值应在整个板上保持一致)。(E)选择"分析"下拉框,单击"设置测量值"并勾选"面积","面积分数","极限阈值"和"显示标签",然后单击"确定"。(F) 单击"测量"以测量覆盖区域。% 区域表示已着色图像的比例。然后,这可以与对照样品一起使用,以确定TI50 滴度。 请点击此处查看此图的放大版本。
6. 转导抑制(TI50)滴度的测定
- 确定以下重复的平均读数(使用步骤 5 中描述的步骤):(1) 仅媒体控制(基线信号读数)。(2)病毒+介质仅控制(最大信号读数)。(3)病毒+感兴趣的血清样本。
- 使用以下公式计算抑制百分比:
100 - [(测试样品信号读数(病毒+目标血清样品)-基线信号读数(仅介质对照))/(最大信号读数(仅介质和病毒)-基线信号读数)x 100] = %转导抑制13。 - 使用6.2中的公式计算所有样品的每种稀释液的所有重复的转导抑制百分比。确定所有样品和对照组的每次稀释的技术重复之间的平均转导抑制。
- 通过确定样品的最低稀释度(产生50 %或更高的hPLAP活性转导抑制),计算目标样品的50%转导抑制滴度(TI50滴度)。例如,如果样品的1/8稀释度根据6.2中进行的计算具有大于50%的转导抑制(而1/4稀释度没有),则将TI50 滴度报告为1/8。
7. 中和AAV颗粒的测定
- 通过采用以下公式计算给定样品每μL血清中和的AAV颗粒数:
((MOI x 细胞计数/孔) / (血清体积 / TI50 滴度的稀释因子)) / 2 = 中和的 AAV 颗粒 / μL 血清9。
注:除以2占TI50测量50%的中和颗粒。对于TI50滴度为1/4(25%血清,75%稀释剂)的样品,其中测定使用80μL未稀释的血清和15k的MOI接种到1×104个细胞上,将使用以下计算:((15000×10000)/ (80/4))/ 2 = 3.75x106中和颗粒/μL血清。
结果
转导测定,以确定板覆盖的最佳病毒剂量
HT1080细胞是一种成熟的纤维肉瘤细胞系,被选择用于该测定。浓度为1×104 HT1080细胞/孔,在96孔板的每个孔中提供〜50%的细胞汇合度。为了确定测定的最佳病毒浓度,在每个细胞的含vg颗粒浓度范围内(MOI:0,150 ,500,1500,1500,1500,500,1500,5000,1500,15000,15000,5000,5000和150000)的范围内?...
讨论
该报告描述了一种比色测定法,该测定法通过评估与 体外 病毒转导程度相对应的显色反应来评估给定血清样品中AAV中和的程度。该方案的开发基于碱性磷酸酶与NBT / BCIP之间的已知显色反应,NBT / BCIP已被广泛用作免疫组织化学等应用中检测蛋白质靶标的染色工具,并作为评估病毒转导的报告工具24,33,34,
披露声明
作者没有什么可透露的。
致谢
这项研究由国家卫生和医学研究委员会对JRM和CJT(ID 1163732)的项目赠款资助,部分由维多利亚州政府的运营基础设施支持计划资助。SB由贝克心脏和糖尿病研究所 - 拉筹伯大学联合博士奖学金支持。KLW得到了The Shine On Foundation和澳大利亚国家心脏基金会(ID 102539)的未来领袖奖学金的支持。JRM由国家卫生和医学研究委员会高级研究奖学金(ID 1078985)提供支持。
材料
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin/EDTA | Gibco | 25300-054 | |
| 50 mL conical centrifuge tube | Falcon | 14-432-22 | Or equivalent |
| 75 cm2 square flasks | Falcon | 353136 | Or equivalent |
| 96 well flat bottomed plate | Falcon | 353072 | |
| AAV6-CMV-hPLAP Vector | Muscle Research & Therapeutics Lab (University of Melbourne, Australia) AAV6-CMV-hPLAP can be provided upon request. | ||
| Aluminium foil | |||
| Anti-AAV6 (intact particle) mouse monoclonal antibody, (ADK6) | PROGEN | 610159 | Positive control monoclonal antibody |
| BCIP/NBT | SIGMAFAST | B5655 | |
| Cell and tissue culture safety cabinet | |||
| Electronic Pipette | 5 & 10 mL stripette inserts | ||
| Fetal Bovine Serum | Gibco | 10099-141 | |
| Haemocytometer | |||
| High glucose Dulbecco's Modified Eagle Medium (DMEM) | Gibco | 11965118 | |
| HT1080 cells | ATCC | ||
| ImageJ Software | Freely available: https://imagej.nih.gov/ij/download.html | ||
| Incubator | 37 °C, 5% CO2 | ||
| Light microscope with camera | Capable of taking photos with a 4x objective lens | ||
| Oven | For a 65 °C incubation | ||
| Paraformaldehyde | MERCK | 30525-89-4 | |
| Penicillin Streptomycin | Gibco | 15140-122 | |
| Phosphate buffered saline | |||
| Pipettes and tips | 20 μL, 200 μL & 1 mL single pipettes and tips & 200 μL multichannel pipette | ||
| Stericup quick release filter | Millipore | S2GPU10RE | Used for combining media reagents |
| Trypan blue solution | Sigma-Aldrich | T8154 | |
| VACUETTE TUBE 8 ml CAT Serum Separator Clot Activator | Greiner BIO-ONE | 455071 | Used for serum collection & processing from sheep |
| Water bath |
参考文献
- Bass-Stringer, S., et al. Adeno-associated virus gene therapy: Translational progress and future prospects in the treatment of heart failure. Heart, Lung and Circulation. 27 (11), 1285-1300 (2018).
- Casey, G. A., Papp, K. M., MacDonald, I. M. Ocular gene therapy with adeno-associated virus vectors: current outlook for patients and researchers. Journal of Ophthalmic and Vision Research. 15 (3), 396-399 (2020).
- Lykken, E. A., Shyng, C., Edwards, R. J., Rozenberg, A., Gray, S. J. Recent progress and considerations for AAV gene therapies targeting the central nervous system. Journal of Neurodevelopmental Disorders. 10 (1), 16 (2018).
- Guggino, W. B., Cebotaru, L. Adeno-Associated Virus (AAV) gene therapy for cystic fibrosis: Current barriers and recent developments. Expert Opinion on Biological Therapy. 17 (10), 1265-1273 (2017).
- Perrin, G. Q., Herzog, R. W., Markusic, D. M. Update on clinical gene therapy for hemophilia. Blood. 133 (5), 407-414 (2019).
- Wang, D., Tai, P. W. L., Gao, G. Adeno-associated virus vector as a platform for gene therapy delivery. Nature Reviews Drug Discovery. 18 (5), 358-378 (2019).
- Kuzmin, D. A., et al. The clinical landscape for AAV gene therapies. Nature Reviews Drug Discovery. 20 (3), 173-174 (2021).
- Russell, S., et al. Efficacy and safety of voretigene neparvovec (AAV2-hRPE65v2) in patients with RPE65-mediated inherited retinal dystrophy: A randomised, controlled, open-label, phase 3 trial. Lancet. 390 (10097), 849-860 (2017).
- Weber, T. Anti-AAV Antibodies in AAV gene therapy: Current challenges and possible solutions. Frontiers in Immunology. 12, 658399 (2021).
- Weeks, K. L., et al. Phosphoinositide 3-kinase p110alpha is a master regulator of exercise-induced cardioprotection and PI3K gene therapy rescues cardiac dysfunction. Circulation: Heart Failure. 5 (4), 523-534 (2012).
- Gregorevic, P., et al. Systemic delivery of genes to striated muscles using adeno-associated viral vectors. Nature Medicine. 10 (8), 828-834 (2004).
- Bernardo, B. C., et al. Gene delivery of medium chain acyl-coenzyme A dehydrogenase induces physiological cardiac hypertrophy and protects against pathological remodelling. Clinical Science (London). 132 (3), 381-397 (2018).
- Meliani, A., et al. Determination of anti-adeno-associated virus vector neutralizing antibody titer with an in vitro reporter system. Human Gene Therapy Methods. 26 (2), 45-53 (2015).
- Falese, L., et al. Strategy to detect pre-existing immunity to AAV gene therapy. Gene Therapy. 24 (12), 768-778 (2017).
- Wang, D., et al. Adeno-Associated virus neutralizing antibodies in large animals and their impact on brain intraparenchymal gene transfer. Molecular Therapy - Methods & Clinical Development. 11, 65-72 (2018).
- Wang, M., et al. Prediction of adeno-associated virus neutralizing antibody activity for clinical application. Gene Therapy. 22 (12), 984-992 (2015).
- Kruzik, A., et al. Detection of biologically relevant low-titer neutralizing antibodies against adeno-associated virus require sensitive in vitro assays. Human Gene Therapy Methods. 30 (2), 35-43 (2019).
- Lehtoranta, L., Villberg, A., Santanen, R., Ziegler, T. A novel, colorimetric neutralization assay for measuring antibodies to influenza viruses. Journal of Virological Methods. 159 (2), 271-276 (2009).
- Johnston, P. B., Grayston, J. T., Loosli, C. G. Adenovirus neutralizing antibody determination by colorimetric assay. Proceedings of the Society for Experimental Biology and Medicine. 94 (2), 338-343 (1957).
- Xiaoli Zhu, T. G. . Nano-Inspired Biosensors for Protein Assay with Clinical Applications. , 237-264 (2019).
- Jungmann, A., Muller, O., Rapti, K. Cell-based measurement of neutralizing antibodies against adeno-associated virus (AAV). Methods in Molecular Biology. 1521, 109-126 (2017).
- Samineni, S., et al. Optimization, comparison, and application of colorimetric vs. chemiluminescence based indirect sandwich ELISA for measurement of human IL-23. Journal of Immunoassay and Immunochemistry. 27 (2), 183-193 (2006).
- Siddiqui, J., Remick, D. G. Improved sensitivity of colorimetric compared to chemiluminescence ELISAs for cytokine assays. Journal of Immunoassay and Immunochemistry. 24 (3), 273-283 (2003).
- Arnett, A. L., Garikipati, D., Wang, Z., Tapscott, S., Chamberlain, J. S. Immune responses to rAAV6: The Influence of canine parvovirus vaccination and neonatal administration of viral vector. Frontiers in Microbiology. 2, 220 (2011).
- Australian code for the care and use of animals for scientific purposes. National Health and Medical Research Council Available from: https://www.nhmrc.gov.au/about-us/publications/australian-code-care-and-use-animals-scientific-purposes (2013)
- Coecke, S., et al. Guidance on good cell culture practice. A report of the second ECVAM task force on good cell culture practice. Alternatives to Laboratory Animals. 33 (3), 261-287 (2005).
- Journal of Visualized Experiments. General Laboratory Techniques. Journal of Visualized Experiments Database. , (2018).
- AAV-HT1080 Cells. Stratagene Available from: https://www.chem-agilent.com/pdf/strata/240109.pdf (2003)
- Strober, W. Trypan blue exclusion test of cell viability. Current Protocols in Immunology. 111 (3), 1-3 (2015).
- Bieber, S., et al. Extracorporeal delivery of rAAV with metabolic exchange and oxygenation. Scientific Reports. 3, 1538 (2013).
- Winbanks, C. E., Beyer, C., Qian, H., Gregorevic, P. Transduction of skeletal muscles with common reporter genes can promote muscle fiber degeneration and inflammation. PLoS One. 7 (12), 51627 (2012).
- Thomas, C. J., et al. Evidence that the MEK/ERK but not the PI3K/Akt pathway is required for protection from myocardial ischemia-reperfusion injury by 3',4'-dihydroxyflavonol. European Journal of Pharmacology. 758, 53-59 (2015).
- Barger, A., et al. Use of alkaline phosphatase staining to differentiate canine osteosarcoma from other vimentin-positive tumors. Veterinary Pathology. 42 (2), 161-165 (2005).
- Gregorevic, P., et al. Evaluation of vascular delivery methodologies to enhance rAAV6-mediated gene transfer to canine striated musculature. Molecular Therapy. 17 (8), 1427-1433 (2009).
- Sharma, A., Ghosh, A., Hansen, E. T., Newman, J. M., Mohan, R. R. Transduction efficiency of AAV 2/6, 2/8 and 2/9 vectors for delivering genes in human corneal fibroblasts. Brain Research Bulletin. 81 (2-3), 273-278 (2010).
- Smejkal, G. B., Kaul, C. A. Stability of nitroblue tetrazolium-based alkaline phosphatase substrates. Journal of Histochemistry & Cytochemistry. 49 (9), 1189-1190 (2001).
- Falese, L., et al. Strategy to detect pre-existing immunity to AAV gene therapy. Gene Therapy. 24 (12), 768-778 (2017).
- Orlowski, A., et al. Successful transduction with AAV Vectors after selective depletion of anti-aav antibodies by immunoadsorption. Molecular Therapy - Methods & Clinical Development. 16, 192-203 (2020).
- Goossens, K., et al. Differential microRNA expression analysis in blastocysts by whole mount in situ hybridization and reverse transcription quantitative polymerase chain reaction on laser capture microdissection samples. Analytical Biochemistry. 423 (1), 93-101 (2012).
- Entrican, G., Wattegedera, S. R., Griffiths, D. J. Exploiting ovine immunology to improve the relevance of biomedical models. Molecular Immunology. 66 (1), 68-77 (2015).
- Walters, E. M., Prather, R. S. Advancing swine models for human health and diseases. Molecular Medicine. 110 (3), 212-215 (2013).
- Rapti, K., et al. Neutralizing antibodies against AAV serotypes 1, 2, 6, and 9 in sera of commonly used animal models. Molecular Therapy. 20 (1), 73-83 (2012).
- Tellez, J., et al. Characterization of naturally-occurring humoral immunity to AAV in sheep. PLoS One. 8 (9), 75142 (2013).
- Gupta, S., et al. Recommendations for the validation of cell-based assays used for the detection of neutralizing antibody immune responses elicited against biological therapeutics. Journal of Pharmaceutical and Biomedical Analysis. 55 (5), 878-888 (2011).
- Gupta, S., et al. Recommendations for the design, optimization, and qualification of cell-based assays used for the detection of neutralizing antibody responses elicited to biological therapeutics. Journal of Immunological Methods. 321 (1-2), 1-18 (2007).
- Shankar, G., et al. Recommendations for the validation of immunoassays used for detection of host antibodies against biotechnology products. Journal of Pharmaceutical and Biomedical Analysis. 48 (5), 1267-1281 (2008).
- U.S. Department of Health and Human Services Food and Drug Administration. Center for Drug Evaluation and Research (CDER). Immunogenicity Testing of Therapeutic Protein Products — Developing and Validating Assays for Anti-Drug Antibody Detection. U.S. Department of Health and Human Services Food and Drug Administration. , (2019).
- Baatartsogt, N., et al. A sensitive and reproducible cell-based assay via secNanoLuc to detect neutralizing antibody against adeno-associated virus vector capsid. Molecular Therapy - Methods & Clinical Development. 22, 162-171 (2021).
- Watano, R., Ohmori, T., Hishikawa, S., Sakata, A., Mizukami, H. Utility of micro mini pigs for evaluating liver-mediated gene expression in the presence of neutralizing antibody against vector capsid. Gene Therapy. 27 (9), 427-434 (2020).
- Majowicz, A., et al. Therapeutic hFIX activity achieved after single AAV5-hFIX treatment in Hemophilia B patients and NHPs with pre-existing anti-AAV5 NABs. Molecular Therapy - Methods & Clinical Development. 14, 27-36 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。