Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Kolorimetrik Hücre Tabanlı Bir Test Kullanarak AAV'ye Karşı Nötralize Edici Antikorları Tespit Etmek İçin Adım Adım Bir Yöntem
Bu Makalede
Özet
AAV6'ya karşı nötralize edici unsurları tespit etmek için hızlı, uygun maliyetli ve basit kolorimetrik hücre tabanlı bir test için kapsamlı bir laboratuvar protokolü ve analiz iş akışı açıklanmaktadır.
Özet
Rekombinant adeno ilişkili virüsler (rAAV), hem laboratuvarda hem de klinikte çeşitli sağlık koşullarını tedavi etmek için genetik materyal transferi için güvenli ve başarılı bir vektör olduğunu kanıtlamıştır. Bununla birlikte, AAV kapsidlerine karşı önceden var olan nötralize edici antikorlar (NAbs), hem büyük hayvan deney modellerinde hem de insan popülasyonlarında gen tedavilerinin başarılı bir şekilde verilmesi için devam eden bir zorluk oluşturmaktadır. AAV'ye karşı konak bağışıklığı için ön tarama, AAV tabanlı gen tedavilerinin hem bir araştırma aracı hem de klinik olarak uygulanabilir bir terapötik ajan olarak etkinliğini sağlamak için gereklidir. Bu protokol, AAV serotip 6'ya (AAV6) karşı nötralize edici faktörleri tespit etmek için kolorimetrik bir in vitro testini açıklar. Test, alkali fosfataz (AP) muhabir geni kodlayan bir AAV ile kombinasyon halinde çözünmeyen ölçülebilir mor bir leke oluşturan NBT/BCIP alt tabakası arasındaki reaksiyonu kullanır.
Bu protokolde serum örnekleri AP'yi ifade eden bir AAV ile birleştirilir ve potansiyel nötralizasyon aktivitesinin gerçekleşmesine izin vermek için inkübe edilir. Virüs serum karışımı daha sonra nötralize edilmemiş AAV'lerin viral transdüksiyonu için hücrelere eklenir. NBT/BCIP substratı eklenir ve viral transdüksiyon ve nötralize edici aktiviteye karşılık gelen kromojenik bir reaksiyona uğrar. Renkli alan oranı, nötralize edici titreler oluşturmak için özgür bir yazılım aracı kullanılarak nicelleştirilir. Bu test, renklenme ve viral konsantrasyon arasında güçlü bir pozitif korelasyon görüntüler. Rekombinant AAV6'nın uygulamadan önce ve sonra koyunlardan alınan serum örneklerinin değerlendirilmesi nötralize edici aktivitede çarpıcı bir artışa yol açtı (125 ila >10.000 kat artış). Test, 1:32.000 > serum seyreltmesinde nötralizasyon aktivitesini tespit etmek için yeterli hassasiyet gösterdi. Bu tahlil, NAB'leri AAV'lere karşı tespit etmek için basit, hızlı ve uygun maliyetli bir yöntem sağlar.
Giriş
Adeno ilişkili virüsler (AAV), gen tedavilerinin kardiyovasküler, pulmoner, dolaşım, oküler ve merkezi sinir sistemlerini etkileyen çeşitli sağlık durumları için deneme tedavilerine ulaştırılmasında vektör olarak giderek daha fazla kullanılmaktadır1,2,3,4,5. AAV vektörlerinin önde gelen gen tedavisi platformu olarak popülaritesi, pozitif güvenlik profili, uzun süreli transgene ekspresyasyonu ve dokuya özgü geniş kapsamlı tropizmlerinden kaynaklanmaktadır1,6. Hayvan çalışmalarındaki başarılı sonuçlar, etkinlik uç noktalarına başarıyla ulaşan elliden fazla AAV gen tedavisi klinik denemesinin ve ABD Gıda ve İlaç İdaresi8 tarafından onaylanan ilk ticari olarak mevcut AAV gen tedavisi ilacının piyasaya sürülmesinin önünü açmıştır8. İlk başarıların ardından, AAV tercih edilen bir vektör olarak temel ve klinik araştırma sektörlerinde ilgi görmeye devam etti ve şu anda ABD ve Avrupa'da klinik kullanım için onaylanan tek in vivo gen tedavisi9. Bununla birlikte, AAV vektör kapsidlerine karşı önceden var olan nötralize edici antikorların (NAbs) varlığı hem klinik öncesi araştırmalara hem de klinik çalışmaların etkinliğine engel olmaya devam etmektedir. NAb'ler hem naif insan hem de hayvan popülasyonlarında bulunur ve bir AAV vektörün in vivo yönetimini takiben gen transdüksiyonu inhibe eder1. AAV seropozitliği çoğu gen tedavisi denemesi için bir dışlama kriteridir ve bu nedenle konak bağışıklığı için ön tarama hem laboratuvarda hem de klinikte çok önemlidir. AAV'ye karşı NAB'lerin varlığını tespit edebilecek bir test oluşturmak, herhangi bir AAV gen terapisi tabanlı araştırma projesinin boru hattında önemli bir adımdır. Bu rapor, çizgili kas (kalp ve iskelet kası)1,10,11,12'de etkili ve seçici transdüksiyon nedeniyle araştırmacıların ilgisini çeken AAV6'ya odaklanmıştır. Gen tedavisi kalbi hedeflemek için umut verici bir strateji olarak kabul edilir, çünkü invaziv açık kalp prosedürleri olmadan kalbi özellikle hedeflemek zordur.
Nötralize edici aktivite genellikle hücre bazlı in vitro veya in vivo transdüksiyon inhibisyon tahlili kullanılarak belirlenir. In vivo NAb tahlilleri genellikle serumun bir denekten (örneğin, insan veya büyük hayvan) farelere verilmesini, ardından muhabir geni olan bir AAV'nin ve ardından muhabir geninin veya ilgili antijenin ekspresyozunun testini içerir. İn vitro tahliller, bir muhabir genini ifade eden rekombinant AAV (rAAV) ile seri seyreltmelerde insan veya büyük bir hayvandan serum veya plazma inkübasyon yaparak NAb titrlerini belirler. Hücreler serum/virüs karışımı ile enfekte edilir ve muhabir gen ekspresyonlarının ne ölçüde inhibe edildiği kontrollerle karşılaştırıldığında değerlendirilir. In vitro tahliller, in vivo testlere kıyasla nispeten daha düşük maliyeti, testlerdeki hızlılığı ve standardizasyon ve doğrulama için daha fazla kapasite13,14 nedeniyle NAb taraması için yaygın olarak kullanılmaktadır. In vivo tahlillerin genellikle daha fazla hassasiyete sahip olduğu bildirilmektedir15,16, ancak aynı iddia in vitro tahlillerle ilgili olarak da ortaya atıldı14,17.
Bugüne kadar, in vitro NAb tahlilleri nötralizasyonunu tespit etmek için muhabir geni olarak esas olarak lüminesans (luciferaz) kullanmıştır. Işık tabanlı bir yöntemin birçok bağlamda değeri olsa da, kolorimetrik/kromojenik bir NAb tahlili bazı durumlarda avantajlı olabilir. Nötralizasyonunu değerlendirmek için yapılan kolorimetrik tahliller influenza ve adenovirüs gibi diğer virüsler için başarıyla sunulmuştir18,19. Çekicilikleri basitliklerinden, daha düşük maliyetlerinden ve sadece günlük laboratuvar cihazları ve araçları için gereksinimden kaynaklanmaktadır20. Lüminesans tabanlı bir muhabir geni kullanan NAb tahlilleri, yüksek maliyetli substrat kitleri, bir luminometre ve analiz için ilgili yazılım gerektirir21. Bu kolorimetrik test, sadece hafif bir mikroskop ve çok ucuz bir substrat gerektirme avantajına sahiptir. Kolorimetrik ve parlak testlere karşı duyarlılığının raporlanması çelişkili sonuçlar verdi. Bir çalışma, lüminesans tabanlı ELISA testlerinin daha fazla hassasiyet ve kolorimetrik testlerle karşılaştırılabilir tekrarlanabilirlik gösterdiği öne sürsürürd22, bir diğeri ise daha fazla hassasiyet sağlamak için kolorimetrik tabanlı ELISA tahlilleri buldu23. Burada, alkali fosfataz (AP) muhabir geni ile nitro mavisi tetrazolium /5-bromo-4-kloro-3-indolyl fosfat (NBT/BCIP) substratı arasındaki kromojenik reaksiyonu kullanan AAV'ye karşı bir in vitro NAb tahlili için ayrıntılı bir protokol sağlanmıştır. Bu adım adım protokol, AAV24'e karşı nötralize edici aktiviteyi tespit etmek için hPLAP (insan plasntal alkali fosfataz) muhabir geni (AAV6-hPLAP) kullanan önceki bir rapora dayanarak geliştirilmiştir. Bu test uygun maliyetli, zaman verimli, kurulumu kolaydır ve minimum teknik beceri, laboratuvar ekipmanı ve reaktif gerektirir. Ayrıca, bu tahlilin basitliği, farklı hücre, doku veya viral serotip türlerinde geniş uygulamalar için optimize edilebilir potansiyel verir.
Protokol
Hayvan bakımı ve deneyinin tüm yönleri Florey Nörobilim ve Ruh Sağlığı Enstitüsü yönergeleri ve Avustralya Hayvanların Bakımı ve Kullanımı için Referans25'i takiben Bilimsel Amaçlar için Kodu'nu izleyerek gerçekleştirildi. Çalışmada 1,5-3 yaşındaki Merinos koyunları kullanılmıştır. Şekil 1'de test protokolüne şematik bir genel bakış sağlanmaktadır.
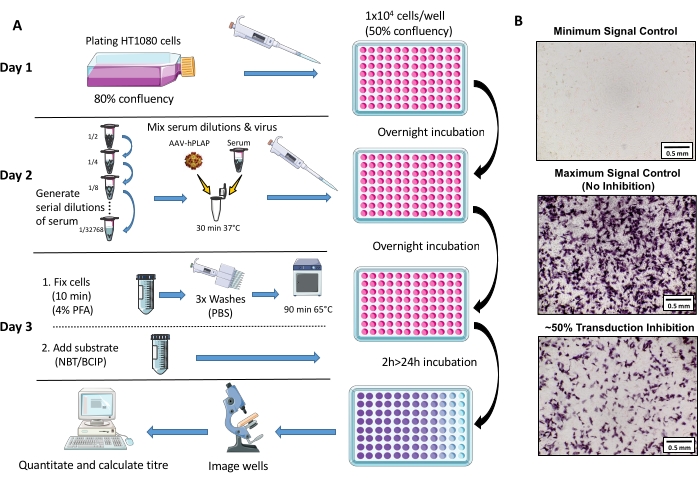
Şekil 1: NAb tahlil protokolünün şematik diyagramı. (A) Üç günlük protokolde yer alan birincil adımları gösteren NAb tahlilinin görsel gösterimi. Kısaca, hücreler bir gecede yetiştirilir ve kaplanr. Ertesi gün serumun seri seyreltmeleri hazırlanır, AAV ile inkübe edilir ve daha sonra bir gecede hücrelerle inkübe edilir. Ertesi gün, hücreler sabitlenir, yıkanır, inkübe edilir, substratla birleştirilir ve tekrar inkübe edilir, ardından görüntüleme ve nicelik. (B) Minimum sinyal kontrolü (komple AAV inhibisyonu), maksimum sinyal kontrolü (inhibisyon yok) ve ~%50 sinyal inhibisyonu olan bir yumurta serumu örneğinin temsili görüntüleri. Ölçek çubuğu = 0,5 mm. Bu rakamın daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
1. İlk hazırlık
- Koyunlarda değerlendirme için: 8 mL serum ayırıcı pıhtı aktivatör tüplerinde kan toplayın (bkz. Malzeme Tablosu), kan örneğini 20-30 dakika oda sıcaklığında (RT) bırakın ve daha sonra 15 dakika boyunca 2.100 x g'da aşağı çevirin. Tüplerin üst kısmında oluşan açık süpernatant serumdur. Berrak sulu fazı mikrosantrifüj tüplerine aliquot ve -80 °C'de saklayın.
NOT: -80 °C'deki serum ~5 yıl boyunca sabit kalır. Şah damarından 16 G iğne (ucu kesilmiş) ve bilinçli hayvanlardan şırınga kullanılarak kan toplandı. - Isı fetal sığır serumu (FBS) 30 dakika boyunca 56 °C'de bir su banyosuna yerleştirerek inaktive ve aralıklı olarak döner. Hassasiyet için, eşdeğer miktarda su içeren ikinci bir şişeye bir termometre yerleştirin ve FBS şişesiyle aynı anda ısı banyosuna ekleyin. Termometre 56 °C'ye ulaştığında zamanlamaya başlayın.
- Hücre kültürü kaputunda gerçekleştirilen sonraki tüm adımlar için uygun aseptik teknik ve hücre kültürü uygulaması 26,27.'yi uygulayın. Kullanmadan önce tüm nesnelere ve davlumbaz üzerine% 70 etanol püskürtün ve tamamlandığında% 1 sodyum hipoklorit ile temizleyin.
- Yüksek glikoz (%4,5 g/L) DMEM (%89) ile ısı inaktive FBS (%10) ve Penisilin Streptomisin 'i (%1) birleştirerek Dulbecco'nun Modifiye Kartal Orta (DMEM) 'ini tamamlayın. Steril vakum filtrasyon sistemi (0,22 μm gözenek boyutu, poliethersülfon membran) kullanarak birleştirin ve filtreleyin (bkz. Malzeme Tablosu). 4 °C'de folyoya sarılı komple DMEM depolayın.
- Referans28'de açıklandığı gibi HT1080 hücreleri (bkz. Malzeme Tablosu) ve 75 cm2 karelik bir şişede geçiş oluşturun. Birden fazla dondurulmuş hücre stokları oluşturun. Daha fazla pasaj test sonuçlarını etkileyebileceğinden, 20 pasajdan sonra hücreleri kullanmayın.
2. Gün 1 - Hücrelerin kaplat
- Ht1080 hücrelerini ~%80 izdiah süresine ulaştıklarında geçiş yap.
- Bir su banyosunda önceden ısınan komple DMEM (adım 1.4), %0.05 tripsin-EDTA ve 1x fosfat tamponlu salin (PBS) ile 37 °C arasında. Bir aspirasyon sistemi kullanarak geçişli hücrelerden büyüme ortamını çıkarın.
NOT: Bu protokoldeki tüm aspirasyon, steril 5 mL serolojik pipete bağlı bir tüpe sahip bir vakum sistemi kullanır. - Hücreleri şişeden ayırmak için önceden ısıtılmış 10 mL (37 °C) 1x PBS ve trypsinize hücrelerini 4 mL önceden ısıtılmış 0,05% trypsin-EDTA'da 3-4 dakika yıkayın.
- Önceden ısıtılmış 6 mL komple DMEM ekleyerek tripsin inaktive edin ve hücreleri 50 mL'lik bir tüpe pipetlayın. Hemositometre ve trippan mavi dışlama yöntemi29 kullanarak canlı hücrelerin sayısını ve konsantrasyonu hesaplayın.
- Önceden ısıtılmış komple DMEM'de hücreleri 1 x 105 hücre/mL konsantrasyonda seyreltin. Tohum 100 μL hücre /kuyu net 96 kuyu düz tabanlı plakalar içine (kuyu başına 1 x 104 hücre). Plakayı 37 °C'de kuluçkaya yatırın, 16-22 saat boyunca gece boyunca% 5 karbondioksit (CO2).
3. Gün 2 - Hücreleri enfekte etme
- Plakayı/plakaları inkübatörden çıkarın ve hücrelerin kuyulara eşit şekilde dağıldığını ve izdiahın ~% 50 olduğunu doğrulamak için hafif bir mikroskop kullanın. Hücreler %45-%55 izdiah aralığında değilse, '1. gün' protokolünü tekrarlayın ve ilk hücre konsantrasyonu buna göre ayarlayın.
- Seyreltici olarak önceden ısıtılmış komple DMEM kullanarak 1,5 mL mikrosantrifüj tüplerde ilgi çekici serum örneklerinin seri seyreltmelerini oluşturun. Tablo 1 , üç taraflı numuneler için seyreltme kaskadının neslini göstermektedir.
- Tahlilleri üç taraflı olarak gerçekleştirmek için, bir virüs stok çözeltisini 1x PBS'de seyrelterek 7,5 x 106 vektör genomu (vg)/μL AAV6-hPLAP çalışma çözeltisi hazırlayın (bkz. Malzeme Tablosu).
- 264 μL serum/ortam seyreltme içeren her tüpe 7,5 x 106 vg/μL virüs çalışma çözeltisinin 66 μL'sini ekleyin (toplam hacim/seyreltmenin 330 μL'si, bkz. Tablo 1).
NOT: Bu, mükemmel kültür koşulları gerektirmeyen sağlam bir testtir. Bununla birlikte, her test çalışmasının doğru bir şekilde nicel olması ve güvenilir olduğundan emin olmak için aşağıdakileri dahil etmek gerekir: (1) yalnızca bir virüs ve ortam kontrolü, (2) yalnızca bir ortam kontrolü ve (3) aynı deneysel koşullar altında tüm plakalarda bir NAb pozitif kontrol örneği. Açıklanan hacim (330 μL), serum ve virüs karışımının +%10'u kadar üç taraflı örnekleri oluşturmaktadır. Nötralize edici aktivitenin doğru tespiti için çoğaltmaların gerçekleştirilmesi şiddetle tavsiye edilir.
- Pipetleme ile virüs/serum seyreltmelerini karıştırın ve virüs/serum karışımlarını içeren tüpleri 37 °C'de bir inkübatöre yerleştirin, 30 dakika boyunca% 5 CO2 potansiyel nötralizasyonun gerçekleşmesini sağlamak için.
- Pipet 100 μL virüs/serum karışımı her kuyuya 96 kuyu plakasında her bir kuyuya 1 x 104 hücre/kuyu içeren her seyreltme için.
NOT: Bu, her kuyuda 15k virüs / hücre çokluğu enfeksiyon (MOI) nihai viral konsantrasyonu üretecektir. Tablo 2 , numuneleri 1/512 seyreltme için değerlendirmek için örnek bir 96 kuyu örnek plaka düzeni sağlar. - Hücre, serum ve AAV-hPLAP içeren 96 kuyu plakasını folyoya sarın ve AAV'nin hücrelere girmesine izin vermek için 37 °C'de bir inkübatöre yerleştirin, 16-24 saat boyunca bir gecede% 5 CO2 .
| Seyreltme basamaklı etiketi | Seyreltme | 3 x numune (240 μL) + %10 tampon hacmi (24 μL) | Serum oranı:medya |
| Seyreltme 1 (D1) | 1/2 | 264 μL serum 264 μL ortam | 50:50 |
| Seyreltme 2 (D2) | 1/4 | 264 μL D1 + 264 μL ortam | 25:75 |
| Seyreltme 3 (D3) | 1/8 | 264 μL D2 +264μL ortam | 12.5:87.5 |
| Seyreltme 4 (D4) | 1/16 | 264 μL D3 +264 μL ortam | 6.25:93.75 |
| Seyreltme 5 (D5) | 1/32 | 264 μL D4 +264 μL ortam | 3.13:96.87 |
| Seyreltme 6 (D6) | 1/64 | 264 μL D5 +264 μL ortam | 1.56:98.44 |
| Seyreltme 7 (D7) | 1/128 | 264 μL D5 +264 μL ortam | 0.78:99.22 |
| Seyreltme 8 (D8) | 1/256 | 264 μL D5 +264 μL ortam | 0.39:99.61 |
| Seyreltme 9 (D9) | 1/512 | 264 μL D7 + 264 μL ortam | 0.2:99.8 |
| Seyreltme 10 (D10) | 1/2048 | 132 μL D8 + 396 μL ortam | 0.05:99.95 |
| Seyreltme 11 (D11) | 1/8192 | 132 μL D9 + 396 μL ortam | 0.01:99.99 |
| Seyreltme 12 (D12) | 1/32768 | 132 μL D10 + 396 μL ortam | 0.003:99.997 |
Tablo 1: Üç taraflı serumun seri seyreltmelerini oluşturmak için serum ve seyreltici hacimleri gereklidir.
| Serum örneği #1 | Serum örneği #2 | Serum örneği #3 | Mono AB (mAB), kontroller ve ekstra numuneler | |||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
| A | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 1/2 | 50 ng MAb | 50 ng MAb | 50 ng MAb |
| B | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 1/4 | 5 ng MAb | 5 ng MAb | 5 ng MAb |
| C | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 1/8 | 0.5 ng MAb | 0.5 ng MAb | 0.5 ng MAb |
| D | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | 1/16 | MO (-C) | MO (-C) | MO (-C) |
| E | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | 1/32 | VO (+C) | VO (+C) | VO (+C) |
| F | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | 1/64 | Örnek #1 1/512 | Örnek #1 1/512 | Örnek #1 1/512 |
| G | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | 1/256 | Örnek #2 1/512 | Örnek #2 1/512 | Örnek #2 1/512 |
| H | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | 1/512 | Örnek #3 1/512 | Örnek #3 1/512 | Örnek #3 1/512 |
Tablo 2: 1/2 ile 1/512 arasında değişen seyreltmelerde naif serum örneklerini değerlendirmek için örnek 96 kuyu plakası düzeni. AAV NAbs (yönetim sonrası numuneler) için pozitif olduğu bilinen bir numunenin değerlendirilmesi veya daha yüksek bir titrenin gerekli olması durumunda daha yüksek seyreltmeler teste dahil edilir. MO (-C): Yalnızca ortam kontrolü. VO (+C): Virüs ve medya yalnızca kontrol eder. mAb: AAV'ye karşı monoklonal antikor (NAb pozitif kontrol).
4. Gün 3 - Hücrelere sabitleme ve alt tabaka ekleme
- 1x PBS ila 37 °C (~25 mL/96-well plaka) aliquot'u önceden ısıtın. PBS (~25 mL/96 kuyu plakası) ve çift damıtılmış H2O (DDW, ~25 mL/96 kuyu plakası) ile 4 °C arasında soğuk ayrı aliquots. BCIP/NBT peletini (bkz. Malzeme Tablosu) 10 mL DDW'de 50 mL konik santrifüj tüpünde girdapla çözün (2 x 96 kuyu plakası için 10 mL yeterlidir).
- Emiş bazlı bir aspirasyon sistemine veya duman kaput vakumuna bağlı serolojik bir pipet veya benzeri bir pipet kullanarak 96 kuyu plakasının kuyularından medyayı epire edin. Serolojik pipet ucunu yavaşça kuyuya yerleştirin ve yapışan hücreleri bozmamak için dikkatli davranarak ortamı çıkarın.
- Pipet kullanarak her kuyuya 50 μL RT %4 PFA ekleyin. Plakayı folyoya sarın ve hücreleri sabitlemek için 10 dakika RT'de bırakın.
DİkKAT: Paraformaldehit (PFA) olası bir kanserojendir ve cilt veya göz teması veya solumadan toksiktir. Uygun kişisel koruyucu ekipmanın yanı sıra yüz maskesi ile duman kaputunda sapın. PBS'de seyreltilmiş taze% 4 PFA yapın (96 kuyu plakası başına ~ 7 mL gereklidir).
- Pipet kullanarak her kuyuya 50 μL RT %4 PFA ekleyin. Plakayı folyoya sarın ve hücreleri sabitlemek için 10 dakika RT'de bırakın.
- Hücreleri 200 μL RT 1x PBS ile yıkayın ve aspire edin. Bu adımı iki kez yineleyin.
NOT: Çok kanallı pipet pipet, pipetleme adımları için verimli bir seçenektir. - Pipet 200 μL önceden ısıtılmış PBS her kuyuya, plakayı folyoya sarın ve endojen alkali fosfataz aktivitesini denature etmek için 90 dakika boyunca 65 °C'de kuluçkaya yatırın30.
- Kuyuları epire edin ve hücreleri 200 μL soğuk (4 °C) PBS ile yıkayın. Tekrar aspire edin, 200 μl soğuk DDW'de yıkayın ve tekrar aspire edin.
- Çözünmüş BCIP/NBT'nin pipet 50 μL'si (adım 4.1'de hazırlanmıştır) her kuyuya.
- Plakayı folyoya sarın ve RT'de 2-24 saat kuluçkaya yatırın.
NOT: Çalıştırmalar arasındaki kuluçka süresiyle tutarlı olun; zaman esnekliği, kullanıcıların kuyuları 3. - Hafif bir mikroskop kamerası kullanarak, 4x objektif lens kullanarak her kuyunun fotoğraflarını çekerek, aynı pozlama, beyaz dengeleme ve ışık ayarlarının gerçekleştirilen tüm tahliller için tutarlı bir şekilde kullanılmasını sağlayın.
- Her birini aynı şekilde konumlandırın ve kuyunun kenarlarının fotoğraflarda görünmemesini sağlayın. Fotoğrafları TIF biçiminde veya benzer bir biçimde kaydedin.
NOT: Belirli ayarlar mikroskoplar arasında değişir, ancak arka plan aydınlatması kuyular boyunca yüksek ve tutarlıysa nicelik en etkili olacaktır (Şekil 1B).
- Her birini aynı şekilde konumlandırın ve kuyunun kenarlarının fotoğraflarda görünmemesini sağlayın. Fotoğrafları TIF biçiminde veya benzer bir biçimde kaydedin.
5. ImageJ kullanarak nötralize etme etkinliğini belirlemek için nicellik
- Serbestçe kullanılabilen "ImageJ" yazılımını indirip yükleyin (bkz. Malzeme Tablosu).
- Dosya > Aç'ı seçerek ImageJ'de analiz edilecek görüntüyü açın (Şekil 2).
- Renkli görüntüler kullanıyorsanız, Görüntü > Tür > 8 bit'i seçerek gri tonlamalı görünüme dönüştürün.
- Görüntü > > Eşiğini Ayarla'ya tıklayın. Tüm renkli alanlar kırmızı renklendirilene kadar eşiği ayarlayın, ancak arka plan renklendirilmez. NBT/BCIP'yi ekledikten sonra, renkli ürün hPLAP'yi ifade eden hücrelerin etrafındaki alana birikir.
NOT: Aynı plakada yakalanan tüm görüntüler için aynı eşik ayarının kullanılması önerilir. - Ölçümleri > Ayarla'yı analiz et'e tıklayın ve Alan, Eşikle Sınırla, Alan Kesir ve Etiket Göster onay kutularını işaretleyin ve Tamam'ı tıklatın.
- Belirli bir kuyunun sinyal okumasını (renklendirme yüzdesi) belirlemek için Ölçü > Analiz Et'i tıklatın. Açılır pencerenin 'Alan Yüzdesi' sütunu sinyal okumasını görüntüler.
- Tüm örnek çoğaltmaları için nicelik gerçekleştirin. Kirlenmiş kuyuları, düzensiz hücre dağılımını gösteren kuyuları veya hücre yoğunluğu veya aydınlatmasında değişen kuyuları hariç tutun.
NOT: Hariç tutma için dikkate alınması gereken kuyu örnekleri için Ek Şekil 1'e bakın. Tipik olarak, 3-4 kuyu 96 kuyu plakasından hariç tutulması gerekebilir. Şekil 2 , ImageJ kullanarak nicellik işleminin görsel bir gösterimini sağlar.
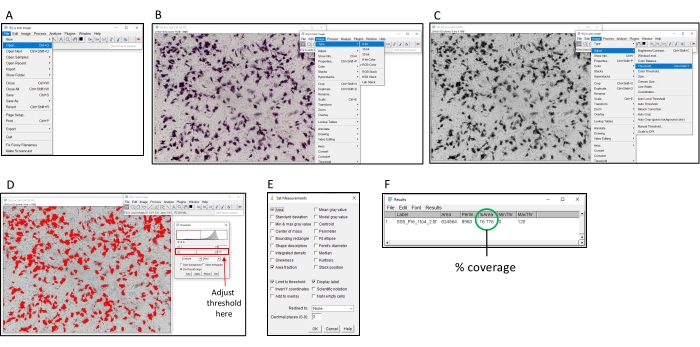
Şekil 2: ImageJ yazılımını kullanarak yüzde renklendirmeyi belirleme adımları. (A) Analiz edilecek görüntüyü ImageJ yazılımı ile açın. (B) Görüntüyü 8 bit gri tonlamalı olarak dönüştürün. (C) Eşik penceresini açın. (D) Tüm renkli alanların kapsanması için maksimum eşiği ayarlayın, ancak arka plan alanı örtülmez (bu eşik tüm plaka boyunca tutarlı olmalıdır). (E) 'Analiz Et' dropbox'ını seçin, 'Ölçümleri ayarla' ve 'Alan', 'Alan fraksiyonu', 'Eşiği sınırla' ve 'Ekran etiketi'ni işaretleyin ve 'Tamam'a tıklayın. (F) Kapalı alanı ölçmek için 'Ölçü'ye tıklayın. % alanı, renkli görüntünün oranını gösterir. Bu daha sonra TI50 titresini belirlemek için kontrol örnekleriyle birlikte kullanılabilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
6. Transdüksiyon İnhibisyonunun (TI50) Titerinin Belirlenmesi
- Aşağıdakiler için çoğaltmalardan ortalama okuma (adım 5'te açıklanan adımları kullanarak) belirleyin: (1) Yalnızca ortam denetimi (temel sinyal okuma). (2) Virüs + sadece medya kontrolü (maksimum sinyal okuma). (3) Virüs + serum örnekleri ilgi çekici.
- Aşağıdaki formülü kullanarak inhibisyon yüzdesini hesaplayın:
100 - [(Test numunesi sinyal okuma (virüs + serum ilgi örneği) - taban çizgisi sinyal okuma (yalnızca medya kontrolü)) / (maksimum sinyal okuma (yalnızca medya ve virüs) - temel sinyal okuma) x 100] = % Transdüksiyon inhibisyonu13. - Formülü 6.2'de kullanarak tüm numuneler için her seyreltmenin tüm çoğaltmalarından % transdüksiyon inhibisyonunu hesaplayın. Tüm numuneler ve kontroller için her seyreltme için teknik çoğaltmalar arasındaki ortalama transdüksiyon inhibisyonunu belirleyin.
- HPLAP aktivitesinin % 50 veya daha fazla transdüksiyon inhibisyonunu veren numunenin en düşük seyreltmesini belirleyerek bir ilgi örneğinin% 50 transdüksiyon inhibisyon titerini (TI50 titer) hesaplayın. örneğin, bir numunenin 1/8 seyreltilmesi, 6,2'de yapılan hesaplamaya göre % 50'den fazla transdüksiyon inhibisyona sahipse (ve 1/4 seyreltme değilse), TI50 titerini 1/8 olarak bildirin.
7. Nötralize edilmiş AAV parçacıklarının belirlenmesi
- Aşağıdaki formülü kullanarak belirli bir örnek için serumun μL başına nötralize edilmiş AAV partiküllerinin sayısını hesaplayın:
((MOI x hücre sayısı/kuyusu) / (serum hacmi / TI50 titresinin seyreltme faktörü)) / 2 = nötralize AAV parçacıkları / μL serum9.
NOT: Nötralize edilmiş parçacıkların %50'sini ölçen TI50 için 2 hesaba bölme. 1/4 TI50 titer (%25 serum) veren bir örnek için, %75 seyreltilmemiş serum ve 1 x 104 hücre üzerine 15k kaplama moi kullanıldığı %75 seyreltici) aşağıdaki hesaplamalar kullanılacaktır: (((15000 x 10000) / (80/4)) / 2 = 3.75x106 nötralize parçacıklar / μL serum.
Sonuçlar
Plaka kapsamı için en uygun viral dozluğu belirlemek için transdüksiyon tahlilleri
Bu test için köklü bir fibrosarkom hücre hattı olan HT1080 hücreleri seçildi. 1 x 104 HT1080 hücre/kuyu konsantrasyonu, 96 kuyulu bir plakanın her kuyusunda ~% 50 hücre konflüensi sağladı. Test için en uygun viral konsantrasyonu belirlemek için, bir hPLAP (insan plasetal alkali fosfataz) muhabir geni (AAV6-hPLAP)31'i kodlayan bir rAAV, hücre başına parçacık iç...
Tartışmalar
Bu rapor, in vitro viral transdüksiyon derecesine karşılık gelen kromojenik reaksiyonu değerlendirerek belirli bir serum örneğinde AAV nötralizasyonunun kapsamını değerlendiren kolorimetrik bir tahlil açıklanmaktadır. Protokolün geliştirilmesi, immünhistokimi gibi uygulamalarda protein hedeflerinin tespiti için bir boyama aracı ve viral transdüksiyonu değerlendirmek için bir muhabir aracı olarak yaygın olarak kullanılan alkali fosfataz enzimi ile NBT/BCIP arasındaki bilinen kromojenik r...
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu çalışma, JRM ve CJT'ye Ulusal Sağlık ve Tıbbi Araştırma Konseyi Proje Hibesi (ID 1163732) ve kısmen Victoria Hükümeti'nin Operasyonel Altyapı Destek Programı tarafından finanse edildi. SB, Baker Kalp ve Diyabet Enstitüsü-La Trobe Üniversitesi Doktora Bursu ile desteklenmektedir. KLW, Avustralya Ulusal Kalp Vakfı'ndan (ID 102539) Shine On Foundation ve Geleceğin Lider Bursu tarafından desteklenmektedir. JRM, Ulusal Sağlık ve Tıbbi Araştırma Konseyi Kıdemli Araştırma Bursu (ID 1078985) tarafından desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin/EDTA | Gibco | 25300-054 | |
| 50 mL conical centrifuge tube | Falcon | 14-432-22 | Or equivalent |
| 75 cm2 square flasks | Falcon | 353136 | Or equivalent |
| 96 well flat bottomed plate | Falcon | 353072 | |
| AAV6-CMV-hPLAP Vector | Muscle Research & Therapeutics Lab (University of Melbourne, Australia) AAV6-CMV-hPLAP can be provided upon request. | ||
| Aluminium foil | |||
| Anti-AAV6 (intact particle) mouse monoclonal antibody, (ADK6) | PROGEN | 610159 | Positive control monoclonal antibody |
| BCIP/NBT | SIGMAFAST | B5655 | |
| Cell and tissue culture safety cabinet | |||
| Electronic Pipette | 5 & 10 mL stripette inserts | ||
| Fetal Bovine Serum | Gibco | 10099-141 | |
| Haemocytometer | |||
| High glucose Dulbecco's Modified Eagle Medium (DMEM) | Gibco | 11965118 | |
| HT1080 cells | ATCC | ||
| ImageJ Software | Freely available: https://imagej.nih.gov/ij/download.html | ||
| Incubator | 37 °C, 5% CO2 | ||
| Light microscope with camera | Capable of taking photos with a 4x objective lens | ||
| Oven | For a 65 °C incubation | ||
| Paraformaldehyde | MERCK | 30525-89-4 | |
| Penicillin Streptomycin | Gibco | 15140-122 | |
| Phosphate buffered saline | |||
| Pipettes and tips | 20 μL, 200 μL & 1 mL single pipettes and tips & 200 μL multichannel pipette | ||
| Stericup quick release filter | Millipore | S2GPU10RE | Used for combining media reagents |
| Trypan blue solution | Sigma-Aldrich | T8154 | |
| VACUETTE TUBE 8 ml CAT Serum Separator Clot Activator | Greiner BIO-ONE | 455071 | Used for serum collection & processing from sheep |
| Water bath |
Referanslar
- Bass-Stringer, S., et al. Adeno-associated virus gene therapy: Translational progress and future prospects in the treatment of heart failure. Heart, Lung and Circulation. 27 (11), 1285-1300 (2018).
- Casey, G. A., Papp, K. M., MacDonald, I. M. Ocular gene therapy with adeno-associated virus vectors: current outlook for patients and researchers. Journal of Ophthalmic and Vision Research. 15 (3), 396-399 (2020).
- Lykken, E. A., Shyng, C., Edwards, R. J., Rozenberg, A., Gray, S. J. Recent progress and considerations for AAV gene therapies targeting the central nervous system. Journal of Neurodevelopmental Disorders. 10 (1), 16 (2018).
- Guggino, W. B., Cebotaru, L. Adeno-Associated Virus (AAV) gene therapy for cystic fibrosis: Current barriers and recent developments. Expert Opinion on Biological Therapy. 17 (10), 1265-1273 (2017).
- Perrin, G. Q., Herzog, R. W., Markusic, D. M. Update on clinical gene therapy for hemophilia. Blood. 133 (5), 407-414 (2019).
- Wang, D., Tai, P. W. L., Gao, G. Adeno-associated virus vector as a platform for gene therapy delivery. Nature Reviews Drug Discovery. 18 (5), 358-378 (2019).
- Kuzmin, D. A., et al. The clinical landscape for AAV gene therapies. Nature Reviews Drug Discovery. 20 (3), 173-174 (2021).
- Russell, S., et al. Efficacy and safety of voretigene neparvovec (AAV2-hRPE65v2) in patients with RPE65-mediated inherited retinal dystrophy: A randomised, controlled, open-label, phase 3 trial. Lancet. 390 (10097), 849-860 (2017).
- Weber, T. Anti-AAV Antibodies in AAV gene therapy: Current challenges and possible solutions. Frontiers in Immunology. 12, 658399 (2021).
- Weeks, K. L., et al. Phosphoinositide 3-kinase p110alpha is a master regulator of exercise-induced cardioprotection and PI3K gene therapy rescues cardiac dysfunction. Circulation: Heart Failure. 5 (4), 523-534 (2012).
- Gregorevic, P., et al. Systemic delivery of genes to striated muscles using adeno-associated viral vectors. Nature Medicine. 10 (8), 828-834 (2004).
- Bernardo, B. C., et al. Gene delivery of medium chain acyl-coenzyme A dehydrogenase induces physiological cardiac hypertrophy and protects against pathological remodelling. Clinical Science (London). 132 (3), 381-397 (2018).
- Meliani, A., et al. Determination of anti-adeno-associated virus vector neutralizing antibody titer with an in vitro reporter system. Human Gene Therapy Methods. 26 (2), 45-53 (2015).
- Falese, L., et al. Strategy to detect pre-existing immunity to AAV gene therapy. Gene Therapy. 24 (12), 768-778 (2017).
- Wang, D., et al. Adeno-Associated virus neutralizing antibodies in large animals and their impact on brain intraparenchymal gene transfer. Molecular Therapy - Methods & Clinical Development. 11, 65-72 (2018).
- Wang, M., et al. Prediction of adeno-associated virus neutralizing antibody activity for clinical application. Gene Therapy. 22 (12), 984-992 (2015).
- Kruzik, A., et al. Detection of biologically relevant low-titer neutralizing antibodies against adeno-associated virus require sensitive in vitro assays. Human Gene Therapy Methods. 30 (2), 35-43 (2019).
- Lehtoranta, L., Villberg, A., Santanen, R., Ziegler, T. A novel, colorimetric neutralization assay for measuring antibodies to influenza viruses. Journal of Virological Methods. 159 (2), 271-276 (2009).
- Johnston, P. B., Grayston, J. T., Loosli, C. G. Adenovirus neutralizing antibody determination by colorimetric assay. Proceedings of the Society for Experimental Biology and Medicine. 94 (2), 338-343 (1957).
- Xiaoli Zhu, T. G. . Nano-Inspired Biosensors for Protein Assay with Clinical Applications. , 237-264 (2019).
- Jungmann, A., Muller, O., Rapti, K. Cell-based measurement of neutralizing antibodies against adeno-associated virus (AAV). Methods in Molecular Biology. 1521, 109-126 (2017).
- Samineni, S., et al. Optimization, comparison, and application of colorimetric vs. chemiluminescence based indirect sandwich ELISA for measurement of human IL-23. Journal of Immunoassay and Immunochemistry. 27 (2), 183-193 (2006).
- Siddiqui, J., Remick, D. G. Improved sensitivity of colorimetric compared to chemiluminescence ELISAs for cytokine assays. Journal of Immunoassay and Immunochemistry. 24 (3), 273-283 (2003).
- Arnett, A. L., Garikipati, D., Wang, Z., Tapscott, S., Chamberlain, J. S. Immune responses to rAAV6: The Influence of canine parvovirus vaccination and neonatal administration of viral vector. Frontiers in Microbiology. 2, 220 (2011).
- Australian code for the care and use of animals for scientific purposes. National Health and Medical Research Council Available from: https://www.nhmrc.gov.au/about-us/publications/australian-code-care-and-use-animals-scientific-purposes (2013)
- Coecke, S., et al. Guidance on good cell culture practice. A report of the second ECVAM task force on good cell culture practice. Alternatives to Laboratory Animals. 33 (3), 261-287 (2005).
- Journal of Visualized Experiments. General Laboratory Techniques. Journal of Visualized Experiments Database. , (2018).
- AAV-HT1080 Cells. Stratagene Available from: https://www.chem-agilent.com/pdf/strata/240109.pdf (2003)
- Strober, W. Trypan blue exclusion test of cell viability. Current Protocols in Immunology. 111 (3), 1-3 (2015).
- Bieber, S., et al. Extracorporeal delivery of rAAV with metabolic exchange and oxygenation. Scientific Reports. 3, 1538 (2013).
- Winbanks, C. E., Beyer, C., Qian, H., Gregorevic, P. Transduction of skeletal muscles with common reporter genes can promote muscle fiber degeneration and inflammation. PLoS One. 7 (12), 51627 (2012).
- Thomas, C. J., et al. Evidence that the MEK/ERK but not the PI3K/Akt pathway is required for protection from myocardial ischemia-reperfusion injury by 3',4'-dihydroxyflavonol. European Journal of Pharmacology. 758, 53-59 (2015).
- Barger, A., et al. Use of alkaline phosphatase staining to differentiate canine osteosarcoma from other vimentin-positive tumors. Veterinary Pathology. 42 (2), 161-165 (2005).
- Gregorevic, P., et al. Evaluation of vascular delivery methodologies to enhance rAAV6-mediated gene transfer to canine striated musculature. Molecular Therapy. 17 (8), 1427-1433 (2009).
- Sharma, A., Ghosh, A., Hansen, E. T., Newman, J. M., Mohan, R. R. Transduction efficiency of AAV 2/6, 2/8 and 2/9 vectors for delivering genes in human corneal fibroblasts. Brain Research Bulletin. 81 (2-3), 273-278 (2010).
- Smejkal, G. B., Kaul, C. A. Stability of nitroblue tetrazolium-based alkaline phosphatase substrates. Journal of Histochemistry & Cytochemistry. 49 (9), 1189-1190 (2001).
- Falese, L., et al. Strategy to detect pre-existing immunity to AAV gene therapy. Gene Therapy. 24 (12), 768-778 (2017).
- Orlowski, A., et al. Successful transduction with AAV Vectors after selective depletion of anti-aav antibodies by immunoadsorption. Molecular Therapy - Methods & Clinical Development. 16, 192-203 (2020).
- Goossens, K., et al. Differential microRNA expression analysis in blastocysts by whole mount in situ hybridization and reverse transcription quantitative polymerase chain reaction on laser capture microdissection samples. Analytical Biochemistry. 423 (1), 93-101 (2012).
- Entrican, G., Wattegedera, S. R., Griffiths, D. J. Exploiting ovine immunology to improve the relevance of biomedical models. Molecular Immunology. 66 (1), 68-77 (2015).
- Walters, E. M., Prather, R. S. Advancing swine models for human health and diseases. Molecular Medicine. 110 (3), 212-215 (2013).
- Rapti, K., et al. Neutralizing antibodies against AAV serotypes 1, 2, 6, and 9 in sera of commonly used animal models. Molecular Therapy. 20 (1), 73-83 (2012).
- Tellez, J., et al. Characterization of naturally-occurring humoral immunity to AAV in sheep. PLoS One. 8 (9), 75142 (2013).
- Gupta, S., et al. Recommendations for the validation of cell-based assays used for the detection of neutralizing antibody immune responses elicited against biological therapeutics. Journal of Pharmaceutical and Biomedical Analysis. 55 (5), 878-888 (2011).
- Gupta, S., et al. Recommendations for the design, optimization, and qualification of cell-based assays used for the detection of neutralizing antibody responses elicited to biological therapeutics. Journal of Immunological Methods. 321 (1-2), 1-18 (2007).
- Shankar, G., et al. Recommendations for the validation of immunoassays used for detection of host antibodies against biotechnology products. Journal of Pharmaceutical and Biomedical Analysis. 48 (5), 1267-1281 (2008).
- U.S. Department of Health and Human Services Food and Drug Administration. Center for Drug Evaluation and Research (CDER). Immunogenicity Testing of Therapeutic Protein Products — Developing and Validating Assays for Anti-Drug Antibody Detection. U.S. Department of Health and Human Services Food and Drug Administration. , (2019).
- Baatartsogt, N., et al. A sensitive and reproducible cell-based assay via secNanoLuc to detect neutralizing antibody against adeno-associated virus vector capsid. Molecular Therapy - Methods & Clinical Development. 22, 162-171 (2021).
- Watano, R., Ohmori, T., Hishikawa, S., Sakata, A., Mizukami, H. Utility of micro mini pigs for evaluating liver-mediated gene expression in the presence of neutralizing antibody against vector capsid. Gene Therapy. 27 (9), 427-434 (2020).
- Majowicz, A., et al. Therapeutic hFIX activity achieved after single AAV5-hFIX treatment in Hemophilia B patients and NHPs with pre-existing anti-AAV5 NABs. Molecular Therapy - Methods & Clinical Development. 14, 27-36 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır