A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
סינתזה של ננו-ג'לים המגיבים לגירויים באמצעות קרוסלינקינג מימי חד-שלבי וקו-ננופילמריזציה
In This Article
Summary
ננו-ג'לים הם פלטפורמת ננו-חלקיקים מצוינת ורב-תכליתית לאספקת תרופות ביולוגיות. ננו-ג'לים פולימריים מבוססי פולי(אתילן) המגיבים לגירויים, המסוגלים לעטוף מטענים מבוססי חלבון, סונתזו באמצעות אסטרטגיית קו-פילמור צולבת בת שלב אחד בתנאים מימיים. הייצור והאפיון האופטימליים של ננו-חלקיקים חדשניים אלה מוצגים כאן.
Abstract
ננו-ג'לים המורכבים מננו-חלקיקים פולימריים מוצלבים פותחו עבור מתן טיפולים כימיים וביולוגיים רבים, הודות לסינתזה הרב-תכליתית שלהם מלמטה למעלה ולתאימות הביולוגית שלהם. בעוד שיטות שונות שימשו לסינתזה של ננו-ג'ל עד כה, מעט מאוד השיגו זאת ללא שימוש בממסים אורגניים קשים או בטמפרטורות גבוהות שעלולות לפגוע בשלמות המטען הביולוגי. לעומת זאת, המתודולוגיה המוצגת כאן משיגה סינתזה של ננו-ג'לים עתירי חלבון בגודל תת-100 ננומטר תוך שימוש בתנאי תגובה מתונים. כאן, אנו מציגים שיטה לאנקפסולציה לא קוולנטית של מטענים מבוססי חלבון בתוך ננו-ג'לים שסונתזו באמצעות טכניקת קופולימריזציה מבוססת מימית, חד-שלבית וקרוסלינקינג. בטכניקה זו, בתחילה אנו קושרים אלקטרוסטטית מטען מבוסס חלבון למונומר אמוניום רבעוני קטיוני ובו זמנית מצליבים וקו-פולימריים אותו באמצעות אמוניום פרסולפט ו- N,N,N',N',N'-TETRAMETHYLETHYLENEDIAMINE ליצירת ננו-ג'לים הלוכדים את מטען החלבון. הגודל ומדד הפיזור של הננו-ג'לים נקבעים באמצעות פיזור אור דינמי (DLS), בעוד שמורפולוגיית פני השטח מוערכת על ידי מיקרוסקופ אלקטרונים תמסורת (TEM). מסת החלבון הכלואה בתוך ננו-ג'לים נקבעת על ידי חישוב יעילות האנקפסולציה. יתר על כן, יכולת השחרור המבוקר של הננו-ג'לים באמצעות פירוק הדרגתי של אלמנטים מבניים המגיבים לחמצון-חיזור מוערכת גם בבדיקות ביו-רדוקציה. אנו מספקים דוגמאות לנתוני אופטימיזציה של ננו-חלקיקים כדי להדגים את כל האזהרות של סינתזת ננו-ג'ל ואפיון באמצעות טכניקה זו. באופן כללי, ננו-ג'לים בגודל אחיד התקבלו עם גודל ממוצע של 57 ננומטר וערך אינדקס polydispersity של 0.093. הושגה יעילות אנקפסולציה גבוהה של 76%. יתר על כן, הננו-ג'לים הציגו שחרור מבוקר של עד 86% מהחלבון העטוף על ידי פירוק הדרגתי של רכיבים חדשים המגיבים לחמצון-חיזור בנוכחות גלוטתיון במשך 48 שעות.
Introduction
ננו-ג'לים הם הידרוג'לים תלת-ממדיים בגודל תת-מיקרוני עם מבני רשת פולימריים מוצלבים שיכולים להכיל כמויות גדולות של נוזלים בתוך מעטפת הליבה שלהם מבלי להשפיע על שלמותם המורפולוגית1. באופן כללי, ננו-ג'לים מסונתזים על ידי פילמור של מונומרים פונקציונליים באמצעות הצלבה פיזיקלית או כימית במערכות קולואידיות הטרוגניות, כגון מיקרואמולסיות הופכיותשל מים בשמן 2,3. קופולימרים אמפיפיליים יכולים להתאסף בעצמם למבנים ננומטריים בסביבות מימיות. עם זאת, יש לייצב אותם באמצעות אסטרטגיות הצלבה כימיות הכוללות דיסולפידים או צימוד מבוסס אמיד, כימיית קליק, או שניתן לגרום להם פיזית (אסטרטגיות הידרופוביות, אלקטרוסטטיות או קשרי מימן) או לגרום לפוטו-אינדוקציה4. בין אסטרטגיות אלה, הרכבה עצמית פיזית של פולימרים ואחריה קרוסלינקינג כימי דווחה כטכניקת ייצור ננו-ג'ל מוצלחת5. בעוד שמבחינה היסטורית, הננו-ג'ל הראשון הוצג בשנות ה-90 על ידי Vingradov et al.6, Akiyoshi et al.7 ו-Lemieux et al.8, לאחרונה פותחו ונחקרו מגוון ננו-ג'לים חכמים המורכבים מפולימרים טבעיים וסינתטיים כאחד עבור יישומים ביו-רפואיים מגוונים9.
לננו-ג'לים יכולת שימור מטען נרחבת, שטח פנים גדול, יציבות in vivo וכן תכונות כימיות ומכניות הניתנות להתאמה אישית10. הסינתזה של ננו-ג'לים היא גם ניתנת להרחבה ויכולה להיות מבוססת על מים. בנוסף, תכולת המים המשופרת של הננו-ג'לים הופכת אותם לנשאים יעילים של מטענים ביולוגיים רגישים11. יתר על כן, שטח הפנים הגבוה יכול לספק צרכים ביולוגיים מרובים, ובכך מאפשר חיבור של אופני מיקוד כדי לאפשר מיקוד פעיל. יש לציין כי הרבגוניות של תכנון ננו-ג'ל מאפשרת שימוש במגוון רחב של מונומרים המגיבים לגירויים המאפשרים שליטה מדויקת בתכונות הפיזיקוכימיות שלהם9. יכולת הנדסית ייחודית זו מאפשרת שיפור רציונלי של תכנון ננו-ג'ל, דבר שקשה להשיג עם ליפוזומים, מיצלים או פולימרוזומים12,13 בשימוש קונבנציונלי. על ידי שילוב moieties מגיבים לגירויים בתוך מונומרים שתוכננו במיוחד, ננו-ג'ל יכול להיות מהונדס כדי להפעיל את השחרור המבוקר של המטען שלהם בתגובה לגירויים פיזיולוגיים רלוונטיים שונים, כגון pH, תנאי חמצון-חיזור, אנזימים וכו '9,14. ננו-ג'לים חכמים כאלה שימושיים יותר מננו-ג'לים רגילים, שכן הם בעלי יציבות מעולה לזרימת דם ממושכת, והם יכולים לעמוד בתנאים פיזיולוגיים כדי לשמור על שלמות המטען שלהם ולתווך את שחרורו המבוקר באתרי המטרה הרצויים15. ואכן, בשל אופיים הרב-תכליתי, ננו-ג'לים צברו תאוצה בזירה הביו-רפואית, עם התקדמות ניכרת בפיתוח ננו-ג'לים מגיבים לגירויים עבור יישומים תרנוסטיים ואבחוניים רבים 2,16,17.
תרופות ביולוגיות יכולות לייצג קטגוריה של מוצרים פרמצבטיים המורכבים מחלבונים, פפטידים ו/או חומצות גרעין וחוללו מהפכה בנוף הטיפולי בשל הסלקטיביות יוצאת הדופן שלהם, ובכך הפכו לקבוצה הצומחת ביותר של תרופות18. ואכן, השוק הצומח של תרופות כאלה ניכר בעלייה התלולה באישורם על ידי איגוד התרופות הפדרלי בארה"ב (FDA), שם ביולוגים היוו ~40% מסך אישורי התרופות, בשנת 202319. בנוסף לספציפיות ולעוצמה שלהם, תגליות מהירות של מטרות תרופות חדשות, תהליכים ביו-הנדסיים יעילים יותר וידע רב יותר על גורלם in vivo של טיפולים אלה הובילו לשימוש מוגבר בהם20. תרופות ביולוגיות מסורתיות כוללות RNA מפריע, חלבונים חלופיים, ציטוקינים והורמונים המיוצרים בדרך כלל באמצעות טכנולוגיית DNA רקומביננטי21. מאז אישור אינסולין רקומביננטי אנושי בשנת 1982, פותחו תרופות ביולוגיות למצבים רבים, כולל סרטן (למשל, trastuzumab, avelumab), מחלות מעי דלקתיות (למשל, adalimumab, certolizumab) ומחלות גנטיות נדירות (למשל, mipomersan, myozyme, aldurazyme, fabrazyme)21. בעוד הספציפיות הגבוהה של האינטראקציות של ביולוגים עם המטרות שלהם אמורה תיאורטית לקזז כל השפעות מחוץ למטרה, מספר חששות קליניים הופיעו עם השימוש בהם הקשורים לתופעות לוואי לא רצויות22. תופעות לוואי אלה ניתן לקבץ לשתי קטגוריות, כולל פרמקולוגיה מוגזמת (גירוי יתר של מטרות) ואימונוגניות. נוסף על כך, זמן מחצית החיים הקצר שלהם, הזמינות הביולוגית המוגבלת, הנזק לפרוטאזות, חיי המדף הקצרים ותהליכי הייצור היקרים מגבילים את היתרונות הטיפוליים שלהם21. שיטות קונבנציונליות להקלה על בעיות אלה, כרוכות בשינוי קוולנטי של תרופות ביולוגיות אלה שעלולות לפגוע בתפקודן, ולכן, יעילות23. לחלופין, גישת הננו-רפואה לעטוף מטענים טיפוליים יכולה להעניק יתרונות רבים לתכונות פרמקולוגיות, והכי חשוב, מיקוד פסיבי לאתר המודלק באמצעות אפקט החלחול והשימור המשופר (EPR)24. יתרונות אחרים הקשורים לננו-חלקיקים יכולים לכלול זמני זרימת דם משופרים, קצב פינוי מופחת, גמישות רבה יותר בפורמולה, חדירות משופרת של כלי הדם וספיגת תאים25. בעוד מגוון עצום של ניסוחים ננו-חלקיקים נחקרים כיום עבור משלוח של מטענים ביולוגיים, מעטים יכולים לחקות את הרב-תכליתיות של ננו-ג'לים. ואכן, ננו-ג'לים עולים על יכולות ההעמסה המושגות על ידי ננו-חלקיקים מבוססי ליפוזומלים ומיצלה, והם מפגינים יציבות קולואידית גדולה יותר מרוב הננו-חלקיקים האי-אורגניים. ככאלה, ננו-ג'לים מהווים פלטפורמה רבת ערך למתן טיפולים ביולוגיים שונים.
בעבר סיפקנו בהצלחה אנזים נוגד חמצון בתוך ננו-ג'לים פולימריים צולבים חדשניים המגיבים למטאלופרוטאינאז, כאשר אסטרטגיית האנקפסולציה הקלה שבה נעשה שימוש שמרה על הפעילות הביולוגית של החלבון עם שחרור26. בעבודה זו, אנו מדגימים את הסינתזה הממוטבת של ננו-ג'לים המגיבים לחמצון-חיזור עבור העברת מטע"דים מבוססי חלבון. יש לציין כי המתודולוגיה הסינתטית מאפשרת סינתזת ננו-ג'ל בתנאים מתונים כדי לתמצת את המטען הרצוי, ללא שימוש בממיסים אורגניים קשים או בטמפרטורות גבוהות. ניצלנו את הומאוסטזיס החיזור בסביבה התוך-תאית כדי לווסת את שחרור המטען העטוף27,28. בדרך כלל, נוגד החמצון גלוטתיון (GSH) המצוי בשפע טבעי שולט בפוטנציאל חמצון-חיזור חוץ-תאי ותוך-תאי, שם ריכוזו נע בין 2-20 מיקרומטר ל-1-10 מילימול, בהתאמה29,30. עד כה, דווח על ננו-חלקיקים רבים הרגישים לחמצון-חיזור, מה שהופך זאת לאסטרטגיה מוכחת ואמינה המאפשרת שחרור מבוקר של תרופות in vivo27,28. ואכן, קשרים דיסולפידים הותקנו בתוך ננו-חומרים פולימריים באמצעות קרוסלינקרים המכילים דיסולפיד31,32, הרכבה עצמית של פולימרים מתכלים ממונומרים המכילים דיסולפיד33, ותרופות פולימר מגיבות חמצון-חיזור או מצומדות תרופות/פולימרים34,35. לכן, מחקר זה חוקר את שילובו של קרוסלינקר דיסולפיד ייחודי ורגיש מאוד ל-GSH בתוך ננו-חלקיקים פולימריים, ובכך מאפשר שחרור מבוקר של מטען חלבוני עטוף.
במחקר זה, תכנון ננו-ג'ל התמקד בקריטריונים הבאים לטיפול בספציפיות ובהעברת מטע"ד: גודל קטן (~100 ננומטר) והתפלגות גודל אחידה (אינדקס פיזור פולי-פיזור (PI)<0.3) כדי להבטיח חדירה יעילה של האנדותל ויציבות in vivo 27; אנקפסולציה יעילה של מטען חלבון, ושחרור מבוקר של מטען בתגובה ל-GSH. אנו מדווחים על סינתזה של ננו-ג'לים צולבים המגיבים ל-GSH, אשר הדגימו ננו-חלקיקים הומוגניים בגודל תת-100 ננומטר, עם יעילות אנקפסולציה של 76% של המטען החלבוני הרצוי.
Protocol
1. סינתזה של crosslinker מגיב חמצון-חיזור
- הוסף 2-aminoethylmethacrylate hydrochloride (44.79 מ"ג, 0.270 mmol) ו 0.063 מ"ל של triethylamine ל 3 מ"ל של dichloromethane נטול מים ולאפשר לערבב במשך 20 דקות תחת גז אינרטי N2 בבקבוק 25 מ"ל עגול תחתית.
- להמיס 4,7,10,13,16,19,22,25,32,35,38,41,44,47,50,53-Hexadecaoxa-28,29-dithiahexapentacontanedioic acid di-N-succinimidyl ester (100 מ"ג, 0.045 mmol) ב 1 מ"ל של dichloromethane נטול מים ולהוסיף לצלוחית.
- מוסיפים 4 מ"ל של dichloromethane נטול מים לצלוחית. עוטפים את בקבוק התגובה ברדיד אלומיניום ומשאירים לערבב מתחת ל-N2 בטמפרטורת החדר.
- אשר את היווצרות המוצר על-ידי כרומטוגרפיה בשכבה דקה. ודא הפניות נכונות לחומר המוצא תוך אישור היווצרות המוצר בשיטה זו.
- כרומטוגרפיה בשכבה דקה היא שיטה מבוססת זיקה המשמשת להפרדת תרכובות רצויות מתערובת התגובה. כאן, השתמש בצלחת סיליקה קוטבית מאוד סופג כמו שלב נייח. זהו את דגימת חומר המוצא ואת דגימת תערובת התגובה בקצה אחד של צלחת הסיליקה והניחו במאונך לתוך זכוכית סגורה עם האלואנט (שלב נייד: 5% מתנול: דיכלורומתאן).
- על ידי פעולה נימית, הפאזה הניידת נעה במעלה לוח הסיליקה ותרכובות הדגימה נודדות למרחקים משתנים בהתאם לזיקתן לשלב הנייח והנייד. כאשר חזית הממס חצתה 3/4מהצלחת , הסר את הצלחת וייבש אותה. התרכובות המופרדות מופיעות ככתמים על הלוח. כמת את גורם השימור (Rf) של התרכובת הרצויה כמרחק שעבר התרכובת/מרחק שעבר הממס. כאן, Rf של המוצר היה 0.35. אור UV או מכתים ניתן להשתמש כדי לדמיין את כתמים (permanganate אשלגן).
- רכזים את התערובת בוואקו ומטהרים באמצעות כרומטוגרפיה של עמוד הבזק (תערובת איזוקרטית של 5% מתנול: דיכלורומתאן)36. הכניסו את תערובת התגובה לחלק העליון של עמוד זכוכית עמוס בסיליקה (פאזה נייחת) ולאחר מכן נמלטו עם מערכת הממס (פאזה ניידת)36. אסוף את כל השברים והבדיקה באמצעות TLC כדי להבחין בין שברי המוצר באמצעות ערך Rf שנקבע קודם לכן.
- רכז את השברים המטוהרים על ידי אידוי הממס באמצעות מאייד סיבובי (טמפרטורה: 40 מעלות צלזיוס), הגדר את לחץ הוואקום ללחץ אטמוספרי כדי להסיר תחילה דיכלורומתאן רותח נמוך יותר. כאשר רמת הממס מפסיקה לרדת, הגדר את לחץ הוואקום ל -337 mbar כדי להסיר מתנול ולהשיג שמן צהוב בהיר, אשר לאחר מכן יהיה נתון לאפיון נוסף כדי לאשר היווצרות המוצר37.
- בצע ניתוח פורייה טרנספורמציה אינפרא אדום (FT-IR)38, 1H NMR (בדימתיל-סולפוקסיד deuterated (DMSO-d 6))39, 13C NMR39 וניתוח זמן ספיחה/יינון לייזר בסיוע מטריצה (MALDI-ToF)40 כדי לאשר את היווצרות המוצר לפני ביצוע השלבים הבאים.
- לניתוח FT-IR, יש להעמיס 1 מ"ג של השמן על המכשיר כדי לקבל את הספקטרה.
- עבור ניתוחי NMR, יש להמיס מחדש 10 מ"ג של המוצר ב-0.75 מ"ל של ממס ה-NMR הרלוונטי, להעביר לצינור NMR ולאטום היטב כדי למנוע דליפה. טען את הדגימה על מכשיר NMR, ולאחר מכן הספקטרום מתקבל39.
- לניתוח ספקטרומטריית מסות, חותמים 1 מ"ג של המוצר בבקבוקון, מתמוססים ב- DMSO ומעמיסים על המכשיר.
הערה: ניתוח אינפרא אדום מספק מידע לגבי הקבוצות הפונקציונליות העיקריות במוצר הרצוי, כלומר מתיחות קרבוניל (C=O) המזוהות על ידי השיא החד ב 1650 cm-1 מציין את היווצרות הקשר amide, ובכך מדגיש היווצרות המוצר. ה- 1H NMR וה- 13C מספקים מידע על הסביבה הכימית ובכך ניתן להשתמש בהם כדי לקבוע את ההרכב הכימי של המוצר הרצוי באמצעות זיהוי סביבות כימיות הקיימות בתרכובת. לבסוף, השימוש בספקטרומטריית מסות יכול לאמת את המסה המדויקת של המוצר הרצוי.
2. בדיקת מחשוף של קרוסלינקר דיסולפיד עם גלוטתיון
- יש לדגור על הקרוסלינקר דיסולפיד (לריכוז סופי של 4.55 מ"ג/מ"ל) עם החומר המחזר גלוטתיון (סופי [GSH]: 10 מ"ל), לנפח סופי של 1 מ"ל, למשך 24 שעות בבקבוקון זכוכית של 1.5 מ"ל.
- כדי לאשר את המחשוף של המקשר דיסולפיד, שלח את הבקבוקון לניתוח MALDI-ToF26,40.
3. סינתזת ננו-ג'ל המגיבה לחמצון-חיזור
- ודא שכל כלי הזכוכית שישמשו לתגובה נקיים מאבק על ידי שטיפה במים מסוננים (0.20 מיקרומטר) שעברו דה-יוניזציה ולאחר מכן ייבוש כלי הזכוכית באמצעות אוויר דחוס שניתן לגשת אליו דרך כלי השירות לאוויר דחוס בצד האדים. חבר פייה מאובטחת לשקע האוויר הדחוס כדי להקל על הנגישות. החזק את הבקבוקון היטב ומקם את הזרבובית לתוכו. הפעל את האוויר הדחוס, שחרור זרם מבוקר לתוך הבקבוקון. יש לבחון את התהליך כדי להבטיח ייבוש יעיל, ולבדוק אם נותרו מזהמים או לחות.
- הכינו בקבוקון זכוכית של 10 מ"ל על ידי מילויו במים נטולי יונים, ואטמו את הבקבוק במחיצת גומי. נטרלו את החמצן של המים על ידי בעבוע N2 דרכם במשך 30 דקות לפחות לפני תחילת התגובה. כדי לעשות זאת, למלא בלון עם גז N2 ולחבר מחט לבלון; הניחו אותו על המחיצה והשתמשו במחט כדי לחדור את מחיצת הגומי ולאפשר זרימת N2 . חבר מחט יציאה לבקבוק כדי להבטיח זרימה קבועה של N2.
- יש להמיס אלבומין בסרום בקר (BSA; 2 מ"ג, 30 ננומול) או BSA עם תווית Cy7 (2 מ"ג, 30 ננומול) ב-1 מ"ל של מים נטולי חמצון ולהוסיף לבקבוקון זכוכית נקי אחר של 10 מ"ל.
- הוסף [2-(acryloyloxy)ethyl]trimethylammonium כלוריד (AETC) פתרון (12.00 מ"ג / 10.86 μL, 0.060 mmol ) לבקבוק ואטם אותו באמצעות מחיצת גומי אחרת. יש לוודא שתערובת התגובה נשמרת תחת זרימה קבועה של גז N2 ולערבב במשך 30 דקות.
- ממיסים אקרילאמיד (9.21 מ"ג, 0.13 מילימול) ב 1 מ"ל של מים deionized deoxygenated ולהוסיף לתערובת בבקבוקון.
- להמיס crosslinker דיסולפיד (4.44 מ"ג, 0.004 mmol) ב 1 מ"ל של מים deionized ולהוסיף לתערובת בבקבוקון. שוטפים את התערובת בגז N2 למשך 20 דקות.
- ממיסים סודיום דודציל סולפט (2 מ"ג, 0.007 מילימול) ב-1 מ"ל מים נטולי חמצן ומוסיפים לתערובת באמצעות מזרק סמוק גז N2 ומערבבים את התערובת במשך 30 דקות.
הערה: על ידי שטיפת המזרק עם N2 אנו ממזערים את החשיפה של תערובת התגובה לחמצן באטמוספירה אשר יכול לעכב את תגובת פילמור רדיקלי. - הוסף N,N,N',N'-TETRAMETHYLETHYLENEDIAMINE (1.5 μL, 0.010 mmol) ותן לתערובת התגובה deoxygenate במשך 3 דקות תחת גז N2 .
- להמיס אמוניום persulfate (1 מ"ג, 0.004 mmol) ב 1 מ"ל של מים deoxygenated deionized ולהוסיף לתערובת התגובה. ודא כי גז N2 מבעבע דרך תערובת התגובה במשך 10 דקות.
הערה: אם שלב החיבור N2 מושמט, סביר להניח שייווצרו חלקיקים לבנים בצלוחית התגובה. מדובר בחלקיקים ו/או אגרגטים גדולים יותר שיכולים לבלבל כל אפיון נוסף. - אטמו את הבקבוק תחת אטמוספירה N2 והשאירו לערבוב במשך 3 שעות ו-30 דקות בטמפרטורת החדר.
- כדי לסיים את התגובה, להסיר את החותם מן הבקבוק ולתת את תערובת התגובה לערבב לפחות 10 דקות. זה יחשוף את תערובת התגובה לרמות אטמוספריות של גז O2 , אשר לאחר מכן ירווה את כל הרדיקלים שנותרו בתערובת התגובה. התגובה מסתיימת כאשר התערובת מקבלת מראה אטום כחול ברור.
- על מנת לטהר את הננו-ג'לים, הוסף את תערובת התגובה ליחידת מסנן צנטריפוגלית של 15 מ"ל (100 kDa MWCO) והוסף מים נטולי יונים, כדי למלא את היחידה הצנטריפוגלית. צנטריפוגה את תערובת התגובה ב 1000 x גרם במשך 10 דקות. פעולה זו תסיר כימיקלים שלא הגיבו (או מטען לא מכוסה) הקטנים מ-100 kDa ותרכז את דגימת הננו-ג'ל.
- ברגע שמפלס המים ביחידה הצנטריפוגלית יורד, מוסיפים 2 מ"ל מים שעברו דה-יוניזציה כדי לדלל את דגימת הננו-ג'ל וצנטריפוגה כדי לרכז את המוצר. חזור על שלב זה 3x.
- אחסנו את הדגימה בטמפרטורה של 2-8°C כדי למנוע את התפרקות החלבון העטוף.
- בצע ניתוח FT-IR ו- 1H NMR (בדימתיל סולפוקסיד מנוטרל (DMSO-d6)) כדי לאשר פילמור39,41. כדי להכין את הדגימה, יבש בהקפאה 1 מ"ל של תמיסת ננוג'ל בבקבוקון 1.5 מ"ל. תהליך הייבוש בהקפאה כולל הקפאת הדגימה ולאחר מכן מריחת ואקום כדי להסיר את הממס הקפוא באמצעות סובלימציה, תוך השארת שאריות אבקה. לאחר ייבוש בהקפאה, יש להמיס מחדש את הדגימה בממס ה-NMR הרלוונטי, להעביר לצינור NMR ולאטום אותה היטב. טען את הדגימה למכונת NMR, כמתואר לעיל39. עבור ניתוח FT-IR, יש להעמיס 1 מ"ג של האבקה היבשה על המכשיר כדי לקבל את הספקטרה.
4. אפיון מורפולוגי ננוג'ל
- פיזור אור דינמי (DLS)
הערה: קוטר הידרודינמי (nm), אינדקס polydispersity (PI) ופוטנציאל zeta נמדדו ב- 25 ° C, אורך גל לייזר 632.8 ננומטר וגלאי אותות 173° באמצעות מכונת DLS. בכל ריצה נמדדו 25 מחזורי סריקה משנה.- מדידת גודל הידרודינמי (nm)
- הכינו קובטה או תא נימי מקופל חד פעמי על ידי ניקויו במים מסוננים שעברו דה-יוניזציה. נשפו אוויר דחוס לתוך הקובטה (מתאים למדידות פוטנציאליות של DLS וזטה) כדי להבטיח שהיא נקייה מחלקיקי אבק גדולים.
- ממלאים את הקובטה בלפחות 50-100 μL של הדגימה ומדללים ב 750-1000 μL של מים מסוננים deionized. בעת השימוש בקובט פוטנציאלי zeta, ודא כי cuvette כבר מלא דגימה ללא היווצרות בועות, אשר יכול להפריע מדידות.
- שים את הקובט בתוך מכשיר DLS, ודא שהוא הוכנס כראוי. לשם כך, פתח את מכסה תא הדגימה של מכשיר ה-DLS. החזק את הקובטה בקצוות העליונים שלה כדי למנוע טביעות אצבע על החלונות האופטיים. ודא שהקובטה יושבת כראוי במחזיק הקובט וודא שהיא ישרה ומיושרת עם הנתיב האופטי של המכשיר. סגור את תא הדגימה כדי למנוע הפרעות לאור הסביבה.
הערה: מדיית הדילול מסוננת באמצעות מסנן מזרק בגודל נקבוביות 0.45 מיקרומטר. - לחץ כדי להתחיל את מדידת גודל החלקיקים בתוכנת מכונת DLS הרלוונטית.
- בחר את התוצאות המתאימות למדגם כדי לקבל את ממוצע z (גודל חלקיקים ממוצע), PI ממוצע, ספירת קילו לשנייה (kcps), פוטנציאל zeta וגרפיקה רלוונטית. ודא שפונקציית המתאם מציגה עקומה סיגמואידית חלקה, מכיוון שהדבר מצביע על מדגם אחיד.
- לאחר השלמת הניתוח, הסר את הקובטה מה- DLS.
- מדידת גודל הידרודינמי (nm)
- מיקרוסקופ אלקטרונים תמסורת (TEM)
- הכן דגימות על ידי הנחת 10 μL של תמיסת ננו-חלקיקים (0.077 מ"ג / מ"ל) על רשתות נחושת מצופות פחמן. יש לייבש באוויר בטמפרטורת החדר למשך שעה אחת.
- יש לשטוף את הרשתות במים מסוננים ולכתם עם 5 מיקרוליטר של אורניל אצטט מסונן 1% במים למשך 2 דקות.
- לאחר השריית חומר הצביעה העודף בנייר פילטר, יבשו את הרשתות למשך הלילה בטמפרטורת החדר. צלם תמונות TEM למחרת בהגדלה של 45,000x באמצעות מצלמת שדה בהיר.
- השתמש בתוכנה שסופקה לעיבוד תמונה (רזולוציה: 2048 x 2048 פיקסלים).
5. כימות של חלבון (BSA) עטוף בתוך ננו-ג'ל באמצעות בדיקת חומצה מיקרו-ביכונכונית (BCA)
- על פי פרוטוקול בדיקת microBCA (שניתן באתר היצרן), נוצר עקומה סטנדרטית המבוססת על ריכוז חלבוןמוגדר מראש 42.
- לאחר הסינתזה שלהם, לטהר את הננו-ג'לים העוטפים את החלבון באמצעות יחידות מסנן צנטריפוגלי של 15 מ"ל עם MWCO של 100 kDa (1000 x גרם, 10 דקות) כמתואר בשלבים 3.12-3.14.
- לאסוף את התסנין ולנתח באמצעות בדיקת microBCA (פרוטוקול זמין באתר האינטרנט של היצרן). מדוד את הספיגה ב- 562 ננומטר באמצעות קורא לוחות. מכיוון שמדידה זו מתואמת עם ריכוז החלבון הלא עטוף, קבעו את מסת החלבון העטוף. כדי לחשב את יעילות האנקפסולציה (EE) %, השתמש במשוואה הבאה:
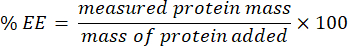
6. כימות שחרור חלבונים מננו-ג'לים בנוכחות גלוטתיון
- לדגור 200 μL של 5 מ"ג/מ"ל של ננו-ג'לים טעונים Cy7BSA עם 200 μL של 10 mM גלוטתיון (GSH) ביחידות מסנן צנטריפוגלי 0.5 מ"ל (100 kDa MWCO). מקם את יחידות המסנן באמבט מים כדי לשמור על הטמפרטורה ב 37 °C (77 °F).
- צנטריפוגה ב 1000 x גרם במשך 3 דקות כל 10 דקות לפחות 1 שעה - ואז כל 2-8 שעות.
- לאסוף את התסנין ולהשתמש לניתוח נוסף. שמור על נפח המסנן בתוך יחידות המסנן הצנטריפוגלי על 500 μL על ידי הוספת מים נטולי יונים, או PBS.
- מדדו את כמות החלבון בתסנין על ידי התייחסות לעקומה סטנדרטית עבור ננו-ג'לים עמוסי Cy7BSA, שם נמדדה ספיגת החלבון הפלואורסצנטי באמצעות מכשיר ננו-טיפה ב-750 ננומטר.
הערה: ניתן לחשב עקומה סטנדרטית זו על ידי הכנת דילולים סדרתיים של Cy7BSA בטווח של 0 מ"ג/מ"ל עד 2 מ"ג/מ"ל. ערכים המתקבלים מהננו-טיפה ניתנים לאינטרפולציה כנגד עקומת כיול זו כדי לקבוע את יעילות האנקפסולציה.
תוצאות
סינתזה ואפיון של פולי(אתילן גליקול) (PEG) דיסולפיד דיאקרילט crosslinker הקרוסלינקר המגיב לחמצון-חיזור סונתז על-ידי החלפה נוקלאופילית של אסטר N-הידרוקסיסוקסינימיד (NHS) על-ידי 2-אמינואתיל מתקרילט באמצעות יצירת קישור אמיד (איור 1). הסינתזה של המוצר הנדר...
Discussion
הביקוש הגובר לתרופות ביולוגיות ספציפיות למטרה בתעשיית הביו-פרמצבטיקה הניע צורך בטכנולוגיות שיכולות לשפר את הפרופיל הפרמקולוגי in vivo שלהם, תוך מניעת ההידרדרות הפיזיולוגית המהירה שלהם וקיזוז תופעות לוואי לא רצויות. עם זאת בחשבון, הליך פשוט לסינתזה של ננו-ג'לים טעוני?...
Disclosures
למחברים אין ניגודי עניינים לחשוף. אין פרטים כספיים להצהיר.
Acknowledgements
אנו מודים לאימפריאל קולג' בלונדון, המחלקה לכימיה והמכון למדעי החיים של המועצה למחקר רפואי על תמיכתם.
Materials
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| 2-( acryloyloxy)ethyl]trimethylammonium chloride solution | Sigma Aldrich | 496146 | |
| 2-aminoethyl methacrylatehydrochloride | Sigma Aldrich | 516155 | |
| 4,7,10,13,16,19,22,25,32,35,38,41, 44,47,50,53-Hexadecaoxa-28,29-dithiahexapentacontanedioic acid di-N-succinimidyl ester | Sigma Aldrich | 671630 | |
| Acrylamide | Sigma Aldrich | 23701 | |
| Ammonium persulfate | Sigma Aldrich | 248614 | |
| Bovine serum albumin | Sigma Aldrich | B6917 | |
| Cy7- labelled bovine serum albumin | Nanocs | BS1-S7-1 | |
| Deuterated dimethyl sulfoxide | Sigma Aldrich | 547239 | |
| Dichloromethane | Sigma Aldrich | 270997 (anhydrous) and D65100 | |
| Glutathione | Sigma Aldrich | G4251 | |
| Methanol | Sigma Aldrich | 34860 | |
| N,N,N’,N’-tetramethylethylenediamine | Sigma Aldrich | 411019 | |
| Phosphate buffered saline | ThermoFisher | 10010023 | |
| Sodium dodecyl sulfate | Sigma Aldrich | 436143 | |
| Triethylamine | Sigma Aldrich | 471283 | |
| Uranyl Acetate | Agar Scientific | AGR1260A | |
| Equipment necessary for nanogel synthesis and characterisation | |||
| Amicon Ultra-15 Centrifugal filter units (100kDa MWCO) | Merck Millipore | C7715 | |
| Camera | Olympus | Veleta | |
| Carbon-coated copper grids | Agar Scientific | AGS160 | |
| Dialysis tubing (100kDa MWCO) | Spectrum labs | 11405949 | |
| Dynamic Light Scattering | Malvern | Zetasizer Nano Ultra | |
| Freeze dryer | Labconco | WZ-03336-01 | |
| Infrared spectroscopy | Agilent | Cary 630 FTIR | |
| iTEM software | Olympus | ||
| Mass spectrometry | Waters | Micromass MALDI microMX MALDI Q-ToF | |
| MF-MilliporeTM membrane filter (0.45/0.2μm pore size) | Merck Millipore, UK | HAWP04700, GSWP04700 | |
| Micro BCA Protein Assay Kit | ThermoFisher | 23235 | |
| Plate reader | Beckman | Coulter-PARADIGM | |
| Proton and Carbon-13 nuclear magnetic resonance data | Bruker | 400MHz AV-400 NMR spectrometer | |
| Rotary evaporator | Buchi | R-114 Rotary Vap System | |
| Single-use needles | Sterican | 4665643 | |
| Suba-Seal septa | Sigma Aldrich | Z124575 | |
| Transmission electron microscopy | Phillips | CM 100 TEM | |
| UV-vis spectrophotometer | Nanodrop | Nanodrop One/One C microvolume |
References
- Zhang, X., Malhotra, S., Molina, M., Haag, R. Micro- and nanogels with labile crosslinks - from synthesis to biomedical applications. Chem Soc Rev. 44 (7), 1948-1973 (2015).
- Chacko, R. T., Ventura, J., Zhuang, J., Thayumanavan, S. Polymer nanogels: A versatile nanoscopic drug delivery platform. Adv Drug Del Rev. 64 (9), 836-851 (2012).
- Hajebi, S., et al. Stimulus-responsive polymeric nanogels as smart drug delivery systems. Acta Biomaterialia. 92, 1-18 (2019).
- Lee, V. Y., et al. Nanogel star polymer architectures: A nanoparticle platform for modular programmable macromolecular self-assembly, intercellular transport, and dual-mode cargo delivery. Adv Mat. 23 (39), 4509-4515 (2015).
- Ekkelenkamp, A., Rachèl Elzes, M., Engbersen, J. F., Paulusse, J. M. Responsive crosslinked polymer nanogels for imaging and therapeutics delivery. J Mat Chem B. 6 (2), 210-235 (2018).
- Vinogradov, S. V., Zeman, A. D., Batrakova, E. V., Kabanov, A. V. Polyplex nanogel formulations for drug delivery of cytotoxic nucleoside analogs. J Control Rel. 107 (1), 143-157 (2015).
- Akiyoshi, K., Deguchi, S., Moriguchi, N., Yamaguchi, S., Sunamoto, J. Self-aggregates of hydrophobized polysaccharides in water. Formation and characteristics of nanoparticles. Macromol. 26 (12), 3062-3068 (1993).
- Lemieux, P., et al. Block and graft copolymers and NanoGel copolymer networks for DNA delivery into cell. J Drug Target. 8 (2), 91-105 (2000).
- Preman, N. K., Barki, R. R., Vijayan, A., Sanjeeva, S. G., Johnson, R. P. Recent developments in stimuli-responsive polymer nanogels for drug delivery and diagnostics: A review. Euro J Pharma Biopharmac. 157, 121-153 (2020).
- Oh, J. K., Drumright, R., Siegwart, D. J., Matyjaszewski, K. The development of microgels/nanogels for drug delivery applications. Prog Poly Sci. 33 (4), 448-477 (2008).
- Jiang, Y., Chen, J., Deng, C., Suuronen, E. J., Zhong, Z. Click hydrogels, microgels and nanogels: Emerging platforms for drug delivery and tissue engineering. Biomat. 35 (18), 4969-4985 (2014).
- Napier, M. E., DeSimone, J. M. Nanoparticle drug delivery platform. Poly Rev. 47 (3), 321-327 (2007).
- Malmsten, M. Soft drug delivery systems. Soft Matt. 2 (9), 760-769 (2006).
- Kamaly, N., Yameen, B., Wu, J., Farokhzad, O. C. Degradable controlled-release polymers and polymeric nanoparticles: Mechanisms of controlling drug release. Che Rev. 116 (4), 2602-2663 (2016).
- Molina, M., et al. Stimuli-responsive nanogel composites and their application in nanomedicine. Chem Soc Rev. 44 (17), 6161-6186 (2015).
- Ma, Y., Ge, Y., Li, L. Advancement of multifunctional hybrid nanogel systems: Construction and application in drug co-delivery and imaging technique. Mat Sci Eng: C. 71, 1281-1292 (2017).
- Wang, H., Qian, J., Ding, F. Recent advances in engineered chitosan-based nanogels for biomedical applications. J Mat Chem B. 5 (34), 6986-7007 (2017).
- Durán-Lobato, M., Niu, Z., Alonso, M. J. Oral delivery of biologics for precision medicine. Adv Mat. 32 (13), 1901935 (2020).
- de la Torre, B. G., Albericio, F. The pharmaceutical industry in 2022: An analysis of FDA drug approvals from the perspective of molecules. Molecules. 28 (3), 1038 (2023).
- Škalko-Basnet, N. Biologics: The role of delivery systems in improved therapy. Biologics. 8, 107-114 (2014).
- Andrews, L., Ralston, S., Blomme, E., Barnhart, K. A snapshot of biologic drug development: Challenges and opportunities. Human Exp Toxicol. 34 (12), 1279-1285 (2015).
- Sathish, J. G., et al. Challenges and approaches for the development of safer immunomodulatory biologics. Nat Rev Drug Disc. 12 (4), 306-324 (2013).
- Pfister, D., Morbidelli, M. Process for protein PEGylation. J Control Rel. 180, 134-149 (2014).
- Blanco, E., Shen, H., Ferrari, M. Principles of nanoparticle design for overcoming biological barriers to drug delivery. Nat Biotechnol. 33 (9), 941-951 (2015).
- Golombek, S. K., et al. Tumor targeting via EPR: Strategies to enhance patient responses. Adv Drug Del Rev. 130, 17-38 (2018).
- Basak, S., et al. Simultaneous cross-linking and cross-polymerization of enzyme responsive polyethylene glycol nanogels in confined aqueous droplets for reduction of low-density lipoprotein oxidation. Biomacromol. 22 (2), 386-398 (2021).
- Morgulchik, N., Kamaly, N. Meta-analysis of in vitro drug-release parameters reveals predictable and robust kinetics for redox-responsive drug-conjugated therapeutic nanogels. ACS Appl Nano Mat. 4 (5), 4256-4268 (2021).
- Ghorbani, M., Hamishehkar, H. Redox-responsive smart nanogels for intracellular targeting of therapeutic agents: Applications and recent advances. J Drug Target. 27 (4), 408-422 (2019).
- Bajic, V. P., et al. Glutathione "redox homeostasis" and its relation to cardiovascular disease. Oxi Med Cell Long. 2019, e5028181 (2019).
- Forman, H. J., Zhang, H., Rinna, A. Glutathione: Overview of its protective roles, measurement, and biosynthesis. Mol Asp Med. 30 (1-2), 1-12 (2009).
- Wang, Y. C., et al. Core-shell-corona micelle stabilized by reversible cross-linkage for intracellular drug delivery. Macromol Rapid Comm. 31 (13), 1201-1206 (2010).
- Elkassih, S. A., Kos, P., Xiong, H., Siegwart, D. J. Degradable redox-responsive disulfide-based nanogel drug carriers via dithiol oxidation polymerization. Biomat Sci. 7 (2), 607-617 (2019).
- Hu, X., et al. Stimuli-responsive polymersomes for biomedical applications. Biomacromol. 18 (3), 649-673 (2017).
- Navath, R. S., Wang, B., Kannan, S., Romero, R., Kannan, R. M. Stimuli-responsive star poly(ethylene glycol) drug conjugates for improved intracellular delivery of the drug in neuroinflammation. J Control Release. 142 (3), 447-456 (2010).
- Ling, X., et al. Glutathione-responsive prodrug nanoparticles for effective drug delivery and cancer therapy. ACS Nano. 13 (1), 357-370 (2019).
- Still, W. C., Kahn, M., Mitra, A. Rapid chromatographic technique for preparative separations with moderate resolution. J Org Chem. 43 (14), 2923-2925 (1978).
- JoVE. JoVE science education database - Organic chemistry. Rotary evaporation to remove solvent. JoVE. , (2023).
- JoVE. JoVE science education database - Organic chemistry II. Infrared spectroscopy. JoVE. , (2024).
- JoVE. science education database - Organic chemistry. Nuclear magnetic resonance (NMR) spectroscopy. JoVE. , (2023).
- Kim, J. Sample preparation for matrix-assisted laser desorption/ionization mass spectrometry. Mass Spec Lett. 6, 27-30 (2015).
- Liu, P., Pearce, C. M., Anastasiadi, R. M., Resmini, M., Castilla, A. M. Covalently crosslinked nanogels: An NMR study of the effect of monomer reactivity on composition and structure. Polymers. 11 (2), 353 (2019).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Anal Biochem. 150 (1), 76-85 (1985).
- Yu, M., Wu, J., Shi, J., Farokhzad, O. C. Nanotechnology for protein delivery: Overview and perspectives. J Control Release. 240, 24-37 (2016).
- Zhang, Y., Zhang, D., Wang, J. T., Zhang, X., Yang, Y. Fabrication of stimuli-responsive nanogels for protein encapsulation and traceless release without introducing organic solvents, surfactants, or small-molecule cross-linkers. Poly Chem. 12 (4), 554-563 (2021).
- Kamaly, N., et al. Targeted interleukin-10 nanotherapeutics developed with a microfluidic chip enhance resolution of inflammation in advanced atherosclerosis. ACS Nano. 10 (5), 5280-5292 (2016).
- Lu, R., et al. Probing the secondary structure of bovine serum albumin during heat-induced denaturation using mid-infrared fiberoptic sensors. Analyst. 140 (3), 765-770 (2015).
- Abrosimova, K. V., Shulenina, O. V., Paston, S. V. FTIR study of secondary structure of bovine serum albumin and ovalbumin. J Phys: Conf Ser. 769, 012016 (2016).
- Kabanov, A. V., Vinogradov, S. V. Nanogels as pharmaceutical carriers: Finite networks of infinite capabilities. Ang Chem Int Ed Eng. 48 (30), 5418-5429 (2009).
- Li, C., Obireddy, S. R., Lai, W. F. Preparation and use of nanogels as carriers of drugs. Drug Del. 28 (1), 1594-1602 (2021).
- Kulkarni, J. A., et al. The current landscape of nucleic acid therapeutics. Nat Nanotechnol. 16 (6), 630-643 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved